Method Article
Evaluación de la madurez del óvulo humano y su aplicación clínica
En este artículo
Resumen
Proporcionamos un esquema del protocolo clínico para la evaluación no invasiva de la madurez del óvulo humano mediante microscopía de luz polarizada.
Resumen
El momento óptimo de la inyección intracitoplasmática de espermatozoides (ICSI) es una grave preocupación para los programas de fertilidad porque la entrada intempeslista de espermatozoides disminuye la competencia en el desarrollo del óvulo. La presencia del primer cuerpo polar (PB) junto con el husillo meiótico indica la finalización de la maduración del ovocitos y la preparación del óvulo para la fertilización. En la práctica clínica, es habitual suponer que todos los ovocitos que muestran un PB son ovocitos maduros de metafase (MII). Sin embargo, la extrusión de PB precede a la formación del husillo MII bipolar. Esta asincronía hace que la mera presencia de PB sea un marcador poco fiable de la madurez de los ovocitos. Las imágenes no invasivas del husillo mediante microscopía de luz polarizada (PLM) permiten una inspección rápida y sencilla de si el ovocitos que muestra PB realmente volvió a montar un husillo meiótico antes de ICSI. Aquí, presentamos un protocolo estándar para realizar la evaluación de la madurez del óvulo humano en el laboratorio clínico. También mostramos cómo optimizar el tiempo de ICSI con respecto a la etapa de desarrollo del ovocitos con el fin de prevenir la inyección prematura de espermatozoides de ovocitos de maduración tardía. Usando este enfoque, incluso los ovocitos inmaduros que extruyen PB in vitro pueden ser clínicamente utilizados. Afirmación de que el husillo MII está presente antes de la inyección de espermatozoides y el ajuste individual del tiempo de ICSI es particularmente importante en ciclos de fertilización in vitro de mal pronóstico (FIV) con un bajo número de ovocitos disponibles para la fertilización.
Introducción
Para convertirse en un óvulo haploide fertilizable, el ovocitos diploides tiene que extruir la mitad de su información genética en una célula adyacente, llamada el primer cuerpo polar (PB), y alinear los cromosomas en el ecuador del husillo de la metafase bipolar II (MII). Mientras que la PB se puede observar claramente mediante la microscopía de luz convencional, la detección de material genético y estructuras citoesqueléticas normalmente requiere procedimientos preparatorios invasivos que son incompatibles con el uso posterior del ovocitos para el tratamiento de fertilidad. Por lo tanto, en la práctica clínica, la presencia del PB se considera como un sello distintivo de la madurez de los ovocitos. Sin embargo, las imágenes en vivo del microtúbulo y la dinámica cromosómica durante la maduración de los ovocitos humanos revelaron que la PB se hace visible un par de horas antes de que se ensamble el husillo MII bipolar y los cromosomas estén alineados1. Sin embargo, en la luz transmitida, los huevos detenidos del MII son indistinguibles de los ovocitos que acaban de entrar en el proceso de segregación cromosómica. Por lo tanto, una cohorte de ovocitos, clasificados como ovocitos MII basados únicamente en la presencia de PB, podría contener ovocitos latematantes que aún no han completado su desarrollo y, por lo tanto, no están listos para la fertilización.
Es probable que el retraso de la maduración de los ovocitos afecte a la población de respondedores pobres con unbajo número de ovocitos MII y una alta proporción de ovocitos inmaduros recogidos inesperadamente en los ciclos estimulados 2. In vivo, sólo un solo huevo de mejor calidad alcanza la madurez y se vula. En los ciclos de fertilización in vitro (FIV), la hiperestimulación ovárica controlada se utiliza para reclutar múltiples ovocitos para la maduración. La oleada de gonadotropina desencadena una reanudación del programa meolítico y se supone que los progenitores de óvulos deben llegar a la etapa de detención del MII dentro de las 36 horas3. Sin embargo, los ovocitos recuperados de folículos preovulatorios a menudo constituyen una variedad de ovocitos MII y ovocitos inmaduros, ya sea en la fase de metafase I (MI) o en la etapa de vesícula germinal (GV) (Figura1). Sólo los ovocitos MII son sometidos a inyección intracitoplasmática de espermatozoides (ICSI) mientras que los ovocitos inmaduros se descartan típicamente. Sin embargo, cuando se cultivan in vitro, los ovocitos MI se observan comúnmente para extruir PB in vitro. A pesar de su inferioridad general, los ovocitos de maduración tardía que completaron espontáneamente la primera división meiótica durante el cultivo nocturno se han utilizado con éxito como ovocitos de último recurso, y se han reportado nacimientos vivos4,5 ,6,7,8. Por lo tanto, la inyección inoportuna de los espermatozoides podría ser una razón principal subyacente a los malos resultados de desarrollo de los ovocitos de maduración tardía reportados en estudios anteriores9,10,11.
La microscopía de luz polarizada (PLM) combinada con un software de procesamiento de imágenes permite la visualización no invasiva del husillo meiótico en el ovocitos vivos. La doble reflexión se genera por la interacción del haz de luz polarizado con el conjunto altamente ordenado de microtúbulos que construyen el husillo bipolar. Dado que la luz polarizada es de intensidad normal, la técnica podría utilizarse de forma segura en entornos clínicos para ver la dinámica del aparato de división11,12,13,14. La presencia de la birefringencia del husillo MII dentro del ovo ha sido identificada como un marcador de la competencia de desarrollo de un óvulo9,15,16,17,18, 19,20,21,22,23. Por lo tanto, se ha sugerido que la imagen del husillo meiótico no invasivo podría utilizarse para el control de la calidad del óvulo en la práctica clínica11,14,20.
Dado que la línea de tiempo para la dinámica microtubular durante la meiosis de ovocitos se ha resuelto1, el patrón de PLM observado puede estar mejor relacionado con el curso de tiempo de la transición de MI a MII. Poco después de la emisión de PB, el naciente husillo MII se vuelve indetectable por PLM. Sin embargo, si los ovocitos se mantienen en el cultivo, la señal de birefringencia puede surgir más tarde cuando el husillo MII bipolar vuelve a montar9,10,11. Por lo tanto, en los ovocitos que extruyen un PB in vitro, la ausencia del husillo podría ser sólo temporal correspondiente a la transición fisiológica del ovocitos de maduración tardía de la etapa MI a MII. Si la señal del husillo MII es indetectable, la inyección de espermatozoides se puede aplazar a un punto de tiempo posterior, lo que proporciona tiempo adicional para la formación del husillo del MII. La optimización del tiempo ICSI asistida por PLM maximiza la posibilidad de que los ovocitos de maduración tardíase utilicen clínicamente y marcan la diferencia para los pacientes con mal pronóstico 9.
A continuación, proporcionamos un protocolo paso a paso sobre cómo realizar imágenes de husillo no invasivas en ovocitos humanos. También demostramos cómo se puede emplear PLM para evitar el riesgo de fertilización prematura de ovocitos de maduración tardía.
Protocolo
Este protocolo describe el procedimiento clínico que es un "complemento" al tratamiento estándar de FIV. Debe ser realizado por personal experimentado en cumplimiento de buenas prácticas de laboratorio y directrices clínicas24,25. Se recomienda obtener el consentimiento informado por escrito de los pacientes elegibles. Este protocolo fue aprobado por el Comité de ética institucional.
1. Recuperación y denudación de óvulos
- Inducir la estimulación ovárica utilizando protocolos de estimulación convencionales3. Ajuste la dosis a la respuesta individual. Cuando dos o más folículos, visualizados por ecografía, alcanzan un diámetro de 18 mm, inducen la maduración de ovocitos con la aplicación de 250 g de gonadotropina coriónica humana (hCG). Programar la recogida de ovocitos (OPU) a 35 a 36 h después de la inyección de hCG.
- Recoger los complejos cumulus-ovocitos recuperados (COC) en el medio de manipulación independiente de CO2(Tablade materiales). Después de un breve período de incubación (10-15 min) en una incubadora independiente de CO 2, expone brevemente (hasta 30 s) los COC recogidos a la solución de hialuronidasa (Tablade materiales). Bajo un estereomicroscopio, retire mecánicamente las células cumulus-corona pipeteando suavemente los COC con una punta de filtro de 200 ml.
- Utilizando micropipetas de denudación con un diámetro decreciente gradual (200 m, 180 y 150 m), retire suavemente los ovocitos de las células foliculares restantes y lave los ovocitos 3 veces en el medio de manipulación.
- Evaluar el número y el estado de desarrollo de los ovocitos denados según la presencia o ausencia del núcleo y del primer PB (Figura1).
- Compruebe los criterios de inclusión para el examen PLM. Llevar a cabo una evaluación de la madurez del óvulo si hay (1) una respuesta inesperada deficiente a la estimulación convencional con menos de 6 ovocitos MII recogidos en OPU y (2) un historial de fracaso de fertilización previa u inmadurez de ovocitos.
- Colocar los ovocitos GV, MI y MII en pozos separados en una bandeja de FIV, cada uno de los cuales contiene 500 l de medio de cultivo preequilibrado dependiente de CO2(Tablade materiales)cubierto con aceite mineral (Tablade materiales).
- Incubar durante 3 x 4 h adicionales a 37 oC en una atmósfera humidificada del 5% O2 y del 6% de CO2.
2. Preparación para el examen PLM y posterior ICSI
NOTA: El protocolo proporcionado aquí describe la evaluación PLM realizada utilizando el sistema OCTAX Polar AIDE (Tablade materiales). Alternativamente, se pueden utilizar otros sistemas de vista de husillo disponibles comercialmente.
- Preparar placas para el cultivo de embriones.
- Dependiendo del número de ovocitos a examinar (total de ovocitos MII y ovocitos MIM extruyendo un PB durante el período de preincubación), prepare una placa de 4 pocillos o una placa de 12 pocillos, llene cada pozo con 500 o 30 ol de medio de cultivo, respectivamente , y cubrir con aceite mineral previamente equilibrado.
- Asegurar que tanto el medio de cultivo como el aceite mineral se hayan equilibrado en la incubadora de CO2 durante la noche. Conservar el plato preparado en la incubadora dependiente de CO2durante al menos 2 h. Numerar los pozos si es necesario para rastrear el destino del desarrollo de ovocitos individuales.
- Prepare el plato ICSI.
- Utilice el plato de plástico asignado y haga una gota de 5 l de medio de manipulación precalentado para cada ovocitos que muestren PB y una gota adicional para el lavado con agujas. Hacer una gota adicional de solución de polivinilpirrolidona (PVP) (Tablade materiales)para la inmovilización de espermatozoides antes de ICSI (añadir esperma justo antes de ICSI) y superponercon aceite mineral precalentado.
- Mantenga el plato ICSI preparado en la incubadora independiente de CO2durante al menos 20 minutos.
- Prepare el plato de examen PLM.
- Utilice el plato inferior de vidrio asignado y haga gotas de 5 l de medio de manipulación precalentado para cada ovocitos que muestren PB. Superposición con aceite mineral precalentado.
- Conservar el plato en la incubadora independiente de CO2durante al menos 20 minutos.
- Prepare el microscopio listo para el examen de PLM.
- Cambie la etapa calentada del microscopio invertido con bastante antelación para lograr la temperatura de calentamiento correcta. Asegúrese de que los ajustes se ajustan con precisión para mantener los 37 oC en las gotas medianas de manipulación en la placa PLM/ICSI durante los procedimientos de micromanipulación.
- Coloque la sujeción estéril y la aguja ICSI en soportes de microinyección y concéntrelos. Alternativamente, utilice una aguja para eclosión.
- Seleccione el objetivo adecuado (20x y 25x son los más adecuados) y asegúrese de que el condensador está en posición de campo brillante.
- Inserte el filtro de interferencia verde (la luz se vuelve verde) y coloque el control deslizante de análisis de cristal líquido en la posición de trabajo.
- Ajuste el obturador a un 50 % y ajuste el polarizador circular para reducir el ruido de fondo.
- Prepare el equipo listo para el examen de PLM.
- Inicie el software de imágenes.
- Seleccione Vídeo (Video) Fuente de vídeo ? polarAIDE en el menú de vídeo de la barra de menúsuperior.
- Cambie a vídeo en directo yendo a la página Vídeo y active el análisis de husillo y zona pulsando el icono (Figurasuplementaria 1) en la barra de herramientas de vídeo.
- Seleccione el modo de visualización para el escalado dinámico durante la creación de imágenes del husillo: (1) vista combinada roja (birefringencia)/verde (fondo) o (2) vista blanca (birefringencia)/y negra (fondo). El modo de puntuación dinámica se utiliza para la puntuación automática de zona pellucida.
3. Examen de la madurez del huevo
- Después del período de preincubación (3 x 4 h), realice un examen de PLM que revele el estado de madurez de los ovocitos en el momento estándar de ICSI (39-40 h después del desencadenante de hCG).
- Transfiera todos los ovocitos a gotas individuales en la placa PLM y colóquelos bajo el microscopio invertido preparado para la toma de imágenes del husillo. Recuerde retirar la tapa de plástico de la bandeja inferior de vidrio antes de comenzar el examen.
- Concéntrese con el primer ovo. Si es difícil buscar la celda bajo luz verde, extraiga el filtro verde temporalmente. Asegúrese de que el filtro verde está insertado antes del análisis.
- Observe la imagen de birefringencia de ovocitos detectada (rojo/naranja sobre fondo verde) ya que se procesa por ordenador y se muestra en tiempo real en la pantalla del ordenador. Recuerde que la señal no es visible en el ocular.
- Si el mensaje que anuncia la exposición a la luz es demasiado baja/alta, ajuste el brillo a la intensidad adecuada utilizando la perilla de intensidad de luz del microscopio.
- Utilice una aguja ICSI y una sujeción para girar el ovocitos para que el PB esté en la posición de las 12 en punto y enfocado al PB.
- Si la birefringencia del husillo no es visible a primera vista en las proximidades de PB, gire suavemente el ovocitos alrededor de cada eje tocando ligeramente la zona pellucida para asegurar la alineación de la luz polarizada con las fibras del husillo de la matriz (VídeoSuplementario ). Declare la ausencia del husillo MII siempre y cuando el ovocitos no muestre la señal del husillo a pesar de la rotación rigurosa.
- Basándose en el patrón de birefringencia observado, clasificar los ovocitos en las siguientes categorías (Figura 2): (A) ovocitos con señal brillante de husillo MII bipolar en forma de barril con límites claramente delineados e incluso distribución de birefringencia ; (B) ovocitos con husillo MII dismórfico, apolar y translúcido con límites irregulares y distribución desigual de la señal; (C) ovocitos sin birefringencia detectable del husillo MII en el ooplasmo; (D) ovocitos de la anafase I/telofase I, que muestran un puente microtubular (una hebra conectiva entre el primer PB y el ovocitos) en lugar del husillo MII.
NOTA: El oocyte con señal de husillo MII detectable (grado A o B) es adecuado para ICSI inmediato. - Tome una instantánea (F9) o grabe vídeo para un informe y/o un análisis de imagen posterior. Mantenga la documentación del patrón de imagen para reducir la subjetividad del operador.
- Muévase a la posición de un siguiente ovo y repita los pasos 3.6 a 3.9.
4. Optimización del tiempo ICSI
- Transfiera todos los ovocitos positivos para husillos (grado A o B, paso 3.8) a la placa ICSI y sometalos a ICSI de acuerdo con los protocolos estándar24,25.
- Si los ovocitos no muestran ninguna señal de husillo MII detectable, coloque la placa PLM en la incubadora independiente de CO2y cambie el ICSI a un momento posterior.
- Realice el reexamen de PLM de 2 a 3 h más tarde siguiendo los pasos 3.3 a 3.9. Si algunos ovocitos todavía carecen de un husillo MII, retrase aún más el ICSI durante 1 a 2 h adicionales.
- Transfiera todos los ovocitos a la placa ICSI e inyéctelos de acuerdo con los protocolos estándar24. Si la placa PLM es compatible con el ángulo de flexión de la aguja de microinyección, realice ICSI inmediatamente en la placa PLM después de cambiar a un modo de campo brillante.
- Sobre ICSI, transfiera los ovocitos a placas preparadas para el cultivo y cultivo de embriones hasta la etapa de blastocisto.
Resultados
La microscopía de luz polarizada permite inspeccionar instantáneamente si el ovocitos completó la maduración nuclear y ensambló el husillo MII antes de ICSI. Debido a su carácter no invasivo, se puede utilizar para evaluar con seguridad la preparación del óvulo humano para la fertilización en entornos clínicos11,12,13,14. Los ovocitos con husillo son más propensos a dar lugara embriones viables que ovocitos sin husillo 9,15,16,17,18,19, 20 , 21 , 22 , 23. Además, los ovocitos con un husillo bipolar distinto parecen tener una mayor competencia de desarrollo que los ovocitos con husillos dismórficos9,21,22. En conjunto, las imágenes del husillo pueden servir como una herramienta para identificar los ovocitos con mayor potencial para ser fertilizados con éxito, someterse a un desarrollo preimplantacional y apoyar el embarazo a término9,15, 16 , 17 , 18 , 19 , 20 , 21 , 22 , 23.
La incidencia notificada del husillo varía (44-97%) reflejando la diversidad de la población estudiada9,15,16,17,18,19,20,21, 22 , 23 , 26 , 27 , 28. Los ovocitos maduros in vivo de los respondedores normales suelen mostrar el husillo MII bipolar a 40 h después del activador de hCG9,18,27,29. Sin embargo, en los respondedores lentos, el grupo de ovocitos recuperados defolículos preovulatorios se ve afectado por el retraso de maduración 9,27. Aquí, las imágenes del husillo deben llevarse a cabo para discriminar a los ovocitos detenidos en la etapa MII de aquellos que están experimentando una importante transición maturacional (Figura3). Recomendamos la eliminación de células foliculares inmediatamente después de la recuperación, y la incubación de ovocitos MI y MII en pozos separados para poder distinguir los ovocitos maduros In vivo y los ovocitos de maduración tardía que extruyen PB in vitro, poco antes de ICSI. En caso de que la denfinación se realice justo antes de ICSI, estas dos poblaciones de ovocitos son indistinguibles en función de la apariencia de PB.
Los cambios específicos de fase del patrón PLM deben interpretarse en el contexto del conocimiento de la dinámica del husillo durante la maduración meiótica. Durante la interquinesis, el aparato de división se somete a una extensa reorganización estructural y la señal PLM desaparece transitoriamente1,9,10,11. Por lo tanto, en los ovocitos retrasados en el desarrollo que extruyen PB in vitro, la ausencia de la señal del husillo MII puede no reflejar necesariamente la perturbación celular, pero podría indicar la progresión del ovocitos de la etapa MI a LA MII (Figura3). Si el espermatozoide se inyecta en un momento no fisiológico, el potencial de desarrollo del óvulo se ve comprometido. El postpuesto de ICSI proporciona a los ovocitos de maduración tardía más tiempo paraensamblar un husillo MII cuya presencia se asocia con mejores resultados clínicos 9,10,11. En el estudio clínico con respondedores lentos/pobres, casi el 60% de los ovocitos inicialmentenegativos del husillo desarrollaron la señal del husillo antes de que el PLM se reexaminara aproximadamente 2 h más tarde 9. Dependiendo de la etapa de desarrollo y la aptitud general de los ovocitos de maduración tardía, la apariencia del husillo MII después de la extrusión de PB normalmente toma 2 a 6 h (observación inédita). Los ovocitos que presentan un puente de microtúbulos (anafase/telofase, grado D) durante el primer examen plM requieren un tiempo más largo para desarrollar la señal de husillo MII que los ovocitos sin husillo visible (husillos emergentes, grado C). El ajuste individual del tiempo del ICSI a la etapa de desarrollo del óvulo previene la activaciónprematura del ovocitos y da como resultado una mejor tasa de fertilización y un desarrollo embrionario exitoso 9.
Aunque los ovocitos de maduración tardía que extruyen el PB in vitro generalmente tienen una menor competencia de desarrollo que los ovocitos madurados in vivo, la tasa de desarrollo embrionario es aceptable si logran ensamblar un husillo detectable antes del ICSI retardado (blastulation tasa de 41,32%)9. Usando este enfoque, incluso los ovocitos inmaduros, que normalmente son rechazados para el tratamiento de fertilidad, pueden ser clínicamente utilizados, producir embriones transferibles, y dar lugar a embarazos a término. La evaluación de la etapa madurativa de cada ovocitos individuales es especialmente beneficiosa en ciclos de mal pronóstico que producen un pequeño número deovocitos MII y/o después de realizar un rescate en la maduración in vitro de ovocitos inmaduros 9.
Aparte de la evaluación de la madurez del óvulo, también se recomienda la toma de imágenes del husillo antes de la biopsia de PB para evitar la destrucción del husillo en ovocitos de la anafase I/telofase. En la embriología experimental, la visualización del husillo meiótico se utiliza durante el procedimiento de enucleación de óvulos y/o transferencia de husillo13.
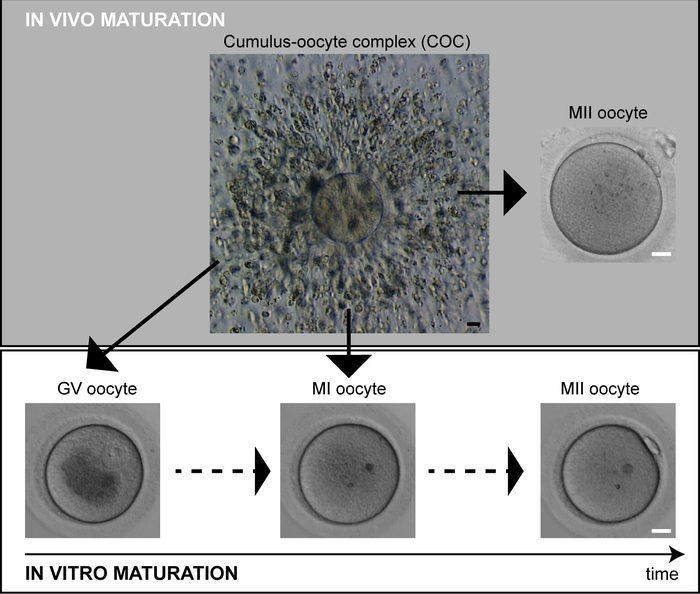
Figura 1: Maduración de ovocitos humanos. Los ovocitos maduros in vivo (MII) exhiben PB en el momento de la recuperación. Los ovocitos inmaduros (GV, MI) pueden completar espontáneamente la maduración in vitro. Barra de escala a 20 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.
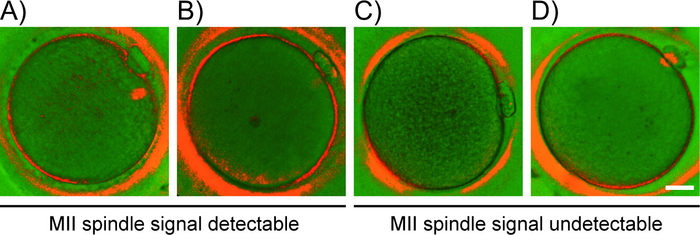
Figura 2: Clasificación de ovocitos basada en el patrón detectado por PLM. Ejemplos representativos de grados de ovocitos (A-D) basados en la apariencia de la señal del husillo. Patrón detectado por PLM: (A) señal prominente del husillo bipolar, (B) husillo MII apolar translúcido, (C) sin husillo detectable y (D) puente de microtubbule. Barra de escala a 20 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.
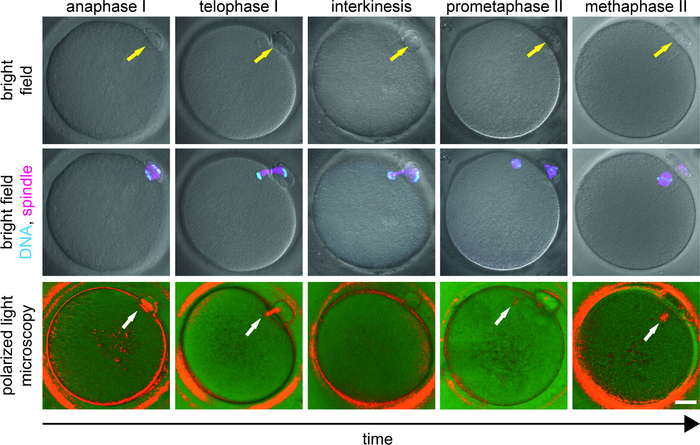
Figura 3: Etapas de la transición de MI a MII en la maduración de ovocitos. Se muestra la aparición de ovocitos en el campo brillante (fila superior), combinado con una señal de fluorescencia de cromosomas (cian) y microtúbulos (magenta) (fila media), y en luz polarizada (fila inferior). Cada ovocitos fue examinado primero por PLM y se fijó inmediatamente. Los ovocitos fijos fueron (inmuno)etiquetados con Hoechst (ADN) y anticuerpos anti-a-tubulina (microtúbulos). La flecha amarilla indica la presencia de PB y la flecha blanca resalta la posición de los microtúbulos birefringentes. Barra de escala a 20 m. Esta cifra ha sido modificada de Holubcová et al., JARG 20199. Haga clic aquí para ver una versión más grande de esta figura.
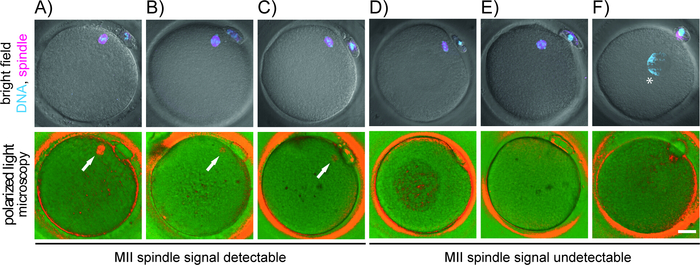
Figura 4: Correlación de la organización cromosoma-microtúbulo con patrón de birefringencia detectado por microscopía de luz polarizada. Se muestra la aparición de ovocitos en el campo brillante combinado con una señal fluorescente para cromosomas (cian) y microtúbulos (magenta) (fila superior), y en luz polarizada (fila inferior). Cada ovocitos se fijó inmediatamente después del examen de PLM. Se tiñó el ADN (Hoechst) y el microtúbulo (-tubulina). (A-C) ovocitos con husillo detectable por PLM pero cromosomas desalineados (A, B) o polos de husillo enfocados libremente (C); (D-F) ovocitos anormales sin husillo MII detectable por PLM que muestre subdesarrollado (D), apolar (E) o sin husillo (F). La flecha blanca resalta la posición de los microtúbulos birefringentes y el asterisco (*) indica la posición de la cromatina descondensada. Barra de escala a 20 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.
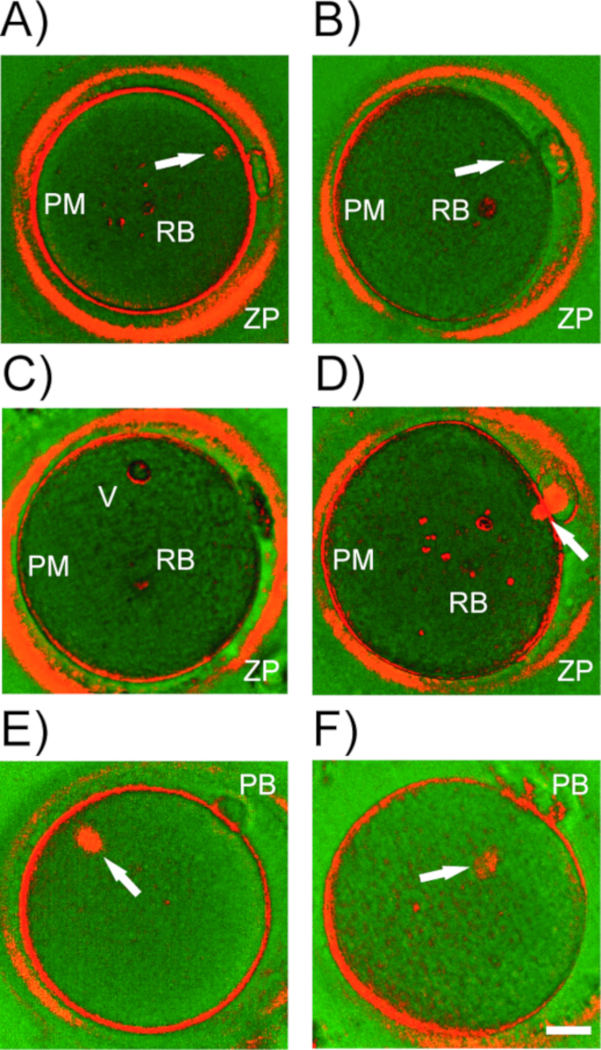
Figura 5: Estructuras de birefringencia en ovocitos humanos. Ejemplos representativos de estructuras birefringentes(A-D)detectadas por PLM en ovocitos humanos. ZP - zona pellucida; PM - membrana plasmática (oolema); RB - cuerpos refractarios, vacuolas. Flecha blanca, husillo meiotico en diferentes etapas de maduración. (E) Desalineación del husillo MII con el cuerpo polar (PB). (F) Desprendimiento del husillo de la membrana plasmática. Barra de escala a 20 m. Por favor, haga clic aquí para ver una versión más grande de esta figura.
Figura suplementaria 1: Diseño de escritorio del software de análisis de imágenes. Haga clic aquí para descargar este archivo.
Video Suplementario: Procedimiento de examen PLM. Se requiere rotación del ovocitos para excluir la presencia del husillo (flecha). Barra de escala a 20 m. Por favor, haga clic aquí para descargar este archivo.
Discusión
El husillo meolítico acentrosomal en ovocitos humanos es altamente dinámico y una estructura delicada1. En condiciones subóptimas, las fibras de microtúbulos se despolimerizan rápidamente y el husillo meiótico desmonta30,31,32,33. Por lo tanto, es de vital importancia asegurarse de que el cultivo de ovocitos y las condiciones de micromanipulación, a saber, la temperatura y el pH se encuentran en el rango óptimo. Para minimizar el riesgo de interrupción del husillo, los ovocitos deben mantenerse en un entorno con temperatura controlada manteniendo 37 o0,5 oC en los medios de oocitos. Se requiere estrictamente el uso de microscopios y una configuración de microinyección equipada con una etapa calentada. Toda manipulación con ovocitos fuera de la incubadora debe llevarse a cabo en medios tamponados HEPES/MOPS para evitar la fluctla de pH. Para evitar posibles efectos adversos de la entrega excesiva de ovocitos en condiciones ambientales, el tiempo total de examen de PLM no debe exceder de 10 minutos. Los ovocitos tienen que ser analizados en la placa inferior de vidrio con la tapa de plástico removida porque el posicionamiento de un plástico estándar en la trayectoria del haz afecta el análisis de imagen. Debido a que los platos de plástico y vidrio inferior tienen diferentes características térmicas, la temperatura debe comprobarse directamente en las gotas del medio de manipulación en el plato de examen.
Además de las condiciones de laboratorio, las diferencias de procedimiento y las habilidades de micromanipulación del operador podrían tener un impacto en la precisión del examen plM. Solo los husillos bipolares altamente ensamblados se pueden visualizar de forma no invasiva. La señal observada es proporcional al grado de organización estructural del husillo. Los husillos nacientes, apolares, aflojados o desorganizados solo muestran birefringencia borrosa o ninguno en absoluto (Figura3 y Figura 4). Además, la alineación imperfecta de la luz polarizada con matrices de microtúbulos produce sólo una birefringencia translúcida y mal definida a pesar de la presencia real de husillo bipolar bien desarrollado (Figura4). A menos que se oriente correctamente, la señal del husillopodría perderse fácilmente y la madurez de los ovocitos se diagnostica erróneamente (Vídeo Suplementario). Para obtener imágenes óptimas del husillo, el ovo debe girarse correctamente alrededor de cada eje. Dado que la birefringencia no es visible en los oculares, el operador tiene que ver la pantalla del ordenador mientras realiza la rotación del ovocitos. La experiencia previa con la micromanipulación y la formación de imágenes de husillo en ovocitos maduros in vitro excedentes es deseable antes de cambiar a la aplicación clínica.
Además del husillo, las células cúmulos que rodean el ovocitos, el oolema, la capa interna de la zona pellucida y algunas estructuras citoplasmáticas (por ejemplo, cuerpos refractarios, vacuolas) exhiben birefringencia (Figura 5A-D). A menos que se retire nariamente del ovocitos antes de la toma de imágenes, las células foliculares estrechamente unidas producen ruido de fondo y comprometen la detección del husillo meiótico. Tenga cuidado de no confundir un cuerpo refractario grande con el husillo. Muchas inclusiones citoplasmáticas que residen en el citoplasma muestran un alto brillo que contrasta fuertemente con el fondo oscuro. El husillo meiotico, por otro lado, sólo exhibe una señal moderada, límites borrosos y normalmente se une al oolema debajo o adyacente al primer PB. Ocasionalmente, el examen PLM revela una desviación bruta del husillo de su posición estándar (Figura 5E,F). Si hay una desalineación importante entre el aparato de división y el PB, PLM ayuda a orientar el ovitor para evitar el riesgo de lesión del husillo durante la microinyección. La posición relativa del husillo dentro del ovocitos no parece influir en el potencial de desarrollo de los embriones resultantes17,34. Sin embargo, cuando el husillo se separa constantemente del oolema, se producen anomalías de fertilización. Curiosamente, algunos ovocitos de mala calidad sufren descondensación de cromatina inmediatamente después de la extrusión de PB en lugar de iniciar la nucleación de microtúbulos (Figura4F). Utilizando la microscopía de luz convencional y el PB como único marcador de madurez de ovocitos, tales ovocitos subcompetentes se considerarían fertilizables. Por lo tanto, además de la evaluación morfológica rutinaria, la imagen del husillo agrega información importante sobre la madurez del huevo y puede servir como un marcador indirecto de su calidad.
Es probable que la incidencia de ovocitos MII con husillo se vea afectada por las características de la población del estudio (por ejemplo, antecedentes genéticos, condición médica, edad materna). Además, la proporción de ovocitos retrasados en el desarrollo dentro de la cohorte influirá en el número real de ovocitos negativos de husillo detectados9,27. La visualización del husillo meiotico permite identificar claramente los ovocitos fertilizables detenidos en la etapa MII. Además, la segunda inspección en un momento posterior puede revelar si el ovocitos negativos del husillo es anormal o sólo ha progresado recientemente a través de la transición MI/MII9,10,11. Cuando se permite desarrollar un husillo antes de ICSI, incluso los ovocitos inmaduros, que se descartan rutinariamente, pueden producir embriones viables9. En ciclos con muy pocos ovocitos disponibles para la fertilización, ICSI de ovocitos que extruyen PB de tiempo fino puede servir como una estrategia de rescate y alternativa a la cancelación del ciclo.
Sin embargo, la ampliación del tiempo de preincubación no debe generalizarse a todos los ovocitos. Los ovocitos maduros in vivo de los respondedores normales suelen exhibir un husillo MII9,20,21,27. Aquí, la probabilidad de imágenes exitosas del husillo disminuye con el tiempo como consecuencia del envejecimiento in vitro post-ovulatorio35. Si es posible, ICSI debe realizarse el día de la recuperación y no debe exceder las 9 horas (45 horas después de hCG), el período asociado con una disminución en la calidad del embrión resultante36,37. Los ovocitos que muestren husillos bipolares distintos deben someterse a ICSI sin más demora. En resumen, la optimización individualizada del tiempo ICSI vale la pena en pacientes con mal pronóstico para excluir cualquier riesgo de inyección prematura de espermatozoides. Sin embargo, es innecesario, demasiado lento y laborioso para ser realizado en todos los ciclos de FIV.
El análisis de PLM revela si el ovocitos llegó a la etapa MII. Sin embargo, la visualización no invasiva del husillo meiótico no proporciona información sobre la organización cromosómica. Puede haber una desalineación cromosómica grave y/o la división cromátida relacionada con la edad materna en ovocitos con un husillo bipolar (Figura5). Varios otros factores tienen un impacto significativo en el éxito de la reproducción (por ejemplo, factor espermático, mitocondrias, activación del genoma embrionario, escote irregular, epigenética, endometrio, inmunidad materna). Por lo tanto, la detección del husillo MII per se, no garantiza un resultado clínico positivo del procedimiento de FIV.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría dar las gracias al laboratorio de embriología de Reprofit International. También reconocemos la instalación central CELLIM de CEITEC con el apoyo de MEYS CR (LM2015062 Czech-Bioimaging) por su apoyo a la obtención de datos de imágenes de inmunofluorescencia presentados aquí.
Materiales
| Name | Company | Catalog Number | Comments |
| Continuous Single Culture Complete with Human Serum Albumin | Irvine Scientific | 90164 | bicarbonate based single-step culture medium for embryo culture |
| Denuding micropipette 150 µm | Microtech IVF | 005-150C | |
| Denuding micropipette 180 µm | Microtech IVF | 005-180B | suitable for oocyte transfer between dishes |
| Denuding micropipette 200 µm | Microtech IVF | 005-250-A | suitable for oocyte transfer between dishes |
| FluoroDish | World Precision Instruments | FD 5040-100 | glass-bottom dish |
| (alternative: WillCo-dish GWST-5040 WillCo Wells) | |||
| Holding micropipette | Microtech | 001-120-30 | sterile glass microneedles |
| Hyaluronidase solution | Irvine Scientific | 90101 | for oocyte denudation |
| ICSI micropipette | Microtech | 002-5-30 | sterile glass microneedles |
| Micro Droplet Culture Dish | Vitrolife | 16003 | 12-well plate for embryo culture |
| Multipurpose Handling Medium (MHM) with Gentamicin | Irvine Scientific | 90163 | handling medium, MOPS/HEPES buffered |
| Nikon Eclipse TE 2000-U | Nikon | inverted microscope with heated stage | |
| Nunc IVF Petri Dish, 60 mm | Thermo Fisher Scientific | 150270 | plastic ICSI dish |
| Nunc non-treated 4-well IVF dish | Thermo Fisher Scientific | 179830 | 4-well plate for embryo culture |
| OCTAX polarAide | MTG | integrated PLM system | |
| Oil for embryo culture | Irvine Scientific | 9305 | oil for overlay |
| Polyvinylpyrrolidone | Irvine Scientific | 90123 | for sperm immobilization prior to ICSI |
Referencias
- Holubcova, Z., Blayney, M., Elder, K., Schuh, M. Human oocytes. Error-prone chromosome-mediated spindle assembly favors chromosome segregation defects in human oocytes. Science. 348 (6239), 1143-1147 (2015).
- Oudendijk, J. F., Yarde, F., Eijkemans, M. J., Broekmans, F. J., Broer, S. L. The poor responder in IVF: is the prognosis always poor?: a systematic review. Human Reproduction Update. 18 (1), 1-11 (2012).
- Gautam, N., Allahbadia, Y. M. . Ovarian Stimulation Protocols. , (2016).
- Piqueras, P., et al. Live birth after replacement of an embryo obtained from a spontaneously in vitro matured metaphase-I oocyte. Systems Biology in Reproductive Medicine. 63 (3), 209-211 (2017).
- Liu, J., Lu, G., Qian, Y., Mao, Y., Ding, W. Pregnancies and births achieved from in vitro matured oocytes retrieved from poor responders undergoing stimulation in in vitro fertilization cycles. Fertility and Sterility. 80 (2), 447-449 (2003).
- Shu, Y., et al. Fertilization, embryo development, and clinical outcome of immature oocytes from stimulated intracytoplasmic sperm injection cycles. Fertility and Sterility. 87 (5), 1022-1027 (2007).
- Sachdev, N. M., Grifo, J. A., Licciardi, F. Delayed intracytoplasmic sperm injection (ICSI) with trophectoderm biopsy and preimplantation genetic screening (PGS) show increased aneuploidy rates but can lead to live births with single thawed euploid embryo transfer (STEET). Journal of Assisted Reproduction and Genetics. 33 (11), 1501-1505 (2016).
- De Vos, A., Van de Velde, H., Joris, H., Van Steirteghem, A. In-vitro matured metaphase-I oocytes have a lower fertilization rate but similar embryo quality as mature metaphase-II oocytes after intracytoplasmic sperm injection. Human Reproduction. 14 (7), 1859-1863 (1999).
- Holubcova, Z., et al. Egg maturity assessment prior to ICSI prevents premature fertilization of late-maturing oocytes. Journal of Assisted Reproduction and Genetics. 36 (3), 445-452 (2019).
- Montag, M., Schimming, T., van der Ven, H. Spindle imaging in human oocytes: the impact of the meiotic cell cycle. Reproductive BioMedicine Online. 12 (4), 442-446 (2006).
- Montag, M., van der Ven, H. Symposium: innovative techniques in human embryo viability assessment. Oocyte assessment and embryo viability prediction: birefringence imaging. Reproductive BioMedicine Online. 17 (4), 454-460 (2008).
- Keefe, D., Liu, L., Wang, W., Silva, C. Imaging meiotic spindles by polarization light microscopy: principles and applications to IVF. Reproductive BioMedicine Online. 7 (1), 24-29 (2003).
- Caamano, J. N., Munoz, M., Diez, C., Gomez, E. Polarized light microscopy in mammalian oocytes. Reproduction in Domestic Animals. 45, 49-56 (2010).
- Eichenlaub-Ritter, U., Shen, Y., Tinneberg, H. R. Manipulation of the oocyte: possible damage to the spindle apparatus. Reproductive BioMedicine Online. 5 (2), 117-124 (2002).
- Wang, W. H., Meng, L., Hackett, R. J., Odenbourg, R., Keefe, D. L. The spindle observation and its relationship with fertilization after intracytoplasmic sperm injection in living human oocytes. Fertility and Sterility. 75 (2), 348-353 (2001).
- Wang, W. H., Meng, L., Hackett, R. J., Keefe, D. L. Developmental ability of human oocytes with or without birefringent spindles imaged by Polscope before insemination. Human Reproduction. 16 (7), 1464-1468 (2001).
- Moon, J. H., et al. Visualization of the metaphase II meiotic spindle in living human oocytes using the Polscope enables the prediction of embryonic developmental competence after ICSI. Human Reproduction. 18 (4), 817-820 (2003).
- Cohen, Y., et al. Spindle imaging: a new marker for optimal timing of ICSI?. Human Reproduction. 19 (3), 649-654 (2004).
- Rama Raju, G. A., Prakash, G. J., Krishna, K. M., Madan, K. Meiotic spindle and zona pellucida characteristics as predictors of embryonic development: a preliminary study using PolScope imaging. Reproductive BioMedicine Online. 14 (2), 166-174 (2007).
- Heindryckx, B., De Gheselle, S., Lierman, S., Gerris, J., De Sutter, P. Efficiency of polarized microscopy as a predictive tool for human oocyte quality. Human Reproduction. 26 (3), 535-544 (2011).
- Kilani, S., Cooke, S., Tilia, L., Chapman, M. Does meiotic spindle normality predict improved blastocyst development, implantation and live birth rates?. Fertility and Sterility. 96 (2), 389-393 (2011).
- Kilani, S., Chapman, M. G. Meiotic spindle normality predicts live birth in patients with recurrent in vitro fertilization failure. Fertility and Sterility. 101 (2), 403-406 (2014).
- Tilia, L., Venetis, C., Kilani, S., Cooke, S., Chapman, M. Is oocyte meiotic spindle morphology associated with embryo ploidy? A prospective cohort study. Fertility and Sterility. 105 (4), 1085-1092 (2016).
- ESHRE Guideline Group on Good Practice in IVF Labs, De los Santos, M. J., et al. Revised guidelines for good practice in IVF laboratories (2015). Human Reproduction. 31 (4), 685-686 (2016).
- Montag, M., Morbeck, D. . Principles of IVF Laboratory Practice: Optimizing Performance and Outcomes. , (2017).
- Chamayou, S., et al. Meiotic spindle presence and oocyte morphology do not predict clinical ICSI outcomes: a study of 967 transferred embryos. Reproductive BioMedicine Online. 13 (5), 661-667 (2006).
- Rienzi, L., et al. Relationship between meiotic spindle location with regard to the polar body position and oocyte developmental potential after ICSI. Human Reproduction. 18 (6), 1289-1293 (2003).
- Woodward, B. J., Montgomery, S. J., Hartshorne, G. M., Campbell, K. H., Kennedy, R. Spindle position assessment prior to ICSI does not benefit fertilization or early embryo quality. Reproductive BioMedicine Online. 16 (2), 232-238 (2008).
- Kilani, S., Cooke, S., Chapman, M. Time course of meiotic spindle development in MII oocytes. Zygote. 19 (1), 55-62 (2011).
- Wang, W. H., Meng, L., Hackett, R. J., Odenbourg, R., Keefe, D. L. Limited recovery of meiotic spindles in living human oocytes after cooling-rewarming observed using polarized light microscopy. Human Reproduction. 16 (11), 2374-2378 (2001).
- Sun, X. F., Wang, W. H., Keefe, D. L. Overheating is detrimental to meiotic spindles within in vitro matured human oocytes. Zygote. 12 (1), 65-70 (2004).
- Mullen, S. F., et al. The effect of osmotic stress on the metaphase II spindle of human oocytes, and the relevance to cryopreservation. Human Reproduction. 19 (5), 1148-1154 (2004).
- Swearman, H., et al. pH: the silent variable significantly impacting meiotic spindle assembly in mouse oocytes. Reproductive BioMedicine Online. 37 (3), 279-290 (2018).
- Rienzi, L., Vajta, G., Ubaldi, F. Predictive value of oocyte morphology in human IVF: a systematic review of the literature. Human Reproduction Update. 17 (1), 34-45 (2011).
- Miao, Y. L., Kikuchi, K., Sun, Q. Y., Schatten, H. Oocyte aging: cellular and molecular changes, developmental potential and reversal possibility. Human Reproduction Update. 15 (5), 573-585 (2009).
- Pujol, A., Garcia, D., Obradors, A., Rodriguez, A., Vassena, R. Is there a relation between the time to ICSI and the reproductive outcomes?. Human Reproduction. 33 (5), 797-806 (2018).
- Yanagida, K., et al. Influence of oocyte preincubation time on fertilization after intracytoplasmic sperm injection. Human Reproduction. 13 (8), 2223-2226 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados