Method Article
Évaluation de la maturité des œufs humains et son application clinique
Dans cet article
Résumé
Nous fournissons un aperçu du protocole clinique pour l'évaluation non-invasive de la maturité humaine d'oeuf utilisant la microscopie polarisée de lumière.
Résumé
Le moment optimal de l'injection intracytoplasmique de sperme (ICSI) est d'une préoccupation sérieuse pour des programmes de fertilité parce que l'entrée prématurée de sperme diminue la compétence développementale de l'oeuf. La présence du premier corps polaire (PB) ainsi que le fuseau méiotique indique l'achèvement de la maturation des ovocytes et la préparation de l'œuf pour la fécondation. Dans la pratique clinique, il est d'usage de supposer que tous les ovocytes affichant un PB sont des ovocytes à métaphase mature (MII). Cependant, l'extrusion de PB précède la formation du fuseau bipolaire de MII. Cette asynchronie fait de la simple présence de PB un marqueur peu fiable de la maturité des ovocytes. L'imagerie de fuseau non invasif utilisant la microscopie polarisée de lumière (PLM) permet l'inspection rapide et facile de si l'oocyte PB-displaying a réellement remonté un fuseau méiotique avant ICSI. Ici, nous présentons un protocole standard pour effectuer l'évaluation de maturité d'oeuf humain dans le laboratoire clinique. Nous montrons également comment optimiser le temps de l'ICSI en ce qui concerne le stade de développement de l'ovocyte afin de prévenir l'injection prématurée de spermatozoïdes d'ovocytes à maturation tardive. En utilisant cette approche, même les ovocytes immatures extrudant PB in vitro peuvent être médicalement utilisés. L'affirmation que le fuseau MII est présent avant l'injection de sperme et l'ajustement individuel du temps de ICSI est particulièrement important dans les cycles de fertilisation in vitro de pronostic pauvre (IVF) avec un petit nombre d'oocytes disponibles pour la fertilisation.
Introduction
Pour devenir un œuf haploïde fertilizable, l'ovocyte diploïde doit extruder la moitié de son information génétique dans une cellule adjacente, appelée le premier corps polaire (PB), et aligner les chromosomes dans l'équateur de la métaphase bipolaire II (MII) fuseau. Tandis que PB peut être clairement observé par la microscopie conventionnelle de lumière, la détection du matériel génétique et des structures cytosquelettiques exige typiquement des procédures préparatoires envahissantes qui sont incompatibles avec l'utilisation ultérieure de l'ovocyte pour le traitement de fertilité. Par conséquent, dans la pratique clinique, la présence du PB est considérée comme une marque de maturité des ovocytes. Cependant, l'imagerie vivante de la dynamique de microtubule et de chromosome pendant la maturation humaine d'oocyte aindiqué que PB devient visible quelques heures avant que le fuseau bipolaire de MII soit assemblé et les chromosomes soient alignés 1. Néanmoins, dans la lumière transmise, les œufs arrêtés MII sont indiscernables des ovocytes qui viennent d'entrer dans le processus de ségrégation chromosomique. Ainsi, une cohorte d'ovocytes, classés comme ovocytes MII basés uniquement sur la présence de PB, pourrait contenir des ovocytes lamnolisants qui n'ont pas encore terminé leur développement et ne sont donc pas prêts pour la fécondation.
Le retard de maturation des ovocytes est susceptible d'affecter la population de mauvais intervenants avec un faible nombre d'ovocytes MII et une forte proportion d'ovocytes immatures recueillis de façon inattendue dans les cycles stimulés2. In vivo, seul un seul œuf de la meilleure qualité atteint sa maturité et devient ovulé. Dans les cycles de fécondation in vitro (FIV), l'hyperstimulation ovarienne contrôlée est utilisée pour recruter plusieurs ovocytes pour la maturation. La poussée de gonadotropine déclenche une reprise du programme méiotique et les progéniteurs d'oeufs sont censés atteindre le stade d'arrestation MII dans les 36 heures3. Cependant, les ovocytes extraits des follicules préovulatoires constituent souvent un assortiment d'ovocytes MII et d'ovocytes immatures, soit à la métaphase I (MI) soit au stade de la vésicule germinale (GV) (figure1). Seuls les ovocytes MII sont soumis à l'injection intracytoplasmique de sperme (ICSI) tandis que les ovocytes immatures sont typiquement jetés. Pourtant, lorsqu'ils sont cultivés in vitro, les ovocytes MI sont couramment observés pour extruder PB in vitro. Malgré leur infériorité générale, les ovocytes à maturation tardive qui ont spontanément terminé la première division méiotique pendant la culture du jour au lendemain ont été utilisés avec succès comme derniers ovocytes de ressource, et des naissances vivantes ont été rapportées4,5 ,6,7,8. Par conséquent, l'injection inopportune du sperme pourrait être une raison primaire sous-jacente à de mauvais résultats développementaux des ovocytes à maturation tardive rapportés dans les études précédentes9,10,11.
La microscopie lumineuse polarisée (PLM) combinée à un logiciel de traitement d'image permet une visualisation non invasive du fuseau méiotique dans l'ovocyte vivant. La double réflexion est générée par l'interaction du faisceau lumineux polarisé avec l'assemblage très ordonné de microtubules construisant le fuseau bipolaire. Puisque la lumière polarisée est d'intensité normale, la technique pourrait être utilisée en toute sécurité dans les milieux cliniques pour voir la dynamique de l'appareil de division11,12,13,14. La présence de la birefringence de fuseau MII dans l'oocyte a été identifiée comme marqueur de la compétence développementale d'un oeuf9,15,16,17,18, 19,20,21,22,23. Ainsi, il a été suggéré que l'imagerie méiotique non invasive de fuseau pourrait être employée pour le contrôle de qualité d'oeuf dans la pratique clinique11,14,20.
Puisque la chronologie pour la dynamique microtubulaire pendant laméiose d'oocyte a été résolue 1, le modèle observé de PLM peut être meilleur lié au cours de temps de la transition de MI à MII. Peu de temps après l'émission de PB, le fuseau MII naissant devient indétectable par PLM. Cependant, si les ovocytes sont conservés dans la culture, le signal de birefringence peut émerger plus tard lorsque le fuseau bipolaire MII se réassemble9,10,11. Ainsi, dans les ovocytes extrudant un PB in vitro, l'absence du fuseau pourrait être seulement temporaire correspondant à la transition physiologique de l'ovocyte à maturation tardive de MI à MII stade. Si le signal de fuseau MII est indétectable, l'injection de sperme peut être reportée à un point de temps plus tard fournissant le temps supplémentaire pour la formation de fuseau MII. L'optimisation assistée par PLM du temps ICSI maximise la chance des ovocytes à maturation tardive d'être médicalement utilisés et de faire une différence pour les patients de pronostic pauvres9.
Ci-dessous, nous fournissons un protocole étape par étape de la façon d'effectuer la formation image de fuseau non-invasive dans les ovocytes humains. Nous démontrons également comment PLM peut être employé pour éviter le risque de fertilisation prématurée des ovocytes à maturation tardive.
Protocole
Ce protocole décrit la procédure clinique qui est un « add-on » au traitement standard de FIV. Il doit être effectué par du personnel expérimenté en conformité avec les bonnes pratiques de laboratoire et les lignes directrices cliniques24,25. Il est recommandé d'obtenir le consentement éclairé écrit des patients admissibles. Ce protocole a été approuvé par le Comité d'éthique institutionnelle.
1. Récupération et dénudation des œufs
- Induire la stimulation ovarienne à l'aide de protocoles de stimulation conventionnels3. Ajustez la dose à la réponse individuelle. Lorsque deux follicules ou plus, visualisés par échographie, atteignent un diamètre de 18 mm, induisent la maturation des ovocytes avec l'application de 250 g de gonadotropine chorionique humaine (hCG). Planifiez le ramassage des ovocytes (OPU) à 35 à 36 h après l'injection de hCG.
- Recueillir les complexes cumulus-ovocytes récupérés (COC) dans le milieu de manutention CO2-indépendant (Tableau des matériaux). Après une courte période d'incubation (10 à15 min) dans un incubateur CO 2-indépendant, brièvement (jusqu'à 30 s) exposent les COC collectés à la solution hyaluronidase (Tableaudes matériaux). Sous un stéréomicroscope, retirer mécaniquement les cellules cumulus-corona en pipetilage doucement COC avec une pointe de filtre de 200 l.
- À l'aide de micropipettes dénudation dont le diamètre diminue graduellement (200 m, 180 m et 150 m), dépouiller délicatement les ovocytes des cellules folliculaires restantes et laver les ovocytes 3x dans le milieu de manipulation.
- Évaluer le nombre et l'état de développement des ovocytes dénudés en fonction de la présence ou de l'absence du noyau et du premier PB (figure 1).
- Vérifiez les critères d'inclusion pour l'examen PLM. Effectuer une évaluation de la maturité des œufs s'il y a (1) une mauvaise réponse inattendue à la stimulation conventionnelle avec moins de 6 ovocytes MII recueillis à l'OPU et (2) une histoire d'échec de fécondation ou d'immaturité des ovocytes.
- Placer les ovocytes GV, MI et MII dans des puits séparés dans un plat de FIV, contenant chacun 500 l l de milieu de culture prééquilibéré co2-dépendant (Tableau des matériaux) recouvert d'huile minérale ( Tableau desmatériaux).
- Incuber pendant 3 à 4 h supplémentaires à 37 oC dans une atmosphère humidifiée de 5 % O2 et 6 % de CO2.
2. Préparation à l'examen PLM et à l'ICSI subséquent
REMARQUE : Le protocole fourni ici décrit l'évaluation PLM effectuée à l'aide du système OCTAX Polar AIDE (Tableaudes matériaux). Alternativement, d'autres systèmes de vue de fuseau disponibles dans le commerce peuvent être utilisés.
- Préparer les plaques pour la culture des embryons.
- Selon le nombre d'ovocytes à examiner (total des ovocytes MII et des ovocytes MI extrudant un PB pendant la période de préincubation), préparez une plaque de 4 puits ou une plaque de 12 puits, remplissez chaque puits de 500 l ou 30 l de milieu de culture, respectivement , et couvrir d'huile minérale préalablement equilibée.
- Veiller à ce que l'huile moyenne et minérale de culture ait été réquidiée dans l'incubateur co2 du jour au lendemain. Gardez le plat préparédans l'incubateur CO 2-dépendant pendant au moins 2 h. Numéroter les puits si nécessaire pour suivre le sort développemental des ovocytes individuels.
- Préparer le plat ICSI.
- Utilisez le plat en plastique assigné et faites 5 gouttelettes de llet de manipulation préchauffée pour chaque ovocyte PB-displaying et une gouttelette supplémentaire pour le lavage d'aiguille. Faire une gouttelette supplémentaire de polyvinylpyrrolidone (PVP) solution (Tableau des matériaux) pour l'immobilisation des spermatozoïdes avant ICSI (ajouter du sperme juste avant ICSI) et la resserbrique avec de l'huile minérale préchauffée.
- Conservez le plat ICSIpréparé dans l'incubateur co 2-indépendant pendant au moins 20 min. Numéroter les puits si nécessaire pour suivre les ovocytes après icSI.
- Préparer le plat d'examen PLM.
- Utilisez le plat de fond en verre assigné et faites 5 gouttelettes de ll de milieu de manipulation préchauffé pour chaque ovocyte PB-displaying. Reproducteur d'huile minérale préchauffée.
- Gardez le platdans l'incubateur CO 2-indépendant pendant au moins 20 min. Numéroles si nécessaire pour suivre les ovocytes après l'examen PLM.
- Préparez le microscope pour l'examen PLM.
- Allumez l'étape chauffée sur le microscope inversé bien à l'avance pour obtenir une température de réchauffement correcte. Assurez-vous que les réglages sont ajustés avec précision pour maintenir 37 oC dans les gouttelettes moyennes de manipulation dans le plat PLM/ICSI pendant les procédures de micromanipulation.
- Ajustez la tenue stérile et l'aiguille ICSI dans les supports de microinjection et les mettre au point. Vous pouvez également utiliser une aiguille d'éclosion.
- Sélectionnez l'objectif approprié (20x et 25x sont les plus appropriés) et assurez-vous que le condenseur est en position de champ lumineux.
- Insérez le filtre d'interférence vert (la lumière devient verte) et placez le curseur d'analyse de cristal liquide en position de travail.
- Réglez l'obturateur à 50 % et ajustez le polariseur circulaire pour diminuer le bruit de fond.
- Préparez l'ordinateur pour l'examen PLM.
- Lancez le logiciel d'imagerie.
- Sélectionner la vidéo Source de la vidéo (en anglais) polarAIDE dans le menu vidéo dans la barre de menu haut.
- Passez à la vidéo en direct en allant à la page vidéo et activer spindle et zona analyse en frappant sur l'icône (Figure supplémentaire 1) dans la barre d'outils vidéo.
- Sélectionnez le mode d'affichage pour la mise à l'échelle dynamique pendant l'imagerie du fuseau : (1) vue combinée rouge (biréfringence)/vert (arrière-plan) ou (2) vue blanche (birefringence)/et noire (arrière-plan). Le mode de notation dynamique est utilisé pour l'autoscoring de zona pellucida.
3. Examen de la maturité des œufs
- Après la période de préincubation (3 à 4 h), effectuer un examen PLM révélant l'état de maturité des ovocytes au moment normal de l'ICSI (39 à 40 h après le déclenchement hCG).
- Transférer tous les ovocytes dans des gouttelettes individuelles sur le plat PLM et le placer sous le microscope inversé préparé pour l'imagerie du fuseau. N'oubliez pas d'enlever le couvercle en plastique du plat en verre avant de commencer l'examen.
- Mettre le premier ovocyte au point. S'il est difficile de rechercher la cellule sous la lumière verte, retirez temporairement le filtre vert. Assurez-vous que le filtre vert est inséré avant l'analyse.
- Observez l'image de birefringence d'oocyte détectée (rouge/orange sur fond vert) car elle est traitée par ordinateur et affichée en temps réel sur l'écran de l'ordinateur. Rappelez-vous que le signal n'est pas visible dans l'oculaire.
- Si le message annonçant une exposition à la lumière est trop faible/élevé apparaît, ajustez la luminosité à l'intensité appropriée à l'aide du bouton d'intensité lumineuse du microscope.
- Utilisez une cale et une aiguille ICSI pour tourner l'ovocyte de sorte que le PB est en position de 12 heures et se concentrer sur le PB.
- Si la biréfringence fuseau n'est pas visible à première vue dans le voisinage de PB, tournez doucement l'ovocyte autour de chaque axe en touchant légèrement la zona pellucida pour assurer l'alignement de la lumière polarisée avec les fibres de fuseau de tableau (Vidéo supplémentaire ). Déclarez l'absence du fuseau MII tant que l'ovocyte ne montre pas le signal de fuseau malgré une rotation rigoureuse.
- Sur la base du modèle de biréfringence observé, classez les ovocytes dans les catégories suivantes (figure2) oocytes avec signal lumineux de fuseau MII bipolaire en forme de baril avec des limites clairement délimitées et même la distribution de la biréfringence ; (B) ovocytes avec fuseau MII dysmorphique, apolaire et translucide avec des limites irrégulières et une distribution inégale du signal; (C) ovocytes sans birefringence de fuseau MII détectable dans l'ooplasme; (D) anaphase I/télophase I oocytes, montrant un pont microtubulaire (un brin conjonctif entre le premier PB et l'ovocyte) au lieu du fuseau MII.
REMARQUE : L'ovocyte avec le signal détectable de fuseau de MII (catégorie A ou B) convient à ICSI immédiat. - Prenez un instantané (F9) ou enregistrez une vidéo pour un rapport et/ou une analyse d'image ultérieure. Conservez la documentation du modèle d'image pour réduire la subjectivité de l'opérateur.
- Déplacez-vous vers la position d'un prochain ovocyte et répétez les étapes 3.6-3.9.
4. Optimiser le calendrier de l'ICSI
- Transférer tous les ovocytes à broches positives (catégorie A ou B, étape 3.8) dans le plat ICSI et les soumettre à l'ICSI selon les protocoles standard24,25.
- Si les ovocytes ne montrent aucun signal de fuseau MII détectable, placez le plat PLM dans l'incubateur indépendant CO2et déplacez l'ICSI dans un temps ultérieur.
- Effectuer un réexamen PLM de 2 à 3 h plus tard après les étapes 3.3-3.9. Si certains ovocytes manquent encore d'un fuseau MII, retardez encore l'ICSI pour un supplément de 1 à 2 h.
- Transférer tous les ovocytes dans le plat ICSI et les injecter selon les protocoles standard24. Si le plat PLM est compatible avec l'angle de flexion de l'aiguille microinjection, effectuez ICSI immédiatement dans le plat PLM après être passé à un mode champ lumineux.
- Sur ICSI, transférer les ovocytes dans des plaques préparées pour la culture et la culture des embryons jusqu'au stade blastocyste.
Résultats
La microscopie lumineuse polarisée permet d'inspecter instantanément si l'ovocyte a terminé la maturation nucléaire et assemblé le fuseau MII avant l'ICSI. En raison de son caractère non invasif, il peut être utilisé pour évaluer en toute sécurité la préparation de l'œuf humain pour la fécondation dans les milieux cliniques11,12,13,14. Les ovocytes épinelés sont plus susceptibles de donner naissance à des embryons viables que les ovocytes sans fuseau9,15,16,17,18,19, 20 Ans, états-unis , 21 Ans, états-unis , 22 Ans , 23. En outre, les ovocytes comportant un fuseau bipolaire distinct semblent avoir une compétence de développement plus élevée que les ovocytes avec des fuseaux dysmorphiques9,21,22. Pris ensemble, l'imagerie de fuseau peut servir d'outil pour identifier les ovocytes avec le plus grand potentiel pour être avec succès fertilisé, subir le développement préimplantatoire et soutenir la grossesse à terme9,15, 16 Annonces , 17 Annonces , 18 ans, états-unis qui , 19 ans, états-unis qui , 20 Ans, états-unis , 21 Ans, états-unis , 22 Ans , 23.
L'incidence déclarée du fuseau varie (44 à 97 %) reflétant la diversité de la population étudiée9,15,16,17,18,19,20,21, 22 Ans , 23 Ans, états-unis , 26 Annonces , 27 Annonces , 28. In vivo, les ovocytes mûris des répondeurs normaux montrent généralement le fuseau bipolaire MII à 40 h après le déclenchement hCG9,18,27,29. Cependant, dans les intervenants lents, le pool d'ovocytes récupérés dans les follicules préovulatoires est affecté par le retard de maturation9,27. Ici, l'imagerie du fuseau devrait être effectuée pour discriminer les ovocytes arrêtés au stade MII de ceux qui subissent une importante transition de maturation (figure 3). Nous recommandons l'élimination des cellules folliculaires immédiatement après la récupération, et l'incubation des ovocytes MI et MII dans des puits séparés pour être en mesure de distinguer les ovocytes mûris in vivo et les ovocytes à maturation tardive extrudant PB in vitro, peu de temps avant icSI. Dans le cas où la dénudation est effectuée juste avant ICSI, ces deux populations d'ovocytes sont indiscernables en fonction de l'apparence PB.
Les changements spécifiques à la phase du modèle de PLM devraient être interprétés dans le contexte de la connaissance de la dynamique de fuseau pendant la maturation méiotique. Pendant l'interkinésie, l'appareil de division subit une réorganisation structurelle étendue et le signal PLM disparaît transitoirement1,9,10,11. Ainsi, dans les ovocytes retardés de développement extrudant PB in vitro, l'absence du signal de fuseau MII peut ne pas nécessairement refléter la perturbation cellulaire, mais il pourrait indiquer la progression de l'ovocyte de MI à MII stade (Figure 3). Si le sperme est injecté à un moment non physiologique, le potentiel de développement de l'ovule est compromis. Le report de l'ICSI donne aux ovocytes à maturation tardive plus de temps pour assembler un fuseau MII dont la présence est associée à de meilleurs résultats cliniques9,10,11. Dans l'étude clinique impliquant des répondeurs lents/pauvres, près de 60 % des ovocytes initialement spindle-négatifs ont développé un signal de fuseau avant que le PLM ne réexamine environ 2 h plus tard9. Selon le stade de développement et la condition physique globale des ovocytes à maturation tardive, l'apparence du fuseau MII après l'extrusion de PB prend généralement de 2 à 6 h (observation non publiée). Les ovocytes présentant un pont de microtubule (anaphase/telophase, catégorie D) pendant le premier examen de PLM exigent un plus long temps pour développer le signal de fuseau miI que les ovocytes sans fuseau visible (spindles émergents, catégorie C). L'ajustement individuel du temps de l'ICSI au stade de développement de l'ovule empêche l'activation prématurée de l'ovocyte et entraîne une amélioration du taux de fécondation et le développement réussi de l'embryon9.
Bien que les ovocytes à maturation tardive extrudant le PB in vitro aient généralement une compétence de développement inférieure à celle des ovocytes adultes in vivo, le taux de développement des embryons est acceptable s'ils parviennent à assembler un fuseau détectable avant le retard de l'ICSI (blastulation taux de 41,32%)9. En utilisant cette approche, même les ovocytes immatures, qui sont normalement rejetés pour le traitement de fertilité, peuvent être médicalement utilisés, produire des embryons transférables, et donner lieu à des grossesses à terme. L'évaluation du stade de maturation de chaque ovocyte individuel est particulièrement bénéfique dans les cycles de pronostic pauvres donnant un petitnombre d'ovocytes MII et/ou après avoir effectué une maturation in vitro de sauvetage des ovocytes immatures 9.
Outre l'évaluation de la maturité des œufs, la formation image du fuseau est également recommandée avant la biopsie PB afin d'éviter la destruction du fuseau dans les ovocytes anaphase I/télophase. Dans l'embryologie expérimentale, la visualisation du fuseau méiotique est utilisée pendant l'enucleation d'oeufs et/ou la procédure de transfert de fuseau13.
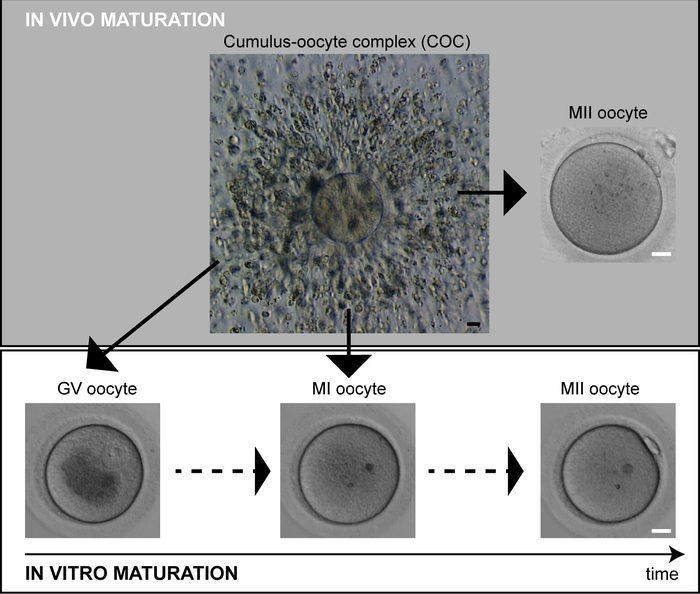
Figure 1 : Maturation des ovocytes humains. Les ovocytes mûris in vivo (MII) présentent pb au moment de la récupération. Les ovocytes immatures (GV, MI) peuvent compléter spontanément la maturation in vitro. Barre d'échelle de 20 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
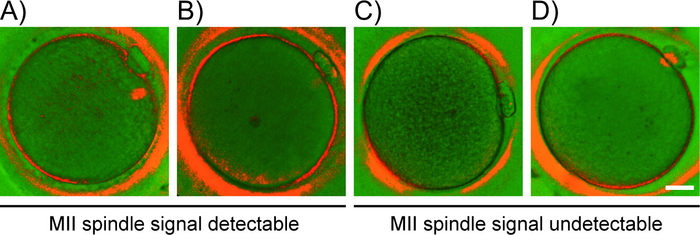
Figure 2 : Classification des ovocytes basée sur le modèle détecté par PLM. Exemples représentatifs de grades d'ovocytes (A-D) basés sur l'apparence du signal de fuseau. Modèle détecté par PLM : (A) signal proéminent de fuseau bipolaire, (B) fildeur apolaire translucide MII, (C) aucun fuseau détectable, et (D) pont microtubule. Barre d'échelle de 20 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
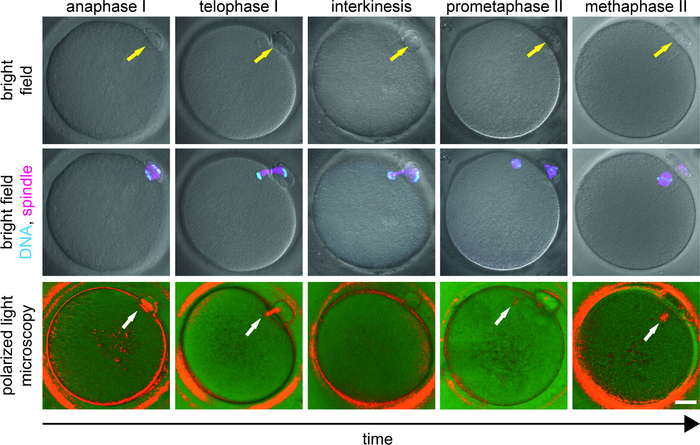
Figure 3 : Étapes de la transition MI à MII dans la maturation des ovocytes. L'apparition d'ovocytes dans le champ lumineux (rangée supérieure), combinée à un signal de fluorescence des chromosomes (cyan) et des microtubules (magenta) (rangée du milieu), et dans la lumière polarisée (rangée inférieure) est montrée. Chaque ovocyte a d'abord été examiné par le PLM et immédiatement fixé. Les ovocytes fixes ont été (immuno)étiquetés avec hoechst (ADN) et anticorps anti-tubulin (microtubules). La flèche jaune indique la présence de PB et la flèche blanche met en évidence la position des microtubules birefringents. Barre d'échelle de 20 m. Ce chiffre a été modifié à partir de Holubcovet al., JARG 20199. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
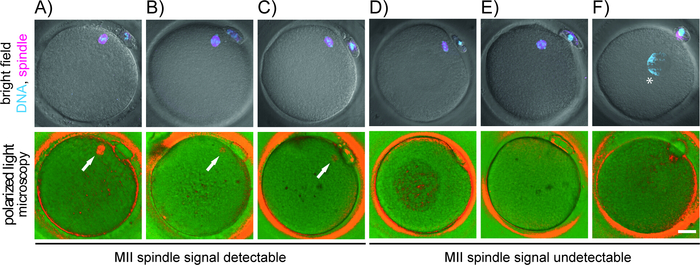
Figure 4 : Corrélation de l'organisation de chromosome-microtubule avec le modèle de birefringence détecté par la microscopie polarisée de lumière. L'apparition d'ovocytes dans le champ lumineux combiné avec un signal fluorescent pour les chromosomes (cyan) et les microtubules (magenta) (rangée supérieure), et dans la lumière polarisée (rangée inférieure) est montrée. Chaque ovocyte a été fixé immédiatement après l'examen de PLM. L'ADN (Hoechst) et le microtubule (tubuline) ont été tachés. (A-C) oocytes avec fuseau PLM-détectable encore chromosomes mal alignés (A, B) ou des poteaux de fuseau lâchement focalisés (C); (D-F) ovocytes anormaux sans fuseau MII plM-détectable montrant sous-développé (D), apolaire (E) ou pas de fuseau (F). La flèche blanche met en évidence la position des microtubules birefringents, et l'astérisque indique la position de la chromatine décondensée. Barre d'échelle de 20 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
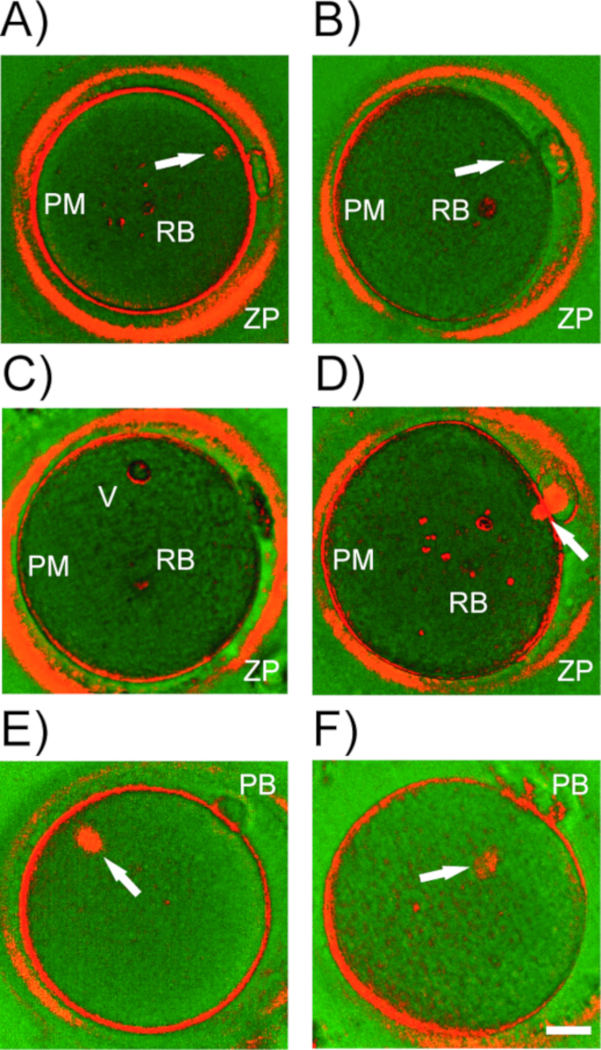
Figure 5 : Structures de biréfringence dans les ovocytes humains. Exemples représentatifs de structures biréfringentes(A-D)détectées par Le PLM dans les ovocytes humains. ZP et zona pellucida; PM et membrane plasmatique (oolema); RB - corps réfractiles, vacuoles. Flèche blanche, fuseau méiotique à différents stades de maturation. (E) MII spindle désalignement avec le corps polaire (PB). (F) Détachement de spindle de la membrane de plasma. Barre d'échelle de 20 m. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Figure supplémentaire 1 : Mise en page de bureau du logiciel d'analyse d'image. Veuillez cliquer ici pour télécharger ce fichier.
Vidéo supplémentaire : Procédure d'examen PLM. La rotation de l'ovocyte est nécessaire pour exclure la présence de la broche (flèche). Barre d'échelle de 20 m. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Le fuseau méiotique acentrosomal dans les ovocytes humains est très dynamique et une structure délicate1. Dans des conditions sous-optimales, les fibres de microtubule dépolymérisent rapidement et le fuseau méiotique démonte30,31,32,33. Par conséquent, il est d'une importance cruciale de s'assurer que la culture des ovocytes et les conditions de micromanipulation, à savoir la température et le pH sont dans la plage optimale. Afin de minimiser le risque de perturbation du fuseau, les ovocytes doivent être conservés dans un environnement à température contrôlée, en maintenant 37 à 0,5 oC dans le milieu des ovocytes. L'utilisation de microscopes et de micro-injection équipés d'une scène chauffée est strictement nécessaire. Toute manipulation avec des ovocytes à l'extérieur de l'incubateur doit être effectuée dans les médias tamponnés HEPES/MOPS pour éviter les fluctuations de pH. Afin d'éviter les effets indésirables potentiels de la remise excessive d'ovocytes dans un état ambiant, le temps total de l'examen PLM ne doit pas dépasser 10 minutes. Les ovocytes doivent être analysés sur le plat en verre avec le couvercle en plastique enlevé parce que le positionnement d'un plastique standard dans le chemin du faisceau altère l'analyse d'image. Étant donné que les plats en plastique et en verre ont des caractéristiques thermiques différentes, la température doit être vérifiée directement dans les gouttelettes du milieu de manutention dans le plat d'examen.
En plus des conditions de laboratoire, les différences de procédure et les compétences en micromanipulation de l'opérateur pourraient avoir une incidence sur l'exactitude de l'examen PLM. Seules les broches bipolaires très assemblées peuvent être visualisées de manière non invasive. Le signal observé est proportionnel au degré d'organisation structurelle du fuseau. Les fuseaux nascents, apolaires, desserrés ou désdésordonnés n'affichent que des birefringences floues ou aucune (figure3 et figure 4). En outre, l'alignement imparfait de la lumière polarisée avec des tableaux de microtubules ne produit qu'une biréfringence translucide et mal définie malgré la présence réelle de fuseau bipolaire bien développé (Figure 4). À moins d'être correctement orienté, le signal de fuseau pourrait être facilement manqué et la maturité des ovocytes mal diagnostiquée (Vidéo supplémentaire). Pour une imagerie optimale du fuseau, l'ovocyte doit être correctement tourné autour de chaque axe. Étant donné que la biréfringence n'est pas visible dans les oculaires, l'opérateur doit regarder l'écran de l'ordinateur tout en effectuant la rotation de l'ovocyte. Une expérience antérieure avec la micromanipulation et la formation de l'imagerie de fuseau dans les ovocytes mûris in vitro excédentaires est souhaitable avant de passer à l'application clinique.
Outre le fuseau, les cumulus entourant l'ovocyte, l'oolema, la couche interne de la zona pellucida et certaines structures cytoplasmiques (p. ex. corps réfractiles, vacuoles) présentent une biréfringence (figure 5A-D). À moins d'être complètement retirés de l'ovocyte avant l'imagerie, les cellules folliculaires étroitement attachées produisent le bruit de fond et compromettent la détection méiotique de fuseau. Veillez à ne pas confondre un grand corps réfractaire pour le fuseau. Beaucoup d'inclusions cytoplasmiques résidant dans le cytoplasme montrent la luminosité élevée qui contraste fortement avec le fond foncé. Le fuseau méiotique, d'autre part, ne présentent qu'un signal modéré, des limites floues et se fixe généralement à l'oolema sous ou à côté du premier PB. À l'occasion, l'examen PLM révèle un écart de fuseau brut par rapport à sa position standard (figure 5E,F). S'il y a un décalage majeur entre l'appareil de division et le PB, PLM aide à orienter l'ovocyte pour éviter le risque de blessure de fuseau pendant la microinjection. La position relative du fuseau dans l'ovocyte ne semble pas influencer le potentiel développemental des embryons résultants17,34. Cependant, quand le fuseau se détache en compétition du oolema, des anomalies de fertilisation se produisent. Fait intéressant, certains ovocytes de mauvaise qualité subissent une décongestion de chromatine immédiatement après l'extrusion de PB au lieu de commencer la nucléation microtubule (Figure 4F). Utilisant la microscopie lumineuse conventionnelle et le PB comme seul marqueur de maturité d'ovocyte, de tels ovocytes sous-compétents seraient considérés comme fertilizables. Ainsi, en plus de l'évaluation morphologique de routine, l'imagerie par fuseau ajoute des informations importantes sur la maturité de l'œuf et peut servir de marqueur indirect de sa qualité.
L'incidence des ovocytes MII fuselés est susceptible d'être affectée par les caractéristiques de la population étudiée (p. ex., antécédents génétiques, condition médicale, âge maternel). De plus, la proportion d'ovocytes retardés dans le développement au sein de la cohorte influera sur le nombre réel d'ovocytes négatifs à broches détectés9,27. La visualisation de fuseau méiotique permet d'identifier clairement les ovocytes fertilizables arrêtés au stade MII. En outre, la deuxième inspection à un moment ultérieur peut révéler si l'ovocyte spindle-négatif est anormal ou n'a progressé que récemment à travers la transition MI/MII9,10,11. Lorsqu'ils sont autorisés à développer un fuseau avant l'ICSI, même les ovocytes immatures, qui sont systématiquement jetés, peuvent produire des embryons viables9. Dans les cycles avec très peu d'ovocytes disponibles pour la fécondation, ICSI finement chronométré des ovocytes extrudant PB peut servir de stratégie de sauvetage et de remplacement à l'annulation de cycle.
Néanmoins, l'allongement du temps de préincubation ne devrait pas être généralisé à tous les ovocytes. Les ovocytes mûris in vivo des répondeurs normaux présentent typiquement un fuseauDEMII 9,20,21,27. Ici, le risque de succès de l'imagerie fuseau diminue avec le temps en raison du vieillissement in vitro post-ovulatoire35. Si possible, l'ICSI doit être effectuée le jour de la récupération et ne doit pas dépasser 9 heures (45 heures après hCG), la période associée à une baisse de la qualité de l'embryonrésultant 36,37. Les ovocytes affichant des fuseaux bipolaires distincts devraient être soumis à l'ICSI sans plus tarder. En résumé, l'optimisation individualisée du calendrier icSI est utile chez les patients de mauvais pronostic pour exclure tout risque d'injection prématurée de sperme. Cependant, il est inutile, trop long et laborieux pour être effectué dans tous les cycles de FIV.
L'analyse de PLM indique si l'oocyte a atteint le stade miI. Cependant, la visualisation non invasive du fuseau méiotique ne fournit aucune information sur l'organisation de chromosome. Il pourrait y avoir un mauvais alignement chromosomique grave et/ou une division chromatide liée à l'âge maternel dans les ovocytes comportant un fuseau bipolaire (figure 5). Divers autres facteurs ont un impact significatif sur le succès de la reproduction (p. ex. facteur de sperme, mitochondries, activation du génome embryonnaire, clivage irrégulier, épigénétique, endomètre, immunité maternelle). Par conséquent, la détection du fuseau MII en soi, ne garantit pas un résultat clinique positif de la procédure de FIV.
Déclarations de divulgation
Les auteurs n'ont rien à révéler.
Remerciements
Nous tenons à remercier le laboratoire d'embryologie de Reprofit International. Nous reconnaissons également l'installation de base CELLIM du CEITEC soutenue par MEYS CR (LM2015062 Czech-Bioimaging) pour leur soutien à l'obtention de données d'imagerie par immunofluorescence présentées ici.
matériels
| Name | Company | Catalog Number | Comments |
| Continuous Single Culture Complete with Human Serum Albumin | Irvine Scientific | 90164 | bicarbonate based single-step culture medium for embryo culture |
| Denuding micropipette 150 µm | Microtech IVF | 005-150C | |
| Denuding micropipette 180 µm | Microtech IVF | 005-180B | suitable for oocyte transfer between dishes |
| Denuding micropipette 200 µm | Microtech IVF | 005-250-A | suitable for oocyte transfer between dishes |
| FluoroDish | World Precision Instruments | FD 5040-100 | glass-bottom dish |
| (alternative: WillCo-dish GWST-5040 WillCo Wells) | |||
| Holding micropipette | Microtech | 001-120-30 | sterile glass microneedles |
| Hyaluronidase solution | Irvine Scientific | 90101 | for oocyte denudation |
| ICSI micropipette | Microtech | 002-5-30 | sterile glass microneedles |
| Micro Droplet Culture Dish | Vitrolife | 16003 | 12-well plate for embryo culture |
| Multipurpose Handling Medium (MHM) with Gentamicin | Irvine Scientific | 90163 | handling medium, MOPS/HEPES buffered |
| Nikon Eclipse TE 2000-U | Nikon | inverted microscope with heated stage | |
| Nunc IVF Petri Dish, 60 mm | Thermo Fisher Scientific | 150270 | plastic ICSI dish |
| Nunc non-treated 4-well IVF dish | Thermo Fisher Scientific | 179830 | 4-well plate for embryo culture |
| OCTAX polarAide | MTG | integrated PLM system | |
| Oil for embryo culture | Irvine Scientific | 9305 | oil for overlay |
| Polyvinylpyrrolidone | Irvine Scientific | 90123 | for sperm immobilization prior to ICSI |
Références
- Holubcova, Z., Blayney, M., Elder, K., Schuh, M. Human oocytes. Error-prone chromosome-mediated spindle assembly favors chromosome segregation defects in human oocytes. Science. 348 (6239), 1143-1147 (2015).
- Oudendijk, J. F., Yarde, F., Eijkemans, M. J., Broekmans, F. J., Broer, S. L. The poor responder in IVF: is the prognosis always poor?: a systematic review. Human Reproduction Update. 18 (1), 1-11 (2012).
- Gautam, N., Allahbadia, Y. M. . Ovarian Stimulation Protocols. , (2016).
- Piqueras, P., et al. Live birth after replacement of an embryo obtained from a spontaneously in vitro matured metaphase-I oocyte. Systems Biology in Reproductive Medicine. 63 (3), 209-211 (2017).
- Liu, J., Lu, G., Qian, Y., Mao, Y., Ding, W. Pregnancies and births achieved from in vitro matured oocytes retrieved from poor responders undergoing stimulation in in vitro fertilization cycles. Fertility and Sterility. 80 (2), 447-449 (2003).
- Shu, Y., et al. Fertilization, embryo development, and clinical outcome of immature oocytes from stimulated intracytoplasmic sperm injection cycles. Fertility and Sterility. 87 (5), 1022-1027 (2007).
- Sachdev, N. M., Grifo, J. A., Licciardi, F. Delayed intracytoplasmic sperm injection (ICSI) with trophectoderm biopsy and preimplantation genetic screening (PGS) show increased aneuploidy rates but can lead to live births with single thawed euploid embryo transfer (STEET). Journal of Assisted Reproduction and Genetics. 33 (11), 1501-1505 (2016).
- De Vos, A., Van de Velde, H., Joris, H., Van Steirteghem, A. In-vitro matured metaphase-I oocytes have a lower fertilization rate but similar embryo quality as mature metaphase-II oocytes after intracytoplasmic sperm injection. Human Reproduction. 14 (7), 1859-1863 (1999).
- Holubcova, Z., et al. Egg maturity assessment prior to ICSI prevents premature fertilization of late-maturing oocytes. Journal of Assisted Reproduction and Genetics. 36 (3), 445-452 (2019).
- Montag, M., Schimming, T., van der Ven, H. Spindle imaging in human oocytes: the impact of the meiotic cell cycle. Reproductive BioMedicine Online. 12 (4), 442-446 (2006).
- Montag, M., van der Ven, H. Symposium: innovative techniques in human embryo viability assessment. Oocyte assessment and embryo viability prediction: birefringence imaging. Reproductive BioMedicine Online. 17 (4), 454-460 (2008).
- Keefe, D., Liu, L., Wang, W., Silva, C. Imaging meiotic spindles by polarization light microscopy: principles and applications to IVF. Reproductive BioMedicine Online. 7 (1), 24-29 (2003).
- Caamano, J. N., Munoz, M., Diez, C., Gomez, E. Polarized light microscopy in mammalian oocytes. Reproduction in Domestic Animals. 45, 49-56 (2010).
- Eichenlaub-Ritter, U., Shen, Y., Tinneberg, H. R. Manipulation of the oocyte: possible damage to the spindle apparatus. Reproductive BioMedicine Online. 5 (2), 117-124 (2002).
- Wang, W. H., Meng, L., Hackett, R. J., Odenbourg, R., Keefe, D. L. The spindle observation and its relationship with fertilization after intracytoplasmic sperm injection in living human oocytes. Fertility and Sterility. 75 (2), 348-353 (2001).
- Wang, W. H., Meng, L., Hackett, R. J., Keefe, D. L. Developmental ability of human oocytes with or without birefringent spindles imaged by Polscope before insemination. Human Reproduction. 16 (7), 1464-1468 (2001).
- Moon, J. H., et al. Visualization of the metaphase II meiotic spindle in living human oocytes using the Polscope enables the prediction of embryonic developmental competence after ICSI. Human Reproduction. 18 (4), 817-820 (2003).
- Cohen, Y., et al. Spindle imaging: a new marker for optimal timing of ICSI?. Human Reproduction. 19 (3), 649-654 (2004).
- Rama Raju, G. A., Prakash, G. J., Krishna, K. M., Madan, K. Meiotic spindle and zona pellucida characteristics as predictors of embryonic development: a preliminary study using PolScope imaging. Reproductive BioMedicine Online. 14 (2), 166-174 (2007).
- Heindryckx, B., De Gheselle, S., Lierman, S., Gerris, J., De Sutter, P. Efficiency of polarized microscopy as a predictive tool for human oocyte quality. Human Reproduction. 26 (3), 535-544 (2011).
- Kilani, S., Cooke, S., Tilia, L., Chapman, M. Does meiotic spindle normality predict improved blastocyst development, implantation and live birth rates?. Fertility and Sterility. 96 (2), 389-393 (2011).
- Kilani, S., Chapman, M. G. Meiotic spindle normality predicts live birth in patients with recurrent in vitro fertilization failure. Fertility and Sterility. 101 (2), 403-406 (2014).
- Tilia, L., Venetis, C., Kilani, S., Cooke, S., Chapman, M. Is oocyte meiotic spindle morphology associated with embryo ploidy? A prospective cohort study. Fertility and Sterility. 105 (4), 1085-1092 (2016).
- ESHRE Guideline Group on Good Practice in IVF Labs, De los Santos, M. J., et al. Revised guidelines for good practice in IVF laboratories (2015). Human Reproduction. 31 (4), 685-686 (2016).
- Montag, M., Morbeck, D. . Principles of IVF Laboratory Practice: Optimizing Performance and Outcomes. , (2017).
- Chamayou, S., et al. Meiotic spindle presence and oocyte morphology do not predict clinical ICSI outcomes: a study of 967 transferred embryos. Reproductive BioMedicine Online. 13 (5), 661-667 (2006).
- Rienzi, L., et al. Relationship between meiotic spindle location with regard to the polar body position and oocyte developmental potential after ICSI. Human Reproduction. 18 (6), 1289-1293 (2003).
- Woodward, B. J., Montgomery, S. J., Hartshorne, G. M., Campbell, K. H., Kennedy, R. Spindle position assessment prior to ICSI does not benefit fertilization or early embryo quality. Reproductive BioMedicine Online. 16 (2), 232-238 (2008).
- Kilani, S., Cooke, S., Chapman, M. Time course of meiotic spindle development in MII oocytes. Zygote. 19 (1), 55-62 (2011).
- Wang, W. H., Meng, L., Hackett, R. J., Odenbourg, R., Keefe, D. L. Limited recovery of meiotic spindles in living human oocytes after cooling-rewarming observed using polarized light microscopy. Human Reproduction. 16 (11), 2374-2378 (2001).
- Sun, X. F., Wang, W. H., Keefe, D. L. Overheating is detrimental to meiotic spindles within in vitro matured human oocytes. Zygote. 12 (1), 65-70 (2004).
- Mullen, S. F., et al. The effect of osmotic stress on the metaphase II spindle of human oocytes, and the relevance to cryopreservation. Human Reproduction. 19 (5), 1148-1154 (2004).
- Swearman, H., et al. pH: the silent variable significantly impacting meiotic spindle assembly in mouse oocytes. Reproductive BioMedicine Online. 37 (3), 279-290 (2018).
- Rienzi, L., Vajta, G., Ubaldi, F. Predictive value of oocyte morphology in human IVF: a systematic review of the literature. Human Reproduction Update. 17 (1), 34-45 (2011).
- Miao, Y. L., Kikuchi, K., Sun, Q. Y., Schatten, H. Oocyte aging: cellular and molecular changes, developmental potential and reversal possibility. Human Reproduction Update. 15 (5), 573-585 (2009).
- Pujol, A., Garcia, D., Obradors, A., Rodriguez, A., Vassena, R. Is there a relation between the time to ICSI and the reproductive outcomes?. Human Reproduction. 33 (5), 797-806 (2018).
- Yanagida, K., et al. Influence of oocyte preincubation time on fertilization after intracytoplasmic sperm injection. Human Reproduction. 13 (8), 2223-2226 (1998).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon