Method Article
ヒト卵成熟度評価とその臨床応用
要約
偏光顕微鏡を用いたヒト卵成熟度の非侵襲的評価のための臨床プロトコルの概要を提供する.
要約
生体精子注射(ICSI)の最適なタイミングは、タイムリーな精子のエントリが卵の発達能力を低下させるので、不妊プログラムにとって深刻な懸念事項である。最初の極性体(PB)とメオティックスピンドルの存在は、卵母細胞の成熟の完了と受精のための卵子の準備を示す。臨床実践では、PBを示す全ての卵母細胞が成熟したメタフェイズ(MII)卵母細胞であると仮定するのが慣例である。しかしながら、PB押出は、双極MIIスピンドルの形成に先行する。この非同期は、PBの単なる存在を卵母細胞成熟の信頼できないマーカーにする。偏光顕微鏡(PLM)を用いた非侵襲的なスピンドルイメージングにより、PB表示卵母細胞がICSIの前に消光スピンドルを実際に組み立て直したかどうかを迅速かつ容易に検査できます。ここでは、臨床検査室でヒト卵成熟度評価を行う標準プロトコルを提示する。また、遅産卵母細胞の早期精子注入を防ぐために、卵母細胞の発達段階に関してICSIの時間を最適化する方法を示す。このアプローチを用いて、インビトロでPBを押し出す未熟な卵母細胞であっても、臨床的に利用することができる。MIIスピンドルが精子注射の前に存在し、ICSIの時間の個々の調整が受精のために利用できる卵母細胞の数が少ない体外受精(IVF)サイクルの予後不良で特に重要であるという確約。
概要
受精性ハプロイド卵子になるためには、ジプロイド卵母細胞は、その遺伝情報の半分を隣接する細胞に押し出し、双極性メタフェイズII(MII)スピンドルの赤道に染色体を整列させる必要があります。PBは従来の光顕微鏡で明確に観察できますが、遺伝物質および細胞骨格構造の検出には、通常、不妊治療のための卵母細胞のさらなる使用と互換性のない侵襲的な準備手順が必要です。したがって、臨床実践において、PBの存在は卵母細胞成熟の特徴とみなされる。しかし、ヒト卵母細胞成熟時の微小管および染色体ダイナミクスのライブイメージングは、双極MIIスピンドルが組み立てられ、染色体が整列される数時間前にPBが可視化することを明らかにした。それにもかかわらず、透過光の中で、MII逮捕された卵は染色体分離の過程に入った卵母細胞と区別がつかない。したがって、PBの存在のみに基づいてMII卵母細胞として分類される卵母細胞のコホートは、その発達をまだ完了しておらず、したがって受精の準備ができていない後期卵母細胞を含んでいる可能性がある。
卵母細胞成熟の遅延は、MII卵母細胞の数が少なく、刺激サイクル2で予期せず採取された未熟な卵母細胞の割合が高い貧しい応答者の集団に影響を与える可能性が高い。生体内では、唯一の最高品質の卵が成熟を達成し、排卵します。体外受精(IVF)サイクルでは、制御された卵巣過剰刺激が成熟のために複数の卵母細胞を募集するために使用される。ゴナドトロピンサージは、マイオティックプログラムの再開をトリガし、卵前駆子は36時間以内にMII逮捕段階に到達することになっている3.しかし、前胚葉胞から取り出した卵母細胞は、多くの場合、メタフェーズI(MI)または胚葉期(GV)のいずれかで、MII卵母細胞および未熟卵母細胞を表示するPCの品揃えを構成する(図1)。MII卵母細胞のみが細胞質内精子注射(ICSI)を受け、未熟な卵母細胞は通常廃棄される。しかし、インビトロで培養すると、MI卵母細胞は一般的にインビトロでPBを押し出すために観察される。彼らの一般的な劣等にもかかわらず、夜間培養中に最初のマイオティック分裂を自発的に完了した後期成熟卵母細胞は、最後の資源卵母細胞として正常に使用され、生きた出生は4、5と報告されている。 ,6,7,8.したがって、精子の不時注射は、以前の研究9、10、11で報告された後期成熟卵母細胞の発達不全の根本的な主な理由である可能性がある。
画像処理ソフトウェアと組み合わせた偏光顕微鏡(PLM)により、生卵細胞内のマイオティックスピンドルの非侵襲的な可視化が可能です。二重反射は、偏光線とバイポーラスピンドルを構築する微小管の高度に順序付けされたアセンブリとの相互作用によって生成されます。偏光は正常強度であるため、この技術は、分割装置11、12、13、14のダイナミクスを見るために臨床設定で安全に使用することができる。卵母細胞内のMIIスピンドル二重性の存在は、卵の発達能力9、15、16、17、18のマーカーとして同定された。 19,20,21,22,23.従って、非侵襲的なメオティックスピンドルイメージングは、臨床実践11、14、20における卵質管理に用いることができることが示唆された。
卵母細胞マイオシス中の微小管ダイナミクスのタイムラインは1を解決したので、観察されたPLMパターンはMII遷移へのMIの時間経過に関連するより良いことができます。PB放出の直後に、新生MIIスピンドルはPLMによって検出不能になる。しかし、卵母細胞が培養中に保持されている場合、双極MIIスピンドルが9、10、11を再組み立てるとき、二重逆性シグナルが後で現れる可能性がある。したがって、インビトロでPBを押し出す卵母細胞において、スピンドルの不在は、MIからMII期への後期成熟卵母細胞の生理的転移に一時的に対応するだけでありうまでありうである。MIIスピンドル信号が検出できない場合、精子注入は、MIIスピンドル形成のための余分な時間を提供する後の時間ポイントに延期することができる。ICSI時間のPLM支援最適化は、後期成熟卵母細胞が臨床的に利用される可能性を最大化し、予後不良患者9に違いを生み出す。
以下に、ヒト卵母細胞における非侵襲的スピンドルイメージングを実行する方法のステップバイステッププロトコルを提供する。また、遅産卵母細胞の早期受精のリスクを回避するためにPLMを採用する方法についても示す。
プロトコル
このプロトコルは、標準的なIVF治療への「アドオン」である臨床手順を説明する。それは良い実験室の練習および臨床指針24、25に従って経験豊富な人員によって行われるべきである。対象となる患者から書面によるインフォームド・コンセントの取得をお勧めします。このプロトコルは、制度倫理委員会によって承認されました。
1. 卵の取り出しと非難
- 従来の刺激プロトコル3を用いて卵巣刺激を誘発する。個々の応答に用量を調整します。超音波スキャンによって可視化された2つ以上の卵胞が、直径18mmに達すると、250μgのヒト絨毛性ゴナドトロピン(hCG)の適用を伴う卵母細胞成熟を誘導する。35−36hポストhCG注射で卵母細胞ピックアップ(OPU)をスケジュールします。
- 回収した卵母細胞複合体(COC)をCO2-独立処理媒体(材料の表)で収集する。CO2-独立インキュベーターの短いインキュベーション期間(10−15分)の後、一時的に(最大30秒)収集されたCOCをヒアルロニダーゼ溶液(材料の表)に暴露する。立体顕微鏡下では、200 μL フィルター先端を使用して COC を優しくピペッティングすることにより、卵性コロナ細胞を機械的に除去します。
- 徐々に減少する直径(200 μm、180 μmおよび150 μm)を持つ脱窒マイクロピペットを使用して、残りの濾胞細胞から卵母細胞を穏やかに取り除き、処理媒体で卵母細胞を3倍洗います。
- 核および最初のPBの有無に応じて、否定された卵母細胞の数および発達状態を評価する(図1)。
- PLM 検査の包含基準を確認します。(1)OPUで採取した6個未満のMII卵母細胞を有する従来の刺激に対する予期せぬ不反応がある場合、および(2)以前の受精不良または卵母細胞未熟の歴史がある場合に、卵子成熟評価を行う。
- GV、MI、MII卵母細胞をIVF皿の別々のウェルに入れ、それぞれ500μLの予見されたCO2依存培養培地(材料の表)を鉱物油で覆った(材料の表)を含む。
- 5%O2および6%CO2の加湿雰囲気の37 °Cで追加の3-4 hのためにインキュベートする。
2. PLM検査及びその後のICSIの準備
注: ここで提供されるプロトコルは、OCTAX 極性AIDEシステム (材料の表)を使用して実行される PLM 評価について説明します。あるいは、他の市販のスピンドルビューシステムを使用することができる。
- 胚栽培用のプレートを準備します。
- 検査する卵母細胞の数(MII卵母細胞の合計、および前置き期間中にPBを押し出すMI卵母細胞の合計)に応じて、4ウェルプレートまたは12ウェルプレートのいずれかを調製し、それぞれ500 μLまたは30μLの培養培地で各ウェルを充填する。、以前に平衡化された鉱物油で覆います。
- 培養培地と鉱物油の両方が一晩CO2インキュベーターで平衡化されていることを確認します。少なくとも2時間CO2依存インキュベーターで準備された皿を保つ必要がある場合は、個々の卵母細胞の発達の運命を追跡するためにウェルに番号を付けます。
- ICSI皿を準備します。
- 割り当てられたプラスチック皿を使用し、各PB表示卵母細胞のための予備の処理媒体の5 μL液滴と針洗浄のための1つの余分な液滴を作る。ICSI(ICSIの直前に精子を追加)の前に精子固定のためのポリビニルピロリドン(PVP)溶液(材料の表)の追加の液滴を作り、予備のミネラルオイルでオーバーレイします。
- 準備したICSI皿をCO2-独立インキュベーターに少なくとも20分間保管し、必要に応じてICSI後に卵母細胞を追跡するために必要な場合はウェルに番号を付けます。
- PLM検査皿を準備します。
- 割り当てられたガラス底皿を使用し、各PB表示卵母細胞の予備処理媒体の5 μL液滴を作ります。あらかじめ温められたミネラルオイルでオーバーレイします。
- CO2-独立したインキュベーターで少なくとも20分間皿を保管し、PLM検査後に卵母細胞を追跡するために必要な場合は液滴を数えます。
- PLM検査の準備ができて顕微鏡を設定します。
- 正しい温度を達成するために、事前に反転顕微鏡上の加熱された段階を十分に切り替えます。マイクロマニピュレーション手順中にPLM/ICSI皿の取り扱い媒体液滴で37°Cを維持するように設定が正確に調整されていることを確認してください。
- 無菌保持とICSI針をマイクロインジェクションホルダーに取り付け、ピントを合わせます。または、ハッチング針を使用します。
- 適切な目的(20xと25xが最も適している)を選択し、凝縮器が明るいフィールド位置にあることを確認します。
- 緑色の干渉フィルタ(ライトが緑色に変わります)を挿入し、液晶解析スライダを動作位置に設定します。
- シャッターを~50%に設定し、円偏光器を調整してバックグラウンドノイズを減らします。
- PLM 検査の準備ができているコンピュータを設定します。
- イメージング ソフトウェアを起動します。
- ビデオの選択|ビデオソース |トップメニューバーのビデオメニューにpolarAIDEを表示します。
- ビデオページに行ってライブビデオに切り替え、ビデオツールバーのアイコン(補足図1)を押してスピンドルとゾーナ解析を有効にします。
- スピンドルイメージング中の動的スケーリングの表示モードを選択します:(1)赤(バイリフリンジ)/緑(背景)複合ビュー、または(2)白(バイリフリンジ)/黒(背景)ビュー。動的スコアリングモードは、ゾナ・ペルシダの自動スコアリングに使用されます。
3. 卵の成熟度の検討
- プリインキュベーション期間(3−4時間)の後、ICSIの標準時(hCGトリガ後39−40h)で卵母細胞成熟度を明らかにするPLM検査を行う。
- すべての卵母細胞をPLM皿上の個々の液滴に移し、スピンドルイメージング用に調製された反転顕微鏡の下に置きます。検査を開始する前に、ガラス底皿からプラスチック製の蓋を取り外すことを忘れないでください。
- 最初の卵母細胞に焦点を当てます。緑色の光の下でセルを検索することが困難な場合は、緑色のフィルタを一時的に引き出します。解析の前に緑色のフィルタが挿入されていることを確認します。
- 検出された卵母細胞二反着画像(緑色の背景に赤/オレンジ)は、コンピュータ処理され、コンピュータ画面上にリアルタイムで表示されます。信号はアイピースに見えないことに注意してください。
- 光の露出をアナウンスするメッセージが低すぎる/高くポップアップする場合は、顕微鏡の光強度ノブを使用して、適切な強度に明るさを調整します。
- PBが12時の位置にあり、PBに焦点を合わせるように、保持針とICSI針を使用して卵母細胞を回します。
- PB付近でスピンドルバイリフリンジが一目見えない場合は、ゾーナ・ペルシダに少し触れて各軸の周りに卵母細胞をそっと回し、偏光とアレイスピンドル繊維との位置合わせを確保する(補足ビデオ)).厳密な回転にもかかわらず、卵母細胞がスピンドル信号を示すことができない限り、MII スピンドルの不在を宣言します。
- 観察された二重縁取りパターンに基づいて、卵母細胞を次のカテゴリーに分類する(図2):(A)明確に線引きされた境界と二重縁の分布を持つ双極バレル形MIIスピンドルの明るい信号を有する卵母細胞;(B)不規則な境界と信号の不均一な分布を有する異形、極性および半透明のMIIスピンドルを有する卵母細胞;(C) 検出可能なMIIスピンドルビレフリンジェンスを有する卵母細胞 (D)アナフェーズI/テロフェイズI卵母細胞は、MIIスピンドルの代わりに微小管状ブリッジ(第1PBと卵母細胞との間の結合鎖)を示す。
注:検出可能なMIIスピンドル信号(グレードAまたはB)を有する卵母細胞は、即時ICSIに適しています。 - スナップショット(F9)を取るか、レポートや後続の画像分析のためにビデオを記録します。演算子の主観性を減らすために、画像パターンのドキュメントを保持します。
- 次の卵母細胞の位置に移動し、ステップ 3.6−3.9を繰り返します。
4. ICSIタイミングの最適化
- すべてのスピンドル陽性卵母細胞(グレードAまたはB、ステップ3.8)をICSI皿に移し、標準プロトコル24、25に従ってICSIに従う。
- 卵母細胞が検出可能なMIIスピンドル信号を示さない場合は、PLM皿をCO2-独立インキュベーターに入れ、ICSIを後でシフトします。
- PLM 再検査 ~2−3 h 後の手順 3.3−3.9 を実行します。一部の卵母細胞がまだMIIスピンドルを欠いている場合は、さらに1−2時間ICSIを遅らせる。
- ICSI皿にすべての卵母細胞を転送し、標準プロトコル24に従ってそれらを注入する。PLM皿がマイクロインジェクション針の曲げ角度と互換性がある場合は、明るいフィールドモードに切り替えた後、すぐにPLM皿でICSIを実行します。
- ICSIでは、胚細胞の段階まで胚の栽培および培養のための準備プレートに卵母細胞を移移す。
結果
偏光顕微鏡は、卵母細胞が核成熟を完了し、ICSIの前に組み立てられたMIIスピンドルを組み立てたかどうかを即座に検査することを可能にします。その非侵襲的な性格のために、それは臨床設定11、12、13、14の受精のための人間の卵の準備を安全に評価するために使用することができる。紡錘9、15、16、17、18、19を持たない卵母細胞よりも生存可能な胚を生じる可能性が高い20歳,21歳,22歳,23.また、明確な双極性スピンドルを特徴とする卵母細胞は、異形紡錘9、21、22を有する卵母細胞よりも高い発達能力を有するように見える。一緒に、スピンドルイメージングは、正常に受精される最大の可能性を持つ卵母細胞を識別するためのツールとして機能し、移植前の開発を受け、完全な妊娠9、15をサポートすることができます。16歳,17歳,18歳,19歳,20歳,21歳,22歳,23.
スピンドルの報告された発生率は変化する(44−97%)研究対象人口9,15,16,17,18,19,20,21の多様性を反映して、22歳,23歳,26歳,27歳,28.正常応答者からの生体内成熟卵母細胞では、通常、hCGトリガ9、18、27、29の後40hで双極MIIスピンドルを示す。しかし、遅い応答者では、排卵前卵胞から取り出された卵母細胞のプールは、成熟遅延9、27の影響を受ける。ここで、スピンドルイメージングは、MII段階で逮捕された卵母細胞を重要な経理転移を受けているものから判別するために行われるべきである(図3)。我々は、検索直後に濾胞細胞を除去し、別々のウェルにMIおよびMII卵母細胞のインキュベーションを行うことを推奨し、ICSIの直前に、ICSIの直前に、インビボ成熟卵母細胞と後期成熟卵母細胞をインビトロで押し出す卵母細胞を区別することができる。脱窒がICSIの直前に行われる場合、これらの2つの卵母細胞の集団はPBの出現に基づいて区別できない。
PLMパターンの位相固有の変化は、メオティック成熟時のスピンドルダイナミクスの知識の文脈で解釈されるべきである。インターカネシスの間、分割装置は広範な構造再編成を受け、PLM信号は一時的に1、9、10、11を消失する。したがって、発達的に遅れた卵母細胞がインビトロでPBを押し出すと、MIIスピンドル信号の欠如は必ずしも細胞障害を反映するとは限らないが、MIからMIIステージへの卵母細胞の進行を示す可能性がある(図3)。精子が生理的な時点で注入されると、卵の発達の可能性が損なわれる。ICSIを延期すると、より良い臨床結果9、10、11に関連する存在が付いているMIIスピンドルを組み立てる時間が増える後期成熟卵母細胞を提供します。遅い/貧弱な応答者を含む臨床研究では、最初のスピンドル陰性卵母細胞のほぼ60%は、PLMが約2時間後に約2時間後に再検査する前にスピンドルシグナルを開発しました9.後期成熟卵母細胞の発達段階および全体的な適合性に応じて、PB押出後のMIIスピンドルの出現は、通常2−6h(未発表の観察)を要する。最初のPLM検査中に微小管ブリッジ(アナフェーズ/テロフェーズ、グレードD)を示す卵母細胞は、目に見えるスピンドル(新興スピンドル、グレードC)を有しない卵母細胞よりもMIIスピンドル信号を開発するのに長い時間を要する。卵子の発達段階へのICSIの時間の個々の調整は、卵母細胞の早期活性化を防止し、改善された受精率と成功した胚の発達9をもたらす。
インビトロでPBを押し出す後期成熟卵母細胞は、一般的にInviv成熟卵母細胞よりも発達能力が低いが、遅れたICSI(爆発)の前に検出可能なスピンドルを組み立てることができれば、胚の発達の速度は許容される。率 41.32%)9.このアプローチを用いて、不妊治療のために通常拒絶される未熟な卵母細胞でさえ、臨床的に利用され、転移可能な胚を産生し、全期間妊娠を引き起こす可能性がある。個々の卵母細胞の成熟期の評価は、少数のMII卵母細胞を生得る悪い予後周期において特に有益であり、未熟卵母細胞の体外成熟における救済を行った後9。
卵の成熟度評価とは別に、アナフェーズI/テロ相卵母細胞のスピンドル破壊を避けるために、PB生検の前にスピンドルイメージングも推奨されます。実験的発生学では、卵の発生および/または紡錘の伝達手順13の間に、マイオティックスピンドルの可視化が用いられる。
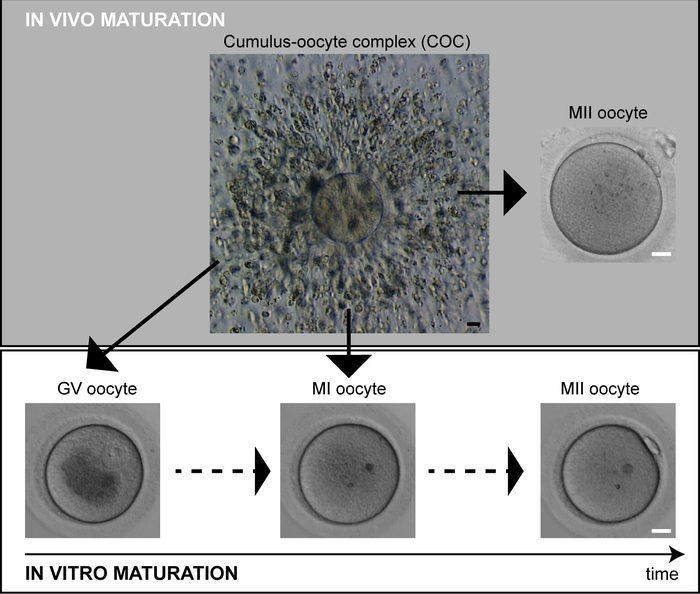
図1:ヒト卵母細胞成熟生体内成熟卵母細胞(MII)では、取得時にPBを示す。未熟卵母細胞(GV、MI)は、インビトロで自発的に成熟を完了することができます。スケールバー = 20 μm.この図のより大きなバージョンを表示するには、ここをクリックしてください。
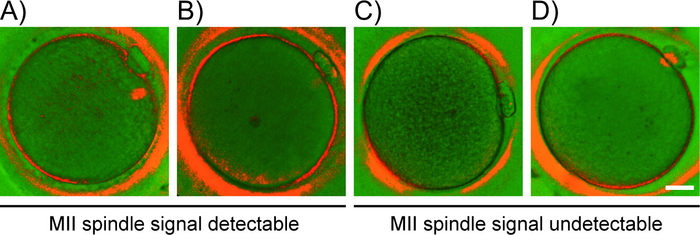
図2:PLM検出パターンに基づく卵母細胞分類。スピンドル信号の出現に基づく卵母細胞グレード(A-D)の代表的な例。PLM検出パターン:(A)バイポーラスピンドルの顕著な信号、(B)半透明のアポーラMIIスピンドルスピンドル、(C)検出可能なスピンドル、および(D)微小管橋。スケールバー = 20 μm.この図のより大きなバージョンを表示するには、ここをクリックしてください。
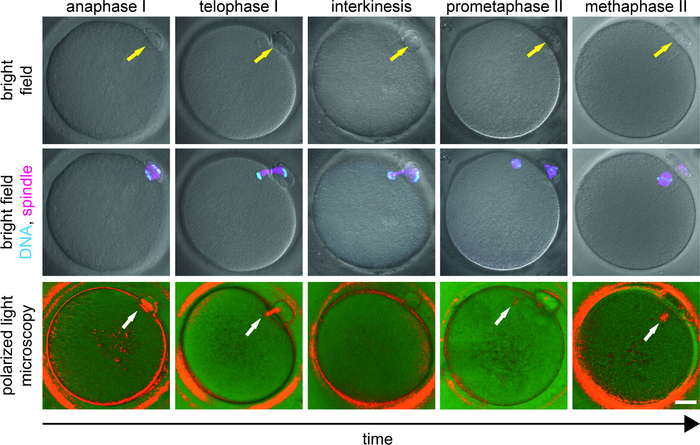
図3:卵母細胞成熟におけるMII遷移へのMIの段階。明視野(上段)における卵母細胞の出現は、染色体(シアン)および微小管(マゼンタ)(中間列)の蛍光シグナルと組み合わせ、偏光(下段)で示される。各卵母細胞は、最初にPLM検査を行い、直ちに修正した。固定卵母細胞(免疫)を、ホエヒト(DNA)および抗αチューブリン抗体(微小管)で標識した。黄色の矢印はPBの存在を示し、白い矢印は二屈線微小管の位置を強調表示します。スケールバー = 20 μm.この図は、ホルブコヴァら、JARG 20199から変更されています。この図のより大きなバージョンを表示するには、ここをクリックしてください。
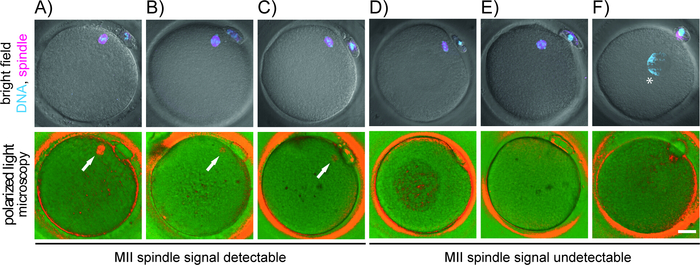
図4:偏光顕微鏡で検出された二重縁斑パターンとの染色体微小管組織の相関。明るい分野における卵母細胞の出現は、染色体(シアン)および微小管(マゼンタ)(上段)および偏光(下段)の蛍光シグナルと組み合わされた。各卵母細胞はPLM検査直後に固定された。DNA(ホエヒト)および微小管(α-チューブリン)を染色した。(A-C) PLM検出可能なスピンドルを有する卵母細胞でありながら、染色体(A、B)または緩やかに焦点を合わせたスピンドル極(C);。 (D-F)PLM検出可能なMIIスピンドルを持たない異常卵母細胞は、未発達(D)、アポーラ(E)、またはスピンドルなし(F)を示す。白い矢印は、二重屈線微小管の位置を強調表示し、アスタリスク(*)は、凝縮クロマチンの位置を示します。スケールバー = 20 μm.この図のより大きなバージョンを表示するには、ここをクリックしてください。
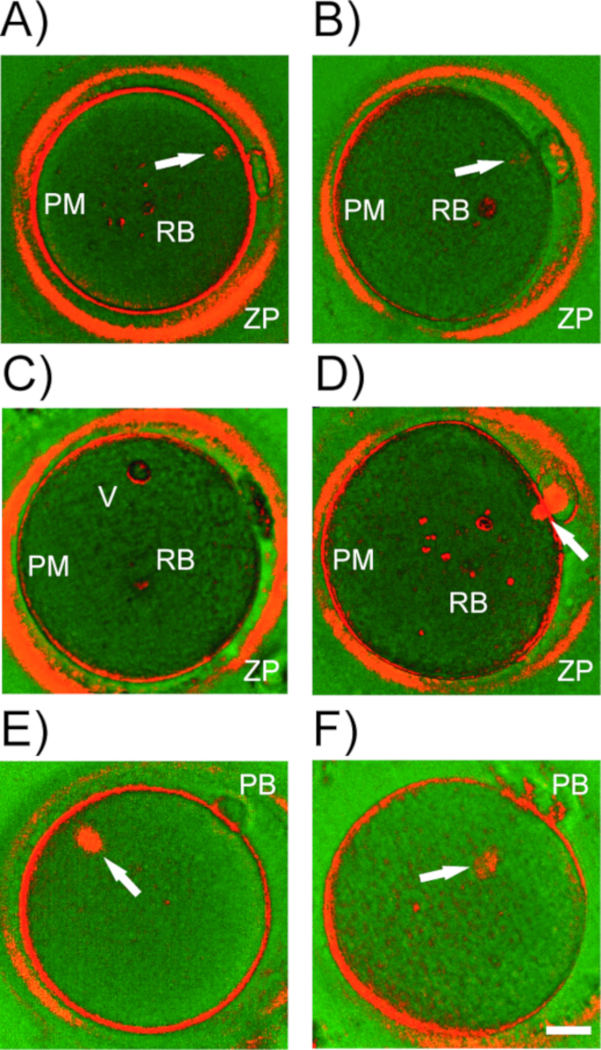
図5:ヒト卵母細胞における二重縁の構造。ヒト卵母細胞におけるPLMによって検出された(A-D)二屈不和構造の代表的な例。ZP = ゾナ・ペルシダ;PM = 血漿膜 (ウーレマ);RB =破砕体、真空。白い矢印、成熟の異なる段階でのマイオティックスピンドル。(E) MIIスピンドルは極性体(PB)とのずれ。(F) 血漿膜からのスピンドル剥離。スケールバー = 20 μm.この図のより大きなバージョンを表示するには、ここをクリックしてください。
補足図 1: 画像解析ソフトウェアのデスクトップ レイアウト。このファイルをダウンロードするには、ここをクリックしてください。
補足ビデオ:PLM検査手順。卵母細胞の回転は、紡錘(矢印)の存在を排除するために必要とされる。スケールバー = 20 μm.ここをクリックしてこのファイルをダウンロードしてください。
ディスカッション
ヒト卵母細胞におけるアセントロソームマイオティックスピンドルは、非常にダイナミックで繊細な構造1です。最適でない条件下では、微小管繊維は急速に脱重合し、マイオティックスピンドルは30、31、32、33を分解する。したがって、卵母細胞培養およびマイクロマニピュレーション条件、すなわち温度およびpHが最適な範囲にあることを確認することが非常に重要である。スピンドル破壊のリスクを最小限に抑えるために、卵母細胞は、卵母細胞培中の37 ±0.5 °Cを維持する温度管理された環境に保持する必要があります。加熱段階を備えた顕微鏡およびマイクロインジェクションの組み立ては厳密に要求される。インキュベーターの外側の卵母細胞によるすべての操作は、pHフラクレーションを避けるためにHEPES/MOPSバッファ化媒体で行う必要があります。周囲条件での過剰な卵母細胞ハンドの潜在的な悪影響を避けるために、PLM検査の合計時間は10分を超えてはなりません。ビームパス内の標準的なプラスチックの位置は画像解析を損なうので、卵母細胞はプラスチック蓋を取り外したガラス底皿で分析する必要があります。プラスチックとガラス底皿は異なる熱特性を持っているので、温度は試験皿の取り扱い媒体の液滴で直接チェックする必要があります。
実験室の条件に加えて、手続き上の違いやオペレータのマイクロマニピュレーションのスキルは、PLM検査の精度に影響を与える可能性があります。非常に組み立てられた双極性紡錘だけが非侵襲的に視覚化することができる。観測された信号は、紡錘の構造組織の程度に比例する。ナセント、アポーラ、ゆるみ、または乱れたスピンドルは、ぼやけた二重縁または全く表示されません(図3および図4)。また、微小管配列との偏光の不完全なアライメントは、よく発達した双極スピンドルの実際の存在にもかかわらず、半透明で不明確な二重リフリンゲンのみを生成します(図4)。適切な指向でない限り、スピンドル信号は見逃しやすく、卵母細胞の成熟度が誤診される可能性があります(補足ビデオ)。最適なスピンドルイメージングを行うには、卵母細胞を各軸に正しく回す必要があります。バイリフリンジは眼球に見えないので、オペレータは卵母細胞の回転を行っている間コンピュータの画面を見る必要があります。インビトロ成熟卵母細胞の余剰におけるスピンドルイメージングのマイクロマニピュレーションおよびトレーニングの以前の経験は、臨床応用に切り替える前に望ましいです。
スピンドルの他に、卵母細胞を取り巻く卵母細胞、卵母、ゾーナ・ペルシダおよびいくつかの細胞質構造の内層(例えば、破砕体、血管)は二重性を示す(図5A-D)。イメージングの前に卵母細胞から完全に除去されない限り、しっかりと取り付けられた濾胞細胞はバックグラウンドノイズを生成し、マイオティックスピンドル検出を損なう。スピンドルの大きな壊死体を間違えないように注意してください。細胞質に存在する多くの細胞質包含物は、暗い背景と鋭く対照的な高輝度を表示します。一方、マイオティックスピンドルは、中程度の信号のみを示し、境界がぼやけ、通常、最初のPBの下または隣接するウーレマに付着する。時折、PLM検査は、標準位置からの総スピンドル偏差を明らかにする(図5E、F)。分割装置とPBの間に大きなずれがある場合、PLMはマイクロインジェクション中にスピンドル損傷のリスクを回避するために卵母細胞の向きをするのに役立ちます。卵母細胞内の紡錘の相対的な位置は、得られた胚17、34の発達電位に影響を与えるようには見えない。しかし、紡錘がウレマから競合して切り離されると、受精異常が生じる。興味深いことに、いくつかの低品質の卵母細胞は、微小管核化を開始する代わりにPB押出直後にクロマチン脱凝縮を受ける(図4F)。従来の光顕微鏡とPBを卵母細胞成熟の唯一のマーカーとして用いると、このようなサブ有能な卵母細胞は受精性と考えられる。したがって、日常的な形態学的評価の上に、スピンドルイメージングは卵の成熟度に関する重要な情報を追加し、その品質の間接的なマーカーとして役立つことができます。
紡錘MII卵母細胞の発生率は、研究集団の特性(例えば、遺伝的背景、病状、母体年齢)の特性によって影響を受ける可能性が高い。さらに、コホート内の発達遅延卵母細胞の割合は、検出されたスピンドル陰性卵母細胞9、27の実際の数に影響を与える。マイオティックスピンドルビジュアライゼーションにより、MII段階で捕膜性卵母細胞を明確に識別することが可能になります。さらに、後の第2の検査は、紡錘陰性卵母細胞が異常であるか、またはMI/MII遷移9、10、11を通して最近進行したかどうかを明らかにしてもよい。ICSIの前にスピンドルを開発させると、日常的に廃棄される未熟な卵母細胞でさえ、生存可能な胚9を産生することができる。受精に利用できる卵母細胞が非常に少ないサイクルでは、PBを押し出す卵母細胞の微細時ICSIは、救助戦略およびサイクルキャンセルの代替手段として役立つことができる。
それにもかかわらず、前潜伏時間を延長することは、すべての卵母細胞に一般化されるべきではない。正常応答者からの生体内成熟卵母細胞では、通常、MIIスピンドル9、20、21、27を示す。ここで、スピンドルイメージングに成功する確率は、インビトロ老化35における排卵後の結果として時間とともに減少する。可能であれば、ICSIは検索日に行われるべきであり、9時間(hCG後45時間)を超えてはならない、結果として生じる胚質36、37の低下に関連する期間。明確な双極スピンドルを示す卵母細胞は、さらなる遅延なしにICSIに供されるべきである。要約すると、ICSIタイミングの個別化された最適化は、早期精子注射のリスクを排除する予後不良患者において価値がある。しかし、すべてのIVFサイクルで実行するには、あまりにも時間がかかり、手間がかかり、不要です。
PLM分析は、卵母細胞がMII段階に達したかどうかを明らかにする。しかし、マイオティックスピンドルの非侵襲的な可視化は染色体組織に関する情報を提供しない。双極性スピンドルを特徴とする卵母細胞では、重度の染色体のずれや母体の年齢に関連するクロマチド分裂が起こる可能性があります(図5)。様々な他の要因は、生殖成功に大きな影響を与える(例えば、精子因子、ミトコンドリア、胚ゲノム活性化、不規則な切断、エピジェネティクス、子宮内膜、母体免疫)。したがって、MIIスピンドル当たりの検出は、IVF手順の肯定的な臨床結果を保証するものではありません。
開示事項
著者は何も開示していない。
謝辞
リプロフィット・インターナショナルの発生学研究室に感謝申し上げます。我々はまた、MEYS CR(LM2015062チェコバイオイメージング)がサポートするCEITECの中核施設CELLIMを、ここに示す免疫蛍光イメージングデータの取得を支援することを認める。
資料
| Name | Company | Catalog Number | Comments |
| Continuous Single Culture Complete with Human Serum Albumin | Irvine Scientific | 90164 | bicarbonate based single-step culture medium for embryo culture |
| Denuding micropipette 150 µm | Microtech IVF | 005-150C | |
| Denuding micropipette 180 µm | Microtech IVF | 005-180B | suitable for oocyte transfer between dishes |
| Denuding micropipette 200 µm | Microtech IVF | 005-250-A | suitable for oocyte transfer between dishes |
| FluoroDish | World Precision Instruments | FD 5040-100 | glass-bottom dish |
| (alternative: WillCo-dish GWST-5040 WillCo Wells) | |||
| Holding micropipette | Microtech | 001-120-30 | sterile glass microneedles |
| Hyaluronidase solution | Irvine Scientific | 90101 | for oocyte denudation |
| ICSI micropipette | Microtech | 002-5-30 | sterile glass microneedles |
| Micro Droplet Culture Dish | Vitrolife | 16003 | 12-well plate for embryo culture |
| Multipurpose Handling Medium (MHM) with Gentamicin | Irvine Scientific | 90163 | handling medium, MOPS/HEPES buffered |
| Nikon Eclipse TE 2000-U | Nikon | inverted microscope with heated stage | |
| Nunc IVF Petri Dish, 60 mm | Thermo Fisher Scientific | 150270 | plastic ICSI dish |
| Nunc non-treated 4-well IVF dish | Thermo Fisher Scientific | 179830 | 4-well plate for embryo culture |
| OCTAX polarAide | MTG | integrated PLM system | |
| Oil for embryo culture | Irvine Scientific | 9305 | oil for overlay |
| Polyvinylpyrrolidone | Irvine Scientific | 90123 | for sperm immobilization prior to ICSI |
参考文献
- Holubcova, Z., Blayney, M., Elder, K., Schuh, M. Human oocytes. Error-prone chromosome-mediated spindle assembly favors chromosome segregation defects in human oocytes. Science. 348 (6239), 1143-1147 (2015).
- Oudendijk, J. F., Yarde, F., Eijkemans, M. J., Broekmans, F. J., Broer, S. L. The poor responder in IVF: is the prognosis always poor?: a systematic review. Human Reproduction Update. 18 (1), 1-11 (2012).
- Gautam, N., Allahbadia, Y. M. . Ovarian Stimulation Protocols. , (2016).
- Piqueras, P., et al. Live birth after replacement of an embryo obtained from a spontaneously in vitro matured metaphase-I oocyte. Systems Biology in Reproductive Medicine. 63 (3), 209-211 (2017).
- Liu, J., Lu, G., Qian, Y., Mao, Y., Ding, W. Pregnancies and births achieved from in vitro matured oocytes retrieved from poor responders undergoing stimulation in in vitro fertilization cycles. Fertility and Sterility. 80 (2), 447-449 (2003).
- Shu, Y., et al. Fertilization, embryo development, and clinical outcome of immature oocytes from stimulated intracytoplasmic sperm injection cycles. Fertility and Sterility. 87 (5), 1022-1027 (2007).
- Sachdev, N. M., Grifo, J. A., Licciardi, F. Delayed intracytoplasmic sperm injection (ICSI) with trophectoderm biopsy and preimplantation genetic screening (PGS) show increased aneuploidy rates but can lead to live births with single thawed euploid embryo transfer (STEET). Journal of Assisted Reproduction and Genetics. 33 (11), 1501-1505 (2016).
- De Vos, A., Van de Velde, H., Joris, H., Van Steirteghem, A. In-vitro matured metaphase-I oocytes have a lower fertilization rate but similar embryo quality as mature metaphase-II oocytes after intracytoplasmic sperm injection. Human Reproduction. 14 (7), 1859-1863 (1999).
- Holubcova, Z., et al. Egg maturity assessment prior to ICSI prevents premature fertilization of late-maturing oocytes. Journal of Assisted Reproduction and Genetics. 36 (3), 445-452 (2019).
- Montag, M., Schimming, T., van der Ven, H. Spindle imaging in human oocytes: the impact of the meiotic cell cycle. Reproductive BioMedicine Online. 12 (4), 442-446 (2006).
- Montag, M., van der Ven, H. Symposium: innovative techniques in human embryo viability assessment. Oocyte assessment and embryo viability prediction: birefringence imaging. Reproductive BioMedicine Online. 17 (4), 454-460 (2008).
- Keefe, D., Liu, L., Wang, W., Silva, C. Imaging meiotic spindles by polarization light microscopy: principles and applications to IVF. Reproductive BioMedicine Online. 7 (1), 24-29 (2003).
- Caamano, J. N., Munoz, M., Diez, C., Gomez, E. Polarized light microscopy in mammalian oocytes. Reproduction in Domestic Animals. 45, 49-56 (2010).
- Eichenlaub-Ritter, U., Shen, Y., Tinneberg, H. R. Manipulation of the oocyte: possible damage to the spindle apparatus. Reproductive BioMedicine Online. 5 (2), 117-124 (2002).
- Wang, W. H., Meng, L., Hackett, R. J., Odenbourg, R., Keefe, D. L. The spindle observation and its relationship with fertilization after intracytoplasmic sperm injection in living human oocytes. Fertility and Sterility. 75 (2), 348-353 (2001).
- Wang, W. H., Meng, L., Hackett, R. J., Keefe, D. L. Developmental ability of human oocytes with or without birefringent spindles imaged by Polscope before insemination. Human Reproduction. 16 (7), 1464-1468 (2001).
- Moon, J. H., et al. Visualization of the metaphase II meiotic spindle in living human oocytes using the Polscope enables the prediction of embryonic developmental competence after ICSI. Human Reproduction. 18 (4), 817-820 (2003).
- Cohen, Y., et al. Spindle imaging: a new marker for optimal timing of ICSI?. Human Reproduction. 19 (3), 649-654 (2004).
- Rama Raju, G. A., Prakash, G. J., Krishna, K. M., Madan, K. Meiotic spindle and zona pellucida characteristics as predictors of embryonic development: a preliminary study using PolScope imaging. Reproductive BioMedicine Online. 14 (2), 166-174 (2007).
- Heindryckx, B., De Gheselle, S., Lierman, S., Gerris, J., De Sutter, P. Efficiency of polarized microscopy as a predictive tool for human oocyte quality. Human Reproduction. 26 (3), 535-544 (2011).
- Kilani, S., Cooke, S., Tilia, L., Chapman, M. Does meiotic spindle normality predict improved blastocyst development, implantation and live birth rates?. Fertility and Sterility. 96 (2), 389-393 (2011).
- Kilani, S., Chapman, M. G. Meiotic spindle normality predicts live birth in patients with recurrent in vitro fertilization failure. Fertility and Sterility. 101 (2), 403-406 (2014).
- Tilia, L., Venetis, C., Kilani, S., Cooke, S., Chapman, M. Is oocyte meiotic spindle morphology associated with embryo ploidy? A prospective cohort study. Fertility and Sterility. 105 (4), 1085-1092 (2016).
- ESHRE Guideline Group on Good Practice in IVF Labs, De los Santos, M. J., et al. Revised guidelines for good practice in IVF laboratories (2015). Human Reproduction. 31 (4), 685-686 (2016).
- Montag, M., Morbeck, D. . Principles of IVF Laboratory Practice: Optimizing Performance and Outcomes. , (2017).
- Chamayou, S., et al. Meiotic spindle presence and oocyte morphology do not predict clinical ICSI outcomes: a study of 967 transferred embryos. Reproductive BioMedicine Online. 13 (5), 661-667 (2006).
- Rienzi, L., et al. Relationship between meiotic spindle location with regard to the polar body position and oocyte developmental potential after ICSI. Human Reproduction. 18 (6), 1289-1293 (2003).
- Woodward, B. J., Montgomery, S. J., Hartshorne, G. M., Campbell, K. H., Kennedy, R. Spindle position assessment prior to ICSI does not benefit fertilization or early embryo quality. Reproductive BioMedicine Online. 16 (2), 232-238 (2008).
- Kilani, S., Cooke, S., Chapman, M. Time course of meiotic spindle development in MII oocytes. Zygote. 19 (1), 55-62 (2011).
- Wang, W. H., Meng, L., Hackett, R. J., Odenbourg, R., Keefe, D. L. Limited recovery of meiotic spindles in living human oocytes after cooling-rewarming observed using polarized light microscopy. Human Reproduction. 16 (11), 2374-2378 (2001).
- Sun, X. F., Wang, W. H., Keefe, D. L. Overheating is detrimental to meiotic spindles within in vitro matured human oocytes. Zygote. 12 (1), 65-70 (2004).
- Mullen, S. F., et al. The effect of osmotic stress on the metaphase II spindle of human oocytes, and the relevance to cryopreservation. Human Reproduction. 19 (5), 1148-1154 (2004).
- Swearman, H., et al. pH: the silent variable significantly impacting meiotic spindle assembly in mouse oocytes. Reproductive BioMedicine Online. 37 (3), 279-290 (2018).
- Rienzi, L., Vajta, G., Ubaldi, F. Predictive value of oocyte morphology in human IVF: a systematic review of the literature. Human Reproduction Update. 17 (1), 34-45 (2011).
- Miao, Y. L., Kikuchi, K., Sun, Q. Y., Schatten, H. Oocyte aging: cellular and molecular changes, developmental potential and reversal possibility. Human Reproduction Update. 15 (5), 573-585 (2009).
- Pujol, A., Garcia, D., Obradors, A., Rodriguez, A., Vassena, R. Is there a relation between the time to ICSI and the reproductive outcomes?. Human Reproduction. 33 (5), 797-806 (2018).
- Yanagida, K., et al. Influence of oocyte preincubation time on fertilization after intracytoplasmic sperm injection. Human Reproduction. 13 (8), 2223-2226 (1998).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved