Method Article
Seguimiento de células madre mesenquimales con etiqueta de óxido de hierro superparamagnético mediante RMN después de la entrega intranasal en un modelo de murino de lesión cerebral traumática
En este artículo
Resumen
Aquí se presenta un protocolo para la entrega y seguimiento de células madre mesenquimales no invasivas (MSC) en un modelo de ratón de lesión cerebral traumática. Las nanopartículas de óxido de hierro superparamagnético se emplean como una sonda de resonancia magnética (RM) para el etiquetado de MSC y el seguimiento in vivo no invasivo después de la administración intranasal mediante RMN en tiempo real.
Resumen
Las terapias basadas en células madre para lesiones cerebrales, como lesiones cerebrales traumáticas (TBI, por sus aires), son un enfoque prometedor para los ensayos clínicos. Sin embargo, los obstáculos técnicos como el parto de células invasivas y el seguimiento con baja eficiencia de trasplante siguen siendo desafíos en la terapia traslacional basada en el tallo. Este artículo describe una técnica emergente para el etiquetado y seguimiento de células madre basada en el etiquetado de las células madre mesenquimales (MSC) con nanopartículas de óxido de hierro superparamagnético (SPIO), así como la entrega intranasal de los MSC etiquetados. Estas nanopartículas son incrustadas en isotiocianato de fluoresceína (FITC) y son seguras para etiquetar los MSC, que posteriormente se entregan a los cerebros de ratones inducidos por TBI por la vía intranasal. A continuación, se les realiza un seguimiento in vivo no invasivo mediante imágenes por resonancia magnética (RM) en tiempo real. Las ventajas importantes de esta técnica que combina SPIO para el etiquetado celular y la entrega intranasal incluyen (1) seguimiento in vivo no invasivo después del parto durante largos períodos de seguimiento, (2) la posibilidad de múltiples regímenes de dosificación debido a los regímenes no invasivos debido a los regímenes de dosificación múltiple debido a los regímenes no invasivos debido a los regímenes no invasivos debido a los regímenes no invasivos debido a los regímenes de dosificación múltiple debido a los regímenes no invasivos debido a los regímenes de dosificación múltiple debido a los regímenes no invasivos debido a los regímenes no invasivos debido a los regímenes de dosificación múltiple debido a los regímenes no invasivos debido a los regímenes no invasivos debido a vía de entrega de MSC, y (3) posibles aplicaciones a los seres humanos, debido a la seguridad del SPIO, la naturaleza no invasiva del método de seguimiento celular por RMN y la vía de administración.
Introducción
Las células madre mesenquimales (MSC) son atractivas candidatas para terapias basadas en células madre en tratamientos de trastornos y lesiones del sistema nervioso central (SNC) en humanos. Además, los MSC se han utilizado como vehículo para la entrega de proteínas terapéuticas en los sitios de lesión1,2. En los últimos años, se han desarrollado innovaciones prometedoras para establecer 1) nuevas vías de entrega celular y 2) seguimiento celular de terapias basadas en células madre de trastornos del SNC. La entrega intranasal de células madre en el cerebro depende de la capacidad de las células para pasar por alto la placa cribriforme y entrar en la bombilla olfativa parcialmente a través de una ruta parénquimal3. La combinación de la administración intranasal y el etiquetado de los MCS con nanopartículas de óxido de hierro superparamagnético (SPIO) representa un enfoque prometedor para las aplicaciones clínicas de los MCS en el tratamiento de los trastornos del SNC, ya que las nanopartículas SPIO son sondas seguras para imágenes por resonancia magnética (RM) y permiten el seguimiento longitudinal no invasivo sensible de los MCS después de la entrega mediante RM33,4,5. Además, el parto intranasal es una vía segura y no invasiva que permite la administración repetida en un corto período de tiempo.
Este artículo describe una técnica altamente sensible y no invasiva para el seguimiento de los MCS en el parto post-intranasal in vivo en un modelo de ratón de lesión cerebral traumática (TBI), que emplea células etiquetadas por SPIO y RMN. Una ventaja importante del etiquetado SPIO es la detección sensible de SPIO en el tejido mediante RMN, que permite rastrear las células de manera eficiente y no invasiva. Las nanopartículas SPIO utilizadas aquí están disponibles comercialmente y etiquetadas con un fluoresceína isotiocianato (FITC) fluoróforo, que permite la detección de SPIO en tejido sin inmunostaining o procesamiento adicional. Además, es posible realizar un seguimiento longitudinal en tiempo real e investigar la biodistribución de los MSC entregados.
Protocolo
Todos los procedimientos relacionados con los animales en este protocolo fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales, con la aprobación del Comité de ética para uso animal en la Universidad Médica de Taipei (aprobación no. LAC-2018-0574; 15.03.2019).
1. Etiquetado de MSCs con Nanopartículas SPIO
- Para etiquetar los MSC con SPIO, añada 6 ml de soporte de etiquetado (25 g/ml de SPIO en el medio Eagle modificado [DMEM] de Dulbecco sin suero bovino fetal [FBS]) a un matraz T75 que contenga SME (80% de confluencia).
-
Incubar las células con el medio de etiquetado en una incubadora de CO2 (37 oC, 5% CO2) sin agitar. Después de las 24 h, retire suavemente el soporte de etiquetado con una pipeta Pasteur estéril con una punta de plástico unida al vacío. Lave las células monocapa 2x con 6 ml de solución salina tamponada de fosfato (PBS) para eliminar cualquier rastro de SPIO no internalizado.
- Para determinar si las células se han etiquetado con éxito, compruebe las celdas etiquetadas bajo un microscopio fluorescente o microscopio confocal si el SPIO está etiquetado con un fluoróforo (es decir, como los utilizados aquí; Figura 1B,C). Alternativamente, realice la tinción azul prusiana para las células (consulte los pasos 6.2–6.4 para el protocolo de tinción).
- Cosecha de células adherentes mediante tratamiento con 3 ml de tripsina e incubaa a 37oC. Después de 5 min de incubación, agregue 7 ml de medios DMEM precalentados con 10% FBS (v/v) para inactivar la trippsina. Recoja la suspensión celular con una pipeta en un tubo cónico de 15 ml.
- Centrifugar la suspensión celular a 300 x g durante 5 min. Deseche el sobrenadante y vuelva a suspender el pellet celular en PBS. Cuente las células viables usando un tinte azul trypan y un hemocitómetro.
NOTA: El pellet celular de las celdas etiquetadas aparecerá como un color oscuro debido a la carga de hierro(Figura 1D). Este protocolo es relevante para el etiquetado de MSC y la imagen por RMN. El procedimiento para el etiquetado de MSC6 ha sido optimizado previamente, y sólo los pasos para preparar los MSC etiquetados para realizar un seguimiento in vivo se incluyen aquí, ya que el seguimiento in vivo es el foco. El protocolo para el cultivo y etiquetado de otros tipos de células debe ser optimizado por el investigador. - Ajustar la concentración celular utilizando PBS a 150.000 células (o un número que da como resultado una señal de RMN suficiente) en 18 sL de PBS (o el volumen total que se utilizará en el procedimiento de administración intranasal).
NOTA: Se notó que una concentración celular superior a 150.000 células/18 l de PBS conduce a la agregación celular, lo que puede afectar la eficiencia de la administración intranasal. Si se necesita un mayor número de células para el parto intranasal, aumente el volumen total de suspensión celular y aumente el número de administraciones intranasales, ya que la administración intranasal es un procedimiento no invasivo, y es posible realizar dosdos múltiples.
2. Lesión de Impacto Cortical Controlado (CCI)
NOTA: En este protocolo, los ratones machoC57 BL/6 (7-8 semanas de edad) se mantuvieron en un ciclo de luz/oscuridad de 12/12 h con acceso ad libitum a alimentos y agua.
- Para preparar cada ratón para la lesión CCI, administre el cóctel de anestesia zolazepam (50 mg/kg) y xilazina (20 mg/kg) mediante inyección intraperitoneal (i.p.) (1 ml/kg). Asegúrese de que la profundidad de la anestesia es suficiente por la falta de respuesta de los dedos de los dedos de los dedos. Alternativamente, coloque el ratón en una cámara suministrada con 2%-4% de isoflurano durante 60s.
- Afeitar el pelaje de la superficie dorsal del cráneo entre las orejas usando un cortapelos electrónico. Limpie el área de afeitado varias veces con un hisopo de algodón estéril empapado en yodo. Use un hisopo de algodón empapado en 70% de etanol para limpiar el yodo.
- Coloque el ratón anestesiado en el marco estereotáctico y fije el ratón usando barras de oído y barras nasales. Hacer una incisión mediasgittal (aproximadamente 2,5 cm) en la piel arascada usando tijeras estériles para acceder a la superficie del cráneo.
- Retire el tejido del hueso con una almohadilla de algodón para exponer el cráneo. Limpie la superficie del cráneo con un hisopo de algodón empapado en un 3% H2O2 durante 10 s, luego límpielo con una almohadilla de algodón seco.
NOTA: Las suturas del cráneo y los bregma y lambda ahora se pueden identificar fácilmente. - Identifique las coordenadas de elección en la superficie del cráneo para la lesión CCI y dibuje un círculo (4 mm de diámetro) alrededor de las coordenadas usando un lápiz o un marcador adecuado.
NOTA: En este protocolo, las coordenadas anteeroposteriores (AP) -2,0 mm y mediolaterales (ML) +1,5 mm se utilizaron para la inducción de CCI. - Utilice un microrretay y una rebaba redonda (0,5 mm de diámetro) para adelgazar el cráneo en el círculo marcado. Evite aplicar presión durante la perforación, ya que la perforación a través del hueso puede causar daño al parénquima cerebral. Limpie el polvo óseo con un hisopo de algodón limpio y seco.
- Retire suavemente el colgajo óseo usando fórceps finos estériles para exponer el dura mater mientras lo mantiene intacto. Retire el ratón del marco estereotáctico que se utilizó para la preparación previa a la lesión y colóquelo en el marco estereotáctico del dispositivo CCI.
- Estabilice la cabeza del ratón con las barras de los oídos y las barras de la nariz. Asegúrese de que la cabeza del ratón esté nivelada en la dirección rostral-caudal y ajuste las barras de la nariz, si es necesario.
- Siga las instrucciones de la caja de control para poner a cero la punta del impactador a la superficie cortical expuesta. Asegúrese de que la punta del impactador esté alineada directamente por encima de las coordenadas de la corteza deseadas para ser impactada usando las ruedas de control X e Y en la base del impactador.
- Establezca los parámetros del experimento utilizando la caja de control con una velocidad de 5 m/s, un tiempo de permanencia de 250 ms y una profundidad de lesión de 1 mm para inducir lesiones leves en el ratón.
- Induzca la lesión pulsando el botón ''impact'' en la caja de control. Swab cualquier sangrado que se produzca utilizando un hisopo de algodón estéril.
- Retire el ratón del marco estereotáctico y cierre la incisión con suturas quirúrgicas de seda. No utilice clips metálicos para cerrar el sitio quirúrgico, ya que el ratón se someterá a un campo magnético para la RMN.
- Aplicar antibióticos tópicos (bacitracina neomicina) en el sitio quirúrgico para prevenir infecciones. Mantenga el ratón en la almohadilla de calentamiento y monitoree lo de cerca durante la fase de recuperación.
- Administrar ketoprofeno (2,5 mg/kg, IP) diariamente durante 3 días después de la cirugía, a menos que la administración de ketoprofeno contradiga los objetivos del estudio.
3. Parto intranasal
- A 1 día de inducción después de CCI, administre el cóctel de anestesia zolazepam (50 mg/kg) y xilazina (20 mg/kg) mediante inyección i.p. Asegúrese de que el ratón está profundamente anestesiado por la falta de respuesta de pinchar los dedos de los dedos.
-
Preparar el ratón para la administración intranasal de los MSC mediante el tratamiento con hialuronidasa.
- Coge el desaliñado del ratón y gira su espalda firmemente mientras inmoviliza el cráneo. Coloque la punta de una pipeta que contenga hialuronidasa en PBS estéril (4 U/L) cerca de la fosa nasal del ratón en un ángulo de 45o.
- Administrar 3 l de suspensión de hialuronidasa en cada fosa nasal. Mantenga el ratón inmovilizado y mirando hacia arriba sobre una almohadilla limpia durante 5 min. Repita el tratamiento con hialuronidasa 4x (total de 100 U de suspensión de hialuronidasa).
- Después del tratamiento con hialuronidasa, mantenga el ratón tratado en una almohadilla limpia hacia arriba durante 30 minutos.
- Para entregar los MSC en el cerebro, sostenga el ratón firmemente, como se describe en el paso 3.2.1. Administrar 3 l/nasal de suspensión de MSC con un intervalo de 3 s. Mantenga el ratón en la misma posición durante 30 s hasta que las gotas de muestra hayan desaparecido por completo.
NOTA: Evite formar burbujas de aire durante la administración. - Repita la administración con un intervalo de 2 minutos hasta 3x.
NOTA: El número total de células a administrar es de 150.000, de tal forma que 18 l de la suspensión celular se pueden administrar a una dosis de 3 l por cada fosa nasal, 3 veces cada una. - Devuelva el ratón a su jaula y monitoree de cerca hasta que se recupere completamente de la anestesia.
4. In Vivo Magnetic Resonance Imaging
NOTA: La tinción histológica del tejido cerebral se ha utilizado previamente para confirmar la administración exitosa de células madre después de la administración intranasal. Sin embargo, este método sólo se puede utilizar como un punto final de un estudio, no longitudinalmente. El uso de sondas de RMN para etiquetar células madre terapéuticas permitirá un seguimiento longitudinal, no invasivo e in vivo de las células mediante RMN. Es importante destacar que este protocolo reduce eficientemente el número de animales necesarios. En este protocolo, la exploración por RMN se realizó en los días 1, 7 y 14 después de la entrega de MSC.
- Para preparar el ratón para la exploración por RMN, anestetiza el ratón con isoflurano (5% isoflurano en 1 L/min de O2 para la inducción, 1.5%–2% isoflurano para mantenimiento). Realice un dedo del pie para asegurarse de que el ratón alcanza el nivel de anestesia requerido.
- Coloque el ratón sobre el soporte de imágenes y asegure su posición con grifos o cualquier otro método adecuado. Mueva el soporte al centro de la bobina de RMN (imán de 7 T/40 cm) y conecte la conexión de supervisión.
- Para adquirir escaneos ponderados T2* utilizando una secuencia de eco de giro, establezca el tiempo de repetición (TR) en 1500 ms y el tiempo de eco (TE) en 2.8 ms.
- Utilice un campo de visión de 16 mm x 16 mm (FOV), una matriz de adquisición (MTX) de 128 x 128 y un espesor de corte de 0,75 x 0,8 mm2 con promedios de cuatro señales y un ángulo de volteo (FA) de 90o.
- Retraiga el soporte del ratón del centro de la bobina de RMN después de completar los escaneos. Devuelva el ratón a su jaula y monitoree de cerca hasta que se recupere completamente de la anestesia.
-
Para realizar un seguimiento y cuantificar los MSC etiquetados en las imágenes ponderadas por T2*, utilice el software ITK-SNAP (versión 3.8.0)7.
- Transfiera los datos sin procesar de las resonancias magnéticas desde el ordenador de la máquina de RMN al ordenador utilizado para el análisis en un formato DICOM (imágenes digitales y comunicaciones en medicina).
- Ejecute el software ITK-SNAP y cargue las imágenes de RMN haciendo clic en el botón Archivo. A continuación, haga clic en Abrir imagen principal en el menú. Pulse el botón Abrir imagen en la ventana de visualización y, a continuación, localice y abra las imágenes de RMN con el botón Examinar.
NOTA: La visualización de las celdas etiquetadas en las imágenes de RMN aparecerá como áreas hipointensas. Si es necesario ajustar el contraste de la imagen, seleccione Herramientas . Contraste de imagen. - Cree segmentaciones de las áreas hipointensas y lesiones u otras partes cerebrales seleccionando Etiqueta activa en la sección de etiquetas de segmentación. Utilice colores de etiqueta diferentes para diferentes segmentos (si se necesita la segmentación de más de una pieza).
- Utilice la herramienta Polígono de la barra de herramientas principal para dibujar alrededor de las áreas hipointensas que representan los MSC con la etiqueta SPIO. Las áreas segmentadas aparecerán como el mismo color de la etiqueta activa asignada a ese segmento en particular. Repita este paso de segmentación para todos los sectores de RMN.
- Desarrolle un mapa 3D de las áreas segmentadas para representar la distribución de MSC en todo el cerebro seleccionando la Herramienta Scalpel en la parte inferior de la Barra de herramientas 3D,ubicada en la sección Etiquetas de segmentación en la parte inferior de la caja de herramientas TheITK-SNAP. A continuación, pulse Aceptar en la parte inferior del mapa 3D creado.
- Para realizar un análisis cuantitativo (media de volumen e intensidad) de las áreas hipointensas segmentadas que representan celdas etiquetadas, pulse el botón Segmentación en el panel superior y seleccione Volumen y Estadísticas.
5. Fijación del cerebro del ratón y la criosección
-
Para reparar el cerebro del ratón, realice la perfusión transcardiaca con un 4% de paraformaldehído (PFA) después de la última resonancia magnética, como se describió anteriormente8.
- Decapita rinde la cabeza y extrae el cerebro8. Arreglar el cerebro con 4% pfa durante al menos 48 h a 4 oC.
- Deshidratar el cerebro sumergiéndolo en una solución de sacarosa del 30% a 4 oC hasta que el cerebro se hunda en la parte inferior de la solución.
- Incruste el cerebro en la solución óptima de temperatura de corte (OCT) y congele a -20 oC. Secciona el cerebro con un microtomo de criostato en rodajas con un grosor de 14 m y mórtalos en diapositivas. Almacene las secciones a -20 oC hasta su uso posterior.
6. Mancha azul prusiana
NOTA: La tinción azul prusiano se utiliza comúnmente para detectar el contenido de hierro en las células etiquetadas con SPIO. Aquí, la tinción azul prusiana se utiliza para confirmar que las señales hipointensas en las imágenes de RMN corresponden a los MSC etiquetados por SPIO y no a artefactos. La tinción azul prusiana es uno de los métodos histoquímicos más sensibles utilizados para detectar hierro en los tejidos y se puede utilizar para identificar incluso un solo gránulo de hierro en las células.
- Lave los portaobjetos de las secciones cerebrales con agua destilada durante 5 min.
- Realizar la tinción azul prusiano sumergiendo los portaobjetos durante 30 minutos en la solución de tinción, que contiene partes iguales de ácido clorhídrico (10%) y ferrocianuro de potasio (10%) preparado inmediatamente antes de su uso.
- Lavar 3x con agua destilada, durante 5 min cada uno. Contratratar las secciones con rojo rápido nuclear durante 5 min. Enjuagar los portaobjetos 2x con agua destilada.
- Deshidrata riseres las secciones gradualmente sumergiendo los portaobjetos en 95% y 100% alcohol durante 2 min cada una. Agregue el cubreobjetos con un medio de montaje resinoso.
- Utilice un microscopio de luz para detectar las células manchadas en las secciones cerebrales.
NOTA: El hierro en las celdas etiquetadas aparecerá como depósitos de color azul.
Resultados
Veinticuatro horas después del parto intranasal, los SSC etiquetados por sPIO se detectaron como áreas hipointensas fuertes mediales a la lesión cortical en imágenes ponderadas por T2*(Figura 2B),lo que indica la migración dirigida de SPIO al sitio de la lesión. Esta migración permaneció visible hasta 14 días después de la entrega, ya que se encontró que las señales hipointensas eran visibles sin reducción significativa para este período de tiempo(Figura 2B). Los animales lesionados tratados con PBS no mostraron áreas hipointensas, lo que indica que las áreas hipointensas observadas corresponden a los SPIO etiquetados mSC y no a artefactos de señalización (Figura 2A) La biodistribución de los MCS etiquetados que se observaron in vivo con rmis visualizar se realizó mediante la reconstrucción 3D(Figura 2C,D). La migración de los MSC a la corteza lesionada fue confirmada histológicamente por la tinción azul prusiana y la detección del canal FITC del SPIO etiquetado por el FITC en los MSC etiquetados(Figura 3A,B).
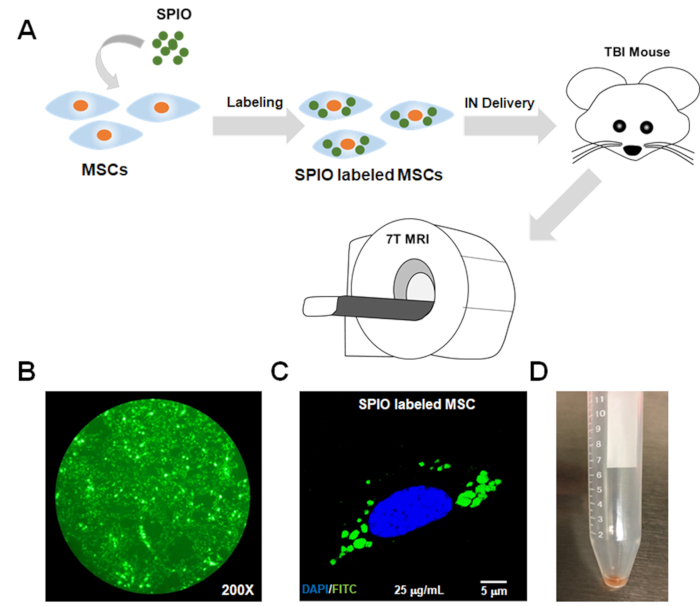
Figura 1: Diagrama de flujo esquemático del protocolo y confirmación in vitro de la adopción de SPIO por mSCs. (A) Se incubaron con SPIO durante 24 horas para su etiquetado. A continuación, los MSC etiquetados se entregaron en un modelo de ratón TBI a través de una ruta intranasal (IN). La RMN en diferentes momentos se realizó para realizar un seguimiento de los MSC etiquetados. La confirmación del etiquetado suficiente de los MC SSC por SPIO se logró mediante la microscopía de fluorescencia(B)y la microscopía confocal(C)utilizando el canal FITC, ya que las nanopartículas SPIO fueron etiquetadas con FITC. (D) El pellet celular de los MSC etiquetados parecía de color oscuro debido a la carga de hierro. FITC - isotiocianato de fluoresceína; SPIO - partículas superparamagnéticas de óxido de hierro; MSCs - células madre mesenquimales; RMN - resonancia magnética; EN intranasal; TBI : lesión cerebral traumática. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: La RMN en tiempo real permite la detección y el seguimiento de la migración de MSC etiquetada por SPIO hacia sitios de lesiones en los cerebros de ratones inducidos por TBI. (A) Los ratones fueron sometidos a TBI, seguidos de un tratamiento con ISP con pbS o MSC etiquetados por SPIO, administrados por vía intranasal 24 h después de una lesión. Las secciones coronales de las imágenes ponderadas por T2* mostraron los MSC etiquetados como un área hipointensa (cabeza de flecha) en el borde del sitio de la lesión (área esbozada) a los 1, 7 y 14 días después de la entrega. Los ratones tratados con PBS no muestran área hipointensa. (B) Proceso de segmentación del área del sitio de la lesión (verde) y MSCs etiquetados (rojo) basados en imágenes coronales T2*-MRI. (C) Reconstrucción 3D del tratamiento cerebral del ratón basado en imágenes ponderadas por T2* que ilustran la biodistribución de los SSC etiquetados por SPIO en el cerebro 14 días después de la entrega. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: El análisis histológico confirma la presencia de SPIO etiquetados con SIS en el cerebro de los animales tratados. La tinción azul prusiano de las secciones cerebrales de un ratón (A) tratado con PBS (control) y (C) ratón tratado con MSC-etiquetado MSCs. SPIO-positivas células fueron detectadas en el ratón tratado con MSC (células en caja, azul), mientras que el ratón de control no mostró células positivas en el sitio de la lesión en el sitio de la lesión en la corteza a los 14 días después de la entrega, confirmando observaciones de RMN. El análisis de microscopía de fluorescencia de la corteza de un ratón de control (B) tratado con PBS y (D) ratón tratado con MSCs etiquetados por SPIO se llevó a cabo 14 días después de la entrega. El análisis reveló la presencia de células positivas SPIO con etiqueta FITC (células en caja, verde) en la corteza lesionada en el ratón tratado con MSC, pero no se observaron señales FITC en la corteza del ratón tratado con PBS. Barras de escala de 50 m, a menos que se indique lo contrario. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El protocolo descrito aquí representa procedimientos generales para el etiquetado SPIO de los MCS y el seguimiento de la RMN de los MSC etiquetados con SPIO después de la entrega intranasal. El protocolo permite estudiar la migración y biodistribución de los MSC después de la entrega in vivo en el cerebro, utilizando un método no invasivo.
Los MSC son candidatos atractivos para terapias basadas en células madre para trastornos y lesiones del SNC debido a su capacidad para secretar factores tróficos que 1) desencadenan procesos neurorrestorativos y 2) proporcionan neuroprotección, debido a sus efectos antiinflamatorios dentro del área de lesiones9,10,11,12. Aunque el seguimiento y la detección de resonancias magnéticas a largo plazo de los MCS etiquetados por SPIO pueden ser limitados debido a la dilución del SPIO intercelular con la división celular, las células etiquetadas pueden detectarse hasta varias semanas después del trasplante en los cerebros de los modelos animales13.
También se describe aquí el protocolo de etiquetado de los MSC con nanopartículas SPIO recubiertas con deextran sin agentes de transfección. Otros protocolos se han utilizado en la literatura14,15,16. Sin embargo, en todos los casos, estos protocolos deben ajustarse para el tipo de celda, el tamaño del SPIO, el tiempo de incubación y la concentración de SPIO. Se ha demostrado que los MSC han deteriorado el potencial de diferenciación condrogénica, pero no la diferenciación adipogénica en el etiquetado SPIO17. Por lo tanto, se recomienda encarecidamente que los ensayos de diferenciación se realicen antes de la entrega de células madre para evaluar la influencia del SPIO en la potencia de diferenciación de las células madre. En un estudio anterior, se demostró que el etiquetado DE MSC con el mismo tipo de SPIO y concentración utilizado en el presente no afectaba a la potencia de diferenciación osteogénica o adipogénica de los MSC6.
La vía intranasal de la entrega terapéutica de células madre para trastornos cerebrales y lesiones es un enfoque prometedor para la aplicación clínica de células madre. Sin embargo, los mecanismos intrínsecos y moleculares que dictan los comportamientos de las células madre en la cavidad nasal siguen sin estar claros. Aunque la vía intranasal es ampliamente explorada para la administración de moléculas pequeñas, el tamaño y el comportamiento de biodistribución del tallo terapéutico difieren de moléculas pequeñas. El protocolo actual demuestra que los MSC tienden a migrar hacia el sitio de la lesión después del parto intranasal.
Aquí, se utilizaron imágenes ponderadas por T2* para rastrear los MSC etiquetados por SPIO. Otros informes han utilizado imágenes de eco de gradiente. Sin embargo, los artefactos de susceptibilidad a menudo se observan en imágenes de eco de gradiente debido al SPIO intercelular. En el protocolo actual, la ubicación de las áreas hipointensas que representan los MSC etiquetados por SPIO en imágenes ponderadas por T2* fue la misma que la ubicación del SPIO en secciones cerebrales detectadas por el examen histológico(Figura 3). Esto indica la sensibilidad adecuada de las imágenes de eco de giro ponderadas por T2* para el seguimiento de MSC etiquetado por SPIO en el cerebro.
En resumen, el protocolo descrito es beneficioso para los estudios de seguimiento de células madre in vivo de lesiones y trastornos cerebrales. El seguimiento longitudinal de las células madre in vivo se ha realizado tradicionalmente sacrificando animales en múltiples puntos de tiempo. El protocolo actual proporciona un enfoque no invasivo y eficiente para la entrega y el seguimiento de los CCR, que representa un procedimiento potencial para la terapia basada en células madre para lesiones y trastornos cerebrales en entornos clínicos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por el Ministerio de Subvenciones científicas y tecnológicas, Taiwán (MOST 104-2923-B-038-004 -MY2, MOST 107-2314-B-038-063, y MOST 107-2314-B-038-042) y Taipei Medical University (TMU 105-AE1-B03, TMU 106-5400-004-400 106-5310-001-400, DP2-107-21121-01-N-05 y DP2-108-21121-01-N-05-01).
Materiales
| Name | Company | Catalog Number | Comments |
| Cell culture supplies (Plastics) | ThermoFisher Scientific | Varies | Replaceable with any source |
| Disposable Microtome Blade | VWR | 95057-832 | |
| D-MEM/F-12 (1X) with GlutaMAX | GIBCO | 10565-018 | |
| Embedding medium for frozen tissue specimens (O. C. T.) | Sakura Finetek | 4583 | |
| Fetal Bovine Serum (FBS) | GIBCO | 12662-029 | |
| Fluorescence Wild Field Microscope | Olympus | Olympus BX43 | |
| Forcept | Fine Science Tools | 11293-00 | Surgery |
| Gentamicin (10 mg/mL) | GIBCO | 15710-064 | |
| Hair clipper | Pet Club | PC-400 | |
| Head Trauma Contusion device | Precision Systems and Instrumentation | Model TBI-0310 | |
| Hyaluronidase from bovine testes | MilliporeSigma | H3506 | |
| ITK-SNAP Software | Penn Image Computing and Science Laboratory (PICSL) at the University of Pennsylvania, and the Scientific Computing and Imaging Institute (SCI) at University of Utah | ITK-SNAP 3.8.0 | |
| Ketamine (Ketavet) | Pfizer | 778-551 | |
| Mice | National Laboratory Animal Center, Taiwan | C57BL6 | Wild type mice strain used in the study |
| Microdrill | Nakanishi | NE50 | Combine with Burrs for generating the bone window |
| Microtome | Leica | RM2265 | |
| Mouse (C57BL/6) Mesenchymal Stem Cells | GIBCO | S1502-100 | |
| MRI scanner | Bruker Biospec | ||
| Phosphate Buffer Saline (PBS) | Corning Cellgro/ThermoFisher | 21-031-CV | |
| Povidone-iodine 7.5% | Purdue product L.P. | Surgical scrub | |
| Prussian Blue Stain | Abcam | ab150674 | |
| Scissor | Fine Science Tools | 14084-08 | Surgery |
| Stereotaxic frame | Kopf Instruments | Model 900 | |
| Superparamagnetic iron oxide (SPIO) nanoparticles | BioPAL | Molday ION EverGreen, CL-50Q02-6A-51 | stem cells labeling for in vivo tracking using MRI |
| Suture monofilament | Ethicon | G697 | Suture |
| Timer | Wisewind | Replaceable with any source | |
| TrypLE | GIBCO | 12604-013 | |
| Xylazine (Rompun) | Bayer | QN05 cm92 |
Referencias
- Pelled, G., et al. Smad8/BMP2-engineered mesenchymal stem cells induce accelerated recovery of the biomechanical properties of the Achilles tendon. Journal of Orthopedic Research. 30 (12), 1932-1939 (2012).
- Shahror, R. A., et al. Transplantation of Mesenchymal Stem Cells Overexpressing Fibroblast Growth Factor 21 Facilitates Cognitive Recovery and Enhances Neurogenesis in a Mouse Model of Traumatic Brain Injury. Journal of Neurotrauma. , (2019).
- Danielyan, L., et al. Intranasal delivery of cells to the brain. European Journal of Cell Biology. 88 (6), 315-324 (2009).
- Karussis, D., et al. Safety and immunological effects of mesenchymal stem cell transplantation in patients with multiple sclerosis and amyotrophic lateral sclerosis. Archives in Neurology. 67 (10), 1187-1194 (2010).
- Danielyan, L., et al. Intranasal delivery of bone marrow-derived mesenchymal stem cells, macrophages, and microglia to the brain in mouse models of Alzheimer's and Parkinson's disease. Cell Transplant. 23, 123-139 (2014).
- Shahror, R. A., Ali, A. A. A., Wu, C. C., Chiang, Y. H., Chen, K. Y. Enhanced Homing of Mesenchymal Stem Cells Overexpressing Fibroblast Growth Factor 21 to Injury Site in a Mouse Model of Traumatic Brain Injury. International Journal of Molecular Science. 20 (11), (2019).
- Yushkevich, P. A., et al. User-guided 3D active contour segmentation of anatomical structures: significantly improved efficiency and reliability. Neuroimage. 31 (3), 1116-1128 (2006).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Li, Y., Chopp, M. Marrow stromal cell transplantation in stroke and traumatic brain injury. Neuroscience Letters. 456 (3), 120-123 (2009).
- Aertker, B. M., Bedi, S., Cox, C. S. Strategies for CNS repair following TBI. Experimental Neurology. 275, 411-426 (2016).
- Ohtaki, H., et al. Stem/progenitor cells from bone marrow decrease neuronal death in global ischemia by modulation of inflammatory/immune responses. Proceedings of the National Academy of Sciences of the United States of America. 105 (38), 14638-14643 (2008).
- Mahmood, A., Lu, D., Chopp, M. Intravenous administration of marrow stromal cells (MSCs) increases the expression of growth factors in rat brain after traumatic brain injury. Journal of Neurotrauma. 21 (1), 33-39 (2004).
- Hoehn, M., et al. Monitoring of implanted stem cell migration in vivo: a highly resolved in vivo magnetic resonance imaging investigation of experimental stroke in rat. Proceedings of the National Academy of Sciences of the United States of America. 99 (25), 16267-16272 (2002).
- Reddy, A. M., et al. In vivo tracking of mesenchymal stem cells labeled with a novel chitosan-coated superparamagnetic iron oxide nanoparticles using 3.0T MRI. Journal of Korean Medical Science. 25 (2), 211-219 (2010).
- Roeder, E., et al. Dose-response of superparamagnetic iron oxide labeling on mesenchymal stem cells chondrogenic differentiation: a multi-scale in vitro study. PLoS ONE. 9 (5), e98451 (2014).
- Schafer, R., et al. Labeling of human mesenchymal stromal cells with superparamagnetic iron oxide leads to a decrease in migration capacity and colony formation ability. Cytotherapy. 11 (1), 68-78 (2009).
- Kostura, L., Kraitchman, D. L., Mackay, A. M., Pittenger, M. F., Bulte, J. W. Feridex labeling of mesenchymal stem cells inhibits chondrogenesis but not adipogenesis or osteogenesis. NMR in Biomedicine. 17 (7), 513-517 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados