Method Article
Verfolgung von superparamagnetischen Eisenoxid-beschrifteten mesenchymalen Stammzellen mit MRT nach intranasaler Lieferung in einem traumatischen Hirnverletzungs-Murine-Modell
In diesem Artikel
Zusammenfassung
Hier wird ein Protokoll zur nicht-invasiven mesenchymalen Stammzell-Entbindung (MSC) und Tracking in einem Mausmodell traumatischer Hirnverletzungen vorgestellt. Superparamagnetische Eisenoxid-Nanopartikel werden als Magnetresonanztomographie (MRT) für die MSC-Kennzeichnung und nicht-invasive in vivo-Tracking nach intranasaler Abgabe mittels Echtzeit-MRT eingesetzt.
Zusammenfassung
Stammzellbasierte Therapien für Hirnverletzungen wie traumatische Hirnverletzungen (TBI) sind ein vielversprechender Ansatz für klinische Studien. Technische Hürden wie die invasive Zellabgabe und das Tracking mit geringer Transplantationseffizienz bleiben jedoch Herausforderungen in der translationalen Stammtherapie. Dieser Artikel beschreibt eine aufkommende Technik zur Stammzellkennzeichnung und -verfolgung basierend auf der Kennzeichnung der mesenchymalen Stammzellen (MSCs) mit superparamagnetischen Eisenoxid-Nanopartikeln (SPIO) sowie der intranasalen Abgabe der markierten MSCs. Diese Nanopartikel sind Fluoresceinisothiocyanat (FITC)-eingebettet und sicher, um die MSCs zu kennzeichnen, die anschließend über den intranasalen Weg an die Gehirne von TBI-induzierten Mäusen geliefert werden. Sie werden dann nicht-in-in-vivo mittels Echtzeit-Magnetresonanztomographie (MRT) nachverfolgt. Wichtige Vorteile dieser Technik, die SPIO für die Zellkennzeichnung und intranasale Abgabe kombiniert, sind (1) nicht-invasives, in vivo MSC-Tracking nach der Verabreichung über lange Tracking-Zeiträume, (2) die Möglichkeit mehrerer Dosierschemas aufgrund der nicht-invasiven Aufgrund der Sicherheit von SPIO, der nichtinvasiven Art der Zellverfolgungsmethode durch MRT und des Verabreichungswegs können (3) mögliche Anwendungen für den Menschen möglich sein.
Einleitung
Mesenchymale Stammzellen (MSC) sind attraktive Kandidaten für Stammzell-basierte Therapien bei Derbehandlungen von Erkrankungen des zentralnervensystems (ZNS) und Verletzungen beim Menschen. Darüber hinaus wurden MSCs als Vehikel für die Lieferung von therapeutischen Proteinen an den Verletzungsstellen1,2verwendet. In den letzten Jahren wurden vielversprechende Innovationen entwickelt, um 1) neue Wege der Zellabgabe und 2) Zellverfolgung für Stammzell-basierte Therapien von ZNS-Erkrankungen zu etablieren. Die intranasale Abgabe von Stammzellen in das Gehirn hängt von der Fähigkeit der Zellen ab, die Krippenplatte zu umgehen und teilweise über eine parenchymale Route3in die Riechbirne einzudringen. Die Kombination von intranasaler Abgabe und kennzeichnung von MSCs mit superparamagnetischen Eisenoxid-Nanopartikeln (SPIO) stellt einen vielversprechenden Ansatz für die klinische Anwendung von MSCs bei der Behandlung von CNS-Erkrankungen dar, da SPIO-Nanopartikel sichere Sonden für die Magnetresonanztomographie (MRT) sind und eine nicht-invasive sensitive Längsverfolgung von MSCs nach der Lieferung durch MRT3,4,5ermöglichen. Darüber hinaus ist die intranasale Verabreichung eine sichere und nicht-invasive Route, die eine wiederholte Verabreichung innerhalb kurzer Zeit ermöglicht.
Dieser Artikel beschreibt eine hochsensible und nicht-invasive Technik zur Verfolgung von MSCs in vivo post-intranasal Erzeugnis in einem Mausmodell der traumatischen Hirnverletzung (TBI), das SPIO-markierte Zellen und MRT verwendet. Ein wichtiger Vorteil der SPIO-Kennzeichnung ist der empfindliche Nachweis von SPIO im Gewebe durch MRT, der es ermöglicht, Zellen effizient und nicht-invasiv zu verfolgen. Die hier verwendeten SPIO-Nanopartikel sind im Handel erhältlich und mit einem Fluoresceinisothiocyanat (FITC) Fluorophor gekennzeichnet, das den Nachweis von SPIO im Gewebe ohne Immunfärbung oder zusätzliche Verarbeitung ermöglicht. Darüber hinaus ist es möglich, Längs-Echtzeit-Tracking durchzuführen und die Bioverteilung der gelieferten MSCs zu untersuchen.
Protokoll
Alle Verfahren, an denen Tiere in diesem Protokoll beteiligt sind, wurden vom Institutional Animal Care and Use Committee mit Genehmigung der Ethikkommission für die Tierverwendung an der Taipei Medical University (Zulassungsnummer. LAC-2018-0574; 15.03.2019).
1. Kennzeichnung von MSCs mit SPIO Nanopartikeln
- Um MSCs mit SPIO zu kennzeichnen, fügen Sie einem T75-Kolben, der MSCs (80 % Konfluenz) enthält, 6 ml Etikettiermedien (25 g/ml SPIO in Dulbeccos modifiziertem Eagle-Medium [DMEM] ohne fetales Rinderserum [FBS]) hinzu.
-
Inkubieren Sie die Zellen mit dem Etikettiermedium in einemCO2-Inkubator (37 °C, 5%CO2) ohne zu schütteln. Nach 24 h die Etikettiermedien vorsichtig mit einer sterilen Pasteurpipette mit einer an einem Vakuum befestigten Kunststoffspitze entfernen. Waschen Sie die Zellen monolayer 2x mit 6 ml Phosphat gepufferte Saline (PBS), um alle Spuren von nicht internalisierten SPIO zu entfernen.
- Um festzustellen, ob die Zellen erfolgreich beschriftet wurden, überprüfen Sie die markierten Zellen unter einem Fluoreszenzmikroskop oder konfokalen Mikroskop, ob der SPIO mit einem Fluorophor markiert ist (d. h. wie hier verwendet; Abbildung 1B,C). Alternativ können Sie preußische blaue Färbung für die Zellen durchführen (siehe Schritte 6.2–6.4 für das Färbeprotokoll).
- Anh.: Anh., anhantibe Zellen nach Behandlung mit 3 ml Trypsin ernten und bei 37 °C inkubieren. Nach 5 min Inkubation 7 ml vorgewärmte DMEM-Medien mit 10% FBS (v/v) hinzufügen, um das Trypsin zu inaktivieren. Sammeln Sie die Zellsuspension mit einer Pipette in ein 15 ml konisches Rohr.
- Zentrifugate die Zellsuspension bei 300 x g für 5 min. Entsorgen Sie den Überstand und setzen Sie das Zellpellet in PBS wieder auf. Zählen Sie die lebensfähigen Zellen mit Trypan-Blaufarbstoff und einem Hämozytometer.
HINWEIS: Das Zellpellet der beschrifteten Zellen erscheint aufgrund der Eisenbelastung als dunkle Farbe (Abbildung 1D). Dieses Protokoll ist für die MSC-Kennzeichnung und MRT-Bildgebung relevant. Das Verfahren für die MSC-Kennzeichnung6 wurde zuvor optimiert, und nur die Schritte zur Vorbereitung beschrifteter MSCs zum Nachverfolgen von in vivo sind hier enthalten, da in vivo Tracking im Mittelpunkt steht. Das Protokoll zur Kultivierung und Kennzeichnung anderer Zelltypen sollte vom Forscher optimiert werden. - Passen Sie die Zellkonzentration mit PBS auf 150.000 Zellen (oder eine Zahl, die zu einem ausreichenden MRT-Signal führt) in 18 L PBS (oder das Gesamtvolumen, das im intranasalen Verabreichungsverfahren verwendet wird) an.
HINWEIS: Es wurde festgestellt, dass eine Zellkonzentration von mehr als 150.000 Zellen/18 L PBS zur Zellaggregation führt, was die Effizienz der intranasalen Abgabe beeinträchtigen kann. Wenn eine höhere Anzahl von Zellen für die intranasale Entbindung benötigt wird, erhöhen Sie das Gesamtvolumen der Zellsuspension und erhöhen Sie die Anzahl der intranasalen Verabreichungen, da die intranasale Verabreichung ein nicht-invasives Verfahren ist und eine Mehrfachbehandlung möglich ist.
2. Kontrollierte Cortical Impact (CCI) Verletzung
HINWEIS: In diesem Protokoll wurden männliche C57 BL/6-Mäuse (7–8 Wochen alt) in einem 12/12 h Hellen/Dunkel-Zyklus mit ad libitum Zugang zu Nahrung und Wasser gehalten.
- Um jede Maus auf CCI-Verletzungen vorzubereiten, verabreichen Sie den Zolazepam (50 mg/kg) und Xylazin (20 mg/kg) anästhesierenden Cocktail mittels intraperitonealer (i.p.) Injektion (1 ml/kg). Stellen Sie sicher, dass die Tiefe der Anästhesie durch einen Mangel an Zehen-Pinch-Antwort ausreichend ist. Alternativ platzieren Sie die Maus in einer Kammer, die mit 2%–4% Isofluran für 60 s geliefertwird.
- Rasieren Sie das Fell der dorsalen Oberfläche des Schädels zwischen den Ohren mit einem elektronischen Haarschneider. Reinigen Sie den rasierten Bereich mehrmals mit einem sterilen Wattestäbchen, der in Jod getränkt ist. Verwenden Sie einen Wattestäbchen in 70% Ethanol getränkt, um das Jod zu reinigen.
- Legen Sie die anästhesierte Maus in den stereotaktischen Rahmen und sichern Sie die Maus mit Ohr- und Nasenstangen. Machen Sie einen midsagittalen Schnitt (ca. 2,5 cm) in der rasierten Haut mit einer sterilen Schere, um auf die Oberfläche des Schädels zuzugreifen.
- Entfernen Sie das Gewebe auf dem Knochen mit einem Wattepad, um den Schädel freizulegen. Reinigen Sie die Schädeloberfläche mit einem Wattestäbchen, der in einem 3% H2O2 für 10 s eingeweicht ist, und reinigen Sie ihn dann mit einem trockenen Wattepad.
HINWEIS: Die Schädelnähte und bregma und lambda können nun leicht identifiziert werden. - Identifizieren Sie die Koordinaten der Wahl auf der Schädeloberfläche für die CCI-Verletzung und zeichnen Sie einen Kreis (4 mm Durchmesser) um die Koordinaten mit einem Bleistift oder einem richtigen Marker.
HINWEIS: In diesem Protokoll wurden die Koordinaten bei anteeroposterior (AP) -2,0 mm und mediolateral (ML) +1,5 mm für die CCI-Induktion verwendet. - Verwenden Sie einen Mikrobohrer und einen runden Grat (0,5 mm Durchmesser), um den Schädel am markierten Kreis zu verdünnen. Vermeiden Sie die Anwendung von Druck während des Bohrens, da das Bohren durch den Knochen Schäden am Parenchym des Gehirns verursachen kann. Reinigen Sie den Knochenstaub mit einem sauberen und trockenen Wattestäbchen.
- Entfernen Sie die Knochenklappe vorsichtig mit sterilen feinen Zangen, um die Dura mater freizulegen, während Sie sie intakt halten. Entfernen Sie die Maus aus dem stereotaktischen Rahmen, der für die Vorbereitung vor verletzungen verwendet wurde, und legen Sie sie in den stereotaktischen Rahmen des CCI-Geräts.
- Stabilisieren Sie den Kopf der Maus mit den Ohr- und Nasenstangen. Stellen Sie sicher, dass der Kopf der Maus in rostral-kaudaler Richtung eben ist, und passen Sie bei Bedarf die Nasenstangen an.
- Befolgen Sie die Anweisungen im Steuerfeld, um die Stoßspitze auf die freiliegende kortikale Oberfläche zu bringen. Stellen Sie sicher, dass die Stoßspitze direkt über den gewünschten Kortexkoordinaten ausgerichtet ist, die mit den X- und Y-Steuerrädern auf der Basis des Stoßsos eingeschlagen werden sollen.
- Stellen Sie die Experimentparameter mithilfe des Steuerkastens mit einer Geschwindigkeit von 5 m/s, einer Verweilzeit von 250 ms und einer Verletzungstiefe von 1 mm ein, um leichte Verletzungen in der Maus zu verursachen.
- Induzieren Sie Verletzungen, indem Sie die Taste "Aufprall" am Steuerkasten drücken. Abstriche alle Blutungen, die mit einem sterilen Wattestäbchen auftreten.
- Entfernen Sie die Maus aus dem stereotaktischen Rahmen und schließen Sie den Schnitt mit Seidenchirurgischen Nähten. Verwenden Sie keine Metallclips, um die chirurgische Stelle zu schließen, da die Maus einem Magnetfeld für DIE MRT ausgesetzt wird.
- Wenden Sie topische Antibiotika (Bacitracin Neomycin) auf die chirurgische Stelle an, um Infektionen zu verhindern. Halten Sie die Maus auf dem Heizkissen und überwachen Sie es während der Erholungsphase genau.
- Verabreichen Sie Ketoprofen (2,5 mg/kg, IP) täglich für 3 Tage nach der Operation, es sei denn, die Ketoprofen-Verabreichung widerspricht den Studienzielen.
3. Intranasale Lieferung
- An 1 Tag nach der CCI-Induktion das Zolazepam (50 mg/kg) und Xylazin (20 mg/kg) anbeschumenden Cocktail mittels i.p. Injektion verabreichen. Stellen Sie sicher, dass die Maus durch fehlende Zehen-Pinch-Antwort tief beästhestisiert ist.
-
Bereiten Sie die Maus für die intranasale Lieferung von MSCs durch Hyaluronidase-Behandlung vor.
- Schnappen Sie sich die Maus schroff und drehen Sie auf dem Rücken fest, während immobilisieren den Schädel. Legen Sie die Spitze einer Pipette, die Hyaluronidase enthält, in sterilem PBS (4 U/L) in der Nähe des Nasenlochs der Maus in einem 45°-Winkel.
- In jedem Nasenloch 3 L Hyaluronidasesuspension verabreichen. Halten Sie die Maus immobilisiert und nach oben auf einem sauberen Pad für 5 min. Wiederholen Hyaluronidase Behandlung 4x (insgesamt 100 U Hyaluronidase Suspension).
- Nach der Hyaluronidase-Behandlung die behandelte Maus 30 min auf einem sauberen Pad nach oben halten.
- Um MSCs in das Gehirn zu liefern, halten Sie die Maus fest, wie in Schritt 3.2.1 beschrieben. Verabreichen Sie 3 L/Nostril der MSC-Suspension mit einem 3-s-Intervall. Halten Sie die Maus 30 s lang in der gleichen Position, bis die Probentropfen vollständig verschwunden sind.
HINWEIS: Vermeiden Sie die Bildung von Luftblasen während der Verabreichung. - Wiederholen Sie die Verabreichung mit einem Intervall von 2 min bis zu 3x.
HINWEIS: Die Gesamtanzahl der zu liefernden Zellen beträgt 150.000, so dass 18 L der Zellsuspension in einer 3-L-Dosierung für jedes Nasenloch, jeweils 3x, abgegeben werden können. - Bringen Sie die Maus in ihren Käfig zurück und überwachen Sie sie genau, bis sie sich vollständig von der Anästhesie erholt.
4. In Vivo Magnetresonanztomographie
HINWEIS: Histologische Färbung von Hirngewebe wurde zuvor verwendet, um die erfolgreiche Lieferung von Stammzellen nach intranasaler Verabreichung zu bestätigen. Diese Methode kann jedoch nur als Endpunkt einer Studie verwendet werden, nicht längs. Die Verwendung von MRT-Sonden zur Kennzeichnung therapeutischer Stammzellen ermöglicht eine Längs-, nicht-invasive In-vivo-Verfolgung der Zellen mittels MRT. Wichtig ist, dass dieses Protokoll die Anzahl der benötigten Tiere effizient reduziert. In diesem Protokoll wurde das MRT-Scannen an den Tagen 1, 7 und 14 nach der Lieferung von MSCs durchgeführt.
- Um die Maus auf das MRT-Scannen vorzubereiten, befeuchten Sie die Maus mit Isofluran (5% Isofluran in 1 L/minO2 für die Induktion, 1,5%–2% Isofluran zur Wartung). Führen Sie eine Zehenzange durch, um sicherzustellen, dass die Maus das erforderliche Anästhesieniveau erreicht.
- Legen Sie die Maus auf den Bildhalter und sichern Sie ihre Position mit Wasserhähnen oder einer anderen geeigneten Methode. Bewegen Sie den Halter in die Mitte der MRT-Spule (7 T/40 cm Magnet) und schließen Sie den Überwachungsanschluss an.
- Um T2*-gewichtete Scans mit einer Spin-Echo-Sequenz zu erfassen, legen Sie die Wiederholungszeit (TR) auf 1500 ms und die Echozeit (TE) auf 2,8 ms fest.
- Verwenden Sie ein Sichtfeld von 16 mm x 16 mm (FOV), eine Erfassungsmatrix (MTX) von 128 x 128 und eine Scheibendicke von 0,75 x 0,8 mm2 mit vier Signaldurchschnitten und einem 90°-Drehwinkel (FA).
- Ziehen Sie den Maushalter aus dem MRT-Spulenzentrum zurück, nachdem Sie die Scans abgeschlossen haben. Bringen Sie die Maus in ihren Käfig zurück und überwachen Sie sie genau, bis sie sich vollständig von der Anästhesie erholt.
-
Verwenden Sie die ITK-SNAP-Software (Version 3.8.0)7, um die beschrifteten MSCs auf den T2*-gewichteten Bildern zu verfolgen und zu quantifizieren.
- Übertragen Sie die Rohdaten der MRT-Scans vom Computer der MRT-Maschine auf den Computer, der für die Analyse im DICOM-Format (Digital Imaging and Communications in medicine) verwendet wird.
- Führen Sie die ITK-SNAP-Software aus und laden Sie die MRT-Bilder, indem Sie auf die Schaltfläche Datei klicken. Klicken Sie dann im Menü auf Hauptbild öffnen. Drücken Sie die Schaltfläche Bild öffnen im Anzeigefenster, und öffnen Sie dann die MRT-Bilder mit der Schaltfläche Durchsuchen.
HINWEIS: Die Visualisierung von beschrifteten Zellen in den MRT-Bildern wird als hypointense Bereiche angezeigt. Wenn der Bildkontrast angepasst werden muss, wählen Sie Extras | Bildkontrast. - Erstellen Sie Segmentierungen der hypointense Bereiche und Läsion oder andere Gehirnteile, indem Sie Aktives Etikett im Abschnitt Segmentierungsbeschriftungen auswählen. Verwenden Sie unterschiedliche Beschriftungsfarben für verschiedene Segmente (wenn die Segmentierung von mehr als einem Teil erforderlich ist).
- Verwenden Sie das Polygon-Werkzeug in der Hauptsymbolleiste, um die hypointense Bereiche zu zeichnen, die die SPIO-beschrifteten MSCs darstellen. Wählen Sie Akzeptierenaus, unterhalb des MRT-Bildes. Die segmentierten Bereiche werden als gleiche Farbe der aktiven Beschriftung angezeigt, die diesem segmentierten Segment zugewiesen ist. Wiederholen Sie diesen Segmentierungsschritt für alle MRT-Slices.
- Entwickeln Sie eine 3D-Karte der segmentierten Bereiche, um die MSC-Verteilung im gesamten Gehirn darzustellen, indem Sie das Scalpel-Tool am unteren Rand der 3D-Symbolleisteauswählen, das sich im Abschnitt Segmentierungsetiketten am unteren Rand der TheITK-SNAP-Toolbox befindet. Drücken Sie dann unten in der erstellten 3D-Karte auf Akzeptieren.
- Um eine quantitative Analyse (Volumen- und Intensitätsmittel) der segmentierten hypointense-Bereiche durchzuführen, die beschriftete Zellen darstellen, drücken Sie die Segmentierungsschaltfläche im oberen Bereich, und wählen Sie Volume und Statisticsaus.
5. Fixierung des Maushirns und Kryosektion
-
Um das Maushirn zu fixieren, führen Sie eine transkardiale Perfusion mit 4% Paraformaldehyd (PFA) nach dem letzten MRT-Scan durch, wie zuvor beschrieben8.
- Enthaupten Sie den Kopf und extrahieren Sie das Gehirn8. Fixieren Sie das Gehirn mit 4% PFA für mindestens 48 h bei 4 °C.
- Dehydrieren Sie das Gehirn, indem Sie es bei 4 °C in eine 30%ige Saccharoselösung eintauchen, bis das Gehirn auf den Boden der Lösung sinkt.
- Das Gehirn in die optimale Schnitttemperaturlösung (OCT) einbetten und bei -20 °C einfrieren. Schneiden Sie das Gehirn mit einem Kryostat-Mikrotom in Scheiben mit einer Dicke von 14 m und montieren Sie sie auf Dias. Bewahren Sie die Sektionsschlitten bis zur weiteren Verwendung bei -20 °C auf.
6. Preußische Blaufärbung
HINWEIS: Preußische blaue Färbung wird häufig verwendet, um den Eisengehalt in SPIO-markierten Zellen zu erkennen. Hier wird preußische blaue Färbung verwendet, um zu bestätigen, dass die hypointense Signale in den MRT-Bildern den SPIO-markierten MSCs und nicht Artefakten entsprechen. Preußische blaue Färbung ist eine der empfindlichsten histochemischen Methoden, die verwendet werden, um Eisen in Geweben zu erkennen und kann verwendet werden, um sogar ein einziges Eisengranulat in den Zellen zu identifizieren.
- Waschen Sie die Dias der Hirnabschnitte mit destilliertem Wasser für 5 min.
- Führen Sie preußische blaue Färbung durch Eintauchen der Dias für 30 min in die Färbelösung, die zu gleichen Teilen Salzsäure enthält (10%) und Kaliumferrocyanid (10%) unmittelbar vor Gebrauch vorbereitet werden.
- Waschen Sie 3x mit destilliertem Wasser, für jeweils 5 min. Die Abschnitte mit kerntechnischem Schnellrot für 5 min. Abspülen sie die Dias 2x mit destilliertem Wasser.
- Dehydrieren Sie die Abschnitte schrittweise, indem Sie die Rutschen in 95% und 100% Alkohol für jeweils 2 min eintauchen. Deckelschlupf mit einem harzigen Montagemedium hinzufügen.
- Verwenden Sie ein Lichtmikroskop, um die gefärbten Zellen in den Gehirnabschnitten zu erkennen.
HINWEIS: Das Eisen in den beschrifteten Zellen erscheint als blau gefärbte Ablagerungen.
Ergebnisse
24 Stunden nach der intranasalen Lieferung wurden die SPIO-gekennzeichneten MSCs als starke hypointense Bereiche medial zur kortikalen Verletzung auf T2*-gewichteten Bildern nachgewiesen (Abbildung 2B), was auf die gezielte Migration von SPIO an die Verletzungsstelle hindeutet. Diese Migration blieb bis zu 14 Tage nach der Lieferung sichtbar, da sich herausstellte, dass die hypointense-Signale für diesen Zeitraum ohne signifikante Reduktion sichtbar waren (Abbildung 2B). Die mit PBS behandelten verletzten Tiere zeigten keine hypointensen Bereiche, was darauf hindeutet, dass die beobachteten hypointense Bereiche den SPIO-markierten MSCs entsprechen und nicht Artefakte signalisieren (Abbildung 2A) Die Bioverteilung der beschrifteten MSCs, die in vivo mit MRT beobachtet wurden, wurde mit 3D-Rekonstruktion visualisiert (Abbildung 2C,D). Die Migration von MSCs in den verletzten Kortex wurde histologisch durch preußische Blaufärbung und FITC-Kanalerkennung des FITC-markierten SPIO in den beschrifteten MSCs bestätigt (Abbildung 3A,B).
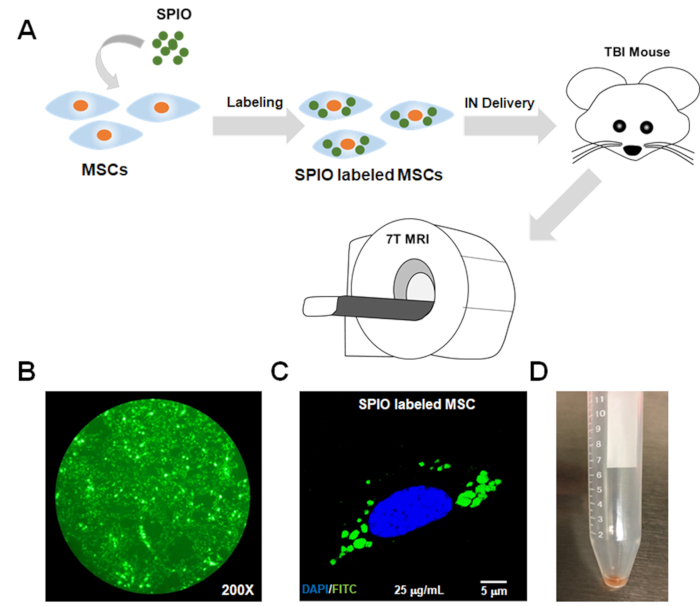
Abbildung 1: Schematisches Flussdiagramm des Protokolls und In-vitro-Bestätigung der SPIO-Aufnahme durch MSCs. (A) MSCs wurden mit SPIO für 24 h zur Kennzeichnung inkubiert. Anschließend wurden die beschrifteten MSCs über eine intranasale (IN) Route in ein TBI-Mausmodell geliefert. Die MRT zu verschiedenen Zeitpunkten wurde durchgeführt, um die beschrifteten MSCs zu verfolgen. Die Bestätigung einer ausreichenden Kennzeichnung von MSCs durch SPIO wurde durch (B) Fluoreszenzmikroskopie und (C) konfokale Mikroskopie mit dem FITC-Kanal erreicht, da SPIO-Nanopartikel mit FITC markiert wurden. (D) Das Zellpellet der beschrifteten MSCs erschien aufgrund der Eisenbelastung dunkel. FITC = Fluorescein isothiocyanat; SPIO = superparamagnetische Partikel von Eisenoxid; MSCs = mesenchymale Stammzellen; MRT = Magnetresonanztomographie; IN = intranasal; TBI = traumatische Hirnverletzung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Echtzeit-MRT ermöglicht die Erkennung und Verfolgung von SPIO-markierter MSC-Migration zu Verletzungsstellen im Gehirn von TBI-induzierten Mäusen. (A) Mäuse wurden TBI unterzogen, gefolgt von einer Behandlung mit PBS- oder SPIO-gekennzeichneten MSCs, die über einen intranasalen Weg 24 h nach einer Verletzung verabreicht wurden. Koronale Abschnitte von T2*-gewichteten Bildern zeigten die beschrifteten MSCs als hypointense Bereich (Pfeilspitze) am Rand der Verletzungsstelle (umrissener Bereich) bei 1, 7 und 14 Tagen nach der Lieferung. Die PBS-behandelten Mäuse zeigen keinen hypointenseBereich. (B) Segmentierungsprozess des Verletzungsplatzbereichs (grün) und beschrifteter MSCs (rot) basierend auf koronaren T2*-MRT-Bildern. (C) 3D-Rekonstruktion der Maus-Hirn-Behandlung auf Basis von T2*-gewichteten Bildern, die die Bioverteilung von SPIO-markierten MSCs im Gehirn 14 Tage nach der Lieferung veranschaulichen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Die histologische Analyse bestätigt das Vorhandensein von SPIO-markierten MSCs im Gehirn der behandelten Tiere. Preußische blaue Färbung von Hirnabschnitten einer (A) Maus, die mit PBS (Steuerung) und (C) Maus behandelt wurde, die mit SPIO-markierten MSCs behandelt wurden. SPIO-positive Zellen wurden in MSC-behandelter Maus (Boxzellen, blau) nachgewiesen, während die Steuermaus nach 14 Tagen nach der Lieferung keine positiven Zellen an der Verletzungsstelle im Kortex zeigte, was MRT-Beobachtungen bestätigte. Die Fluoreszenzmikroskopie-Analyse des Kortex einer ( B ) mit PBS behandelten (B) Und (D) Maus, die mit SPIO-markierten MSCs behandelt wurde, wurde 14 Tage nach der Lieferung durchgeführt. Die Analyse ergab das Vorhandensein von FITC-markierten SPIO-positiven Zellen (boxed cells, green) am verletzten Kortex in der MSC-behandelten Maus, aber es wurden keine FITC-Signale im Kortex der PBS-behandelten Maus beobachtet. Skalenstäbe = 50 m, sofern nicht anders angegeben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Das hier beschriebene Protokoll stellt allgemeine Verfahren für die SPIO-Kennzeichnung von MSCs und die MRT-Verfolgung von SPIO-markierten MSCs nach der intranasalen Lieferung dar. Das Protokoll bietet die Möglichkeit, die Migration und Bioverteilung von MSCs nach der Geburt in vivo im Gehirn mit einer nicht-invasiven Methode zu untersuchen.
MSCs sind attraktive Kandidaten für Stammzell-basierte Therapien für ZNS-Störungen und Verletzungen aufgrund ihrer Fähigkeit, trophische Faktoren zu sezernieren, die 1) neurorestorative Prozesse auslösen und 2) neuronprodizidenrischen Schutz bieten, aufgrund ihrer entzündungshemmenden Wirkung im Verletzungsbereich9,10,11,12. Obwohl die Langzeit-MRT-Verfolgung und der Nachweis von SPIO-markierten MSCs aufgrund der Verdünnung des interzellulären SPIO mit Zellteilung eingeschränkt sein kann, können markierte Zellen bis zu mehreren Wochen nach der Transplantation im Gehirn von Tiermodellen nachgewiesen werden13.
Ebenfalls hier beschrieben ist das Etikettierungsprotokoll von MSCs mit SPIO-Nanopartikeln, die ohne Transfektionsmittel mit Dextran beschichtet sind. Andere Protokolle wurden in der Literatur verwendet14,15,16. In allen Fällen sollten diese Protokolle jedoch an Zelltyp, SPIO-Größe, Inkubationszeit und SPIO-Konzentration angepasst werden. MSCs haben gezeigt, dass sie das chondrogene Differenzierungspotenzial beeinträchtigt haben, aber keine adipogene Differenzierung bei der SPIO-Kennzeichnung17. Daher wird dringend empfohlen, Differenzierungstests vor der Stammzellabgabe durchzuführen, um den Einfluss von SPIO auf die Differenzierungswirksamkeit von Stammzellen zu bewerten. In einer früheren Studie wurde gezeigt, dass die MSC-Kennzeichnung mit demselben SPIO-Typ und der gleichen Konzentration, die hier verwendet wird, die osteogene oder adipogene Differenzierungswirksamkeit von MSCs6nicht beeinflusst.
Der intranasale Weg der therapeutischen Stammzellabgabe bei Hirnerkrankungen und Verletzungen ist ein vielversprechender Ansatz für die klinische Anwendung von Stammzellen. Die intrinsischen und molekularen Mechanismen, die das Verhalten von Stammzellen in der Nasenhöhle diktieren, bleiben jedoch unklar. Obwohl der intranasale Weg für die Lieferung kleiner Moleküle weit erforscht ist, unterscheiden sich die Größe und das Bioverteilungsverhalten des therapeutischen Stammes von kleinen Molekülen. Das aktuelle Protokoll zeigt, dass MSCs nach der tranasalen Bereitstellung tendenziell in Richtung der Verletzungsstelle migrieren.
Hier wurden T2*-gewichtete Bilder verwendet, um die SPIO-beschrifteten MSCs zu verfolgen. Andere Berichte haben Gradienten-Echo-Bildgebung verwendet. Jedoch, Anfälligkeit Artefakte werden oft in Gradient Echo Bildgebung durch interzelluläre SPIO beobachtet. Im aktuellen Protokoll war die Position der hypointense Bereiche, die die SPIO-markierten MSCs auf T2*-gewichteten Bildern darstellten, die gleiche wie die Position des SPIO in Hirnabschnitten, wie sie durch histologische Untersuchung festgestellt wurden (Abbildung 3). Dies zeigt die ausreichende Empfindlichkeit der T2*-gewichteten Spin-Echo-Bildgebung für SPIO-markiertem MSC-Tracking im Gehirn an.
Zusammenfassend lässt sich sagen, dass das beschriebene Protokoll für in vivo-Stammzellverfolgungsstudien zu Hirnverletzungen und -störungen von Vorteil ist. Die Längsspuren von Stammzellen in vivo wurden traditionell durchgeführt, indem Tiere an mehreren Zeitpunkten geopfert wurden. Das aktuelle Protokoll bietet einen nicht-invasiven und effizienten Ansatz für die Bereitstellung und Verfolgung von MSCs, der ein mögliches Verfahren für die Stammzelltherapie bei Hirnverletzungen und Störungen im klinischen Umfeld darstellt.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Diese Arbeit wurde vom Ministerium für Wissenschaft und Technologie, Taiwan (MOST 104-2923-B-038-004 -MY2, MOST 107-2314-B-038-063, und MOST 107-2314-B-038-042) und Taipeh Medical University (TMU 105-AE1-B03, TMU 106-5400-004-400MU, TMU 106-5310-001-400, DP2-107-21121-01-N-05 und DP2-108-21121-01-N-05-01).
Materialien
| Name | Company | Catalog Number | Comments |
| Cell culture supplies (Plastics) | ThermoFisher Scientific | Varies | Replaceable with any source |
| Disposable Microtome Blade | VWR | 95057-832 | |
| D-MEM/F-12 (1X) with GlutaMAX | GIBCO | 10565-018 | |
| Embedding medium for frozen tissue specimens (O. C. T.) | Sakura Finetek | 4583 | |
| Fetal Bovine Serum (FBS) | GIBCO | 12662-029 | |
| Fluorescence Wild Field Microscope | Olympus | Olympus BX43 | |
| Forcept | Fine Science Tools | 11293-00 | Surgery |
| Gentamicin (10 mg/mL) | GIBCO | 15710-064 | |
| Hair clipper | Pet Club | PC-400 | |
| Head Trauma Contusion device | Precision Systems and Instrumentation | Model TBI-0310 | |
| Hyaluronidase from bovine testes | MilliporeSigma | H3506 | |
| ITK-SNAP Software | Penn Image Computing and Science Laboratory (PICSL) at the University of Pennsylvania, and the Scientific Computing and Imaging Institute (SCI) at University of Utah | ITK-SNAP 3.8.0 | |
| Ketamine (Ketavet) | Pfizer | 778-551 | |
| Mice | National Laboratory Animal Center, Taiwan | C57BL6 | Wild type mice strain used in the study |
| Microdrill | Nakanishi | NE50 | Combine with Burrs for generating the bone window |
| Microtome | Leica | RM2265 | |
| Mouse (C57BL/6) Mesenchymal Stem Cells | GIBCO | S1502-100 | |
| MRI scanner | Bruker Biospec | ||
| Phosphate Buffer Saline (PBS) | Corning Cellgro/ThermoFisher | 21-031-CV | |
| Povidone-iodine 7.5% | Purdue product L.P. | Surgical scrub | |
| Prussian Blue Stain | Abcam | ab150674 | |
| Scissor | Fine Science Tools | 14084-08 | Surgery |
| Stereotaxic frame | Kopf Instruments | Model 900 | |
| Superparamagnetic iron oxide (SPIO) nanoparticles | BioPAL | Molday ION EverGreen, CL-50Q02-6A-51 | stem cells labeling for in vivo tracking using MRI |
| Suture monofilament | Ethicon | G697 | Suture |
| Timer | Wisewind | Replaceable with any source | |
| TrypLE | GIBCO | 12604-013 | |
| Xylazine (Rompun) | Bayer | QN05 cm92 |
Referenzen
- Pelled, G., et al. Smad8/BMP2-engineered mesenchymal stem cells induce accelerated recovery of the biomechanical properties of the Achilles tendon. Journal of Orthopedic Research. 30 (12), 1932-1939 (2012).
- Shahror, R. A., et al. Transplantation of Mesenchymal Stem Cells Overexpressing Fibroblast Growth Factor 21 Facilitates Cognitive Recovery and Enhances Neurogenesis in a Mouse Model of Traumatic Brain Injury. Journal of Neurotrauma. , (2019).
- Danielyan, L., et al. Intranasal delivery of cells to the brain. European Journal of Cell Biology. 88 (6), 315-324 (2009).
- Karussis, D., et al. Safety and immunological effects of mesenchymal stem cell transplantation in patients with multiple sclerosis and amyotrophic lateral sclerosis. Archives in Neurology. 67 (10), 1187-1194 (2010).
- Danielyan, L., et al. Intranasal delivery of bone marrow-derived mesenchymal stem cells, macrophages, and microglia to the brain in mouse models of Alzheimer's and Parkinson's disease. Cell Transplant. 23, 123-139 (2014).
- Shahror, R. A., Ali, A. A. A., Wu, C. C., Chiang, Y. H., Chen, K. Y. Enhanced Homing of Mesenchymal Stem Cells Overexpressing Fibroblast Growth Factor 21 to Injury Site in a Mouse Model of Traumatic Brain Injury. International Journal of Molecular Science. 20 (11), (2019).
- Yushkevich, P. A., et al. User-guided 3D active contour segmentation of anatomical structures: significantly improved efficiency and reliability. Neuroimage. 31 (3), 1116-1128 (2006).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Li, Y., Chopp, M. Marrow stromal cell transplantation in stroke and traumatic brain injury. Neuroscience Letters. 456 (3), 120-123 (2009).
- Aertker, B. M., Bedi, S., Cox, C. S. Strategies for CNS repair following TBI. Experimental Neurology. 275, 411-426 (2016).
- Ohtaki, H., et al. Stem/progenitor cells from bone marrow decrease neuronal death in global ischemia by modulation of inflammatory/immune responses. Proceedings of the National Academy of Sciences of the United States of America. 105 (38), 14638-14643 (2008).
- Mahmood, A., Lu, D., Chopp, M. Intravenous administration of marrow stromal cells (MSCs) increases the expression of growth factors in rat brain after traumatic brain injury. Journal of Neurotrauma. 21 (1), 33-39 (2004).
- Hoehn, M., et al. Monitoring of implanted stem cell migration in vivo: a highly resolved in vivo magnetic resonance imaging investigation of experimental stroke in rat. Proceedings of the National Academy of Sciences of the United States of America. 99 (25), 16267-16272 (2002).
- Reddy, A. M., et al. In vivo tracking of mesenchymal stem cells labeled with a novel chitosan-coated superparamagnetic iron oxide nanoparticles using 3.0T MRI. Journal of Korean Medical Science. 25 (2), 211-219 (2010).
- Roeder, E., et al. Dose-response of superparamagnetic iron oxide labeling on mesenchymal stem cells chondrogenic differentiation: a multi-scale in vitro study. PLoS ONE. 9 (5), e98451 (2014).
- Schafer, R., et al. Labeling of human mesenchymal stromal cells with superparamagnetic iron oxide leads to a decrease in migration capacity and colony formation ability. Cytotherapy. 11 (1), 68-78 (2009).
- Kostura, L., Kraitchman, D. L., Mackay, A. M., Pittenger, M. F., Bulte, J. W. Feridex labeling of mesenchymal stem cells inhibits chondrogenesis but not adipogenesis or osteogenesis. NMR in Biomedicine. 17 (7), 513-517 (2004).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten