Method Article
Отслеживание суперпарамагнитного оксида железа помечены мезенхимальных стволовых клеток с использованием МРТ после интраназальной доставки в травматической модели травмы головного мозга Murine
В этой статье
Резюме
Представлен протокол для неинвазивных мезенхимальных стволовых клеток (MSC) доставки и отслеживания в мышиной модели черепно-мозговой травмы. Суперпарамагнитные наночастицы оксида железа используются в качестве магнитно-резонансной томографии (МРТ) зонда для маркировки MSC и неинвазивного отслеживания in vivo после интраназальной доставки с использованием МРТ в реальном времени.
Аннотация
Стволовые клетки на основе терапии для черепно-мозговых травм, таких как черепно-мозговая травма (TBI), являются перспективным подходом для клинических испытаний. Тем не менее, технические препятствия, такие как инвазивные поставки клеток и отслеживание с низкой эффективностью трансплантации остаются проблемами в трансляционной терапии на основе стволовых клеток. В этой статье описывается новый метод маркировки стволовых клеток и отслеживания на основе маркировки мезенхимальных стволовых клеток (MSC) с суперпарамагнитными оксидом железа (SPIO) наночастиц, а также интраназальной доставки помечены MSCs. Эти наночастицы флуоресцеина изотиоцианата (FITC) встроенных и безопасно маркировать MSCs, которые впоследствии поставляются в мозг TBI-индуцированных мышей интраназального маршрута. Затем они отслеживаются неинвазивно in vivo с помощью магнитно-резонансной томографии (МРТ) в режиме реального времени. Важные преимущества этого метода, который сочетает в себе SPIO для маркировки клеток и интраназальные поставки включают (1) неинвазивные, in vivo MSC отслеживания после доставки в течение длительных периодов отслеживания, (2) возможность нескольких схем дозирования из-за неинвазивных маршрут доставки MSC, и (3) возможные применения к людям, в связи с безопасностью SPIO, неинвазивный характер метода отслеживания клеток МРТ, и маршрут управления.
Введение
Мезенхимальные стволовые клетки (MSC) являются привлекательными кандидатами для лечения стволовых клеток в лечении расстройств и травм центральной нервной системы (ЦНС) у людей. Кроме того, MSCs были использованы в качестве средства для доставки терапевтических белков в местахтравмы 1,2. В последние годы, перспективные инновации были разработаны для создания 1) новые маршруты доставки клеток и 2) клеток отслеживания стволовых клеток на основе терапии заболеваний ЦНС. Интраназальное доставка стволовых клеток в мозг зависит от способности клеток обходить крибриформную пластину и входить в обонятельную луковицу частично через паранхимальный маршрут3. Сочетание интраназальной доставки и маркировки MSCs с суперпарамагнитных оксида железа (SPIO) наночастиц представляет собой перспективный подход для клинического применения MSCs в лечении расстройств ЦНС, так как SPIO наночастицы являются безопасными зондами для магнитно-резонансной томографии (МРТ) и позволяют неинвазивного чувствительного продольного отслеживания MSCs после доставки МРТ3,5. Кроме того, интраназальные поставки является безопасным и неинвазивным маршрутом, который позволяет повторное введение в течение короткого периода времени.
В этой статье описывается очень чувствительный и неинвазивный метод для отслеживания MSCs in vivo пост-интраназальный доставки в мышиной модели черепно-мозговой травмы (TBI), которая использует SPIO помечены клетки и МРТ. Одним из важных преимуществ маркировки SPIO является чувствительное обнаружение СПИО в тканях с помощью МРТ, что позволяет эффективно и неинвазивно отслеживать клетки. Наночастицы SPIO, используемые здесь, доступны на коммерческой форме и помечены флюорозным изотиоцианатом (FITC) фторофором, который позволяет обнаруживать СПИО в тканях без иммуномаркировки или дополнительной обработки. Кроме того, можно выполнять продольные отслеживания в режиме реального времени и исследовать биораспределение доставленных МСК.
протокол
Все процедуры, связанные с животными в этом протоколе, были одобрены Институциональным комитетом по уходу за животными и использованию с одобрения Комитета по этике по использованию животных в Медицинском университете Тайбэя (утверждение нет. ЛАК-2018-0574; 15.03.2019).
1. Маркировка МСК с помощью наночастиц SPIO
- Чтобы пометить MSCs с SPIO, добавьте 6 мл маркировки носителей (25 мкг/мл SPIO в модифицированной среде Eagle Dulbecco «DMEM» без сыворотки крупного рогатого скота (FBS) в колбу T75, содержащую MSC (80% сближания).
-
Инкубировать клетки с маркировки средств в CO2 инкубатор (37 КК, 5% CO2) без тряски. После 24 ч аккуратно удалите носитель маркировки с помощью стерильной пифетки Pasteur с пластиковым наконечником, прикрепленным к вакууму. Вымойте клетки монослой 2x с 6 мл фосфатбуферного солей (PBS), чтобы удалить любые следы неинтернированных SPIO.
- Чтобы определить, были ли клетки успешно помечены, проверьте помеченные клетки под флуоресцентным микроскопом или конфокальный микроскоп, если SPIO помечены флюорофором (т.е., как те, которые используются здесь; Рисунок 1B, C). Кроме того, выполнить прусское синее окрашивание для клеток (см. шаги 6.2-6.4 для протокола окрашивания).
- Урожай адептов клеток путем лечения с 3 мл трипсина и инкубировать при 37 градусов по Цельсию. После 5 мин инкубации добавьте 7 мл предварительно разогретых DMEM-носителей с 10% FBS (v/v), чтобы инактивировать трипсин. Соберите подвеску ячейки с помощью пипетки в коническую трубку 15 мл.
- Центрифугия клеточной подвески на 300 х г в течение 5 мин. Отбросьте супернатант и resuspend клеточной гранулы в PBS. Подсчитайте жизнеспособные клетки с помощью трипан синий краситель и гемоситометр.
ПРИМЕЧАНИЕ: Клеточные гранулы помеченных клеток будут отображаться как темный цвет из-за нагрузки железа(рисунок 1D). Этот протокол актуален для маркировки MSC и МРТ-изображения. Процедура маркировки MSC6 была ранее оптимизирована, и только шаги по подготовке помеченных MSC для отслеживания in vivo включены здесь, так как отслеживание in vivo находится в центре внимания. Протокол для культивирования и маркировки других типов клеток должен быть оптимизирован исследователем. - Отрегулируйте концентрацию клеток с помощью PBS до 150 000 клеток (или числа, которое приводит к достаточному сигналу МРТ) в 18 Л Л PbS (или общий объем, который будет использоваться в процедуре интраназалальной доставки).
ПРИМЕЧАНИЕ: Было замечено, что концентрация клеток выше 150 000 клеток/18 Л ПБС приводит к агрегации клеток, что может повлиять на эффективность интраназального рода. Если для интраназалальной доставки требуется большее количество клеток, увеличьте общий объем клеточной суспензии и увеличьте количество интраназаальных администраций, так как интраназальное введение является неинвазивной процедурой, и возможно многократное дозирование.
2. Травма контролируемого кортикового воздействия (CCI)
ПРИМЕЧАНИЕ: В этом протоколе, мужчины C57 BL/6 мышей (7-8 недель) были сохранены в 12/12 ч свет / темный цикл с объявлением libitum доступ к пище и воде.
- Чтобы подготовить каждую мышь к травме CcI, вводят золазепам (50 мг/кг) и ксилазин (20 мг/кг) анестезирующий коктейль через интраперитонеальную (т.п.) инъекцию (1 мл/кг). Убедитесь, что глубина анестезии достаточна из-за отсутствия ответа на нос. Кроме того, поместите мышь в камеру поставляется с 2%-4% изолюран для 60с.
- Бритье меха сонной поверхности черепа между ушами с помощью электронного клипера для волос. Очистите бритую область несколько раз, используя стерильный ватный тампон, пропитанный йодом. Используйте ватный тампон, пропитанный 70% этанола, чтобы очистить йод.
- Поместите обезожденную мышь в стереотаксическую рамку и закрепите мышь с помощью ушных брусков и носовых брусьев. Сделайте разрез среднего (примерно 2,5 см) в бритой коже с помощью стерильных ножниц для доступа к поверхности черепа.
- Удалите ткань на кости с помощью ватной палочки, чтобы разоблачить череп. Очистите поверхность черепа с помощью ватного тампона, пропитанного 3% H2O2 на 10 с, а затем очистить его с сухой ватным тампоном.
ПРИМЕЧАНИЕ: Швы черепа и брегма и лямбда теперь могут быть легко идентифицированы. - Определите координаты выбора на поверхности черепа для повреждения CCI и нарисуйте круг (диаметр 4 мм) вокруг координат с помощью карандаша или правильного маркера.
ПРИМЕЧАНИЕ: В этом протоколе координаты при антеропостериоре (AP) -2,0 мм и посредственейке (ML) -1,5 мм использовались для индукции ТПП. - Используйте микродриль и круглую заусенцу (диаметр омицировать 0,5 мм), чтобы разбавить череп на отмеченном круге. Избегайте применения давления во время бурения, так как бурение через кость может привести к повреждению мозга паренхимы. Очистите костную пыль с помощью чистого и сухого ватного тампона.
- Аккуратно удалите костной лоскут с помощью стерильных тонких щипц, чтобы разоблачить dura mater, сохраняя при этом его нетронутым. Удалите мышь из стереотаксической рамы, которая использовалась для подготовки к травмам, и поместите ее в стереотаксическую раму устройства CCI.
- Стабилизировать голову мыши с помощью ушных прутьев и носовых брусьев. Убедитесь, что головка мыши находится на уровне в ростально-каудальном направлении и при необходимости отрегулируйте носовой решетки.
- Следуйте инструкциям на поле управления к нулю наконечник удара к открытой корковой поверхности. Убедитесь, что наконечник удара выровнен непосредственно над желаемыми координатами коры головного мозга, чтобы быть затронуты с помощью X и Y управления колесами на базе ударного.
- Установите параметры эксперимента с помощью коробки управления со скоростью 5 м/с, временем пребывания 250 мс и глубиной травмы 1 мм, чтобы вызвать легкую травму мыши.
- Вызвать травму, нажав кнопку ''удар' на коробке управления. Swab любое кровотечение, которое происходит с помощью стерильного ватного тампона.
- Удалите мышь из стереотаксической рамы и закройте разрез с помощью шелковых хирургических швов. Не используйте металлические зажимы, чтобы закрыть хирургическое место, так как мышь будет подвергаться магнитному полю для МРТ.
- Применение актуальных антибиотиков (бацитрацин неомицин) в хирургическом месте для предотвращения инфекций. Держите мышь на грелке и внимательно следите за ней во время фазы восстановления.
- Администрирование кетопрофена (2,5 мг/кг, ИС) ежедневно в течение 3 дней после операции, если администрация кетопрофена не противоречит целям исследования.
3. Интраназальное доставка
- На 1 день после CCI индукции, вводят золазепам (50 мг/кг) и ксилазин (20 мг/кг) анестезирующий коктейль через i.p. инъекции. Убедитесь, что мышь глубоко обезглавлена из-за отсутствия ответа на нос...
-
Подготовка мыши для интраназалальной доставки MSCs с помощью лечения гиалуронидаза.
- Возьмите потертости мыши и повернуть на спину твердо, обездвижив череп. Поместите кончик пипетки, содержащей гиалуронидазу в стерильной PBS (4 U/l) вблизи ноздри мыши под углом 45 градусов.
- В каждой ноздре вводят 3 ЗЛ гиалуронидаза. Держите мышь обездвиженной и лицом вверх на чистую площадку в течение 5 мин. Повторите гиалуронидазу лечения 4x (всего 100 U hyaluronidase подвески).
- После лечения гиалуронидазой держите обработанную мышь на чистой площадке, обращенной вверх в течение 30 мин.
- Чтобы доставить MSCs в мозг, держите мышь твердо, как описано в шаге 3.2.1. Администрирование 3 Л/ноздря подвески MSC с интервалом 3 с. Держите мышь в том же положении в течение 30 с, пока образец капель полностью исчезли.
ПРИМЕЧАНИЕ: Избегайте образования пузырьков воздуха во время введения. - Повторите администрирование с интервалом 2 мин до 3x.
ПРИМЕЧАНИЕ: Общее количество клеток, которые будут доставлены составляет 150000, таким образом, что 18 л клеточной подвески могут быть доставлены в дозировке 3 зл для каждой ноздри, 3x каждый. - Верните мышь в клетку и внимательно следите за ней, пока она полностью не восстановится от наркоза.
4. В Vivo магнитно-резонансная томография
ПРИМЕЧАНИЕ: Гистологическое окрашивание тканей головного мозга ранее использовалось для подтверждения успешной доставки стволовых клеток после интраназального введения. Однако этот метод может быть использован только в качестве конечной точки исследования, а не продольно. Использование МРТ зондов для обозначения терапевтических стволовых клеток позволит продольно, неинвазивным, in vivo отслеживания клеток с помощью МРТ. Важно отметить, что этот протокол эффективно сокращает количество животных, необходимых. В этом протоколе МРТ было проведено в дни 1, 7 и 14 после доставки МСК.
- Чтобы подготовить мышь для МРТ сканирования, анестезируйте мышь изофлураном (5% изофлуран в 1 л/мин O2 для индукции, 1,5%-2% изофлуран для обслуживания). Выполните щепотку ног, чтобы убедиться, что мышь достигает необходимого уровня анестезии.
- Поместите мышь на держатель изображения и закрепите его положение с помощью кранов или любого другого надлежащего метода. Переместите держатель в центр катушки МРТ (7 Т/40 см магнита) и подключите контрольное соединение.
- Чтобы приобрести T2'взвешенное сканирование с помощью последовательности спин-эхо, установите время повторения (TR) до 1500 мс и время эхо (TE) до 2,8 мс.
- Используйте поле зрения 16 мм x 16 мм (FOV), матрицу приобретения 128 x 128 (MTX) и толщину ломтиков 0,75 х 0,8 мм2 с четырьмя средними сигналами и углом обзора 90 градусов (FA).
- Уречку держателя мыши из центра катушки МРТ после завершения сканирования. Верните мышь в клетку и внимательно следите за ней, пока она полностью не восстановится от наркоза.
-
Для отслеживания и количественной оценки помеченных MSC на изображениях, взвешенных по T2, используйте программное обеспечение ITK-SNAP (версия 3.8.0)7.
- Передача необработанных данных МРТ с компьютера аппарата МРТ на компьютер, используемый для анализа в формате DICOM (цифровая визуализация и связь в медицине).
- Запустите программное обеспечение ITK-SNAP и загрузите МРТ-изображения, нажав на кнопку Файл. Затем нажмите на Open Main Image в меню. Нажмите на кнопку "Открытое изображение" в окне дисплея, а затем найдите и откройте мРТ-изображения с помощью кнопки "Просмотр".
ПРИМЕЧАНИЕ: Визуализация помеченных клеток на МРТ-изображениях будет отображаться как гипоинтенсивные области. Если контраст изображения нуждается в корректировке, выберите Инструменты Контраст изображения. - Создавайте сегментации гипоинтенсивных областей и поражений или других частей мозга, выбирая Active Label в разделе сегментационных меток. Используйте различные цвета меток для разных сегментов (если требуется сегментация более чем одной детали).
- Используйте инструмент Polygon в главной панели инструментов, чтобы нарисовать вокруг гипоинтенсивных областей, представляющих MSCs с маркировкой SPIO. Выберите Принять, расположенный под мРТ-изображением. Сегментированные области будут отображаться как тот же цвет активной метки, назначенной данному сегменту. Повторите этот шаг сегментации для всех срезов МРТ.
- Разработайте 3D-карту сегментированных областей, чтобы представлять распределение MSC во всем мозге, выбрав инструмент Scalpel в нижней части панели инструментов 3D,расположенную в разделе Сегментация этикетки в нижней части инструментария TheITK-SNAP. Затем нажмите Accept в нижней части созданной 3D-карты.
- Для выполнения количественного анализа (средний объем и интенсивность) сегментированных гипоинтенсивных областей, представляющих помеченные клетки, нажмите кнопку сегментации в верхней панели и выберите Том и Статистику.
5. Фиксация мозга мыши и криосекция
-
Чтобы исправить мозг мыши, выполнить транскардионную перфузию с 4% параформальдегида (PFA) после последнего МРТ, как ранее описано8.
- Обезглавить голову и извлечь мозг8. Исправить мозг с 4% ПФА, по крайней мере 48 ч при 4 c.
- Обезвоживать мозг, погружая его в 30% раствор сахарозы при 4 градусах Цельсия, пока мозг не опустится до нижней части раствора.
- Встраивай мозг в оптимальный температурный раствор (OCT) и заморозить при температуре -20 градусов. Раздел мозга с криостат микротом на ломтики с толщиной 14 мкм и смонтировать их на слайды. Храните разделы слайдов при -20 градусах цельсия до дальнейшего использования.
6. Прусское голубое окрашивание
ПРИМЕЧАНИЕ: Прусское синее окрашивание обычно используется для обнаружения содержания железа в клетках с маркировкой SPIO. Здесь прусское синее окрашивание используется для подтверждения того, что гипоинтенсивные сигналы на изображениях МРТ соответствуют MSC с маркировкой SPIO, а не артефактам. Прусское синее окрашивание является одним из наиболее чувствительных гистохимических методов, используемых для обнаружения железа в тканях и может быть использован для выявления даже одного гранулы железа в клетках.
- Вымойте слайды секций мозга дистиллированной водой в течение 5 мин.
- Выполните прусское синее окрашивание, погружая горки в течение 30 минут в раствор окрашивания, который содержит равные части соляной кислоты (10%) и ферроцианид калия (10%) подготовлен непосредственно перед использованием.
- Вымойте 3x дистиллированной водой, по 5 мин каждый. Противопокой разделы с ядерным быстро красным в течение 5 мин. Промыть горки 2x с дистиллированной водой.
- Обезвоживать секции постепенно, погружая горки в 95% и 100% алкоголь в течение 2 мин каждый. Добавьте coverslip с resinous монтируя цином.
- Используйте легкий микроскоп для обнаружения окрашенных клеток в секциях мозга.
ПРИМЕЧАНИЕ: Утюг в маркированных клетках будет отображаться как отложения синего цвета.
Результаты
Двадцать четыре часа после интраназального доставки, SPIO помечены MSCs были обнаружены в качестве сильных гипоинтенсивных областях медиального к повреждению корковой на T2 "взвешенных изображений (Рисунок 2B), с указанием целевой миграции SPIO к травме сайта. Эта миграция оставалась видимой до 14 дней после доставки, так как гипоинтенсивные сигналы были обнаружены без значительного сокращения за этот период времени(рисунок 2B). Пострадавшие животные, обработанные PBS показали не гипоинтенсивные области, указывая, что наблюдаемые гипоинтенсивные области соответствуют SPIO помечены MSCs и не сигнал артефактов (Рисунок 2A) Биораспределение помечены MSCs, которые наблюдались в vivo с МРТ был визуализирован с помощью 3D реконструкции (Рисунок 2C,D). Миграция MSCs к поврежденной коре была подтверждена гистологически прусский синий окрашивания и FITC канал обнаружения FITC помечены SPIO в помечены MSCs (Рисунок 3A,B).
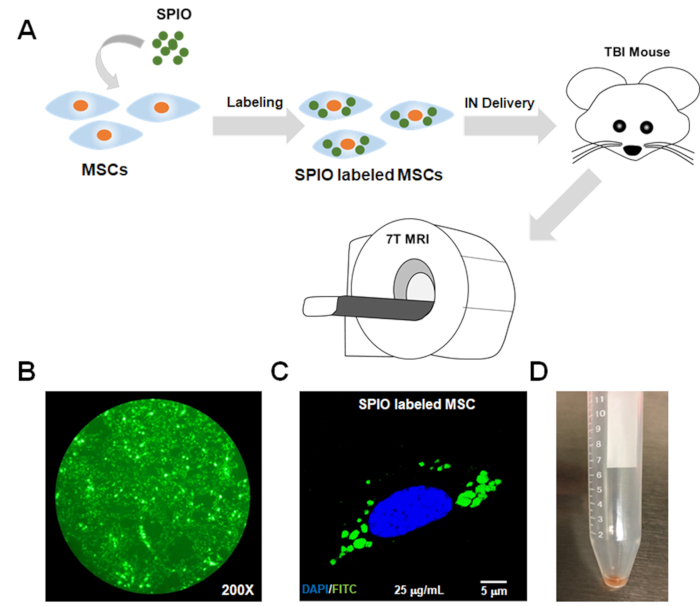
Рисунок 1: Схематическая flowchart протокола и в пробирке подтверждение поглощения SPIO MSCs. (A) MSCs были инкубированы с SPIO для 24 h для маркировки. Затем помеченные MSC были доставлены в модель мыши TBI по внутриназаливому (IN) маршруту. МРТ в разных временных точках было выполнено для отслеживания помеченных MSCs. Подтверждение достаточной маркировки MSCs SPIO было достигнуто путем (B) флуоресценции микроскопии и (C) конфокальной микроскопии с использованием канала FITC, так как наночастицы SPIO были помечены FITC. (D) Клеточные гранулы помеченных MSCs появились темного цвета из-за нагрузки железа. FITC - флуоресцеин изотиоцианат; СПИО - суперпарамагнитные частицы оксида железа; MSCs - мезенхимальные стволовые клетки; МРТ - магнитно-резонансная томография; ИН - интраназальное; ТБИ и черепно-мозговая травма. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 2: МРТ в режиме реального времени позволяет обнаруживать и отслеживать миграцию MSC с маркировкой SPIO в сторону мест травм в мозге мышей, индуцированных ТБИ. (A) Мыши были подвергнуты TBI, а затем лечение с PBS или SPIO помечены MSCs, вводят через интраназальный маршрут 24 ч после травмы. Корональные разделы T2 'взвешенных изображений показали помечены MSCs как гипоинтенсивной области (стрелка) на краю травмы сайта (очерченная область) на 1, 7 и 14 дней после доставки. У обработанных PBS мышей нет гипоинтенсивной области. (B) Процесс сегментации области участка травмы (зеленый) и помечены MSCs (красный) на основе корональных T2 '-МРТ изображений. (C) 3D реконструкция лечения мозга мыши на основе T2 "взвешенных изображений, иллюстрирующих биораспределение SPIO помечены MSCs в мозге 14 дней после доставки. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3: Гистологический анализ подтверждает наличие МСК с маркировкой SPIO в мозге обработанных животных. Прусское синее окрашивание мозговых секций а (A) мыши, обработанной PBS (контроль) и(C) мышью, обработанной с помощью MSCs с маркировкой SPIO. SPIO-положительные клетки были обнаружены в msC-обработанной мыши (коробочные клетки, синий), в то время как контрольная мышь не показала положительных клеток в месте травмы в коре головного мозга на 14 дней после доставки, подтверждая наблюдения МРТ. Флуоресценция микроскопии анализ коры головной мыши (B) контроль мыши, обработанные PBS и (D) мышь, обработанная SPIO помечены MSCs был проведен 14 дней после доставки. Анализ показал наличие FITC-тегами SPIO-позитивных клеток (коробок клетки, зеленый) на поврежденной коры в MSC-обработанных мыши, но не FITC сигналы не наблюдались в коре головного мозга, обработанной PBS мыши. Шкала баров 50 мкм, если не указано иное. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Описанный здесь протокол представляет общие процедуры маркировки МСЗ и МРТ-отслеживания MSCs с маркировкой SPIO после интраназального рода. Протокол дает возможность изучить миграцию и биораспределение МСК после доставки в виво в головном мозге, используя неинвазивный метод.
MSCs являются привлекательными кандидатами для стволовых клеток на основе терапии для заболеваний ЦНС и травм из-за их способности выделять трофические факторы, которые 1) вызвать нейропресторативные процессы и 2) обеспечить нейропротекционную защиту, в связи с их противовоспалительные эффекты в области травмыобласти 9,10,11,12. Хотя долгосрочное отслеживание МРТ и обнаружение MSC с маркировкой SPIO может быть ограничено из-за разбавления межклеточного SPIO с клеточным делением, помеченные клетки могут быть обнаружены на срок до нескольких недель после трансплантации в мозге животных моделей13.
Также описан протокол маркировки МСК с наночастицами SPIO, покрытыми днекном без трансфекционных агентов. Другие протоколы были использованы в литературе14,15,16. Однако во всех случаях эти протоколы должны быть скорректированы с учетом типа клеток, размера SPIO, времени инкубации и концентрации SPIO. MSCs было показано, что нарушения хондрогенной дифференциации потенциал, но не адипогенной дифференциации на SPIO маркировки17. Поэтому настоятельно рекомендуется проводить дифференциации до родов стволовых клеток для оценки влияния SPIO на потенцию дифференциации стволовых клеток. В предыдущем исследовании было продемонстрировано, что маркировка MSC с тем же типом SPIO и концентрацией, используемой здесь, не влияет на остеогенную или адипогенную дифференциацию потенции МСК6.
Интраназальный путь терапевтической доставки стволовых клеток при нарушениях и травмах головного мозга является перспективным подходом для клинического применения стволовых клеток. Однако, внутренние и молекулярные механизмы, которые диктуют поведение стволовых клеток в полости носа остаются неясными. Хотя интраназальный маршрут широко изучен для доставки малых молекул, размер и биораспределительное поведение терапевтического стебля отличаются от мелких молекул. Текущий протокол показывает, что MSCs, как правило, мигрируют к месту травмы после интраназалальной доставки.
Здесь, T2 'взвешенные изображения были использованы для отслеживания SPIO помечены MSCs. В других отчетах использовалась градиентная эхо-изображение. Тем не менее, артефакты восприимчивости часто наблюдаются в градиентной эхо-изображении из-за межклеточного SPIO. В текущем протоколе расположение гипоинтенсивных областей, представляющих MSC с маркировкой SPIO, на взвешенных изображениях, было таким же, как расположение SPIO в секциях мозга, обнаруженных гистологическим исследованием(рисунок 3). Это указывает на адекватную чувствительность T2'-взвешенный спин эхо изображения для SPIO помечены MSC отслеживания в головном мозге.
Таким образом, описанный протокол полезен для in vivo стволовых клеток отслеживания исследований черепно-мозговых травм и расстройств. Продольное отслеживание стволовых клеток in vivo традиционно осуществляется путем жертвования животными в нескольких временных точках. Текущий протокол обеспечивает неинвазивный и эффективный подход для доставки и отслеживания MSCs, который представляет собой потенциальную процедуру для лечения стволовыми клетками для черепно-мозговых травм и расстройств в клинических условиях.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была поддержана Министерством науки и техники грантов, Тайвань (MOST 104-2923-B-038-004 -MY2, MOST 107-2314-B-038-063 и MOST 107-2314-B-038-042) и Тайбэйский медицинский университет (TMU 105-AE1-B03, ТМУ 106-5400-004-400, ТМУ 106-5310-001-400, DP2-107-21121-01-N-05 и DP2-108-21121-01-N-05-01).
Материалы
| Name | Company | Catalog Number | Comments |
| Cell culture supplies (Plastics) | ThermoFisher Scientific | Varies | Replaceable with any source |
| Disposable Microtome Blade | VWR | 95057-832 | |
| D-MEM/F-12 (1X) with GlutaMAX | GIBCO | 10565-018 | |
| Embedding medium for frozen tissue specimens (O. C. T.) | Sakura Finetek | 4583 | |
| Fetal Bovine Serum (FBS) | GIBCO | 12662-029 | |
| Fluorescence Wild Field Microscope | Olympus | Olympus BX43 | |
| Forcept | Fine Science Tools | 11293-00 | Surgery |
| Gentamicin (10 mg/mL) | GIBCO | 15710-064 | |
| Hair clipper | Pet Club | PC-400 | |
| Head Trauma Contusion device | Precision Systems and Instrumentation | Model TBI-0310 | |
| Hyaluronidase from bovine testes | MilliporeSigma | H3506 | |
| ITK-SNAP Software | Penn Image Computing and Science Laboratory (PICSL) at the University of Pennsylvania, and the Scientific Computing and Imaging Institute (SCI) at University of Utah | ITK-SNAP 3.8.0 | |
| Ketamine (Ketavet) | Pfizer | 778-551 | |
| Mice | National Laboratory Animal Center, Taiwan | C57BL6 | Wild type mice strain used in the study |
| Microdrill | Nakanishi | NE50 | Combine with Burrs for generating the bone window |
| Microtome | Leica | RM2265 | |
| Mouse (C57BL/6) Mesenchymal Stem Cells | GIBCO | S1502-100 | |
| MRI scanner | Bruker Biospec | ||
| Phosphate Buffer Saline (PBS) | Corning Cellgro/ThermoFisher | 21-031-CV | |
| Povidone-iodine 7.5% | Purdue product L.P. | Surgical scrub | |
| Prussian Blue Stain | Abcam | ab150674 | |
| Scissor | Fine Science Tools | 14084-08 | Surgery |
| Stereotaxic frame | Kopf Instruments | Model 900 | |
| Superparamagnetic iron oxide (SPIO) nanoparticles | BioPAL | Molday ION EverGreen, CL-50Q02-6A-51 | stem cells labeling for in vivo tracking using MRI |
| Suture monofilament | Ethicon | G697 | Suture |
| Timer | Wisewind | Replaceable with any source | |
| TrypLE | GIBCO | 12604-013 | |
| Xylazine (Rompun) | Bayer | QN05 cm92 |
Ссылки
- Pelled, G., et al. Smad8/BMP2-engineered mesenchymal stem cells induce accelerated recovery of the biomechanical properties of the Achilles tendon. Journal of Orthopedic Research. 30 (12), 1932-1939 (2012).
- Shahror, R. A., et al. Transplantation of Mesenchymal Stem Cells Overexpressing Fibroblast Growth Factor 21 Facilitates Cognitive Recovery and Enhances Neurogenesis in a Mouse Model of Traumatic Brain Injury. Journal of Neurotrauma. , (2019).
- Danielyan, L., et al. Intranasal delivery of cells to the brain. European Journal of Cell Biology. 88 (6), 315-324 (2009).
- Karussis, D., et al. Safety and immunological effects of mesenchymal stem cell transplantation in patients with multiple sclerosis and amyotrophic lateral sclerosis. Archives in Neurology. 67 (10), 1187-1194 (2010).
- Danielyan, L., et al. Intranasal delivery of bone marrow-derived mesenchymal stem cells, macrophages, and microglia to the brain in mouse models of Alzheimer's and Parkinson's disease. Cell Transplant. 23, 123-139 (2014).
- Shahror, R. A., Ali, A. A. A., Wu, C. C., Chiang, Y. H., Chen, K. Y. Enhanced Homing of Mesenchymal Stem Cells Overexpressing Fibroblast Growth Factor 21 to Injury Site in a Mouse Model of Traumatic Brain Injury. International Journal of Molecular Science. 20 (11), (2019).
- Yushkevich, P. A., et al. User-guided 3D active contour segmentation of anatomical structures: significantly improved efficiency and reliability. Neuroimage. 31 (3), 1116-1128 (2006).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Li, Y., Chopp, M. Marrow stromal cell transplantation in stroke and traumatic brain injury. Neuroscience Letters. 456 (3), 120-123 (2009).
- Aertker, B. M., Bedi, S., Cox, C. S. Strategies for CNS repair following TBI. Experimental Neurology. 275, 411-426 (2016).
- Ohtaki, H., et al. Stem/progenitor cells from bone marrow decrease neuronal death in global ischemia by modulation of inflammatory/immune responses. Proceedings of the National Academy of Sciences of the United States of America. 105 (38), 14638-14643 (2008).
- Mahmood, A., Lu, D., Chopp, M. Intravenous administration of marrow stromal cells (MSCs) increases the expression of growth factors in rat brain after traumatic brain injury. Journal of Neurotrauma. 21 (1), 33-39 (2004).
- Hoehn, M., et al. Monitoring of implanted stem cell migration in vivo: a highly resolved in vivo magnetic resonance imaging investigation of experimental stroke in rat. Proceedings of the National Academy of Sciences of the United States of America. 99 (25), 16267-16272 (2002).
- Reddy, A. M., et al. In vivo tracking of mesenchymal stem cells labeled with a novel chitosan-coated superparamagnetic iron oxide nanoparticles using 3.0T MRI. Journal of Korean Medical Science. 25 (2), 211-219 (2010).
- Roeder, E., et al. Dose-response of superparamagnetic iron oxide labeling on mesenchymal stem cells chondrogenic differentiation: a multi-scale in vitro study. PLoS ONE. 9 (5), e98451 (2014).
- Schafer, R., et al. Labeling of human mesenchymal stromal cells with superparamagnetic iron oxide leads to a decrease in migration capacity and colony formation ability. Cytotherapy. 11 (1), 68-78 (2009).
- Kostura, L., Kraitchman, D. L., Mackay, A. M., Pittenger, M. F., Bulte, J. W. Feridex labeling of mesenchymal stem cells inhibits chondrogenesis but not adipogenesis or osteogenesis. NMR in Biomedicine. 17 (7), 513-517 (2004).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены