Method Article
Rastreamento de células-tronco mesenchymal rotuladas por óxido de ferro superparamagnético usando ressonância magnética após parto intranasal em um modelo de urina de urina de lesão cerebral traumática
Neste Artigo
Resumo
Apresentado aqui é um protocolo para a entrega e o seguimento não invasores da pilha de haste do mesenchymal (MSC) em um modelo do rato de ferimento de cérebro traumático. As nanopartículas superparamagnéticas do óxido de ferro são empregadas como uma ponta de prova da imagem latente da ressonância magnética (MRI) para a rotulagem de MSC e o seguimento in vivo não invasor após a entrega intranasal usando mri em tempo real.
Resumo
Terapias baseadas em células-tronco para lesões cerebrais, como lesão cerebral traumática (TCE), são uma abordagem promissora para ensaios clínicos. No entanto, obstáculos técnicos, como o parto invasivo de células e rastreamento com baixa eficiência de transplante, continuam sendo desafios na terapia translacional baseada em troncos. Este artigo descreve uma técnica emergente para rotulagem e rastreamento de células-tronco com base na rotulagem das células-tronco mesenchymal (MSCs) com nanopartículas de óxido de ferro superparamagnético (SPIO), bem como entrega intranasal dos MSCs rotulados. Essas nanopartículas são isotiocianato fluorescenato (FITC) embutido e seguro para rotular os MSCs, que são posteriormente entregues aos cérebros de camundongos induzidos por TCE pela rota intranasal. Eles são então rastreados in vivo não invasivamente por ressonância magnética em tempo real (RM). As vantagens importantes desta técnica que combina SPIO para rotulagem celular e parto intranasal incluem (1) rastreamento de MSC não invasivo e invivo após a entrega por longos períodos de rastreamento(2) a possibilidade de múltiplos regimes de dosagem devido aos não invasivos rota de entrega de MSC, e (3) possíveis aplicações para seres humanos, devido à segurança do SPIO, natureza não invasiva do método de rastreamento celular por ressonância magnética e via de administração.
Introdução
As células-tronco mesenchymal (MSC) são candidatos atraentes para terapias baseadas em células-tronco em tratamentos de distúrbios e lesões do sistema nervoso central (SNC) em humanos. Além disso, os MSCs têm sido utilizados como veículo para a entrega de proteínas terapêuticas nos locais de lesões1,2. Nos últimos anos, inovações promissoras foram desenvolvidas para estabelecer 1) novas rotas de entrega celular e 2) rastreamento de células para terapias baseadas em células-tronco de distúrbios do SNC. A entrega intranasal de células-tronco no cérebro depende da capacidade das células para contornar a placa cribriforme e entrar no bulbo olfativo parcialmente através de uma rota parenchymal3. A combinação de parto intranasal e a rotulagem de MSCs com nanopartículas de óxido de ferro superparamagnético (SPIO) representa uma abordagem promissora para aplicações clínicas de MSCs no tratamento de distúrbios do SNC, uma vez que as nanopartículas spio são sondas seguras para ressonância magnética (RM) e permitem rastreamento longitudinal sensível não invasivo de MSCs após a entrega por RS,4,5. Além disso, o parto intranasal é uma rota segura e não invasiva que permite a administração repetida dentro de um curto período de tempo.
Este artigo descreve uma técnica altamente sensível e não invasiva para rastrear MSCs na entrega pós-intranasal vivo em um modelo de lesão cerebral traumática (TCE) por camundongos, que emprega células com rótulospidespido e ressonância magnética. Uma vantagem importante da rotulagem spio é a detecção sensível de SPIO em tecido por ressonância magnética, o que torna possível rastrear as células de forma eficiente e não invasiva. As nanopartículas SPIO usadas aqui estão comercialmente disponíveis e marcadas com um fluotiocianato de fluorescena (FITC), que permite a detecção de SPIO em tecido sem imunocoloração ou processamento adicional. Além disso, é possível realizar rastreamento longitudinal em tempo real e investigar a biodistribuição dos MSCs entregues.
Protocolo
Todos os procedimentos envolvendo animais neste protocolo foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais, com a aprovação do Comitê de Ética para uso animal na Universidade Médica de Taipei (aprovação não. LAC-2018-0574; 15.03.2019).
1. Rotulagem de MSCs com nanopartículas SPIO
- Para rotular os MSCs com SPIO, adicione 6 mL de mídia de rotulagem (25 μg/mL do SPIO no meio Eagle modificado de Dulbecco [DMEM] sem soro bovino fetal [FBS]) a um frasco T75 contendo MSCs (80% de confluência).
-
Incubar as células com a mídia de rotulagem em uma incubadora de CO2 (37 °C, 5% CO2)sem tremer. Após 24 h, remova delicadamente os meios de rotulagem usando uma pipeta estéril de Pasteur com uma ponta plástica unida a um vácuo. Lave as células monocamada 2x com 6 mL de sostelo tampão de fosfato (PBS) para remover quaisquer vestígios de SPIO não internalizado.
- Para determinar se as células foram rotuladas com sucesso, verifique as células rotuladas um microscópio fluorescente ou microscópio confocal se o SPIO for marcado com um fluoroffora (ou seja, como os usados aqui; Figura 1B,C). Alternativamente, realizar manchas azuis prussianas para as células (ver passos 6,2-6,4 para o protocolo de coloração).
- Colher células aderentes por tratamento com 3 mL de trippsina e incubar a 37 °C. Após 5 min de incubação, adicione 7 mL de mídia DMEM pré-aquecida com 10% FBS (v/v) para inativar a trippsina. Colete a suspensão celular usando uma pipeta em um tubo cônico de 15 mL.
- Centrífuga a suspensão celular a 300 x g por 5 min. Descarte o supernatant e resuspenda a pelota celular na PBS. Conte as células viáveis usando tinudura azul trippan e um hemocytometer.
Nota: A pelota celular das células rotuladas aparecerá como uma cor escura devido ao carregamento de ferro (Figura 1D). Este protocolo é relevante para rotulagem msc e ressonância magnética. O procedimento para rotulagemmsc 6 foi previamente otimizado, e apenas as etapas para preparar os MSCs rotulados para rastrear in vivo estão incluídos aqui, uma vez que o rastreamento in vivo é o foco. O protocolo para a culturing e a rotulagem de outros tipos da pilha deve ser aperfeiçoado pelo investigador. - Ajuste a concentração celular usando PBS para 150.000 células (ou um número que resulta em um sinal de ressonância magnética suficiente) em 18 μL de PBS (ou o volume total que será usado no procedimento de parto intranasal).
Nota: Notou-se que uma concentração celular superior a 150.000 células/18 μL de PBS leva à agregação celular, o que pode afetar a eficiência do parto intranasal. Se um maior número de células é necessária para o parto intranasal, aumentar o volume total de suspensão celular e aumentar o número de administrações intranasal, como a administração intranasal é um procedimento não invasivo, e dosagem múltipla é possível.
2. Impacto cortical controlado (CCI) Ferimento
Nota: Neste protocolo, camundongos C57 BL/6 masculinos (7-8 semanas de idade) foram mantidos em um ciclo de luz/escuridão de 12/12 h com acesso a ad libitum a alimentos e água.
- Para preparar cada rato para lesão do CCI, administrar o zolazepam (50 mg/kg) e xilazine (20 mg/kg) coquetel anesteso via intraperitoneal (i.p.) injeção (1 mL/kg). Certifique-se de que a profundidade da anestesia é suficiente por falta de resposta toe-pinch. Alternativamente, coloque o mouse em uma câmara fornecida com isoflurane de 2%-4% para 60s.
- Raspe a pele da superfície dorsal do crânio entre as orelhas usando um clipper eletrônico do cabelo. Limpe a área raspada várias vezes usando um cotonete estéril embebido em iodo. Use um cotonete embebido em 70% de etanol para limpar o iodo.
- Coloque o mouse anestesiado no quadro estereotático e proteja o mouse usando barras de ouvido e barras de nariz. Faça uma incisão midsagittal (aproximadamente 2,5 cm) na pele raspada usando tesoura estéril para acessar a superfície do crânio.
- Retire o tecido no osso usando uma almofada de algodão para expor o crânio. Limpe a superfície do crânio usando um cotonete embebido em um 3% H2O2 para 10 s, em seguida, limpá-lo com uma almofada de algodão seco.
Nota: As suturas do crânio e bregma e lambda agora podem ser facilmente identificadas. - Identifique as coordenadas de escolha na superfície do crânio para a lesão do CCI e desenhe um círculo (4 mm de diâmetro) em torno das coordenadas usando um lápis ou marcador adequado.
Nota: Neste protocolo, foram utilizadas as coordenadas no anteeroposterior (AP) -2,0 mm e mediolateral (ML) +1,5 mm para indução do CCI. - Use uma microdrill e rebarba redonda (0,5 mm de diâmetro) para diluir o crânio no círculo marcado. Evite aplicar pressão durante a perfuração, como perfuração através do osso pode causar danos ao parenchyma cérebro. Limpe a poeira óssea usando um cotonete limpo e seco.
- Remova delicadamente a aleta do osso usando fórceps finos estérils para expor o mater do dura ao mantê-lo intato. Retire o mouse do quadro estereotático que foi usado para a preparação pré-lesão e coloque-o no quadro estereotático do dispositivo CCI.
- Estabilizar a cabeça do rato usando as barras de orelha e barras de nariz. Certifique-se de que a cabeça do mouse está nivelada na direção rostral-caudal e ajuste as barras do nariz, se necessário.
- Siga as instruções na caixa de controle para zerar a ponta do impactor à superfície corticana exposta. Certifique-se de que a ponta do impactor está alinhada diretamente acima das coordenadas do córtex desejadas para ser impactada usando as rodas de controle X e Y na base do impactor.
- Defina os parâmetros do experimento usando a caixa de controle com uma velocidade de 5 m/s, tempo de habitar de 250 ms e profundidade de lesão de 1 mm para induzir lesão leve no mouse.
- Induza a lesão pressionando o botão ''impacto' na caixa de controle. Cotonete qualquer sangramento que ocorre usando um cotonete estéril.
- Retire o mouse do quadro estereotático e feche a incisão usando suturas cirúrgicas de seda. Não use clipes de metal para fechar o local cirúrgico, uma vez que o mouse será submetido a um campo magnético para ressonância magnética.
- Aplique antibióticos tópicos (neomimicina bacitracina) para o local cirúrgico para prevenir infecções. Mantenha o mouse na almofada de aquecimento e monitore-o de perto durante a fase de recuperação.
- Administrar cetoprofeno (2,5 mg/kg, IP) diariamente por 3 dias após a cirurgia, a menos que a administração de cetoprofeno contradiga com os objetivos do estudo.
3. Entrega intranasal
- Em 1 dia de indução pós-CCI, administrar o zolazepam (50 mg/kg) e xilazine (20 mg/kg) coquetel anesteso via injeção de i.p. Certifique-se de que o mouse é profundamente anestesiado pela falta de resposta toe-pinch.
-
Prepare o mouse para entrega intranasal de MSCs por tratamento hialuronidase.
- Pegue a nuca do rato e vire as costas com firmeza enquanto imobiliza o crânio. Coloque a ponta de uma pipeta que contém hialuronidase em PBS estéreis (4 U/μL) perto da narina do mouse em um ângulo de 45°.
- Administrar 3 μL de suspensão hialuronidase em cada narina. Mantenha o mouse imobilizado e voltado para cima em uma almofada limpa por 5 min. Repita o tratamento hialuronidase 4x (total de 100 U suspensão hialuronidase).
- Após o tratamento com hialuronidase, mantenha o rato tratado em uma almofada limpa virada para cima por 30 min.
- Para entregar MSCs no cérebro, segure o mouse com firmeza, como descrito no passo 3.2.1. Administrar 3 μL/narina de suspensão msc com um intervalo de 3 s. Continue segurando o mouse na mesma posição por 30 s até que as gotas da amostra tenham desaparecido completamente.
Nota: Evite formar bolhas de ar durante a administração. - Repita a administração com um intervalo de 2 minutos até 3x.
Nota: O número total de células a serem entregues é de 150.000, de modo que 18 μL da suspensão celular pode ser entregue em uma dosagem de 3 μL para cada narina, 3x cada. - Devolva o rato à sua gaiola e monitore-o de perto até que se recupere totalmente da anestesia.
4. Imagem de ressonância magnética in vivo
Nota: A coloração histológica do tecido cerebral já foi usada para confirmar a entrega bem-sucedida de células-tronco após a administração intranasal. No entanto, este método só pode ser usado como um ponto final de um estudo, não longitudinalmente. Usar pontas de prova de MRI para etiquetar pilhas de haste terapêuticas permitirá o seguimento longitudinal, não invasor, in vivo das pilhas usando MRI. É importante ressaltar que este protocolo reduz de forma eficiente o número de animais necessários. Neste protocolo, a varredura de MRI foi executada nos dias 1, 7, e 14 borne-entrega de MSCs.
- Para preparar o mouse para ressonância magnética, anestesie o mouse com isoflurane (5% isoflurano em 1 L/min de O2 para indução, 1,5%-2% isoflurane para manutenção). Executar um dedo do dedo do dedo do dedo do dia para garantir que o mouse atinja o nível de anestesia necessário.
- Coloque o mouse no suporte de imagem e proteja sua posição usando torneiras ou qualquer outro método adequado. Mova o suporte para o centro da bobina de ressonância magnética (ímã de 7 T/40 cm) e conecte a conexão de monitoramento.
- Para adquirir exames ponderados por T2*usando uma sequência de spin-echo, defina o tempo de repetição (TR) para 1500 ms e o tempo de eco (TE) para 2,8 ms.
- Use um campo de visão de 16 mm x 16 mm (FOV), matriz de aquisição de 128 x 128 (MTX) e corte de espessura de 0,75 x 0,8 mm2 com quatro médias de sinal e um ângulo de lançamento de 90° (FA).
- Retraia o suporte do rato do centro da bobina de MRI após ter terminado as varreduras. Devolva o rato à sua gaiola e monitore-o de perto até que se recupere completamente da anestesia.
-
Para rastrear e quantificar os MSCs rotulados nas imagens ponderadas por T2*, use o software ITK-SNAP (versão 3.8.0)7.
- Transfira os dados brutos das ressonâncias magnéticas do computador da máquina de ressonância magnética para o computador usado para análise em um formato DICOM (imagem digital e comunicações em medicina).
- Executar o software ITK-SNAP e carregar as imagens de ressonância magnética clicando no botão Arquivo. Em seguida, clique na Imagem Principal Aberta no menu. Pressione o botão Open Image na janela de exibição e, em seguida, localize e abra as imagens de ressonância magnética usando o botão Browse.
Nota: A visualização de células rotuladas nas imagens de ressonância magnética aparecerá como áreas hipointensas. Se o contraste de imagem precisa ser ajustado, selecione Ferramentas | Contraste de imagem. - Crie segmentações das áreas hipointensas e lesões ou outras partes cerebrais, selecionando o Active Label na seção de rótulos de segmentação. Use cores diferentes do rótulo para diferentes segmentos (se for necessária a segmentação de mais de uma parte).
- Use a ferramenta Polygon na barra de ferramentas principal para desenhar em torno das áreas hipointensas que representam os MSCs spio-rotulados. Select Accept, localizado abaixo da imagem de ressonância magnética. As áreas segmentadas aparecerão da mesma cor do rótulo ativo atribuído a esse segmento específico. Repita esta etapa da segmentação para todas as fatias de MRI.
- Desenvolva um mapa 3D das áreas segmentadas para representar a distribuição de MSC em todo o cérebro, selecionando a Ferramenta bisturi na parte inferior da barra de ferramentas 3D,localizada na seção de etiquetas de segmentação na parte inferior da caixa de ferramentas TheITK-SNAP. Em seguida, pressione Aceitar na parte inferior do mapa 3D criado.
- Para realizar uma análise quantitativa (volume e intensidade média) das áreas hipointensas segmentadas que representam células rotuladas, pressione o botão segmentação no painel superior e selecione Volume e Estatística.
5. Fixação do cérebro do rato e criosecção
-
Para corrigir o cérebro do camundongo, realize perfusão transcardíaca com paraformaldeído de 4% (PFA) após a última ressonância magnética, conforme descrito anteriormente8.
- Decapite a cabeça e extraia o cérebro8. Corrigir o cérebro com 4% PFA para pelo menos 48 h a 4 °C.
- Desidratar o cérebro, imergindo-o em uma solução de sacarose de 30% em 4 °C até que o cérebro afunda para o fundo da solução.
- Incorporar o cérebro na solução de temperatura de corte ideal (OCT) e congelar a -20 °C. Secione o cérebro com um microtome criostat em fatias com espessura de 14 μm e monte-os em slides. Guarde as seções desliza a -20 °C até continuar a ser útil.
6. Mancha azul prussiana
Nota: Coloração azul prussiana é comumente usada para detectar o teor de ferro em células com rótulospido spio. Aqui, a coloração azul prussiana é usada para confirmar que os sinais hipointensos nas imagens de ressonância magnética correspondem aos MSCs rotulados pelo SPIO e não a artefatos. A coloração azul prussiana é um dos métodos histoquímicos mais sensíveis usados para detectar ferro nos tecidos e pode ser usada para identificar até mesmo um único grânulo de ferro nas células.
- Lave os slides das seções cerebrais com água destilada por 5 min.
- Realizar manchas azuis prussianas imergindo os slides por 30 min na solução de coloração, que contém partes iguais ácido clorídrico (10%) e ferrocianeto de potássio (10%) preparado imediatamente antes do uso.
- Lave 3x com água destilada, por 5 min cada. Contramanchar as seções com vermelho rápido nuclear por 5 minutos. Enxágüe os slides 2x com água destilada.
- Desidratar as seções gradualmente imergindo os slides em 95% e 100% de álcool para 2 min cada. Adicione o coverslip com um meio de montagem resinoso.
- Use um microscópio de luz para detectar as células manchadas nas seções cerebrais.
Nota: O ferro nas células rotuladas aparecerá como depósitos de cor azul.
Resultados
Vinte e quatro horas após a entrega intranasal, os MSCs rotulados por SPIO foram detectados como áreas hipointensas fortes mediais para a lesão cortical em imagens t2*ponderadas (Figura 2B),indicando a migração direcionada do SPIO para o local da lesão. Essa migração permaneceu visível até 14 dias após o parto, pois os sinais hipointensos foram considerados visíveis sem redução significativa para este período de tempo(Figura 2B). Os animais feridos tratados com PBS não apresentaram áreas hipointensas, indicando que as áreas hipointensas observadas correspondem aos MSCs rotulados por SPIO e não sinalizaram artefatos(Figura 2A)A biodistribuição dos MSCs rotulados que foram observados in vivo com ressonância magnética foi visualizada por meio de reconstrução 3D (Figura 2C,D). A migração de MSCs para o córtex ferido foi confirmada histologicamente pela coloração azul prussiana e detecção do canal FITC do SPIO marcado fitc nos MSCs rotulados (Figura 3A,B).
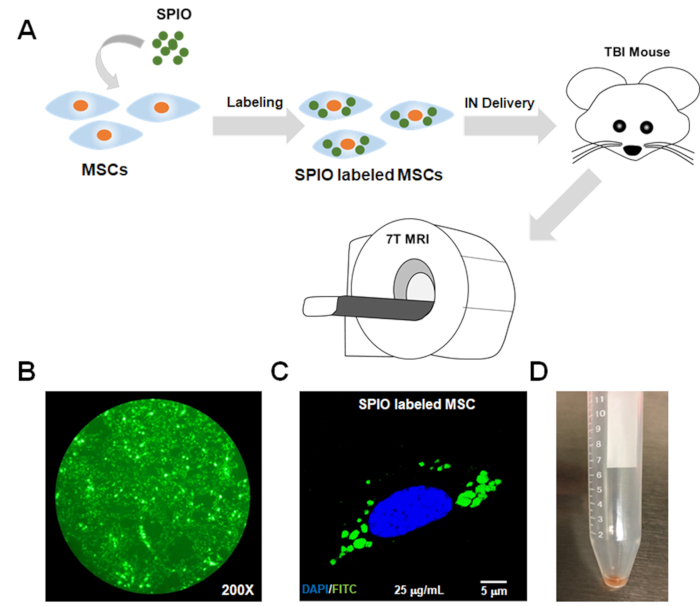
Figura 1: Fluxograma esquemático do protocolo e confirmação in vitro da captação spio por MSCs. (A)MSCs foram incubados com SPIO para 24 h para rotulagem. Em seguida, os MSCs rotulados foram entregues em um modelo de mouse TBI através de uma rota intranasal (IN). Mri em diferentes pontos de tempo foi realizada para rastrear os MSCs rotulados. Confirmação de rotulagem suficiente de MSCs por SPIO foi alcançado por(B)microscopia fluorescência e (C)microscopia confocal usando o canal FITC, uma vez que as nanopartículas SPIO foram marcadas com FITC. (D) A pelota celular dos MSCs rotulados parecia de cor escura devido ao carregamento de ferro. FITC = isotiocianato de fluoresceina; SPIO = partículas superparamagnéticas de óxido de ferro; MSCs = células-tronco mesenchymal; Ressonância magnética = ressonância magnética; IN = intranasal; TCE = lesão cerebral traumática. Clique aqui para ver uma versão maior deste número.

Figura 2: A ressonância magnética em tempo real permite a detecção e rastreamento da migração de MSC rotulada por SPIO para locais de lesões nos cérebros de camundongos induzidos por TCE. (A)Os ratos foram submetidos a TCE, seguidos de tratamento com MSCs com rótulo PBS ou SPIO, administrados através de uma rota intranasal 24 h após lesão. As seções coronais de imagens t2*-ponderadas mostraram os MSCs rotulados como uma área hipointensa (seta) na borda do local da lesão (área delineada) em 1, 7 e 14 dias após a entrega. Os ratos PBS-tratados não mostram nenhuma área hypointense. (B) Processo de segmentação da área do local da lesão (verde) e rotulado de MSCs (vermelho) com base em imagens coronais T2*-MRI. (C) reconstrução 3D do tratamento do cérebro do rato com base em imagens t2*-ponderadas ilustrando a biodistribuição de MSCs rotulados por SPIO no cérebro 14 dias após o parto. Clique aqui para ver uma versão maior deste número.

Figura 3: A análise histológica confirma a presença de MSCs rotulados por SPIO nos cérebros dos animais tratados. Manchaazul prussiana de seções cerebrais de um camundongo(A)tratado com PBS (controle) e (C)rato tratado com MSCs rotulados por SPIO. células SPIO-positivas foram detectadas em mouse tratado por MSC (células encaixotadas, azul), enquanto o rato controle não mostrou células positivas no local da lesão no córtex aos 14 dias após o parto, confirmando observações de Ressonância Magnética. A análise da microscopia de fluorescência do córtex de um camundongo controle(B)tratado com PBS e (D)mouse tratado com MSCs rotulados por SPIO foi realizada 14 dias após a entrega. A análise revelou a presença de células SPIO-positivas marcadas por FITC (células encaixotadas, verdes) no córtex lesionado no mouse tratado pelo MSC, mas nenhum sinal FITC foi observado no córtex do rato tratado com PBS. Barras de escala = 50 μm, salvo indicação em contrário. Clique aqui para ver uma versão maior deste número.
Discussão
O protocolo descrito aqui representa procedimentos gerais para a rotulagem spio de MSCs e rastreamento de ressonância magnética de SPIO-rotulado scs pós-intranasal entrega. O protocolo permite a oportunidade de estudar a migração e a biodistribuição de MSCs após o parto in vivo no cérebro, utilizando um método não invasivo.
Os MSCs são candidatos atraentes para terapias baseadas em células-tronco para distúrbios e lesões do SNC devido à sua capacidade de secretar fatores tróficos que 1) desencadeiam processos neurorestauradores e 2) fornecem neuroproteção, devido aos seus efeitos anti-inflamatórios dentro da área de lesões9,10,11,12. Embora o rastreamento e detecção de Ressonância magnética de longo prazo de MSCs rotulados por SPIO possam ser limitados devido à diluição do SPIO intercelular com divisão celular, células rotuladas podem ser detectadas por até várias semanas após o transplante nos cérebros dos modelos animais13.
Também descrito aqui é o protocolo de rotulagem de MSCs com nanopartículas SPIO revestidas com dextran sem agentes de transfecção. Outros protocolos têm sido utilizados na literatura14,15,16. No entanto, em todos os casos, esses protocolos devem ser ajustados para o tipo celular, tamanho spio, tempo de incubação e concentração spio. MSCs foram mostrados para ter prejudicado o potencial de diferenciação condrógena, mas não a diferenciação adipogênica sobre SPIO rotulagem17. Portanto, é altamente recomendado que os ensaios de diferenciação sejam realizados antes da entrega de células-tronco para avaliar a influência do SPIO na potência de diferenciação das células-tronco. Em um estudo anterior, foi demonstrado que a rotulagem de MSC com o mesmo tipo spio e concentração usada no aqui não afetou a potência de diferenciação osteogênica ou adipogênica de MSCs6.
A rota intranasal da entrega terapêutica da pilha de haste para desordens e ferimentos de cérebro é uma aproximação prometedora para a aplicação clínica de pilhas de haste. No entanto, os mecanismos intrínsecos e moleculares que ditam os comportamentos das células-tronco na cavidade nasal permanecem obscuros. Embora a rota intranasal seja amplamente explorada para a entrega de pequenas moléculas, o tamanho e o comportamento de biodistribuição do caule terapêutico diferem das pequenas moléculas. O protocolo atual demonstra que os MSCs tendem a migrar para o local da lesão após a entrega intranasal.
Aqui, imagens ponderadas por T2*foram usadas para rastrear os MSCs rotulados por SPIO. Outros relatórios usaram imagens de eco gradiente. No entanto, artefatos de suscetibilidade são frequentemente observados em imagens de eco gradiente devido ao SPIO intercelular. No protocolo atual, a localização das áreas hipointensas que representam os MSCs rotulados pelo SPIO em imagens ponderadas por T2*foi a mesma que a localização do SPIO em seções cerebrais detectadas pelo exame histológico (Figura 3). Isso indica a sensibilidade adequada de imagens de eco de rotação ponderadas por T2*para rastreamento de MSC rotulado por SPIO no cérebro.
Em resumo, o protocolo descrito é benéfico para estudos in vivo do seguimento da pilha de haste de ferimentos e de desordens de cérebro. O rastreamento longitudinal de células-tronco in vivo tem sido tradicionalmente realizado sacrificando animais em vários pontos de tempo. O protocolo atual fornece uma abordagem não invasiva e eficiente para o parto e rastreamento de MSCs, o que representa um procedimento potencial para a terapia baseada em células-tronco para lesões cerebrais e distúrbios em ambientes clínicos.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Este trabalho foi apoiado pelo Ministério da Ciência e Tecnologia Grants, Taiwan (MAIS 104-2923-B-038-004 -MY2, MAIS 107-2314-B-038-063, e mais 107-2314-B-038-042) e Taipei Medical University (TMU 105-AE1-B03, TMU 106-5400-004-400, TMU 106-5310-001-400, DP2-107-21121-01-N-05 e DP2-108-21121-01-N-05-01).
Materiais
| Name | Company | Catalog Number | Comments |
| Cell culture supplies (Plastics) | ThermoFisher Scientific | Varies | Replaceable with any source |
| Disposable Microtome Blade | VWR | 95057-832 | |
| D-MEM/F-12 (1X) with GlutaMAX | GIBCO | 10565-018 | |
| Embedding medium for frozen tissue specimens (O. C. T.) | Sakura Finetek | 4583 | |
| Fetal Bovine Serum (FBS) | GIBCO | 12662-029 | |
| Fluorescence Wild Field Microscope | Olympus | Olympus BX43 | |
| Forcept | Fine Science Tools | 11293-00 | Surgery |
| Gentamicin (10 mg/mL) | GIBCO | 15710-064 | |
| Hair clipper | Pet Club | PC-400 | |
| Head Trauma Contusion device | Precision Systems and Instrumentation | Model TBI-0310 | |
| Hyaluronidase from bovine testes | MilliporeSigma | H3506 | |
| ITK-SNAP Software | Penn Image Computing and Science Laboratory (PICSL) at the University of Pennsylvania, and the Scientific Computing and Imaging Institute (SCI) at University of Utah | ITK-SNAP 3.8.0 | |
| Ketamine (Ketavet) | Pfizer | 778-551 | |
| Mice | National Laboratory Animal Center, Taiwan | C57BL6 | Wild type mice strain used in the study |
| Microdrill | Nakanishi | NE50 | Combine with Burrs for generating the bone window |
| Microtome | Leica | RM2265 | |
| Mouse (C57BL/6) Mesenchymal Stem Cells | GIBCO | S1502-100 | |
| MRI scanner | Bruker Biospec | ||
| Phosphate Buffer Saline (PBS) | Corning Cellgro/ThermoFisher | 21-031-CV | |
| Povidone-iodine 7.5% | Purdue product L.P. | Surgical scrub | |
| Prussian Blue Stain | Abcam | ab150674 | |
| Scissor | Fine Science Tools | 14084-08 | Surgery |
| Stereotaxic frame | Kopf Instruments | Model 900 | |
| Superparamagnetic iron oxide (SPIO) nanoparticles | BioPAL | Molday ION EverGreen, CL-50Q02-6A-51 | stem cells labeling for in vivo tracking using MRI |
| Suture monofilament | Ethicon | G697 | Suture |
| Timer | Wisewind | Replaceable with any source | |
| TrypLE | GIBCO | 12604-013 | |
| Xylazine (Rompun) | Bayer | QN05 cm92 |
Referências
- Pelled, G., et al. Smad8/BMP2-engineered mesenchymal stem cells induce accelerated recovery of the biomechanical properties of the Achilles tendon. Journal of Orthopedic Research. 30 (12), 1932-1939 (2012).
- Shahror, R. A., et al. Transplantation of Mesenchymal Stem Cells Overexpressing Fibroblast Growth Factor 21 Facilitates Cognitive Recovery and Enhances Neurogenesis in a Mouse Model of Traumatic Brain Injury. Journal of Neurotrauma. , (2019).
- Danielyan, L., et al. Intranasal delivery of cells to the brain. European Journal of Cell Biology. 88 (6), 315-324 (2009).
- Karussis, D., et al. Safety and immunological effects of mesenchymal stem cell transplantation in patients with multiple sclerosis and amyotrophic lateral sclerosis. Archives in Neurology. 67 (10), 1187-1194 (2010).
- Danielyan, L., et al. Intranasal delivery of bone marrow-derived mesenchymal stem cells, macrophages, and microglia to the brain in mouse models of Alzheimer's and Parkinson's disease. Cell Transplant. 23, 123-139 (2014).
- Shahror, R. A., Ali, A. A. A., Wu, C. C., Chiang, Y. H., Chen, K. Y. Enhanced Homing of Mesenchymal Stem Cells Overexpressing Fibroblast Growth Factor 21 to Injury Site in a Mouse Model of Traumatic Brain Injury. International Journal of Molecular Science. 20 (11), (2019).
- Yushkevich, P. A., et al. User-guided 3D active contour segmentation of anatomical structures: significantly improved efficiency and reliability. Neuroimage. 31 (3), 1116-1128 (2006).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Li, Y., Chopp, M. Marrow stromal cell transplantation in stroke and traumatic brain injury. Neuroscience Letters. 456 (3), 120-123 (2009).
- Aertker, B. M., Bedi, S., Cox, C. S. Strategies for CNS repair following TBI. Experimental Neurology. 275, 411-426 (2016).
- Ohtaki, H., et al. Stem/progenitor cells from bone marrow decrease neuronal death in global ischemia by modulation of inflammatory/immune responses. Proceedings of the National Academy of Sciences of the United States of America. 105 (38), 14638-14643 (2008).
- Mahmood, A., Lu, D., Chopp, M. Intravenous administration of marrow stromal cells (MSCs) increases the expression of growth factors in rat brain after traumatic brain injury. Journal of Neurotrauma. 21 (1), 33-39 (2004).
- Hoehn, M., et al. Monitoring of implanted stem cell migration in vivo: a highly resolved in vivo magnetic resonance imaging investigation of experimental stroke in rat. Proceedings of the National Academy of Sciences of the United States of America. 99 (25), 16267-16272 (2002).
- Reddy, A. M., et al. In vivo tracking of mesenchymal stem cells labeled with a novel chitosan-coated superparamagnetic iron oxide nanoparticles using 3.0T MRI. Journal of Korean Medical Science. 25 (2), 211-219 (2010).
- Roeder, E., et al. Dose-response of superparamagnetic iron oxide labeling on mesenchymal stem cells chondrogenic differentiation: a multi-scale in vitro study. PLoS ONE. 9 (5), e98451 (2014).
- Schafer, R., et al. Labeling of human mesenchymal stromal cells with superparamagnetic iron oxide leads to a decrease in migration capacity and colony formation ability. Cytotherapy. 11 (1), 68-78 (2009).
- Kostura, L., Kraitchman, D. L., Mackay, A. M., Pittenger, M. F., Bulte, J. W. Feridex labeling of mesenchymal stem cells inhibits chondrogenesis but not adipogenesis or osteogenesis. NMR in Biomedicine. 17 (7), 513-517 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados