Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un prospecto de válvula mitral transapical guiado por imágenes Modelo de punción de sobrecarga de volumen controlado de la insuficiencia mitral en la rata
En este artículo
Resumen
Se notifica un modelo de roedor de sobrecarga del volumen del corazón izquierdo por insuficiencia mitral. La insuficiencia mitral de la gravedad controlada se induce mediante el avance de una aguja de dimensiones definidas en el prospecto anterior de la válvula mitral, en un corazón latiendo, con guía por ultrasonido.
Resumen
La insuficiencia mitral es una lesión de válvula cardíaca ampliamente frecuente, que causa remodelación cardíaca y conduce a insuficiencia cardíaca congestiva. Aunque se conocen los riesgos de RM no corregido y su mal pronóstico, los cambios longitudinales en la función cardíaca, la estructura y la remodelación se entienden incompletamente. Esta brecha de conocimiento ha limitado nuestra comprensión del momento óptimo para la corrección de RM, y el beneficio que la corrección de RM temprana frente a tardía puede tener en el ventrículo izquierdo. Para investigar los mecanismos moleculares que subyacen a la remodelación ventricular izquierda en el entorno de RM, son necesarios modelos animales. Tradicionalmente, el modelo de fístula aorto-caval se ha utilizado para inducir una sobrecarga de volumen, que difiere de lesiones clínicamente relevantes como MR. MR representa un estresante hemodinámico de sobrecarga de volumen de baja presión, que requiere modelos animales que imitan esta condición. Aquí, describimos un modelo de roedor de RM severa en el que el prospecto anterior de la válvula mitral de rata se perfora con una aguja de 23G, en un corazón latiendo, con guía de imagen ecocardiográfica. La gravedad de la RMN se evalúa y se confirma con ecocardiografía, y se notifica la reproducibilidad del modelo.
Introducción
La insuficiencia mitral (RM) es una lesión frecuente de la válvula cardíaca, diagnosticada en el 1,7% de la población general de Los Estados Unidos y en el 9% de la población de edad avanzada mayor de 65 años de edad1. En esta lesión de la válvula cardíaca, el cierre inadecuado de las vallas mitrales en la sístole, provoca la regurgitación de sangre desde el ventrículo izquierdo hacia la aurícula izquierda. La RM puede ocurrir debido a varias etiologías; sin embargo, las lesiones primarias de la válvula mitral (RM primaria) se diagnostican y tratan con mayor frecuencia en comparación conlaRM2 secundaria. La RM primaria aislada es a menudo el resultado de la degeneración mexomatosa de la válvula mitral, lo que resulta en un alargamiento de los foliolos o tendineae chordae, o la ruptura de algunas cuerdas, todas las cuales contribuyen a la pérdida de coaptación sistólica de la válvula.
La RMN resultante de tales lesiones valvulares eleva el volumen sanguíneo que llena el ventrículo izquierdo en cada latido del corazón, aumentando el estrés diastólico final de la pared y proporcionando un estrés hemodinámico que incita a la adaptación y remodelación cardíaca. La remodelación cardíaca en esta lesión se caracteriza a menudo por el agrandamiento significativo de la cámara3,,4, hipertrofia de pared leve, con función contráctea conservada durante períodos prolongados de tiempo. Dado que la fracción de eyección a menudo se conserva, la corrección de la RMN mediante medios quirúrgicos o transcatéter a menudo se retrasa, hasta la aparición de síntomas como disnea, insuficiencia cardíaca y arritmias. Sin embargo, la RMN no corregida se asocia con altos riesgos de eventos adversos cardíacos, aunque actualmente se desconoce el conocimiento sobre los cambios ultraestructurales subyacentes a estos eventos.
Los modelos animales de RM proporcionan un modelo valioso para investigar estos cambios ultraestructurales en el corazón, y estudiar la progresión longitudinal de la enfermedad. Anteriormente, los investigadores han inducido RM en animales grandes incluyendo cerdos, perros y ovejas, mediante la creación de una derivación ventriculo-auricular externa5, ruptura de acordes intracardiaca6,o perforación defolletos 7. Si bien las técnicas quirúrgicas son más fáciles en animales grandes, estos estudios se han limitado al seguimiento subcrónico en un tamaño de muestra pequeño, debido a los altos costos de realizar tales estudios en animales grandes. Además, el análisis molecular del tejido de estos modelos es a menudo desafiante debido a los anticuerpos específicos de especies limitadas y las bibliotecas del genoma anotado para la alineación.
Los modelos animales pequeños de RM pueden proporcionar una alternativa adecuada para estudiar esta lesión de válvula y su impacto en la remodelación cardíaca. Históricamente, se ha utilizado el modelo de rata de fístula aorto-caval (ACF) de sobrecarga de volumen cardíaco. Descrita por primera vez en 1973 por Stumpe et al.8, se crea quirúrgicamente una fístula arteriovenosa para evitar la sangre arterial de alta presión desde la aorta descendente hasta la vena cava inferior a baja presión. La alta tasa de flujo en la fístula induce una drástica sobrecarga de volumen en ambos lados del corazón, causando una hipertrofia ventricular derecha e izquierda significativa y disfunción que ocurre a los pocos días de la creación del ACF9. A pesar de su éxito, ACF no imita la hemodinámica de MR, una sobrecarga de volumen de baja presión, que eleva la precarga, pero también reduce la carga posterior. Debido a tales limitaciones del modelo ACF, buscamos desarrollar y caracterizar un modelo de MR que imita mejor la sobrecarga de volumen de baja presión.
Aquí, describimos el protocolo para un modelo de punción del prospecto de la válvula mitral para crear RM severa en ratas10,,11. Se introdujo una aguja hipodérmica en el corazón de la rata latiendo y se avanzó en el prospecto de la válvula mitral anterior bajo guía ecocardiográfica en tiempo real. La técnica es altamente reproducible y un modelo relativamente bueno que imita la RMN como se ve en los pacientes. La gravedad de la RMN se controla por el tamaño de la aguja utilizada para perforar el prospecto mitral y la gravedad de la RMSe puede evaluar mediante ecocardiografía transesofágica (TEE).
Protocolo
Los procedimientos fueron aprobados por el Programa de Cuidado y Uso de Animales de la Universidad Emory bajo el número de protocolo EM63Rr, fecha de aprobación 06/06/2017.
1. Preparación prequirúrgica
- Esterilizar al vapor los instrumentos quirúrgicos antes del procedimiento.
- El día del procedimiento, transfiera ratas de la vivienda a la cirugía, y pesquélas.
- Extraer medicamentos preoperatorios y postoperatorios según el peso: dos dosis de Carprofeno (2,5 mg/kg cada una), una dosis de gentamicina (6 mg/kg) y una dosis de buprenorfina (0,02 mg/kg).
- Asegurar el volumen adecuado de isoflurano en el mezclador de gas, y oxígeno en los tanques están disponibles para la cirugía. Un tanque lleno de oxígeno (24 pies3) es a menudo adecuado.
2. Preparación animal
NOTA: En este estudio se utilizaron ratas macho sprague-Dawley adultas que pesan 350-400 g. Las técnicas quirúrgicas son susceptibles a animales ligeramente más pequeños o más grandes, si se desea.
- Sedar la rata en una cámara de inducción con 5% de isoflurano mezclado en 1 LPM (litro por minuto) de 100% de oxígeno. Determinar el nivel adecuado de sedación a partir de una frecuencia respiratoria más lenta bajo observación visual, y la pérdida de espasmo al pellizcar el dedo del pie de la rata.
- Intubar la rata con una angiocath de 16 G, incorporada para su uso como tubo endotraqueal.
- Visualiza la tráquea y las cuerdas vocales usando un otoscopio, y usa un aplicador de punta de algodón para eliminar las secreciones faríngeas.
- Introducir el tubo endotraqueal en un cable guía de 0.034 pulgadas, en las cuerdas vocales. Una vez que el tubo esté colocado adecuadamente en la tráquea, empuje el tubo hacia adentro y retire el cable (Figura 1).
- Coloque la rata en la almohadilla quirúrgica calentada mantenida a 37oC y conecte el tubo endotraqueal a un respirador mecánico. Introduzca el peso de la rata en el software de control del ventilador, que calcula la velocidad de ventilación y el volumen de marea. En este estudio se utilizaron 66 respiraciones por minuto con un volumen de marea de 1 mL/100 g de peso corporal(Figura 1D).
- Use 100% de oxígeno (1 LPM) mezclado con 2-2.5% de isoflurano como anestésico inhalante y confirme el nivel de anestesia con pérdida del tono de la mandíbula y pérdida de respuesta al pellizco del dedo del pie.
- Tenga en cuenta que si se intuba correctamente, el movimiento del pecho debe sincronizarse con el respirador.
- Si se intuba incorrectamente, el movimiento del pecho no se sincronizará con el respirador. Para comprobar si la intubación es incorrecta, comprima el abdomen de la rata, lo que crea contrapresión en el respirador, generando una alarma de sobrepresión. En este escenario, retraiga la angioccáya suavemente, y devuelva la rata a la cámara de inducción con 5% de isoflurano durante unos minutos para asegurarse de que la rata está suficientemente anestesiada y re-intubar la rata.
- Una vez intubado correctamente, asegure el tubo endotraqueal suturando el extremo proximal del tubo a la mejilla de la rata con una sutura de seda 4-0 para evitar la extubación durante el procedimiento.
- Inserte una sonda de temperatura rectal para monitorear la temperatura corporal y un electrocardiograma de cuatro terminales para monitorear el ECG durante todo el procedimiento.
- Utilice una lámpara de calentamiento superior si el calor de la plataforma quirúrgica es insuficiente. Apague la lámpara si la temperatura corporal sube por encima de los 37 oC.
- Evaluar visualmente el electrocardiograma para detectar cualquier arritmia o signo de isquemia miocárdica. Si no hay ninguno, registre el electrocardiograma basal.
- Realizar ecocardiografía transtorácica (TET) para la función cardíaca basal(Figura 2A).
- Gire la rata a una posición supina y afitúe el lado izquierdo del tórax. Para obtener vistas de eco claras, elimina el cabello con una crema depilatoria.
- Utilice cualquier sistema de ultrasonido con la frecuencia adecuada para obtener imágenes de frecuencia cardíaca alta. En este estudio utilizamos el sistema Visualsonics 2100 con una sonda de 21 MHz, que es adecuada para imágenes cardíacas en ratas.
- Obtenga imágenes en modo B en el plano parasternal del eje largo, para calcular los volúmenes ventriculares izquierdos. En el mismo plano, obtenga imágenes en modo M para medir las cotas de muro.
- Gire la sonda 90o y obtenga vistas de eje corto parasternal en modo B y M en el nivel medio-papilar para medir las dimensiones de la pared transversal.
- Realizar ecocardiografía transesofágica (TEE) para imágenes de línea de base(Figura 2B).
- Coloque la rata en la posición de decúbito derecha e inserte una sonda de ultrasonido intracardiaca de 8 Fr (8 MHz) en el esófago de la rata con una pequeña cantidad de gel aplicado a la punta. La frecuencia de la sonda ICE (ecocardiografía intracardiaca) es suficiente para obtener 4-6 fotogramas por latido del corazón, que son adecuados para visualizar el movimiento de la válvula.
NOTA: Se puede utilizar un sistema primo GE Vivid I o Siemens SC2000 para imágenes ICE. - Obtenga una vista esofágica alta para obtener una vista de dos cámaras del lado izquierdo del corazón. Esta vista es ideal para visualizar la aurícula izquierda, la válvula mitral y el ventrículo izquierdo. Coloque la sonda de tal forma que se visualicen los foliolos anterior es y posterior es central. Este ángulo también permite mediciones Doppler a través de la válvula mitral, sin corrección de ángulo.
- Mida el área auricular izquierda y las dimensiones del anillo de la válvula mitral en esta vista.
- Realice imágenes Doppler a color para confirmar la competencia de la válvula y la falta de RM Al inicio. Realice imágenes Doppler de onda pulsada y onda continua para cuantificar la entrada mitral y confirmar la falta de flujo regurgitante.
- Realice imágenes Doppler de ondas pulsadas y en modo B de la aorta para medir el diámetro de la raíz aórtica y calcular el flujo aórtico.
- Realice imágenes Doppler de ondas pulsadas de la vena pulmonar para medir el flujo venoso pulmonar.
- Coloque la rata en la posición de decúbito derecha e inserte una sonda de ultrasonido intracardiaca de 8 Fr (8 MHz) en el esófago de la rata con una pequeña cantidad de gel aplicado a la punta. La frecuencia de la sonda ICE (ecocardiografía intracardiaca) es suficiente para obtener 4-6 fotogramas por latido del corazón, que son adecuados para visualizar el movimiento de la válvula.
- Inyectar una dosis única de Carprofeno (2,5 mg/kg, SQ, antiinflamatorio no esteroideo), gentamicina (6 mg/kg, SQ, antibiótico) y solución salina estéril (1 ml, SQ) para compensar preventivamente la pérdida de sangre durante el procedimiento.
- Atener el lado izquierdo del tórax según sea necesario para eliminar el vello restante del campo quirúrgico. Afeitarse desde la región del cuello inferior hasta el cifoso, y desde el brazo izquierdo hasta el esternón medio, debe ser suficiente para garantizar un campo que carezca de cabello y reducir el riesgo de contaminación del sitio quirúrgico.
- Frote el área quirúrgica con una gasa empapada en Betadine, seguida de una gasa empapada en 70% de etanol. Frote el área en movimientos circulares sobre la piel, de modo que la gasa no entre en contacto con un área previamente limpiada.
- Repita este paso tres veces para lograr un campo adecuadamente estéril para la cirugía.
- Cubrir al animal con cubiertas estériles, abriendo una ventana para acceder al área quirúrgica estéril.
3. Toracotomía izquierda
- Realizar todo el procedimiento quirúrgico utilizando técnicas asépticas, con isoflurano mantenido en 2-2.5% en 1 LPM de oxígeno. Coloque todos los instrumentos en una bandeja estéril y vuelva a colocarlos en la bandeja después de cada uso.
- Use guantes estériles, una máscara y una gorra quirúrgica por el cirujano para todo el procedimiento. También se puede usar una bata quirúrgica estéril, pero es opcional a menos que se espera contaminación.
- Use un bisturí quirúrgico con una cuchilla Sin #15 para hacer una incisión cutánea en el lado izquierdo del tórax, aproximadamente 1 cm proximal al xifoidea. Utilice unas tijeras de punta dissección contundentes para separar la capa de la piel de la capa muscular y hacer una incisión longitudinal.
- Diseccionar las capas musculares de la misma manera hasta que las costillas estén expuestas.
- Realice cuidadosamente una incisión longitudinal de 2-3 cm en el quinto espacio intercostal, adecuada para insertar retractores y exponer el corazón.
- Usa fórceps con punta fina para levantar el pericardio, y microtijeras para extirparlo en la región que rodea el ápice del corazón. Este paso ayuda a evitar adherencias postquirúrgicas del corazón a las paredes del pecho y al diafragma.
NOTA: Evite las incisiones quirúrgicas cerca del esternón para minimizar el sangrado. La transsección de las arterias mamarias internas que corren a lo largo del esternón puede causar sangrado excesivo. Si se encuentra con este sangrado, identifique el sangrador y cauterizarlo.
4. Procedimiento de RM guiado por eco(Figura 3 y Figura 4)
- Utilice una sutura de proleno 6-0 y un soporte de microaguja, para colocar una sutura de cuerda de bolso en el ápice del ventrículo izquierdo. Si es necesario, utilice micro fórceps para estabilizar el corazón.
- Ate suavemente la sutura apical para estabilizar el ápice e insertar una aguja de 23 G (lavada con salina, y con una tortilla en su extremo distal) en el centro de la sutura de la cuerda del bolso, en la cavidad ventricular izquierda.
- Utilice una mano para sujetar y guiar la aguja de forma estable, y la otra mano para manipular simultáneamente la sonda de eco transesofágico para lograr una vista de eco óptima para visualizar la aguja, como se describió anteriormente.
- Con la guía de ultrasonido en tiempo real, avance la aguja hacia el lado ventricular del prospecto mitral anterior. Una vez confirmada la posición de la aguja en el ultrasonido, avance la aguja en un movimiento fino a través del prospecto de la válvula. Si se siente una resistencia, gire la aguja a medida que avanza en el prospecto para perforarla.
NOTA: El avance de la aguja demasiado hacia la aurícula izquierda podría provocar una perforación auricular izquierda, causando sangrado excesivo y muerte animal. La aguja debe visualizarse en el ultrasonido en todo momento. - Retraiga la aguja en la cámara ventricular izquierda, lejos de la válvula mitral, y confirme la RM Nal activando las imágenes Doppler a color.
- Si no se observa RM en imágenes Doppler a color, repita los pasos 4.4 y 4.5. Ajuste la sonda de eco si es necesario para obtener una mejor vista. Después de la práctica en pocas ratas, es posible inducir una punción del prospecto en un movimiento de la aguja, induciendo un agujero que es del tamaño del diámetro exterior de la aguja. Esto fue confirmado después de la necropsia de los corazones de rata.
- Una vez confirmada la RM, retraiga la aguja de la cavidad ventricular izquierda y ate suavemente la sutura de la cuerda del monedero.
- Use una gasa estéril para absorber cualquier sangre en el ápice y en la cavidad torácica.
NOTA: Tocar la sonda de eco con los guantes quirúrgicos puede resultar en contaminación del entorno estéril. Rocíe sus guantes con 70% de etanol o sustituya los guantes por otros nuevos, apropiadamente.
5. Recuperación de animales y cuidado postoperatorio
- Después de 5-10 minutos de función cardíaca estable (ECG normal y frecuencia cardíaca), cierre la toracotomía en capas con 4-0 vicryl, mientras reduce el isoflurano en pasos.
- Utilice una sutura interrumpida para aproximarse a las costillas, con isoflurano mantenido en 2%. Inserte un tubo torácico en el sexto espacio intercostal y fíjelo a las cortinas estériles para evitar el avance involuntario del tubo en la cavidad torácica.
- Utilice una sutura continua para cerrar la capa muscular con isoflurano mantenido en 1.5%.
- Utilice una sutura continua para cerrar la capa de la piel con isoflurano mantenido al 1%.
- Conecte una jeringa con punta de válvula Luer de 10 ml al tubo torácico y drene 10-12 ml de aire de la cavidad torácica y luego retire el tubo torácico.
- Administrar una dosis final de Carprofeno (2,5 mg/kg, SQ) y desactivar el isoflurano.
- Continuar la ventilación mecánica mientras los daños de rata de la anestesia, el monitoreo de los signos vitales (SpO2 y la frecuencia cardíaca). Al inicio de la respiración espontánea, apague la ventilación para probar la capacidad de la rata para mantener dicha respiración y buena SpO2.
- Si los niveles de SpO2 comienzan a caer por debajo del 90%, encienda el respirador. Una vez que la rata es capaz de mantener los niveles de SpO2 sin ventilación, se corta la sutura de anclaje al tubo endotraqueal, y el animal está preparado para la extubación.
- Una vez que la rata muestra signos de estado de alerta, incluyendo movimientos de bigote o ojos, extubar al animal.
- Coloque un cono nasal con 100% de oxígeno hasta que la rata esté ambulatoria.
- Transfiera la rata a una jaula limpia con ropa de cama mínima y continúe monitoreando los signos vitales usando un monitor Demano SpO2, colocado en el pie o la cola de la rata, hasta que la rata esté ambulatoria.
NOTA: Si se observan efectos adversos de la cirugía, los animales pueden tener un tiempo de recuperación más largo y pueden tardar más en mantener altos niveles de SpO2. Si esto ocurre, se puede aplicar un cono nasal con 100% de oxígeno hasta que los niveles de SpO2 sean estables. - Para reducir el riesgo de lesiones en el sitio quirúrgico y evitar el riesgo de infección, ratas de una sola casa después de la cirugía.
- Administrar buprenorfina dentro de las 3 horas después de que la rata esté despierta y lo suficientemente ambulatoria. La buprenorfina puede causar dificultad respiratoria cuando se administra al principio del período de recuperación perioperatoria, lo que la retrasa hasta que la rata esté respirando sin dificultad.
- Después de la cirugía, todos los animales reciben los siguientes medicamentos: gentamicina (6 mg/kg, SQ, SID POD 1-3) y rimadyl (5 mg/kg, SQ, SID POD 1-3). Todos los animales se observan una vez al día durante cinco días después de la cirugía para el examen de los sitios de incisión, y una vez al día durante las primeras dos semanas después de la cirugía para la evaluación del dolor.
6. Validación de la gravedad de la RM Con ecocardiografía (Figura 5)
- Repita el TEE a las dos semanas posteriores a la cirugía, utilizando los mismos pasos especificados en la sección 2.7. Dos semanas después de la cirugía es el tiempo adecuado para que la hemodinámica se estabilice.
- Obtenga imágenes Doppler a color en una vista de 2 cámaras mediante imágenes por ultrasonido transesofágico, visualizando el ventrículo izquierdo y la aurícula izquierda. Mida el área de la aurícula izquierda y el chorro de RM. Calcule la fracción de área de chorro de MR utilizando
 (1)
(1)
La RM grave se define como área de chorro de RMN al 30%. - Aproximadamente el área del orificio regurgitante calculando el área de la aguja de 23 G, utilizando el diámetro exterior de la aguja. Esta ecuación supone que el área del orificio regurgitante es igual al área de la aguja 23G.
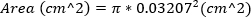 (2)
(2) - Obtenga imágenes Doppler de onda continua con la puerta Doppler en el orificio del chorro regurgitante. Trace la forma de onda para calcular el VTI del chorro regurgitante. El volumen de RM se puede estimar utilizando
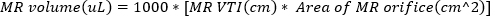 (3)
(3)
La RM grave se define como volumen de RM a 95 ml. - Obtenga imágenes Doppler de ondas de pulso de la vena pulmonar girando la sonda de eco lateralmente, en el sentido de las agujas del reloj. Mida las velocidades de onda sistólica y diastólica y utilice la siguiente ecuación para calcular la relación.
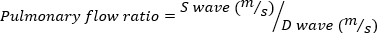 (4)
(4)
Una relación de flujo pulmonar negativo indica RM grave.
7. Cirugía sham
- Realice las secciones 1-3 como se describe.
- Modificar la sección 4 se modificó de tal manera que la aguja de 23 G se inserta en la cámara ventricular izquierda, a través de una sutura de la cuerda del bolso en el ápice ventricular izquierdo, pero no avanzó en la válvula mitral para crear MR. Inserte la aguja en la cámara ventricular izquierda y retraiga inmediatamente, después de apretar y cerrar el ápice ventricular.
- Realice la sección 5 como se describe.
- Realice la evaluación de la válvula mitral como se describe en la sección 6. Sin embargo, la RM no debe estar presente en ninguno de los animales, por lo que la cuantificación como se describe no es necesaria.
Resultados
Viabilidad y reproducibilidad
El modelo de RM propuesto es altamente reproducible, con un agujero bien definido en el prospecto mitral logrado en el 100% de las ratas utilizadas en este estudio. La Figura 6A representa la dirección de la aguja a medida que se inserta en la válvula mitral. La Figura 6B representa un agujero en el prospecto de la válvula mitral de una rata re...
Discusión
Se ha notificado un modelo de roedor reproducible de RM grave con buena supervivencia (93,75% de supervivencia después de la cirugía) y sin complicaciones postoperatorias significativas. Las imágenes en tiempo real con ecocardiografía transesofágica y la introducción de una aguja en el corazón latiendo para perforar el prospecto mitral son factibles y se pueden enseñar. La RM grave se produjo con el tamaño de la aguja de 23 G en este estudio, que puede variar como se desee utilizando una aguja más pequeña o m?...
Divulgaciones
M.P es asesor de Heart Repair Technologies (HRT), por lo que ha recibido honorarios de consultoría. HRT no tuvo ningún papel en este estudio, ni proporcionó financiación para apoyar esta labor.
Agradecimientos
Este trabajo fue financiado por la subvención 19PRE34380625 y 14SDG20380081 de la Asociación Americana del Corazón a D. Corporan y M. Padala, respectivamente, otorgan a HL135145, HL133667 y HL140325 de los Institutos Nacionales de Salud a M. Padala, y financiación de infraestructura del Carlyle Fraser Heart Center en Emory University Hospital Midtown a M. Padala.
Materiales
| Name | Company | Catalog Number | Comments |
| 23G needle | Mckesson | 16-N231 | |
| 25G needle, 5/8 inch | McKesson | 1031797 | |
| 4-0 vicryl | Ethicon | J496H | |
| 6-0 prolene | Ethicon | 8307H | |
| 70% ethanol | McKesson | 350600 | |
| ACE Light Source | Schott | A20500 | |
| ACUSON AcuNav Ultrasound probe | Biosense Webster | 10135936 | 8Fr Intracardiac echo probe |
| ACUSON PRIME Ultrasound System | Siemens | SC2000 | |
| Betadine | McKesson | 1073829 | |
| Blunted microdissecting scissors | Roboz | RS5990 | |
| Buprenorphine | Patterson Veterinary | 99628 | |
| Carprofen | Patterson Veterinary | 7847425 | |
| Chest tube (16G angiocath) | Terumo | SR-OX1651CA | |
| Disposable Surgical drapes | Med-Vet | SMS40 | |
| Electric Razor | Oster | 78400-XXX | |
| Gentamycin | Patterson Veterinary | 78057791 | |
| Heat lamp with table clamp | Braintree Scientific | HL-1 120V | |
| Hemostatic forceps, curved | Roboz | RS7341 | |
| Hemostatic forceps, straight | Roboz | RS7110 | |
| Induction chamber | Braintree Scientific | EZ-1785 | |
| Injection Plug, Cap, Luer Lock | Exel | 26539 | |
| Isoflurane | Patterson Veterinary | 6679401725 | |
| Mechanical ventilator | Harvard Apparatus | Inspira ASV | |
| Microdissecting forceps | Roboz | RS5135 | |
| Microdissecting spring scissors | Roboz | RS5603 | |
| Needle holder | Roboz | RS6417 | |
| No. 15 surgical blade | McKesson | 1642 | |
| Non-woven sponges | McKesson | 446036 | |
| Otoscope | Welch Allyn | 23862 | |
| Oxygen | Airgas Healthcare | UN1072 | |
| Pulse Oximeter | Nonin Medical | 2500A VET | |
| Retractor, Blunt 4x4 | Roboz | RS6524 | |
| Rodent Surgical Monitor | Indus Instruments | 113970 | The integrated platform allows for monitoring of vital signs and surgical warming |
| Scale | Salter Brecknell | LPS 150 | |
| Scalpel Handle | Roboz | RS9843 | |
| Silk suture 3-0 | McKesson | 220263 | |
| Small Animal Anesthesia System | Ohio Medical | AKDL03882 | |
| Sterile saline (0.9%) | Baxter | 281322 | |
| Sugical Mask | McKesson | 188696 | |
| Surgical cap | McKesson | 852952 | |
| Surgical gloves | McKesson | 854486 | |
| Syringe 10mL | McKesson | 1031801 | |
| Syringe 1mL | McKesson | 1031817 | |
| Ultra-high frequency probe | Fujifilm Visualsonics | MS250 | |
| Ultrasound gel | McKesson | 150690 | |
| VEVO Ultrasound System | Fujifilm Visualsonics | VEVO 2100 |
Referencias
- Nkomo, V. T., et al. Burden of valvular heart diseases: a population-based study. Lancet. 368 (9540), 1005-1011 (2006).
- Zamorano, J. L., et al. Mechanism and Severity of Mitral Regurgitation: Are There any Differences Between Primary and Secondary Mitral Regurgitation?. The Journal of Heart Valve Disease. 25 (6), 724-729 (2016).
- Grossman, W., Jones, D., McLaurin, L. P. Wall stress and patterns of hypertrophy in the human left ventricle. Journal of Clinical Investigation. 56 (1), 56-64 (1975).
- Carabello, B. A. Concentric versus eccentric remodeling. Journal of Cardiac Failure. 8 (6), S258-S263 (2002).
- Braunwald, E., Welch, G. H., Sarnoff, S. J. Hemodynamic effects of quantitatively varied experimental mitral regurgitation. Circulation Research. 5 (5), 539-545 (1957).
- Sasayama, S., Kubo, S., Kusukawa, R. Hemodynamic and angiocardiographic studies on cardiodynamics: experimental mitral insufficiency. Japanese Circulation Journal. 34 (6), 513-530 (1970).
- Hennein, H., Jones, M., Stone, C., Clark, R. Left ventricular function in experimental mitral regurgitation with intact chordae tendineae. Journal of Thoracic and Cardiovascular Surgery. 105 (4), 624-632 (1993).
- Stumpe, K. O., Sölle, H., Klein, H., Krück, F. Mechanism of sodium and water retention in rats with experimental heart failure. Kidney International. 4 (5), 309-317 (1973).
- Abassi, Z., Goltsman, I., Karram, T., Winaver, J., Hoffman, A. Aortocaval fistula in rat: A unique model of volume-overload congestive heart failure and cardiac hypertrophy. Journal of Biomedicine and Biotechnology. 2011 (January), 1-13 (2011).
- Corporan, D., Onohara, D., Hernandez-Merlo, R., Sielicka, A., Padala, M. Temporal changes in myocardial collagen, matrix metalloproteinases, and their tissue inhibitors in the left ventricular myocardium in experimental chronic mitral regurgitation in rodents. American Journal of Physiology - Heart and Circulatory Physiology. 315 (5), H1269-H1278 (2018).
- Onohara, D., Corporan, D., Hernandez-Merlo, R., Guyton, R. A., Padala, M. Mitral Regurgitation Worsens Cardiac Remodeling in Ischemic Cardiomyopathy in an Experimental Model. The Journal of Thoracic and Cardiovascular Surgery. , (2019).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovascular Research. 24 (5), 430-432 (1990).
- Brower, G. L., Janicki, J. S. Contribution of ventricular remodeling to pathogenesis of heart failure in rats. American Journal of Physiology-Heart and Circulatory Physiology. 280 (2), H674-H683 (2001).
- McCutcheon, K., et al. Dynamic changes in the molecular signature of adverse left ventricular remodeling in patients with compensated and decompensated chronic primary mitral regurgitation. Circulation Heart Failure. 12 (9), (2019).
- McCutcheon, K., Manga, P. Left ventricular remodeling in chronic primary mitral regurgitation. Cardiovascular Journal of Africa. 29 (1), 51-64 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados