JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
쥐의 승모판 역류에서 제어된 볼륨 과부하의 이미지 유도 횡격모동 밸브 전단지 펑크 모델
요약
승모판 역류에서 왼쪽 심장 볼륨 과부하의 설치류 모델이보고됩니다. 통제된 엄격의 승모판 역류는 초음파 지도와 함께, 박동하는 심혼에 있는 승모판막의 전방 전단지로 정의된 차원의 바늘을 전진하 여 유도됩니다.
초록
승모판 역류 (MR)는 심장 리모델링을 일으키는 원인이 되고 울혈성 심부전으로 이끌어 내는 널리 널리 퍼진 심장 판막 병변입니다. 교정되지 않은 MR의 위험과 그 나쁜 예후는 알려져 있지만, 심장 기능, 구조 및 리모델링의 세로 변화는 불완전하게 이해됩니다. 이 지식 격차는 MR 교정을 위한 최적 타이밍에 대한 우리의 이해를 제한하고, 초기 대 늦은 MR 보정이 좌심실에 있을 수 있다는 이점. MR의 설정에서 좌심실 리모델링의 기초가되는 분자 메커니즘을 조사하려면 동물 모델이 필요합니다. 전통적으로, 대공 기병 누공 모델은 MR. MR과 같은 임상적으로 관련된 병변과 다른 부피 과부하를 유도하는 데 사용되어 왔으며, 이는 이 조건을 모방하는 동물 모델을 필요로 하는 저압 부피 과부하 혈역학 적 스트레스기를 나타낸다. 본 명세서에서, 우리는 쥐 승모판의 전방 전단지가 심장 박동심장에서 23G 바늘로 천포되는 심한 MR의 설치류 모델을 설명하며, 심초음파 이미지 안내를 한다. MR의 중증도는 심초음파로 평가되고 확인되며 모델의 재현성이 보고됩니다.
서문
승모판 역류 (MR)는 일반적인 심장 판막 병변으로, 일반 미국 인구의 1.7 %와 65세이상 노인 인구의 9 %에서 진단됩니다 1. 이 심장 판막 병변에서, 실란판 전단지의 부적절한 폐쇄는 좌심실에서 왼쪽 심방으로 혈액의 역류를 일으킵니다. MR은 다양한 병인으로 인해 발생할 수 있습니다. 그러나 승모판막(1차 MR)의 1차 병변은 이차 MR2에비해 더 자주 진단되고 치료된다. 고립 된 기본 MR은 종종 승모판막의 균종 성 변성의 결과로, 전단지 또는 chordae tendineae의 연신, 또는 일부 chordae의 파열의 결과로, 모두는 밸브의 수축기 무비 절삭의 손실에 기여.
이러한 판막 병변으로 인한 MR은 각 심장 박동에서 좌심실을 채우는 혈액 량을 상승시켜 끝 확장기 벽 스트레스를 증가시키고 심장 적응 및 리모델링을 선동하는 혈역학적 스트레스를 제공합니다. 이 병변의 심장 리모델링은 종종 상당한 챔버확대3,4,경증 벽 비대, 장기간 동안 수축 기능이 보존되어 특징입니다. 배출 분획이 수시로 보존되기 때문에, 외과 적 또는 경피계를 사용하여 MR의 보정은 호흡 곤란, 심부전 및 부정맥과 같은 현상의 개시까지 수시로 연기됩니다. 그러나, 정정되지 않은 MR은 심장 불리한 사건의 고위험과 연관됩니다, 그러나 현재 이 사건의 기초에 있는 초구조적 변경에 관하여 지식은 불명합니다.
MR의 동물 모델은 심장의 이러한 초구조적 변화를 조사하고 질병의 세로 진행을 연구하는 귀중한 모델을 제공합니다. 이전에는 돼지, 개, 양 등의 대형 동물에서 MR을 유도하였고, 외부 심방션션션션5,심근내 화음 파열6,또는 리플렛 천포7을생성하여 MR을 유도했다. 수술 기술은 큰 동물에서 쉽게 하는 동안, 이러한 연구는 작은 샘플 크기에 하위 만성 후속으로 제한 되었습니다., 큰 동물에서 이러한 연구를 수행 하는 높은 비용으로 인해. 게다가, 이 모형에서 조직의 분자 분석은 수시로 정렬을 위한 한정된 종 특정 항체 및 추가된 게놈 도서관 때문에 도전적입니다.
MR의 작은 동물 모델은 이 판막 병변 및 심장 리모델링에 미치는 영향을 연구하기에 적합한 대안을 제공할 수 있습니다. 역사적으로, 심장 볼륨 과부하의 대공 기병 누공 (ACF)의 쥐 모델이 사용되었습니다. 1973년에 Stumpe et al.8에의해 처음 기술된 동맥 정맥 누공은 하강대에서 저압 열등한 정맥 카바로 고압 동맥 혈액을 우회하기 위해 외과적으로 만들어집니다. 누공의 높은 유량은 심장의 양쪽에 과부하를 유도, ACF를 만드는 일 이내에 발생하는 상당한 오른쪽 및 왼쪽 심실 비대 및 기능 장애를 일으키는9. 그 성공에도 불구하고, ACF는 MR의 혈역학을 모방하지 않습니다, 저압 볼륨 과부하, 이는 예압을 상승뿐만 아니라 애프터 로드를 감소. ACF 모델의 이러한 한계로 인해 저압 부피 과부하를 더 잘 모방하는 MR 모델을 개발하고 특성화하고자 했습니다.
본 명세서에서, 우리는 랫트10,,11에서심한 MR을 생성하기 위해 승모판 막 전단지 펑크의 모델에 대한 프로토콜을 설명한다. 피하 주사바늘이 박동하는 쥐 심장에 도입되었고, 실시간 심초음파 지도하에 전방 승모판 막 전단지로 진행되었다. 이 기술은 매우 재현성이 높으며 환자에서 볼 수 있듯이 MR을 모방하는 비교적 좋은 모델입니다. MR 중증도는 승모판 전단지를 천천하는 데 사용되는 바늘의 크기에 의해 제어되며 MR의 중증도는 경식도 심초음파(TEE)를 사용하여 평가될 수 있다.
프로토콜
절차는 프로토콜 번호 EM63Rr, 승인 날짜 06/06/2017에 따라 에모리 대학의 동물 관리 및 사용 프로그램에 의해 승인되었습니다.
1. 수술 전 준비
- 시술 전에 수술 기구를 증기 살균하십시오.
- 절차 일에, 수술에 주택에서 쥐를 전송, 그들을 무게.
- 체중에 따라 수술 전 및 수술 후 약물을 그립니다 : 카프로펜 2 회 용량 (각 2.5 mg / kg), 겐타마이신 1 회 용량 (6 mg / kg), 그리고 부프레 노르핀 (0.02 mg / kg)의 한 복용량.
- 가스 믹서에서 이소플루란의 적절한 부피를 확인하고 탱크의 산소를 수술에 사용할 수 있습니다. 산소 (24 피트3)의한 전체 탱크는 종종 적절 하다.
2. 동물 준비
참고: 350-400 g의 성인 스프라그-Dawley 수컷 쥐가 이 연구에서 사용되었습니다. 수술 기술은 약간 작거나 더 큰 동물에게, 원하는 경우에 매실 수 있습니다.
- 100% 산소의 1 LPM (분당 리터)에서 혼합 5 % 이소플루란과 유도 챔버에서 쥐를 진정. 육안 관찰 하에 느린 호흡 속도에서 적절한 수준의 완화를 결정하고 쥐의 발가락을 꼬집을 때 경련을 잃습니다.
- 쥐를 16 G angiocath로 삽관하고, 내시경 튜브로 사용하기 위해 장착됩니다.
- 이경을 사용하여 기관및 성대를 시각화하고 면팁 어플리케이터를 사용하여 인두 분비를 제거합니다.
- 0.034 인치 가이드 와이어에 성대에 내구 튜브를 소개합니다. 튜브가 기관에 적절하게 배치되면 튜브를 안쪽으로 밀고 와이어를인출합니다(그림 1).
- 37°C에서 유지된 가열된 수술 패드에 쥐를 놓고 내구튜브를 기계식 인공호흡기에 연결한다. 환기 제어 소프트웨어에 쥐의 무게를 입력, 이는 환기 속도와 조수 볼륨을 계산합니다. 본 연구에서는 1 mL/100 g의 조수부피와 함께 분당 66회 호흡을 사용하였다(도1D).
- 흡입성 마취제로 2-2.5% 이소플루란과 혼합된 100% 산소(1 LPM)를 사용하고 턱톤 손실과 발가락 핀치에 대한 반응 상실로 마취 수준을 확인합니다.
- 제대로 삽관경우 가슴 운동은 인공호흡기와 동기화되어야 합니다.
- 부적절하게 삽관이 있으면 가슴 운동이 인공 호흡기와 동기화되지 않습니다. 부적절한 삽관을 테스트하려면 쥐의 복부를 압축하여 인공 호흡기에 역압을 생성하여 과압 경보를 생성합니다. 이 시나리오에서는, 부드럽게 협심증을 철회하고, 쥐가 충분히 마취하고 쥐를 다시 삽관되도록 몇 분 동안 5 % 이소플루란과 유도 챔버에 쥐를 반환합니다.
- 일단 제대로 삽관되면, 시술 중에 절착을 피하기 위해 4-0 실크 봉합사로 쥐의 뺨에 튜브의 근위 쪽 끝을 봉합하여 내구 튜브를 고정시됩니다.
- 직장 온도 프로브를 삽입하여 체온을 모니터링하고 4단자 심전도를 삽입하여 전체 절차 동안 심전도를 모니터링합니다.
- 수술 플랫폼의 열이 충분하지 않은 경우 오버헤드 가열 램프를 사용하십시오. 체온이 37 °C 이상으로 상승하면 램프를 끕니다.
- 심근 허혈의 부정맥 또는 징후를 위해 심전도를 시각적으로 평가합니다. 존재하지 않는 경우, 기준선 심전도를 기록하십시오.
- 기저부 심장 기능에 대한 흉부 심초음파(TTE)를 수행합니다(그림2A).
- 쥐를 척추 위치로 돌리고 흉부 왼쪽을 면도합니다. 명확한 에코 뷰를 얻으려면 제모 크림을 사용하여 머리카락을 제거하십시오.
- 높은 심박수 이미징을 위한 적절한 주파수를 가진 모든 초음파 시스템을 사용하십시오. 이 연구에서는 쥐의 심장 이미징에 적합한 21MHz 프로브가 있는 Visualsonics 2100 시스템을 사용했습니다.
- 왼쪽 심실 체적을 계산하기 위해 파라스테날 장거리 축 평면에서 B 모드 이미지를 가져옵니다. 동일한 평면에서 M 모드 이미지를 얻어 벽 치수를 측정합니다.
- 프로브를 90°로 돌리고 중간 유두 수준에서 B 모드 및 M 모드 파라스테른 단축 뷰를 얻어 단면 벽 치수를 측정합니다.
- 기저 선 진 이미징에 대한 심도 심초음파(TEE)를 수행합니다(그림2B).
- 오른쪽 입욕 위치에 쥐를 놓고 팁에 도포된 소량의 겔로 랫트의 식도에 8 Fr 심장 내 초음파 프로브(8 MHz)를 삽입합니다. ICE(심근 심초음파) 프로브의 빈도는 심장 박동당 4-6 프레임을 얻기에 충분하며, 이는 밸브 모션을 시각화하기에 충분합니다.
참고: GE 비비드 I 또는 지멘스 SC2000 프라임 시스템은 ICE 이미징에 사용할 수 있습니다. - 심장의 좌측의 2 챔버 뷰를 얻기 위해 높은 식도 뷰를 얻는다. 이 뷰는 좌심방, 승모판막 및 좌심실을 시각화하는 데 이상적입니다. 전방 및 후방 전단지가 시각화되고 coaptation이 중심이 되도록 프로브를 배치합니다. 이 각도는 또한 각도 보정없이 승모판에서 도플러 측정을 할 수 있습니다.
- 이 뷰에서 왼쪽 심방 영역 및 승모판 annulus 치수를 측정합니다.
- 컬러 도플러 이미징을 수행하여 기준선에서 밸브 능력과 MR 부족을 확인합니다. 맥박파와 연속파 도플러 이미징을 수행하여 승모판 유입을 정량화하고 역류 흐름의 부족을 확인합니다.
- 대동맥의 B 모드 및 펄스 파 도플러 이미징을 수행하여 대동맥 근직경을 측정하고 대동맥 흐름을 계산합니다.
- 폐 정맥의 펄스 파 도플러 이미징을 수행하여 폐 정맥 흐름을 측정합니다.
- 오른쪽 입욕 위치에 쥐를 놓고 팁에 도포된 소량의 겔로 랫트의 식도에 8 Fr 심장 내 초음파 프로브(8 MHz)를 삽입합니다. ICE(심근 심초음파) 프로브의 빈도는 심장 박동당 4-6 프레임을 얻기에 충분하며, 이는 밸브 모션을 시각화하기에 충분합니다.
- 카프로펜 (2.5 mg/kg, SQ, 비 스테로이드 항 염증), 겐타마이신 (6 mg / kg, SQ, 항생제) 및 멸균 식염수 (1 mL, SQ)의 단일 복용량을 주입하여 시술 중 혈액 손실을 선제적으로 보상하십시오.
- 수술 장에서 남은 머리카락을 제거하기 위해 필요에 따라 흉부 왼쪽을 면도하십시오. 아래 목 부위에서 자시푸스로 면도하고 왼쪽 팔에서 중간 흉골까지 면도하면 머리카락이없는 필드를 보장하고 수술 부위 오염의 위험을 줄이기에 충분해야합니다.
- 베타딘에 담근 거즈로 수술 부위를 닦은 다음 70 % 에탄올에 담근 거즈를 닦습니다. 거즈가 이전에 문질러진 부위에 접촉하지 않도록 피부에 원을 그리며 영역을 문지하십시오.
- 수술을 위한 적당하게 살균필드를 달성하기 위하여 이 단계를 세 번 반복하십시오.
- 멸균 커버로 동물을 드레이프하고 창문을 열어 멸균 수술 부위에 접근할 수 있습니다.
3. 왼쪽 소강절제술
- 무균 기술을 사용하여 전체 외과 적 수술을 수행, 이소플루란은 산소의 1 LPM에 2-2.5 %로 유지. 모든 악기를 멸균 트레이에 놓고 매번 사용한 후 다시 트레이에 놓습니다.
- 전체 절차에 대한 외과 의사에 의해 멸균 장갑, 마스크와 수술 모자를 착용. 멸균 수술 용 가운도 착용 할 수 있지만 오염이 예상되지 않는 한 선택 사항입니다.
- no #15 블레이드가있는 수술 용 메스를 사용하여 흉부 왼쪽에 피부 절개를 하고 자시포이드에 약 1cm 근접시합니다. 무딘 해부 팁 가위를 사용하여 피부 층을 근육 층에서 분리하고 세로 절개를합니다.
- 갈비뼈가 노출 될 때까지 같은 방식으로 근육 층을 해부.
- 조심스럽게 다섯 번째 늑간 공간에서 2-3cm 경막 절개를, 리트랙터를 삽입하고 심장을 노출하기에 적합합니다.
- 미세 한 팁 집게를 사용 하 여 심낭을 들어 올리고, 마이크로 가위는 심장의 정점을 둘러싼 지역에서 그것을 절제. 이 단계는 흉벽과 횡격막에 심장의 수술 후 유착을 방지하는 데 도움이됩니다.
참고: 출혈을 최소화하기 위해 흉골 에 가까운 수술 절개를 피하십시오. 흉골을 따라 달리는 내부 유방 동맥을 경시하면 과도한 출혈을 일으킬 수 있습니다. 그러한 출혈이 발생하면 출혈을 확인하고 소작하십시오.
4. 에코 가이드 MR 절차(그림 3 및 그림 4)
- 6-0 프롤렌 봉합사와 마이크로 니들 홀더를 사용하여 왼쪽 심실의 정점에 지갑 끈 봉합사를 놓습니다. 필요한 경우 마이크로 집게를 사용하여 심장을 안정시키게 하십시오.
- 정점을 안정화하기 위해 정점 봉합사를 부드럽게 밧줄로 묶고 지갑 끈 봉합사의 중앙에 23G 바늘 (식염수로 플러시하고 말단끝에 스톱콕)을 삽입하여 왼쪽 심실 구멍에 넣습니다.
- 한 손을 사용하여 바늘을 안정적으로 잡고 안내하고, 다른 한편으로는 전술한 바와 같이 바늘을 시각화하는 최적의 에코 뷰를 달성하기 위해 식도 에코 프로브를 동시에 조작한다.
- 실시간 초음파 안내를 통해 바늘을 전방 승모판 전단지의 심실 쪽으로 진행합니다. 초음파에서 바늘 위치가 확인되면 밸브 전단지를 통해 바늘을 한 번의 미세한 동작으로 진행합니다. 저항이 느껴지면 바늘을 전단지로 전진하여 천공하십시오.
참고: 바늘을 왼쪽 심방으로 너무 멀리 진행하면 좌심방 천강이 발생하여 과도한 출혈과 동물 사망을 초래할 수 있습니다. 바늘은 항상 초음파에 시각화해야합니다. - 승모판막에서 떨어진 좌심실 챔버로 바늘을 후퇴시키고 컬러 도플러 이미징을 켜서 MR을 확인합니다.
- 도플러 이미징에서 MR이 보이지 않으면 4.4 단계와 4.5단계를 반복합니다. 더 나은 뷰를 얻으려면 필요한 경우 에코 프로브를 조정합니다. 몇 마리의 쥐에서 연습한 후, 바늘의 한 동작으로 리플렛 펑크를 유도하여 바늘의 외직경의 크기인 구멍을 유도할 수 있다. 이것은 쥐 의 심장의 부검 후에 확인되었다.
- MR이 확인되면 왼쪽 심실 구멍에서 바늘을 철회하고 지갑 끈 봉합사를 부드럽게 묶습니다.
- 멸균 거즈를 사용하여 정점과 흉강 구멍에 혈액을 담그십시오.
참고: 수술용 장갑으로 에코 프로브를 만지면 멸균 환경이 오염될 수 있습니다. 장갑에 70% 에탄올을 뿌리거나 장갑을 새 장갑으로 적절하게 교체하십시오.
5. 동물 회복 및 수술 후 치료
- 안정된 심장 기능 (정상적인 심전도 및 심박수)의 5-10 분 후, 단계별 이소플루란을 줄이면서 4-0 vicryl로 층에서 흉부 절제술을 닫습니다.
- 중단된 봉합사를 사용하여 갈비뼈를 근사화하고 이소플루란을 2%로 유지합니다. 여섯 번째 늑간 공간에 가슴 튜브를 삽입하고 흉강 구멍으로 튜브의 실수로 발전을 방지하기 위해 멸균 커튼에 고정.
- 1.5 %로 유지 이소플루란으로 근육 층을 닫기 위해 연속 봉합사를 사용합니다.
- 이소플루란이 1%로 유지된 피부 층을 닫기 위해 연속 봉합사를 사용합니다.
- 10 mL Luer-lock 밸브 팁 주사기를 가슴 튜브에 연결하고 가슴 구멍에서 10-12 mL의 공기를 배출한 다음 가슴 튜브를 제거하십시오.
- 카프로펜의 최종 복용량을 관리 (2.5 mg/kg, SQ) 이소플루란을 해제.
- 쥐가 마취에서 잡초를 나는 동안 기계 환기를 계속, 활력 징후를 모니터링 (SpO2 및 심장 박동). 자발적인 호흡의 개시에, 그러한 호흡및 좋은 SpO2를유지하기 위하여 쥐의 기능을 시험하기 위하여 환기를 끕니다.
- SpO2 레벨이 90% 이하로 떨어지기 시작하면 인공호흡기를 켭니다. 일단 쥐가 환기 없이 SpO2 수준을 유지할 수 있게 되면, 안구절제 튜브에 고정 봉합사가 절단되고, 동물은 퇴출을 위해 준비된다.
- 쥐가 수염이나 눈 의 움직임을 포함한 경보의 징후를 보여주면, 동물을 extubate.
- 쥐가 외래가 될 때까지 100 % 산소로 코 콘을 놓습니다.
- 최소한의 침구로 깨끗한 케이지로 쥐를 옮기고 쥐가 외래될 때까지 쥐의 발이나 꼬리에 놓인 휴대용 SpO2 모니터를 사용하여 활력 징후를 계속 모니터링합니다.
참고: 수술로 인한 부작용이 관찰되면 동물은 회복 시간이 길어질 수 있으며 높은 SpO2 수준을 유지하는 데 더 오래 걸릴 수 있습니다. 이 경우 SpO2 수준이 안정될 때까지 100% 산소를 가진 코 콘을 적용할 수 있습니다. - 수술 부위에 부상의 위험을 줄이고 감염의 위험을 피하기 위해, 수술 후 단일 집 쥐.
- 쥐가 깨어 있고 충분히 외래 후 3 시간 이내에 Buprenorphine을 관리합니다. Buprenorphine 는 perioperative 복구 기간에 일찌기 관리될 때 호흡 고민을 일으키는 원인이 될 수 있습니다, 따라서 쥐가 어려움 없이 호흡할 때까지 그것을 연기합니다.
- 수술 후, 모든 동물은 다음과 같은 약물을받습니다 : gentamicin (6 mg / kg, SQ, SID POD 1-3) 및 리마딜 (5 mg / kg, SQ, SID POD 1-3). 모든 동물은 절개 부위의 검사를 위해 수술 후 5 일 동안 매일 한 번 관찰되고, 통증 평가를 위해 수술 후 처음 2 주 동안 매일 한 번 관찰됩니다.
6. 심초음파를 통한 MR 심각도 검증(그림 5)
- 수술 후 2주 후에 2.7절에 명시된 것과 동일한 단계를 사용하여 TEE를 반복합니다. 수술 후 2 주 혈역학이 안정화될 적절한 시간입니다.
- 좌심실 과 좌심방 을 시각화, 식도 초음파 이미징을 사용하여 2 챔버 보기에 색상 도플러 이미징을 가져옵니다. 왼쪽 아트리움과 MR 제트의 면적을 측정합니다. 를 사용하여 MR 제트 영역 분수를 계산합니다.
 (1)
(1)
심한 MR은 MR 제트 영역 ≥ 30%로 정의된다. - 바늘의 외경을 사용하여 23G 바늘의 면적을 계산하여 역류성 오리피스의 면적을 근사화합니다. 이 방정식은 역류성 오리피스의 면적이 23G 바늘의 면적과 동일하다고 가정합니다.
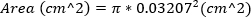 (2)
(2) - 역류 제트의 오리피스에서 도플러 게이트로 연속 파동 도플러 이미징을 가져옵니다. 파형을 추적하여 역류제트의 VTI를 계산합니다. MR 볼륨을 사용하여 추정할 수 있습니다.
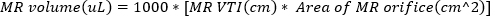 (3)
(3)
심한 MR은 MR 부피 ≥ 95 μL로 정의된다. - 에코 프로브를 시계 방향으로 회전시켜 폐 정맥의 펄스파 도플러 이미징을 가져옵니다. 수축기 및 확장기 파동 속도를 측정하고 다음 방정식을 사용하여 비율을 계산합니다.
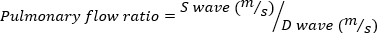 (4)
(4)
음의 폐 유량은 심한 MR을 나타냅니다.
7. 샴 수술
- 설명된 대로 섹션 1-3을 수행합니다.
- 개질부 4는 23G 바늘이 좌심실 실내로 삽입되도록 수정하였고, 좌심실 정점에 지갑 끈 봉합사를 통해, 승모판막내로 진행되지 는 않았지만 MR. 바늘을 좌심실 챔버에 삽입하고 즉시 후퇴시키고, 심실 정점의 조임 및 폐쇄에 의해 후퇴시켰다.
- 설명된 대로 섹션 5를 수행합니다.
- 섹션 6에 설명된 대로 승모판 판막 평가를 수행합니다. 그러나, MR은 어떠한 동물에도 존재해서는 안 되며, 따라서 설명된 바와 같은 정량화는 필요하지 않다.
결과
타당성 및 재현성
제안된 MR 모형은 이 연구 결과에서 사용된 쥐의 100%에서 달성된 승모판 전단지에 있는 잘 정의된 구멍과 더불어 높게 재현성이 있습니다. 그림 6A는 승모판막에 삽입되는 바늘의 방향을 묘사합니다. 도 6B는 시술 후 2주에 이식된 대표적인 쥐로부터 승모판 막 전단지에 ?...
토론
좋은 생존 (수술 후 93.75 % 생존)과 상당한 수술 후 합병증없이 심각한 MR의 재현 설치류 모델이보고됩니다. 경식도 심초음파를 통해 실시간 이미징과 승모판 전단지를 뚫기 위해 박동하는 심장에 바늘을 도입하는 것은 가능하며 가르칠 수 있습니다. 가혹한 MR은 더 작거나 더 큰 바늘을 사용하여 원하는 대로 변화될 수 있는 이 연구에서 23 G 바늘 크기로 생성되었다. 이 모형에서 유도된 MR은 좌심실?...
공개
M.P는 심장 수리 기술 (HRT)의 고문이며 컨설팅 비용을 받았습니다. HRT는 이 연구에서 어떤 역할도 하지 않았으며, 이 연구를 지원하기 위한 자금도 제공하지 않았습니다.
감사의 말
이 작품은 미국 심장 협회에서 D에 교부금 19PRE3380625 및 14SDG20380081에 의해 지원되었다. 코포란과 M. 파달라는 각각 HL135145, HL133667, HL140325를 국립보건원에서 M. 파다라로, 에모리 대학 병원 미드타운의 칼라일 프레이저 하트 센터에서 M. 파달라에 이르는 인프라 자금을 지원한다.
자료
| Name | Company | Catalog Number | Comments |
| 23G needle | Mckesson | 16-N231 | |
| 25G needle, 5/8 inch | McKesson | 1031797 | |
| 4-0 vicryl | Ethicon | J496H | |
| 6-0 prolene | Ethicon | 8307H | |
| 70% ethanol | McKesson | 350600 | |
| ACE Light Source | Schott | A20500 | |
| ACUSON AcuNav Ultrasound probe | Biosense Webster | 10135936 | 8Fr Intracardiac echo probe |
| ACUSON PRIME Ultrasound System | Siemens | SC2000 | |
| Betadine | McKesson | 1073829 | |
| Blunted microdissecting scissors | Roboz | RS5990 | |
| Buprenorphine | Patterson Veterinary | 99628 | |
| Carprofen | Patterson Veterinary | 7847425 | |
| Chest tube (16G angiocath) | Terumo | SR-OX1651CA | |
| Disposable Surgical drapes | Med-Vet | SMS40 | |
| Electric Razor | Oster | 78400-XXX | |
| Gentamycin | Patterson Veterinary | 78057791 | |
| Heat lamp with table clamp | Braintree Scientific | HL-1 120V | |
| Hemostatic forceps, curved | Roboz | RS7341 | |
| Hemostatic forceps, straight | Roboz | RS7110 | |
| Induction chamber | Braintree Scientific | EZ-1785 | |
| Injection Plug, Cap, Luer Lock | Exel | 26539 | |
| Isoflurane | Patterson Veterinary | 6679401725 | |
| Mechanical ventilator | Harvard Apparatus | Inspira ASV | |
| Microdissecting forceps | Roboz | RS5135 | |
| Microdissecting spring scissors | Roboz | RS5603 | |
| Needle holder | Roboz | RS6417 | |
| No. 15 surgical blade | McKesson | 1642 | |
| Non-woven sponges | McKesson | 446036 | |
| Otoscope | Welch Allyn | 23862 | |
| Oxygen | Airgas Healthcare | UN1072 | |
| Pulse Oximeter | Nonin Medical | 2500A VET | |
| Retractor, Blunt 4x4 | Roboz | RS6524 | |
| Rodent Surgical Monitor | Indus Instruments | 113970 | The integrated platform allows for monitoring of vital signs and surgical warming |
| Scale | Salter Brecknell | LPS 150 | |
| Scalpel Handle | Roboz | RS9843 | |
| Silk suture 3-0 | McKesson | 220263 | |
| Small Animal Anesthesia System | Ohio Medical | AKDL03882 | |
| Sterile saline (0.9%) | Baxter | 281322 | |
| Sugical Mask | McKesson | 188696 | |
| Surgical cap | McKesson | 852952 | |
| Surgical gloves | McKesson | 854486 | |
| Syringe 10mL | McKesson | 1031801 | |
| Syringe 1mL | McKesson | 1031817 | |
| Ultra-high frequency probe | Fujifilm Visualsonics | MS250 | |
| Ultrasound gel | McKesson | 150690 | |
| VEVO Ultrasound System | Fujifilm Visualsonics | VEVO 2100 |
참고문헌
- Nkomo, V. T., et al. Burden of valvular heart diseases: a population-based study. Lancet. 368 (9540), 1005-1011 (2006).
- Zamorano, J. L., et al. Mechanism and Severity of Mitral Regurgitation: Are There any Differences Between Primary and Secondary Mitral Regurgitation?. The Journal of Heart Valve Disease. 25 (6), 724-729 (2016).
- Grossman, W., Jones, D., McLaurin, L. P. Wall stress and patterns of hypertrophy in the human left ventricle. Journal of Clinical Investigation. 56 (1), 56-64 (1975).
- Carabello, B. A. Concentric versus eccentric remodeling. Journal of Cardiac Failure. 8 (6), S258-S263 (2002).
- Braunwald, E., Welch, G. H., Sarnoff, S. J. Hemodynamic effects of quantitatively varied experimental mitral regurgitation. Circulation Research. 5 (5), 539-545 (1957).
- Sasayama, S., Kubo, S., Kusukawa, R. Hemodynamic and angiocardiographic studies on cardiodynamics: experimental mitral insufficiency. Japanese Circulation Journal. 34 (6), 513-530 (1970).
- Hennein, H., Jones, M., Stone, C., Clark, R. Left ventricular function in experimental mitral regurgitation with intact chordae tendineae. Journal of Thoracic and Cardiovascular Surgery. 105 (4), 624-632 (1993).
- Stumpe, K. O., Sölle, H., Klein, H., Krück, F. Mechanism of sodium and water retention in rats with experimental heart failure. Kidney International. 4 (5), 309-317 (1973).
- Abassi, Z., Goltsman, I., Karram, T., Winaver, J., Hoffman, A. Aortocaval fistula in rat: A unique model of volume-overload congestive heart failure and cardiac hypertrophy. Journal of Biomedicine and Biotechnology. 2011 (January), 1-13 (2011).
- Corporan, D., Onohara, D., Hernandez-Merlo, R., Sielicka, A., Padala, M. Temporal changes in myocardial collagen, matrix metalloproteinases, and their tissue inhibitors in the left ventricular myocardium in experimental chronic mitral regurgitation in rodents. American Journal of Physiology - Heart and Circulatory Physiology. 315 (5), H1269-H1278 (2018).
- Onohara, D., Corporan, D., Hernandez-Merlo, R., Guyton, R. A., Padala, M. Mitral Regurgitation Worsens Cardiac Remodeling in Ischemic Cardiomyopathy in an Experimental Model. The Journal of Thoracic and Cardiovascular Surgery. , (2019).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovascular Research. 24 (5), 430-432 (1990).
- Brower, G. L., Janicki, J. S. Contribution of ventricular remodeling to pathogenesis of heart failure in rats. American Journal of Physiology-Heart and Circulatory Physiology. 280 (2), H674-H683 (2001).
- McCutcheon, K., et al. Dynamic changes in the molecular signature of adverse left ventricular remodeling in patients with compensated and decompensated chronic primary mitral regurgitation. Circulation Heart Failure. 12 (9), (2019).
- McCutcheon, K., Manga, P. Left ventricular remodeling in chronic primary mitral regurgitation. Cardiovascular Journal of Africa. 29 (1), 51-64 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유