Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un modelo murino inducido por doxorrubicina de miocardiopatía dilatada in vivo
En este artículo
Erratum Notice
Resumen
Se describe un protocolo para establecer un modelo de miocardiopatía dilatada (MCD) inducida por doxorrubicina en ratones mediante inyección intraperitoneal a largo plazo de doxorrubicina.
Resumen
La miocardiopatía dilatada (MCD) se refiere a un espectro de trastornos miocárdicos heterogéneos caracterizados por dilatación ventricular y rendimiento cardíaco deprimido en ausencia de hipertensión, enfermedades cardíacas valvulares, congénitas o isquémicas, y que pueden estar relacionados con infecciones, anomalías autoinmunes o metabólicas, o herencia familiar. Puede progresar a insuficiencia cardíaca congestiva con un mal pronóstico. La doxorrubicina (Dox) se emplea ampliamente como un fármaco quimioterapéutico, pero su uso es limitado porque causa cambios similares a la DCM del miocardio. Su toxicidad miocárdica se atribuye al estrés oxidativo, la inflamación crónica y la apoptosis cardiomiocita. No se ha establecido un modelo de DCM que explote estos síntomas de DCM inducidos por Dox.
Introducción
Una de las causas más comunes de insuficiencia cardíaca, la DCM se caracteriza por la dilatación ventricular y la disminución de la función cardíaca y es la razón más común para el trasplante de corazón en todo el mundo1. Para investigar más a fondo su patogénesis y encontrar tratamientos efectivos, el acceso a modelos animales maduros es especialmente importante. El propósito de los experimentos descritos es establecer un modelo de ratón estable de DCM que se asemeje al DCM humano.
Debido a la compleja patogénesis de DCM, hay muchos métodos diferentes para hacer modelos animales correspondientes. Los modelos2 de DCM espontáneos son relativamente estables, pero son caros y no están fácilmente disponibles. Los modelos animales modificados genéticamente3 no están bien establecidos y requieren un uso más experimental. Los modelos animales DCM inducidos por infección viral4 o defectos autoinmunes5 son fáciles de obtener, pero no son totalmente representativos de DCM. Los modelos asociados con la toxicidad miocárdica incluyen modelos DCM inducidos por alcohol y modelos animales DCM inducidos por Dox.
El modelo de miocardiopatía inducida por Dox se obtiene mediante inyección intraperitoneal de Dox6. El modelo explota el efecto secundario crónico más grave de Dox: Después de la exposición a Dox, los pacientes desarrollan síntomas de DCM de inicio tardío con uniformidad clínica7. El estrés oxidativo inducido por Dox8 y el daño mitocondrial9,que conducen a la apoptosis de los cardiomiocitos, son síntomas en la patogénesis de dcM. Existen modelos de tratamiento dox agudo y crónico: una sola dosis alta de Dox (15 mg/kg) induce un modelo a corto plazo para la miocardiopatía10,mientras que las inyecciones repetitivas de Dox en dosis bajas (seis semanales, 3 mg/kg) inducen un modelo a largo plazo para la miocardiopatía11. Según el estudio presentado, los ratones de tipo salvaje inyectados por vía intraperitoneal una vez a la semana durante un mes a una dosis de 5 mg / kg muestran morfología e histología del corazón consistentes con las características de DCM al final del tratamiento, proporcionando una forma ideal de establecer un modelo de DCM.
Protocolo
Los experimentos con animales fueron aprobados por el Comité Institucional de Cuidado y Uso de Animales (IACUC) del Hospital Nanjing Drum Tower.
1. Preparación de los reactivos y animales
- Disolver el clorhidrato de doxorrubicina (Pfizer, EE.UU.) en agua esterilizada. Vórtice para obtener una solución Dox de 1 mg/ml y mantener a 4 °C.
- Use ratones C57BL/6 (8–10 semanas de edad; 25–30 g de peso). Para este estudio, los ratones fueron comprados en el Centro de Investigación de Animales Modelo de la Universidad de Nanjing y mantenidos en la sala de animales del Hospital nanjing Drum Tower.
- Las jaulas de ratones libres de patógenos se mantuvieron bajo un ciclo de luz/oscuridad de 12 h a una temperatura constante de 23 °C. Todos los animales fueron alimentados con una dieta normal de chow y recibieron comida y agua ad libitum.
2. Establecimiento del modelo animal DCM
- Aleatorizar ratones en un grupo normal (n = 5) y Dox (n = 5).
- Administrar la solución dox por vía intraperitoneal a una dosis de 5 mg/kg utilizando una jeringa esterilizada de 1 ml 1 veces a la semana para el grupo Dox. Trate a los ratones de control de la misma manera con la misma cantidad de solución salina.
- Mida el peso corporal de los dos grupos semanalmente. En consecuencia, ajuste la dosis de inyección en función del peso corporal semanalmente durante un total de 4 semanas, con una dosis acumulada de 20 mg / kg (Figura 1).
NOTA: Se eligió un período de tiempo de 4 semanas porque la ecocardiografía a las 4 semanas mostró una diferencia significativa en la función cardíaca entre los dos grupos.
3. Examen ecocardiográfico
- Al final de la cuarta semana, realice un examen ecocardiográfico de los ratones.
- Anestesiar a los ratones con 2% de isoflurano por vía intranasal. Si los ratones no responden a una pizca de la piel con una pinza dentada o estimulando los dedos de los pies y la cola, continúe con el protocolo.
- Coloque el ratón en una plataforma de manipulación de animales en posición supina. Para mantener la anestesia, cubra la nariz y la boca del animal con un cono nasal y administre isoflurano al 2%.
NOTA: Para la anestesia IP, inyecte hidrato de cloral al 4% a una dosis de 0,2 ml/20 g. - Retire el pelaje del pecho con cuidado con una afeitadora eléctrica. Evaluar la función cardíaca in vivo mediante ecocardiografía transtorácica.
- Realizar el ecocardiograma del VI tanto en las vistas paraesternales de eje largo como de eje corto a una velocidad de fotogramas de 233 Hz. Las dimensiones sistólicas finales y diastólicas finales se definieron como las fases correspondientes a la onda T del ECG y a la onda R, respectivamente.
- En los trazados en modo M, mida el diámetro sistólico final del VI promedio (LVIDd), el diámetro diastólico final del VI (LVID), el grosor septal interventricular (IVS) y el grosor de la pared posterior del VI (LVPW) de 3 a 5 latidos cardíacos. También calcule la fracción de eyección (EF) y el acortamiento de fracción (FS) en función de la ecocardiografía.
4. Tinción histológica
- Después del análisis ecocardiográfico, sacrificar a los ratones mediante inyección intraventricular de cloruro de potasio al 10%.
- Perfundir el corazón con aproximadamente 30 ml de solución salina después de la disección hasta que el hígado y el pulmón se vuelvan pálidos.
- Extirpe el corazón y lávelo a fondo en una solución tampón de fosfato para extruir la sangre.
- Fije el corazón en formalina al 4% a temperatura ambiente durante 24 h y trate el tejido en una caja de parafina para que la cera de parafina se enfríe y se solidifique.
- Cortar los corazones en rodajas de 5 μm de grosor para la tinción patológica.
- Desparar y rehidratar secciones que contengan músculo papilar.
- Incubar portaobjetos a 55 °C durante 30 min. Luego, incubar en xileno 2x durante 2 min cada uno; 100% etanol 2x durante 2 min cada uno; 95% de etanol 2x durante 2 min cada uno; 80% de etanol durante 2 min; 75% de etanol durante 2 min; y etanol al 50% durante 2 min.
- Tinción con hematoxilina y eosina (H&E), así como la tinción de Masson.
Resultados
Función cardíaca
La miocardiopatía dilatada se caracteriza por dilatación ventricular progresiva y disfunción contráctil. La Figura 2 muestra imágenes ecocardiográficas representativas de los dos grupos. Los ratones tratados con Dox mostraron una fracción de eyección del ventrículo izquierdo marcadamente reducida y acortamiento fraccional del ventrículo izquierdo(Figura 3A,B). El diámetro del VI también aumentó...
Discusión
Dox es un fármaco antitumoral antitumoral inespecífico de uso común en la práctica clínica12. Su principal efecto secundario es la cardiotoxicidad, caracterizada por miocardiopatía y posterior insuficiencia cardíaca13. El mecanismo subyacente incluye el daño de la peroxidación lipídica miocárdica, la inhibición del retículo sarcoplásmico miocárdico Ca2+-ATPasa y la activación del sistema miocárdico local de renina-angiotensina, lo que resulta en ...
Divulgaciones
No se declaran conflictos de intereses.
Agradecimientos
Este trabajo fue apoyado por Key Project Medical Science and Technology Development Foundation, Nanjing Department of Health (No.YKK16098).
Materiales
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde | servicebio | CAS30525-89-4 | |
| C57BL/6 mice | Model Animal Research Center of Nanjing University | \ | |
| Doxorubicin hydrochloride | Pfizer | CAS25316-40-9 | |
| echocardiography | Visualsonics | \ | |
| Hematoxylin and Eosin staining kit | Solarbio | G1120 | |
| Masson staining kit | Solarbio | G1343 | |
| phosphate buffer solution | Sigma | P5368 | |
| potassium chloride | Sigma | CAS7447-40-7 | |
| sterilized syringe | Millipore | SLGP033RB |
Referencias
- Weintraub, R. G., Semsarian, C., MacDonald, P. Dilated cardiomyopathy. Lancet. 390 (10092), 400-414 (2017).
- Ichihara, S., et al. Attenuation of oxidative stress and cardiac dysfunction by bisoprolol in an animal model of dilated cardiomyopathy. Biochemical and Biophysical Research Communications. 350 (1), 105-113 (2006).
- Fountoulakis, M., et al. Alterations in the heart mitochondrial proteome in a desmin null heart failure model. Journal of Molecular and Cellular Cardiology. 38 (3), 461-474 (2005).
- Fairweather, D., Rose, N. R. Coxsackievirus-induced myocarditis in mice: a model of autoimmune disease for studying immunotoxicity. Methods. 41 (1), 118-122 (2007).
- Wang, Z. H., et al. A therapeutic anti-CD4 monoclonal antibody inhibits T cell receptor signal transduction in mouse autoimmune cardiomyopathy. Chinese Medical Journal. 120 (15), 1319-1325 (2007).
- Riad, A., et al. Toll-like receptor-4 deficiency attenuates doxorubicin-induced cardiomyopathy in mice. European Journal of Heart Failure. 10 (3), 233-243 (2008).
- Kankeu, C., Clarke, K., Passante, E., Huber, H. J. Doxorubicin-induced chronic dilated cardiomyopathy-the apoptosis hypothesis revisited. Journal of Molecular Medicine. 95 (3), 239-248 (2017).
- Zhao, L., et al. MicroRNA-140-5p aggravates doxorubicin-induced cardiotoxicity by promoting myocardial oxidative stress via targeting Nrf2 and Sirt2. Redox Biology. 15, 284-296 (2018).
- O'Connell, J. L., et al. Short-term and long-term models of doxorubicin-induced cardiomyopathy in rats: A comparison of functional and histopathological changes. Experimental and Toxicologic Pathology. 69 (4), 213-219 (2017).
- Yuan, Y. P., et al. CTRP3 protected against doxorubicin-induced cardiac dysfunction, inflammation and cell death via activation of Sirt1. Journal of Molecular and Cellular Cardiology. 114, 38-47 (2018).
- Sun, Z., et al. The TGF-beta pathway mediates doxorubicin effects on cardiac endothelial cells. Journal of Molecular and Cellular Cardiology. 90, 129-138 (2016).
- Minotti, G., Menna, P., Salvatorelli, E., Cairo, G., Gianni, L. Anthracyclines: molecular advances and pharmacologic developments in antitumor activity and cardiotoxicity. Pharmacological Reviews. 56 (2), 185-229 (2004).
- Vejpongsa, P., Yeh, E. T. Prevention of anthracycline-induced cardiotoxicity: challenges and opportunities. Journal of The American College of Cardiology. 64 (9), 938-945 (2014).
- Renu, K., V, G. A., P, B. T., Arunachalam, S. Molecular mechanism of doxorubicin-induced cardiomyopathy - An update. European Journal of Pharmacology. 818, 241-253 (2018).
Erratum
Formal Correction: Erratum: A Doxorubicin-Induced Murine Model of Dilated Cardiomyopathy In Vivo
Posted by JoVE Editors on 11/04/2021. Citeable Link.
An erratum was issued for: A Doxorubicin-Induced Murine Model of Dilated Cardiomyopathy In Vivo. A figure was updated.
Figure 1 was updated from:
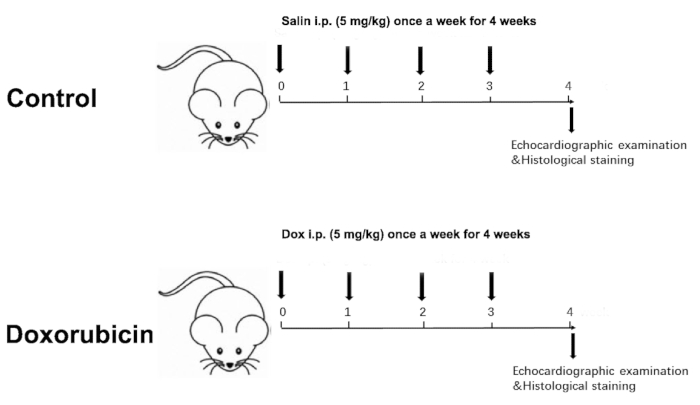
Figure 1: Schematic diagram of a Dox-induced dilated cardiomyopathy. Please click here to view a larger version of this figure.
to:
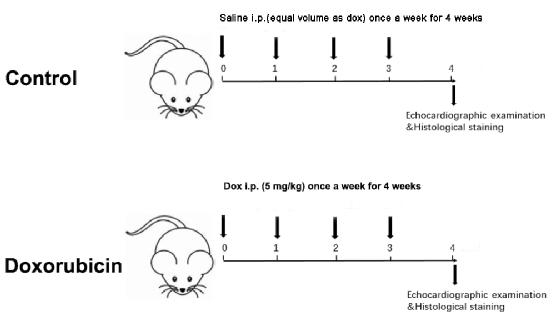
Figure 1: Schematic diagram of a Dox-induced dilated cardiomyopathy. Please click here to view a larger version of this figure.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados