A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
דגם מורין המושרה על ידי דוקסורוביצין של קרדיומיופתיה מונפשת ב- Vivo
In This Article
Erratum Notice
Summary
מתואר הוא פרוטוקול כדי להקים דוקסורוביצין המושרה קרדיומיופתיה המושרה (DCM) מודל בעכברים באמצעות הזרקה תוך-פטרייתונית לטווח ארוך של Doxorubicin.
Abstract
קרדיומיופתיה מורחבת (DCM) מתייחסת לספקטרום של הפרעות שריר הלב הטרוגניות המאופיינת בהרחבת חדרי הלב וביצועי לב מדוכאים בהיעדר יתר לחץ דם, valvular, מולד, או איסכמי מחלות לב, אשר עשוי להיות קשור לזיהום, הפרעות אוטואימוניות או מטבוליות, או ירושה משפחתית. זה יכול להתקדם לתוך אי ספיקת לב עם פרוגנוזה גרועה. Doxorubicin (Dox) מועסק באופן נרחב כסם כימותרפי, אך השימוש בו מוגבל מכיוון שהוא גורם לשינויים דמויי DCM של שריר הלב. רעילות שריר הלב שלה מיוחסת עקה חמצונית, דלקת כרונית, אפופטוזיס cardiomyocyte. מודל של DCM ניצול אלה סימפטומים DCM הנגרמת Dox לא הוקם.
Introduction
אחד הגורמים הנפוצים ביותר לאי ספיקת לב, DCM מאופיין בהרחבת חדרית וירידה בתפקוד הלב והיא הסיבה הנפוצה ביותר להשתלת לב ברחבי העולם1. על מנת להמשיך לחקור את הפתוגנזה שלה ולמצוא טיפולים יעילים, גישה למודלים בעלי חיים בוגרים חשובה במיוחד. מטרת הניסויים המתוארים היא ליצור מודל עכבר יציב של DCM הדומה ל- DCM אנושי.
בשל הפתוגנזה המורכבת של DCM, ישנן שיטות רבות ושונות כדי להפוך מודלים בעלי חיים מתאימים. דגמי DCM ספונטניים2 יציבים יחסית, אך הם יקרים ולא זמינים בקלות. מודלים בעלי חיים מהונדסים גנטית3 אינם מבוססים היטב ודורשים שימוש ניסיוני יותר. מודלים בעלי חיים DCM המושרה על ידי זיהום ויראלי4 או פגמים אוטואימוניות5 קל להשיג, אבל הם לא מייצגים לחלוטין של DCM. מודלים הקשורים רעילות שריר הלב כוללים מודלים DCM הנגרמים מאלכוהול ומודלים בעלי חיים DCM המושרה Dox.
מודל קרדיומיופתיה המושרה דוקס מתקבל על ידי הזרקה תוך-איפריטונית של Dox6. המודל מנצל את תופעת הלוואי הכרונית החמורה ביותר של Dox: לאחר חשיפה של Dox, חולים לפתח סימפטומים DCM 12et מאוחר עם אחידות קלינית7. דוקס-המושרה סטרס חמצוני8 ונזק מיטוכונדריאלי9, אשר מובילים אפופטוזיס cardiomyocyte, הם סימפטומים בפתוגנזה של DCM. ישנם מודלים טיפול דוק אקוטי וכרוני: מינון גבוה יחיד של Dox (15 מ"ג/ק"ג) מעורר מודל לטווח קצר עבור קרדיומיופתיה10, בעוד זריקות דוקס במינון נמוך חוזרות ונשנות (שש שבועיות, 3 מ"ג/ קילוגרם) לגרום מודל לטווח ארוך עבור קרדיומיופתיה11. בהתבסס על המחקר שהוצג, עכברי סוג בר מוזרק תוך אלפיציונלי פעם בשבוע במשך חודש במינון של 5 מ"ג / קילוגרם תצוגה מורפולוגיה והיסתולוגיה של הלב עולה בקנה אחד עם המאפיינים של DCM עד סוף הטיפול, מתן דרך אידיאלית להקים מודל DCM.
Protocol
ניסויים בבעלי חיים אושרו על ידי הוועדה המוסדית לטיפול בבעלי חיים ושימוש (IACUC) של בית החולים מגדל התוף נאנג'ינג.
1. הכנת ריאגנטים ובעלי חיים
- להמיס דוקסורוביצין הידרוכלוריד (פייזר, ארה"ב) במים מעוקרים. מערבולת כדי להשיג פתרון דוקס של 1 מ"ג / מ"ל ולשמור על 4 °C (70 °F).
- השתמש C57BL / 6 עכברים (8-10 שבועות; 25-30 גרם משקל). לצורך מחקר זה, עכברים נרכשו מהמרכז לחקר בעלי חיים מודל של אוניברסיטת נאנג'ינג ונשמרו בחדר החיות של בית החולים מגדל התוף נאנג'ינג.
- כלובי עכברים ללא פתוגן נשמרו תחת מחזור בהיר / כהה 12 שעות בטמפרטורה קבועה של 23 °C (70 °F). כל בעלי החיים ניזונים מדיאטת צ'או רגילה וקיבלו מזון ומים עד ליביטום.
2. הקמת מודל בעלי חיים DCM
- הפוך עכברים לקבוצה רגילה (n = 5) ולקבוצה דוקס (n = 5).
- לנהל את פתרון Dox תוך-פרטי באופן תוך-זמני במינון של 5 מ"ג/ק"ג באמצעות מזרק מעוקר 1 מ"ל 1x בשבוע עבור קבוצת Dox. לטפל בעכברים בקרה באותו אופן עם אותה כמות של תמיסת מלח.
- למדוד את משקל הגוף של שתי הקבוצות בשבוע. בהתאם, להתאים את מינון ההזרקה בהתבסס על משקל הגוף מדי שבוע במשך סך של 4 שבועות, עם מינון מצטבר של 20 מ"ג/ קילוגרם (איור 1).
הערה: פרק זמן של 4 שבועות נבחר כי אקוקרדיוגרפיה ב 4 שבועות הראה הבדל משמעותי בתפקוד הלב בין שתי הקבוצות.
3. בחינה אקוקרדיוגרפית
- בסוף השבוע הרביעי, לערוך בדיקה אקוקרדיוגרפית של העכברים.
- להרידים את העכברים עם 2% איזופלוריין תוך גולגולתי. אם העכברים אינם מגיבים קמצוץ של העור עם פינצטה שיניים או מגרה את בהונות וזנבות, להמשיך עם הפרוטוקול.
- הנח את העכבר על פלטפורמה לטיפול בבעלי חיים בתנוחה העגמה. כדי לשמור על ההרדמה, לכסות את האף והפה של החיה עם חרוט האף ולספק 2% איזופלורן.
הערה: עבור הרדמה IP, להזריק 4% הידרציה כלורל במינון של 0.2 מ"ל / 20 גרם. - הסר פרוות חזה בזהירות עם מכונת גילוח חשמלית. להעריך את תפקוד הלב ב vivo באמצעות אקו-קרדיוגרפיה טרנסתורקטית.
- בצע את ההד-לב של LV הן בתצוגות ציר ארוך-צירי והן בתצוגות קצרות ציר בקצב פריימים של 233 הרץ. הממדים הסופיים-סיסטוליים והדיאסטוליים הסופיים הוגדרו כשלבים המתאימים לגל ה- ECG T ולגל ה- R, בהתאמה.
- במעקבי מצב M, מדוד את הקוטר הסיסטולי הממוצע של LV (LVIDd), קוטר קצה-דיאסטולי של LV (LVIDs), עובי מחיצה בין-חדרי (IVS) ועובי הקיר האחורי של LV (LVPW) מפעימות לב של 3-5. חשב גם את שבר הפליטה (EF) וקיצור השבר (FS) בהתבסס על אקו-קרדיוגרפיה.
4. כתמים היסתולוגיים
- לאחר הניתוח echocardiographic, להקריב את העכברים על ידי הזרקה תוך חדרית של 10% אשלגן כלורי.
- לטפס את הלב עם כ 30 מ"ל של תמיסת מלח לאחר הניתוח עד הכבד והריאה להיות חיוור.
- Excise את הלב ביסודיות לשטוף אותו בתמיסת חוצץ פוספט כדי להלל דם.
- תקן את הלב ב 4% פורמלין בטמפרטורת החדר במשך 24 שעות ולטפל ברקמה בקופסת פרפין, כך שעוות פרפין מתקררת ומתמצק.
- חותכים את הלבבות לפרוסות בעובי 5 מיקרומטר להכתמה פתולוגית.
- Dewax ו rehydrate חלקים המכילים שריר הפפילרי.
- מגלשות דגירה ב 55 °C (55 °F) במשך 30 דקות. לאחר מכן, דגירה קסילן 2x במשך 2 דקות כל אחד; 100% אתנול 2x במשך 2 דקות כל אחד; 95% אתנול 2x במשך 2 דקות כל אחד; 80% אתנול במשך 2 דקות; 75% אתנול במשך 2 דקות; ו-50% אתנול ל-2 דקות.
- כתם באמצעות המטוקסילין ואוסין (H&E) כמו גם הכתם של מאסון.
תוצאות
תפקוד הלב
קרדיומיופתיה מתרחבת מאופיינת בהרחבת חדרים מתקדמת ותפקוד לקוי של התכווצות. איור 2 מציג תמונות אקו-קרדיוגרפיות מייצגות של שתי הקבוצות. עכברים שטופלו בדוקס הראו שבר פליטה מופחת משמעותית של החדר השמאלי וקיצור חלקי חדר שמאלי(איור 3A,B).
Discussion
Dox היא תרופה אנטי-טמורית תקופתית לא-מדעית הנפוצה בפרקטיקה קלינית12. תופעת הלוואי העיקרית שלה היא cardiotoxicity, המאופיינת על ידי קרדיומיופתיה ואי ספיקת לב לאחר מכן13. המנגנון הבסיסי כולל נזק של peroxidation השומנים שריר הלב, עיכוב של רשתית סרקופלסמית שריר הלב Ca2 +- ATPase, והפ...
Disclosures
לא הוכרזו ניגודי אינטרסים.
Acknowledgements
עבודה זו נתמכה על ידי הקרן לפיתוח מדע וטכנולוגיה של פרויקט מפתח, מחלקת הבריאות של נאנג'ינג (No.YKK16098).
Materials
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde | servicebio | CAS30525-89-4 | |
| C57BL/6 mice | Model Animal Research Center of Nanjing University | \ | |
| Doxorubicin hydrochloride | Pfizer | CAS25316-40-9 | |
| echocardiography | Visualsonics | \ | |
| Hematoxylin and Eosin staining kit | Solarbio | G1120 | |
| Masson staining kit | Solarbio | G1343 | |
| phosphate buffer solution | Sigma | P5368 | |
| potassium chloride | Sigma | CAS7447-40-7 | |
| sterilized syringe | Millipore | SLGP033RB |
References
- Weintraub, R. G., Semsarian, C., MacDonald, P. Dilated cardiomyopathy. Lancet. 390 (10092), 400-414 (2017).
- Ichihara, S., et al. Attenuation of oxidative stress and cardiac dysfunction by bisoprolol in an animal model of dilated cardiomyopathy. Biochemical and Biophysical Research Communications. 350 (1), 105-113 (2006).
- Fountoulakis, M., et al. Alterations in the heart mitochondrial proteome in a desmin null heart failure model. Journal of Molecular and Cellular Cardiology. 38 (3), 461-474 (2005).
- Fairweather, D., Rose, N. R. Coxsackievirus-induced myocarditis in mice: a model of autoimmune disease for studying immunotoxicity. Methods. 41 (1), 118-122 (2007).
- Wang, Z. H., et al. A therapeutic anti-CD4 monoclonal antibody inhibits T cell receptor signal transduction in mouse autoimmune cardiomyopathy. Chinese Medical Journal. 120 (15), 1319-1325 (2007).
- Riad, A., et al. Toll-like receptor-4 deficiency attenuates doxorubicin-induced cardiomyopathy in mice. European Journal of Heart Failure. 10 (3), 233-243 (2008).
- Kankeu, C., Clarke, K., Passante, E., Huber, H. J. Doxorubicin-induced chronic dilated cardiomyopathy-the apoptosis hypothesis revisited. Journal of Molecular Medicine. 95 (3), 239-248 (2017).
- Zhao, L., et al. MicroRNA-140-5p aggravates doxorubicin-induced cardiotoxicity by promoting myocardial oxidative stress via targeting Nrf2 and Sirt2. Redox Biology. 15, 284-296 (2018).
- O'Connell, J. L., et al. Short-term and long-term models of doxorubicin-induced cardiomyopathy in rats: A comparison of functional and histopathological changes. Experimental and Toxicologic Pathology. 69 (4), 213-219 (2017).
- Yuan, Y. P., et al. CTRP3 protected against doxorubicin-induced cardiac dysfunction, inflammation and cell death via activation of Sirt1. Journal of Molecular and Cellular Cardiology. 114, 38-47 (2018).
- Sun, Z., et al. The TGF-beta pathway mediates doxorubicin effects on cardiac endothelial cells. Journal of Molecular and Cellular Cardiology. 90, 129-138 (2016).
- Minotti, G., Menna, P., Salvatorelli, E., Cairo, G., Gianni, L. Anthracyclines: molecular advances and pharmacologic developments in antitumor activity and cardiotoxicity. Pharmacological Reviews. 56 (2), 185-229 (2004).
- Vejpongsa, P., Yeh, E. T. Prevention of anthracycline-induced cardiotoxicity: challenges and opportunities. Journal of The American College of Cardiology. 64 (9), 938-945 (2014).
- Renu, K., V, G. A., P, B. T., Arunachalam, S. Molecular mechanism of doxorubicin-induced cardiomyopathy - An update. European Journal of Pharmacology. 818, 241-253 (2018).
Erratum
Formal Correction: Erratum: A Doxorubicin-Induced Murine Model of Dilated Cardiomyopathy In Vivo
Posted by JoVE Editors on 11/04/2021. Citeable Link.
An erratum was issued for: A Doxorubicin-Induced Murine Model of Dilated Cardiomyopathy In Vivo. A figure was updated.
Figure 1 was updated from:
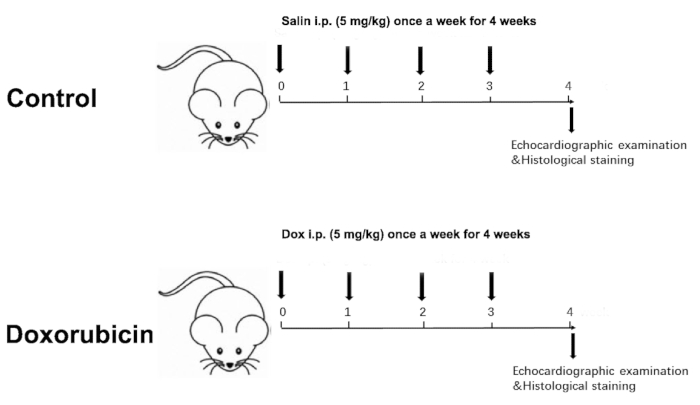
Figure 1: Schematic diagram of a Dox-induced dilated cardiomyopathy. Please click here to view a larger version of this figure.
to:
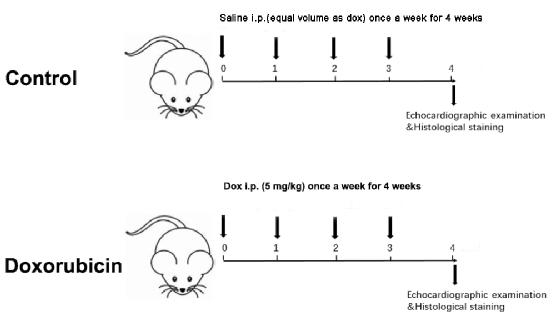
Figure 1: Schematic diagram of a Dox-induced dilated cardiomyopathy. Please click here to view a larger version of this figure.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved