Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Un modèle murin induit par la doxorubicine de la cardiomyopathie dilatée in vivo
Dans cet article
Erratum Notice
Résumé
Décrit est un protocole visant à établir un modèle de cardiomyopathie dilatée (DCM) induite par la doxorubicine chez la souris par injection intrapéritonéale à long terme de doxorubicine.
Résumé
La cardiomyopathie dilatée (DCM) fait référence à un spectre de troubles myocardiques hétérogènes caractérisés par une dilatation ventriculaire et une performance cardiaque déprimée en l’absence d’hypertension, de valvulopathies, congénitales ou ischémiques, et qui peuvent être liés à une infection, à des anomalies auto-immunes ou métaboliques ou à une hérédité familiale. Il peut évoluer vers une insuffisance cardiaque congestive avec un mauvais pronostic. La doxorubicine (Dox) est largement utilisée comme médicament chimiothérapeutique, mais son utilisation est limitée car elle provoque des changements du myocarde de type DCM. Sa toxicité myocardique est attribuée au stress oxydatif, à l’inflammation chronique et à l’apoptose cardiomyocytaire. Aucun modèle de DCM exploitant ces symptômes de DCM induits par Dox n’a été établi.
Introduction
L’une des causes les plus courantes d’insuffisance cardiaque, le DCM se caractérise par une dilatation ventriculaire et une diminution de la fonction cardiaque et est la raison la plus courante de transplantation cardiaque dans le monde1. Afin d’étudier plus avant sa pathogenèse et de trouver des traitements efficaces, l’accès à des modèles animaux matures est particulièrement important. Le but des expériences décrites est d’établir un modèle murin stable de DCM qui ressemble à un DCM humain.
En raison de la pathogenèse complexe du DCM, il existe de nombreuses méthodes différentes pour créer des modèles animaux correspondants. Les modèles DCMspontanés 2 sont relativement stables, mais ils sont coûteux et difficiles à trouver. Les modèles animaux génétiquement modifiés3 ne sont pas bien établis et nécessitent une utilisation plus expérimentale. Les modèles animaux DCM induits par une infection virale4 ou des défauts auto-immuns5 sont faciles à obtenir, mais ils ne sont pas entièrement représentatifs du DCM. Les modèles associés à la toxicité myocardique comprennent les modèles DCM induits par l’alcool et les modèles animaux DCM induits par Dox.
Le modèle de cardiomyopathie induite par Dox est obtenu par injection intrapéritonéale de Dox6. Le modèle exploite l’effet secondaire chronique le plus grave de Dox: après une exposition à Dox, les patients développent des symptômes de DCM tardifs avec une uniformité clinique7. Le stress oxydatif induit par Dox8 et les dommages mitochondriaux9, qui conduisent à l’apoptose cardiomyocytaire, sont des symptômes de la pathogenèse du DCM. Il existe des modèles de traitement Dox aigu et chronique: une seule dose élevée de Dox (15 mg / kg) induit un modèle à court terme pour la cardiomyopathie10, tandis que les injections répétitives de Dox à faible dose (six hebdomadaires, 3 mg / kg) induisent un modèle à long terme pour la cardiomyopathie11. Sur la base de l’étude présentée, les souris de type sauvage injectées par voie intrapéritonéale une fois par semaine pendant un mois à une dose de 5 mg / kg présentent une morphologie et une histologie du cœur compatibles avec les caractéristiques du DCM à la fin du traitement, offrant un moyen idéal d’établir un modèle DCM.
Protocole
Les expériences sur les animaux ont été approuvées par le Comité institutionnel de soins et d’utilisation des animaux (IACUC) de l’hôpital Drum Tower de Nanjing.
1. Préparation des réactifs et des animaux
- Dissoudre le chlorhydrate de doxorubicine (Pfizer, Usa) dans de l’eau stérilisée. Vortex pour obtenir une solution Dox de 1 mg/mL et conserver à 4 °C.
- Utilisez des souris C57BL/6 (âgées de 8 à 10 semaines; poids de 25 à 30 g). Pour cette étude, des souris ont été achetées au Centre de recherche sur les animaux modèles de l’Université de Nanjing et gardées dans la salle des animaux de l’hôpital de la tour du tambour de Nanjing.
- Les cages de souris exemptes d’agents pathogènes ont été maintenues sous un cycle lumière/obscurité de 12 h à une température constante de 23 °C. Tous les animaux ont été nourris avec un régime chow normal et ont reçu de la nourriture et de l’eau ad libitum.
2. Mise en place d’un modèle animal DCM
- Randomiser les souris dans un groupe normal (n = 5) et un groupe Dox (n = 5).
- Administrer la solution Dox par voie intrapéritonéale à une dose de 5 mg/kg à l’aide d’une seringue stérilisée de 1 mL 1 fois par semaine pour le groupe Dox. Traitez les souris témoins de la même manière avec la même quantité de solution saline.
- Mesurez le poids corporel des deux groupes chaque semaine. En conséquence, ajuster la dose d’injection en fonction du poids corporel hebdomadaire pendant un total de 4 semaines, avec une dose cumulative de 20 mg / kg (Figure 1).
NOTE: Une période de 4 semaines a été choisie parce que l’échocardiographie à 4 semaines a montré une différence significative dans la fonction cardiaque entre les deux groupes.
3. Examen échocardiographique
- À la fin de la quatrième semaine, effectuez un examen échocardiographique des souris.
- Anesthésier les souris avec 2% d’isoflurane par voie intranasale. Si les souris ne répondent pas à une pincée de la peau avec une pince à dents ou en stimulant les orteils et la queue, continuez avec le protocole.
- Placez la souris sur une plate-forme de manipulation d’animaux en position couchée. Pour maintenir l’anesthésie, couvrez le nez et la bouche de l’animal avec un cône nasal et délivrez 2% d’isoflurane.
REMARQUE: Pour l’anesthésie IP, injecter 4% d’hydrate de chloral à une dose de 0,2 mL / 20 g. - Retirez soigneusement la fourrure de la poitrine avec un rasoir électrique. Évaluer la fonction cardiaque in vivo à l’aide de l’échocardiographie transthoracique.
- Effectuer l’échocardiogramme BT dans les vues parasternales à axe long et à axe court à une fréquence d’images de 233 Hz. Les dimensions systoliques et diastoliques finales ont été définies comme les phases correspondant respectivement à l’onde T de l’ECG et à l’onde R.
- Sur les tracés en mode M, mesurez le diamètre systolique final LV (LVIDd), le diamètre diastolique terminal LV (LVID), l’épaisseur septale interventriculaire (IVS) et l’épaisseur de paroi postérieure LV (LVPW) à partir de 3 à 5 battements cardiaques. Calculez également la fraction d’éjection (EF) et le raccourcissement de fraction (FS) en fonction de l’échocardiographie.
4. Coloration histologique
- Après l’analyse échocardiographique, sacrifier les souris par injection intraventriculaire de chlorure de potassium à 10%.
- Perfuser le cœur avec environ 30 mL de solution saline après dissection jusqu’à ce que le foie et les poumons deviennent pâles.
- Excisez le cœur et lavez-le soigneusement dans une solution tampon de phosphate pour extruder le sang.
- Fixez le cœur dans du formol à 4% à température ambiante pendant 24 h et traitez le tissu dans une boîte de paraffine afin que la cire de paraffine refroidisse et se solidifie.
- Coupez les cœurs en tranches de 5 μm d’épaisseur pour une coloration pathologique.
- Décolorer et réhydrater les sections contenant du muscle papillaire.
- Incuber les lames à 55 °C pendant 30 min. Ensuite, incuber dans du xylène 2x pendant 2 min chacun; 100% éthanol 2x pendant 2 min chacun; 95% d’éthanol 2x pendant 2 min chacun; 80% d’éthanol pendant 2 min; 75% d’éthanol pendant 2 min; et 50% d’éthanol pendant 2 min.
- Coloration à l’aide d’hématoxyline et d’éosine (H&E) ainsi que de la coloration de Masson.
Résultats
Fonction cardiaque
La cardiomyopathie dilatée est caractérisée par une dilatation ventriculaire progressive et un dysfonctionnement contractile. La figure 2 montre des images échocardiographiques représentatives des deux groupes. Les souris traitées dox ont montré une réduction marquée de la fraction d’éjection ventriculaire gauche et du raccourcissement fractionnel ventriculaire gauche(Figure 3A, B). Le diamètre...
Discussion
Dox est un médicament de chimiothérapie antitumorale périodique non spécifique couramment utilisé dans la pratique clinique12. Son principal effet secondaire est la cardiotoxicité, caractérisée par une cardiomyopathie et une insuffisance cardiaque ultérieure13. Le mécanisme sous-jacent comprend des dommages à la peroxydation lipidique myocardique, l’inhibition de l’activité du réticulum sarcoplasmique myocardique Ca2+-ATPase et l’activation du ...
Déclarations de divulgation
Aucun conflit d’intérêts n’a été déclaré.
Remerciements
Ce travail a été soutenu par key project Medical Science and Technology Development Foundation, Nanjing Department of Health (No.YKK16098).
matériels
| Name | Company | Catalog Number | Comments |
| 4% paraformaldehyde | servicebio | CAS30525-89-4 | |
| C57BL/6 mice | Model Animal Research Center of Nanjing University | \ | |
| Doxorubicin hydrochloride | Pfizer | CAS25316-40-9 | |
| echocardiography | Visualsonics | \ | |
| Hematoxylin and Eosin staining kit | Solarbio | G1120 | |
| Masson staining kit | Solarbio | G1343 | |
| phosphate buffer solution | Sigma | P5368 | |
| potassium chloride | Sigma | CAS7447-40-7 | |
| sterilized syringe | Millipore | SLGP033RB |
Références
- Weintraub, R. G., Semsarian, C., MacDonald, P. Dilated cardiomyopathy. Lancet. 390 (10092), 400-414 (2017).
- Ichihara, S., et al. Attenuation of oxidative stress and cardiac dysfunction by bisoprolol in an animal model of dilated cardiomyopathy. Biochemical and Biophysical Research Communications. 350 (1), 105-113 (2006).
- Fountoulakis, M., et al. Alterations in the heart mitochondrial proteome in a desmin null heart failure model. Journal of Molecular and Cellular Cardiology. 38 (3), 461-474 (2005).
- Fairweather, D., Rose, N. R. Coxsackievirus-induced myocarditis in mice: a model of autoimmune disease for studying immunotoxicity. Methods. 41 (1), 118-122 (2007).
- Wang, Z. H., et al. A therapeutic anti-CD4 monoclonal antibody inhibits T cell receptor signal transduction in mouse autoimmune cardiomyopathy. Chinese Medical Journal. 120 (15), 1319-1325 (2007).
- Riad, A., et al. Toll-like receptor-4 deficiency attenuates doxorubicin-induced cardiomyopathy in mice. European Journal of Heart Failure. 10 (3), 233-243 (2008).
- Kankeu, C., Clarke, K., Passante, E., Huber, H. J. Doxorubicin-induced chronic dilated cardiomyopathy-the apoptosis hypothesis revisited. Journal of Molecular Medicine. 95 (3), 239-248 (2017).
- Zhao, L., et al. MicroRNA-140-5p aggravates doxorubicin-induced cardiotoxicity by promoting myocardial oxidative stress via targeting Nrf2 and Sirt2. Redox Biology. 15, 284-296 (2018).
- O'Connell, J. L., et al. Short-term and long-term models of doxorubicin-induced cardiomyopathy in rats: A comparison of functional and histopathological changes. Experimental and Toxicologic Pathology. 69 (4), 213-219 (2017).
- Yuan, Y. P., et al. CTRP3 protected against doxorubicin-induced cardiac dysfunction, inflammation and cell death via activation of Sirt1. Journal of Molecular and Cellular Cardiology. 114, 38-47 (2018).
- Sun, Z., et al. The TGF-beta pathway mediates doxorubicin effects on cardiac endothelial cells. Journal of Molecular and Cellular Cardiology. 90, 129-138 (2016).
- Minotti, G., Menna, P., Salvatorelli, E., Cairo, G., Gianni, L. Anthracyclines: molecular advances and pharmacologic developments in antitumor activity and cardiotoxicity. Pharmacological Reviews. 56 (2), 185-229 (2004).
- Vejpongsa, P., Yeh, E. T. Prevention of anthracycline-induced cardiotoxicity: challenges and opportunities. Journal of The American College of Cardiology. 64 (9), 938-945 (2014).
- Renu, K., V, G. A., P, B. T., Arunachalam, S. Molecular mechanism of doxorubicin-induced cardiomyopathy - An update. European Journal of Pharmacology. 818, 241-253 (2018).
Erratum
Formal Correction: Erratum: A Doxorubicin-Induced Murine Model of Dilated Cardiomyopathy In Vivo
Posted by JoVE Editors on 11/04/2021. Citeable Link.
An erratum was issued for: A Doxorubicin-Induced Murine Model of Dilated Cardiomyopathy In Vivo. A figure was updated.
Figure 1 was updated from:
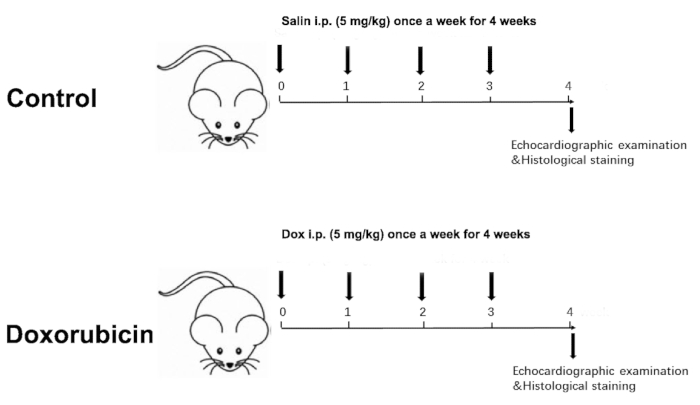
Figure 1: Schematic diagram of a Dox-induced dilated cardiomyopathy. Please click here to view a larger version of this figure.
to:
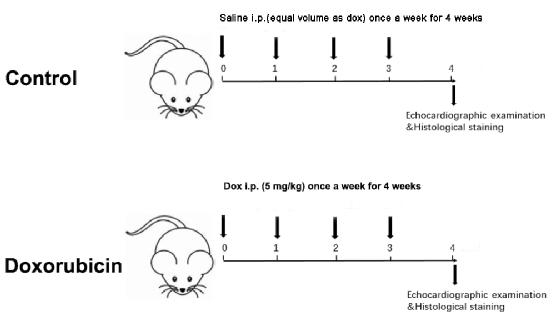
Figure 1: Schematic diagram of a Dox-induced dilated cardiomyopathy. Please click here to view a larger version of this figure.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon