Method Article
Uso de un vaporizador anestésico de bajo flujo integrado, ventilador y sistema de monitoreo fisiológico para roedores
En este artículo
Resumen
Aquí, presentamos un protocolo para administrar de forma segura y eficaz gas anestésico a ratones utilizando un sistema digital de anestesia de bajo flujo con ventilador integrado y módulos de monitoreo fisiológico.
Resumen
Los vaporizadores digitales de bajo flujo utilizan comúnmente una bomba de jeringa para administrar directamente anestésicos volátiles en una corriente de gas portador. Según las recomendaciones de bienestar animal, los animales son calentados y monitoreados durante los procedimientos que requieren anestesia. Los equipos comunes de anestesia y monitoreo fisiológico incluyen tanques de gas, vaporizadores y soportes anestésicos, controladores y almohadillas de calentamiento, respiradores mecánicos y oxímetros de pulso. Un ordenador también es necesario para la recopilación de datos y para ejecutar software de equipo. En espacios más pequeños o al realizar trabajos de campo, puede ser difícil configurar todo este equipo en un espacio limitado.
El objetivo de este protocolo es demostrar las mejores prácticas para el uso de un vaporizador digital de bajo flujo utilizando oxígeno comprimido y aire de habitación, junto con un respirador mecánico integrado, oxímetro de pulso y calentamiento infrarrojo lejano como una anestesia todo incluido y una suite de monitoreo fisiológico ideal para roedores.
Introducción
La investigación que involucra modelos animales a menudo requiere equipos especializados de recolección de datos. Hay dos tipos comunes de vaporizador anestésico comúnmente utilizado para la cirugía de animales pequeños. Los vaporizadores anestésicos tradicionales dependen de la vaporización pasiva de anestésicos volátiles basados en la presión atmosférica y el flujo de gas1,2,3,4,5,6,7,8,9,10. Están diseñados para funcionar a caudales de 0,5 L/min a 10 L/min, por lo que son ideales para grandes modelos animales11.
Recientemente demostramos los efectos de un vaporizador digital de bajo flujo en comparación con un vaporizador tradicional12,13. El sistema de anestesia digital de bajo flujo se puede utilizar para mantener a un animal en un cono nasal a caudales muy bajos de 1,5-2,2 veces el volumen de minutos del animal14,15,16.
Hay numerosos beneficios en el uso de un sistema de anestesia digital. Incorpora una bomba incorporada, que atrae aire ambiente para su uso como gas portador. Esto permite al usuario administrar anestesia sin el uso de gas comprimido. Estudios recientes17,18 han sugerido que el uso de aire en lugar de oxígeno como un gas portador puede ser beneficioso para muchos procedimientos.
Las capacidades de monitoreo fisiológico y calentamiento también se pueden instalar en el sistema digital de anestesia de bajo flujo. En la mayoría de las instituciones, el calentamiento animal y el monitoreo fisiológico son requeridos por los Comités Institucionales de Cuidado y Uso Animal19,20,21,22. Los estudios que comparan los efectos fisiológicos de los agentes anestésicos han demostrado una depresión drástica de la temperatura corporal, la función cardíaca y la función respiratoria23,24,25. A menudo se requiere colocar al animal en una almohadilla de calentamiento para monitorear y mantener una temperatura corporal normal. Hay muchos métodos de calentamiento animal disponibles, como calentadores de agua caliente, almohadillas de calefacción eléctricas y lámparas de calor, pero cada uno de ellos tiene inconvenientes significativos. En estudios que comparan diferentes métodos de calentamiento animal, se ha encontrado que el calentamiento infrarrojo lejano es el más beneficioso26. El vaporizador digital incluye el calentamiento homeotérmico de infrarrojos lejanos para mantener una temperatura corporal animal específica. Esto elimina las necesidades de cualquier controlador de almohadilla de calentamiento adicional.
Además de controlar la temperatura corporal, la oximetría de pulsos es un método popular para controlar la frecuencia cardíaca del animal y la saturación de oxígeno. Este método no invasivo es simple, preciso, y proporciona una evaluación general de la capacidad del animal para regular los niveles de oxigenación de la sangre. Un sensor de pata para la oximetría de pulsos se puede conectar al sistema de anestesia, como hemos demostrado previamente2.
A menudo se requiere ventilación mecánica cuando el animal está bajo períodos más largos de anestesia, o siempre que el patrón de respiración del animal necesita ser controlado. El vaporizador digital de bajo flujo tiene la capacidad de ofrecer respiraciones controladas en control de presión o volumen. Un respirador integrado elimina la necesidad de un respirador externo y los requisitos de configuración de tubos excesivos.
Debido a que todos estos monitores y características comunes se combinan en una sola pieza de equipo, la configuración del tubo se simplifica sustancialmente. El propósito de este protocolo es demostrar la configuración y el uso de un sistema de anestesia digital todo en uno.
Protocolo
Todos los estudios en animales fueron aprobados por el Comité de Cuidado y Uso de Animales de Purdue.
1. Configuración del vaporizador de bajo flujo
- Entrega de isofluranos o sevofluranos
- Seleccione una fuente de gas portadora. Para utilizar la bomba de aire interna, retire la tapa roja del puerto de entrada en la parte posterior del sistema, lo que permite al sistema tomar aire de la sala de admisión. Para utilizar gas comprimido, utilice un regulador de presión o un reductor de presión establecido en 15 PSI y conéctese al puerto de gas comprimido en la parte posterior del sistema.
- Conecte el recipiente de carbón al puerto de escape.
- Conecte el conector accesorio a los puertos inspiratorios y espiratorios de la parte frontal del sistema. Conecte la cámara de inducción a ramas con clips azules y el cono nasal a ramas con clips blancos(Figura 1).
- Para ventilación mecánica
- Conecte el tubo del conector de intubación a los clips codificados en amarillo (Figura 2).
- Calibrar el ventilador realizando una calibración del espacio muerto. En la pantalla Ejecutar ventilación,toque Configuracióny, a continuación, Calib & Tests. Seleccione Calibración de espacio muerto y pulse Marcar B.
- Para la oximetría del pulso
- Conecte el sensor al puerto de la parte posterior del sistema, con la etiqueta MouseSTAT.
- Para el calentamiento
- Conecte la almohadilla de calentamiento al puerto 'Pad Power' en la parte delantera del sistema.
- Conecte un sensor al puerto "Sensor corporal" y el otro al puerto "Sensor de almohadilla". Asegure el sensor pad a la almohadilla de calentamiento.
2. Configure los ajustes
- Para la anestesia
- Encienda el sistema de anestesia. En la pantalla de ejecución de Anest,toque Configurar.
- Elija el agente anestésico. Toque Tipo Anesty, a continuación, gire Marcar B para seleccionar Isoflurane o Sevoflurane.
- Ajuste el tamaño de la jeringa. Toque Tamaño de jeringay, a continuación, gire marcar B para seleccionar un tamaño.
- Toque Atrás para volver a la pantalla de ejecución de Anest.
- Con el adaptador superior de la botella, llene la jeringa con anestésico.
- Conecte la jeringa al sistema de anestesia. Toque Eliminar para mover el bloque del empujador hacia atrás si es necesario.
- Prepara la jeringa. Mantenga pulsado Prime para mover el bloque del empujador hacia delante hasta que el bloque del empujador toque la parte superior del émbolo de la jeringa. Girar B mientras mantiene pulsado el botón Prime regula la velocidad del bloque del pulsador.
- Para ventilación mecánica
- Toque la pestaña Pantalla de ejecución de ventilación y, a continuación, configurar.
- Toque Peso corporal e introduzca el peso del animal.
- Toque Prioridad para elegir el volumen o la ventilación controlada por presión. El ajuste Peso corporal establece automáticamente la frecuencia respiratoria adecuada y los volúmenes de marea.
- Para la oximetría del pulso
- Toque la pestaña Pantalla de ejecución Oxi y, a continuación, Configurar.
- Toque HR y gire el dial B para establecer la lectura mínima permitida de la frecuencia cardíaca. Los ajustes preestablecidos están disponibles.
- Para el calentamiento
- En la pantalla De ejecución cálida,toque Configuración. Elija un método de calentamiento y un ajuste de temperatura objetivo.
3. Comenzar la entrega de anestesia
- Anestesiar el ratón
- En la pantalla de ejecución de Anest,toque Iniciar inducción para iniciar el flujo de aire. El caudal de inducción predeterminado es de 500 mL/min. El dial de giro A ajusta el caudal según sea necesario.
- Coloque el ratón en la cámara de inducción, cerrando la tapa firmemente. Ajuste el dial de concentración del agente anestésico al 3% para isoflurano.
- Monitoree hasta que el ratón haya alcanzado el plano anestésico deseado, determinado por una disminución en la frecuencia de respiración y una pérdida del reflejo de corrección cuando la cámara está inclinada. Ajuste el dial de concentración del agente anestésico según sea necesario.
- Una vez que el animal ha perdido el reflejo corrector y está lo suficientemente anestesiado, toque Detener inducción.
- Si lo desea, toque Cámara de descarga para vaciar la cámara de gas anestésico residual.
- Abra las abrazaderas que conducen al cono nasal y cierre las abrazaderas que conducen a la cámara.
- Toque Iniciar cono nasal. El ajuste Peso corporal determina el caudal del cono nasal, aunque se puede ajustar manualmente girando el dial A.
- Coloque inmediatamente el cono nasal y centre al animal en la almohadilla de calentamiento infrarrojo.
- Inserte el sensor animal como una sonda rectal.
4. Comience la ventilación mecánica
- Intubate al animal.
- Transfiera el animal a la etapa de intubación manteniendo al animal anestesiado.
- Suspenda al animal de sus incisivos superiores utilizando un hilo fijado en la etapa de intubación vertical (Figura 3).
- Desplazar suavemente la lengua del animal hacia un lado y visualizar la tráquea utilizando las luces proporcionadas en el kit de intubación.
- Inserte cuidadosamente el tubo traqueal y verifique la colocación correcta conectando la vejiga de aire pequeña al tubo y comprobando si los pulmones se inflan.
- Conecte el tubo endotraqueal al tubo de ventilación.
- Toque Detener cono nasaly, a continuación, toque Iniciar ventilador.
NOTA: El ajuste Peso corporal determina automáticamente la frecuencia de respiración adecuada y los volúmenes de marea. Para realizar la ventilación controlada por presión, ajuste la presión inspiratoria objetivo entre 15-18 cm H2O. Realice ajustes en los ajustes del respirador según sea necesario según los protocolos quirúrgicos.
5. Iniciar el monitoreo fisiológico
- Coloque el sensor sobre la pata trasera del animal(Figura 4). El oxímetro de pulso comenzará a leer HR y SpO2 automáticamente. Toque la pestaña Pantalla de ejecución Oxi para ver los datos de oximetría de pulso.
Resultados
Diez semanas de edad, macho, salvaje tipo C57Bl6j ratones que pesan 25.41 ± 0.8 g se utilizaron para este estudio. Los ratones fueron anestesiados y mantenidos en un cono nasal o intubados y mantenidos en un respirador mecánico integrado con 1,5-2,5% de isoflurano, mientras que la frecuencia cardíaca y la saturación de oxígeno fueron monitoreados. Los animales estaban alojados en grupo en caging de microisolación y proporcionaban acceso gratuito a la comida estándar de roedores y al agua por botella.
La frecuencia cardíaca y el SpO2 fueron monitoreados durante el mantenimiento a través de la oximetría de pulso(Figura 5, Figura 6y Figura 7,). La temperatura corporal se mantuvo en 36.5-37.5 ° C a través de una almohadilla de calentamiento infrarrojo y lámpara de calor. Los animales ventilados recibieron el suministro continuo de isofluranos durante el procedimiento de intubación a través de soporte de intubación con cono nasal integrado. Cada ratón fue ventilado o mantenido con éxito en un cono nasal a bajas velocidades de flujo no superiores a 141 ml/min de aire de habitación (RA) o oxígeno (O2)durante 15 minutos. Las frecuencias cardíacas de los animales y la saturación de oxígeno en la sangre se mantuvieron estables con pocos cambios significativos en cualquiera de las medidas para todos los grupos. SpO2 se mantuvo entre 82-99% para todos los grupos, mientras que la temperatura corporal se mantuvo entre 36.5-37.5 ° C. Observamos que tanto la posición del oxímetro de pulso como la temperatura corporal influyeron en las mediciones de SpO2. Si observamos una lectura inválida del oxímetro de pulso, ajustamos la colocación del sensor y el nivel de calentamiento para mantener estable la temperatura corporal del núcleo.
Se realizó un ANOVA bidireccional con una corrección de Bonferroni para determinar la importancia de los datos en la Figura 5, Figura 6 y Figura 7. Un valor pinferior a 0,05 se consideró significativo.
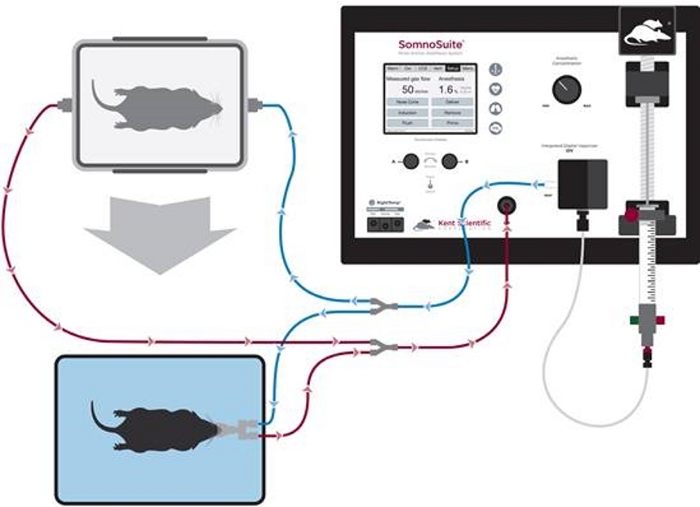
Figura 1: Diagrama de configuración de tubos para inducción anestésica y mantenimiento de conos nasales. Haga clic aquí para ver una versión más grande de esta figura.
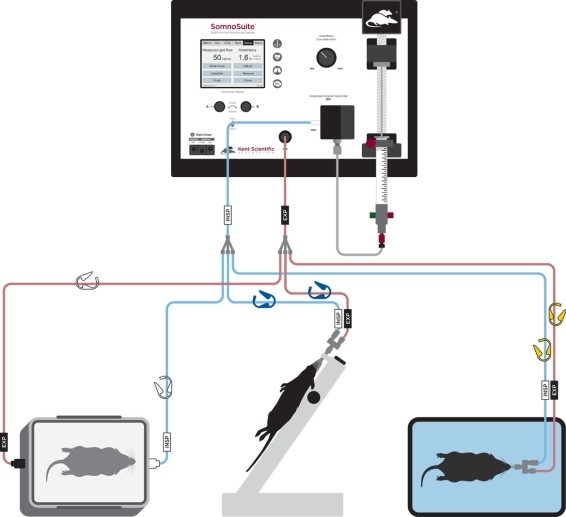
Figura 2: Diagrama de configuración de tubos para inducción anestésica, intubación y ventilación. Haga clic aquí para ver una versión más grande de esta figura.
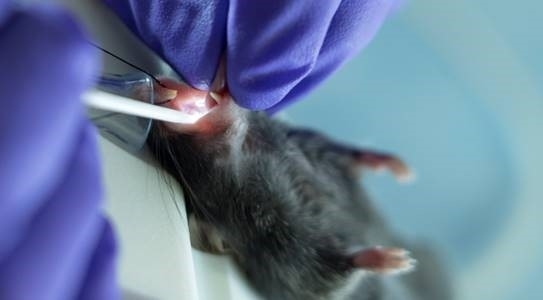
Figura 3: Los ratones recibieron administración continua de isofluranos durante el procedimiento de intubación a través de un soporte de intubación con un cono nasal integrado. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: Colocación integrada del sensor del oxímetro de pulso sobre la pata trasera. Haga clic aquí para ver una versión más grande de esta figura.
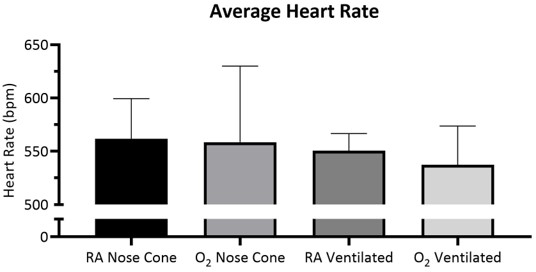
Figura 5: Frecuencia cardíaca media durante 15 minutos ± SD con aire ambiente (AR) o 100% oxígeno (O2)entregado a través del cono nasal o ventilado a través de tubo traqueal (n=5/grupo). No se observó ninguna diferencia significativa entre los grupos. Haga clic aquí para ver una versión más grande de esta figura.
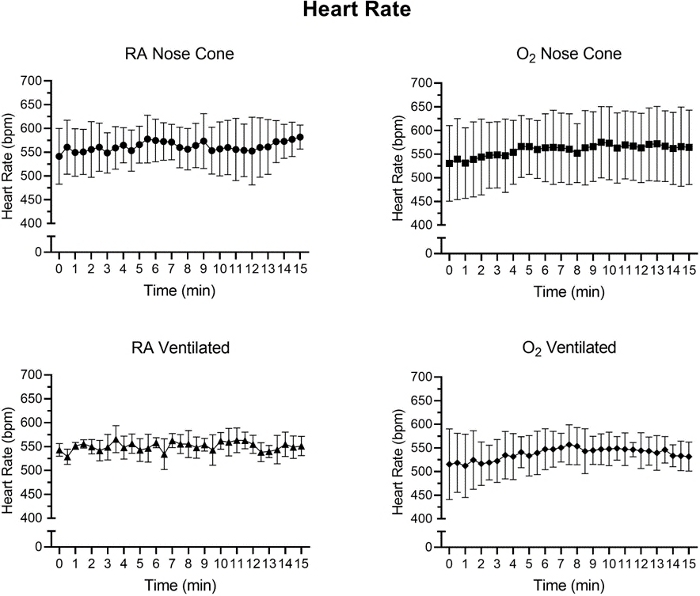
Figura 6: Valores de frecuencia cardíaca (bpm) registrados después de la inducción anestésica inicial con el sistema de anestesia de bajo flujo. Valores medios de frecuencia cardíaca calculados a partir de intervalos de tiempo de 30 segundos durante un período de 15 minutos. Cada punto de datos representa la media ± SD de todos los animales de cada grupo (n=5). No se observaron cambios significativos en la frecuencia cardíaca durante el período de 15 minutos en ningún grupo. Haga clic aquí para ver una versión más grande de esta figura.
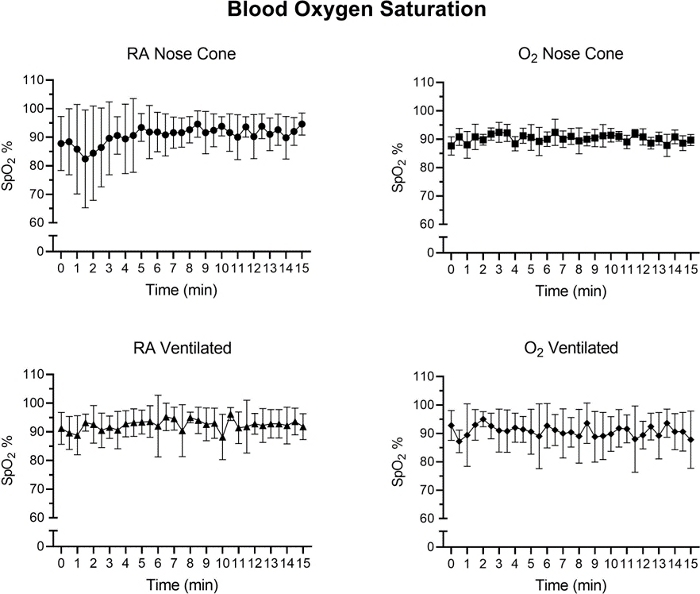
Figura 7: Los niveles de saturación de oxígeno tisular (%) después de la inducción anestésica inicial con el sistema de anestesia de bajo flujo. Valores promedio de SpO2 calculados a partir de intervalos de tiempo de 30 segundos durante un período de 15 minutos. Cada punto de datos representa la media ± SD de todos los animales de cada grupo (n=5). No se observaron cambios significativos en el SpO2 durante el período de 15 minutos en ningún grupo. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este sistema digital de anestesia de bajo flujo integra anestesia, ventilación, calentamiento y sistemas de monitoreo fisiológico en una sola pieza de equipo. Además, el sistema contiene una bomba interna, lo que le permite extraer aire ambiente para su uso como gas portador, eliminando la necesidad de una fuente de gas comprimido.
En este procedimiento, el sistema se utiliza como único equipo para reemplazar un vaporizador anestésico, respirador mecánico, oxímetro de pulso y almohadilla de calentamiento. Anteriormente demostramos la entrega anestésica a un caudal de 100 ml/min2. Los ajustes del caudal son críticos para esta técnica de entrega anestésica, ya que el caudal controla directamente el volumen de anestésico líquido utilizado. También demostramos previamente cómo el uso de bajos caudales ahorra líquido anestésico1,2. Cuando un vaporizador tradicional está conectado a un respirador mecánico, el vaporizador debe funcionar continuamente mientras el ventilador toma muestras de entrada de la corriente de gas. En el caso del vaporizador digital con respirador integrado, sólo el ventilador emite el gas necesario para la ventilación. Esto reduce los costos asociados con el líquido anestésico, los gases portadores y los filtros de carbón.
Aunque hay muchas ventajas de usar un vaporizador digital de bajo flujo, también hay limitaciones. Este sistema está diseñado para funcionar a bajos caudales ideales para roedores y otros mamíferos pequeños, pero no proporciona anestesia por encima de los caudales de 1000 ml/min. Por lo tanto, este sistema en particular sólo es adecuado para especies animales pequeños. El oxímetro de pulso integrado incluye un sensor solo para uso de patas. No se recomienda el uso del sensor en la cola, lo que puede ser una limitación para ciertos procedimientos quirúrgicos. Además, si bien la frecuencia respiratoria se puede controlar a través de este sistema a través del sensor de la pata, puede ser difícil obtener grabaciones respiratorias consistentes durante un período prolongado de tiempo. Por último, a diferencia de un vaporizador tradicional, este sistema digital requiere electricidad. Las baterías están disponibles para su uso en casos en los que la energía eléctrica no está disponible o en caso de un corte de energía, y pueden alimentar el sistema a través de varias horas de uso.
Esta configuración y protocolo demuestran un uso seguro y eficaz de un sistema de anestesia digital de bajo flujo con ventilador integrado y módulos de monitorización fisiológica. Esta configuración será útil para cualquier laboratorio con espacios de banco limitados, o donde no sea factible albergar múltiples piezas de equipo y tubos cerca de un campo quirúrgico. Hay numerosos beneficios para un sistema todo en uno, incluyendo la eliminación de tanques de gas comprimido y equipos de monitoreo fisiológico separados. En general, este sistema integrado podría ser considerado por grupos donde el uso de un vaporizador tradicional no es ideal.
Divulgaciones
Este proyecto fue apoyado con equipos y financiación por Kent Scientific Corporation. Los autores Krista Bigiarelli y Dave FitzMiller son empleados de Kent Scientific Corporation que fabrica equipos utilizados en este artículo. La publicación de acceso abierto de este artículo está patrocinada por Kent Scientific Corporation.
Agradecimientos
Los autores no tienen reconocimientos.
Materiales
| Name | Company | Catalog Number | Comments |
| Intubation Kit | Kent Scientific Corporation | ETM-MSE | Includes intubation stage, intubation tube, LED light |
| Isoflurane Liquid Inhalation 99.9% | Henry Schein, Inc. | 1182097 | Glass bottle 250mL |
| MouseSTAT Pulse Oximeter | Kent Scientific Corporation | SS-03 | Integrated into SomnoSuite |
| Oxygen Tank | Indiana Oxygen Company | 23-160246 | Medical Grade O2 99% |
| RoVent Automatic Ventilator | Kent Scientific Corporation | SS-04 | Integrated into SomnoSuite |
| SomnoSuite Low Flow Digital Anesthesia System | Kent Scientific Corporation | SS-01 | Includes RightTemp Homeothermic Warming control, pad, and temperature sensors |
| SomnoSuite Mouse Starter Kit | Kent Scientific Corporation | SOMNO-MSEKIT | Includes nose cone, syringes, induction chamber, and charcoal canister |
Referencias
- El-Attar, A. M. Guided isoflurane injection in a totally closed circuit. Anaesthesia. 46 (12), 1059-1063 (1991).
- Lockwood, G., Chakrabarti, M. K., Whitwam, J. G. A computer-controller closed anaesthetic breathing system. Anaesthesia. 48 (8), 690-693 (1993).
- Lowe, H. J., Cupic, M. Dose-regulated automated anesthesia (Abstract). British Journal of Clinical Pharmacologyl. 12 (2), 281-282 (1971).
- Walker, T. J., Chackrabarti, M. K., Lockwood, G. G. Uptake of desflurane during anaesthesia. Anaesthesia. 51 (1), 33-36 (1996).
- Weingarten, M., Lowe, H. J. A new circuit injection technic for syringe-measured administration of methoxyflurane: a new dimension in anesthesia. Anesthesia & Analgesia. 52 (4), 634-642 (1973).
- Enlund, M., Wiklund, L., Lambert, H. A new device to reduce the consumption of a halogenated anaesthetic agent. Anaesthesia. 56 (5), 429-432 (2001).
- Kelly, J. M., Kong, K. L. Accuracy of ten isoflurane vaporisers in current clinical use. Anaesthesia. 66 (8), 682-688 (2011).
- Matsuda, Y., et al. NARCOBIT - A newly developed inhalational anesthesia system for mice. Experimental Animals. 56 (2), 131-137 (2007).
- Soro, M., et al. The accuracy of the anesthetic conserving device (Anaconda) as an alternative to the classical vaporizer in anesthesia. Anesthesia & Analgesia. 111 (5), 1176-1179 (2010).
- Ward, C. S. . Physical principles and maintenance. Anaesthetic equipment. , (1985).
- Ambrisko, T. D., Klide, A. M. Evaluation of isoflurane and Sevoflurane vaporizers over a wide range of oxygen flow rates. American Journal of Veterinary Research. 67 (6), 936-940 (2006).
- Damen, F. W., Adelsperger, A. R., Wilson, K. E., Goergen, C. J. Comparison of traditional and integrated digital anesthetic vaporizers. Journal of the American Association for Laboratory Animal Science. 54 (6), 756-762 (2015).
- Adelsperger, A. R., Bigiarelli-Nogas, K. J., Toore, I., Goergen, C. J. Use of a Low-flow Digital Anesthesia System for Mice and Rats. Journal of Visualized Experiments. (115), e54436 (2016).
- Flecknell, P. . Laboratory animal anaesthesia. , (2009).
- Mapleson, W. W. The elimination of rebreathing in various semiclosed anaesthetic systems. British Journal of Anaesthesia. 26 (5), 323-332 (1954).
- Chakravarti, S., Basu, S. Modern Anaesthesia Vapourisers. Indian Journal of Anaesthesia. 57 (5), 464-471 (2013).
- Mullin, L., et al. Effect of anesthesia carrier gas on in vivo circulation times of ultrasound microbubble contrast agents in rats. Contrast Media & Molecular Imaging. 6 (3), 126-131 (2011).
- Flores, J. E., et al. The effects of anesthetic agent and carrier gas on blood glucose and tissue uptake in mice undergoing dynamic FDG-PET imaging: sevoflurane and isoflurane compared in air and in oxygen. Molecular Imaging and Biology. 10 (4), 192 (2008).
- Carroll, G. . Small Animal Anesthesia and Analgesia. , (2008).
- Thomas, J., Lerche, P. . Anesthesia and Analgesia for Veterinary Technicians, 4th ed. 335, (2011).
- McKelvey, D. H. . Veterinary Anesthesia and Analgesia. , (2003).
- Tranquilli, W. J., Thurmon, J. C., Grimm, K. A. . Lumb and Jones' veterinary anesthesia and analgesia. , 23-86 (2013).
- Matsuda, Y., et al. Comparison of newly developed inhalation anesthesia system and intraperitoneal anesthesia on the hemodynamic state in mice. Biological and Pharmaceutical Bulletin. 30 (9), 1716-1720 (2007).
- Garber, J., et al. . Guide for the Care and Use of Laboratory Animals. 8th edn. , (2011).
- Zarndt, B. S., et al. Use of a far-infrared active warming device in Guinea pigs (Cavia porcellus). Journal of the American Association for Laboratory Animal Science. 54 (6), 779-782 (2015).
- Wolforth, J., Dyson, M. C. Flushing induction chambers used for rodent anesthesia to reduce waste anesthetic gas. Lab Animal. 40 (3), 76-83 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados