Method Article
Utilisation d’un vaporisateur anesthésique intégré à faible débit, d’un ventilateur et d’un système de surveillance physiologique pour les rongeurs
Dans cet article
Résumé
Ici, nous présentons un protocole pour administrer en toute sécurité et efficacement le gaz anesthésique aux souris à l’aide d’un système d’anesthésie numérique à faible débit avec ventilateur intégré et modules de surveillance physiologique.
Résumé
Les vaporisateurs numériques à faible débit utilisent couramment une pompe à seringues pour administrer directement des anesthésiques volatils dans un flux de gaz porteur. Selon les recommandations relatives au bien-être des animaux, les animaux sont réchauffés et surveillés pendant les interventions nécessitant une anesthésie. L’anesthésie commune et l’équipement physiologique de surveillance incluent des réservoirs de gaz, des vaporisateurs et des stands anesthésiques, des contrôleurs et des garnitures de réchauffement, des ventilateurs mécaniques, et des oxymètres d’impulsion. Un ordinateur est également nécessaire pour la collecte de données et pour exécuter un logiciel d’équipement. Dans les petits espaces ou lors des travaux sur le terrain, il peut être difficile de configurer tout cet équipement dans un espace limité.
L’objectif de ce protocole est de démontrer les meilleures pratiques pour l’utilisation d’un vaporisateur numérique à faible débit utilisant à la fois de l’oxygène comprimé et de l’air de pièce, ainsi qu’un ventilateur mécanique intégré, oxymètre d’impulsion, et le réchauffement infrarouge lointain comme une anesthésie tout compris et suite de surveillance physiologique idéale pour les rongeurs.
Introduction
La recherche sur des modèles animaux nécessite souvent de l’équipement spécialisé de collecte de données. Il existe deux types courants de vaporisateur anesthésique couramment utilisé pour la chirurgie des petits animaux. Les vaporisateurs anesthésiques traditionnels reposent sur la vaporisation passive d’anesthésiques volatils basés sur la pression atmosphérique et le fluxde gaz 1,2,3,4,5,6,7,8,9,10. Ils sont conçus pour fonctionner à des débits de 0,5 L/min à 10 L/min, ce qui les rend idéaux pour les grands modèles animaux11.
Nous avons récemment démontré les effets d’un vaporisateur numérique à faible débit par rapport à un vaporisateurtraditionnel 12,13. Le système d’anesthésie numérique à faible débit peut être utilisé pour maintenir un animal sur un cône nasal à des taux d’écoulement très faibles de 1,5 à 2,2 fois le volume minute de l’animal14,15,16.
L’utilisation d’un système d’anesthésie numérique offre de nombreux avantages. Il intègre une pompe intégrée, qui aspire l’air ambiant à utiliser comme un gaz porteur. Cela permet à l’utilisateur d’administrer une anesthésie sans l’utilisation de gaz comprimé. Des études récentes17,18 ont suggéré que l’utilisation de l’air au lieu de l’oxygène comme un gaz porteur peut être bénéfique pour de nombreuses procédures.
Des capacités physiologiques de surveillance et de réchauffement peuvent également être installées dans le système d’anesthésie numérique à faible débit. Dans la plupart des institutions, le réchauffement des animaux et le suivi physiologique sont exigés par les comités institutionnels de soins et d’utilisationdes animaux 19,20,21,22. Des études comparant les effets physiologiques des agents anesthésiques ont montré une dépression drastique de la température corporelle, de la fonction cardiaque et de la fonctionrespiratoire 23,24,25. Il est souvent nécessaire de placer l’animal sur un coussin chauffant pour surveiller et maintenir une température corporelle normale. Il existe de nombreuses méthodes de réchauffement des animaux disponibles, telles que les chauffe-eau, les coussinets de chauffage électriques et les lampes thermiques, mais chacune d’entre elles présente des inconvénients importants. Dans des études comparant différentes méthodes de réchauffement des animaux, le réchauffement infrarouge lointain s’est avéré être le plus bénéfique26. Le vaporisateur numérique comprend construit dans le réchauffement infrarouge lointain homéothermique pour maintenir une température spécifique du corps animal. Cela élimine les besoins pour tous les contrôleurs de coussin chauffant supplémentaires.
En plus de surveiller la température corporelle, l’oximétrie des impulsions est une méthode populaire de surveillance de la fréquence cardiaque de l’animal et de la saturation en oxygène. Cette méthode non invasive est simple, précise, et fournit une évaluation globale de la capacité de l’animal à réguler les niveaux d’oxygénation du sang. Un capteur de patte pour l’oximétrie des impulsions peut être connecté au système d’anesthésie, comme nous l’avons déjàdémontré 2.
La ventilation mécanique est souvent nécessaire lorsque l’animal est sous de plus longues périodes d’anesthésie, ou chaque fois que le modèle de respiration de l’animal doit être contrôlé. Le vaporisateur numérique à faible débit a la capacité de fournir des respirations contrôlées dans le contrôle de la pression ou du volume. Un ventilateur intégré élimine le besoin d’un ventilateur externe et les exigences d’installation de tubes excédentaires.
Étant donné que tous ces moniteurs et caractéristiques communs sont combinés en une seule pièce d’équipement, la configuration du tube est considérablement simplifiée. Le but de ce protocole est de démontrer la configuration et l’utilisation d’un système d’anesthésie numérique tout-en-un.
Protocole
Toutes les études sur les animaux ont été approuvées par le Comité de soins et d’utilisation des animaux Purdue.
1. Configuration du vaporisateur à faible débit
- Livraison d’isoflurane ou de sevoflurane
- Sélectionnez une source de gaz de transporteur. Pour utiliser la pompe à air interne, retirez le bouchon rouge du port d’Inlet à l’arrière du système, ce qui permet au système de prendre l’air de la pièce. Pour utiliser du gaz comprimé, utilisez un régulateur de pression ou un répresseur de pression réglé à 15 PSI, et connectez-vous au port de gaz comprimé à l’arrière du système.
- Connectez la boîte de charbon de bois au port d’échappement.
- Connectez le connecteur accessoire aux ports inspiratoires et expiratoires à l’avant du système. Connectez la chambre d’induction aux branches avec des clips bleus et le cône avant aux branches avec des clips blancs (Figure 1).
- Pour ventilation mécanique
- Connectez le tube du connecteur d’intubation aux clips codés jaunes (Figure 2).
- Calibrez le ventilateur en effectuant un étalonnage de l’espace mort. De l’écran vent run, configurationtactile , puis Calib & Tests. Sélectionnez Étalonnage Deadspace et appuyez sur Dial B.
- Pour l’oximétrie des impulsions
- Connectez le capteur au port à l’arrière du système, étiqueté MouseSTAT.
- Pour le réchauffement
- Connectez le coussin chauffant au port « Pad Power » à l’avant du système.
- Connectez un capteur au port « Body Sensor », et l’autre au port 'Pad Sensor'. Fixez le capteur Pad sur le coussin chauffant.
2. Configurer les paramètres
- Pour l’anesthésie
- Puissance sur le système d’anesthésie. De l’écran Anest Run, touch Set Up.
- Choisissez l’agent anesthésique. Touchez Type Anest,puis tournez Dial B pour sélectionner Isoflurane ou Sevoflurane.
- Réglez la taille de la seringue. Touchez la taille de la seringue,puis tournez le cadran B pour sélectionner une taille.
- Revenez à l’écran Anest Run.
- À l’aide de l’adaptateur du dessus de la bouteille, remplir la seringue d’anesthésie.
- Connectez la seringue au système d’anesthésie. Touchez Retirer pour déplacer le bloc pusher vers l’arrière si nécessaire.
- Prime la seringue. Touchez et maintenez Prime pour déplacer le bloc pousseur vers l’avant jusqu’à ce que le bloc de poussée touche le haut du piston de seringue. Tourner B tout en tenant le bouton Prime régule la vitesse du bloc poussoir.
- Pour ventilation mécanique
- Touchez l’onglet Écran d’évent, puis configurez.
- Toucher le poids corporel et entrer dans le poids de l’animal.
- Touch Priority pour choisir la ventilation à volume ou à pression contrôlée. Le réglage du poids corporel définit automatiquement la fréquence respiratoire appropriée et les volumes de marée.
- Pour l’oximétrie des impulsions
- Touchez l’onglet Écran d’exécuter Oxi, puis configurez.
- Touchez HR et tournez le cadran B pour définir le minimum autorisé la lecture de la fréquence cardiaque. Des presets sont disponibles.
- Pour le réchauffement
- De l’écran de course chaude, configuration tactile. Choisissez une méthode de réchauffement et ciblez le réglage de la température.
3. Commencez l’accouchement par anesthésie
- Anesthésier la souris
- Depuis l’écran Anest Run,touchez Start Induction pour commencer le flux d’air. Le débit d’induction par défaut est de 500 mL/min. Tourner le cadran A ajuste le débit au besoin.
- Placez la souris dans la chambre d’induction, en fermant le couvercle hermétiquement. Réglez le cadran de concentration de l’agent anesthésique à 3 % pour l’isoflurane.
- Surveillez jusqu’à ce que la souris ait atteint le plan anesthésique désiré, déterminé par une diminution du taux de respiration et une perte de réflexe de droitage lorsque la chambre est inclinée. Réglez le cadran de concentration de l’agent anesthésique au besoin.
- Une fois que l’animal a perdu le réflexe de droitage et est suffisamment anesthésié, touchez Stop Induction.
- Si désiré, touchez flush chamber pour vider la chambre de gaz anesthésique résiduel.
- Ouvrez les pinces menant au cône avant et fermez les pinces menant à la chambre.
- Touch Start Nose Cône. Le réglage du poids corporel détermine le débit du cône avant, bien qu’il puisse être ajusté manuellement en tournant le cadran A.
- Adaptez immédiatement le cône avant et centrez l’animal sur le coussin chauffant infrarouge.
- Insérez le capteur animal comme sonde rectale.
4. Commencer la ventilation mécanique
- Intuber l’animal.
- Transférer l’animal au stade d’intubation tout en gardant l’animal anesthésié.
- Suspendre l’animal de ses incisives supérieures à l’aide d’un fil fixé sur le stade d’intubation verticale (Figure 3).
- Déplacez doucement la langue de l’animal sur le côté et visualisez la trachée à l’aide des lumières fournies dans le kit d’intubation.
- Insérez soigneusement le tube trachéal et vérifiez le placement correct en reliant la petite vessie d’air au tube et en vérifiant si les poumons gonflent.
- Connectez le tube ensotracheal au tube de ventilation.
- Touch Stop Nose Cône, puis toucher démarrer ventilateur.
REMARQUE : Le réglage du poids corporel détermine automatiquement le taux de respiration et les volumes de marée appropriés. Pour effectuer une ventilation contrôlée par pression, réglez la pression inspiratoire cible entre 15 et 18 cm H2O. Faites des ajustements aux paramètres du ventilateur au besoin selon les protocoles chirurgicaux.
5. Commencer la surveillance physiologique
- Placez le capteur sur la patte arrière de l’animal( Figure 4). L’Oxymètre Pulse commencera à lire HR et SpO2 automatiquement. Touchez l’onglet Écran d’affichage Oxi pour afficher les données d’oximétrie des impulsions.
Résultats
Des souris C57Bl6j de type sauvage de type 10 semaines pesant 25,41 ± 0,8 g ont été utilisées pour cette étude. Les souris ont été anesthésiées et maintenues sur un cône nasal ou intubées et maintenues sur un ventilateur mécanique intégré avec 1,5-2,5% d’isoflurane tandis que la fréquence cardiaque et la saturation en oxygène ont été surveillées. Les animaux étaient logés en groupe dans des cages de microisolation et offrait un accès gratuit au chow standard des rongeurs et à l’eau par bouteille.
La fréquence cardiaque et le SpO2 ont fait l’objet d’un suivi pendant l’entretien par oximétriedes impulsions (figure 5, figure 6 et figure 7,). La température corporelle a été maintenue à 36,5-37,5 °C par l’intermédiaire d’un coussin chauffant infrarouge et d’une lampe thermique. Les animaux ventilés ont reçu la livraison continue de l’isoflurane pendant la procédure d’intubation par l’intermédiaire du support d’intubation avec le cône intégré de nez. Chaque souris a été ventilée ou maintenue avec succès sur un cône avant à faible débit ne dépassant pas 141 mL/min d’air de pièce (RA) ou d’oxygène (O2)pendant 15 minutes. Les fréquences cardiaques des animaux et la saturation en oxygène dans le sang sont restées stables avec peu de changements significatifs dans l’une ou l’autre mesure pour tous les groupes. SpO2 est resté entre 82-99% pour tous les groupes, tandis que la température corporelle a été maintenue entre 36.5-37.5 °C. Nous avons observé que la position du pulse-oximeter et la température corporelle influençait les mesures de SpO2. Si nous avons observé une lecture invalide du pulse-oximeter, nous avons ajusté le placement du capteur et le niveau de chauffage pour maintenir la température corporelle centrale stable.
Une ANOVA dans les deux sens avec une correction Bonferroni a été effectuée pour déterminer l’importance des données à la figure 5, à la figure 6 et à la figure 7. Une valeur pinférieure à 0,05 a été considérée comme importante.
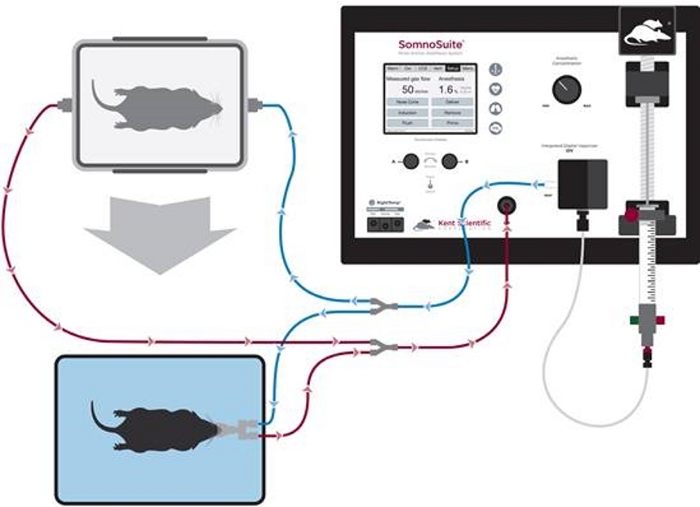
Figure 1 : Diagramme de la configuration des tubes pour l’induction anesthésique et l’entretien des cônes avant. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
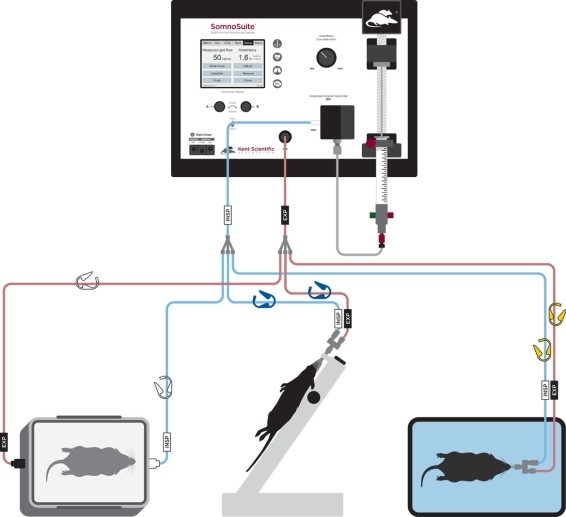
Figure 2 : Diagramme de la configuration du tube pour l’induction anesthésique, l’intubation et la ventilation. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
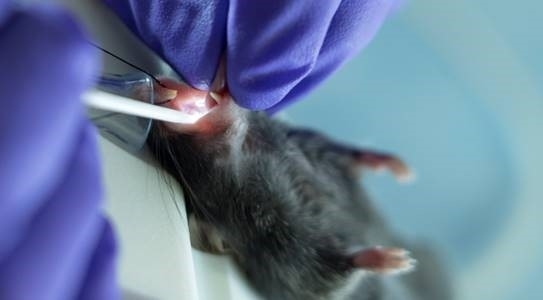
Figure 3 : Les souris ont reçu la livraison continue de l’isoflurane pendant la procédure d’intubation par l’intermédiaire d’un support d’intubation avec un cône intégré de nez. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 4 : Placement intégré du capteur d’oxymètre d’impulsion sur la patte arrière. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
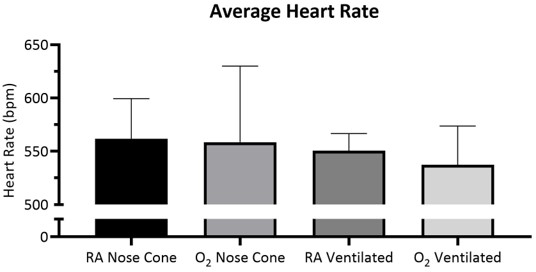
Figure 5 : Fréquence cardiaque moyenne de plus de 15 minutes ± SD avec de l’air de pièce (RA) ou 100 % d’oxygène (O2)livré par cône nasal ou ventilé par tube trachéal (n=5/groupe). Aucune différence significative n’a été observée entre les groupes. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
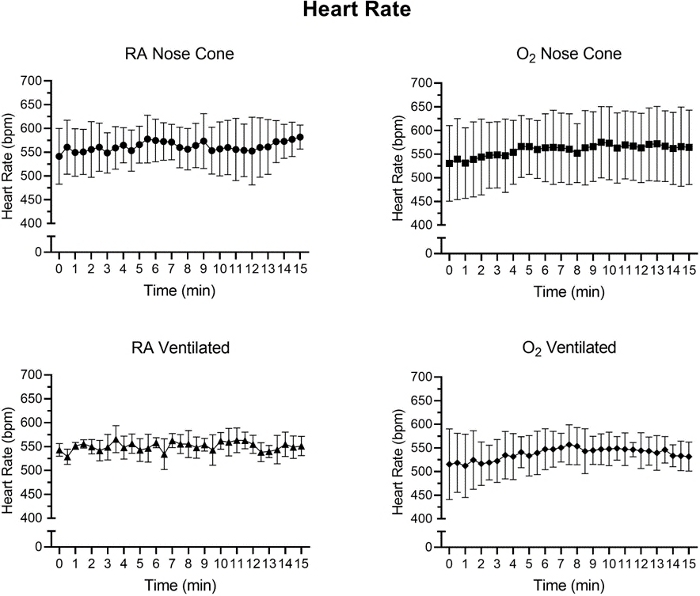
Figure 6 : Valeurs de fréquence cardiaque (bpm) enregistrées après l’induction anesthésique initiale avec le système d’anesthésie à faible débit. Valeurs moyennes de fréquence cardiaque calculées à partir d’intervalles de temps de 30 secondes sur une période de 15 minutes. Chaque point de données représente ± SD de tous les animaux de chaque groupe (n=5). Aucun changement significatif de la fréquence cardiaque n’a été observé au cours de la période de 15 minutes dans n’importe quel groupe. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
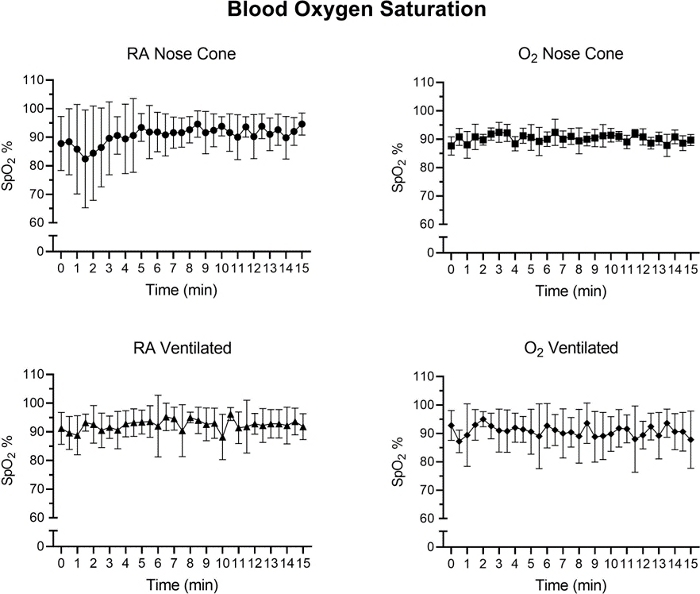
Figure 7 : Les niveaux de saturation en oxygène des tissus (%) après l’induction anesthésique initiale avec le système d’anesthésie à faible débit. Valeurs moyennes spo2 calculées à partir d’intervalles de temps de 30 secondes sur une période de 15 minutes. Chaque point de données représente ± SD de tous les animaux de chaque groupe (n=5). Aucun changement significatif dans spo2 n’a été observé au cours de la période de 15 minutes dans n’importe quel groupe. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
Ce système d’anesthésie numérique à faible débit intègre les systèmes d’anesthésie, de ventilation, de réchauffement et de surveillance physiologique en une seule pièce d’équipement. En outre, le système contient une pompe interne, lui permettant de puiser dans l’air ambiant pour une utilisation comme un gaz porteur, éliminant le besoin d’une source de gaz comprimé.
Dans cette procédure, le système est utilisé comme une seule pièce d’équipement pour remplacer un vaporisateur anesthésique, ventilateur mécanique, oxymètre d’impulsion, et coussin chauffant. Nous avons précédemment démontré la livraison anesthésique à un taux d’écoulement de 100mL/min2. Les paramètres du débit sont essentiels pour cette technique d’administration anesthésique, car le débit contrôle directement le volume d’anesthésie liquide utilisé. Nous avons également déjà démontré comment l’utilisation de faibles débits permet d’économiser liquideanesthésique 1,2. Lorsqu’un vaporisateur traditionnel est relié à un ventilateur mécanique, le vaporisateur doit fonctionner en continu pendant que le ventilateur inlete des échantillons du flux de gaz. Dans le cas du vaporisateur numérique avec ventilateur intégré, seul le gaz nécessaire à la ventilation est produit par le ventilateur. Cela réduit les coûts associés aux filtres anesthésiques liquides, porteurs de gaz et de charbon de bois.
Bien qu’il existe de nombreux avantages à utiliser un vaporisateur numérique à faible débit, il ya des limites ainsi. Ce système est conçu pour fonctionner à faible débit idéal pour les rongeurs et autres petits mammifères, mais ne fournit pas d’anesthésie au-dessus des débits de 1000 mL/min. Ce système particulier ne convient donc qu’aux petites espèces animales. L’oxymètre d’impulsion intégré inclut un capteur pour l’utilisation de patte seulement. Le capteur n’est pas recommandé pour une utilisation sur la queue, ce qui peut être une limitation pour certaines interventions chirurgicales. De plus, bien que le taux de respiration puisse être surveillé par ce système par l’intermédiaire du capteur de patte, il peut être difficile d’obtenir des enregistrements respiratoires cohérents sur une longue période de temps. Enfin, contrairement à un vaporisateur traditionnel, ce système numérique nécessite de l’électricité. Les batteries sont disponibles pour une utilisation dans les cas où l’électricité n’est pas disponible ou en cas de panne de courant, et peuvent alimenter le système pendant plusieurs heures d’utilisation.
Cette configuration et ce protocole démontrent l’utilisation sûre et efficace d’un système d’anesthésie numérique à faible débit avec ventilateur intégré et modules de surveillance physiologique. Cette configuration sera utile pour tous les laboratoires avec des espaces limités banc, ou où il n’est pas possible d’abriter plusieurs pièces d’équipement et de tubes près d’un champ chirurgical. Il existe de nombreux avantages pour un système tout-en-un, y compris l’élimination des réservoirs de gaz comprimé et de l’équipement de surveillance physiologique distinct. Dans l’ensemble, ce système intégré pourrait être envisagé par des groupes où l’utilisation d’un vaporisateur traditionnel n’est pas idéale.
Déclarations de divulgation
Ce projet a été appuyé par l’équipement et le financement de Kent Scientific Corporation. Les auteurs Krista Bigiarelli et Dave FitzMiller sont des employés de Kent Scientific Corporation qui fabrique l’équipement utilisé dans cet article. La publication en libre accès de cet article est commanditée par Kent Scientific Corporation.
Remerciements
Les auteurs n’ont aucune reconnaissance.
matériels
| Name | Company | Catalog Number | Comments |
| Intubation Kit | Kent Scientific Corporation | ETM-MSE | Includes intubation stage, intubation tube, LED light |
| Isoflurane Liquid Inhalation 99.9% | Henry Schein, Inc. | 1182097 | Glass bottle 250mL |
| MouseSTAT Pulse Oximeter | Kent Scientific Corporation | SS-03 | Integrated into SomnoSuite |
| Oxygen Tank | Indiana Oxygen Company | 23-160246 | Medical Grade O2 99% |
| RoVent Automatic Ventilator | Kent Scientific Corporation | SS-04 | Integrated into SomnoSuite |
| SomnoSuite Low Flow Digital Anesthesia System | Kent Scientific Corporation | SS-01 | Includes RightTemp Homeothermic Warming control, pad, and temperature sensors |
| SomnoSuite Mouse Starter Kit | Kent Scientific Corporation | SOMNO-MSEKIT | Includes nose cone, syringes, induction chamber, and charcoal canister |
Références
- El-Attar, A. M. Guided isoflurane injection in a totally closed circuit. Anaesthesia. 46 (12), 1059-1063 (1991).
- Lockwood, G., Chakrabarti, M. K., Whitwam, J. G. A computer-controller closed anaesthetic breathing system. Anaesthesia. 48 (8), 690-693 (1993).
- Lowe, H. J., Cupic, M. Dose-regulated automated anesthesia (Abstract). British Journal of Clinical Pharmacologyl. 12 (2), 281-282 (1971).
- Walker, T. J., Chackrabarti, M. K., Lockwood, G. G. Uptake of desflurane during anaesthesia. Anaesthesia. 51 (1), 33-36 (1996).
- Weingarten, M., Lowe, H. J. A new circuit injection technic for syringe-measured administration of methoxyflurane: a new dimension in anesthesia. Anesthesia & Analgesia. 52 (4), 634-642 (1973).
- Enlund, M., Wiklund, L., Lambert, H. A new device to reduce the consumption of a halogenated anaesthetic agent. Anaesthesia. 56 (5), 429-432 (2001).
- Kelly, J. M., Kong, K. L. Accuracy of ten isoflurane vaporisers in current clinical use. Anaesthesia. 66 (8), 682-688 (2011).
- Matsuda, Y., et al. NARCOBIT - A newly developed inhalational anesthesia system for mice. Experimental Animals. 56 (2), 131-137 (2007).
- Soro, M., et al. The accuracy of the anesthetic conserving device (Anaconda) as an alternative to the classical vaporizer in anesthesia. Anesthesia & Analgesia. 111 (5), 1176-1179 (2010).
- Ward, C. S. . Physical principles and maintenance. Anaesthetic equipment. , (1985).
- Ambrisko, T. D., Klide, A. M. Evaluation of isoflurane and Sevoflurane vaporizers over a wide range of oxygen flow rates. American Journal of Veterinary Research. 67 (6), 936-940 (2006).
- Damen, F. W., Adelsperger, A. R., Wilson, K. E., Goergen, C. J. Comparison of traditional and integrated digital anesthetic vaporizers. Journal of the American Association for Laboratory Animal Science. 54 (6), 756-762 (2015).
- Adelsperger, A. R., Bigiarelli-Nogas, K. J., Toore, I., Goergen, C. J. Use of a Low-flow Digital Anesthesia System for Mice and Rats. Journal of Visualized Experiments. (115), e54436 (2016).
- Flecknell, P. . Laboratory animal anaesthesia. , (2009).
- Mapleson, W. W. The elimination of rebreathing in various semiclosed anaesthetic systems. British Journal of Anaesthesia. 26 (5), 323-332 (1954).
- Chakravarti, S., Basu, S. Modern Anaesthesia Vapourisers. Indian Journal of Anaesthesia. 57 (5), 464-471 (2013).
- Mullin, L., et al. Effect of anesthesia carrier gas on in vivo circulation times of ultrasound microbubble contrast agents in rats. Contrast Media & Molecular Imaging. 6 (3), 126-131 (2011).
- Flores, J. E., et al. The effects of anesthetic agent and carrier gas on blood glucose and tissue uptake in mice undergoing dynamic FDG-PET imaging: sevoflurane and isoflurane compared in air and in oxygen. Molecular Imaging and Biology. 10 (4), 192 (2008).
- Carroll, G. . Small Animal Anesthesia and Analgesia. , (2008).
- Thomas, J., Lerche, P. . Anesthesia and Analgesia for Veterinary Technicians, 4th ed. 335, (2011).
- McKelvey, D. H. . Veterinary Anesthesia and Analgesia. , (2003).
- Tranquilli, W. J., Thurmon, J. C., Grimm, K. A. . Lumb and Jones' veterinary anesthesia and analgesia. , 23-86 (2013).
- Matsuda, Y., et al. Comparison of newly developed inhalation anesthesia system and intraperitoneal anesthesia on the hemodynamic state in mice. Biological and Pharmaceutical Bulletin. 30 (9), 1716-1720 (2007).
- Garber, J., et al. . Guide for the Care and Use of Laboratory Animals. 8th edn. , (2011).
- Zarndt, B. S., et al. Use of a far-infrared active warming device in Guinea pigs (Cavia porcellus). Journal of the American Association for Laboratory Animal Science. 54 (6), 779-782 (2015).
- Wolforth, J., Dyson, M. C. Flushing induction chambers used for rodent anesthesia to reduce waste anesthetic gas. Lab Animal. 40 (3), 76-83 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon