Method Article
Einsatz eines integrierten Low-Flow Anesthetic Vaporizer, Ventilator und Physiologisches Überwachungssystem für Nagetiere
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll zur sicheren und effektiven Verabreichung von Anästhetikum gasanmäusen mithilfe eines digitalen, strömungsarmen Anästhesiesystems mit integriertem Beatmungsgerät und physiologischen Überwachungsmodulen vor.
Zusammenfassung
Low-Flow-Digital-Verdampfer verwenden häufig eine Spritzenpumpe, um flüchtige Anästhetika direkt in einen Strom von Trägergas zu verabreichen. Gemäß Tierschutzempfehlungen werden die Tiere während der anästhesiepflichtigen Eingriffe erwärmt und überwacht. Zu den gängigen Anästhesie- und physiologischen Überwachungsgeräten gehören Gastanks, Anästhesieverdampfer und -ständer, Wärmeregler und -pads, mechanische Beatmungsgeräte und Pulsoximeter. Ein Computer ist auch für die Datenerfassung und den Betrieb von Gerätesoftware erforderlich. In kleineren Räumen oder bei Feldarbeiten kann es schwierig sein, all diese Geräte auf begrenztem Raum zu konfigurieren.
Das Ziel dieses Protokolls ist es, Best Practices für die Verwendung eines low-flow digitalen Verdampfers mit komprimiertem Sauerstoff und Raumluft zu demonstrieren, zusammen mit einem integrierten mechanischen Beatmungsgerät, Pulsoximeter und Weitinfraroterwärmung als All-inclusive-Anästhesie und physiologische Überwachungssuite ideal für Nagetiere.
Einleitung
Die Forschung mit Tiermodellen erfordert häufig spezielle Datenerfassungsgeräte. Es gibt zwei häufige Arten von Anästhesie-Verdampfer häufig für kleine Tierchirurgie verwendet. Herkömmliche Anästhesieverdampfer verlassen sich auf die passive Verdampfung von flüchtigen Anästhetika auf Basis von atmosphärischem Druck und Gasstrom1,2,3,4,5,6,7,8,9,10. Sie sind für den Betrieb mit Durchflussraten von 0,5 l/min bis 10 l/min ausgelegt und eignen sich daher ideal für große Tiermodelle11.
Wir haben vor kurzem die Auswirkungen eines Low-Flow-Digital-Verdampfers im Vergleich zu einem herkömmlichen Verdampfer12,13demonstriert. Das low-flow digital anesthesia system kann verwendet werden, um ein Tier auf einem Nasenkegel mit sehr niedrigen Durchflussraten von 1,5-2,2 mal das Minutenvolumen des Tieres14,15,16zu halten.
Die Verwendung eines digitalen Anästhesiesystems bietet zahlreiche Vorteile. Es verfügt über eine eingebaute Pumpe, die Umgebungsluft anzieht, um sie als Trägergas zu verwenden. Dies ermöglicht es dem Anwender, Anästhesie ohne Denkanz zu verabreichen. Jüngste Studien17,18 haben vorgeschlagen, dass die Verwendung von Luft anstelle von Sauerstoff als Trägergas für viele Verfahren von Vorteil sein kann.
Physiologische Überwachungs- und Erwärmungsfunktionen können auch in das digitale Low-Flow-Anästhesiesystem eingebaut werden. In den meisten Einrichtungen sind die Erwärmung und physiologische Überwachung von Tieren und Gesundheitsfürsorge und Verwendungsausschüssen. 19,20,21,22erforderlich. Studien zum Vergleich der physiologischen Wirkungen von Anästhetika haben eine drastische Depression der Körpertemperatur, der Herzfunktion und der Atemfunktion23,24,25gezeigt. Es ist oft erforderlich, das Tier auf ein wärmendes Pad zu legen, um eine normale Körpertemperatur zu überwachen und aufrechtzuerhalten. Es gibt viele Methoden der Tiererwärmung zur Verfügung, wie Warmwasserbereiter, elektrische Heizkissen und Wärmelampen, aber jede von ihnen hat erhebliche Nachteile. In Studien, die verschiedene Methoden der Tiererwärmung vergleichen, wurde festgestellt, dass die Ferninfraroterwärmung die vorteilhaftesten26ist. Der digitale Verdampfer beinhaltet eingebaute hausotherme Ferninfraroterwärmung, um eine bestimmte Körpertemperatur zu erhalten. Dadurch entfällt der Bedarf an zusätzlichen Wärmepad-Controllern.
Neben der Überwachung der Körpertemperatur ist die Pulsoximetrie eine beliebte Methode zur Überwachung der Herzfrequenz und Sauerstoffsättigung des Tieres. Diese nichtinvasive Methode ist einfach, genau und bietet eine Gesamtbewertung der Fähigkeit des Tieres, den Sauerstoffgehalt im Blut zu regulieren. Ein Pfotensensor für die Pulsoximetrie kann an das Anästhesiesystem angeschlossen werden, wie wir bereits2gezeigt haben.
Mechanische Belüftung ist oft erforderlich, wenn das Tier unter längeren Anästhesiezeiten steht oder wenn das Atmungsmuster des Tieres kontrolliert werden muss. Der Low-Flow-Digital-Verdampfer ist in der Lage, kontrollierte Atemzüge in der Druck- oder Lautstärkeregelung zu liefern. Ein integriertes Beatmungsgerät macht ein externes Beatmungsgerät und überschüssige Rohreinstellungen überflüssig.
Da alle diese gängigen Monitore und Funktionen zu einem einzigen Gerät kombiniert werden, wird die Rohreinrichtung erheblich vereinfacht. Der Zweck dieses Protokolls ist es, die Einrichtung und Verwendung eines All-in-One-Digitalanästhesiesystems zu demonstrieren.
Protokoll
Alle Tierversuche wurden vom Purdue Animal Care and Use Committee genehmigt.
1. Einrichtung des Low-Flow-Verdampfers
- Isoflurane oder Sevofluran Lieferung
- Wählen Sie eine Trägergasquelle aus. Um die interne Luftpumpe zu nutzen, entfernen Sie die rote Kappe aus dem Einlassanschluss auf der Rückseite des Systems, so dass das System Raumluft aufnehmen kann. Um komprimiertes Gas zu verwenden, verwenden Sie einen Druckregler oder Druckminderer, der auf 15 PSI eingestellt ist, und schließen Sie ihn an den Komprimierten Gasanschluss auf der Rückseite des Systems an.
- Schließen Sie den Holzkohlekanister an den Auspuffanschluss an.
- Schließen Sie den Zubehöranschluss an die Inspiratory- und Expiratory-Ports an der Vorderseite des Systems an. Verbinden Sie die Induktionskammer mit Zweigen mit blauen Clips und den Nasenkegel mit Zweigen mit weißen Clips (Abbildung 1).
- Für die mechanische Belüftung
- Schließen Sie den Intubationsanschluss mit den gelbcodierten Clips an (Abbildung 2).
- Kalibrieren Sie das Beatmungsgerät, indem Sie eine Totraumkalibrierung durchführen. Tippen Sie auf dem Vent Run Screenauf Setupund dann auf Calib & Tests. Wählen Sie Deadspace Calibration und drücken Sie Dial B.
- Für Pulsoximetrie
- Schließen Sie den Sensor an den Anschluss auf der Rückseite des Systems mit der Bezeichnung MouseSTAT an.
- Zur Erwärmung
- Schließen Sie das Wärmepad an den "Pad Power"-Anschluss an der Vorderseite des Systems an.
- Schließen Sie einen Sensor an den "Body Sensor"-Anschluss und den anderen an den "Pad Sensor"-Anschluss an. Befesten Sie den Pad-Sensor am Wärmepad.
2. Konfigurieren Sie die Einstellungen
- Für Anästhesie
- Stromversorgung des Anästhesiesystems. Tippen Sie auf dem Anest Run Screenauf Setup.
- Wählen Sie das Anästhetikum aus. Tippen Sie auf Typ Anest, und drehen Sie dann Dial B, um Isoflurane oder Sevofluran auszuwählen.
- Stellen Sie die Spritzengröße ein. Berühren Sie die Spritzengröße, und aktivieren Sie dann Zifferblatt B, um eine Größe auszuwählen.
- Berühren Sie zurück, um zum Anest Run Screenzurückzukehren.
- Füllen Sie die Spritze mit dem Flaschendeckeladapter mit Anästhetikum.
- Schließen Sie die Spritze an das Anästhesiesystem an. Berühren Sie Entfernen, um den Pusher-Block bei Bedarf rückwärts zu bewegen.
- Prime die Spritze. Berühren und halten Sie Prime, um den Drückerblock nach vorne zu bewegen, bis der Schubblock die Oberseite des Spritzenkolbens berührt. Das Drehen von B beim Halten der Prime-Taste regelt die Druckblockgeschwindigkeit.
- Für die mechanische Belüftung
- Berühren Sie die Registerkarte Entlüftungsbildschirm, und richten Sie dann Setupein.
- Berühren Sie das Körpergewicht und geben Sie das Gewicht des Tieres ein.
- Berühren Sie Priorität, um Volumen oder druckgesteuerte Belüftung zu wählen. Die Einstellung Körpergewicht legt automatisch die entsprechenden Atemfrequenzen und Gezeitenmengen fest.
- Für Pulsoximetrie
- Berühren Sie die Registerkarte Oxi Run Screen, und richten Sie dann Setupein.
- Berühren Sie HR, und drehen Sie Dial B, um die minimale zulässige Herzfrequenzmessung festzulegen. Voreinstellungen sind verfügbar.
- Zur Erwärmung
- Tippen Sie auf dem Warm Run Screenauf Setup. Wählen Sie eine Erwärmungsmethode und eine Zieltemperatureinstellung aus.
3. Beginnen Sie die Anästhesie-Lieferung
- Anästhesisieren der Maus
- Berühren Sie vom Anest Run ScreenStart Induction, um den Luftstrom zu starten. Die Standard-Induktionsdurchflussrate beträgt 500 ml/min. Das Drehrad A passt den Durchfluss nach Bedarf an.
- Legen Sie die Maus in die Induktionskammer und schließen Sie den Deckel fest. Stellen Sie das Anästhesiemittel-Konzentrationszifferblatt für Isofluran auf 3 % ein.
- Überwachen Sie, bis die Maus die gewünschte Anästhesieebene erreicht hat, bestimmt durch eine Abnahme der Atmungsrate und einen Verlust des Rechtenreflexes, wenn die Kammer gekippt wird. Passen Sie das Anästhesiemittel-Konzentrationszifferblatt nach Bedarf an.
- Sobald das Tier den Rechtenreflex verloren hat und ausreichend beäpftisiert ist, berühren Sie Stop Induction.
- Berühren Sie auf Wunsch Flush Chamber, um die Kammer des Restanästhetikums zu entleeren.
- Öffnen Sie die Klemmen, die zum Nasenkegel führen, und schließen Sie die Klemmen, die zur Kammer führen.
- Touch Start Nase Kegel. Die Einstellung Körpergewicht bestimmt den Nasenkegeldurchfluss, kann jedoch manuell durch Drehen von Dial A eingestellt werden.
- Passen Sie sofort den Nasenkegel an und zentrieren Sie das Tier auf das Infrarot-Wärmepad.
- Setzen Sie den Animal Sensor als Rektalsonde ein.
4. Beginnen Sie mit der mechanischen Belüftung
- Intubieren Sie das Tier.
- Übertragen Sie das Tier in das Intubationsstadium, während das Tier anästhetisiert bleibt.
- Das Tier mit einem auf der vertikalen Intubationsstufe fixierten Faden von seinen oberen Schneidezähnen aussetzen (Abbildung 3).
- Verdrängen Sie vorsichtig die Zunge des Tieres zur Seite und visualisieren Sie die Luftröhre mit den Lichtern im Intubationskit.
- Legen Sie vorsichtig Trachealrohr und überprüfen Sie die korrekte Platzierung durch den Anschluss der kleinen Luftblase an das Rohr und überprüfen, ob die Lunge aufbläht.
- Schließen Sie das Endotrachealrohr an die Lüftungsschläuche an.
- Touch Stop Nose Cone, und berühren Sie dann Start Ventilator.
HINWEIS: Die Einstellung Körpergewicht bestimmt automatisch die richtige Atmungsrate und Gezeitenvolumina. Um eine druckgesteuerte Belüftung durchzuführen, stellen Sie den Inspiratorischen Druck zwischen 15-18 cmH2O ein. Nehmen Sie die Einstellungen des Beatmungsgeräts je nach chirurgischen Protokollen an.
5. Beginnen Sie mit der physiologischen Überwachung
- Legen Sie den Sensor über die Hinterpfote des Tieres (Abbildung 4). Das Pulsoximeter beginnt automatisch mit dem Lesen von HR und SpO2. Berühren Sie die Oxi Run Screen Tab, um Pulsoximetriedaten anzuzeigen.
Ergebnisse
Für diese Studie wurden zehn Wochen alte, männliche, wilde Mäuse des Typs C57Bl6j mit einem Gewicht von 25,41 ± 0,8 g verwendet. Die Mäuse wurden anästhesiert und auf einem Nasenkegel gehalten oder intubiert und auf einem integrierten mechanischen Beatmungsgerät mit 1,5-2,5% Isofluran gewartet, während Herzfrequenz und Sauerstoffsättigung überwacht wurden. Die Tiere wurden in Mikroisolationskaging untergebracht und boten freien Zugang zu Standard-Nagetier-Chow und Wasser per Flasche.
Herzfrequenz und SpO2 wurden während der Wartung über Pulsoximetrie überwacht(Abbildung 5, Abbildung 6und Abbildung 7,). Die Körpertemperatur wurde über ein Infrarot-Heizkissen und eine Wärmelampe bei 36,5-37,5 °C gehalten. Belüftete Tiere erhielten während des Intubationsvorgangs kontinuierlich Isofluran über Intubationsständer mit integriertem Nasenkegel. Jede Maus wurde erfolgreich 15 Minuten lang mit einem Nasenkegel bei niedrigen Durchflussraten von nicht mehr als 141 ml/min Raumluft (RA) oder Sauerstoff (O2) belüftet oder gewartet. Die Herzfrequenzen und die Sauerstoffsättigung des Blutes blieben stabil, wobei es in beiden Messungen für alle Gruppen nur wenige signifikante Veränderungen gab. SpO2 blieb für alle Gruppen zwischen 82-99%, während die Körpertemperatur zwischen 36,5-37,5 °C gehalten wurde. Wir beobachteten, dass sowohl die Position des Pulsoximeters als auch die Körpertemperatur die SpO2-Messungen beeinflussten. Wenn wir einen ungültigen Messwert aus dem Puls-Oximeter beobachtethaben, haben wir die Platzierung des Sensors und den Heizpegel angepasst, um die Körpertemperatur des Kernkörpers stabil zu halten.
Eine zweiseitig durchgeführte ANOVA mit Bonferroni-Korrektur wurde durchgeführt, um die Signifikanz der Daten in Abbildung 5, Abbildung 6 und Abbildung 7zu bestimmen. Ein p-Wertkleiner als 0,05 wurde als signifikant angesehen.
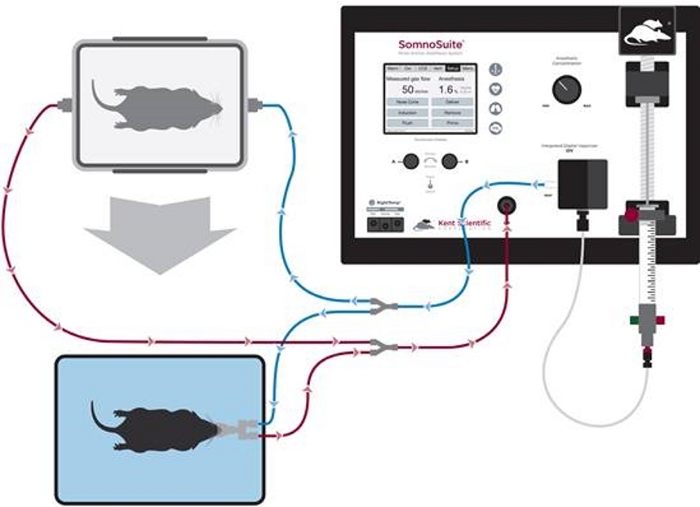
Abbildung 1: Diagramm des Schlauchaufbaus für die Anästhesieinduktion und Dienosekegelpflege. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
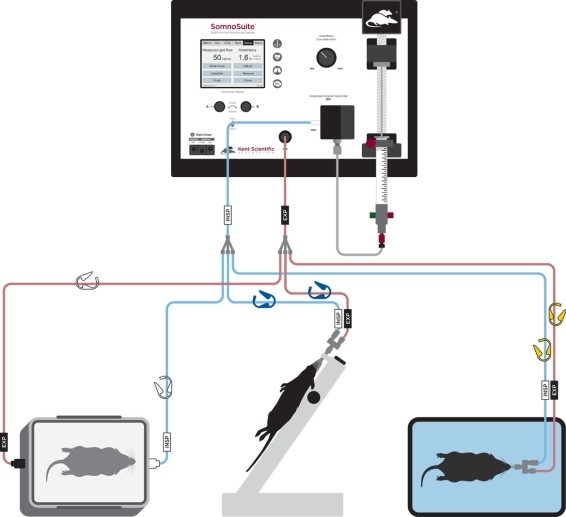
Abbildung 2: Diagramm des Rohraufbaus für Anästhesieind, Intubation und Belüftung. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
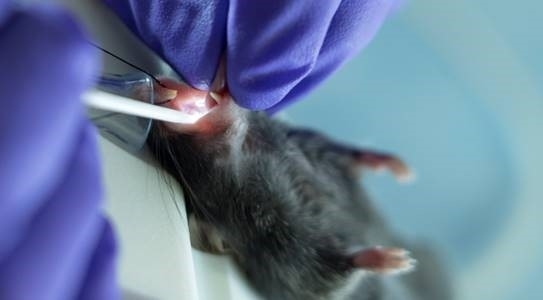
Abbildung 3: Mäuse erhielten während des Intubationsvorgangs eine kontinuierliche Lieferung von Isofluran über einen Intubationsständer mit integriertem Nasenkegel. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Integrierte Pulsoximeter-Sensorplatzierung über der Hinterpfote. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
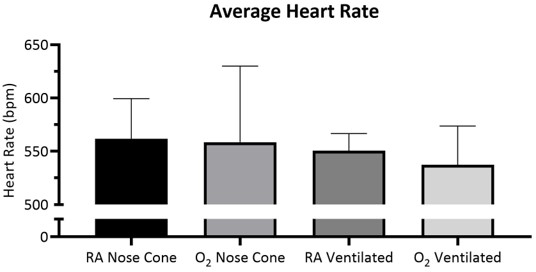
Abbildung 5: Durchschnittliche Herzfrequenz über 15 Minuten ± SD mit Raumluft (RA) oder 100% Sauerstoff (O2), die durch Nasenkegel oder durch Trachealrohr (n=5/Gruppe) belüftet wird. Zwischen den Gruppen wurde kein signifikanter Unterschied beobachtet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
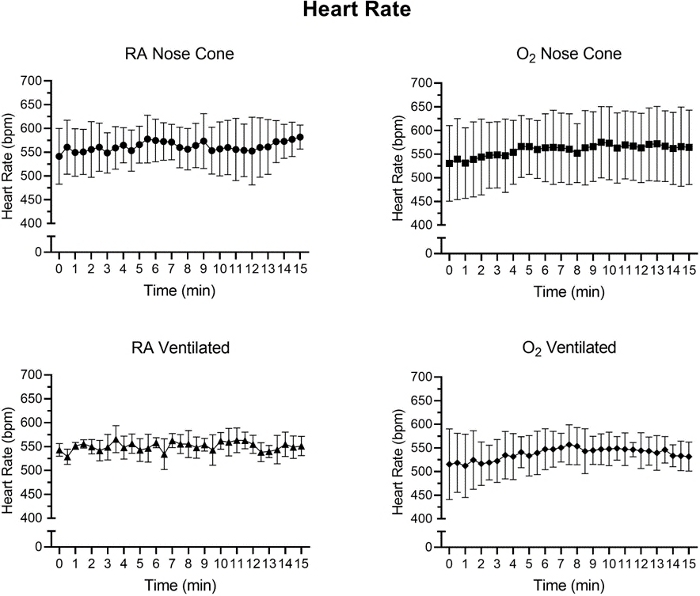
Abbildung 6: Herzfrequenzwerte (bpm), die nach der ersten Anästhesieinduktion mit dem Niedrigstromanästhesiesystem aufgezeichnet wurden. Durchschnittliche Herzfrequenzwerte, berechnet aus 30-Sekunden-Zeitintervallen über einen Zeitraum von 15 Minuten. Jeder Datenpunkt steht für den Mittelwert ± SD aller Tiere in jeder Gruppe (n=5). In keiner Gruppe wurden über den 15-Minuten-Zeitraum signifikante Veränderungen der Herzfrequenz beobachtet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
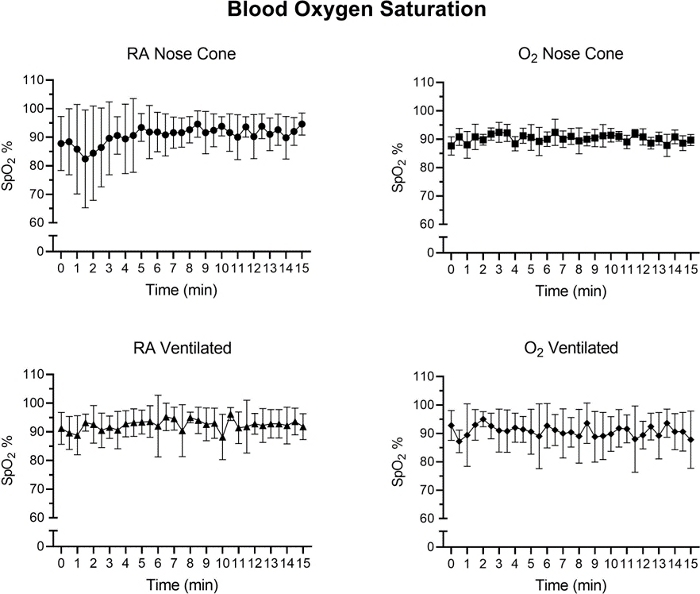
Abbildung 7: Die Gewebesauerstoffsättigung (%) nach der ersten Anästhesieinduktion mit dem Niedrigstromanästhesiesystem. Durchschnittliche SpO 2-Werte, die aus 30-Sekunden-Zeitintervallen über einen Zeitraum von 15 Minuten berechnet werden. Jeder Datenpunkt steht für den Mittelwert ± SD aller Tiere in jeder Gruppe (n=5). In keiner Gruppe wurden signifikante Veränderungen der SpO2 über den 15-Minuten-Zeitraum beobachtet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Dieses digitale Low-Flow-Anästhesiesystem integriert Anästhesie-, Belüftungs-, Erwärmungs- und physiologische Überwachungssysteme in einem einzigen Gerät. Darüber hinaus enthält das System eine interne Pumpe, die es ermöglicht, Umgebungsluft für den Einsatz als Trägergas zu ziehen, wodurch eine Quelle von komprimiertem Gas entfällt.
Bei diesem Verfahren wird das System als einziges Gerät verwendet, um einen Anästhetikum-Verdampfer, mechanisches Beatmungsgerät, Pulsoximeter und Wärmepad zu ersetzen. Zuvor haben wir eine Anästhesieabgabe mit einer Durchflussrate von 100mL/min2demonstriert. Die Durchflussmengeneinstellungen sind für diese Anästhesie-Zufuhrtechnik entscheidend, da die Durchflussrate direkt das Volumen der verwendeten Flüssiganästhetikum steuert. Wir haben auch zuvor gezeigt, wie die Verwendung niedriger Durchflussraten Anästhesieflüssigkeit1,2einsparen kann. Wenn ein herkömmlicher Verdampfer an ein mechanisches Beatmungsgerät angeschlossen ist, muss der Verdampfer kontinuierlich laufen, während der Ventilator Proben aus dem Gasstrom einlupft. Beim digitalen Verdampfer mit integriertem Ventilator wird nur das für die Belüftung notwendige Gas vom Beatmungsgerät ausgedünnt. Dies reduziert die Kosten für Anästhesieflüssigkeiten, Trägergase und Holzkohlefilter.
Obwohl es viele Vorteile für die Verwendung eines Low-Flow-Digital-Verdampfers gibt, gibt es auch Einschränkungen. Dieses System ist für den Betrieb mit niedrigen Durchflussraten ideal für Nagetiere und andere kleine Säugetiere ausgelegt, liefert aber keine Anästhesie über durchFlussraten von 1000 ml/min. Dieses spezielle System ist daher nur für kleine Tierarten geeignet. Das integrierte Pulsoximeter enthält einen Sensor nur für den Pfoteneinsatz. Der Sensor wird nicht für den Einsatz am Schwanz empfohlen, was eine Einschränkung für bestimmte chirurgische Eingriffe sein kann. Während die Atmungsrate über dieses System über den Pfotensensor überwacht werden kann, kann es schwierig sein, über einen längeren Zeitraum konsistente Atemaufnahmen zu erhalten. Im Gegensatz zu einem herkömmlichen Verdampfer benötigt dieses digitale System Schließlich Strom. Batterien stehen für den Einsatz in Fällen zur Verfügung, in denen elektrischer Strom nicht verfügbar ist oder im Falle eines Stromausfalls, und können das System durch mehrere Stunden Nutzung mit Strom versorgen.
Dieses Setup und Protokoll demonstrieren den sicheren und effektiven Einsatz eines digitalen, strömungsarmen Anästhesiesystems mit integriertem Beatmungsgerät und physiologischen Überwachungsmodulen. Dieses Setup wird für alle Labore mit begrenzten Bankräumen nützlich sein, oder wo es nicht möglich ist, mehrere Geräte und Schläuche in der Nähe eines chirurgischen Feldes unterzubringen. Ein All-in-One-System bietet zahlreiche Vorteile, darunter die Eliminierung von Komprimierten Gastanks und separate physiologische Überwachungsgeräte. Insgesamt könnte dieses integrierte System von Gruppen in Betracht gezogen werden, bei denen der Einsatz eines herkömmlichen Verdampfers nicht ideal ist.
Offenlegungen
Dieses Projekt wurde von der Kent Scientific Corporation mit Ausrüstung und Finanzierung unterstützt. Die Autoren Krista Bigiarelli und Dave FitzMiller sind Mitarbeiter der Kent Scientific Corporation, die in diesem Artikel verwendete Geräte herstellt. Open-Access-Publikation dieses Artikels wird von Kent Scientific Corporation gesponsert.
Danksagungen
Die Autoren haben keine Anerkennung.
Materialien
| Name | Company | Catalog Number | Comments |
| Intubation Kit | Kent Scientific Corporation | ETM-MSE | Includes intubation stage, intubation tube, LED light |
| Isoflurane Liquid Inhalation 99.9% | Henry Schein, Inc. | 1182097 | Glass bottle 250mL |
| MouseSTAT Pulse Oximeter | Kent Scientific Corporation | SS-03 | Integrated into SomnoSuite |
| Oxygen Tank | Indiana Oxygen Company | 23-160246 | Medical Grade O2 99% |
| RoVent Automatic Ventilator | Kent Scientific Corporation | SS-04 | Integrated into SomnoSuite |
| SomnoSuite Low Flow Digital Anesthesia System | Kent Scientific Corporation | SS-01 | Includes RightTemp Homeothermic Warming control, pad, and temperature sensors |
| SomnoSuite Mouse Starter Kit | Kent Scientific Corporation | SOMNO-MSEKIT | Includes nose cone, syringes, induction chamber, and charcoal canister |
Referenzen
- El-Attar, A. M. Guided isoflurane injection in a totally closed circuit. Anaesthesia. 46 (12), 1059-1063 (1991).
- Lockwood, G., Chakrabarti, M. K., Whitwam, J. G. A computer-controller closed anaesthetic breathing system. Anaesthesia. 48 (8), 690-693 (1993).
- Lowe, H. J., Cupic, M. Dose-regulated automated anesthesia (Abstract). British Journal of Clinical Pharmacologyl. 12 (2), 281-282 (1971).
- Walker, T. J., Chackrabarti, M. K., Lockwood, G. G. Uptake of desflurane during anaesthesia. Anaesthesia. 51 (1), 33-36 (1996).
- Weingarten, M., Lowe, H. J. A new circuit injection technic for syringe-measured administration of methoxyflurane: a new dimension in anesthesia. Anesthesia & Analgesia. 52 (4), 634-642 (1973).
- Enlund, M., Wiklund, L., Lambert, H. A new device to reduce the consumption of a halogenated anaesthetic agent. Anaesthesia. 56 (5), 429-432 (2001).
- Kelly, J. M., Kong, K. L. Accuracy of ten isoflurane vaporisers in current clinical use. Anaesthesia. 66 (8), 682-688 (2011).
- Matsuda, Y., et al. NARCOBIT - A newly developed inhalational anesthesia system for mice. Experimental Animals. 56 (2), 131-137 (2007).
- Soro, M., et al. The accuracy of the anesthetic conserving device (Anaconda) as an alternative to the classical vaporizer in anesthesia. Anesthesia & Analgesia. 111 (5), 1176-1179 (2010).
- Ward, C. S. . Physical principles and maintenance. Anaesthetic equipment. , (1985).
- Ambrisko, T. D., Klide, A. M. Evaluation of isoflurane and Sevoflurane vaporizers over a wide range of oxygen flow rates. American Journal of Veterinary Research. 67 (6), 936-940 (2006).
- Damen, F. W., Adelsperger, A. R., Wilson, K. E., Goergen, C. J. Comparison of traditional and integrated digital anesthetic vaporizers. Journal of the American Association for Laboratory Animal Science. 54 (6), 756-762 (2015).
- Adelsperger, A. R., Bigiarelli-Nogas, K. J., Toore, I., Goergen, C. J. Use of a Low-flow Digital Anesthesia System for Mice and Rats. Journal of Visualized Experiments. (115), e54436 (2016).
- Flecknell, P. . Laboratory animal anaesthesia. , (2009).
- Mapleson, W. W. The elimination of rebreathing in various semiclosed anaesthetic systems. British Journal of Anaesthesia. 26 (5), 323-332 (1954).
- Chakravarti, S., Basu, S. Modern Anaesthesia Vapourisers. Indian Journal of Anaesthesia. 57 (5), 464-471 (2013).
- Mullin, L., et al. Effect of anesthesia carrier gas on in vivo circulation times of ultrasound microbubble contrast agents in rats. Contrast Media & Molecular Imaging. 6 (3), 126-131 (2011).
- Flores, J. E., et al. The effects of anesthetic agent and carrier gas on blood glucose and tissue uptake in mice undergoing dynamic FDG-PET imaging: sevoflurane and isoflurane compared in air and in oxygen. Molecular Imaging and Biology. 10 (4), 192 (2008).
- Carroll, G. . Small Animal Anesthesia and Analgesia. , (2008).
- Thomas, J., Lerche, P. . Anesthesia and Analgesia for Veterinary Technicians, 4th ed. 335, (2011).
- McKelvey, D. H. . Veterinary Anesthesia and Analgesia. , (2003).
- Tranquilli, W. J., Thurmon, J. C., Grimm, K. A. . Lumb and Jones' veterinary anesthesia and analgesia. , 23-86 (2013).
- Matsuda, Y., et al. Comparison of newly developed inhalation anesthesia system and intraperitoneal anesthesia on the hemodynamic state in mice. Biological and Pharmaceutical Bulletin. 30 (9), 1716-1720 (2007).
- Garber, J., et al. . Guide for the Care and Use of Laboratory Animals. 8th edn. , (2011).
- Zarndt, B. S., et al. Use of a far-infrared active warming device in Guinea pigs (Cavia porcellus). Journal of the American Association for Laboratory Animal Science. 54 (6), 779-782 (2015).
- Wolforth, J., Dyson, M. C. Flushing induction chambers used for rodent anesthesia to reduce waste anesthetic gas. Lab Animal. 40 (3), 76-83 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten