Method Article
Unión Neuromuscular In vitro inducida a partir de células madre pluripotentes inducidas por el hombre
En este artículo
Resumen
Aquí proporcionamos un protocolo para generar NMJ in vitro a partir de células madre pluripotentes inducidas por humanos (iPSC). Este método puede inducir NMJ con morfología madura y función en 1 mes en un solo pozo. Los NMJ resultantes podrían utilizarse potencialmente para modelar enfermedades relacionadas, para estudiar mecanismos patológicos o para detectar compuestos farmacológicos para la terapia.
Resumen
La unión neuromuscular (NMJ) es una sinapsis especializada que transmite potenciales de acción desde la neurona motora al músculo esquelético para el movimiento mecánico. La arquitectura de la estructura NMJ influye en las funciones de la neurona, el músculo y la interacción mutua. Estudios anteriores han reportado muchas estrategias mediante el co-cultivo de las neuronas motoras y miotubos para generar NMJ in vitro con proceso de inducción complejo y largo período de cultivo, pero han luchado para recapitular la morfología madura NMJ y la función. Nuestro sistema de inducción NMJ in vitro está construido diferenciando el iPSC humano en un solo plato de cultivo. Al cambiar el medio de inducción miogénico y neurogénico para la inducción, el NMJ resultante contenía componentes pre y post sinápticos, incluyendo neuronas motoras, músculo esquelético y células Schwann en el cultivo de un mes. El ensayo funcional de NMJ también mostró que la contracción de los miotubos puede ser desencadenada por Ca++ luego inhibido por curare, un inhibidor del receptor de acetilcolina (AChR), en el que la señal estimulante se transmite a través de NMJ. Este enfoque simple y robusto derivó con éxito la compleja estructura de NMJ con conectividad funcional. Este NMJ humano in vitro, con sus estructuras y funciones integradas, tiene un potencial prometedor para el estudio de mecanismos patológicos y cribado de compuestos.
Introducción
La unión neuromuscular (NMJ) es una sinapsis especializada que transmite señales de neuronas motoras a músculos esqueléticos para controlar el movimiento muscular voluntario1,,2. Esta sinapsis se compone de partes pre y postsinápticas. En la parte presináptica, la neurona motora libera acetilcolina (ACh) de vesículas sinápticas por exocitosis. ACh se libera de las vesículas sinápticas para cruzar la hendidura sináptica y unirse a AChR en la parte postsináptica para desencadenar un potencial de acción para la contracción muscular3,,4. Cualquier mal funcionamiento en esta delicada estructura puede causar enfermedades NMJ, incluyendo atrofia muscular espinal (SMA), síndromes miastenicos congénitos (CMS), miastenia grave (MG)5,6,7, etc. Estas enfermedades dañan en gran medida la calidad de vida de los pacientes y, por desgracia, no tienen enfoques de tratamiento eficaces debido a la falta de comprensión del mecanismo patológico. En este estudio, nuestro objetivo era generar NMJ humano in vitro a partir de iPSC humanos para un modelado preciso de la enfermedad y para el cribado de compuestos terapéuticos.
Estudios anteriores han demostrado la posibilidad de generar NMJ in vitro mediante estrategias de co-cultivo. Las neuronas motoras y los miotubos esqueléticos se generan respectivamente. Los dos tipos celulares se pueden generar a partir de cultivos de tejido primario humano o ratón o ser inducidos a partir de células madre8,9,10,11 y luego co-cultivado para la formación NMJ. Las otras aplicaciones incluyen la fusión de la NMJ co-cultivada en dispositivos 3D microfluídicos y el uso de unidades optogenéticas para ensayos funcionales cuantificables12,,13. Sin embargo, estas estrategias toman un largo período de cultivo y requieren lucha para obtener los componentes primarios de la NMJ, ya sea la neurona motora o el miotu esquelético simultáneamente. Otro componente importante de NMJ, la célula Schwann, no se puede generar en estos sistemas de cultivo. El sistema de cultivo avanzado que contiene el miotubo, la neurona motora y la célula Schwann es deseable, ya que puede ofrecer un modelo fiable y robusto para los estudios NMJ.
La diferenciación miogénica 1 (MYOD1) es un regulador miogénico bien conocido para la miogénesis14. El eficiente método de diferenciación miogénica que aplicó MYOD1 para conducir iPSC en miotubos fue construido en un estudio anterior15. Por lo tanto, indujmos los miotubos sobreexpresando MYOD1 en iPSCs15,y se demostró una alta eficiencia de la diferenciación miogénica. Curiosamente, las células de las neuronas aparecieron junto con los miotubos espontáneamente después del día 10. La aparición de células neuronas en el cultivo miogénico nos ha llevado a desarrollar la estrategia para generar NMJ in vitro en un solo plato. Aquí proporcionamos una estrategia para generar NMJs mediante la sobreexpresación de MYOD1 en iPSC humanos para la inducción de neuronas miogénicas y motoras en el mismo plato de cultivo. Las neuronas motoras se inducen espontáneamente con varios factores neurotróficos (GDNF, BDNF, NT3, etc.) 8, y, mientras tanto, las células Schwann también se pueden inducir16,17. A través de las interacciones entre los miotubos, las neuronas motoras y las células Schwann, el NMJ maduro se forman18. Este método puede generar NMJ funcional de manera eficiente, permitiendo el estudio potencial de mecanismos patológicos y cribado de compuestos terapéuticos.
Protocolo
1. Preparación de placas recubiertas de matriz extracelular (ECM)
- ECM diluido (ver Tabla de Materiales)con hielo frío 1x PBS a una concentración final del 2%.
- Añadir 1 ml de ECM a 49 ml de 1x PBS en un tubo de plástico de 50 ml. Mezclar bien pipeteando hacia arriba y hacia abajo varias veces.
- Coloque 1 cubreobjetos en cada pozo de una placa de 6 pozos. Añadir 1,5 ml de ECM al 2% en cada pozo.
- Incubar la placa de pozo con un 2% de ECM durante 2 h a 37oC.
- Aspirar ECM de la placa de pozo y almacenar la placa a 4 oC antes de su uso.
2. Diferenciación de iPSCs hacia NMJ
- Semilla 4 x 105 de iPSC por pozo en la placa de 6 pocillos preparada en la sección 1. Asegúrese de sembrar las células en el cubreobjetos pre-depositados en el pozo.
NOTA: En este estudio, se utilizó la línea celularMYOD iPS 201B7, un regalo del Dr. Sakurai's Lab,15.- Retire el medio de los iPSC en el plato de cultivo de 6 cm y lave los iPSC una vez con 1 PBS.
- Añadir 1 ml de solución desprendimiento celular al plato e incubar durante 10 min a 37oC.
- Añadir 3 ml de medio celular del tallo embrionario de primate (ES) al plato y pipeta 3 veces suavemente.
- Recoger el sobrenadante, que contiene iPSC separados, en un tubo de plástico de 50 ml y centrífuga a 160 x g a 4 oC durante 5 min.
- Aspirar cuidadosamente el sobrenadante, resuspender los iPSC en un medio celular de primate ES de 3 ml con 10 M Y27632, y contar el número de célula utilizando un hemocitoómetro.
- Diluir los iPSC con el medio celular de primate ES y 10 M Y27632 a una concentración de 2 x 105 células/ml. Añadir 2 ml de iPSC en el cubreobjetos pre-depositado en el pozo que se describe en la sección 1.
- Inducción de los iPSC a NMJ
- El día 1, 24 h después de sembrar los iPSC a la placa de 6 pocillos, retire el medio de cultivo y reemplácelo con 2 ml de medio celular es de primate fresco que contenga 1 g/ml de doxiciclina a cada pocía.
- Cambie el medio con 2 ml de medio de diferenciación miogénico (MDM) (Tabla 1) que contenga 1 g/ml de doxiciclina (concentración final) a cada pocero. Refresque el medio todos los días desde el día 2 hasta el día 10.
- Desde el día 11, cambie el medio a 2 mL del medio NMJ (Tabla 1) a cada pozo. Actualice el medio cada 3-u20124 días a partir de entonces hasta el día 30.
- Observar la NMJ diferenciada por microscopía invertida por fase en el día 30. El NMJ se puede utilizar para el siguiente análisis.
3. Tinción de inmunofluorescencia (IF)
- En el día 30, aspirar el medio de cultivo de la placa de 6 pozos. Fijar el cultivo NMJ añadiendo 2 mL de 4% de paraformaldehído a cada pozo durante 30 minutos a temperatura ambiente.
- Lavar las muestras 3 veces añadiendo 2 ml de 1x PBS a cada pozo (3 min para cada lavado).
- Permeabilizar las muestras con 0.1% Tritón/PBS durante 10 min.
- Repita el paso 3.2.
- Bloquear las muestras con 0,5% de BSA durante 1 h a temperatura ambiente.
- Repita el paso 3.2.
- Incubar las muestras con los anticuerpos primarios a 4oC durante la noche. La dilución de los anticuerpos es la siguiente: Islote 1 (1 g/ml), cadena pesada de miosina (MYH) (1/300), neurofilamentos (NF) (1 g/g), /mL), S-100 (1/300), proteína de vesícula sináptica 2 (SV2) (1 g/ml), Tuj1 (1/1000).
- Repita el paso 3.2.
- Incubar las muestras con los anticuerpos secundarios a temperatura ambiente durante 1 h. La concentración de los anticuerpos secundarios utilizados es la siguiente: Anti-ratón IgG 488 conjugado (0,1 g/ml), anti-conejo IgG 488 conjugado (0,1 g/ml).
- Repita el paso 3.2.
- Incubar las muestras con aBTX-647 (0,5 g/ml) para la tinción de AChR y con DAPI (1 g/ml) para la tinción del núcleo.
- Repita el paso 3.2.
- Recoja el cubreobjetos con un par de fórceps de la placa de 6 pocillos y móntelo en una solución de 50% de glicerol/PBS en una corredera de microscopio.
4. Microscopía electrónica de barrido (SEM)
- Fijar el cultivo NMJ con 4% de paraformaldehído y 1% glutaraldehído preparado en 0.1 M tampón de fosfato de potasio a temperatura ambiente durante 1 h.
- Lave las muestras 3 veces sumergiéndolas en un tampón de fosfato potásico de 0,1 M a temperatura ambiente (10 min para cada lavado).
- Deshidratar las muestras con concentraciones ascendentes de etanol (50%, 70%, 90%, 95% y 100% dos veces). Sumergir las muestras en cada concentración de etanol durante 10 min.
- Secar las muestras por un secador de punto crítico (-30 oC, 0,1 Torr).
- Recubrir las muestras con revestimiento de iones Pt (platino) (30 mA durante 3 min; espesor de Pt es de aproximadamente 20 nm).
- Observe las muestras por SEM a 5 kV.
5. Microscopía electrónica de transmisión (TEM)
- Utilice un rascador celular para cosechar el tejido de la placa de cultivo NMJ. Da forma al tejido en un pequeño pellet (3 mm3)con una cuchilla de afeitar y pega por gelización para formar una pieza envuelta en gel. Fijar la pieza envuelta en gel con 2% de paraformaldehído y 2% de glutaraldehído preparado en 0,1 M tampón de fosfato de potasio a 4 oC durante la noche.
- Lave las muestras 3 veces sumergiéndolas en un tampón de fosfato potásico de 0,1 M (15 min para cada lavado) a temperatura ambiente.
- Postfirja las muestras con 1% de tetróxido de osmio preparado en H2O doble destilado durante 1 h a temperatura ambiente.
ADVERTENCIA: Este paso debe realizarse en una campana química. - Repita el paso 5.2.
- Deshidratar las muestras con concentraciones ascendentes de etanol (50%, 70%, 90%, 95% y 100% dos veces). Sumergir las muestras en cada concentración de etanol durante 10 min.
- Aspirar el 100% etanol. Infiltrar las muestras con proporciones de volumen ascendente de resina epoxi a mezclas de etanol 100% (1:3, 1:1 y 3:1). Agitar cada mezcla suavemente a 10 rpm durante 1 h a temperatura ambiente.
- Sustituya la mezcla de epoxi-etanol por resina epoxi pura y agitar suavemente a 10 rpm durante 4 h a temperatura ambiente.
- Después de 4 h, refresque la resina epoxi con resina epoxi fresca y agitar suavemente a 10 rpm durante la noche a temperatura ambiente.
- Incrustar las muestras en cápsulas de incrustación con resina epoxi fresca y curar las muestras en un horno a 65 oC durante la noche.
- Ultramicrotomía
- Recortar gruesomente los bloques de muestra bajo un microscopio de disección para la orientación correcta.
- Recorta finamente los bloques recortados gruesamente con un cuchillo de vidrio sobre un ultramicrotome para obtener superficies lisas.
- Prepare secciones ultrafinas de 70 nm a partir de los bloques bien recortados con un cuchillo de diamante. Recupere las secciones ultrafinas con 200 rejillas de cobre recubiertas de carbono-formavar de malla.
- Manchar las secciones ultrafinas que contienen rejillas con acetato de uranilo saturado preparado en H2O doble destilado durante 30 min y lavar las rejillas 3 veces con H2O doble destilado (10 min para cada lavado).
- Además, contraste las secciones ultrafinas con el citrato principal de Reynold19 (2,5%) durante 5 minutos y lavar con H2O hervido pre-enfriado a temperatura ambiente 3 veces (10 min para cada lavado). Ponga varios gránulos de hidróxido de sodio alrededor de la zona de tinción para evitar la precipitación deCO2 en las secciones.
- Observar las secciones ultrafinas de TEM a 70 kV.
6. Contracción muscular y tratamiento curare
- Para activar la contracción del miotu, agregue 25 mM de CaCl2 en el medio de cultivo en el paso 2.3. El movimiento de los miotubos se puede observar en 1-u20122 min.
- Coloque la placa de 6 pozos en el escenario de un microscopio invertido. Graba una película de contracción de miotu por microscopía de células vivas.
- Para detener la contracción del miotu, añada curare al medio de cultivo (300 ng/mL). A continuación, grabe la película como paso 6.2.
- Abra el archivo de película con el software de análisis de vectores de movimiento y, a continuación, haga clic en el botón Análisis de movimiento para analizar la película.
NOTA: La contracción de los miotubos se muestra como gráfico de movimiento en el tiempo. Las películas están codificadas por colores para mostrar la velocidad de movimiento de los miotubos. Las señales brillantes codificadas por colores indican los movimientos de los miotubos donde el color rojo muestra la velocidad de movimiento más rápida y el color azul muestra la velocidad de movimiento más lenta.
Resultados
Usando nuestra estrategia de diferenciación, el cultivo mostró componentes pre y post-sinápticos de la NMJ en el día 30. Los componentes NMJ fueron inducidos y bien desarrollados en un solo pozo, y su morfología y ubicaciones en la NMJ fueron demostrados por la microscopía IF (Figura 1). El diagrama de flujo de la Figura 1A resume el curso de tiempo de la progresión de la diferenciación NMJ. La tinción de neurofilamentos (NF), vesículas sinápticas (SV2) y AChR (Figura 1B,C) indican las neuronas. Las imágenes de tinción única de NF y SV2 se muestran en la Figura Suplementaria 1. La tinción de alfa-bungarotoxina indica AChR (Figura 1C). La imagen combinada muestra las ubicaciones relativas de una neurona motora y AChR en la NMJ (Figura 1D,E). El segundo conjunto de tinción IF indica la neurona motora por Tuj1 e Islet 1 (Figura 1G,H) y miotubos postsinápticos por cadena pesada de miosina (Figura 1I). Las células Schwann también fueron etiquetadas por el anticuerpo S-100 en el cultivo NMJ (Figura Complementaria 2).
Para confirmar aún más las identidades de los componentes NMJ, utilizamos SEM para el análisis morfológico detallado. La morfología madura NMJ con terminales de axón expandido, axones y fibras musculares se muestran en la Figura 2A,B. TEM se realizó para revelar la ultraestructura madura de los componentes NMJ incluyendo el terminal de axón presináptico con vesículas sinápticas y la parte postsináptica, que está separada por la hendidura sináptica (Figura 2C-u2012E). Los pliegues de unión están indicados por la línea amarilla discontinua, que marca la unión de la neurona y las fibras musculares (Figura 2C). Los terminales de axón maduros que contienen vesículas sinápticas se muestran en la Figura 2D,E (flechas amarillas). Los resultados morfológicos muestran que los componentes NMJ fueron bien inducidos y madurados.
Para evaluar la función del NMJ in vitro, realizamos análisis de movimiento estimulando la neurona motora con CaCl2 para desencadenar contracciones de miotu. Los resultados mostraron que Ca2+ puede desencadenar contracciones musculares. Las contracciones podrían ser interrumpidas por curare. La NMJ mostró señales de movimiento prominentes que desaparecieron con el tratamiento de curare(Figura 3). Este efecto confirma que las señales de la neurona motora se transmitieron a través del NMJ para desencadenar la contracción muscular. En conjunto, los datos de la microscopía IF, SEM y TEM demostraron la distribución espacial, morfología y madurez de los componentes NMJ en el NMJ in vitro generado por el protocolo descrito anteriormente. El análisis de movimiento validó la función del NMJ in vitro, lo que implica su posible aplicación al desarrollo de estrategias terapéuticas.

Figura 1: Diagrama de flujo para la inducción NMJ y las imágenes IF de la referencia cultural NMJ. (A) Un diagrama de flujo para la progresión de la diferenciación NMJ. (B-u2012F) Detección de componentes NMJ, neurofilamentos (NF), vesículas sinápticas (SV2) y AChR. Las flechas blancas en el panel D indican el NMJ. (G-u2012K) Componentes pre y postsinápticos del NMJ. Tuj1 e Islet1 indican la neurona motora, y la cadena pesada de miosina (MYH) indica el miotu. a-BTX, alfa-bungarotoxina. Haga clic aquí para ver una versión más grande de esta figura.
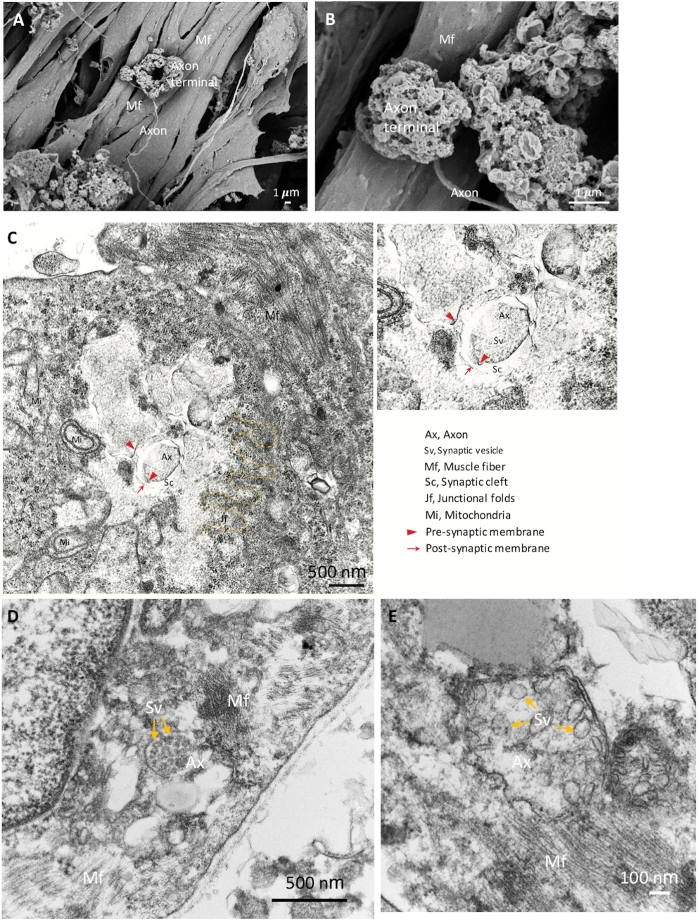
Figura 2: Imágenes SEM y TEM de NMJ maduro. (A) La distribución espacial de los componentes NMJ muestra el terminal de axón anclado en la superficie de la fibra muscular (Mf). (B) Un aumento más alto del NMJ muestra los terminales de axón. (C) La ultraestructura de un NMJ maduro con terminal de axón presináptico (cabezas de flecha rojas) y vesículas sinápticas (Sv), hendidura sináptica (Sc) y partes postsinápticas (flechas rojas). Los pliegues de unión (jf) se indican mediante la línea discontinua amarilla. Hacha, axón. (D, E) Las imágenes de alto aumento muestran las vesículas sinápticas en terminales de axón (flechas amarillas). Haga clic aquí para ver una versión más grande de esta figura.
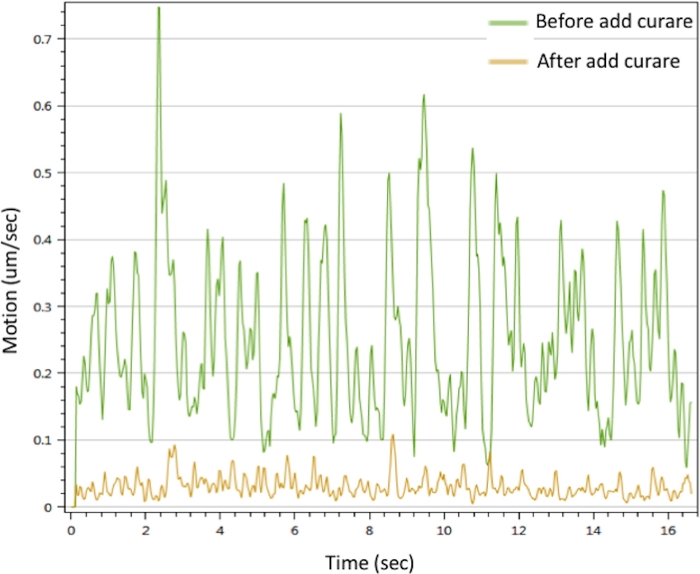
Figura 3: Análisis de contracción de Myotubes de NMJ in vitro. La contracción de los myotubos se activó con una solución de25 mM de CaCl 2 (línea verde). Las contracciones se inhibieron después de tratarse con curare (línea amarilla). Consulte también Película Suplementaria 1 y Película Suplementaria 2. Haga clic aquí para ver una versión más grande de esta figura.
Película Suplementaria 1: La contracción de los myotubos desencadenada por Ca++. Por favor, haga clic aquí para descargar este video.
Película Suplementaria 2: Se muestra la contracción mucho más débil de los miotubos después del tratamiento con curare. Por favor, haga clic aquí para descargar este video.
Figura complementaria 1: Las imágenes de tinción única de neurofilamentos (NF, flechas blancas) en el cultivo NMJ. Las imágenes de tinción única de vesículas sinápticas (SV2, flechas blancas) en el cultivo NMJ. Haga clic aquí para descargar esta figura.
Figura complementaria 2: Las células Schwann etiquetadas por el anticuerpo S-100 en el cultivo NMJ. Haga clic aquí para descargar esta figura.
| Medio de diferenciación miogénico (MDM) | MEM-alfa | 500mL |
| 100mM 2-ME | 1117-L | |
| Doxiciclina | 1 g/ml | |
| Ksr | 56mL (final a 10%) | |
| Pluma/Strep | 2.5mL | |
| Total | 560mL | |
| 100mM 2-mercaptoetanol | 2-mercaptoetanol | 7-L |
| d.d. agua | 993-L | |
| Total | 1000 l | |
| Medio NMJ | Medio neurobasal (NB) | 500mL |
| B27 | 1x (stock en 50x) | |
| Bdnf | 10ng/mL | |
| Gdnf | 10ng/mL | |
| N2 | 1x (stock en 100x) | |
| Nt3 | 10ng/mL | |
| Pluma/Strep | 2.5mL | |
Tabla 1: Fórmula de medio.
Discusión
Estudios previos han reportado métodos para la formación NMJ in vitro con métodos sofisticados que requieren cultivo a largo plazo8,10,12,13,20. Estos logros lideran la progresión de la NMJ in vitro. Sin embargo, las metodologías complicadas obstaculizaron el acceso de los estudios NMJ. Nuestro protocolo evita la co-cultura para generar NMJ de manera eficiente y robusta en un solo pozo. Se observaron tres tipos de células en el NMJ en nuestro sistema de inducción, incluyendo los miotubos, las neuronas motoras y las células Schwann18. Además, se verificaron la morfología madura y la función.
Basado en nuestro estudio anterior, la densidad celular inicial es un factor crítico para la formación de NMJ, y diferentes densidades celulares inducen varios números de NMJ en el cultivo18. Una baja densidad celular (< 1 x 104/cm2) indujo un bajo número de neuronas, que es desfavorable para la formación de NMJ. Aunque se necesitaría mucho más tiempo y recursos para preparar una mayor densidad de células (> 1 x 105/cm2),recomendamos que la densidad de celdas esté entre 1,5 x 104/cm2 y 5 x 104/cm2 utilizando nuestro protocolo. El NMJ generado por este protocolo es un tejido heterogéneo con múltiples tipos de células que está más cerca de imitar las condiciones fisiológicas. Los miotubos se encuentran para distribuir uniformemente en un plato de cultivo, pero las neuronas motoras aparecen al azar, de los cuales el fenómeno resulta en la distribución desigual de los NMJ en un cultivo. Este NMJ es adecuado para estudios cualitativos en lugar del análisis que requiere sistemas de cultivo homogéneos. También usamos otras líneas celulares, eq., H9 (línea celular ES)18 y A11 (línea celular iPS, datos no mostrados) para generar NMJ por este protocolo. El NMJ se puede generar con éxito en morfología y función. La condición de cultivo, sin embargo, debe optimizarse para diferentes líneas celulares.
La contracción de los miotubos químicamente desencadenados y la inhibición dependiente del curare confirmaron que nuestro NMJ in vitro era funcional y podría aplicarse potencialmente para ensayos prácticos. Las contracciones musculares espontáneas se observaron aleatoriamente a las 3-u20124 semanas de cultivo, pero podría evitarse extendiendo el tiempo de cultivo hasta dosmeses 18.
Se han publicado varias estrategias para generar NMJ in vitro de diferentes etapas de maduración, pero la NMJ in vitro generada en nuestro sistema mostró la madurez significativa, ya que podemos observar la transición de las subunidades gamma a épsilon de AChR durante el cultivo18. La madurez es una consideración importante para el modelado de enfermedades con NMJ21in vitro. En conclusión, un NMJ in vitro con componentes estructurales integrados, madurez y función es de uso potencial para el desarrollo terapéutico.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos al Dr. Sakurai por proporcionar amablemente 201B7MYOD. El estudio de microscopía electrónica fue apoyado por Keiko Okamoto-Furuta y Haruyasu Kohda (División de Estudio Microscópico Electrónico, Centro de Estudios Anatómicos, Escuela de Posgrado de Medicina, Universidad de Kioto). El anticuerpo monoclonal fue desarrollado por la Universidad HHMI/Columbia, obtenido del Banco de Estudios del Desarrollo Hybridoma, creado por el Instituto Nacional de Salud Infantil y Desarrollo Humano de los NIH, y mantenido en el Departamento de Biología de la Universidad de Iowa. También damos las gracias a Shiori Oshima, Kazuhiro Nakagawa y Eriko Matsui por el análisis de vectores de movimiento. Este trabajo fue apoyado por la financiación de la Sociedad Japonesa para la Promoción de la Ciencia KAKENHI, concédi con los números 16H05352 y 20H03642 (a MKS); iPS Cell Research Fund (a CYL y MKS); Mochida Memorial Foundation for Medical and Pharmaceutical Research (a MKS); Takeda Science Foundation (a MKS); y una subvención de The Program for Intractable Diseases Research utilizando células iPS específicas de enfermedades, que fue ayudado por la Agencia Japonesa de Investigación y Desarrollo Médico (17935400 a CYL y MKS, y 17935423 a MKS).
Materiales
| Name | Company | Catalog Number | Comments |
| Medium, growth factors and reagents | Item | Brand | Cat. Number |
| 2-mercaptoethanol | Nacalai tesque | 21418-42 | |
| B27, Gibco | Gibco | 12587-001 | |
| BDNF | R & D Systems | 248-BD | |
| Cell detachment solution, Accumax | STEMCELL Technologies | #07921 | |
| Critical point dryer | Hitachi | ES-2030 | |
| Doxycycline | Takara | 631311 | |
| ECM, Matrigel (growth factor reduced) | Corning | 356230 | |
| GDNF | R & D Systems | 212-GD | |
| Gelation, IP gel | Geno Staff | PG20-1 | |
| Ions coater | JEOL | JEC3000FC | |
| iPSC medium, mTeSR | STEMCELL Technologies | 85850 | |
| KnockOut SR (KSR) | Gibco | 10828-028 | |
| live cell microscopy | Nikon | Eclipse Ti microscope | |
| MEM-alpha | Gibco | 12571-071 | |
| Motion vector analysis software | Sony | SI8000 | |
| N2, Gibco | Gibco | 17502-048 | |
| Neurobasal medium | Gibco | 21103-049 | |
| NT3 | R & D Systems | 267-N3 | |
| Primate ES cell medium | ReproCell | RCHEMD001 | |
| SEM | Hitachi | S-4700 | |
| TEM | Hitachi | H7650 | |
| Y27632 | Wako Chemicals GmbH | 253-00513 | |
| Antibodies | Brand | Cat. Number | Dilutions |
| Molecular Probes | B3545 | 0.5 ug/ml | |
| Islet 1 | DSHB | 40.2D6 | 1/100 |
| Myosin heavy chain (MYH) | MilliporeSigma | A4.1025 | 1/300 |
| Neurofilaments (NF) | MilliporeSigma | MAB5254 | 1/500 |
| S-100 | Abcam | ab14849 | 1/300 |
| Synaptic vesicle protein 2 (SV2) | DSHB | SV2 | 1/50 |
| Tuj1 | Covance | MMS435P | 1/1000 |
Referencias
- Hong, I. H. K., Etherington, S. J. Neuromuscular Junction. eLS. , (2001).
- Sanes, J. R., Lichtman, J. W. Development of the vertebrate neuromuscular junction. Annual Review of Neuroscience. 22, 389-442 (1999).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21 (9), 2348-2356 (2017).
- Slater, C. R. The Structure of Human Neuromuscular Junctions: Some Unanswered Molecular Questions. International Journal of Molecular Sciences. 18 (10), 2183 (2017).
- Comley, L. H., Nijssen, J., Frost-Nylen, J., Hedlund, E. Cross-disease comparison of amyotrophic lateral sclerosis and spinal muscular atrophy reveals conservation of selective vulnerability but differential neuromuscular junction pathology. Journal of Comparative Neurology. 524 (7), 1424-1442 (2016).
- Shigemoto, K., et al. Muscle weakness and neuromuscular junctions in aging and disease. Geriatrics & Gerontology International. 10, 137-147 (2010).
- Abicht, A., Müller, J., Lochmüller, H. Congenital Myasthenic Syndromes. GeneReviews. , (2016).
- Faravelli, I., et al. Motor neuron derivation from human embryonic and induced pluripotent stem cells: experimental approaches and clinical perspectives. Stem Cell Research & Therapy. 5 (4), 87-100 (2014).
- Demestre, M., et al. Formation and characterisation of neuromuscular junctions between hiPSC derived motoneurons and myotubes. Stem Cell Research. 15 (2), 328-336 (2015).
- Yoshida, M., et al. Modeling the early phenotype at the neuromuscular junction of spinal muscular atrophy using patient-derived iPSCs. Stem Cell Reports. 4 (4), 561-568 (2015).
- Vilmont, V., Cadot, B., Ouanounou, G., Gomes, E. R. A system for studying mechanisms of neuromuscular junction development and maintenance. Development. 143 (13), 2464-2477 (2016).
- Uzel, S. G. M., et al. Microfluidic device for the formation of optically excitable, three-dimensional, compartmentalized motor units. Science Advances. 2 (8), 1501429 (2016).
- Santhanam, N., et al. Stem cell derived phenotypic human neuromuscular junction model for dose response evaluation of therapeutics. Biomaterials. 166, 64-78 (2018).
- Davis, R. L., Weintraub, H., Lassar, A. B. Expression of a single transfected cDNA converts fibroblasts to myoblasts. Cell. 51 (6), 987-1000 (1987).
- Tanaka, A., et al. Efficient and reproducible myogenic differentiation from human iPS cells: prospects for modeling Miyoshi Myopathy in vitro. PLoS One. 8 (4), 61540 (2013).
- Furlan, A., Adameyko, I. Schwann cell precursor: a neural crest cell in disguise. Developmental Biology. 444, 25-35 (2018).
- Jessen, K. R., Mirsky, R. Schwann Cell Precursors; Multipotent Glial Cells in Embryonic Nerves. Frontiers in Molecular Neuroscience. 12 (69), (2019).
- Lin, C. Y., et al. iPSC-derived functional human neuromuscular junctions model the pathophysiology of neuromuscular diseases. JCI Insight. 4 (18), (2019).
- Reynolds, E. S. The use of lead citrate at high pH as an electron-opaque stain in electron microscopy. Journal of Cell Biology. 17 (1), 208-212 (1963).
- Steinbeck, J. A., et al. Functional Connectivity under Optogenetic Control Allows Modeling of Human Neuromuscular Disease. Cell Stem Cell. 18 (1), 134-143 (2016).
- Bucchia, M., Merwin, S. J., Re, D. B., Kariya, S. Limitations and Challenges in Modeling Diseases Involving Spinal Motor Neuron Degeneration in vitro. Frontiers in Cellular Neuroscience. 12, 61 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados