Method Article
In vitro нейромышечная развязка, индуцированная из индуцированных человеком плюрипотентных стволовых клеток
В этой статье
Резюме
Здесь мы предоставляем протокол для генерации в пробирке NMJs из человека индуцированных плюрипотентных стволовых клеток (iPSCs). Этот метод может вызвать NMJs со зрелой морфологией и функции в 1 месяц в одной хорошо. Полученные NMJ потенциально могут быть использованы для моделирования связанных заболеваний, для изучения патологических механизмов или для проверки лекарственных соединений для терапии.
Аннотация
Нервно-мышечный узел (NMJ) является специализированной синапс, которая передает потенциал действия от моторного нейрона к скелетной мышце для механического движения. Архитектура структуры NMJ влияет на функции нейрона, мышц и взаимного взаимодействия. Предыдущие исследования сообщили о многих стратегиях совместного культивирования моторных нейронов и миотрубов для создания NMJ in vitro со сложным процессом индукции и длительный период культуры, но изо всех сил пытались резюмировать зрелые морфологии и функции NMJ. Наша индукционная система in vitro NMJ построена путем дифференциации человеческого iPSC в одном блюде культуры. Путем переключать миогенную и неврогенную среду индукции для индукции, приводящ к NMJ содержал pre- и столб-синаптические компоненты, включая моторные нейроны, скелетные мышцы и клетки Schwann в культуре одного месяца. Функциональный анализ NMJ также показал, что сокращение миотрубов может быть вызваноCa, а затем ингибируется curare, ингибитор ацетилхолина (AChR), в котором стимулирующий сигнал передается через NMJ. Этот простой и надежный подход успешно вывел сложную структуру NMJ с функциональной связью. Это in vitro человека NMJ, с его интегрированными структурами и функцией, имеет многообещающий потенциал для изучения патологических механизмов и комплексного скрининга.
Введение
Нейромышечный перекресток (NMJ) является специализированной синапс, который передает сигналы от моторных нейронов скелетных мышц для контроля добровольногодвижения мышц 1,2. Этот синапс состоит из до- и пост-синаптических частей. В до синаптической части, моторный нейрон высвобождает ацетилхолин (ACh) из синаптических пузырьков экзоцитоза. ACh высвобождается из синаптических пузырьков, чтобы пересечь синаптической расщелины и связываться с AChR на пост-синаптической части, чтобы вызвать потенциал действия для сокращениямышц 3,4. Любая неисправность в этой деликатной структуре может вызвать заболевания NMJ, в том числе спинальной мышечной атрофии (SMA), врожденные миастенические синдромы (CMS), миастения gravis (MG)5,6,7и т.д. Эти заболевания наносят большой ущерб качеству жизни пациентов и, к сожалению, не имеют эффективных подходов к лечению из-за непонимания патологического механизма. В этом исследовании, мы стремились генерировать in vitro человека NMJ из человека iPSCs для точного моделирования заболеваний и для терапевтического скрининга соединений.
Предыдущие исследования продемонстрировали возможность создания in vitro NMJ с помощью стратегий совместной культуры. Моторные нейроны и скелетные миотрубы генерируются соответственно. Два типа клеток могут быть получены из человека или мыши первичной культуры тканей или быть индуцированыиз стволовых клеток 8,9,10,11, а затем совместно культурируются для формирования NMJ., Дальнейшее применение включает в себя слияние со-культурных NMJ в микрофлюидных 3D устройств и использовать оптогенетические единицы для количественногофункционального анализа 12,13. Тем не менее, эти стратегии занять длительный период культуры и требуют борьбы, чтобы получить основные компоненты NMJ, либо двигатель нейрона или скелетной миотрубы одновременно. Еще один важный компонент NMJ, ячейка Шванн, не может быть создана в этих системах культуры. Продвинутая система культуры, которая содержит миотруб, моторные нейроны и клетки Шванн желательно, поскольку она может предложить надежную и надежную модель для исследований NMJ.
Миогенная дифференциация 1 (MYOD1) является известным миогенным регулятором миогенеза14. Эффективный метод миогенной дифференциации, который применил MYOD1 для привода iPSC в миотрубы, был построен в предыдущем исследовании15. Поэтому мы индуцированы миотрубы путем переэкспрессии MYOD1 в iPSCs15, и высокая эффективность миогенной дифференциации было показано. Интересно, что нейронные клетки появились вместе с миотрубами спонтанно после 10-го дня. Появление нейронных клеток в миогенной культуре привело нас к разработке стратегии генерации in vitro NMJ в одном блюде. Здесь мы предоставляем стратегию для создания NMJs путем overexpressing MYOD1 в человеческих iPSCs для миогенных и двигательных нейронов индукции в той же культуре блюдо. Моторные нейроны индуцируются спонтанно с несколькими нейротрофическими факторами (GDNF, BDNF, NT3 и т.д.) 8, и, в то же время, клетки Шванн также могут быть индуцированы16,17. Благодаря взаимодействию между миотрубами, моторными нейронами и клетками Шванн, зрелые NMJ образуются18. Этот метод может генерировать функциональный NMJ эффективно, что позволяет потенциальное изучение патологических механизмов и терапевтического скрининга соединения.
протокол
1. Подготовка внеклеточной матрицы (ECM) с покрытием пластин
- Разбавить ECM (см. Таблицуматериалов) с ледяной 1x PBS до конечной концентрации 2%.
- Добавьте 1 мл ECM в 49 мл 1x PBS в пластиковой трубке 50 мл. Хорошо перемешать, трубя вверх и вниз несколько раз.
- Поместите 1 крышку в каждый колодец из 6-хорошо пластины. Добавьте 1,5 мл по 2% ECM в каждую колодец.
- Инкубировать пластину хорошо с 2% ECM для 2 ч при 37 градусов по Цельсию.
- Аспират ECM из пластины хорошо и хранить пластину при 4 градусов по Цельсию перед использованием.
2. Дифференциация iPSCs в сторону NMJ
- Семя 4 х 105 iPSCs на колодец на 6-хорошо пластины подготовлены в разделе 1. Убедитесь в том, чтобы семена клеток на крышке предварительно отложены в колодец.
ПРИМЕЧАНИЕ: В этом исследовании, 201B7MYOD iPS сотовой линии, подарок от лаборатории доктора Сакураи, был использован15.- Удалите среду из iPSCs на 6 см культуры блюдо и мыть iPSCs один раз с 1x PBS.
- Добавьте 1 мл раствора клеточного отслоения в блюдо и инкубировать в течение 10 мин при 37 градусах Цельсия.
- Добавьте 3 мл эмбрионального ствола примата (ES) клеточной среды к блюду и пипетки 3 раза осторожно.
- Соберите супернатант, который содержит отдельные iPSCs, в 50 мл пластиковой трубки и центрифуги при 160 х г при 4 градусов по Цельсию в течение 5 мин.
- Тщательно аспирировать супернатант, повторно использовать iPSCs в 3 мл приматов ES клеточной среды с 10 МК Y27632, и подсчитать номер клетки с помощью гемоцитометра.
- Разбавить iPSCs с приматов ES клеточной среды и 10 МК Y27632 в концентрации 2 х 105 клеток / мл. Добавьте 2 мл iPSCs на крышку, предварительно сдаемую в колодец, описанный в разделе 1.
- Индукция iPSCs в NMJ
- На 1 день, 24 ч после посева iPSCs на 6-хорошо пластины, удалить культуру среды и заменить его на 2 мл свежих приматов ES клеточной среды, содержащей 1 мкг / мл доксициклина для каждой хорошо.
- Измените среду с 2 мл миогенной дифференциации среды(МДМ)( Таблица 1 ), содержащий 1 мкг / мл доксициклина (окончательная концентрация) к каждой хорошо. Освежите среду каждый день со дня 2 до 10 дня.
- С 11-го дня переключитесь на средний до 2 мл среды NMJ(таблица 1)на каждый колодец. Освежите среду каждые 3'u20124 дней после этого до 30-го дня.
- Наблюдайте дифференцированный NMJ фазовой инвертированной микроскопией на день 30. NMJ может быть использован для следующего анализа.
3. Иммунофлуоресценция (IF) окрашивание
- На 30-й день, аспирировать культуру среды из 6-ну пластины. Исправить культуру NMJ, добавив 2 мл 4% параформальдегида к каждой колодец в течение 30 минут при комнатной температуре.
- Вымойте образцы 3 раза, добавив 2 мл 1x PBS к каждому хорошо (3 мин для каждой стирки).
- Permeabilize образцов с 0,1% Тритон / PBS в течение 10 мин.
- Повторите шаг 3.2.
- Блокируйте образцы с 0,5% BSA для 1 ч при комнатной температуре.
- Повторите шаг 3.2.
- Инкубировать образцы с первичными антителами при 4 градусов по Цельсию в одночасье. Разбавление антител заключается в следующем: островок 1 (1 мкг/мл), миозин тяжелой цепи (MYH) (1/300), нейрофиламенты (NF) (1 мкг) /mL), S-100 (1/300), синаптический везикулярный белок 2 (SV2) (1 мкг/мл), Tuj1 (1/1000).
- Повторите шаг 3.2.
- Инкубировать образцы вторичными антителами при комнатной температуре в течение 1 ч. Концентрация вторичных антител, используемых следующим образом: анти-мышь IgG 488 конъюгированных (0,1 мкг/мл), анти-кролик IgG 488 конъюгированных (0,1 мкг / мл).
- Повторите шаг 3.2.
- Инкубировать образцы с aBTX-647 (0,5 мкг/мл) для окрашивания AChR и с DAPI (1 мкг/мл) для окрашивания ядра.
- Повторите шаг 3.2.
- Возьмите крышку с парой типсов из 6-хорошо пластины и смонтировать его в 50% глицерол / PBS решение на микроскоп слайд.
4. Сканирование электронной микроскопии (SEM)
- Исправить культуру NMJ с 4% параформальдегида и 1% глутаралдегида, приготовленного в буфере фосфатов калия 0,1 М при комнатной температуре 1 ч.
- Вымойте образцы 3 раза, погружая их в 0,1 М фосфатного буфера калия при комнатной температуре (10 мин для каждого мытья).
- Обезвоживаемые образцы с восходящими концентрациями этанола (50%, 70%, 90%, 95% и 100% в два раза). Погрузите образцы в каждую концентрацию этанола в течение 10 минут.
- Высушите образцы сушилкой критической точки (-30 градусов по Цельсию, 0,1 Торр).
- Пальто образцов с Pt (платиновый) ионный пальто (30 мА за 3 мин; толщина Pt составляет около 20 нм).
- Наблюдайте образцы SEM на 5 kV.
5. Передача электронной микроскопии (TEM)
- Используйте клеточный скребок для сбора ткани из пластины культуры NMJ. Форма ткани в небольшой гранулы (3мм 3) с лезвием бритвы и клей геля, чтобы сформировать гель-обернутый кусок. Исправить гель-обернутый кусок с 2% параформальдегида и 2% глутаралдегид, приготовленный в 0,1 М фосфатного буфера калия при 4 градусов по Цельсию в одночасье.
- Вымойте образцы 3 раза, погружая их в 0,1 М фосфатного буфера калия (15 мин для каждой стирки) при комнатной температуре.
- Постфиксировать образцы с 1% осмия тетроксида, подготовленного в двойнойдистиллированнойH 2 O для 1 ч при комнатной температуре.
ВНИМАНИЕ: Этот шаг должен быть сделан в химическом капюшоне. - Повторите шаг 5.2.
- Обезвоживаемые образцы с восходящими концентрациями этанола (50%, 70%, 90%, 95% и 100% в два раза). Погрузите образцы в каждую концентрацию этанола в течение 10 минут.
- Аспирировать 100% этанол. Проникнуть в образцы с восходящим объемом соотношения эпоксидной смолы до 100% этанола смесей (1:3, 1:1 и 3:1). Агитировать каждую смесь осторожно при 10 об/мин при 1 ч при комнатной температуре.
- Замените смесь эпоксидно-этанола чистой эпоксидной смолой и осторожно агитйте при 10 об/мин при комнатной температуре 4 ч.
- После 4 ч, освежить эпоксидной смолы со свежей эпоксидной смолы и агитировать осторожно при 10 об /мин ночь при комнатной температуре.
- Встраивание образцов в встраивание капсул со свежей эпоксидной смолой и вылечить образцы в духовке при температуре 65 градусов по Цельсию на ночь.
- Ультрамикротомия
- Грубо обрезать образец блоков под рассечением микроскопа для правильной ориентации.
- Мелко обрезать грубо подстриженные блоки стеклянным ножом на ультрамикротом для получения гладких поверхностей.
- Приготовьте 70 нм ультратонких секций из хорошо подстриженных блоков с алмазным ножом. Извлечения ультратонких секций с 200 сетки углеродного покрытия медных сеток.
- Пятно ультратонких секций, содержащих сетки с насыщенным уранил ацетат подготовлен в двойнойдистиллированнойH 2 O в течение 30 минут и мыть сетки 3 раза с двойной дистиллированной H2O (10 мин для каждой стирки).
- Кроме того, контраст ультратонких секций с свинцовым цитратом Рейнольдса19 (2,5%) в течение 5 мин и промыть с вареным H2O предварительно охлаждается до комнатной температуры 3 раза (10 мин для каждой стирки). Поместите несколько гранул гидроксида натрия вокруг области окрашивания, чтобы предотвратить co2 осадков на участках.
- Наблюдайте ультратонкие секции TEM на 70 кВ.
6. Мышечное сокращение и лечение кураре
- Чтобы вызвать сокращение миотруба, добавьте 25 мМ. CaCl2 в среде культуры в шаге 2.3. Движение миотрубов можно наблюдать в 1-20122 мин.
- Поместите пластину из 6 колодец на сцену перевернутого микроскопа. Запись фильма о сокращении миотруба живой микроскопии клеток.
- Чтобы остановить сокращение миотруба, добавьте кураре в культурную среду (300 нг/мл). Затем завехать фильм как шаг 6.2.
- Откройте файл фильма с помощью программного обеспечения для анализа векторов движения, а затем нажмите кнопку анализа движения для анализа фильма.
ПРИМЕЧАНИЕ: Сокращение myotubes показано как график движения времени. Фильмы цветные, чтобы показать скорость движения myotubes. Цветные блестящие сигналы указывают на движения миотуберов, где красный цвет показывает самую быструю скорость движения, а синий цвет показывает самую медленную скорость движения.
Результаты
Используя нашу стратегию дифференциации, культура показала до- и пост-синаптические компоненты NMJ на 30-й день. Компоненты NMJ были индуцированы и хорошо развиты в одной колодец, и их морфология и расположение в NMJ были продемонстрированы микроскопией IF(рисунок 1). Диаграмма потока на рисунке 1A обобщает ход времени прогрессирования дифференциации NMJ. Окрашивание неврофиламентов (NF), синаптических пузырьков (SV2) и AChR(рисунок 1B,C) указывает на нейроны. Одиночные изображения окрашивания NF и SV2 показаны на дополнительном рисунке 1. Альфа-бунгаротоксин окрашивание указывает на AChR (Рисунок 1C). Слитое изображение показывает относительное расположение моторного нейрона и AChR в NMJ(рисунок 1D,E). Второй набор IF окрашивания указывает на двигатель нейрона Tuj1 и островок 1 (Рисунок 1G,H) и пост-синаптические миотрубы миозин тяжелой цепи (Рисунок 1I). Клетки Шванн были также помечены антителами S-100 в культуре NMJ(Дополнительный рисунок 2).
Для дальнейшего подтверждения идентификационных данных компонентов NMJ мы использовали SEM для детального морфологического анализа. Зрелая морфология NMJ с расширенными аксон-терминалами, аксонами и мышечными волокнами показана на рисунке 2A,B. TEM была выполнена, чтобы выявить зрелые ультраструктуры компонентов NMJ, включая до синаптический аксон терминала с синаптических пузырьков и пост-синаптической части, которая отделена от синаптической расщелины (Рисунок 2C'u2012E). Соединения складки указываются желтой пунктирной линии, которая знаменует собой соединение нейронов и мышечных волокон(рисунок 2C). Зрелые аксонные терминалы, содержащие синаптические пузырьки, показаны на рисунке 2D,E (желтые стрелки). Морфологические результаты показывают, что компоненты NMJ были хорошо индуцированы и созрели.
Чтобы оценить функцию in vitro NMJ, мы провели анализ движения, стимулируя двигательный нейрон с CaCl2, чтобы вызвать сокращения миотрубов. Результаты показали, что Ca2 "может вызвать мышечные сокращения. Схватки могут быть прерваны кураре. NMJ показал видные сигналы движения, которые исчезли с лечением кураре (Рисунок 3). Этот эффект подтверждает, что сигналы моторных нейронов были переданы через NMJ, чтобы вызвать сокращение мышц. В совокупности данные if microscopy, SEM и TEM продемонстрировали пространственное распределение, морфологию и зрелость компонентов NMJ в in vitro NMJ, генерируемых описанным выше протоколом. Анализ движения подтвердил функцию in vitro NMJ, что подразумевает его потенциальное применение для разработки терапевтических стратегий.

Рисунок 1: Диаграмма потока для индукции NMJ и ЕСЛИ изображений культуры NMJ. (A)Диаграмма потока для прогрессирования дифференциации NMJ. (Бю2012F) Обнаружение компонентов NMJ, неврофильтров (NF), синаптических пузырьков (SV2) и AChR. Белые стрелки в панели D указывают на NMJ. (Гю2012К) До- и пост-синаптические компоненты NMJ. Tuj1 и Islet1 указывают на двигатель нейрона, и миозин тяжелой цепи (MYH) указывает на myotube. a-BTX, альфа-бунгаротоксин. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
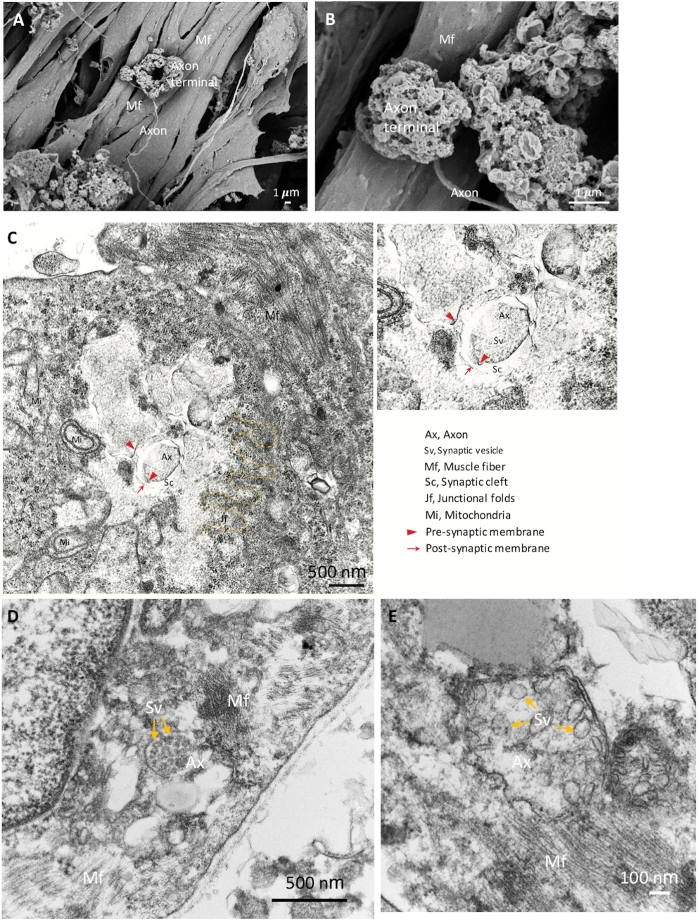
Рисунок 2: SEM и TEM изображения зрелых NMJ. (A)Пространственное распределение компонентов NMJ показывает аксональный терминал, закрепленный на поверхности мышечного волокна (Mf). (B)Более высокое увеличение NMJ показывает аксон терминалов. (C) Ультраструктура созревленного NMJ с до синаптической аксоновой терминальной (красные наконечники стрел) и синаптических пузырьков (Sv), синаптической расщелины (Sc) и пост-синаптических частей (красные стрелки). Развязонные складки (jf) обозначены желтой пунктирной линией. Топор, аксон. (D, E) На снимках высокого увеличения показаны синаптические пузырьки в аксонных терминалах (желтые стрелки). Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
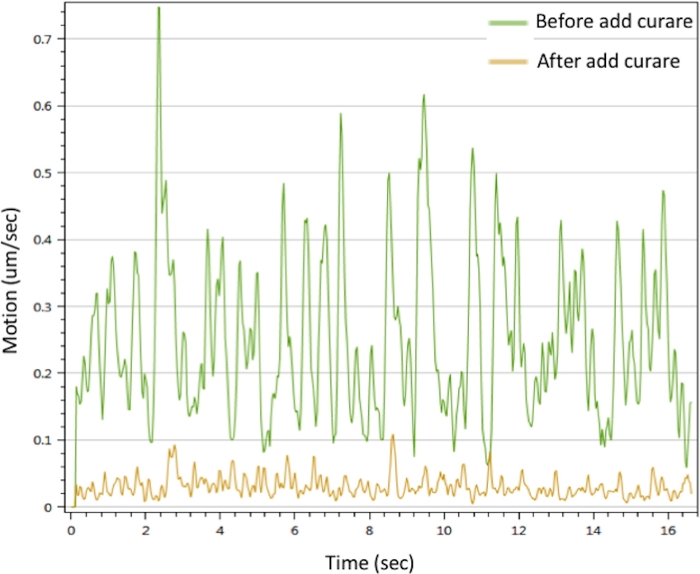
Рисунок 3: Анализ сокращения myotubes in vitro NMJ. Сокращение myotubes было вызвано раствором 25 mM CaCl2 (зеленая линия). Схватки ингибируются после лечения кураре (желтой линией). Пожалуйста, также смотрите дополнительный фильм 1 и дополнительный фильм 2. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Дополнительный фильм 1: миотрубы сокращение вызвано Ca. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Дополнительный фильм 2: Гораздо слабее сокращение myotubes после лечения кураре показано. Пожалуйста, нажмите здесь, чтобы загрузить это видео.
Дополнительная цифра 1: Единственное окрашивание изображений нейрофиламентов (NF, белые стрелки) в культуре NMJ. Одно окрашивание изображений синаптических пузырьков (SV2, белые стрелки) в культуре NMJ. Пожалуйста, нажмите здесь, чтобы загрузить эту цифру.
Дополнительная цифра 2: Клетки Шванн помечены антителами S-100 в культуре NMJ. Пожалуйста, нажмите здесь, чтобы загрузить эту цифру.
| Миогенная дифференциация среды (МДМ) | МЕМ-альфа | 500mL |
| 100mM 2-ME | 1117 мл | |
| Доксициклин | 1 мкг/мл | |
| КСР | 56mL (окончательный до 10%) | |
| Ручка/Стреп | 2.5mL | |
| Общая | 560mL | |
| 100mM 2-меркаптоэтанол | 2 меркаптоэтанол | 7 л |
| d.d. вода | 993 л | |
| Общая | 1000 мл | |
| NMJ средний | Нейробазальная среда (NB) | 500mL |
| B27 | 1x (запас в 50x) | |
| Bdnf | 10ng/mL | |
| GDNF | 10ng/mL | |
| N2 | 1x (запас в 100x) | |
| NT3 | 10ng/mL | |
| Ручка/Стреп | 2.5mL | |
Таблица 1: Формула среды.
Обсуждение
Предыдущие исследования сообщили методы формирования NMJ in vitro с изощренными методами, которыетребуют долгосрочной культуры 8,,10,,12,,13,,20. Эти достижения приводят к прогрессированию in vitro NMJ. Однако сложные методологии препятствовали доступу к исследованиям НМДж. Наш протокол позволяет избежать совместной культуры для эффективного и надежного создания NMJ в одной колодец. Три типа клеток в NMJ наблюдались в нашей системе индукции, в том числе миотрубы, моторные нейроны и клеткиШванн 18. Кроме того, была проверена зрелая морфология и функция.
Основываясь на нашем предыдущем исследовании, начальная плотность клеток является критическим фактором для формирования NMJ, и различные плотности клеток вызывают различное количество NMJs вкультуре 18. Низкая плотность клеток (Lt; 1 x 104/cm2)индуцированных небольшое количество нейронов, что неблагоприятно для формирования NMJ. Хотя это займет гораздо больше времени и ресурсов, чтобы подготовить более высокую плотность клеток (1 х 105/см 2),мы рекомендуем, чтобы плотность клеток между 1,5 х 104/см 2 и 5 х 104/см2 с помощью нашего протокола. NMJ порожденных этим протоколом является неоднородной ткани с несколькими типами клеток, которая ближе к имитации физиологических условий. Миотрубы, как установлено, равномерно распределяются по культуре блюдо, но двигательные нейроны появляются случайным образом, из которых явление приводит к неравномерному распределению NMJs в культуре. Этот NMJ подходит для качественных исследований, а не для анализа, требующего однородных систем культуры. Мы также использовали другие клеточные линии, eq., H9 (линия ячейки ES)18 и A11 (линия ячейки iPS, данные не показаны) для генерации NMJ этим протоколом. NMJ может быть успешно сгенерирован в морфологии и функции. Тем не менее, состояние культуры необходимо оптимизировать для различных клеточных линий.
Химически вызвало сокращение миотрубов и кураре-зависимых ингибирование подтвердило, что наш in vitro NMJ был функциональным и потенциально может быть применен для практических анализов. Спонтанные сокращения мышц наблюдались случайным образом на 3'u20124 недель культуры, но этого можно было бы избежать, продлив время культуры до тех пор, какдва месяца 18.
Различные стратегии были опубликованы для генерации in vitro NMJ различных стадий созревания, но in vitro NMJ, генерируемый в нашей системе, показал значительную зрелость, так как мы можем наблюдать переход гамма-эпсилон субъедиленций AChR во времякультуры 18. Зрелость является важным фактором для моделирования заболеваний с in vitro NMJ21. В заключение, in vitro NMJ со встроенными структурными компонентами, зрелостью и функцией потенциально используется для терапевтического развития.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Мы благодарим д-ра Сакураи за любезное предоставление 201B7MYOD. Исследование электронной микроскопии было поддержано Кейко Окамото-Фурута и Харуясу Кохда (Отдел электронного микроскопического исследования, Центр анатомических исследований, Высшая школа медицины, Киотский университет). Моноклональные антитела были разработаны HHMI / Колумбийский университет, полученные из развития исследований Hybridoma банка, созданного Национальным институтом здоровья детей и развития человека NIH, и поддерживается на кафедре биологии, Университет штата Айова. Мы также благодарим Сиори Осима, Кадзухиро Накагава и Эрико Мацуи за анализ вектора движения. Эта работа была поддержана финансированием Японского общества содействия науке KAKENHI, грант номера 16H05352 и 20H03642 (для MKS); iPS Cell Research Fund (для CYL и MKS); Мемориальный фонд Мохида медицинских и фармацевтических исследований (в MKS); Научный фонд Такеда (для MKS); и грант программы по исследованию неразрешимых заболеваний с использованием клеток iPS, специфичных для болезней, которая была предоставлена Японское агентство медицинских исследований и разработок (17935400 cYL и MKS, и 17935423 для MKS).
Материалы
| Name | Company | Catalog Number | Comments |
| Medium, growth factors and reagents | Item | Brand | Cat. Number |
| 2-mercaptoethanol | Nacalai tesque | 21418-42 | |
| B27, Gibco | Gibco | 12587-001 | |
| BDNF | R & D Systems | 248-BD | |
| Cell detachment solution, Accumax | STEMCELL Technologies | #07921 | |
| Critical point dryer | Hitachi | ES-2030 | |
| Doxycycline | Takara | 631311 | |
| ECM, Matrigel (growth factor reduced) | Corning | 356230 | |
| GDNF | R & D Systems | 212-GD | |
| Gelation, IP gel | Geno Staff | PG20-1 | |
| Ions coater | JEOL | JEC3000FC | |
| iPSC medium, mTeSR | STEMCELL Technologies | 85850 | |
| KnockOut SR (KSR) | Gibco | 10828-028 | |
| live cell microscopy | Nikon | Eclipse Ti microscope | |
| MEM-alpha | Gibco | 12571-071 | |
| Motion vector analysis software | Sony | SI8000 | |
| N2, Gibco | Gibco | 17502-048 | |
| Neurobasal medium | Gibco | 21103-049 | |
| NT3 | R & D Systems | 267-N3 | |
| Primate ES cell medium | ReproCell | RCHEMD001 | |
| SEM | Hitachi | S-4700 | |
| TEM | Hitachi | H7650 | |
| Y27632 | Wako Chemicals GmbH | 253-00513 | |
| Antibodies | Brand | Cat. Number | Dilutions |
| Molecular Probes | B3545 | 0.5 ug/ml | |
| Islet 1 | DSHB | 40.2D6 | 1/100 |
| Myosin heavy chain (MYH) | MilliporeSigma | A4.1025 | 1/300 |
| Neurofilaments (NF) | MilliporeSigma | MAB5254 | 1/500 |
| S-100 | Abcam | ab14849 | 1/300 |
| Synaptic vesicle protein 2 (SV2) | DSHB | SV2 | 1/50 |
| Tuj1 | Covance | MMS435P | 1/1000 |
Ссылки
- Hong, I. H. K., Etherington, S. J. Neuromuscular Junction. eLS. , (2001).
- Sanes, J. R., Lichtman, J. W. Development of the vertebrate neuromuscular junction. Annual Review of Neuroscience. 22, 389-442 (1999).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21 (9), 2348-2356 (2017).
- Slater, C. R. The Structure of Human Neuromuscular Junctions: Some Unanswered Molecular Questions. International Journal of Molecular Sciences. 18 (10), 2183 (2017).
- Comley, L. H., Nijssen, J., Frost-Nylen, J., Hedlund, E. Cross-disease comparison of amyotrophic lateral sclerosis and spinal muscular atrophy reveals conservation of selective vulnerability but differential neuromuscular junction pathology. Journal of Comparative Neurology. 524 (7), 1424-1442 (2016).
- Shigemoto, K., et al. Muscle weakness and neuromuscular junctions in aging and disease. Geriatrics & Gerontology International. 10, 137-147 (2010).
- Abicht, A., Müller, J., Lochmüller, H. Congenital Myasthenic Syndromes. GeneReviews. , (2016).
- Faravelli, I., et al. Motor neuron derivation from human embryonic and induced pluripotent stem cells: experimental approaches and clinical perspectives. Stem Cell Research & Therapy. 5 (4), 87-100 (2014).
- Demestre, M., et al. Formation and characterisation of neuromuscular junctions between hiPSC derived motoneurons and myotubes. Stem Cell Research. 15 (2), 328-336 (2015).
- Yoshida, M., et al. Modeling the early phenotype at the neuromuscular junction of spinal muscular atrophy using patient-derived iPSCs. Stem Cell Reports. 4 (4), 561-568 (2015).
- Vilmont, V., Cadot, B., Ouanounou, G., Gomes, E. R. A system for studying mechanisms of neuromuscular junction development and maintenance. Development. 143 (13), 2464-2477 (2016).
- Uzel, S. G. M., et al. Microfluidic device for the formation of optically excitable, three-dimensional, compartmentalized motor units. Science Advances. 2 (8), 1501429 (2016).
- Santhanam, N., et al. Stem cell derived phenotypic human neuromuscular junction model for dose response evaluation of therapeutics. Biomaterials. 166, 64-78 (2018).
- Davis, R. L., Weintraub, H., Lassar, A. B. Expression of a single transfected cDNA converts fibroblasts to myoblasts. Cell. 51 (6), 987-1000 (1987).
- Tanaka, A., et al. Efficient and reproducible myogenic differentiation from human iPS cells: prospects for modeling Miyoshi Myopathy in vitro. PLoS One. 8 (4), 61540 (2013).
- Furlan, A., Adameyko, I. Schwann cell precursor: a neural crest cell in disguise. Developmental Biology. 444, 25-35 (2018).
- Jessen, K. R., Mirsky, R. Schwann Cell Precursors; Multipotent Glial Cells in Embryonic Nerves. Frontiers in Molecular Neuroscience. 12 (69), (2019).
- Lin, C. Y., et al. iPSC-derived functional human neuromuscular junctions model the pathophysiology of neuromuscular diseases. JCI Insight. 4 (18), (2019).
- Reynolds, E. S. The use of lead citrate at high pH as an electron-opaque stain in electron microscopy. Journal of Cell Biology. 17 (1), 208-212 (1963).
- Steinbeck, J. A., et al. Functional Connectivity under Optogenetic Control Allows Modeling of Human Neuromuscular Disease. Cell Stem Cell. 18 (1), 134-143 (2016).
- Bucchia, M., Merwin, S. J., Re, D. B., Kariya, S. Limitations and Challenges in Modeling Diseases Involving Spinal Motor Neuron Degeneration in vitro. Frontiers in Cellular Neuroscience. 12, 61 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены