Method Article
Giunzione neuromuscolare in vitro indotta da cellule staminali pluripotenti indotte dall'uomo
In questo articolo
Riepilogo
Qui forniamo un protocollo per generare NMJ in vitro da cellule staminali pluripotenti indotte dall'uomo (IPSC). Questo metodo può indurre NMJ con morfologia e funzione mature in 1 mese in un unico pozzo. Gli NMJ risultanti potrebbero potenzialmente essere utilizzati per modellare malattie correlate, per studiare meccanismi patologici o per migliorare i composti farmacologici per la terapia.
Abstract
La giunzione neuromuscolare (NMJ) è una sinapsi specializzata che trasmette potenziali d'azione dal motoneurone al muscolo scheletrico per il movimento meccanico. L'architettura della struttura NMJ influenza le funzioni del neurone, del muscolo e dell'interazione reciproca. Studi precedenti hanno riportato molte strategie co-coltivando i motoneuroni e i miotubi per generare NMJ in vitro con un processo di induzione complesso e un lungo periodo di coltura, ma hanno faticato a ricapitolare la morfologia e la funzione nmj mature. Il nostro sistema di induzione NMJ in vitro è costruito differenziando l'iPSC umano in un unico piatto di coltura. Cambiando il mezzo di induzione miogenico e neurogenico per l'induzione, il NMJ risultante conteneva componenti pre e post-sinaptici, tra cui motoneuroni, muscoli scheletrici e cellule di Schwann nella cultura di un mese. Il saggio funzionale di NMJ ha anche dimostrato che la contrazione dei miotubi può essere innescata da Ca++ poi inibita dal curaro, un inibitore del recettore dell'acetilcolina (AChR), in cui il segnale stimolante viene trasmesso attraverso NMJ. Questo approccio semplice e robusto ha derivato con successo la complessa struttura di NMJ con connettività funzionale. Questo NMJ umano in vitro, con le sue strutture e funzioni integrate, ha un potenziale promettente per lo studio dei meccanismi patologici e dello screening composto.
Introduzione
La giunzione neuromuscolare (NMJ) è una sinapsi specializzata che trasmette segnali dai motoneuroni ai muscoli scheletrici per controllare il movimento muscolarevolontario 1,2. Questa sinapsi è composta da parti pre e post-sinaptiche. Nella parte pre-sinaptica, il motoneurone rilascia acetilcolina (ACh) dalle vescicole sinaptiche per esocitosi. ACh viene rilasciato dalle vescicole sinaptiche per attraversare la fessura sinaptica e legarsi all'AChR sulla parte post-sinaptica per innescare un potenziale d'azione per la contrazionemuscolare 3,4. Qualsiasi malfunzionamento in questa delicata struttura può causare malattie nmj, tra cui atrofia muscolare spinale (SMA), sindromi miosteniche congenite (CMS), miastenia gravis (MG)5,6,7, ecc. Queste malattie danneggiano notevolmente la qualità della vita dei pazienti e purtroppo non hanno approcci terapeutici efficaci a causa della mancanza di comprensione del meccanismo patologico. In questo studio, abbiamo mirato a generare NMJ umano in vitro dagli iPSC umani per una modellazione accurata delle malattie e per lo screening dei composti terapeutici.
Studi precedenti hanno dimostrato la possibilità di generare NMJ in vitro mediante strategie di co-coltura. I motoneuroni e i miotubi scheletrici sono generati rispettivamente. I due tipi di cellule possono essere generati da colture di tessuto primario umano o topo o essere indottida cellule staminali 8,,9,,10,11 e quindi co-coltivati per la formazione di NMJ. Le ulteriori applicazioni includono l'unione della NMJ co-coltivata in dispositivi 3D microfluidici e l'utilizzo di unità optogenetiche per saggi funzionali quantificabili12,,13. Tuttavia, queste strategie richiedono un lungo periodo di coltura e richiedono difficoltà per ottenere i componenti primari della NMJ, sia il motoneurone che il miotubo scheletrico contemporaneamente. Un'altra componente importante della NMJ, la cellula di Schwann, non può essere generata in questi sistemi di coltura. Il sistema di coltura avanzato che contiene il miotubo, il motoneurone e la cellula di Schwann è desiderabile in quanto può offrire un modello affidabile e robusto per gli studi NMJ.
La differenziazione miogenica 1 (MYOD1) è un noto regolatore miogenico per la miogenesi14. L'efficiente metodo di differenziazione miogenica che ha applicato MYOD1 per guidare iPSC in miotubi è stato costruito in uno studio precedente15. Pertanto, abbiamo indotto i miotubi sovraesprimendo MYOD1 in iPSC15e è stata mostrata un'alta efficienza della differenziazione miogenica. È interessante notare che le cellule neuronali sono apparse spontaneamente insieme ai miotubi dopo il giorno 10. La comparsa di cellule neuronali nella coltura miogenica ci ha portato a sviluppare la strategia per generare NMJ in vitro in un unico piatto. Qui forniamo una strategia per generare NMJs sovraesprimendo MYOD1 negli iPSC umani per l'induzione miogenica e del motoneurone nello stesso piatto di coltura. I motoneuroni sono indotti spontaneamente con diversi fattori neurotrofici (GDNF, BDNF, NT3, ecc.) 8, e, nel frattempo, le cellule di Schwann possono anche essereindotte 16,,17. Attraverso le interazioni tra i miotubi, i motoneuroni e le cellule di Schwann, si forma la NMJ matura18. Questo metodo può generare NMJ funzionale in modo efficiente, consentendo il potenziale studio dei meccanismi patologici e dello screening del composto terapeutico.
Protocollo
1. Preparazione di piastre rivestite in matrice extracellulare (ECM)
- Diluire l'ECM (vedi Tabella dei materiali)con ghiaccio freddo 1x PBS ad una concentrazione finale del 2%.
- Aggiungere 1 ml di ECM a 49 ml di 1x PBS in un tubo di plastica da 50 ml. Mescolare bene pipettando su e giù più volte.
- Posizionare 1 coverslip in ogni pozzo di una piastra da 6 po'. Aggiungere 1,5 mL del 2% di ECM in ogni pozzo.
- Incubare la piastra del pozzo con 2% di ECM per 2 ore a 37 °C.
- Aspirare ECM dalla piastra del pozzo e conservare la piastra a 4 °C prima dell'uso.
2. Differenziazione degli iPSC verso nmj
- Seme 4 x 105 di iPSC per pozzo sulla piastra a 6 po 'preparata nella sezione 1. Assicurarsi di seminare le cellule sul coverslip pre-depositato nel pozzo.
NOTA: In questo studio, la linea cellulareMYOD iPS 201B7, un regalo del Dr. Sakurai's Lab, è statautilizzata 15.- Rimuovere il supporto dagli iPSC sulla coltura da 6 cm e lavare gli iPSC una volta con 1x PBS.
- Aggiungere 1 mL di soluzione di distacco cellulare al piatto e incubare per 10 minuti a 37 °C.
- Aggiungere 3 mL di gambo embrionale primate (ES) al piatto e pipetta 3 volte delicatamente.
- Raccogliere il supernatante, che contiene iPSC staccati, in un tubo di plastica da 50 ml e centrifugare a 160 x g a 4 °C per 5 min.
- Aspirare con cura il supernatante, rimescolare gli iPSC in mezzo cellulare ES primate da 3 mL con 10 μM Y27632 e contare il numero di cellulare usando un emocitometro.
- Diluire gli iPSC con mezzo cellulare ES primate e 10 μM Y27632 ad una concentrazione di 2 x 105 cellule/mL. Aggiungere 2 mL di iPSC sul coverslip pre-depositato nel pozzo descritto nella sezione 1.
- Induzione degli iPSC a NMJ
- Il primo giorno, 24 ore dopo aver seminato gli iPSC nella piastra a 6 poggiagli, rimuovere il mezzo di coltura e sostituirlo con 2 mL di mezzo cellulare ES primate fresco contenente 1 μg/mL di doxiciclina ad ogni pozzo.
- Modificare il mezzo con 2 mL di mezzo di differenziazione miogenica (MDM)(tabella 1)contenente 1 μg/mL di doxiciclina (concentrazione finale) in ciascun pozzo. Rinfresca il mezzo ogni giorno dal giorno 2 al giorno 10.
- Dal giorno 11, passare il mezzo a 2 mL del mezzo NMJ (Tabella 1) su ciascun pozzo. Aggiornare il supporto ogni 3\u20124 giorni dopo fino al giorno 30.
- Osservare la NMJ differenziata per microscopia invertita di fase il giorno 30. L'NMJ può essere utilizzato per la seguente analisi.
3. Colorazione immunofluorescenza (IF)
- Il giorno 30, aspirare il mezzo di coltura dal piatto a 6 pozzi. Fissare la coltura NMJ aggiungendo 2 mL di paraformaldeide al 4% ad ogni pozzo per 30 minuti a temperatura ambiente.
- Lavare i campioni 3 volte aggiungendo 2 mL di 1x PBS ad ogni pozzo (3 minuti per ogni lavaggio).
- Permeabilizzare i campioni con 0,1% Tritone/PBS per 10 min.
- Ripetere il passaggio 3.2.
- Bloccare i campioni con 0,5% di BSA per 1 h a temperatura ambiente.
- Ripetere il passaggio 3.2.
- Incubare i campioni con gli anticorpi primari a 4 °C durante la notte. La diluizione degli anticorpi è la seguente: Isolotto 1 (1 μg/mL), catena pesante di miosina (MYH) (1/300), neurofilamenti (NF) (1 μg /mL), S-100 (1/300), proteina sinaptica vescicolare 2 (SV2) (1 μg/mL), Tuj1 (1/1000).
- Ripetere il passaggio 3.2.
- Incubare i campioni con gli anticorpi secondari a temperatura ambiente per 1 h. La concentrazione degli anticorpi secondari utilizzati è la seguente: IgG 488 coniugato anti-topo (0,1 μg/mL), coniugato anti-coniglio IgG 488 (0,1 μg/mL).
- Ripetere il passaggio 3.2.
- Incubare i campioni con aBTX-647 (0,5 μg/mL) per la colorazione AChR e con DAPI (1 μg/mL) per la colorazione del nucleo.
- Ripetere il passaggio 3.2.
- Prelevare il coverslip con un paio di forcep dalla piastra a 6 porri e montarlo in soluzione di glicerolo/PBS al 50% su uno scivolo al microscopio.
4. Microscopia elettronica a scansione (SEM)
- Fissare la coltura di NMJ con il 4% di paraformaldeide e l'1% di glutaraldeide preparata in tampone di fosfato di potassio da 0,1 M a temperatura ambiente per 1 h.
- Lavare i campioni 3 volte immergendoli in tampone di fosfato di potassio da 0,1 M a temperatura ambiente (10 minuti per ogni lavaggio).
- Disidratare i campioni con concentrazioni ascendenti di etanolo (50%, 70%, 90%, 95% e 100% due volte). Immergere i campioni in ogni concentrazione di etanolo per 10 minuti.
- Asciugare i campioni con un essiccatore a punti critici (-30 °C, 0,1 Torr).
- Rivestire i campioni con rivestimento ionica Pt (platino) (30 mA per 3 min; lo spessore di Pt è di circa 20 nm).
- Osservare i campioni con SEM a 5 kV.
5. Microscopia elettronica a trasmissione (TEM)
- Utilizzare un raschietto cellulare per raccogliere il tessuto dalla piastra di coltura NMJ. Modellare il tessuto in un piccolo pellet (3 mm3)con una lama di rasoio e colla per gelazione per formare un pezzo avvolto in gel. Fissare il pezzo avvolto in gel con il 2% di paraformaldeide e il 2% di glutaraldeide preparata in tampone di fosfato di potassio da 0,1 M a 4 °C durante la notte.
- Lavare i campioni 3 volte immergendoli in tampone di fosfato di potassio da 0,1 M (15 minuti per ogni lavaggio) a temperatura ambiente.
- Postfissare i campioni con tetrossido di osmio all'1% preparato in H2O doppio distillato per 1 h a temperatura ambiente.
ATTENZIONE: Questo passaggio deve essere fatto in una cappa chimica. - Ripetere il passaggio 5.2.
- Disidratare i campioni con concentrazioni ascendenti di etanolo (50%, 70%, 90%, 95% e 100% due volte). Immergere i campioni in ogni concentrazione di etanolo per 10 minuti.
- Aspirare l'etanolo al 100%. Infiltrarsi nei campioni con rapporti di volume ascendenti di resina epossidica al 100% di miscele di etanolo (1:3, 1:1 e 3:1). Agitare delicatamente ogni miscela a 10 giri/min per 1 h a temperatura ambiente.
- Sostituire la miscela epossidico-etanolo con resina epossidica pura e agitare delicatamente a 10 giri/min per 4 ore a temperatura ambiente.
- Dopo 4 ore, rinfrescare la resina epossidica con resina epossidica fresca e agitare delicatamente a 10 giri/min durante la notte a temperatura ambiente.
- Incorporare i campioni in capsule di incorporamento con resina epossidica fresca e polimerizzarli in forno a 65 °C durante la notte.
- Ultramicrotomia
- Tagliare grossolanamente i blocchi campione sotto un microscopio sezionato per l'orientamento corretto.
- Tagliare finemente i blocchi grossolanamente tagliati con un coltello di vetro su un ultramicrotomo per ottenere superfici lisce.
- Preparare sezioni ultrathin da 70 nm dai blocchi ben tagliati con un coltello a diamante. Recupera le sezioni ultrathin con 200 griglie in rame rivestite in carbonio a rete.
- Macchiare le sezioni ultrathin contenenti griglie con acetato di uranile saturo preparato in doppio H2O distillato per 30 min e lavare le griglie 3 volte con doppio H2O distillato (10 min per ogni lavaggio).
- Inoltre, contrasta le sezioni ultrathin con il citrato di piombo di Reynold19 (2,5%) per 5 minuti e lavare con H2O bollito pre-raffreddato a temperatura ambiente 3 volte (10 minuti per ogni lavaggio). Mettere diversi pellet di idrossido di sodio intorno all'area di colorazione per prevenireprecipitazioni di CO 2 sulle sezioni.
- Osservare le sezioni ultrathin di TEM a 70 kV.
6. Contrazione muscolare e trattamento curare
- Per innescare la contrazione del miotubo, aggiungere 25 mM CaCl2 nel mezzo di coltura nel passaggio 2.3. Il movimento dei miotubi può essere osservato in 1\u20122 min.
- Posizionare la piastra a 6 pozzi sul palco di un microscopio invertito. Registra un filmato della contrazione del miotubo con la microscopia a cellule vive.
- Per fermare la contrazione del miotubo, aggiungere curare al mezzo di coltura (300 ng/mL). Quindi registrare il filmato come passaggio 6.2.
- Aprite il file filmato con il software di analisi dei vettori di movimento, quindi fate clic sul pulsante Analisi movimento (Motion Analysis) per analizzare il filmato.
NOTA: la contrazione dei miotubi viene mostrata come grafica time-motion. I film sono codificati a colori per mostrare la velocità di movimento dei miotubi. I segnali scintillanti codificati a colori indicano i movimenti dei miotubi in cui il colore rosso mostra la velocità di movimento più veloce e il colore blu mostra la velocità di movimento più lenta.
Risultati
Utilizzando la nostra strategia di differenziazione, la cultura ha mostrato componenti pre e post-sinaptici della NMJ il giorno 30. I componenti NMJ sono stati indotti e ben sviluppati in un unico pozzo, e la loro morfologia e posizione nella NMJ sono state dimostrate dalla microscopia IF (Figura 1). Il diagramma di flusso nella figura 1A riassume il corso del tempo della progressione della differenziazione NMJ. La colorazione dei neurofilamenti (NF), delle vescicole sinaptiche (SV2) e dell'AChR (Figura 1B,C) indica i neuroni. Le singole immagini di colorazione di NF e SV2 sono mostrate nella figura complementare 1. La colorazione alfa-bungarotossina indica AChR (Figura 1C). L'immagine unita mostra le posizioni relative di un motoneurone e dell'AChR nella NMJ (Figura 1D,E). Il secondo set di colorazione IF indica il motoneurone di Tuj1 e Isolotto 1 (Figura 1G,H) e miotubi post-sinaptici per catena pesante di miosina (Figura 1I). Le cellule di Schwann sono state anche etichettate con anticorpi S-100 nella coltura nmj(Figura complementare 2).
Per confermare ulteriormente le identità dei componenti NMJ, abbiamo utilizzato SEM per analisi morfologiche dettagliate. La morfologia nmj matura con terminali axon espansi, assoni e fibre muscolari è mostrata nella figura 2A,B. TEM è stato eseguito per rivelare l'ultrastruttura matura dei componenti NMJ, incluso il terminale assone pre-sinaptico con vescicole sinaptiche e la parte post-sinaptica, che è separata dalla fessura sinaptica (Figura 2C\u2012E). Le pieghe giunzionali sono indicate dalla linea tratteggiata gialla, che segna la giunzione del neurone e delle fibre muscolari (Figura 2C). I terminali axon maturi che contengono vescicole sinaptiche sono mostrati nella figura 2D,E (frecce gialle). I risultati morfologici mostrano che i componenti nmj erano ben indotti e maturati.
Per valutare la funzione dell'NMJ in vitro, abbiamo eseguito l'analisi del movimento stimolando il motoneurone con CaCl2 a innescare contrazioni del miotubo. I risultati hanno mostrato che Ca2 + può innescare contrazioni muscolari. Le contrazioni potrebbero essere interrotte dalla curare. La NMJ ha mostrato segnali di movimento prominenti scomparsi con il trattamento curare (Figura 3). Questo effetto conferma che i segnali del motoneurone sono stati trasmessi attraverso la NMJ per innescare la contrazione muscolare. Nel loro insieme, i dati if microscopy, SEM e TEM hanno dimostrato la distribuzione spaziale, la morfologia e la maturità dei componenti NMJ nella NMJ in vitro generata dal protocollo sopra descritto. L'analisi del movimento ha convalidato la funzione della NMJ in vitro, il che implica la sua potenziale applicazione allo sviluppo di strategie terapeutiche.

Figura 1: Diagramma di flusso per le immagini di induzione NMJ e IF delle impostazioni cultura NMJ. (A) Diagramma di flusso per la progressione della differenziazione NMJ. (B\u2012F) Rilevamento di componenti NMJ, neurofilamenti (NF), vescicole sinaptiche (SV2) e AChR. Le frecce bianche nel pannello D indicano il NMJ. (G\u2012K) Componenti pre e post-sinaptici della NMJ. Tuj1 e Islet1 indicano il motoneurone e la catena pesante della miosina (MYH) indica il miotubo. a-BTX, alfa-bungarotossina. Clicca qui per visualizzare una versione più grande di questa figura.
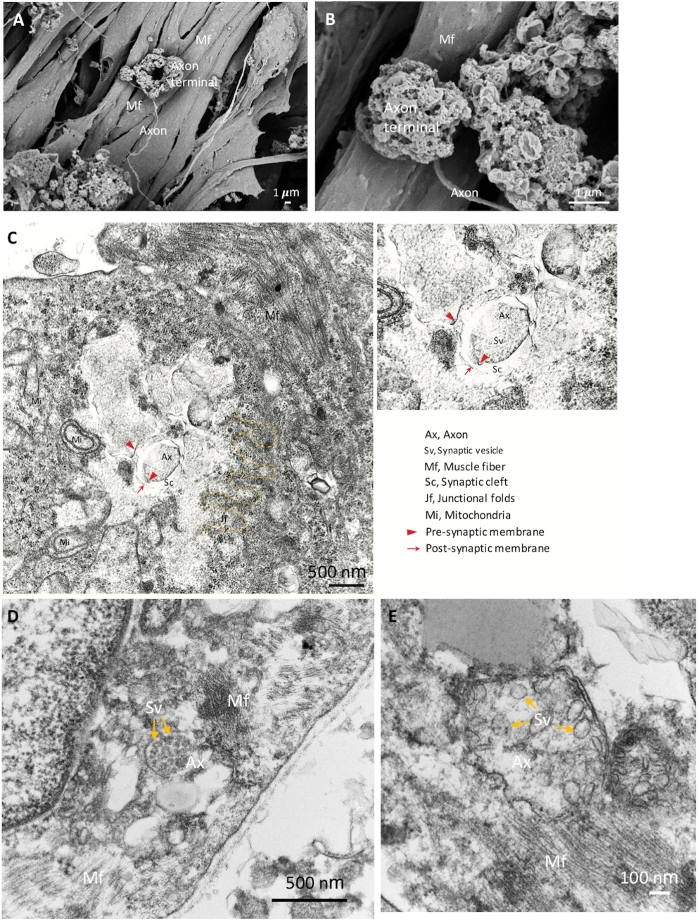
Figura 2: Immagini SEM e TEM di NMJ maturo. (A) La distribuzione spaziale dei componenti NMJ mostra il terminale dell'assone ancorato sulla superficie della fibra muscolare (Mf). (B) Un ingrandimento più elevato della NMJ mostra i terminali axon. (C) L'ultrastruttura di una NMJ maturata con terminale di assone presinaptico (punte di freccia rosse) e vescicole sinaptiche (Sv), fessura sinaptica (Sc) e parti post-sinaptiche (frecce rosse). Le pieghe giunzionali (jf) sono indicate dalla linea tratteggiata gialla. Ax, Axon. (D, E) Le immagini ad alto ingrandimento mostrano le vescicole sinaptiche nei terminali axon (frecce gialle). Clicca qui per visualizzare una versione più grande di questa figura.
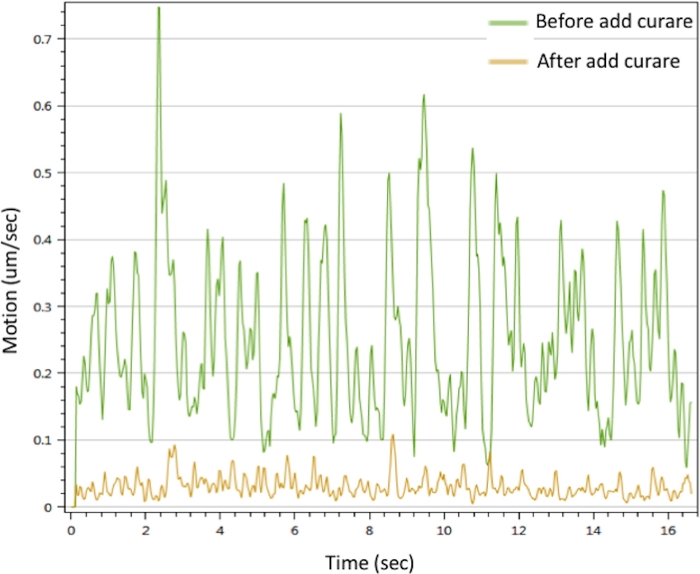
Figura 3: Analisi della contrazione dei miotubi della NMJ in vitro. La contrazione di Myotubes è stata attivata con una soluzione CaCl2 da 25 mM (linea verde). Le contrazioni sono state inibite dopo il trattamento con curare (linea gialla). Si prega di vedere anche Film supplementare 1 e Film supplementare 2. Clicca qui per visualizzare una versione più grande di questa figura.
Filmato supplementare 1: La contrazione dei miotubi innescata da Ca++. Clicca qui per scaricare questo video.
Supplementary Movie 2: Viene mostrata la contrazione molto più debole dei miotubi dopo il trattamento della cura. Clicca qui per scaricare questo video.
Figura complementare 1: Le singole immagini di colorazione dei neurofilamenti (NF, frecce bianche) nella cultura NMJ. Le singole immagini di colorazione delle vescicole sinaptiche (SV2, frecce bianche) nella cultura NMJ. Clicca qui per scaricare questa cifra.
Figura complementare 2: Le cellule di Schwann etichettate con anticorpo S-100 nella coltura di NMJ. Clicca qui per scaricare questa cifra.
| Mezzo di differenziazione miogenica (MDM) | MEM-alfa | 500mL |
| 100mM 2-ME | 1117μL | |
| Doxiciclina | 1μg/mL | |
| KSR | 56mL (finale al 10%) | |
| Penna/Strep | 2,5 mL | |
| Totale | 560mL | |
| 100mM 2-mercaptoetanolo | 2-mercaptoetanolo | 7μL |
| d.d. acqua | 993μL | |
| Totale | 1000μL | |
| Mezzo NMJ | Mezzo neurobasale (NB) | 500mL |
| B27 B27 b) la commissione per | 1x (magazzino in 50x) | |
| Bdnf | 10ng/mL | |
| GDNF | 10ng/mL | |
| N2 A | 1x (azioni in 100x) | |
| NT3 lavoro a tempo in stato di | 10ng/mL | |
| Penna/Strep | 2,5 mL | |
Tabella 1: Formula del mezzo.
Discussione
Studi precedenti hanno riportato metodi per la formazione di NMJ in vitro con metodi sofisticati che richiedono la coltura alungo termine 8,,10,,12,13,20. Questi risultati portano alla progressione della NMJ in vitro. Tuttavia, le metodologie complicate hanno ostacolato l'accesso agli studi nmj. Il nostro protocollo evita la co-cultura per generare NMJ in modo efficiente e robusto in un unico pozzo. Tre tipi di cellule nella NMJ sono stati osservati nel nostro sistema di induzione, tra cui i miotubi, i motoneuroni e le cellule di Schwann18. Inoltre, sono stati verificati morfologia e funzione maturi.
Sulla base del nostro studio precedente, la densità cellulare iniziale è un fattore critico per la formazione di NMJ, e diverse densità cellulari inducono vari numeri di NMJ nellacoltura 18. Una bassa densità cellulare (< 1 x 104/cm2) ha indotto un basso numero di neuroni, il che è sfavorevole per la formazione di NMJ. Anche se ci vorrebbe molto più tempo e risorse per preparare una maggiore densità di cellule (> 1 x 105/ cm2), si consiglia che la densità cellulare sia compresa tra 1,5 x 104/ cm2 e 5 x 104/ cm2 utilizzando il nostro protocollo. La NMJ generata da questo protocollo è un tessuto eterogeneo con più tipi di cellule che è più vicino a imitare le condizioni fisiologiche. I miotubi si trovano a distribuire uniformemente su un piatto di coltura, ma i motoneuroni appaiono casualmente, di cui il fenomeno si traduce nella distribuzione non uniforme degli NMJ in una cultura. Questo NMJ è adatto per studi qualitativi invece che per l'analisi che richiede sistemi di coltura omogenei. Abbiamo anche usato altre linee cellulari, eq., H9 (linea cellulare ES)18 e A11 (linea cellulare iPS, dati non mostrati) per generare NMJ da questo protocollo. La NMJ può essere generata con successo in morfologia e funzione. La condizione di coltura, tuttavia, deve essere ottimizzata per diverse linee cellulari.
La contrazione chimica dei miotubi innescata chimicamente e l'inibizione curare-dipendente hanno confermato che il nostro NMJ in vitro era funzionale e poteva essere potenzialmente applicato per test pratici. Le contrazioni muscolari spontanee sono state osservate casualmente a 3\u20124 settimane di cultura, ma potrebbero essere evitate estendendo il tempo di coltura fino a due mesi18.
Sono state pubblicate varie strategie per generare NMJ in vitro di diversi stadi di maturazione, ma la NMJ in vitro generata nel nostro sistema ha mostrato la maturità significativa, in quanto possiamo osservare la transizione delle subunità gamma-epsilon di AChR durante lacoltura 18. La maturità è una considerazione importante per la modellazione delle malattie con NMJ21in vitro. In conclusione, una NMJ in vitro con componenti strutturali integrati, maturità e funzione è di potenziale utilizzo per lo sviluppo terapeutico.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo il Dr. Sakurai per aver gentilmente fornitoMYOD201B7. Lo studio di microscopia elettronica è stato supportato da Keiko Okamoto-Furuta e Haruyasu Kohda (Divisione di studio microscopico elettronico, Centro di studi anatomici, Scuola di medicina universitaria, Università di Kyoto). L'anticorpo monoclonale è stato sviluppato dalla HHMI/Columbia University, ottenuto dalla Developmental Studies Hybridoma Bank, creata dal National Institute Child Health and Human Development del NIH, e mantenuta presso il Dipartimento di Biologia dell'Università dell'Iowa. Ringraziamo anche Shiori Oshima, Kazuhiro Nakagawa ed Eriko Matsui per l'analisi del vettore di movimento. Questo lavoro è stato sostenuto dal finanziamento della Japan Society for the Promotion of Science KAKENHI, numero di borse di studio 16H05352 e 20H03642 (a MKS); iPS Cell Research Fund (a CYL e MKS); Mochida Memorial Foundation for Medical and Pharmaceutical Research (a MKS); Takeda Science Foundation (a MKS); e una sovvenzione del The Program for Intractable Diseases Research che utilizza cellule iPS specifiche della malattia, che fu aiutata dalla Japan Agency for Medical Research and Development (17935400 a CYL e MKS, e 17935423 a MKS).
Materiali
| Name | Company | Catalog Number | Comments |
| Medium, growth factors and reagents | Item | Brand | Cat. Number |
| 2-mercaptoethanol | Nacalai tesque | 21418-42 | |
| B27, Gibco | Gibco | 12587-001 | |
| BDNF | R & D Systems | 248-BD | |
| Cell detachment solution, Accumax | STEMCELL Technologies | #07921 | |
| Critical point dryer | Hitachi | ES-2030 | |
| Doxycycline | Takara | 631311 | |
| ECM, Matrigel (growth factor reduced) | Corning | 356230 | |
| GDNF | R & D Systems | 212-GD | |
| Gelation, IP gel | Geno Staff | PG20-1 | |
| Ions coater | JEOL | JEC3000FC | |
| iPSC medium, mTeSR | STEMCELL Technologies | 85850 | |
| KnockOut SR (KSR) | Gibco | 10828-028 | |
| live cell microscopy | Nikon | Eclipse Ti microscope | |
| MEM-alpha | Gibco | 12571-071 | |
| Motion vector analysis software | Sony | SI8000 | |
| N2, Gibco | Gibco | 17502-048 | |
| Neurobasal medium | Gibco | 21103-049 | |
| NT3 | R & D Systems | 267-N3 | |
| Primate ES cell medium | ReproCell | RCHEMD001 | |
| SEM | Hitachi | S-4700 | |
| TEM | Hitachi | H7650 | |
| Y27632 | Wako Chemicals GmbH | 253-00513 | |
| Antibodies | Brand | Cat. Number | Dilutions |
| Molecular Probes | B3545 | 0.5 ug/ml | |
| Islet 1 | DSHB | 40.2D6 | 1/100 |
| Myosin heavy chain (MYH) | MilliporeSigma | A4.1025 | 1/300 |
| Neurofilaments (NF) | MilliporeSigma | MAB5254 | 1/500 |
| S-100 | Abcam | ab14849 | 1/300 |
| Synaptic vesicle protein 2 (SV2) | DSHB | SV2 | 1/50 |
| Tuj1 | Covance | MMS435P | 1/1000 |
Riferimenti
- Hong, I. H. K., Etherington, S. J. Neuromuscular Junction. eLS. , (2001).
- Sanes, J. R., Lichtman, J. W. Development of the vertebrate neuromuscular junction. Annual Review of Neuroscience. 22, 389-442 (1999).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21 (9), 2348-2356 (2017).
- Slater, C. R. The Structure of Human Neuromuscular Junctions: Some Unanswered Molecular Questions. International Journal of Molecular Sciences. 18 (10), 2183 (2017).
- Comley, L. H., Nijssen, J., Frost-Nylen, J., Hedlund, E. Cross-disease comparison of amyotrophic lateral sclerosis and spinal muscular atrophy reveals conservation of selective vulnerability but differential neuromuscular junction pathology. Journal of Comparative Neurology. 524 (7), 1424-1442 (2016).
- Shigemoto, K., et al. Muscle weakness and neuromuscular junctions in aging and disease. Geriatrics & Gerontology International. 10, 137-147 (2010).
- Abicht, A., Müller, J., Lochmüller, H. Congenital Myasthenic Syndromes. GeneReviews. , (2016).
- Faravelli, I., et al. Motor neuron derivation from human embryonic and induced pluripotent stem cells: experimental approaches and clinical perspectives. Stem Cell Research & Therapy. 5 (4), 87-100 (2014).
- Demestre, M., et al. Formation and characterisation of neuromuscular junctions between hiPSC derived motoneurons and myotubes. Stem Cell Research. 15 (2), 328-336 (2015).
- Yoshida, M., et al. Modeling the early phenotype at the neuromuscular junction of spinal muscular atrophy using patient-derived iPSCs. Stem Cell Reports. 4 (4), 561-568 (2015).
- Vilmont, V., Cadot, B., Ouanounou, G., Gomes, E. R. A system for studying mechanisms of neuromuscular junction development and maintenance. Development. 143 (13), 2464-2477 (2016).
- Uzel, S. G. M., et al. Microfluidic device for the formation of optically excitable, three-dimensional, compartmentalized motor units. Science Advances. 2 (8), 1501429 (2016).
- Santhanam, N., et al. Stem cell derived phenotypic human neuromuscular junction model for dose response evaluation of therapeutics. Biomaterials. 166, 64-78 (2018).
- Davis, R. L., Weintraub, H., Lassar, A. B. Expression of a single transfected cDNA converts fibroblasts to myoblasts. Cell. 51 (6), 987-1000 (1987).
- Tanaka, A., et al. Efficient and reproducible myogenic differentiation from human iPS cells: prospects for modeling Miyoshi Myopathy in vitro. PLoS One. 8 (4), 61540 (2013).
- Furlan, A., Adameyko, I. Schwann cell precursor: a neural crest cell in disguise. Developmental Biology. 444, 25-35 (2018).
- Jessen, K. R., Mirsky, R. Schwann Cell Precursors; Multipotent Glial Cells in Embryonic Nerves. Frontiers in Molecular Neuroscience. 12 (69), (2019).
- Lin, C. Y., et al. iPSC-derived functional human neuromuscular junctions model the pathophysiology of neuromuscular diseases. JCI Insight. 4 (18), (2019).
- Reynolds, E. S. The use of lead citrate at high pH as an electron-opaque stain in electron microscopy. Journal of Cell Biology. 17 (1), 208-212 (1963).
- Steinbeck, J. A., et al. Functional Connectivity under Optogenetic Control Allows Modeling of Human Neuromuscular Disease. Cell Stem Cell. 18 (1), 134-143 (2016).
- Bucchia, M., Merwin, S. J., Re, D. B., Kariya, S. Limitations and Challenges in Modeling Diseases Involving Spinal Motor Neuron Degeneration in vitro. Frontiers in Cellular Neuroscience. 12, 61 (2018).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon