Method Article
Junção neuromuscular in vitro induzida de células-tronco pluripotentes induzidas por humanos
Neste Artigo
Resumo
Aqui fornecemos um protocolo para gerar NMJs in vitro a partir de células-tronco pluripotentes induzidas por humanos (iPSCs). Este método pode induzir NMJs com morfologia madura e função em 1 mês em um único poço. Os NMJs resultantes poderiam potencialmente ser usados para modelar doenças relacionadas, para estudar mecanismos patológicos ou para rastrear compostos medicamentosos para terapia.
Resumo
A junção neuromuscular (NMJ) é uma sinapse especializada que transmite potenciais de ação do neurônio motor ao músculo esquelético para movimento mecânico. A arquitetura da estrutura do NMJ influencia as funções do neurônio, do músculo e da interação mútua. Estudos anteriores relataram muitas estratégias co-culminando os neurônios motores e miotubes para gerar NMJ in vitro com processo de indução complexo e longo período de cultura, mas têm lutado para recapitular a morfologia e função NMJ maduras. Nosso sistema de indução in vitro NMJ é construído diferenciando iPSC humano em um único prato de cultura. Ao trocar o meio de indução miogênica e neurogênica por indução, o NMJ resultante continha componentes pré e pós-sinápticos, incluindo neurônios motores, músculo esquelético e células schwann na cultura de um mês. O ensaio funcional do NMJ também mostrou que a contração dos miotubes pode ser desencadeada por Ca++ então inibida pelo curare, um inibidor do receptor de acetilcolina (AChR), no qual o sinal estimulante é transmitido através de NMJ. Esta abordagem simples e robusta deriva com sucesso a complexa estrutura do NMJ com conectividade funcional. Este NMJ humano in vitro, com suas estruturas e função integradas, tem potencial promissor para estudar mecanismos patológicos e triagem composta.
Introdução
A junção neuromuscular (NMJ) é uma sinapse especializada que transmite sinais de neurônios motores para músculos esqueléticos para controlar o movimento muscular voluntário1,,2. Esta sinapse é composta de partes pré e pós-sinápticas. Na parte pré-sináptica, o neurônio motor libera acetilcolina (ACh) de vesículas sinápticas por exocitose. ACh é liberado de vesículas sinápticas para atravessar a fissura sináptica e ligar-se ao AChR na parte pós-sináptica para desencadear um potencial de ação para contração muscular3,,4. Qualquer defeito nesta estrutura delicada pode causar doenças de NMJ, incluindo atrofia muscular espinhal (SMA), síndromes miasthenic congênitas (CMS), myasthenia gravis (MG)5,,6,,7, etc. Essas doenças prejudicam muito a qualidade de vida dos pacientes e, infelizmente, não têm abordagens efetivas de tratamento devido à falta de compreensão do mecanismo patológico. Neste estudo, tivemos como objetivo gerar NMJ humano in vitro a partir de iPSCs humanos para modelagem precisa de doenças e para triagem de compostos terapêuticos.
Estudos anteriores demonstraram a possibilidade de gerar NMJ in vitro por estratégias de cocultura. Os neurônios motores e os miótubos esqueléticos são gerados, respectivamente. Os dois tipos de células podem ser gerados a partir de culturas de tecido primário humano ou camundongo ou induzidos a partir de células-tronco8,,9,,10,11 e, emseguida,co-cultivados para a formação de NMJ. As outras aplicações incluem a fusão do NMJ co-cultivado em dispositivos 3D microfluidos e o uso de unidades optogenéticas para ensaios funcionais quantificáveis12,,13. No entanto, essas estratégias levam um longo período de cultura e requerem luta para obter os componentes primários do NMJ, seja o neurônio motor ou o mióbo esquelético simultaneamente. Outro componente importante do NMJ, a célula Schwann, não pode ser gerado nesses sistemas culturais. O sistema de cultura avançada que contém o miotube, neurônio motor e célula Schwann é desejável, pois pode oferecer um modelo confiável e robusto para estudos de NMJ.
A Diferenciação Miogênica 1 (MYOD1) é um conhecido regulador miogênico para miogênese14. O eficiente método de diferenciação miogênica que aplicou MYOD1 para conduzir o iPSC em miotubes foi construído em um estudo anterior15. Por isso, induzimos os miotubes ao superexpressar o MYOD1 nos iPSCs15, e mostrou-se alta eficiência da diferenciação miogênica. Curiosamente, as células neurônios apareceram junto com os miotubes espontaneamente após o dia 10. O aparecimento de células neurônios na cultura miogênica nos levou a desenvolver a estratégia para gerar NMJ in vitro em um único prato. Aqui fornecemos uma estratégia para gerar NMJs, superexpressando MYOD1 em iPSCs humanos para indução de neurônios miogênicos e motores no mesmo prato de cultura. Os neurônios motores são induzidos espontaneamente com vários fatores neurotróficos (GDNF, BDNF, NT3, etc.) 8, e, enquanto isso, as células Schwann também podem ser induzidas16,17. Através das interações entre os miótubos, os neurônios motores e as células Schwann, o NMJ maduro é formado18. Este método pode gerar NMJ funcional de forma eficiente, possibilitando o estudo potencial de mecanismos patológicos e triagem de compostos terapêuticos.
Protocolo
1. Preparação de placas revestidas de matriz extracelular (ECM)
- ECM diluído (ver Tabela de Materiais) com gelo frio 1x PBS para uma concentração final de 2%.
- Adicione 1 mL de ECM a 49 mL de 1x PBS em um tubo plástico de 50 mL. Misture bem por pipetting para cima e para baixo várias vezes.
- Coloque 1 tampa em cada poço de uma placa de 6 poços. Adicione 1,5 mL de 2% de ECM em cada poço.
- Incubar a placa do poço com 2% de ECM por 2h a 37 °C.
- Aspire ECM da placa do poço e armazene a placa a 4 °C antes de usar.
2. Diferenciação de iPSCs em relação ao NMJ
- Semente 4 x 105 de iPSCs por poço na placa de 6 poços preparada na seção 1. Certifique-se de semear as células no deslizamento pré-depositado no poço.
NOTA: Neste estudo, foi utilizada a linha de célulasiPS MYOD 201B7, um presente do Laboratório do Dr. Sakurai,15.- Retire o meio dos iPSCs no prato de cultura de 6 cm e lave os iPSCs uma vez com 1x PBS.
- Adicione 1 mL de solução de descolamento celular ao prato e incubar por 10 min a 37 °C.
- Adicione 3 mL de meio de célula embrionária primata (ES) ao prato e pipeta 3 vezes suavemente.
- Colete o supernasciente, que contém iPSCs separados, em um tubo plástico de 50 mL e centrífuga a 160 x g a 4 °C por 5 min.
- Aspire cuidadosamente o supernasciente, resuspenque os iPSCs em 3 mL primata es médio celular com 10 μM Y27632, e conte o número de celular usando um hemócito.
- Diluir os iPSCs com meio de célula ES primata e 10 μM Y27632 a uma concentração de 2 x 105 células/mL. Adicione 2 mL de iPSCs no deslizamento de tampas pré-depositado no poço descrito na seção 1.
- Indução dos iPSCs ao NMJ
- No dia 1, 24 h depois de semear os iPSCs na placa de 6 poços, remova o meio de cultura e substitua-o por 2 mL de meio de célula ES primata fresco contendo 1 μg/mL doxiciclina para cada poço.
- Altere o meio com 2 mL de meio de diferenciação miogênica (MDM) (Tabela 1) contendo 1 μg/mL doxiciclina (concentração final) para cada poço. Refrescar o meio todos os dias do dia 2 ao dia 10.
- A partir do dia 11, troque o médio para 2 mL de meio NMJ(Tabela 1) para cada poço. Atualize o meio a cada 3\u20124 dias depois até o dia 30.
- Observe o NMJ diferenciado por microscopia invertida de fase no dia 30. O NMJ pode ser usado para a seguinte análise.
3. Coloração de imunofluorescência (IF)
- No dia 30, aspire o meio de cultura da placa de 6 poços. Corrija a cultura NMJ adicionando 2 mL de 4% de paraformaldeído a cada poço por 30 minutos à temperatura ambiente.
- Lave as amostras 3 vezes adicionando 2 mL de 1x PBS a cada poço (3 min para cada lavagem).
- Permeabilize as amostras com Triton/PBS de 0,1% por 10 min.
- Repita o passo 3.2.
- Bloqueie as amostras com 0,5% de BSA por 1h em temperatura ambiente.
- Repita o passo 3.2.
- Incubar as amostras com os anticorpos primários a 4 °C durante a noite. A diluição dos anticorpos é a seguinte: Ilhota 1 (1 μg/mL), cadeia pesada de miosina (MYH) (1/300), neurofilamentos (NF) (1 μg/mL)g/mL), S-100 (1/300), proteína de vesícula sináptica 2 (SV2) (1 μg/mL), Tuj1 (1/1000).
- Repita o passo 3.2.
- Incubar as amostras com os anticorpos secundários à temperatura ambiente por 1h. A concentração dos anticorpos secundários utilizados é a seguinte: anti-rato IgG 488 conjugado (0,1 μg/mL), anti-coelho IgG 488 conjugado (0,1 μg/mL).
- Repita o passo 3.2.
- Incubar as amostras com aBTX-647 (0,5 μg/mL) para coloração AChR e com DAPI (1 μg/mL) para coloração do núcleo.
- Repita o passo 3.2.
- Pegue a tampa com um par de fórceps da placa de 6 poços e monte-a em solução de 50% de glicerol/PBS em um slide de microscópio.
4. Microscopia eletrônica de varredura (SEM)
- Fixar a cultura NMJ com 4% de paraformaldeído e 1% glutaraldeído preparado em tampão fosfato de potássio de 0,1 M à temperatura ambiente por 1h.
- Lave as amostras 3 vezes, imergindo-as em tampão fosfato de potássio de 0,1 M à temperatura ambiente (10 min para cada lavagem).
- Desidratar as amostras com concentrações ascendentes de etanol (50%, 70%, 90%, 95% e 100% duas vezes). Mergulhe as amostras em cada concentração de etanol por 10 minutos.
- Seque as amostras por um secador de ponto crítico (-30 °C, 0,1 Torr).
- Cubra as amostras com revestimento de íon pt (platina) (30 mA por 3 min; espessura de Pt é de cerca de 20 nm).
- Observe as amostras por SEM a 5 kV.
5. Microscopia eletrônica de transmissão (TEM)
- Use um raspador de células para colher o tecido da placa de cultura NMJ. Modele o tecido em uma pequena pelota (3 mm3) com uma lâmina de barbear e cola por gelação para formar uma peça embrulhada em gel. Fixar a peça embrulhada em gel com 2% de paraformaldeído e 2% glutaraldeído preparado em 0,1 M tampão fosfato de potássio a 4 °C durante a noite.
- Lave as amostras 3 vezes, imergindo-as em 0,1 M tampão fosfato de potássio (15 min para cada lavagem) à temperatura ambiente.
- Pós-fixar as amostras com 1% de tetroxida de ósmio preparado em H2O destilado duplo por 1h em temperatura ambiente.
ATENÇÃO: Este passo deve ser feito em uma capa química. - Repita o passo 5.2.
- Desidratar as amostras com concentrações ascendentes de etanol (50%, 70%, 90%, 95% e 100% duas vezes). Mergulhe as amostras em cada concentração de etanol por 10 minutos.
- Aspire o etanol 100%. Infiltrar-se nas amostras com proporções de volume ascendente de resina epóxi a misturas 100% de etanol (1:3, 1:1 e 3:1). Agitar cada mistura suavemente a 10 rpm por 1h em temperatura ambiente.
- Substitua a mistura epóxi-etanol por resina epóxi pura e agitar suavemente a 10 rpm por 4h à temperatura ambiente.
- Depois de 4h, refresque a resina epóxi com resina epóxi fresca e agitar suavemente a 10 rpm durante a noite em temperatura ambiente.
- Incorpore as amostras em cápsulas de incorporação com resina epóxi fresca e cure as amostras em um forno a 65 °C durante a noite.
- Ultramicrotomia
- Corte grosseiramente os blocos de amostra sob um microscópio dissecando para a orientação correta.
- Aparar finamente os blocos grosseiramente aparados com uma faca de vidro em um ultramicroome para obter superfícies lisas.
- Prepare seções ultrathin de 70 nm dos blocos bem aparados com uma faca de diamante. Recupere as seções ultrathin com 200 redes de cobre revestidas de carbono de 200 malhas.
- Manche as seções ultrathin contendo grades com acetato de urânl saturado preparado em H2O destilado duplo por 30 min e lave as grades 3 vezes com H2O destilado duplo (10 min para cada lavagem).
- Além disso, contraste as seções ultrathin com o citrato de chumbo da Reynold19 (2,5%) por 5 min e lavar com H2O cozido à temperatura ambiente 3 vezes (10 min para cada lavagem). Coloque várias pelotas de hidróxido de sódio ao redor da área de coloração para evitar a precipitação de CO2 nas seções.
- Observe as seções ultrathin por TEM a 70 kV.
6. Contração muscular e tratamento de curare
- Para desencadear a contração do miotube, adicione 25 mM CaCl2 no meio de cultura na etapa 2.3. O movimento dos miotubes pode ser observado em 1\u20122 min.
- Coloque a placa de 6 poços no palco de um microscópio invertido. Grave um filme de contração do miotube por microscopia celular viva.
- Para parar a contração do miotube, adicione curare ao meio de cultura (300 ng/mL). Em seguida, registo o filme como passo 6.2.
- Abra o arquivo de filme com o software de análise vetorial de movimento e clique no botão Análise de Movimento para analisar o filme.
NOTA: A contração dos miotubes é mostrada como gráfico de movimento temporal. Os filmes são codificados por cores para mostrar a velocidade de movimento dos miotubes. Os sinais brilhantes codificados por cores indicam os movimentos dos miotubes onde a cor vermelha mostra a velocidade de movimento mais rápida e a cor azul mostra a velocidade de movimento mais lenta.
Resultados
Utilizando nossa estratégia de diferenciação, a cultura mostrou componentes pré e pós-sinápticos do NMJ no dia 30. Os componentes do NMJ foram induzidos e bem desenvolvidos em um único poço, e sua morfologia e localizações no NMJ foram demonstradas pela microscopia IF (Figura 1). O fluxograma na Figura 1A resume o curso de tempo da progressão de diferenciação do NMJ. A coloração de neurofilamentos (NF), vesículas sinápticas (SV2) e AChR(Figura 1B,C) indicam os neurônios. As únicas imagens de coloração de NF e SV2 são mostradas na Figura Suplementar 1. A coloração alfa-bungarotoxina indica AChR (Figura 1C). A imagem mesclada mostra as localizações relativas de um neurônio motor e AChR no NMJ (Figura 1D,E). O segundo conjunto de manchas de IF indica o neurônio motor por Tuj1 e Ilhota 1(Figura 1G,H) e miótubos pós-sinápticos pela cadeia pesada de miosina(Figura 1I). As células Schwann também foram rotuladas por anticorpo S-100 na cultura NMJ (Figura Suplementar 2).
Para confirmar melhor as identidades dos componentes do NMJ, utilizou-se SEM para análise morfológica detalhada. Morfologia NMJ madura com terminais de axônio expandidos, axônios e fibras musculares são mostrados na Figura 2A,B. FOI realizado para revelar a ultraestrutura madura dos componentes NMJ, incluindo o terminal de axônio pré-sináptico com vesículas sinápticas e a parte pós-sináptica, que é separada pela fissura sináptica(Figura 2C\u2012E). As dobras juncionais são indicadas pela linha amarela tracejada, que marca a junção do neurônio e das fibras musculares(Figura 2C). Os terminais de axônio maduros que contêm vesículas sinápticas são mostrados na Figura 2D,E (setas amarelas). Os resultados morfológicos mostram que os componentes do NMJ foram bem induzidos e amadurecidos.
Para avaliar a função do NMJ in vitro, realizamos a análise de movimento estimulando o neurônio motor com CaCl2 para desencadear contrações do miotube. Os resultados mostraram que o Ca2+ pode desencadear contrações musculares. As contrações podem ser interrompidas por curare. O NMJ mostrou sinais de movimento proeminentes que desapareceram com o tratamento curare(Figura 3). Este efeito confirma que os sinais do neurônio motor foram transmitidos através do NMJ para desencadear a contração muscular. Juntos, os dados de microscopia if, SEM e TEM demonstraram a distribuição espacial, morfologia e maturidade dos componentes NMJ no NMJ in vitro gerado pelo protocolo descrito acima. A análise de movimento validou a função do NMJ in vitro, o que implica sua potencial aplicação ao desenvolvimento de estratégias terapêuticas.

Figura 1: Gráfico de fluxo para indução de NMJ e imagens IF da cultura NMJ. (A) Um fluxograma para a progressão de diferenciação do NMJ. (B\u2012F) Detecção de componentes NMJ, neurofilamentos (NF), vesículas sinápticas (SV2) e AChR. As setas brancas no painel D indicam o NMJ. (G\u2012K) Componentes pré e pós-sinápticos do NMJ. Tuj1 e Islet1 indicam o neurônio motor, e a cadeia pesada de minosina (MYH) indica o miotube. a-BTX, alfa-bungarotoxina. Clique aqui para ver uma versão maior desta figura.
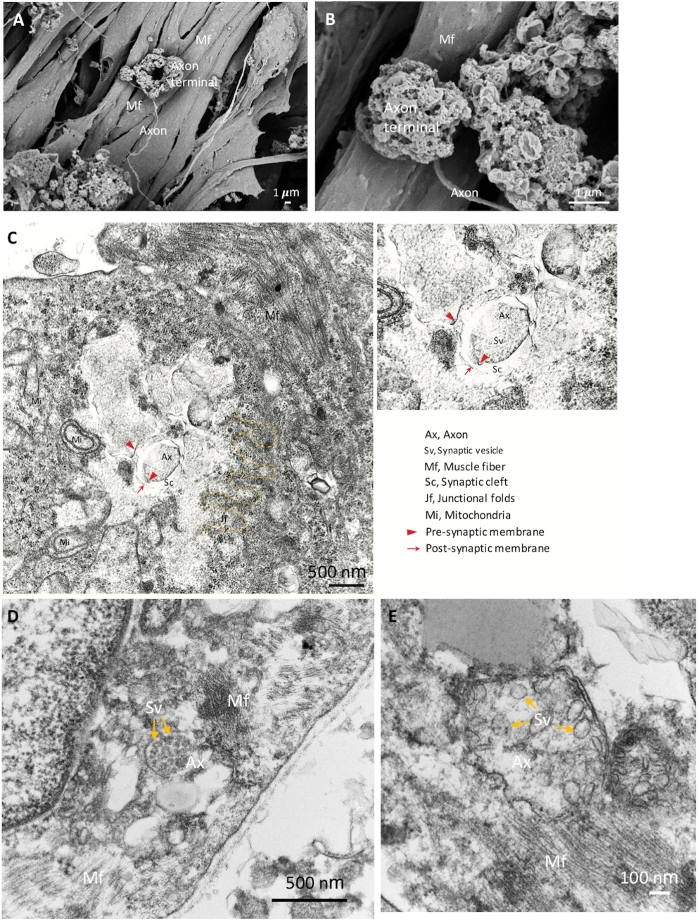
Figura 2: Imagens SEM e TEM de NMJ maduro. (A) A distribuição espacial dos componentes do NMJ mostra o terminal de axônio ancorado na superfície da fibra muscular (Mf). (B) Uma ampliação mais elevada do NMJ mostra os terminais de axônio. (C) A ultraestrutura de um NMJ amadurecido com terminal de axônio pré-sináptico (pontas das flechas vermelhas) e vesículas sinápticas (Sv), fissura sináptica (Sc) e partes pós-sinápticas (setas vermelhas). As dobras juncionais (jf) são indicadas pela linha amarela tracejada. Ax, axon. (D, E) As imagens de alta ampliação mostram as vesículas sinápticas nos terminais de axônio (setas amarelas). Clique aqui para ver uma versão maior desta figura.
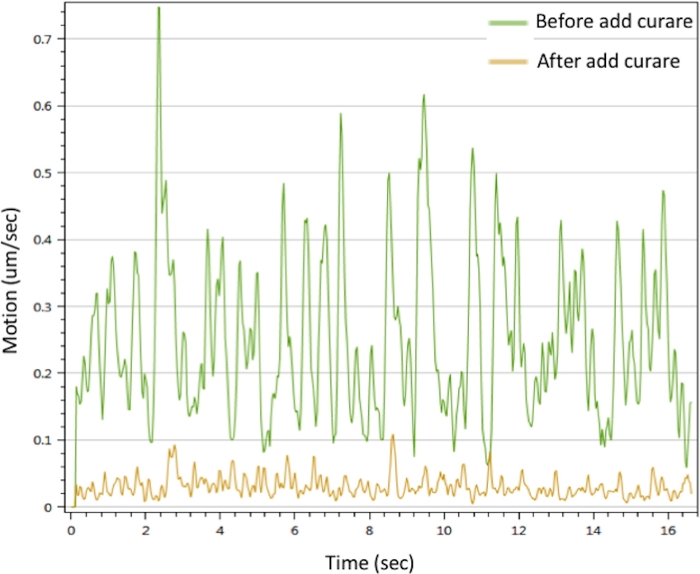
Figura 3: Análise de contração de myotubes de NMJ in vitro. A contração dos miotubes foi desencadeada com a solução CaCl 2 de25 mM (linha verde). As contrações foram inibidas após tratamento com curare (linha amarela). Consulte também o Filme Suplementar 1 e o Filme Suplementar 2. Clique aqui para ver uma versão maior desta figura.
Filme suplementar 1: A contração dos miotubes desencadeada por Ca++. Clique aqui para baixar este vídeo.
Filme suplementar 2: A contração muito mais fraca dos miótubos após o tratamento curare é mostrada. Clique aqui para baixar este vídeo.
Figura suplementar 1: As únicas imagens de coloração de neurofilamentos (NF, setas brancas) na cultura NMJ. As únicas imagens de coloração de vesículas sinápticas (SV2, setas brancas) na cultura NMJ. Clique aqui para baixar este número.
Figura suplementar 2: As células Schwann rotuladas por anticorpo S-100 na cultura NMJ. Clique aqui para baixar este número.
| Meio de diferenciação miogênica (MDM) | MEM-alfa | 500mL |
| 100mM 2-ME | 1117μL | |
| Doxiciclina | 1μg/mL | |
| Ksr | 56mL (final a 10%) | |
| Caneta/Estreptococos | 2,5mL | |
| Total | 560mL | |
| 100mM 2-mercaptoetanol | 2-mercaptoetanol | 7μL |
| d.D. água | 993μL | |
| Total | 1000μL | |
| Meio NMJ | Meio neurobásal (RN) | 500mL |
| B27 | 1x (estoque em 50x) | |
| Bdnf | 10ng/mL | |
| GDNF | 10ng/mL | |
| N2 | 1x (estoque em 100x) | |
| NT3 | 10ng/mL | |
| Caneta/Estreptococos | 2,5mL | |
Tabela 1: Fórmula de médio.
Discussão
Estudos anteriores relataram métodos para formação de NMJ in vitro com métodos sofisticados que requerem cultura de longo prazo8,,10,,12,,13,,20. Essas conquistas lideram a progressão do NMJ in vitro. No entanto, as complicadas metodologias dificultaram o acesso dos estudos do NMJ. Nosso protocolo evita a co-cultura para gerar NMJs de forma eficiente e robusta em um único poço. Três tipos de células no NMJ foram observados em nosso sistema de indução, incluindo os miotubes, os neurônios motores e as células Schwann18. Além disso, foram verificadas morfologia madura e função.
Com base em nosso estudo anterior, a densidade celular inicial é um fator crítico para a formação de NMJ, e diferentes densidades celulares induzem vários números de NMJs na cultura18. Uma baixa densidade celular (< 1 x 104/cm2) induziu um baixo número de neurônios, o que é desfavorável para a formação de NMJ. Embora seja necessário muito mais tempo e recursos para preparar uma densidade maior de células (> 1 x 105/cm2), recomendamos que a densidade celular esteja entre 1,5 x 104/cm2 e 5 x 104/cm2 usando nosso protocolo. O NMJ gerado por este protocolo é um tecido heterogêneo com múltiplos tipos de células que está mais perto de imitar condições fisiológicas. Os miótubos são encontrados para distribuir uniformemente em um prato de cultura, mas os neurônios motores aparecem aleatoriamente, dos quais o fenômeno resulta na distribuição desigual de NMJs em uma cultura. Este NMJ é adequado para estudos qualitativos em vez da análise que exige sistemas de cultura homogêneos. Também usamos outras linhas de celular, eq., H9 (linha celular ES)18 e A11 (linha de célula iPS, dados não mostrados) para gerar NMJ por este protocolo. O NMJ pode ser gerado com sucesso em morfologia e função. A condição cultural, no entanto, precisa ser otimizada para diferentes linhas celulares.
A contração quimicamente desencadeada de miotubes e a inibição dependente de curare confirmaram que nosso NMJ in vitro era funcional e poderia ser potencialmente aplicado para ensaios práticos. Contrações musculares espontâneas foram observadas aleatoriamente em 3\u20124 semanas de cultura, mas poderia ser evitada estendendo o tempo de cultura para até doismeses 18.
Várias estratégias foram publicadas para a geração de NMJ in vitro de diferentes estágios de maturação, mas o NMJ in vitro gerado em nosso sistema mostrou a maturidade significativa, pois podemos observar a transição de subunidades gama para epsilon de AChR durante a cultura18. A maturidade é uma consideração importante para a modelagem de doenças com NMJ in vitro21. Em conclusão, um NMJ in vitro com componentes estruturais integrados, maturidade e função é de uso potencial para o desenvolvimento terapêutico.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Agradecemos ao Dr. Sakurai por fornecer gentilmenteMYOD201B7 . O estudo de microscopia eletrônica foi apoiado por Keiko Okamoto-Furuta e Haruyasu Kohda (Divisão de Estudos Microscópicos eletrônicos, Centro de Estudos Anatômicos, Escola de Pós-Graduação em Medicina da Universidade de Kyoto). O anticorpo monoclonal foi desenvolvido pela HHMI/Columbia University, obtido do Banco Hybridoma de Estudos de Desenvolvimento, criado pelo Instituto Nacional de Saúde Infantil e Desenvolvimento Humano do NIH, e mantido no Departamento de Biologia da Universidade de Iowa. Agradecemos também a Shiori Oshima, Kazuhiro Nakagawa e Eriko Matsui pela análise de vetores de movimento. Este trabalho foi apoiado por financiamento da Sociedade Japonesa para a Promoção da Ciência KAKENHI, números de subvenção 16H05352 e 20H03642 (para MKS); Fundo de Pesquisa celular do iPS (para CYL e MKS); Mochida Memorial Foundation for Medical and Pharmaceutical Research (para MKS); Takeda Science Foundation (para MKS); e uma bolsa do Programa de Pesquisa de Doenças Intratáveis utilizando células iPS específicas para doenças, que foi auxiliada pela Agência japonesa de Pesquisa e Desenvolvimento Médico (17935400 para CYL e MKS, e 17935423 para mks).
Materiais
| Name | Company | Catalog Number | Comments |
| Medium, growth factors and reagents | Item | Brand | Cat. Number |
| 2-mercaptoethanol | Nacalai tesque | 21418-42 | |
| B27, Gibco | Gibco | 12587-001 | |
| BDNF | R & D Systems | 248-BD | |
| Cell detachment solution, Accumax | STEMCELL Technologies | #07921 | |
| Critical point dryer | Hitachi | ES-2030 | |
| Doxycycline | Takara | 631311 | |
| ECM, Matrigel (growth factor reduced) | Corning | 356230 | |
| GDNF | R & D Systems | 212-GD | |
| Gelation, IP gel | Geno Staff | PG20-1 | |
| Ions coater | JEOL | JEC3000FC | |
| iPSC medium, mTeSR | STEMCELL Technologies | 85850 | |
| KnockOut SR (KSR) | Gibco | 10828-028 | |
| live cell microscopy | Nikon | Eclipse Ti microscope | |
| MEM-alpha | Gibco | 12571-071 | |
| Motion vector analysis software | Sony | SI8000 | |
| N2, Gibco | Gibco | 17502-048 | |
| Neurobasal medium | Gibco | 21103-049 | |
| NT3 | R & D Systems | 267-N3 | |
| Primate ES cell medium | ReproCell | RCHEMD001 | |
| SEM | Hitachi | S-4700 | |
| TEM | Hitachi | H7650 | |
| Y27632 | Wako Chemicals GmbH | 253-00513 | |
| Antibodies | Brand | Cat. Number | Dilutions |
| Molecular Probes | B3545 | 0.5 ug/ml | |
| Islet 1 | DSHB | 40.2D6 | 1/100 |
| Myosin heavy chain (MYH) | MilliporeSigma | A4.1025 | 1/300 |
| Neurofilaments (NF) | MilliporeSigma | MAB5254 | 1/500 |
| S-100 | Abcam | ab14849 | 1/300 |
| Synaptic vesicle protein 2 (SV2) | DSHB | SV2 | 1/50 |
| Tuj1 | Covance | MMS435P | 1/1000 |
Referências
- Hong, I. H. K., Etherington, S. J. Neuromuscular Junction. eLS. , (2001).
- Sanes, J. R., Lichtman, J. W. Development of the vertebrate neuromuscular junction. Annual Review of Neuroscience. 22, 389-442 (1999).
- Jones, R. A., et al. Cellular and Molecular Anatomy of the Human Neuromuscular Junction. Cell Reports. 21 (9), 2348-2356 (2017).
- Slater, C. R. The Structure of Human Neuromuscular Junctions: Some Unanswered Molecular Questions. International Journal of Molecular Sciences. 18 (10), 2183 (2017).
- Comley, L. H., Nijssen, J., Frost-Nylen, J., Hedlund, E. Cross-disease comparison of amyotrophic lateral sclerosis and spinal muscular atrophy reveals conservation of selective vulnerability but differential neuromuscular junction pathology. Journal of Comparative Neurology. 524 (7), 1424-1442 (2016).
- Shigemoto, K., et al. Muscle weakness and neuromuscular junctions in aging and disease. Geriatrics & Gerontology International. 10, 137-147 (2010).
- Abicht, A., Müller, J., Lochmüller, H. Congenital Myasthenic Syndromes. GeneReviews. , (2016).
- Faravelli, I., et al. Motor neuron derivation from human embryonic and induced pluripotent stem cells: experimental approaches and clinical perspectives. Stem Cell Research & Therapy. 5 (4), 87-100 (2014).
- Demestre, M., et al. Formation and characterisation of neuromuscular junctions between hiPSC derived motoneurons and myotubes. Stem Cell Research. 15 (2), 328-336 (2015).
- Yoshida, M., et al. Modeling the early phenotype at the neuromuscular junction of spinal muscular atrophy using patient-derived iPSCs. Stem Cell Reports. 4 (4), 561-568 (2015).
- Vilmont, V., Cadot, B., Ouanounou, G., Gomes, E. R. A system for studying mechanisms of neuromuscular junction development and maintenance. Development. 143 (13), 2464-2477 (2016).
- Uzel, S. G. M., et al. Microfluidic device for the formation of optically excitable, three-dimensional, compartmentalized motor units. Science Advances. 2 (8), 1501429 (2016).
- Santhanam, N., et al. Stem cell derived phenotypic human neuromuscular junction model for dose response evaluation of therapeutics. Biomaterials. 166, 64-78 (2018).
- Davis, R. L., Weintraub, H., Lassar, A. B. Expression of a single transfected cDNA converts fibroblasts to myoblasts. Cell. 51 (6), 987-1000 (1987).
- Tanaka, A., et al. Efficient and reproducible myogenic differentiation from human iPS cells: prospects for modeling Miyoshi Myopathy in vitro. PLoS One. 8 (4), 61540 (2013).
- Furlan, A., Adameyko, I. Schwann cell precursor: a neural crest cell in disguise. Developmental Biology. 444, 25-35 (2018).
- Jessen, K. R., Mirsky, R. Schwann Cell Precursors; Multipotent Glial Cells in Embryonic Nerves. Frontiers in Molecular Neuroscience. 12 (69), (2019).
- Lin, C. Y., et al. iPSC-derived functional human neuromuscular junctions model the pathophysiology of neuromuscular diseases. JCI Insight. 4 (18), (2019).
- Reynolds, E. S. The use of lead citrate at high pH as an electron-opaque stain in electron microscopy. Journal of Cell Biology. 17 (1), 208-212 (1963).
- Steinbeck, J. A., et al. Functional Connectivity under Optogenetic Control Allows Modeling of Human Neuromuscular Disease. Cell Stem Cell. 18 (1), 134-143 (2016).
- Bucchia, M., Merwin, S. J., Re, D. B., Kariya, S. Limitations and Challenges in Modeling Diseases Involving Spinal Motor Neuron Degeneration in vitro. Frontiers in Cellular Neuroscience. 12, 61 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados