Method Article
Contribución de la bomba Na+/ K+ a la explosión rítmica, explorada con modelado y análisis dinámicos de abrazadera
En este artículo
Erratum Notice
Resumen
Aquí se presenta un método para la investigación de los roles de la bomba Na+/ K+ y la corriente persistente de Na+ en interneuronas cardíacas de sanguijuela utilizando pinza dinámica.
Resumen
La bomba Na+/ K+, a menudo considerada como una función de fondo en la actividad neuronal, contribuye con una corriente hacia afuera(bombaI)que responde a la concentración interna de Na+ ([Na+]i). En las neuronas en explosión, como las que se encuentran en las redes neuronales generadoras de patrones centrales (CPG) que producen movimientos rítmicos, se puede esperar que el [Na+]i y, por lo tanto, la bombaI , varíe a lo largo del ciclo de estallido. Esta capacidad de respuesta a la actividad eléctrica, combinada con la independencia del potencial de membrana, dota a la bomba I de propiedades dinámicas que no son comunes a las corrientes basadas en canales (por ejemplo, canales de voltaje o transmisores o fugas). Además, en muchas neuronas, la actividad de la bomba es modulada por una variedad de moduladores, ampliando aún más el papel potencial de la bomba I en la actividad de estallido rítmico. Este artículo muestra cómo utilizar una combinación de modelado y métodos de pinza dinámica para determinar cómo bombeo y su interacción con la corriente persistente de Na+ influyen en la actividad rítmica en una GPC. Específicamente, este artículo se centrará en un protocolo de pinza dinámica y métodos de modelado computacional en interneuronas cardíacas de sanguijuelas medicinales.
Introducción
Los latidos del corazón en las sanguijuelas son impulsados por una GPC que consiste en 9 pares bilaterales de interneuronas cardíacas (HN) distribuidas en la mayor cantidad de ganglios segmentarios de la mitad del cuerpo. En el núcleo de la GPC se encuentran pares mutuamente inhibitorios de interneuronas ubicadas en los ganglios segmentarios3º y4º que forman osciladores semicéntricos (HCO)(Figura 1A). Estas neuronas continúan estallando cuando se aíslan sinápticamente farmacológicamente usando bicucullina1. Otros, como el par en los ganglios segmentarios7 (el foco de este protocolo), también son ráfagas, capaces de producir actividad de estallido cuando se aíslan sinápticamente. No están mutuamente conectados y reciben solo entrada descendente, y por lo tanto se aíslan fácilmente al separar el ganglio del resto del cordón nervioso. Esta actividad de estallido independiente es sensible a la corriente de fuga introducida causada por la penetración con microelectrodos afilados para la grabación, pero estalla vigorosamente cuando se graba con métodos de parche suelto1.
Se han modelado tanto las neuronas HN individuales como las HN HNO HCOs (modelos de compartimento isopotencial único basados en Hodgkin-Huxley de neuronas HN que contienen todas las corrientes sinápticas y de voltaje identificadas experimentalmente), y todas las características de estallido del sistema vivo se han capturado con éxito2. La miomodulina, un neuropéptido endógeno en las sanguijuelas, disminuye notablemente el período (T) del ritmo de estallido de las neuronas HN aisladas y las HN HNo. Este modulador actúa para aumentar la corriente h (corriente interna activada por hiperpolarización, Ih)y para disminuir labombaI3. Esta observación llevó a la exploración de cómo labomba I interactúa con Ih,y cómo su co-modulación contribuye a la actividad rítmica de las neuronas HN. La activación de la bomba mediante el aumento de [Na+]i (utilizando el ionóforo monensina) acelera el ritmo de estallido de HN tanto en HN HCOs como en neuronas HN aisladas4. Esta aceleración dependía de Ih. Cuando Ih estaba bloqueado (2 mM Cs+),el período de ráfaga no se alteraba por este método de activación de la bomba; sin embargo, la duración de la ráfaga (BD) se redujo y el intervalo de interbursura (IBI) aumentó tanto en HN HCOs como en neuronas HN aisladas4.
Para este protocolo, todas las corrientes de una neurona HN(7) viva, incluida la corriente de bomba, I bomba,se incorporan en el modelo HN de la siguiente manera:
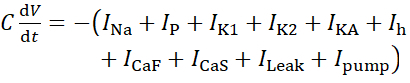 (1)
(1)
donde C es la capacitancia de membrana (en nF), V es el potencial de membrana (en V), t es el tiempo (en s). Las descripciones y ecuaciones detalladas de la corriente iónica se han descrito en otra parte2,4. La neurona modelo HN completa se ejecuta en tiempo real (Figura 2). El software estará disponible en GitHub en el momento de su publicación y será adecuado para ejecutarse en la placa de procesamiento de señal digital descrita en la Tabla de materiales. Aquí, el foco de investigación es la corriente de la bomba Na+/ K+ (bombaI) y las corrientes de voltaje que contribuyen con un flujo significativo de Na+: una corriente rápida de Na+ (INa) y una corriente persistente de Na+ (IP). Las conductancias máximas de estas corrientes son 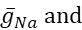
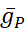 respectivamente. La bomba Na+/K+ intercambia tres iones intracelulares Na+ por dos iones K+ extracelulares, produciendo así una corriente neta hacia el exterior. Es importante destacar que bombea 3 veces más Na+ fuera de la neurona de lo que indica esta corriente, lo cual es importante para calcular la concentración intracelular de Na+.
respectivamente. La bomba Na+/K+ intercambia tres iones intracelulares Na+ por dos iones K+ extracelulares, produciendo así una corriente neta hacia el exterior. Es importante destacar que bombea 3 veces más Na+ fuera de la neurona de lo que indica esta corriente, lo cual es importante para calcular la concentración intracelular de Na+.
La corriente de bomba Na+/K+ depende de las concentraciones intracelulares de Na+ y se expresa mediante la siguiente función sigmoidal:
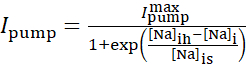 (2)
(2)
donde [Na]i es la concentración intracelular de Na+,  es la corriente máxima de la bomba Na+/K+, [Na]ih es la concentración intracelular de Na+ para la media activación de la bomba Na+/K+, y [Na]es la sensibilidad de la bomba Na+/K+ a [Na]i. [Na]i se construye como resultado de las afluencias de Na+ transportadas por IP e INa y se ve disminuida por el eflujo na+ de la bomba Na+/ K+. La contribución de Ih e ILeak al flujo total deNa+ es pequeña y no se considera en el modelo en tiempo real.
es la corriente máxima de la bomba Na+/K+, [Na]ih es la concentración intracelular de Na+ para la media activación de la bomba Na+/K+, y [Na]es la sensibilidad de la bomba Na+/K+ a [Na]i. [Na]i se construye como resultado de las afluencias de Na+ transportadas por IP e INa y se ve disminuida por el eflujo na+ de la bomba Na+/ K+. La contribución de Ih e ILeak al flujo total deNa+ es pequeña y no se considera en el modelo en tiempo real.
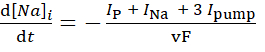 (3)
(3)
donde, v es el volumen (~6.7 pL) del reservorio intracelular de Na+, F es la constante de Faraday, y la concentración extracelular de Na+ se mantiene constante.
Se han diferenciado las conductancias dependientes de voltaje y fugas, que responden al potencial de membrana, de la corriente de la bomba, que está regulada por la concentración intracelular calculada de Na+ ([Na+]i). [Na+] i se construye a través de na+ entrada a través de la corriente rápida Na+ (INa) que produce potenciales de acción (picos) y la corriente persistente Na+ (IP) que proporciona la despolarización para soportar el aumento. [Na+] i es, a su vez, reducido por la acción de la bomba a través de la extrusión deNa+. Se han asumido valores basales de HN vivo de  (5nS) y
(5nS) y 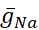 (150 nS), y tenemos en cuenta cualquier abrazadera dinámica
(150 nS), y tenemos en cuenta cualquier abrazadera dinámica  añadida.
añadida.
El objetivo del protocolo descrito aquí es manipular la bomba de forma precisa y reversible en tiempo real para descubrir cómo interactúa con las corrientes de voltaje (corriente persistente de Na+ en el protocolo actual) para controlar el estallido rítmico en HNs individuales. Para lograr este objetivo, se utilizó una abrazadera dinámica, que introduce artificialmente, por orden, una cantidad precisa de cualquier corriente que se puede calcular a medida que se ejecuta el modelo. Este método tiene ventajas sobre la manipulación farmacológica de la bomba, que afecta a todo el tejido, puede tener efectos fuera del objetivo que a menudo son difíciles de revertir y no se pueden manipular con precisión. La abrazadera dinámica5,6 lee el voltaje de una neurona registrada en tiempo real(Figura 1B)y calcula e inyecta, en tiempo real, la cantidad de cualquier corriente basada en ecuaciones del modelo y los valores establecidos de 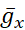 cualquiera o
cualquiera o  . Métodos similares se pueden aplicar fácilmente a cualquier neurona que se pueda registrar intracelularmente. Sin embargo, los parámetros tendrán que ser reescalados a la neurona elegida, y la neurona debe aislarse de las entradas sinápticas, por ejemplo, farmacológicamente.
. Métodos similares se pueden aplicar fácilmente a cualquier neurona que se pueda registrar intracelularmente. Sin embargo, los parámetros tendrán que ser reescalados a la neurona elegida, y la neurona debe aislarse de las entradas sinápticas, por ejemplo, farmacológicamente.
Protocolo
NOTA: Los sujetos experimentales de animales invertebrados no están regulados por los NIH ni por las Universidades Estatales de Emory y Georgia. Sin embargo, se tomaron todas las medidas para minimizar el sufrimiento de las sanguijuelas utilizadas en este trabajo.
1. Prepare el ganglio aislado 7 del cordón nervioso de la sanguijuela
- Mantenga las sanguijuelas Hirudo verbana en agua artificial de estanque (que contiene 0,05% p/v de sal marina) diluidas en agua desionización a 16 °C en un ciclo de luz-oscuridad de 12:12.
- Prepare las sanguijuelas para la disección anestesiando en frío en un lecho de hielo picado durante >10 minutos hasta que quede inmóvil.
- Llene un plato de disección negro forrado de resina a una profundidad de ~ 1 cm con solución salina refrigerada que contenga 115 mM NaCl, 4 mM KCl, 1.7 mM CaCl2,10 mM D-glucosa y 10 mM HEPES en agua desionización; pH ajustado a 7,4 con 1 M de NaOH. Fije el lado dorsal de la sanguijuela hacia arriba en la cámara revestida de resina negra (al menos 20 cm x 10 cm con una profundidad de al menos 2 cm por encima de la resina que tiene al menos 2 cm de espesor).
- Bajo un esteromicroscopio a un aumento de 20x con iluminación de guía de luz oblicua, haga un corte longitudinal de al menos 3 cm de largo con tijeras de resorte de 5 mm a través de la pared del cuerpo en laparte rostral 1/3 del cuerpo. Use alfileres para apartar la pared del cuerpo y exponer los órganos internos.
NOTA: Cualquier harina de sangre almacenada se puede eliminar por succión con una pipeta Pasteur pulida al fuego. - Aislar un ganglio individual de la mitad del cuerpo 7 (séptimo ganglio segmentario libre caudal al cerebro).
- Abra el seno en el que reside el cordón nervioso con las tijeras de resorte de 5 mm. Asegúrese de dividir el seno dorsal y ventralmente dejando dos tiras de seno. Use pinzas afiladas # 5 para ayudar a guiar el corte y sostener el seno.
- Mantenga el seno unido a cada una de las dos raíces nerviosas bilaterales que emergen del ganglio (se adhiere firmemente a cada raíz) para usar estas tiras de seno para fijar el ganglio.
- Retire el ganglio del cuerpo cortando los haces nerviosos conectivos rostrales y caudales que unen los ganglios (lo más lejos posible del ganglio 7) y las tiras sinusales, yluego corte las raíces laterales a donde emergen del seno.
- Fije el ganglio (usando viejas pinzas #5 embotadas) con alfileres de insectos minuten acortados, ventral hacia arriba, en placas de Petri claras y forradas de resina. Inserte alfileres en las tiras de senos paranasales y tejido suelto adheridos a las raíces y los conectivos rostrales y caudales, lo más lejos posible del ganglio.
NOTA: La resina no debe tener un grosor superior a 3 mm si se quiere lograr una buena iluminación desde abajo durante la grabación. Asegúrese de que el ganglio esté tenso, tanto longitudinal como lateralmente. - Aumente la ampliación del estereomiroscopio a 40 veces o más, y ajuste la iluminación oblicua para que los cuerpos celulares neuronales se puedan ver fácilmente en la superficie ventral del ganglio justo debajo del perineurio.
- Retire el perineurio del ganglio (desvainación) con microscisores.
- Comience el desenvainado cortando la funda suelta entre las raíces de un lado, y continúe el corte lateralmente hacia el otro lado, asegurándose de mantener las cuchillas de tijera superficiales y no dañar los cuerpos celulares neuronales directamente debajo de la funda.
- Haga un corte superficial similar caudalmente desde el corte lateral a lo largo de la línea media.
- Ahora agarre el colgajo caudolateral de la vaina de un lado con las finas pinzas # 5, aléjelo del ganglio y córtelo con las microescisoras.
- Repetir en el otro lado; este procedimiento expone ambas neuronas HN(7) para su registro con microelectrodos.
- Coloque el plato de preparación en la configuración de grabación y superfuse con solución salina a un caudal de 5 ml / min a temperatura ambiente.
2. Identificar y registrar interneuronas cardíacas sanguijuelas con microelectrodos afilados
- Durante la duración del registro de la neurona HN(7) (las grabaciones duran entre 30 y 60 min), adquirir y digitalizar las trazas de corriente y voltaje intracelulares de un electrómetro neurofisiológico de muestreo a una velocidad de 5 kHz con un sistema de adquisición de datos digitales (analógico a digital, A a D) y estimulación (digital a analógico, D a A), y mostrar en la pantalla de una computadora.
NOTA: Cualquier software comercial o personalizado y placa de A a D/D a A se puede utilizar para la adquisición de datos (A a D). Se requiere de D a A y software personalizado para la abrazadera dinámica. - Bajo un esterocroscopio a 50-100x con iluminación de campo oscuro desde abajo, identifique tentativamente una neurona HN(7) del par bilateral por su ubicación canónica en la posición posteriolateral en el ganglio de cuerpo medio siete.
- Ahora trate de penetrar en la neurona putativa HN(7) con un microelectrodo afilado lleno de 2 M de acetato de potasio y 20 mM KCl utilizando un micromanipulador.
- Coloque el microelectrodo muy cerca del cuerpo celular objetivo.
- Observe continuamente el potencial registrado con el electrómetro y establezca este potencial en cero mV antes de penetrar en la neurona.
- Penetrar en la neurona con el microelectrodo, impulsando lentamente el electrodo a lo largo de su eje largo con el manipulador. Usando la función de zumbido del electrómetro, ajustado a 100 ms de duración del zumbido, hasta que se observe un cambio negativo en el potencial de la membrana y una actividad de aumento vigoroso.
- Configure el electrómetro en modo de abrazadera de corriente discontinua (DCC) ≥ 3 kHz para registrar simultáneamente el potencial de membrana y la corriente de paso con el microelectrodo único (compensación de capacidad establecida justo debajo del timbre y luego marcada de nuevo 10%).
- Monitoree la sedimentación del electrodo durante la DCC en un osciloscopio.
- Inyecte una corriente constante de -0.1 nA con el inyector de corriente constante del electrómetro durante uno o dos minutos para estabilizar la grabación.
- Identificar definitivamente la neurona HN(7) por su característica forma de espiga y débil actividad de estallido (Figura 1Ci).
- Realice cualquier análisis de datos sin conexión una vez completado el experimento y guarde todos los datos en un disco.
3. Construir una HN en tiempo real u otra neurona modelo
- Cree software personalizado utilizando una placa de procesamiento de señal digital (DSB; D a A y A a D) en un ordenador de sobremesa para implementar en tiempo real las corrientes modelo descritas en2,4 o diferentes corrientes modelo para otras neuronas o experimentos.
- Utilice ecuaciones de estilo Hodgkin-Huxley, ya que son el método generalmente preferido para representar las corrientes del modelo.
- Consulte7 para obtener una descripción detallada de la implementación del modelo HN en tiempo real y la abrazadera dinámica antes de la adición de la corriente de la bomba. Consulte la sección de introducción para la descripción de las corrientes, la concentración intracelular de Na+ y las conductancias de la neurona HN(7) viva en el modelo HN.
4. Implementar y variar las conductancias/corrientes dinámicas de la abrazadera
- Utilice el software de abrazadera dinámica personalizado para el DSB para implementar y cambiar en tiempo real la abrazadera dinámica de cualquiera de las conductancias y corrientes programadas accesibles a la interfaz gráfica de usuario(Figura 3)(GUI) del modelo en tiempo real HN de la neurona HN(7).
NOTA: Como recordatorio, y
y  son la conductancia máxima de la corriente persistenteNa+ (IP) y la corriente máxima de la bomba (bombaI), respectivamente.
son la conductancia máxima de la corriente persistenteNa+ (IP) y la corriente máxima de la bomba (bombaI), respectivamente. - Utilice los cuadros de entrada de gui en el software para realizar cambios, a medida que se ejecuta el modelo, en el
 (cuadro PumpMaxL) y
(cuadro PumpMaxL) y  (cuadro GpinHNLive)(Figura 3).
(cuadro GpinHNLive)(Figura 3).
NOTA: Los cuadros de entrada de gui aceptan valores con tipo, y se recomiendan pasos de 0.1 nA para y pasos de 1 nS para
para y pasos de 1 nS para  .
.- Agregue pequeñas cantidades de
 y
y  con abrazadera dinámica para estabilizar el estallido de la neurona HN(7), que se debilita por una fuga inducida por microelectrodos, como se muestra en la Figura 1Cii.
con abrazadera dinámica para estabilizar el estallido de la neurona HN(7), que se debilita por una fuga inducida por microelectrodos, como se muestra en la Figura 1Cii.
NOTA: La penetración aguda de microelectrodos causa daños en la membrana que se expresan como un aumento de la conductancia de la fuga o una disminución de la resistencia de entrada. - Comience agregando un valor
 de 0.1-0.2 nA, que compensa la fuga inducida por microelectrodos, pero deprime la excitabilidad, y luego aumente
de 0.1-0.2 nA, que compensa la fuga inducida por microelectrodos, pero deprime la excitabilidad, y luego aumente  gradualmente, lo que aumenta la excitabilidad, hasta que se produzca un estallido regular, generalmente a
gradualmente, lo que aumenta la excitabilidad, hasta que se produzca un estallido regular, generalmente a  ~ 1-4 nS(Figura 4A).
~ 1-4 nS(Figura 4A).
- Agregue pequeñas cantidades de
- Co-variar sistemáticamente estas corrientes (incrementos de 0,1 nA para
 y 1 nS para
y 1 nS para  ) a la neurona HN(7) registrada con pinza dinámica ( Figura3), y evaluar sus efectos sobre las características de la ráfaga: frecuencia de pico (f: la recíproca del promedio del intervalo interspike durante una ráfaga), intervalo de interbursura (IBI: el tiempo entre el último pico en una ráfaga y el primer pico en la siguiente ráfaga), duración de la ráfaga (BD: el tiempo entre el primer pico en una ráfaga y el último pico en una ráfaga), y el período de ráfaga (T: el tiempo entre el primer pico en una ráfaga y el primer pico en la explosión posterior).
) a la neurona HN(7) registrada con pinza dinámica ( Figura3), y evaluar sus efectos sobre las características de la ráfaga: frecuencia de pico (f: la recíproca del promedio del intervalo interspike durante una ráfaga), intervalo de interbursura (IBI: el tiempo entre el último pico en una ráfaga y el primer pico en la siguiente ráfaga), duración de la ráfaga (BD: el tiempo entre el primer pico en una ráfaga y el último pico en una ráfaga), y el período de ráfaga (T: el tiempo entre el primer pico en una ráfaga y el primer pico en la explosión posterior).- Cambie los valores de

 y, como en la demostración en video, para familiarizarse con la técnica y luego aventurarse.
y, como en la demostración en video, para familiarizarse con la técnica y luego aventurarse.- Manténgase
 en un valor fijo específico y barre en incrementos de 1 nS en un rango de actividad de ráfaga regular de
en un valor fijo específico y barre en incrementos de 1 nS en un rango de actividad de ráfaga regular de  soporte.
soporte. - Ahora aumente el valor fijo de
 0.1 nA y nuevamente barre sobre un rango de actividad de ráfaga regular de
0.1 nA y nuevamente barre sobre un rango de actividad de ráfaga regular de  apoyo.
apoyo. - Para cada par de parámetros implementado, recopile datos que contengan al menos 8 ráfagas para que se puedan realizar mediciones promedio confiables de f, IBI, BD y T.
- Continúe con barridos durante el tiempo que la neurona permanezca viable, según lo evaluado por un fuerte pico y un potencial de oscilación basal estable.
- Recopilar datos de varias neuronas (de diferentes animales) para generar un gráfico compuesto(Figura 5).
- Manténgase
- Cambie los valores de
Resultados
El modelado con la adición de la bombaI4 acercó los hallazgos experimentales presentados en la sección de introducción y comenzó a explicar el mecanismo de estallido asistido por bomba. El modelo en tiempo real que se muestra aquí se ha ajustado (y se 
 han elegido los parámetros) para que produzca una actividad rítmica regular que caiga dentro de los límites de la actividad normal como se observa en los experimentos - f, IBI, BD, T - y continúa produciendo dicha actividad cuando los parámetros modulados por miomodulina
han elegido los parámetros) para que produzca una actividad rítmica regular que caiga dentro de los límites de la actividad normal como se observa en los experimentos - f, IBI, BD, T - y continúa produciendo dicha actividad cuando los parámetros modulados por miomodulina  (la corriente de bomba máxima) y
(la corriente de bomba máxima) y 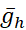 (la conductancia máxima de la corriente h) son variados o covariados en el modelo. Los valores de parámetros determinados se pueden utilizar como punto de referencia o conjunto canónico para experimentos de modelado. En estos casos de modelo, la bomba oscila a lo largo del ciclo de ráfaga como [Na+]i alrededor de un nivel de referencia. Labomba I contribuye a la terminación de la ráfaga durante la fase de ruptura, y la hiperpolarización que produce activa la I h durante el IBI; observe el nivel máximo de Ih cerca de la iniciación de ráfaga(Figura 2).
(la conductancia máxima de la corriente h) son variados o covariados en el modelo. Los valores de parámetros determinados se pueden utilizar como punto de referencia o conjunto canónico para experimentos de modelado. En estos casos de modelo, la bomba oscila a lo largo del ciclo de ráfaga como [Na+]i alrededor de un nivel de referencia. Labomba I contribuye a la terminación de la ráfaga durante la fase de ruptura, y la hiperpolarización que produce activa la I h durante el IBI; observe el nivel máximo de Ih cerca de la iniciación de ráfaga(Figura 2).
Aunque el modelo HN en tiempo real ha implementado todas las corrientes2,4 disponibles para la sujeción dinámica, el enfoque aquí estaba en y , que están disponibles para cambios mientras el modelo se ejecuta en la GUI de 
 abrazadera dinámica(Figura 3). La abrazadera dinámica permite al experimentador agregar (o restar con un negativo
abrazadera dinámica(Figura 3). La abrazadera dinámica permite al experimentador agregar (o restar con un negativo 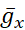 o
o  ) cualquier conductancia o corriente en una neurona artificialmente que imita el voltaje y la dependencia iónica de una conductancia o corriente real. Por lo tanto, es posible explorar completamente cómo una conductancia / corriente particular interactúa con las conductancias / corrientes endógenas dentro de las células (Figura 1). El modelo HN en tiempo real indica que la corriente persistente de Na+ (IP) en las neuronas HN contribuye con gran parte de la entrada de Na+ afectando fuertemente a [Na+]i (Figura 2) y por lo tanto, bombeo. Debido a que IP está activo a potenciales de membrana relativamente negativos, se opone a labomba I incluso durante el IBI.
) cualquier conductancia o corriente en una neurona artificialmente que imita el voltaje y la dependencia iónica de una conductancia o corriente real. Por lo tanto, es posible explorar completamente cómo una conductancia / corriente particular interactúa con las conductancias / corrientes endógenas dentro de las células (Figura 1). El modelo HN en tiempo real indica que la corriente persistente de Na+ (IP) en las neuronas HN contribuye con gran parte de la entrada de Na+ afectando fuertemente a [Na+]i (Figura 2) y por lo tanto, bombeo. Debido a que IP está activo a potenciales de membrana relativamente negativos, se opone a labomba I incluso durante el IBI.
Estas observaciones indican que es instructivo explorar las interacciones entre  y
y  en neuronas HN aisladas con pinza dinámica como se discutió anteriormente8,9,10. Estos experimentos (en curso) se realizan con registros de microelectrodos agudos en neuronas HN(7) aisladas sinápticamente (séptimo ganglio cortado del cordón nervioso). Hasta la fecha, estos experimentos muestran que el estallido robusto se restaura en las neuronas HN tonicamente activas (debido a la fuga introducida de penetración de microelectrodos) mediante la co-adición de IP y Ibomba con abrazadera dinámica(Figura 4). Esta es una observación importante que indica que hay un mecanismo de estallido disponible en estas neuronas (incluso cuando la fuga se ve comprometida) que resulta de la interacción de labomba I y la IP. Los resultados preliminares indican su fuerte interacción complicada, que puede ser explorada en el modelo y los experimentos (Figura 5).
en neuronas HN aisladas con pinza dinámica como se discutió anteriormente8,9,10. Estos experimentos (en curso) se realizan con registros de microelectrodos agudos en neuronas HN(7) aisladas sinápticamente (séptimo ganglio cortado del cordón nervioso). Hasta la fecha, estos experimentos muestran que el estallido robusto se restaura en las neuronas HN tonicamente activas (debido a la fuga introducida de penetración de microelectrodos) mediante la co-adición de IP y Ibomba con abrazadera dinámica(Figura 4). Esta es una observación importante que indica que hay un mecanismo de estallido disponible en estas neuronas (incluso cuando la fuga se ve comprometida) que resulta de la interacción de labomba I y la IP. Los resultados preliminares indican su fuerte interacción complicada, que puede ser explorada en el modelo y los experimentos (Figura 5).
En conclusión, bombeo en respuesta a aumentos periódicos en [Na+]i durante la actividad de estallido contribuye al ritmo de ráfaga a través de la terminación de ráfaga (disminución de BD). La interacción de la bomba IP e I constituye un mecanismo que es suficiente para soportar la actividad de estallido endógeno; este mecanismo puede restablecer el estallido robusto en las interneuronas HN registradas intracelularmente en el ganglio 7. La interacción entre IP y Ibombea a través de [Na+]i afecta el período de ráfaga HN de forma no monótona y garantiza la robustez de la ráfaga autónoma. Estas conclusiones están en línea con los experimentos y el modelado en sistemas de vertebrados11,12.
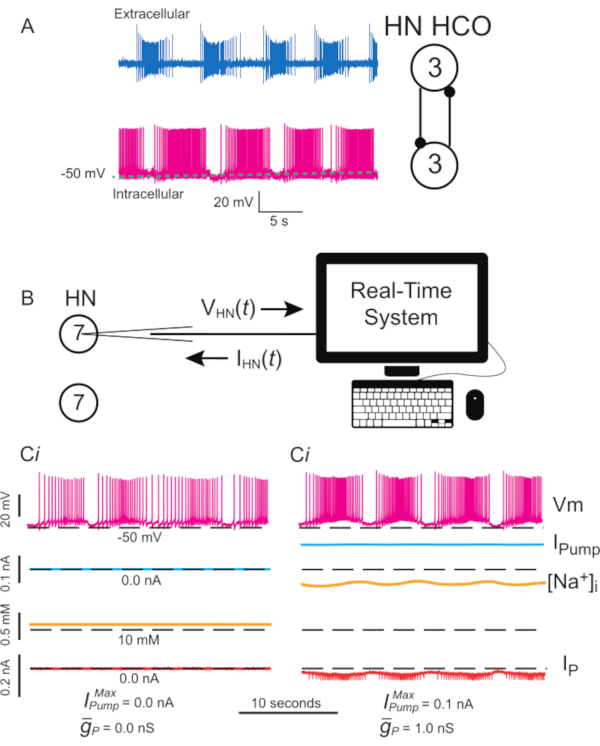
Figura 1: Actividad eléctrica interneurona del corazón de sanguijuela e implementación de la bomba I y la I P con pinza dinámica. (A) Actividad de estallido normal registrada simultáneamente, extracelularmente (arriba) e intracelularmente (abajo), en un latido de sanguijuela HCO de un tercer ganglio, un esquema de las neuronas registradas y sus conexiones sinápticas mutuamente inhibitorias a la derecha. (B) Esquema de pinza dinámica al registrar una interneurona HN(7) en un ganglio aislado 7; nótese que no hay interacción sináptica entre las dos interneuronas HN(7). (Ci) Estallido en una interneurona HN(7) comprometida por fugas. (Cii) Se puede producir una ráfaga más robusta agregando una bomba de pinza I dinámica (  = 0.1 nA), que compensa la fuga inducida por microelectrodos, pero deprime la excitabilidad, y
= 0.1 nA), que compensa la fuga inducida por microelectrodos, pero deprime la excitabilidad, y  (1 nS), que aumenta la excitabilidad. Las líneas discontinuas negras indican los valores de referencia. Abreviaturas: HN = interneurona cardíaca; HCO = oscilador semicénrico; Bomba I = corriente hacia el exterior; IP = Na persistente+ corriente;
(1 nS), que aumenta la excitabilidad. Las líneas discontinuas negras indican los valores de referencia. Abreviaturas: HN = interneurona cardíaca; HCO = oscilador semicénrico; Bomba I = corriente hacia el exterior; IP = Na persistente+ corriente;  = Na máximo+/K+ corriente de la bomba;
= Na máximo+/K+ corriente de la bomba;  = conductancia máxima de la corriente persistente de Na+; Vm = potencial de membrana; [Na+] i = concentración interna de Na+. Haga clic aquí para ver una versión más grande de esta figura.
= conductancia máxima de la corriente persistente de Na+; Vm = potencial de membrana; [Na+] i = concentración interna de Na+. Haga clic aquí para ver una versión más grande de esta figura.
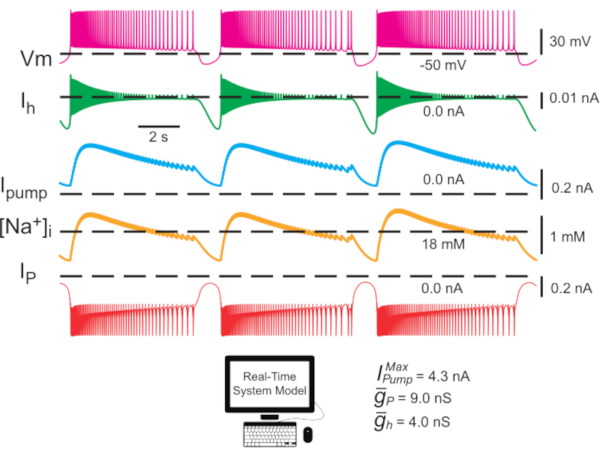
Figura 2: Modelo de interneurona HN único que muestra trazas para el potencial de membrana (Vm), I h, Ibomba,[Na+]ie IP. Las corrientes hiperpolarizantes externas son negativas, y las corrientes despolarizantes hacia adentro son positivas. Las líneas discontinuas negras indican los valores de referencia. Abreviaturas: HN = interneurona cardíaca; Bomba I = corriente hacia el exterior; IP = Na persistente+ corriente;  = Na máximo+/K+ corriente de la bomba; Ih = corriente interna activada por hiperpolarización;
= Na máximo+/K+ corriente de la bomba; Ih = corriente interna activada por hiperpolarización;  = conductancia máxima de la corriente persistente de Na+;
= conductancia máxima de la corriente persistente de Na+; 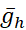 = conductancia máxima de la corriente interna activada por hiperpolarización; Vm = potencial de membrana; [Na+] i = concentración interna de Na+. Haga clic aquí para ver una versión más grande de esta figura.
= conductancia máxima de la corriente interna activada por hiperpolarización; Vm = potencial de membrana; [Na+] i = concentración interna de Na+. Haga clic aquí para ver una versión más grande de esta figura.
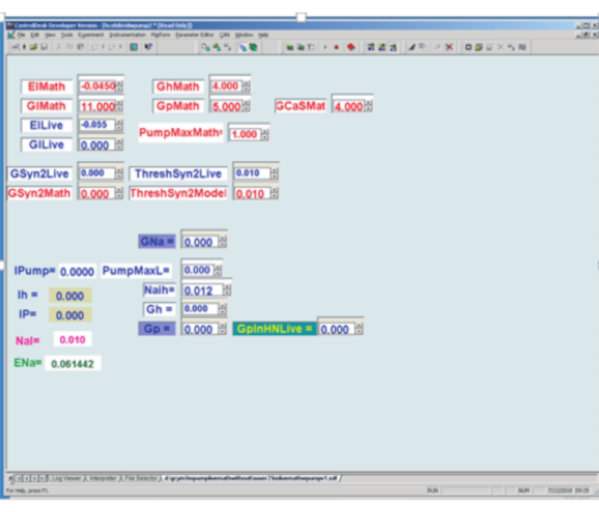
Figura 3: Interfaz gráfica de usuario del modelo de interneurona cardíaca (HN) en tiempo real y abrazadera dinámica implementada en una placa de procesamiento de señal digital. Arriba a la izquierda: Los cuadros matemáticos rojos son cuadros de parámetros determinados por el usuario para el modelo en tiempo real, mientras que los cuadros Blue Live son cuadros de parámetros determinados por el usuario utilizados en la abrazadera dinámica. El = el potencial de inversión de la corriente de fuga; Gl = conductancia de fuga; Gh = conductancia máxima de corriente h; Gp = conductancia máxima de corriente P; GCaS = conductancia máxima de corriente de calcio lenta; PumpMax = corriente máxima de la bomba; [Conductancia sináptica máxima de GSyn2 a la neurona respectiva; Umbral de cruce de picos ThreshSyn2 para mediar un potencial sináptico: estos se utilizan para hacer un oscilador híbrido (vivo / modelo) de medio centro que no se ilustra aquí.]. Abajo a la izquierda para la abrazadera dinámica. A la izquierda hay 5 valores calculados de variables dinámicas de abrazadera: bomba I = corriente de bomba inyectada; Ih = h-corriente inyectada (no utilizada aquí); IP = corriente P inyectada; NaI = Na interno calculado+ concentración; ENa = potencial de reversión de sodio calculado. Abajo a la izquierda para la abrazadera dinámica. A la derecha de las variables calculadas hay 6 cuadros de parámetros determinados por el usuario: GNa = uso de conductancia máxima de sodio rápido endógeno supuesto para calcular Na+ flujo asociado con potenciales de acción; PumpMaxL = corriente máxima de la bomba que se inyectará mediante abrazadera dinámica; Naih ver ecuación (2); Gh = conductancia máxima para determinar la corriente h a inyectar por pinza dinámica; Gp = uso de conductancia máxima de corriente P endógena asumida para calcular el flujo de Na+ asociado con la corriente P endógena; GpinHNLive = conductancia máxima para determinar la corriente P a inyectar por pinza dinámica. Haga clic aquí para ver una versión más grande de esta figura.
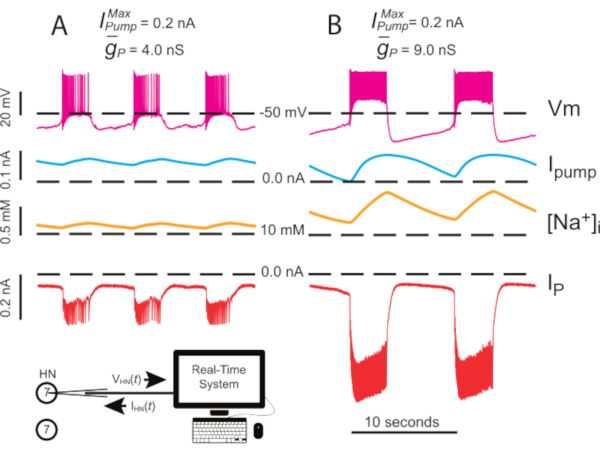
Figura 4: Análisis dinámico de la abrazadera de la explosión independiente de HN(7). La regulación ascendente  de (A) 4.0 nS a (B) 9.0 nS ralentiza el ritmo de ráfaga HN independiente. Los rastros experimentales muestran estallido rítmico en neuronaS HN(7) aisladas con pinza dinámica. Los rangos de oscilación de [Na+]i y Vm aumentan con la regulación al
de (A) 4.0 nS a (B) 9.0 nS ralentiza el ritmo de ráfaga HN independiente. Los rastros experimentales muestran estallido rítmico en neuronaS HN(7) aisladas con pinza dinámica. Los rangos de oscilación de [Na+]i y Vm aumentan con la regulación al  alza. Trazas de arriba a abajo: Vm grabada, bombaIinyectada, calculada [Na+]i, e inyectada IP. Las líneas discontinuas negras indican los valores de referencia. Abreviaturas: HN = interneurona cardíaca; Bomba I = corriente hacia el exterior; IP = Na persistente+ corriente;
alza. Trazas de arriba a abajo: Vm grabada, bombaIinyectada, calculada [Na+]i, e inyectada IP. Las líneas discontinuas negras indican los valores de referencia. Abreviaturas: HN = interneurona cardíaca; Bomba I = corriente hacia el exterior; IP = Na persistente+ corriente;  = Na máximo+/K+ corriente de la bomba;
= Na máximo+/K+ corriente de la bomba;  = conductancia máxima de la corriente persistente de Na+; Vm = potencial de membrana; [Na+] i = concentración interna de Na+. Haga clic aquí para ver una versión más grande de esta figura.
= conductancia máxima de la corriente persistente de Na+; Vm = potencial de membrana; [Na+] i = concentración interna de Na+. Haga clic aquí para ver una versión más grande de esta figura.
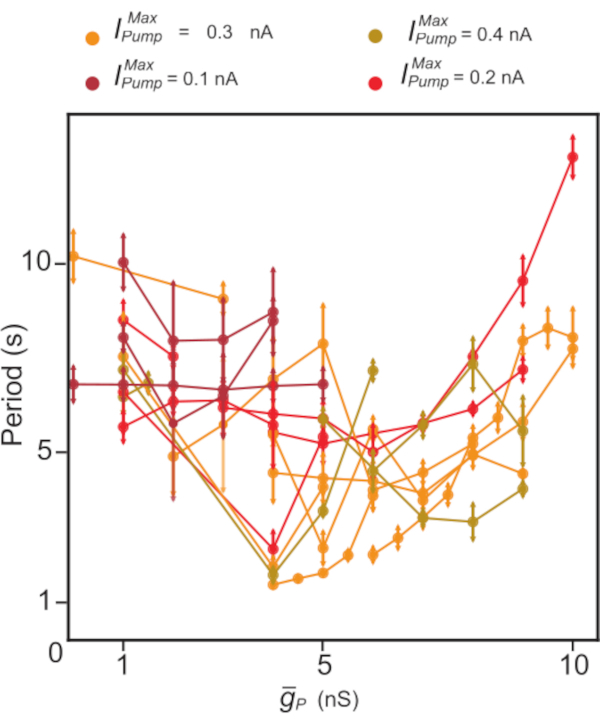
Figura 5: Análisis dinámico de abrazaderas de estallido independiente de HN(7). La regulación al alza de  tiende a disminuir, seguida de un aumento del período de explosión de HN. En experimentos individuales (puntos conectados por líneas) utilizando abrazadera dinámica,
tiende a disminuir, seguida de un aumento del período de explosión de HN. En experimentos individuales (puntos conectados por líneas) utilizando abrazadera dinámica,  los valores se barrieron mientras se
los valores se barrieron mientras se  mantenían constantes. Los colores representan diferentes niveles constantes de acción
mantenían constantes. Los colores representan diferentes niveles constantes de acción  utilizados en diferentes experimentos. Abreviaturas: HN = interneurona cardíaca;
utilizados en diferentes experimentos. Abreviaturas: HN = interneurona cardíaca;  = Na máximo+/K+ corriente de la bomba;
= Na máximo+/K+ corriente de la bomba;  = conductancia máxima de la corriente persistente De Na+. Haga clic aquí para ver una versión más grande de esta figura.
= conductancia máxima de la corriente persistente De Na+. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El modelado, la pinza dinámica y los análisis resultantes que permiten son técnicas útiles para explorar cómo los individuos y los grupos de conductancia /corrientes iónicas contribuyen a la actividad eléctrica de las neuronas(Figura 1, Figura 2,Figura 4y Figura 5). El uso de estas técnicas muestra cómo la corriente de la bomba Na+/ K+ (bombaI)interactúa con las corrientes de voltaje, particularmente la corriente persistente de Na+ (IP),para promover un estallido robusto en las HN centrales del generador del patrón de latidos del corazón de la sanguijuela. Al combinar experimentos de abrazadera dinámica y modelado, es posible probar modelos más directamente de lo que es posible con el registro de voltaje ordinario y las técnicas de abrazadera de corriente. Los resultados obtenidos de los experimentos de abrazadera dinámica(Figura 5)se utilizarán para refinar aún más el modelo HN. El método básico de pinzamiento dinámico demostrado aquí se puede personalizar para reflejar las propiedades de cualquier neurona en estudio si se puede determinar un modelo matemático de corrientes neuronales con experimentos de pinza de voltaje.
La finalización exitosa de los experimentos del tipo que se muestra aquí requiere un empalamiento cuidadoso de un HN u otra neurona cuando se usa un microelectrodo afilado, porque el estallido fuerte se reduce por la penetración del electrodo1. (Las técnicas de registro de parches de células enteras, que minimizan las fugas introducidas, también son aplicables a otras neuronas, pero no funcionan bien en las neuronas sanguijuelas). Es fundamental que el empalamiento de la neurona HN cause un daño mínimo a la neurona (fuga añadida), y la resistencia de entrada debe ser monitoreada y debe estar en el rango de 60-100 MOhms para experimentos exitosos4.
La pinza dinámica es una técnica poderosa, pero tiene limitaciones impuestas por la geometría neuronal porque las conductancias artificiales se implementan en el sitio del electrodo de grabación -generalmente el cuerpo celular- no en el sitio donde las corrientes generadoras de ritmo generalmente se localizan5,6,10. En las neuronas HN sanguijuelas, el cuerpo celular está eléctricamente cerca de la zona de integración (neurita principal) de la neurona donde se localizan la mayoría de las corrientes activas y se inician picos.
Divulgaciones
Ninguno
Agradecimientos
Agradecemos a Christian Erxleben por los experimentos preliminares de pinza dinámica en neuronas HN(7) que demostraron sus capacidades de estallido. Angela Wenning ayudó a los experimentos con el asesoramiento de expertos. Reconocemos a los NIH por financiar este trabajo a través de la Subvención 1 R21 NS111355 a GSC y RLC.
Materiales
| Name | Company | Catalog Number | Comments |
| ANIMALS | |||
| Hirudo verbana | Leech.com, https://www.leech.com/collections/live-leeches | live leeches 2-3 grams | |
| CHEMICALS | |||
| ARTIFICIAL POND WATER | |||
| CaCl2 | Sigma Aldrich | C5670-100G | 1.8 mM add last after adjusting pH |
| glucose | Sigma Aldrich | G7021-100G | 10 mM |
| HEPES | Sigma Aldrich | H4034-100G | 10 mM |
| Instant Ocean (sea salt ) | Spectrum Brands Inc., Madison, WI | 0.05% (w/v) diluted in deionized water | |
| KCl | Sigma Aldrich | P9333-500G | 4 mM |
| NaCl | Sigma Aldrich | S7653-250G | 115 mM |
| NaOH 0.1 N Solution | Sigma Aldrich | 2105-50ML | Adjust to pH 7.4 with NaOH |
| MICROELECTRODES | |||
| K Acetate | Sigma Aldrich | P1190-100G | 2 M |
| KCl | Sigma Aldrich | P9333-500G | 20 mM |
| SALINE | |||
| EQUIPMENT | |||
| #5 Forceps | Fine Science Tools Dumont | 11251-30 OR 11251-20 | For general leech dissection |
| AxoClamp 2A/2B DCC electrometer | Axon Instruments Molecular Devices | 2A/2B | For recording of neuronal membrane potential and discontinuous current clamp |
| Black resin | Dow Sylguard | 170 | Lines general dissect dish |
| Capilary glass 1 mm outer diameter, 0.75 mm inner diameter | A-M Systems | 615000 | For fabricating sharp microelectrodes |
| Clear resin | Dow Sylguard | 184 | Lines Petri dish used to mount ganglion for electrophysilogy |
| Dark field condenser | Nikon | Dry 0.95-0.80 MBL 1210 | For illuminating the ganglion preparation during cell impalement |
| Digidata 1440A | Axon CNS Molecular Devices | 1440A | Performs A to D and D to A for data acquisition and stimulation during electrophysiology |
| Digital signal processing board | dSpace | CLP1104 | Our software implements all the conductances/currents in our model HN neuron on a DS1103 dSPACE PPC Controller Board in real-time at a rate of 20 kHz with a ControlDesk GUI (dSPACE, Paderborn, Germany)9. |
| Falming/Brown Microelectrode Puller | Sutter Instruments | P-97 | For fabricating sharp microelectrodes |
| Fiber-Lite high intensity illuminator | Dolan Jenner Industries | 170D | For illuminating the general dissection and for illuminating the ganglion preparation during cell impalement |
| Headstage amplifier for AxoClamp 2A | Axon Instruments | HS-2A Gain:0.1LU | Now part of Molecular Devices for recording of neuronal membrane potential and discontinuous current clamp |
| Light guide | Dolan Jenner Industries | Rev R 38 08 3729107 | For illuminating the general dissection and for illuminating the ganglion preparation during cell impalement |
| Micromanipulator | Sutter Instruments | MPC-385 | Micromanipulator for cell impalement with microelectrodes |
| Micromanipulator controller | Sutter Instruments | MPC-200 | Controls micromanipulators for cell impalement with microelectrodes |
| Minuten pins | BioQuip | 0.15 mm diameter 1208SA | Should be shortened by curtting to ~5 mm |
| Optical Breadboard 3' x 5' x 8" | Newport | Obsolete | With the 4 pneumatic Isolators below used to construct a vibration free workspace for electrophysiology |
| Oscilloscope | HAMEG Instruments | HM303-6 | To monitor electrode setteling during DCC |
| Pascheff-Wolff spring scissors | Moria | Supplied by Fine Science Tools (Foster City, CA) catalog # 15371-92 | |
| pClamp 9 Software | Axon Instruments | 9 | Now part of Moleculear Devices uses the Digidata 1440 for data acquisition and stimulation during electrophysiology |
| Pneumatic Isolators 28" | Newport | Obsolete | With optical breadboard used to construct a vibration free workspace for electrophysiology |
| Simulink / MATLAB software | MathWorks | 2006 (Obsolete) | Implements dynamic clamp on the digital signal processing board |
| Stereomicroscope | Wild | M5A | 10x Eye Pieces used for dissecting the leech and removingand desheathing ganglia |
| Steromicroscope | Wild | M5 | 20x Eye Pieces used in electrophysiologcal station to visualize neuron for microelectrode penetration |
| Student Vannas Spring Scissors | Fine Science Tools | 91500-09 | For general leech dissection |
Referencias
- Cymbalyuk, G. S., Gaudry, Q., Masino, M. A., Calabrese, R. L. Bursting in leech heart interneurons: cell-autonomous and network-based mechanisms. Journal of Neuroscience. 22, 10580-10592 (2002).
- Hill, A. A., Lu, J., Masino, M. A., Olsen, O. H., Calabrese, R. L. A model of a segmental oscillator in the leech heartbeat neuronal network. Journal of Computational Neuroscience. 10, 281-302 (2001).
- Tobin, A. E., Calabrese, R. L. Myomodulin increases Ih and inhibits the NA/K pump to modulate bursting in leech heart interneurons. Journal of Neurophysiology. 94, 3938-3950 (2005).
- Kueh, D., Barnett, W. H., Cymbalyuk, G. S., Calabrese, R. L. Na(+)/K(+) pump interacts with the h-current to control bursting activity in central pattern generator neurons of leeches. eLife. 5, 19322(2016).
- Sharp, A. A., O'Neil, M. B., Abbott, L. F., Marder, E. Dynamic clamp: computer-generated conductances in real neurons. Journal of Neurophysiology. 69, 992-995 (1993).
- Prinz, A. A., Abbott, L. F., Marder, E. The dynamic clamp comes of age. Trends in Neuroscience. 27, 218-224 (2004).
- Barnett, W., Cymbalyuk, G. Hybrid systems analysis: real-time systems for design and prototyping of neural interfaces and prostheses. Biohybrid systems: nerves, interfaces, and machines. Jung, R. , Wiley VCH Verlag. Weinheim. 115-138 (2011).
- Sorensen, M., DeWeerth, S., Cymbalyuk, G., Calabrese, R. L. Using a hybrid neural system to reveal regulation of neuronal network activity by an intrinsic current. Journal of Neuroscience. 24, 5427-5438 (2004).
- Olypher, A., Cymbalyuk, G., Calabrese, R. L. Hybrid systems analysis of the control of burst duration by low-voltage-activated calcium current in leech heart interneurons. Journal of Neurophysiology. 96, 2857-2867 (2006).
- Calabrese, R. L., Prinz, A. A. Realistic modeling of small neuronal networks. Computational Modeling Methods for Neuroscientists. DeSchutter, E. , MIT Press. MA, USA. 285-316 (2010).
- Rybak, I. A., Molkov, Y. I., Jasinski, P. E., Shevtsova, N. A., Smith, J. C. Rhythmic bursting in the pre-Bötzinger complex: mechanisms and models. Progress in Brain Research. 209, 1-23 (2014).
- Picton, L. D., Nascimento, F., Broadhead, M. J., Sillar, K. T., Miles, G. B. Sodium pumps mediate activity-dependent changes in mammalian motor networks. Journal of Neuroscience. 37, 906-921 (2017).
Erratum
Formal Correction: Erratum: Contribution of the Na+/K+ Pump to Rhythmic Bursting, Explored with Modeling and Dynamic Clamp Analyses
Posted by JoVE Editors on 7/28/2021. Citeable Link.
An erratum was issued for: Contribution of the Na+/K+ Pump to Rhythmic Bursting, Explored with Modeling and Dynamic Clamp Analyses. An author name was updated.
The name of the first author was updated from:
Ricardo Javier Erazo Toscano
to:
Ricardo Javier Erazo-Toscano
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados