Method Article
Na+/K+ Pompanın Ritmik Patlamaya Katkısı, Modelleme ve Dinamik Kelepçe Analizleri ile Keşfedildi
Bu Makalede
Erratum Notice
Özet
Burada sunulan dinamik kelepçe kullanarak sülük kalp internöronlarında Na+/ K+ pompa ve kalıcı Na+ akımı rollerinin araştırılması için bir yöntemdir.
Özet
Genellikle nöronal aktivitede bir arka plan işlevi olarak düşünülen Na+/ K+ pompası, Na + ([Na+ ] i) iç konsantrasyonuna yanıt veren bir dışa doğru akıma(pompalarım)katkıda bulunur. Ritmik hareketler üreten merkezi desen jeneratörü (CPG) nöronal ağlarında bulunanlar gibi patlayan nöronlarda, [Na+]i ve dolayısıyla Ipompası, patlama döngüsü boyunca değişebilir. Elektriksel aktiviteye bu yanıt verme, membran potansiyelinden bağımsızlık ile birlikte, kanal tabanlı akımlarda (örneğin, voltaj veya verici kapılı veya sızıntı kanalları) yaygın olmayan dinamik özelliklere sahip pompayı armatöre eder. Ayrıca, birçok nöronda, pompanın aktivitesi çeşitli modülatörler tarafından modüle edilir ve ritmik patlama aktivitesinde pompalamanın potansiyel rolünü daha da genişletir. Bu makale, bir CPG'deki kalıcı Na+ akım etkisi ritmik aktivitesi ile etkileşimini ve pompalama şeklimi belirlemek için modelleme ve dinamik kelepçe yöntemlerinin bir kombinasyonunun nasıl kullanılacağını göstermektedir. Özellikle, bu makale tıbbi sülüklerin kalp internöronlarında dinamik bir kelepçe protokolüne ve hesaplamalı modelleme yöntemlerine odaklanacaktır.
Giriş
Sülüklerdeki kalp atışı, birçok orta vücut segmental gangliyona dağılmış 9 çift kalp internörüsünden (HN) oluşan bir CPG tarafından tahrik edilir. CPG'nin özünde, yarı merkez osilatörleri (HCO' lar) oluşturan 3rd ve4. segmental gangliyonlarda bulunan internöronların karşılıklı inhibitör çiftleri vardır (Şekil 1A). Bu nöronlar, bikükülin1kullanılarak sinaptik olarak farmakolojik olarak izole edildiğinde patlamaya devam eder. 7. segmental gangliyondaki çift (bu protokolün odak noktası) gibi diğerleri de sinaptik olarak izole edildiğinde patlama aktivitesi üretebilen patlamacılardır. Karşılıklı olarak bağlanmazlar ve sadece alçalan girdileri alırlar ve böylece ganglionu sinir kordonunun geri kalanından kopararak kolayca izole edilirler. Bu bağımsız patlama aktivitesi, kayıt için keskin mikroelekrodlarla penetrasyondan kaynaklanan girişli sızıntı akımına duyarlıdır, ancak gevşek yama yöntemleriyle kaydedildiğinde güçlü bir şekilde patlar1.
Hem bireysel HN nöronları hem de HN HCO'lar modellenmiştir (deneysel olarak tanımlanmış tüm voltaj kapılı ve sinaptik akımları içeren HN nöronlarının Hodgkin-Huxley tabanlı tek izopotential bölme modelleri) ve canlı sistemin tüm patlama özellikleri başarıyla yakalanmıştır2. Sülüklerde endojen bir nöropeptid olan Myomodulin, izole edilmiş HN nöronlarının ve HN HCO'ların patlama ritminin (T) süresini belirgin bir şekilde azaltır. Bu modülatör h akımını (hiperpolarizasyonla aktive edilen içe akım, Ih)artırmak ve Ipompayıazaltmak için3. Bu gözlem, pompalamanın I hile nasıl etkileşime girdiğini ve birlikte modülasyonlarının HN nöronlarının ritmik aktivitesine nasıl katkıda bulunduğunu keşfetmeye yol açtı. Pompanın [Na +]i (iyonofor monensin kullanılarak) artırılarak aktivasyonu, hem HN HCO'larda hem de izole HN nöronlarında HN patlama ritmini hızlandırır4. Bu hız i h'ye bağlıydı. bununla birlikte, patlama süresi (BD) kısıtlandı ve hem HN HCO'larda hem de izole HN nöronlarında iç patlama aralığı (IBI)arttı 4.
Bu protokol için, pompa akımı, Ipompa dahil olmak üzere yaşayan bir HN(7) nöronunun tüm akımları HN modeline aşağıdaki gibi dahil edilir:
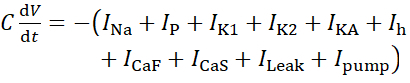 (1)
(1)
burada C membran kapasitansıdır (nF'de), V membran potansiyelidir (V'de), t zamandır (ins). Ayrıntılı iyonik akım açıklamaları ve denklemleri başka bir yerde açıklanmıştır2,4. HN modelinin tamamı nöron gerçek zamanlı olarak çalışır(Şekil 2). Yazılım yayınlandıktan sonra GitHub'da kullanıma sunulacak ve Malzeme Tablosu'nda açıklanan dijital sinyal işleme panosunda çalıştırılacaktır. Burada, sorgulamanın odak noktası Na+/ K+ pompa akımı (Ipompa) ve önemli Na+ akı katkıda bulunan voltaj kapılı akımlardır: hızlı bir Na+ akımı (INa) ve kalıcı bir Na+ akımı (IP). Bu akımların maksimum iletkenlikleri 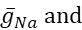
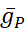 sırasıyladır. Na+/ K+ pompası, iki hücre dışı K+ iyon için üç hücre içi Na+ iyon değiştirir, böylece net bir dış akım üretir. Daha da önemlisi, bu akımın gösterdiğinden 3 kat daha fazla Na+ pompalar, bu da hücre içi Na+ konsantrasyonunun hesaplanması için önemlidir.
sırasıyladır. Na+/ K+ pompası, iki hücre dışı K+ iyon için üç hücre içi Na+ iyon değiştirir, böylece net bir dış akım üretir. Daha da önemlisi, bu akımın gösterdiğinden 3 kat daha fazla Na+ pompalar, bu da hücre içi Na+ konsantrasyonunun hesaplanması için önemlidir.
Na+/ K+ pompa akımı hücre içi Na+ konsantrasyonlarına bağlıdır ve aşağıdaki sigmoidal fonksiyonla ifade edilir:
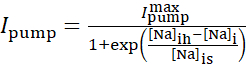 (2)
(2)
burada [Na]i hücre içi Na+ 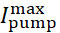 konsantrasyonudur, maksimal Na+/ K+ pompa akımıdır, [Na]ih, Na + / K+ pompanın yarı aktivasyonu için hücre içi Na+konsantrasyonudur ve [Na] Na + / K +pompasının [Na]i'ye duyarlılığıdır. I P ve INa tarafından taşınan Na+ akınlarının bir sonucu olarak inşa edilir ve Na + /K + pompanın Na+efflux'ı tarafından azalır. Ih ve ILeak'in toplam Na+ akı katkısı küçüktür ve gerçek zamanlı modelde dikkate alınmaz.
konsantrasyonudur, maksimal Na+/ K+ pompa akımıdır, [Na]ih, Na + / K+ pompanın yarı aktivasyonu için hücre içi Na+konsantrasyonudur ve [Na] Na + / K +pompasının [Na]i'ye duyarlılığıdır. I P ve INa tarafından taşınan Na+ akınlarının bir sonucu olarak inşa edilir ve Na + /K + pompanın Na+efflux'ı tarafından azalır. Ih ve ILeak'in toplam Na+ akı katkısı küçüktür ve gerçek zamanlı modelde dikkate alınmaz.
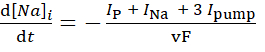 (3)
(3)
burada, v hücre içi Na+ rezervuarın hacmidir (~6.7 pL), F Faraday'ın sabitidir ve hücre dışı Na+ konsantrasyonu sabit tutulur.
Gerilim kapılı ve sızıntı iletkenlikleri ayırt edilmiştir-bunlar membran potansiyeline yanıt verir - hesaplanan hücre içi Na + konsantrasyonu([Na+ ]i)tarafından düzenlenen pompa akımından. [Na+] i, aksiyon potansiyelleri (sivri) ve spiking'i desteklemek için depolarizasyon sağlayan kalıcı Na+ akımı(IP)üreten hızlı Na + akımı ( I Na ) aracılığıyla Na+ girişi aracılığıyla oluşturulmuştır. [Na+] i, sırayla, Na+ekstrüzyonu yoluyla pompanın etkisi ile azaltılır.  (5nS) ve
(5nS) ve 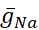 (150 nS) temel yaşam HN değerleri varsayılmıştır ve herhangi bir ilave dinamik kelepçeyi dikkate
(150 nS) temel yaşam HN değerleri varsayılmıştır ve herhangi bir ilave dinamik kelepçeyi dikkate  alıyoruz.
alıyoruz.
Burada açıklanan protokolün amacı, tek HN'lerde ritmik patlamayı kontrol etmek için voltaj kapılı akımlarla (mevcut protokoldeki kalıcı Na+ akım) nasıl etkileşime girdiğini keşfetmek için gerçek zamanlı olarak tam ve geri dönüşümlü olarak pompalamamı manipüle etmektir. Bu hedefe ulaşmak için, komut üzerine, model çalışırken hesaplanabilecek herhangi bir akımın kesin bir miktarını yapay olarak tanıtan dinamik kelepçe kullanıldı. Bu yöntem, tüm dokuyu etkileyen, genellikle tersine çevrililmesi zor olan ve tam olarak manipüle edilemeyen hedef dışı etkilere sahip olabilen pompanın farmakolojik manipülasyonu üzerinde avantajlara sahiptir. Dinamik kelepçe5,6 kaydedilen bir nöronun voltajını gerçek zamanlı olarak okur (Şekil 1B) ve model denklemlerine ve herhangi bir veya herhangi bir veya herhangi bir değerine dayalı herhangi bir akımın miktarını hesaplar ve enjekte 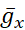
 eder. Benzer yöntemler hücre içi olarak kaydedilebilen herhangi bir nörona kolayca uygulanabilir. Bununla birlikte, parametrelerin seçilen nörona yeniden ölçeklendirilmesi ve nöronun sinapik girdilerden izole edilmesi gerekir, örneğin farmakolojik olarak.
eder. Benzer yöntemler hücre içi olarak kaydedilebilen herhangi bir nörona kolayca uygulanabilir. Bununla birlikte, parametrelerin seçilen nörona yeniden ölçeklendirilmesi ve nöronun sinapik girdilerden izole edilmesi gerekir, örneğin farmakolojik olarak.
Protokol
NOT: Omurgasız hayvan deney konuları NIH veya Emory ve Georgia Eyalet Üniversiteleri tarafından düzenlenmez. Yine de bu çalışmada kullanılan sülüklerin acılarını en aza indirmek için tüm önlemler alındı.
1. Sülük sinir kordonundan izole ganglion 7 hazırlayın
- 12:12 açık-karanlık bir döngüde 16 °C'de iyonize su ile seyreltilmiş yapay gölet suyunda (%0,05 w/v deniz tuzu içeren) sülük hirudo verbana'yı koruyun.
- Sülükleri hareketsiz olana kadar > 10 dakika boyunca ezilmiş buz yatağında soğuk uyuşturarak diseksiyon için hazırlayın.
- Siyah, reçine kaplı bir diseksiyon kabını 115 mM NaCl, 4 mM KCl, 1,7 mM CaCl2,10 mM D-glikoz ve 10 mM HEPES içeren soğutulmuş salin ile ~1 cm derinliğe kadar doldurun; pH, 1 M NaOH ile 7,4'e ayarlandı. Sülük dorsal tarafını siyah reçine kaplı hazneye sabitleyin (en az 2 cm kalınlığında reçinenin en az 2 cm üzerinde derinliği olan en az 20 cm x 10 cm).
- Eğik ışık kılavuzu aydınlatmalı 20x büyütmede bir steromikroskop altında, vücudun rostral 1/3rd kısmındaki vücut duvarından 5 mm yay makası ile en az 3 cm uzunluğunda uzunlamasına bir kesim yapın. Vücut duvarını kenara çekmek ve iç organları açığa çıkarmak için pimleri kullanın.
NOT: Saklanan herhangi bir kan unu, ateş cilalı pastör pipet ile emiş ile çıkarılabilir. - Bireysel bir orta vücut ganglion 7'yi izole edin (beyne yedinci serbest segmental ganglion kaudal).
- Sinir kordonu bulunan sinüsleri 5 mm yay makasını kullanarak açın. Sinüsü dorsally ve ventrally iki sinüs şeridi bırakarak böldüğünüzden emin olun. Kesmeye ve sinüsü tutmaya yardımcı olmak için keskin #5 tokmak kullanın.
- Ganj'dan çıkan iki bilateral sinir kökünün her birine bağlı sinüs tutun (her köke sıkıca yapışır) bu sinüs şeritlerini ganimeti sabitlemek için kullanmak için.
- Ganglionu, ganglionu (mümkün olduğunca7. gangliondan) ve sinüs şeritlerini birbirine bağlayan rostral ve kaudal bağ sinir demetlerini keserek vücuttan çıkarın ve ardından kökleri sinüsten çıktıkları yere yanal olarak kesin.
- Ganglionu (eski körelmiş #5 tostips kullanarak) kısaltılmış minuten böcek pimleri ile sabitle, ventral tarafı yukarı, açık, reçine kaplı Petri tabaklarında. Köklere ve rostral ve kaudal bağlara bağlı kalan sinüs ve gevşek doku şeritlerine, gangliyondan mümkün olduğunca uzağa iğneler yerleştirin.
NOT: Kayıt sırasında aşağıdan iyi aydınlatma elde edilecekse reçine 3 mm'den daha kalın olmamalıdır. Ganglionun hem boyuna hem de yanal olarak gergin olduğundan emin olun - Stereomikroskopun büyütmesini 40 kat veya daha fazlasına çıkarın ve eğik aydınlatmayı, nöronal hücre gövdelerinin perineuriumun hemen altındaki ganglionun ventral yüzeyinde kolayca görülebilmesi için ayarlayın.
- Ganglionun perineüryumunun (desheath) mikrosirsörlerle çıkarılması.
- Bir taraftaki kökler arasındaki gevşek kılıfı keserek desheathing'e başlayın ve makas bıçaklarını yüzeysel tuttuğundan ve kılıfın hemen altındaki nöronal hücre gövdelerine zarar vermediklerinden emin olarak kesmeye yanal olarak devam edin.
- Orta hat boyunca yanal kesimden kaudally benzer bir yüzeysel kesim yapın.
- Şimdi bir taraftaki kaudolateral kılıfi 5 numaralı forsepsle tutun, gangliyondan çekin ve mikrossörlerle kesin.
- Diğer tarafta tekrarlayın; bu prosedür mikroelekrodlarla kayıt için her iki HN(7) nöronlarını da ortaya çıkarır.
- Hazırlama kabını kayıt kurulumuna yerleştirin ve oda sıcaklığında 5 mL / dak'lık bir akış hızında salin ile süper hızlı.
2. Sülük kalp internöronlarını keskin mikroelekrodlarla tanımlayın ve kaydedin
- HN(7) nöronunun (kayıtlar 30 ila 60 dakika arasında sürer) kaydı süresince, dijital veri toplama (Analogdan Dijitale, A'dan D'ye) ve stimülasyon (Dijitalden Analoga, D'den A'ya) sistemi ile 5 kHz hızında nörofizyolojik elektrometre örneklemesinden hücre içi akım ve voltaj izlerini elde etmek ve dijitalleştirmek, ve bir bilgisayar ekranında görüntülenir.
NOT: Herhangi bir ticari veya özel yapım yazılım ve A'dan D/D'ye bir pano veri toplama (A'dan D'ye) için kullanılabilir. Dinamik kelepçe için D'den A'ya ve özel yapım yazılım gereklidir. - Aşağıdan karanlık alan aydınlatması ile 50-100x'te bir steromikroskop altında, orta gövdeli ganglion yedideki posteriolateral konumdaki kanonik konumuyla ikili çiftin HN(7) nöronunu belirsiz bir şekilde tanımlayın.
- Şimdi bir mikromanipülatör kullanarak 2 M potasyum asetat ve 20 mM KCl ile dolu keskin bir mikroelektod ile putatif HN(7) nöronun nüfuz etmeyi hedefleyin.
- Mikroelekrod'u hedef hücre gövdesinin çok yakınına yerleştirin.
- Elektrometre ile kaydedilen potansiyeli sürekli olarak gözlemleyin ve nörona nüfuz etmeden önce bu potansiyeli sıfır mV olarak ayarlayın.
- Elektrodu manipülatörle uzun ekseni boyunca yavaşça sürerek mikroelekrot ile nörona nüfuz edin. Membran potansiyelinde ve güçlü bir sıçrama aktivitesinde negatif bir kayma gözlenene kadar elektrometre vızıltı işlevini kullanarak, 100 ms vızıltı süresine ayarlayın.
- Elektrometreyi, membran potansiyelini aynı anda kaydetmek ve tek mikroelekrod ile akımı geçirmek için 3 kHz'≥ süreksiz akım kelepçe modunda (DCC) ayarlayın (kapasite telafisi zilin hemen altına ayarlanır ve ardından% 10 geri çevrilir).
- DCC sırasında elektrodin yerleşmesini bir osiloskop üzerinde izleyin.
- Kaydı stabilize etmek için bir veya iki dakika boyunca elektrometre sabit akım enjektörü ile -0.1 nA sabit bir akım enjekte edin.
- HN(7) nöronunu karakteristik başak şekli ve zayıf patlama aktivitesi ile kesin olarak tanımlayın (Şekil 1Ci).
- Deneme tamamlandıktan sonra herhangi bir veri çözümlemesi çevrimdışı gerçekleştirin ve tüm verileri bir diske kaydedin.
3. Gerçek zamanlı bir HN veya başka bir model nöron oluşturun
- Dijital sinyal işleme kartı (DSB; D'den A'ya ve A'dan D'ye) masa üstü bilgisayarda, diğer nöronlar veya deneyler için2,4 veya farklı model akımlarında açıklanan model akımlarını gerçek zamanlı olarak uygulamak için.
- Model akımlarını temsil etmek için genellikle tercih edilen yöntem oldukları için Hodgkin-Huxley stil denklemlerini kullanın.
- Pompa akımının eklenmesinden önce gerçek zamanlı HN modelinin ve dinamik kelepçenin uygulanmasının ayrıntılı bir açıklaması içinbkz. HN modelinde yaşayan HN(7) nöronunun akımlarının, hücre içi Na+ konsantrasyonunun ve iletkenliklerinin tanımı için giriş bölümüne bakın.
4. Dinamik kelepçe iletkenliklerini/akımlarını uygulayın ve farklılık göster
- HN(7) nöronunun HN gerçek zamanlı modelinin grafik kullanıcı arayüzünden(Şekil 3) (GUI) erişilebilir, programlanmış iletkenlikleri ve akımlarını gerçek zamanlı dinamik kelepçede uygulamak ve değiştirmek için DSB için özel olarak oluşturulmuş dinamik kelepçe yazılımını kullanın.
NOT: Bir hatırlatma olarak ve
ve 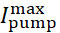 sırasıyla kalıcı Na+ akımının(IP)ve maksimum pompa akımının(pompalarım)maksimum iletkenliğidir.
sırasıyla kalıcı Na+ akımının(IP)ve maksimum pompa akımının(pompalarım)maksimum iletkenliğidir. - Model çalışırken değişiklik yapmak için yazılımdaki GUI giriş kutularını kullanın
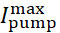 (PumpMaxL kutusu) ve
(PumpMaxL kutusu) ve  (GpinHNLive kutusu) (Şekil 3).
(GpinHNLive kutusu) (Şekil 3).
NOT: GUI giriş kutuları yazılan değerleri kabul eder ve 0,1 nA adımları önerilir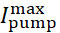 ve 1 nS adımları için
ve 1 nS adımları için  önerilir.
önerilir.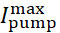
 Şekil 1CII'degösterildiği gibi, mikroelektod kaynaklı bir sızıntı ile zayıflayan HN(7) nöronunun patlamasını stabilize etmek için küçük miktarlarda ve dinamik kelepçe ile ekleyin.
Şekil 1CII'degösterildiği gibi, mikroelektod kaynaklı bir sızıntı ile zayıflayan HN(7) nöronunun patlamasını stabilize etmek için küçük miktarlarda ve dinamik kelepçe ile ekleyin.
NOT: Keskin mikroelekrod penetrasyonu, sızıntı iletimini artırdığı veya giriş direncinin azaldığı ifade edilen membran hasarına neden olur.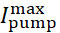 Mikroelekrod kaynaklı sızıntıyı telafi eden, ancak uyarılabilenliği bastıran 0.1-0.2 nA değerini ekleyerek başlayın ve daha sonra kademeli olarak artırın
Mikroelekrod kaynaklı sızıntıyı telafi eden, ancak uyarılabilenliği bastıran 0.1-0.2 nA değerini ekleyerek başlayın ve daha sonra kademeli olarak artırın  , düzenli patlama gerçekleşene kadar, genellikle
, düzenli patlama gerçekleşene kadar, genellikle  ~ 1-4 nS(Şekil 4A).
~ 1-4 nS(Şekil 4A).
- Bu akımları (0,1 nA için ve 1
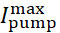 nS için artışlar) dinamik kelepçe ile kaydedilen HN(7) nöronuna sistematik olarak birlikte değişkenlik göster
nS için artışlar) dinamik kelepçe ile kaydedilen HN(7) nöronuna sistematik olarak birlikte değişkenlik göster  ve etkilerini değerlendir patlama özellikleri üzerine: başak frekansı (f: bir patlama sırasında ara aralık aralığının ortalamasının karşılığı), iç patlama aralığı (IBI: bir patlamadaki son ani artış ile bir sonraki patlamadaki ilk ani artış arasındaki süre), patlama süresi (BD: bir patlamadaki ilk ani artış ile bir patlamadaki son ani artış arasındaki süre) ve patlama süresi (T: bir patlamadaki ilk ani artış ile sonraki patlamadaki ilk ani artış arasındaki süre).
ve etkilerini değerlendir patlama özellikleri üzerine: başak frekansı (f: bir patlama sırasında ara aralık aralığının ortalamasının karşılığı), iç patlama aralığı (IBI: bir patlamadaki son ani artış ile bir sonraki patlamadaki ilk ani artış arasındaki süre), patlama süresi (BD: bir patlamadaki ilk ani artış ile bir patlamadaki son ani artış arasındaki süre) ve patlama süresi (T: bir patlamadaki ilk ani artış ile sonraki patlamadaki ilk ani artış arasındaki süre).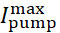 Ve , video
Ve , video  gösteriminde olduğu gibi, tekniği tanımak ve sonra dışarı çıkmak için değerlerini değiştirin.
gösteriminde olduğu gibi, tekniği tanımak ve sonra dışarı çıkmak için değerlerini değiştirin.- Belirli bir sabit değerde tutun
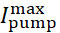 ve düzenli patlama etkinliğini destekleyen bir dizi 1 nS
ve düzenli patlama etkinliğini destekleyen bir dizi 1 nS  artışla süpürün.
artışla süpürün. - Şimdi sabit değeri
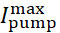 0,1 nA artırın ve düzenli patlama aktivitesini destekleyen bir dizi alanı tekrar
0,1 nA artırın ve düzenli patlama aktivitesini destekleyen bir dizi alanı tekrar  süpürün.
süpürün. - Uygulanan her parametre çifti için, f, IBI, BD ve T'nin güvenilir ortalama ölçümlerinin yapılabilmesi için en az 8 patlama içeren verileri toplayın.
- Güçlü sıçrama ve kararlı bir salınım taban çizgisi potansiyeli ile değerlendirildiği gibi, nöron uygulanabilir kaldığı sürece süpürmelere devam edin.
- Kompozit bir grafik oluşturmak için çeşitli nöronlardan (farklı hayvanlardan) veri toplayın (Şekil 5).
- Belirli bir sabit değerde tutun
Sonuçlar
Ipompa4'ün eklenmesiyle modelleme, giriş bölümünde sunulan deneysel bulguları daha keskin bir odak noktasına getirdi ve pompa destekli patlama mekanizmasını açıklamaya başladı. Burada gösterilen gerçek zamanlı model, 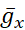 deneylerde gözlemlendiği gibi normal aktivite sınırlarına düşen düzenli ritmik aktivite üretecek şekilde ayarlanmıştır (ve
deneylerde gözlemlendiği gibi normal aktivite sınırlarına düşen düzenli ritmik aktivite üretecek şekilde ayarlanmıştır (ve  parametreler seçilmiştir- f, IBI, BD, T - ve miyomodulin modüle edilmiş parametreler
parametreler seçilmiştir- f, IBI, BD, T - ve miyomodulin modüle edilmiş parametreler 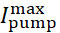 (maksimal pompa akımı) ve
(maksimal pompa akımı) ve 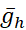 (h akımının maksimum iletimi) modelde çeşitli veya birlikte çeşitli olduğunda bu aktiviteyi üretmeye devam eder. Belirlenen parametre değerleri modelleme denemeleri için bir kıyaslama veya kurallı küme olarak kullanılabilir. Bu model örneklerinde, patlama döngüsü boyunca salınımları bir taban çizgisi düzeyi etrafında [Na+]i olarak pompalarım. Benpompa patlama fazı sırasında patlama sonlandırma katkıda bulunur ve ürettiği hiperpolarizasyon IBI sırasında Ih etkinleştirir; patlamaya yakın Ih'nin maksimum seviyesine dikkat edin (Şekil 2).
(h akımının maksimum iletimi) modelde çeşitli veya birlikte çeşitli olduğunda bu aktiviteyi üretmeye devam eder. Belirlenen parametre değerleri modelleme denemeleri için bir kıyaslama veya kurallı küme olarak kullanılabilir. Bu model örneklerinde, patlama döngüsü boyunca salınımları bir taban çizgisi düzeyi etrafında [Na+]i olarak pompalarım. Benpompa patlama fazı sırasında patlama sonlandırma katkıda bulunur ve ürettiği hiperpolarizasyon IBI sırasında Ih etkinleştirir; patlamaya yakın Ih'nin maksimum seviyesine dikkat edin (Şekil 2).
Gerçek zamanlı HN modeli tüm akımları uygulamış olmasına rağmen2,4 dinamik sıkıştırma için kullanılabilir, burada odak 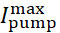 ve , model dinamik
ve , model dinamik  kelepçe GUI'sinde çalışırken değişiklikler için kullanılabilir olan (Şekil 3). Dinamik kelepçe, deneycinin gerçek bir iletkenliğin veya
kelepçe GUI'sinde çalışırken değişiklikler için kullanılabilir olan (Şekil 3). Dinamik kelepçe, deneycinin gerçek bir iletkenliğin veya 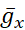
 akımın voltajını ve iyonik bağımlılığını taklit eden herhangi bir iletkenliği veya akımı yapay olarak bir nörona eklemesine (veya negatif veya ile çıkarmasını) sağlar. Bu nedenle, belirli bir iletkenliğin/ akımın hücrelerin içindeki endojen iletkenlikler / akımlarla nasıl etkileşime girdiğini tam olarak keşfetmek mümkündür (Şekil 1). Gerçek zamanlı HN modeli, HN nöronlarındaki kalıcı Na+ akımının (IP) Na+ girişinin çoğunu güçlü bir şekilde etkilediğini gösterir [Na+]i (Şekil 2) ve böylece pompalarım. IP nispeten negatif membran potansiyellerinde aktif olduğu için, IBI sırasında bile pompalanmama karşı çıkıyor.
akımın voltajını ve iyonik bağımlılığını taklit eden herhangi bir iletkenliği veya akımı yapay olarak bir nörona eklemesine (veya negatif veya ile çıkarmasını) sağlar. Bu nedenle, belirli bir iletkenliğin/ akımın hücrelerin içindeki endojen iletkenlikler / akımlarla nasıl etkileşime girdiğini tam olarak keşfetmek mümkündür (Şekil 1). Gerçek zamanlı HN modeli, HN nöronlarındaki kalıcı Na+ akımının (IP) Na+ girişinin çoğunu güçlü bir şekilde etkilediğini gösterir [Na+]i (Şekil 2) ve böylece pompalarım. IP nispeten negatif membran potansiyellerinde aktif olduğu için, IBI sırasında bile pompalanmama karşı çıkıyor.
Bu gözlemler,  daha önce tartışıldığı gibi dinamik kelepçeli izole HN nöronları arasındaki ve bunlardaki etkileşimleri keşfetmenin öğretici olduğunu göstermektedir
daha önce tartışıldığı gibi dinamik kelepçeli izole HN nöronları arasındaki ve bunlardaki etkileşimleri keşfetmenin öğretici olduğunu göstermektedir  8,9,10. Bu deneyler (devam eden) tek, sinaptik olarak izole edilmiş HN(7) nöronlarında (sinir kordonundan kopan yedinci ganglion) keskin mikroelekrod kayıtları ile gerçekleştirilir. Bugüne kadar, bu deneyler, tonik olarak aktif HN nöronlarında (sızıntıya maruz kalan mikroelekrod penetrasyonu nedeniyle) IP ve Ipompasının dinamik kelepçe ile birlikte eklenmesiyle sağlam patlamanın geri yüklendiğini göstermektedir (Şekil 4). Bu, bu nöronlarda (sızıntı tehlikeye atıldığında bile) pompalama ve IPetkileşiminden kaynaklanan bir patlama mekanizmasının mevcut olduğunu gösteren önemli bir gözlemdir. İlk sonuçlar, modelde ve deneylerde araştırılabilen güçlü karmaşık etkileşimlerini gösterir (Şekil 5).
8,9,10. Bu deneyler (devam eden) tek, sinaptik olarak izole edilmiş HN(7) nöronlarında (sinir kordonundan kopan yedinci ganglion) keskin mikroelekrod kayıtları ile gerçekleştirilir. Bugüne kadar, bu deneyler, tonik olarak aktif HN nöronlarında (sızıntıya maruz kalan mikroelekrod penetrasyonu nedeniyle) IP ve Ipompasının dinamik kelepçe ile birlikte eklenmesiyle sağlam patlamanın geri yüklendiğini göstermektedir (Şekil 4). Bu, bu nöronlarda (sızıntı tehlikeye atıldığında bile) pompalama ve IPetkileşiminden kaynaklanan bir patlama mekanizmasının mevcut olduğunu gösteren önemli bir gözlemdir. İlk sonuçlar, modelde ve deneylerde araştırılabilen güçlü karmaşık etkileşimlerini gösterir (Şekil 5).
Sonuç olarak, patlama aktivitesi sırasında [Na+]i'deki periyodik artışlara yanıt olarak pompalarım, patlama sonlandırması (BD'yi azaltma) yoluyla patlama ritmine katkıda bulunur. IP ve Ipompasının etkileşimi, endojen patlama aktivitesini desteklemek için yeterli bir mekanizma oluşturur; bu mekanizma, ganglion 7'de hücre içi olarak kaydedilen HN internöronlarında sağlam patlamayı yeniden sağlayabilir. IP ve Ipump through [Na+] arasındaki etkileşim, HN patlama dönemini monoton olmayan bir şekilde etkiler ve otonom patlamanın sağlamlığını sağlar. Bu sonuçlar omurgalı sistemlerde deneyler ve modelleme ile uyumludur11,12.
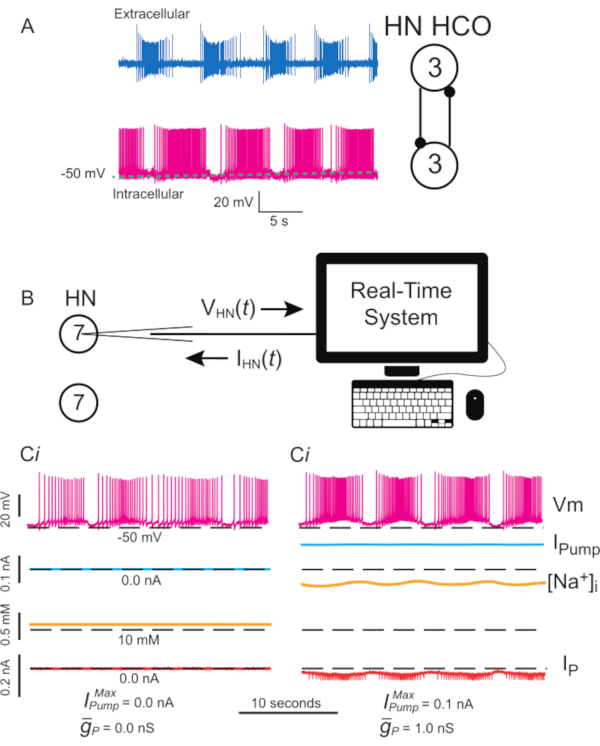
Şekil 1: Sülük kalp internöron elektrik aktivitesi ve Ipompa ve IP'nin dinamik kelepçe ile uygulanması. (A) Normal patlama aktivitesi aynı anda kaydedilmiş, hücre dışı (üstte) ve hücre içi (altta), üçüncü bir gangliyondan sülük kalp atışı HCO'sunda, kaydedilen nöronların şeması ve sağdaki karşılıklı inhibitör sinaptik bağlantıları. (B) İzole bir ganglion 7'de bir HN(7) interneuron kaydederken dinamik kelepçe şeması; iki HN(7) internöron arasında sinaptik etkileşim olmadığını unutmayın. (Ci) Sızıntıdan etkilenen bir HN(7) interneuron'da patlıyor. (Cii) Mikroelekrod kaynaklı sızıntıyı telafi eden, ancak uyarılabilirliği bastıran dinamik kelepçe Ipompası ( 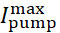 = 0.1 nA) ve
= 0.1 nA) ve  uyarılabilirliği artıran (1 nS) eklenerek daha sağlam patlamalar üretilebilir. Siyah kesikli çizgiler taban çizgisi değerlerini gösterir. Kısaltmalar: HN = kalp internöron; HCO = yarı orta osilatör; Pompalarım = dışa doğru akım; IP = kalıcı Na+ akım;
uyarılabilirliği artıran (1 nS) eklenerek daha sağlam patlamalar üretilebilir. Siyah kesikli çizgiler taban çizgisi değerlerini gösterir. Kısaltmalar: HN = kalp internöron; HCO = yarı orta osilatör; Pompalarım = dışa doğru akım; IP = kalıcı Na+ akım; 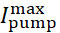 = maksimal Na+/K+ pompa akımı;
= maksimal Na+/K+ pompa akımı;  = kalıcı Na+ akımının maksimal iletimi; Vm = membran potansiyeli; [Na+] i = Na+iç konsantrasyonu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
= kalıcı Na+ akımının maksimal iletimi; Vm = membran potansiyeli; [Na+] i = Na+iç konsantrasyonu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 2: Membran potansiyeli (Vm), Ih,I pump, [Na+]ive IPiçin izler gösteren tek HN interneuron modeli. Dışa doğru hiperpolarizasyon akımları negatif, içe doğru depolarizasyon akımları pozitiftir. Siyah kesikli çizgiler taban çizgisi değerlerini gösterir. Kısaltmalar: HN = kalp internöron; Pompalarım = dışa doğru akım; IP = kalıcı Na+ akım;  = maksimal Na+/K+ pompa akımı; Ih = hiperpolarizasyon-aktive içe akım;
= maksimal Na+/K+ pompa akımı; Ih = hiperpolarizasyon-aktive içe akım;  = kalıcı Na+ akımının maksimal iletimi;
= kalıcı Na+ akımının maksimal iletimi;  = hiperpolarizasyonla aktive edilen içe akımın maksimal iletimi; Vm = membran potansiyeli; [Na+] i = Na+iç konsantrasyonu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
= hiperpolarizasyonla aktive edilen içe akımın maksimal iletimi; Vm = membran potansiyeli; [Na+] i = Na+iç konsantrasyonu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
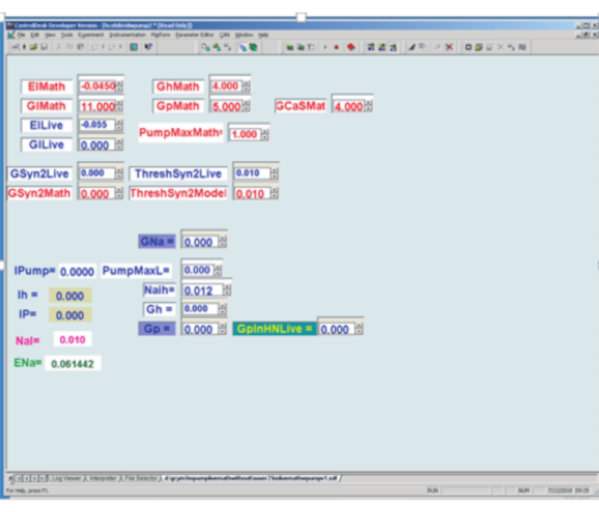
Şekil 3: Dijital sinyal işleme panosunda uygulanan gerçek zamanlı kalp internöron (HN) modeli ve dinamik kelepçenin grafik kullanıcı arayüzü. Sol Üst: Kırmızı Matematik kutuları gerçek zamanlı model için kullanıcı tarafından belirlenen parametre kutularıdır, Mavi Canlı kutular ise dinamik kelepçede kullanılan kullanıcı tarafından belirlenen parametre kutularıdır. El = sızıntı akımının ters potansiyeli; Gl = sızıntı iletimi; Gh = h-akım maksimal iletkenlik; Gp = P akımı maksimum iletkenliği; GCaS = yavaş kalsiyum akımı maksimal iletim; PumpMax = pompa maksimal akım; [GSyn2 ilgili nörona maksimal sinaptik iletim; ThreshSyn2 sinaptik bir potansiyele aracılık etmek için başak geçiş eşiği - bunlar burada resmedilmeyen hibrit (canlı / model) yarı merkezli bir osilatör yapmak için kullanılır.]. Dinamik Kelepçe için Sol Alt. En solda 5 bilgisayarlı dinamik kelepçe değişkeni değeri vardır: Pompa = pompa akımı enjekte edilir; Ih = h akımı enjekte edildi (burada kullanılmaz); IP = P akımı enjekte edildi; NaI = hesaplanan iç Na+ konsantrasyon; ENa = hesaplanan sodyum ters dönüş potansiyeli. Dinamik Kelepçe için Sol Alt. Hesaplanan değişkenlerin sağında kullanıcı tarafından belirlenen 6 parametre kutusu vardır: GNa = eylem potansiyelleriyle ilişkili Na+ akı hesaplamak için endojen hızlı sodyum maksimal iletkenlik kullanımı varsayılır; PumpMaxL = dinamik kelepçe ile enjekte edilecek maksimal pompa akımı; Naih bkz. denklem (2); Gh = dinamik kelepçe ile enjekte edilecek h akımını belirlemek için maksimal iletkenlik; Gp = endojen P akımı ile ilişkili Na+ akı hesaplamak için endojen P akımı maksimal iletkenlik kullanımı varsayıldı; GpinHNLive = dinamik kelepçe ile enjekte edilecek P akımını belirlemek için maksimum iletkenlik. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
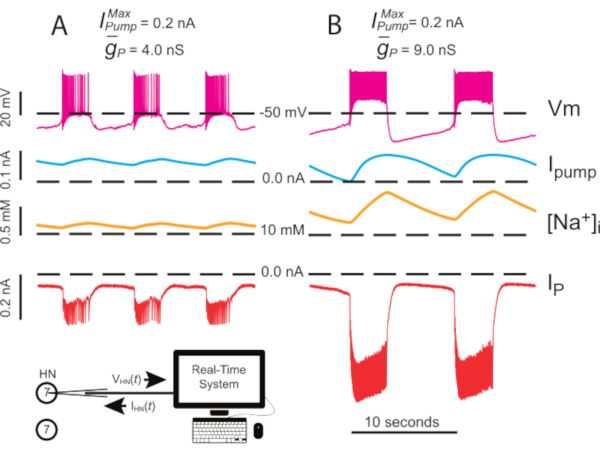
Şekil 4: Bağımsız HN(7) patlamasının dinamik kelepçe analizi. ( A  )4.0 nS ila (B) 9.0 nS'nin yukarı doğru 4.0'ın yukarı doğru doğrulasyonu bağımsız HN patlama ritmini yavaşlatır. Deneysel izler, dinamik kelepçeli izole HN(7) nöronda ritmik patlama olduğunu göstermektedir. [Na+ ]i ve Vm salınım aralıkları upregulated ile
)4.0 nS ila (B) 9.0 nS'nin yukarı doğru 4.0'ın yukarı doğru doğrulasyonu bağımsız HN patlama ritmini yavaşlatır. Deneysel izler, dinamik kelepçeli izole HN(7) nöronda ritmik patlama olduğunu göstermektedir. [Na+ ]i ve Vm salınım aralıkları upregulated ile  artar. İzler yukarıdan aşağıya: kaydedilen Vm, enjekte I pompa, hesaplanan [Na+]i, ve enjekte IP. Siyah kesikli çizgiler taban çizgisi değerlerini gösterir. Kısaltmalar: HN = kalp internöron; Pompalarım = dışa doğru akım; IP = kalıcı Na+ akım;
artar. İzler yukarıdan aşağıya: kaydedilen Vm, enjekte I pompa, hesaplanan [Na+]i, ve enjekte IP. Siyah kesikli çizgiler taban çizgisi değerlerini gösterir. Kısaltmalar: HN = kalp internöron; Pompalarım = dışa doğru akım; IP = kalıcı Na+ akım; 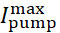 = maksimal Na+/K+ pompa akımı;
= maksimal Na+/K+ pompa akımı;  = kalıcı Na+ akımının maksimal iletimi; Vm = membran potansiyeli; [Na+] i = Na+iç konsantrasyonu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
= kalıcı Na+ akımının maksimal iletimi; Vm = membran potansiyeli; [Na+] i = Na+iç konsantrasyonu. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
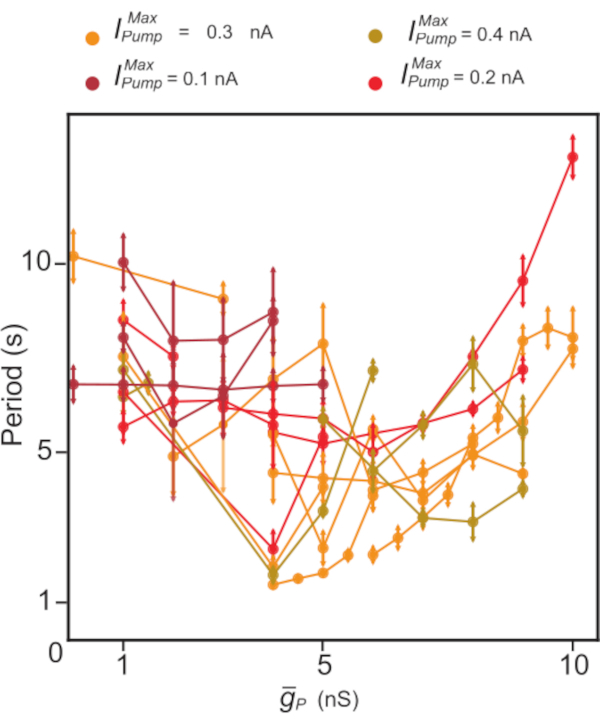
Şekil 5: Bağımsız HN(7) patlamasının dinamik kelepçe analizi. Artan  HN patlama periyodu ile birlikte, boğulma eğilimindedir. Dinamik kelepçe kullanılarak yapılan bireysel deneylerde (çizgilerle bağlanan noktalar)
HN patlama periyodu ile birlikte, boğulma eğilimindedir. Dinamik kelepçe kullanılarak yapılan bireysel deneylerde (çizgilerle bağlanan noktalar)  değerler
değerler 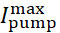 sabit tutulurken süpürüldü. Renkler, farklı denemelerde kullanılan farklı sabit ekleme düzeylerini temsil
sabit tutulurken süpürüldü. Renkler, farklı denemelerde kullanılan farklı sabit ekleme düzeylerini temsil 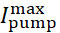 eder. Kısaltmalar: HN = kalp internöron;
eder. Kısaltmalar: HN = kalp internöron; 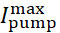 = maksimal Na+/K+ pompa akımı;
= maksimal Na+/K+ pompa akımı;  = kalıcı Na+ akımının maksimum iletimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
= kalıcı Na+ akımının maksimum iletimi. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Modelleme, dinamik kelepçe ve bunların sağladığı analizler, bireysel ve iyonik iletkenlik/akım gruplarının nöronların elektriksel aktivitesine nasıl katkıda bulunduğunu keşfetmek için yararlı tekniklerdir (Şekil 1, Şekil 2,Şekil 4ve Şekil 5). Bu tekniklerin kullanımı, Sülük kalp atışı desen jeneratörünün çekirdek HN'lerinde sağlam patlamayı teşvik etmek için Na+/K + pompa akımının(pompa)voltaj kapılı akımlarla, özellikle kalıcı Na + akımıyla(IP)nasıl etkileşime girdiğini gösterir. Dinamik kelepçe deneyleri ve modellemeyi birleştirerek, sıradan voltaj kaydı ve akım kelepçe teknikleri ile modelleri mümkün olandan daha doğrudan test etmek mümkündür. Dinamik kelepçe deneylerinden elde edilen sonuçlar (Şekil 5) HN modelini daha da iyileştirmek için kullanılacaktır. Burada gösterilen temel dinamik sıkıştırma yöntemi, voltaj kelepçe deneyleri ile matematiksel bir nöron akım modeli belirlenebiliyorsa, incelenen herhangi bir nöronun özelliklerini yansıtacak şekilde özelleştirilebilir.
Burada gösterilen tipteki deneylerin başarıyla tamamlanması, keskin bir mikroelekrod kullanırken bir HN veya diğer nöronun dikkatli bir şekilde delinmesini gerektirir, çünkü güçlü patlama elektrot penetrasyonu ile kısıtlanır1. (Tanıtılan sızıntıyı en aza indiren tüm hücreli yama kayıt teknikleri diğer nöronlar için de geçerlidir, ancak sülük nöronlarında iyi çalışmaz.) HN nöronunun saplanmanın nörona en az zarar vermesi (ilave sızıntı) ve giriş direncinin izlenmesi ve başarılı deneyler için 60-100 MOhm aralığında olması önemlidir4.
Dinamik kelepçe güçlü bir tekniktir, ancak nöronal geometri tarafından dayatılan sınırlamalara sahiptir, çünkü yapay iletkenlikler kayıt elektrodunun yerinde uygulanır- genellikle hücre gövdesi- ritim üreten akımların genellikle lokalize olduğu yerde değil5,6,10. Sülük HN nöronlarında, hücre gövdesi, çoğu aktif akımın lokalize olduğu nöronun entegrasyon bölgesine (ana neurit) elektriksel olarak yakındır ve sivri uçlar başlatılır.
Açıklamalar
Hiç kimse
Teşekkürler
Christian Erxleben'e HN(7) nöronları üzerinde patlama yeteneklerini gösteren ön dinamik kelepçe deneyleri için teşekkür ederiz. Angela Wenning deneylere uzman tavsiyesiyle yardım etti. Nih'i, GSC ve RLC'ye Grant 1 R21 NS11355 aracılığıyla bu çalışmayı finanse etmek için kabul ediyoruz.
Malzemeler
| Name | Company | Catalog Number | Comments |
| ANIMALS | |||
| Hirudo verbana | Leech.com, https://www.leech.com/collections/live-leeches | live leeches 2-3 grams | |
| CHEMICALS | |||
| ARTIFICIAL POND WATER | |||
| CaCl2 | Sigma Aldrich | C5670-100G | 1.8 mM add last after adjusting pH |
| glucose | Sigma Aldrich | G7021-100G | 10 mM |
| HEPES | Sigma Aldrich | H4034-100G | 10 mM |
| Instant Ocean (sea salt ) | Spectrum Brands Inc., Madison, WI | 0.05% (w/v) diluted in deionized water | |
| KCl | Sigma Aldrich | P9333-500G | 4 mM |
| NaCl | Sigma Aldrich | S7653-250G | 115 mM |
| NaOH 0.1 N Solution | Sigma Aldrich | 2105-50ML | Adjust to pH 7.4 with NaOH |
| MICROELECTRODES | |||
| K Acetate | Sigma Aldrich | P1190-100G | 2 M |
| KCl | Sigma Aldrich | P9333-500G | 20 mM |
| SALINE | |||
| EQUIPMENT | |||
| #5 Forceps | Fine Science Tools Dumont | 11251-30 OR 11251-20 | For general leech dissection |
| AxoClamp 2A/2B DCC electrometer | Axon Instruments Molecular Devices | 2A/2B | For recording of neuronal membrane potential and discontinuous current clamp |
| Black resin | Dow Sylguard | 170 | Lines general dissect dish |
| Capilary glass 1 mm outer diameter, 0.75 mm inner diameter | A-M Systems | 615000 | For fabricating sharp microelectrodes |
| Clear resin | Dow Sylguard | 184 | Lines Petri dish used to mount ganglion for electrophysilogy |
| Dark field condenser | Nikon | Dry 0.95-0.80 MBL 1210 | For illuminating the ganglion preparation during cell impalement |
| Digidata 1440A | Axon CNS Molecular Devices | 1440A | Performs A to D and D to A for data acquisition and stimulation during electrophysiology |
| Digital signal processing board | dSpace | CLP1104 | Our software implements all the conductances/currents in our model HN neuron on a DS1103 dSPACE PPC Controller Board in real-time at a rate of 20 kHz with a ControlDesk GUI (dSPACE, Paderborn, Germany)9. |
| Falming/Brown Microelectrode Puller | Sutter Instruments | P-97 | For fabricating sharp microelectrodes |
| Fiber-Lite high intensity illuminator | Dolan Jenner Industries | 170D | For illuminating the general dissection and for illuminating the ganglion preparation during cell impalement |
| Headstage amplifier for AxoClamp 2A | Axon Instruments | HS-2A Gain:0.1LU | Now part of Molecular Devices for recording of neuronal membrane potential and discontinuous current clamp |
| Light guide | Dolan Jenner Industries | Rev R 38 08 3729107 | For illuminating the general dissection and for illuminating the ganglion preparation during cell impalement |
| Micromanipulator | Sutter Instruments | MPC-385 | Micromanipulator for cell impalement with microelectrodes |
| Micromanipulator controller | Sutter Instruments | MPC-200 | Controls micromanipulators for cell impalement with microelectrodes |
| Minuten pins | BioQuip | 0.15 mm diameter 1208SA | Should be shortened by curtting to ~5 mm |
| Optical Breadboard 3' x 5' x 8" | Newport | Obsolete | With the 4 pneumatic Isolators below used to construct a vibration free workspace for electrophysiology |
| Oscilloscope | HAMEG Instruments | HM303-6 | To monitor electrode setteling during DCC |
| Pascheff-Wolff spring scissors | Moria | Supplied by Fine Science Tools (Foster City, CA) catalog # 15371-92 | |
| pClamp 9 Software | Axon Instruments | 9 | Now part of Moleculear Devices uses the Digidata 1440 for data acquisition and stimulation during electrophysiology |
| Pneumatic Isolators 28" | Newport | Obsolete | With optical breadboard used to construct a vibration free workspace for electrophysiology |
| Simulink / MATLAB software | MathWorks | 2006 (Obsolete) | Implements dynamic clamp on the digital signal processing board |
| Stereomicroscope | Wild | M5A | 10x Eye Pieces used for dissecting the leech and removingand desheathing ganglia |
| Steromicroscope | Wild | M5 | 20x Eye Pieces used in electrophysiologcal station to visualize neuron for microelectrode penetration |
| Student Vannas Spring Scissors | Fine Science Tools | 91500-09 | For general leech dissection |
Referanslar
- Cymbalyuk, G. S., Gaudry, Q., Masino, M. A., Calabrese, R. L. Bursting in leech heart interneurons: cell-autonomous and network-based mechanisms. Journal of Neuroscience. 22, 10580-10592 (2002).
- Hill, A. A., Lu, J., Masino, M. A., Olsen, O. H., Calabrese, R. L. A model of a segmental oscillator in the leech heartbeat neuronal network. Journal of Computational Neuroscience. 10, 281-302 (2001).
- Tobin, A. E., Calabrese, R. L. Myomodulin increases Ih and inhibits the NA/K pump to modulate bursting in leech heart interneurons. Journal of Neurophysiology. 94, 3938-3950 (2005).
- Kueh, D., Barnett, W. H., Cymbalyuk, G. S., Calabrese, R. L. Na(+)/K(+) pump interacts with the h-current to control bursting activity in central pattern generator neurons of leeches. eLife. 5, 19322(2016).
- Sharp, A. A., O'Neil, M. B., Abbott, L. F., Marder, E. Dynamic clamp: computer-generated conductances in real neurons. Journal of Neurophysiology. 69, 992-995 (1993).
- Prinz, A. A., Abbott, L. F., Marder, E. The dynamic clamp comes of age. Trends in Neuroscience. 27, 218-224 (2004).
- Barnett, W., Cymbalyuk, G. Hybrid systems analysis: real-time systems for design and prototyping of neural interfaces and prostheses. Biohybrid systems: nerves, interfaces, and machines. Jung, R. , Wiley VCH Verlag. Weinheim. 115-138 (2011).
- Sorensen, M., DeWeerth, S., Cymbalyuk, G., Calabrese, R. L. Using a hybrid neural system to reveal regulation of neuronal network activity by an intrinsic current. Journal of Neuroscience. 24, 5427-5438 (2004).
- Olypher, A., Cymbalyuk, G., Calabrese, R. L. Hybrid systems analysis of the control of burst duration by low-voltage-activated calcium current in leech heart interneurons. Journal of Neurophysiology. 96, 2857-2867 (2006).
- Calabrese, R. L., Prinz, A. A. Realistic modeling of small neuronal networks. Computational Modeling Methods for Neuroscientists. DeSchutter, E. , MIT Press. MA, USA. 285-316 (2010).
- Rybak, I. A., Molkov, Y. I., Jasinski, P. E., Shevtsova, N. A., Smith, J. C. Rhythmic bursting in the pre-Bötzinger complex: mechanisms and models. Progress in Brain Research. 209, 1-23 (2014).
- Picton, L. D., Nascimento, F., Broadhead, M. J., Sillar, K. T., Miles, G. B. Sodium pumps mediate activity-dependent changes in mammalian motor networks. Journal of Neuroscience. 37, 906-921 (2017).
Erratum
Formal Correction: Erratum: Contribution of the Na+/K+ Pump to Rhythmic Bursting, Explored with Modeling and Dynamic Clamp Analyses
Posted by JoVE Editors on 7/28/2021. Citeable Link.
An erratum was issued for: Contribution of the Na+/K+ Pump to Rhythmic Bursting, Explored with Modeling and Dynamic Clamp Analyses. An author name was updated.
The name of the first author was updated from:
Ricardo Javier Erazo Toscano
to:
Ricardo Javier Erazo-Toscano
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır