Method Article
Contributo della pompa Na+/ K+ allo scoppio ritmico, esplorato con la modellazione e le analisi dinamiche del morsetto
* Questi autori hanno contribuito in egual misura
In questo articolo
Erratum Notice
Riepilogo
Qui viene presentato un metodo per lo studio dei ruoli della pompa Na+/ K+ e della corrente Na+ persistente negli interneuroni del cuore di sanguisuga utilizzando il morsetto dinamico.
Abstract
La pompa Na+/K+, spesso pensata come una funzione di fondo nell'attività neuronale, contribuisce a una corrente verso l'esterno (pompaI) che risponde alla concentrazione interna di Na+ ([Na+]i). Nei neuroni bursting, come quelli che si trovano nelle reti neuronali del generatore di pattern centrale (CPG) che producono movimenti ritmici, ci si può aspettare che la [Na+]i e quindi la pompaI varino durante il ciclo di burst. Questa reattività all'attività elettrica, combinata con l'indipendenza dal potenziale di membrana, conferisce alla pompa proprietà dinamiche non comuni alle correnti basate su canali (ad esempio, canali di tensione o trasmettitori o di perdita). Inoltre, in molti neuroni, l'attività della pompa è modulata da una varietà di modulatori, espandendo ulteriormente il ruolo potenziale della pompa I nell'attività di scoppio ritmico. Questo documento mostra come utilizzare una combinazione di metodi di modellazione e di morsetto dinamico per determinare come pompare e la sua interazione con l'attività ritmica persistente di influenza Na+ corrente in un CPG. In particolare, questo documento si concentrerà su un protocollo di morsetto dinamico e metodi di modellazione computazionale negli interneuroni cardiaci di sanguisughe medicinali.
Introduzione
Il battito cardiaco nelle sanguisughe è guidato da un CPG costituito da 9 coppie bilaterali di interneuroni cardiaci (NN) distribuiti su altrettanti gangli segmentali del corpo centrale. Al centro del CPG ci sono coppie reciprocamente inibitorie di interneuroni situati nel 3° e 4° gangli segmentale che formano oscillatori semicentri (HCO) (Figura 1A). Questi neuroni continuano a scoppiare quando sinapticamente isolati farmacologicamente usando bicuculline1. Altri, come la coppia nel 7° gangli segmentale (il focus di questo protocollo), sono anche burster, in grado di produrre attività di scoppio quando isolati sinapticamente. Non sono reciprocamente collegati e ricevono solo input discendenti, e quindi sono facilmente isolati tagliando il ganglio dal resto del cordone nervoso. Questa attività di scoppio indipendente è sensibile alla corrente di dispersione introdotta causata dalla penetrazione con microelettrodi affilati per la registrazione, ma esplode vigorosamente quando registrata con metodi di patch sciolti1.
Sono stati modellati sia i singoli neuroni HN che gli HCO HN (modelli di compartimento isopotenziale singolo basati su Hodgkin-Huxley di neuroni HN contenenti tutte le correnti voltaggio-mo-ari e sinaptiche identificate sperimentalmente) e tutte le caratteristiche di scoppio del sistema vivente sono state catturate con successo2. La miomodulina, un neuropeptide endogeno nelle sanguisughe, diminuisce notevolmente il periodo (T) del ritmo di scoppio dei neuroni HN isolati e degli HCO HN. Questo modulatore agisce per aumentare la corrente h (corrente verso l'interno attivata dall'iperpolarizzazione, Ih) e per diminuire lapompaI3. Questa osservazione ha portato all'esplorazione di come lapompa I interagisce con Ihe di come la loro co-modulazione contribuisce all'attività ritmica dei neuroni HN. L'attivazione della pompa aumentando [Na+]i (usando lo ionoforo monensin) accelera il ritmo di scoppio HN sia negli HCO HN che nei neuroni HN isolati4. Questa velocità dipendeva da Ih. Quando Ih era bloccato (2 mM Cs+),il periodo di scoppio non è stato alterato da questo metodo di attivazione della pompa; tuttavia, la durata del burst (BD) è stata ridotta e l'intervallo di interburst (IBI) è aumentato sia negli HCO HN che nei neuroni HN isolati4.
Per questo protocollo, tutte le correnti di un neurone HN(7) vivente, inclusa la corrente della pompa, la pompaI,sono incorporate nel modello HN come segue:
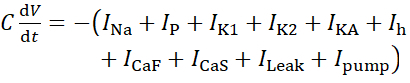 (1)
(1)
dove C è la capacità di membrana (in nF), V è il potenziale di membrana (in V), t è il tempo (in s). Descrizioni ed equazioni dettagliate della corrente ionica sono state descritte altrove2,4. Il neurone modello HN completo funziona in tempo reale (Figura 2). Il software sarà reso disponibile su GitHub al momento della pubblicazione e sarà idoneo all'esecuzione sulla scheda di elaborazione del segnale digitale descritta nella Tabella dei Materiali. Qui, il focus dell'indagine è la corrente della pompa Na+/ K+ (pompaI) e le correnti voltaggio-4 che contribuiscono in modo significativo Na+ flusso: una corrente Na+ veloce (INa) e una corrente Na+ persistente (IP). Le conduttanze massime di queste correnti sono 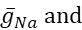
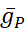 rispettivamente. La pompa Na+/K+ scambia tre ioni Na+ intracellulari per due ioni K+ extracellulari, producendo così una corrente netta verso l'esterno. È importante sottolineare che pompa 3 volte più Na+ dal neurone di quanto indichi questa corrente, il che è importante per il calcolo della concentrazione intracellularedi Na +.
rispettivamente. La pompa Na+/K+ scambia tre ioni Na+ intracellulari per due ioni K+ extracellulari, producendo così una corrente netta verso l'esterno. È importante sottolineare che pompa 3 volte più Na+ dal neurone di quanto indichi questa corrente, il che è importante per il calcolo della concentrazione intracellularedi Na +.
La corrente della pompa Na+/K+ dipende dalle concentrazioni intracellulari di Na+ ed è espressa dalla seguente funzione sigmoidale:
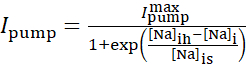 (2)
(2)
dove [Na]i è la concentrazione intracellulare di Na+,  è la massima Na+/K+ corrente della pompa, [Na]ih è la concentrazione intracellulare di Na+ per la semi-attivazione della pompa Na+/K+ e [Na]è la sensibilità della pompa Na+/K+ a [Na]i. [Na]i si costruisce come risultato degli afflussi di Na+ trasportati da IP e INa ed è diminuito dall'efflusso Na+ della pompa Na+/ K+. Il contributo di Ih e ILeak al flusso totale di Na+ è piccolo e non è considerato nel modello in tempo reale.
è la massima Na+/K+ corrente della pompa, [Na]ih è la concentrazione intracellulare di Na+ per la semi-attivazione della pompa Na+/K+ e [Na]è la sensibilità della pompa Na+/K+ a [Na]i. [Na]i si costruisce come risultato degli afflussi di Na+ trasportati da IP e INa ed è diminuito dall'efflusso Na+ della pompa Na+/ K+. Il contributo di Ih e ILeak al flusso totale di Na+ è piccolo e non è considerato nel modello in tempo reale.
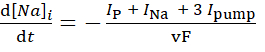 (3)
(3)
dove, v è il volume (~6,7 pL) del serbatoio intracellulare Na+, F è la costante di Faraday e la concentrazione extracellulare di Na+ è mantenuta costante.
Le conduttanza voltaggio-uscita e di perdita sono state differenziate - queste rispondono al potenziale di membrana - dalla corrente della pompa, che è regolata dalla concentrazione intracellulare Na+ calcolata ([Na+]i). [Na+] i è costruito attraverso Na+ ingresso tramite la corrente na+ veloce (INa) che produce potenziali d'azione (picchi) e la corrente Na+ persistente (IP) che fornisce la depolarizzazione per supportare lo spiking. [Na+] i è, a sua volta, ridotto dall'azione della pompa attraverso l'estrusione di Na+. Sono stati assunti valori HN viventi di base di  (5nS) e
(5nS) e 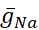 (150 nS) e prendiamo in considerazione qualsiasi morsetto dinamico aggiunto
(150 nS) e prendiamo in considerazione qualsiasi morsetto dinamico aggiunto  .
.
L'obiettivo del protocollo qui descritto è quello di manipolare lapompa I in modo preciso e reversibile in tempo reale per scoprire come interagisce con le correnti voltaggio-mozionato (corrente Na+ persistente nel protocollo di corrente) per controllare lo scoppio ritmico in singoli NN. Per raggiungere questo obiettivo, è stato utilizzato un morsetto dinamico, che introduce artificialmente, su comando, una quantità precisa di qualsiasi corrente che può essere calcolata mentre il modello è in esecuzione. Questo metodo ha vantaggi rispetto alla manipolazione farmacologica della pompa, che colpisce l'intero tessuto, può avere effetti fuori bersaglio che sono spesso difficili da invertire e non possono essere manipolati con precisione. Il morsetto dinamico5,6 legge la tensione di un neurone registrato in tempo reale(Figura 1B)e calcola e inietta, in tempo reale, la quantità di qualsiasi corrente in base alle equazioni del modello e ai valori impostati di qualsiasi o 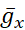
 . Metodi simili possono essere facilmente applicati a qualsiasi neurone che può essere registrato intracellulare. Tuttavia, i parametri dovranno essere riscalati al neurone scelto e il neurone dovrà essere isolato dagli input sinaptici, ad esempio farmacologicamente.
. Metodi simili possono essere facilmente applicati a qualsiasi neurone che può essere registrato intracellulare. Tuttavia, i parametri dovranno essere riscalati al neurone scelto e il neurone dovrà essere isolato dagli input sinaptici, ad esempio farmacologicamente.
Protocollo
NOTA: i soggetti sperimentali su animali invertebrati non sono regolamentati dal NIH o dalle università statali di Emory e Georgia. Tutte le misure sono state tuttavia prese per ridurre al minimo la sofferenza delle sanguisughe utilizzate in questo lavoro.
1. Preparare il ganglio isolato 7 dal cordone nervoso della sanguisuga
- Mantenere le sanguisughe Hirudo verbana in acqua di stagno artificiale (contenente lo 0,05% p/v di sale marino) diluite in acqua deionalizzata a 16 °C su un ciclo luce-buio 12:12.
- Preparare le sanguisughe per la dissezione anestetizzandole a freddo in un letto di ghiaccio tritato per >10 minuti fino a quando non sono immobili.
- Riempire una soluzione di dissezione nera rivestita di resina ad una profondità di ~ 1 cm con soluzione salina refrigerata contenente 115 mM NaCl, 4 mM KCl, 1,7 mM CaCl2, 10 mM D-glucosio e 10 mM HEPES in acqua deionizzata; pH regolato a 7,4 con 1 M NaOH. Appuntare il lato dorsale della sanguisuga verso l'alto nella camera rivestita di resina nera (almeno 20 cm x 10 cm con una profondità di almeno 2 cm sopra la resina che ha uno spessore di almeno 2 cm).
- Sotto uno steromicroscopio a ingrandimento 20x con illuminazione a guida luminosa obliqua, effettuare un taglio longitudinale lungo almeno 3 cm con forbici a molla da 5 mm attraverso la paretecorporea nella porzione rostrale 1/3 del corpo. Usa i perni per tirare da parte la parete del corpo ed esporre gli organi interni.
NOTA: Qualsiasi farina di sangue immagazzinata può essere rimossa mediante aspirazione con una pipetta Pasteur lucidata al fuoco. - Isolare un singolo ganglio centrale 7 (settimo ganglio segmentale libero caudale al cervello).
- Aprire il seno in cui risiede il cordone nervoso utilizzando le forbici a molla da 5 mm. Assicurati di dividere il seno dorsalmente e ventralmente lasciando due strisce di seno. Usa una pinna affilata #5 per aiutare a guidare il taglio e tenere il seno.
- Mantenere il seno attaccato a ciascuna delle due radici nervose bilaterali che emergono dal ganglio (aderisce strettamente a ciascuna radice) per utilizzare queste strisce di seno per bloccare il ganglio.
- Rimuovere il ganglio dal corpo tagliando ifasci nervosi connettivi rostrali e caudali che collegano i gangli (il più lontano possibile dal 7 ° ganglio) e le strisce del seno, quindi tagliare le radici laterali a dove emergono dal seno.
- Pin il ganglio (usando la vecchia pinna smussata #5) con spille di insetti minuten accorciate, lato ventrale in alto, in piastre di Petri chiare e rivestite di resina. Inserire perni nelle strisce di seno e tessuto sciolto aderente alle radici e ai connettivi rostrali e caudali, il più lontano possibile dal ganglio.
NOTA: la resina non deve essere più spessa di 3 mm se si desidera ottenere una buona illuminazione dal basso durante la registrazione. Assicurarsi che il ganglio sia teso, sia longitudinalmente che lateralmente - Aumentare l'ingrandimento dello stereomicroscopio a 40x o superiore e regolare l'illuminazione obliqua in modo che i corpi cellulari neuronali possano essere facilmente visti sulla superficie ventrale del ganglio appena sotto il perineurio.
- Rimuovere il perineurio del ganglio (dente) con microscissori.
- Iniziare la defeazione tagliando la guaine sciolta tra le radici da un lato e continuare il taglio lateralmente verso l'altro lato, assicurandosi di mantenere superficiali le lame a forbice e non danneggiare i corpi cellulari neuronali direttamente sotto la guaine.
- Fai un taglio superficiale simile caudale dal taglio laterale lungo la linea mediana.
- Ora afferra il lembo caudolaterale della guaina su un lato con la pinna fine #5, tiralo via dal ganglio e taglialo con i microscissori.
- Ripeti dall'altra parte; questa procedura espone entrambi i neuroni HN(7) per la registrazione con microelettrodi.
- Posizionare il piatto di preparazione nella configurazione di registrazione e infondere con soluzione salina a una portata di 5 ml / min a temperatura ambiente.
2. Identificare e registrare gli interneuroni del cuore di sanguisuga con microelettrodi affilati
- Per la durata della registrazione del neurone HN(7) (le registrazioni durano tra 30 e 60 min), acquisire e digitalizzare le tracce intracellulari di corrente e tensione da un elettrometro neurofisiologico a una velocità di 5 kHz con un sistema di acquisizione dati digitale (analogico a digitale, da A a D) e di stimolazione (digitale ad analogico, da D ad A), e visualizzare sullo schermo di un computer.
NOTA: qualsiasi software commerciale o personalizzato e scheda da A a D/D a A può essere utilizzata per l'acquisizione dati (da A a D). D to A e software personalizzato sono necessari per il morsetto dinamico. - Sotto uno steromicroscopio a 50-100x con illuminazione del campo scuro dal basso, identificare provvisoriamente un neurone HN(7) della coppia bilaterale dalla sua posizione canonica in posizione posteriolaterale nel ganglio centrale sette.
- Ora cerca di penetrare nel presunto neurone HN(7) con un microelettrodo affilato riempito con 2 M di acetato di potassio e 20 mM KCl usando un micromanipolatore.
- Posizionare il microelettrodo molto vicino al corpo della cellula bersaglio.
- Osservare continuamente il potenziale registrato con l'elettrometro e impostare questo potenziale a zero mV prima di penetrare nel neurone.
- Penetrare nel neurone con il microelettrodo, guidando lentamente l'elettrodo lungo il suo asse lungo con il manipolatore. Utilizzando la funzione di ronzio dell'elettrometro, impostata su 100 ms di durata del ronzio, fino a quando non si osserva uno spostamento negativo del potenziale di membrana e una vigorosa attività di spiking.
- Impostare l'elettrometro in modalità discontinua di bloccaggio della corrente (DCC) ≥ 3 kHz per registrare contemporaneamente il potenziale di membrana e passare la corrente con il singolo microelettrodo (compensazione della capacità impostata su appena sotto lo squillo e quindi ricomposti il 10%).
- Monitorare la sedimentazione dell'elettrodo durante il DCC su un oscilloscopio.
- Iniettare una corrente costante di -0,1 nA con l'iniettore a corrente costante dell'elettrometro per un minuto o due per stabilizzare la registrazione.
- Identificare definitivamente il neurone HN(7) dalla sua caratteristica forma a picco e dalla debole attività di scoppio (Figura 1Ci).
- Eseguire qualsiasi analisi dei dati offline dopo il completamento dell'esperimento e salvare tutti i dati su un disco.
3. Costruisci un HN in tempo reale o un altro neurone modello
- Creare software personalizzato utilizzando una scheda di elaborazione del segnale digitale (DSB; D ad A e da A a D) in un computer da tavolo per implementare in tempo reale le correnti modello descritte in2,4 o diverse correnti modello per altri neuroni o esperimenti.
- Utilizzare equazioni in stile Hodgkin-Huxley in quanto sono il metodo generalmente preferito per rappresentare le correnti del modello.
- Vedere7 per una descrizione dettagliata dell'implementazione del modello HN in tempo reale e del morsetto dinamico prima dell'aggiunta della corrente della pompa. Fare riferimento alla sezione introduttiva per la descrizione delle correnti, della concentrazione intracellulare di Na+ e delle conduttanze del neurone HN(7) vivente nel modello HN.
4. Implementare e variare le conduttanza / correnti dinamiche del morsetto
- Utilizzare il software di morsetto dinamico personalizzato per il DSB per implementare e modificare in tempo reale il morsetto dinamico qualsiasi interfaccia utente grafica (Figura 3) (GUI) accessibile, conduttanza e correnti programmate del modello in tempo reale HN del neurone HN(7).
NOTA: Come promemoria, e
e  sono la conduttanza massima della corrente Na+ persistente (IP) e la corrente massima della pompa (pompaI), rispettivamente.
sono la conduttanza massima della corrente Na+ persistente (IP) e la corrente massima della pompa (pompaI), rispettivamente. - Utilizzare le caselle di immissione GUI nel software per apportare modifiche, mentre il modello è in
 esecuzione, nella (casella PumpMaxL) e
esecuzione, nella (casella PumpMaxL) e  (casella GpinHNLive) (Figura 3).
(casella GpinHNLive) (Figura 3).
NOTA: le caselle di input della GUI accettano valori digitati e si consigliano passaggi di 0,1 nA e si consigliano passaggi di 1 nS per
e si consigliano passaggi di 1 nS per  .
.- Aggiungere piccole quantità di
 e
e  con morsetto dinamico per stabilizzare lo scoppio del neurone HN(7), che è indebolito da una perdita indotta da microelettrodi, come mostrato nella Figura 1Cii.
con morsetto dinamico per stabilizzare lo scoppio del neurone HN(7), che è indebolito da una perdita indotta da microelettrodi, come mostrato nella Figura 1Cii.
NOTA: la penetrazione acuta del microelettrodo provoca danni alla membrana che si esprimono come aumento della conduttanza delle perdite o diminuzione della resistenza di ingresso. - Inizia aggiungendo un valore
 di 0,1-0,2 nA, che compensa la perdita indotta dal microelettrodo, ma deprime l'eccitabilità, e poi aumenta gradualmente
di 0,1-0,2 nA, che compensa la perdita indotta dal microelettrodo, ma deprime l'eccitabilità, e poi aumenta gradualmente  , che aumenta l'eccitabilità, fino a quando ne consegue uno scoppio regolare, di solito a
, che aumenta l'eccitabilità, fino a quando ne consegue uno scoppio regolare, di solito a  ~ 1-4 nS (Figura 4A).
~ 1-4 nS (Figura 4A).
- Aggiungere piccole quantità di
- Co-variare sistematicamente queste correnti (incrementi di 0,1 nA per
 e 1 nS per
e 1 nS per  ) al neurone HN(7) registrato con morsetto dinamico (Figura 3), e valutare i loro effetti sulle caratteristiche di scoppio: frequenza di picco (f: il reciproco della media dell'intervallo di interspike durante un burst), intervallo di interburst (IBI: il tempo tra l'ultimo picco in una raffica e il primo picco nel burst successivo), durata del burst (BD: il tempo tra il primo spike in un burst e l'ultimo spike in un burst), e il periodo di burst (T: il tempo tra il primo spike in un burst e il primo spike nel burst successivo).
) al neurone HN(7) registrato con morsetto dinamico (Figura 3), e valutare i loro effetti sulle caratteristiche di scoppio: frequenza di picco (f: il reciproco della media dell'intervallo di interspike durante un burst), intervallo di interburst (IBI: il tempo tra l'ultimo picco in una raffica e il primo picco nel burst successivo), durata del burst (BD: il tempo tra il primo spike in un burst e l'ultimo spike in un burst), e il periodo di burst (T: il tempo tra il primo spike in un burst e il primo spike nel burst successivo).- Modificare i valori di

 e, come nella dimostrazione video, per acquisire familiarità con la tecnica e quindi avventurarsi.
e, come nella dimostrazione video, per acquisire familiarità con la tecnica e quindi avventurarsi.- Mantenere
 un valore fisso specifico e spazzare in incrementi di 1 nS su un intervallo di supporto dell'attività di
un valore fisso specifico e spazzare in incrementi di 1 nS su un intervallo di supporto dell'attività di  scoppio regolare.
scoppio regolare. - Ora aumenta il valore fisso di
 0,1 nA e di nuovo spazza su una gamma di attività di
0,1 nA e di nuovo spazza su una gamma di attività di  scoppio regolare di supporto.
scoppio regolare di supporto. - Per ogni coppia di parametri implementata, raccogliere dati contenenti almeno 8 burst in modo da poter eseguire misurazioni medie affidabili di f, IBI, BD e T.
- Continuare con sweep per tutto il tempo in cui il neurone rimane vitale, come valutato da un forte picco e da un potenziale di oscillazione basale stabile.
- Raccogliere dati da diversi neuroni (da diversi animali) per generare un grafico composito (Figura 5).
- Mantenere
- Modificare i valori di
Risultati
La modellazione con l'aggiunta della pompaI4 ha portato i risultati sperimentali presentati nella sezione introduttiva in modo più nitido e ha iniziato a spiegare il meccanismo di scoppio assistito dalla pompa. Il modello in tempo reale qui dimostrato è stato sintonizzato 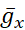 (e
(e  i parametri scelti) in modo che produca un'attività ritmica regolare che rientra nei limiti dell'attività normale come osservato negli esperimenti - f, IBI, BD, T - e continua a produrre tale attività quando i parametri modulati dalla miomodulina
i parametri scelti) in modo che produca un'attività ritmica regolare che rientra nei limiti dell'attività normale come osservato negli esperimenti - f, IBI, BD, T - e continua a produrre tale attività quando i parametri modulati dalla miomodulina  (la corrente massima della pompa) e
(la corrente massima della pompa) e 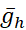 (conduttanza massima della corrente h) sono variati o co-variati nel modello. I valori dei parametri determinati possono essere utilizzati come benchmark o set canonico per esperimenti di modellazione. In questi casi di modello, la pompa oscilla durante il ciclo di scoppio come [Na+]i attorno a un livello di base. Lapompa I contribuisce alla terminazione dello scoppio durante la fase di scoppio e l'iperpolarizzazione che produce attiva I h durante l'IBI; notare il livello massimo di Ih vicino all'inizio del burst (Figura 2).
(conduttanza massima della corrente h) sono variati o co-variati nel modello. I valori dei parametri determinati possono essere utilizzati come benchmark o set canonico per esperimenti di modellazione. In questi casi di modello, la pompa oscilla durante il ciclo di scoppio come [Na+]i attorno a un livello di base. Lapompa I contribuisce alla terminazione dello scoppio durante la fase di scoppio e l'iperpolarizzazione che produce attiva I h durante l'IBI; notare il livello massimo di Ih vicino all'inizio del burst (Figura 2).
Sebbene il modello HN in tempo reale abbia tutte le correnti2,4 disponibili per il serraggio dinamico, l'attenzione qui era su  e , che sono disponibili per le modifiche
e , che sono disponibili per le modifiche  mentre il modello è in esecuzione nella GUI del morsetto dinamico ( Figura3). Il morsetto dinamico consente allo sperimentatore di aggiungere (o sottrarre con un negativo
mentre il modello è in esecuzione nella GUI del morsetto dinamico ( Figura3). Il morsetto dinamico consente allo sperimentatore di aggiungere (o sottrarre con un negativo 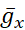
 o) qualsiasi conduttanza o corrente in un neurone artificialmente che imita la tensione e la dipendenza ionica di una conduttanza o corrente reale. Pertanto, è possibile esplorare appieno come una particolare conduttanza / corrente interagisce con le conduttanza / correnti endogene all'interno delle cellule (Figura 1). Il modello HN in tempo reale indica che la corrente Na+ persistente (IP) nei neuroni HN contribuisce a gran parte della voce Na+ influenzando fortemente [Na+]i (Figura 2) e quindi, pompa. Poiché IP è attivo a potenziali di membrana relativamente negativi, si oppone alla pompa I anche durante l'IBI.
o) qualsiasi conduttanza o corrente in un neurone artificialmente che imita la tensione e la dipendenza ionica di una conduttanza o corrente reale. Pertanto, è possibile esplorare appieno come una particolare conduttanza / corrente interagisce con le conduttanza / correnti endogene all'interno delle cellule (Figura 1). Il modello HN in tempo reale indica che la corrente Na+ persistente (IP) nei neuroni HN contribuisce a gran parte della voce Na+ influenzando fortemente [Na+]i (Figura 2) e quindi, pompa. Poiché IP è attivo a potenziali di membrana relativamente negativi, si oppone alla pompa I anche durante l'IBI.
Queste osservazioni indicano che è istruttivo esplorare le interazioni tra  e
e  in neuroni HN isolati con morsetto dinamico come discusso in precedenza8,9,10. Questi esperimenti (in corso) vengono eseguiti con registrazioni di microelettrodi taglienti in singoli neuroni HN(7) isolati sinapticamente (settimo ganglio reciso dal cordone nervoso). Ad oggi, questi esperimenti mostrano che lo scoppio robusto viene ripristinato nei neuroni HN tonicamente attivi (a causa della penetrazione del microelettrodo introdotta perdita) mediante co-aggiunta di pompa IP e I con morsetto dinamico (Figura 4). Questa è un'osservazione importante che indica che in questi neuroni è disponibile un meccanismo di scoppio (anche quando la perdita è compromessa) che deriva dall'interazione di Ipump e IP. I risultati preliminari indicano la loro forte interazione complicata, che può essere esplorata nel modello e negli esperimenti (Figura 5).
in neuroni HN isolati con morsetto dinamico come discusso in precedenza8,9,10. Questi esperimenti (in corso) vengono eseguiti con registrazioni di microelettrodi taglienti in singoli neuroni HN(7) isolati sinapticamente (settimo ganglio reciso dal cordone nervoso). Ad oggi, questi esperimenti mostrano che lo scoppio robusto viene ripristinato nei neuroni HN tonicamente attivi (a causa della penetrazione del microelettrodo introdotta perdita) mediante co-aggiunta di pompa IP e I con morsetto dinamico (Figura 4). Questa è un'osservazione importante che indica che in questi neuroni è disponibile un meccanismo di scoppio (anche quando la perdita è compromessa) che deriva dall'interazione di Ipump e IP. I risultati preliminari indicano la loro forte interazione complicata, che può essere esplorata nel modello e negli esperimenti (Figura 5).
In conclusione, pompare in risposta agli aumenti periodici di [Na+]i durante l'attività di scoppio contribuisce al ritmo di scoppio attraverso la terminazione di scoppio (diminuzione BD). L'interazione della pompa IP e I costituisce un meccanismo sufficiente a supportare l'attività di scoppio endogena; questo meccanismo può ripristinare robusti scoppi negli interneuroni HN registrati intracellulari nel ganglio 7. L'interazione tra IP e Ipompa attraverso [Na+]i influisce sul periodo di scoppio HN in modo non monotono e garantisce la robustezza dello scoppio autonomo. Queste conclusioni sono in linea con gli esperimenti e la modellazione nei sistemi vertebrati11,12.
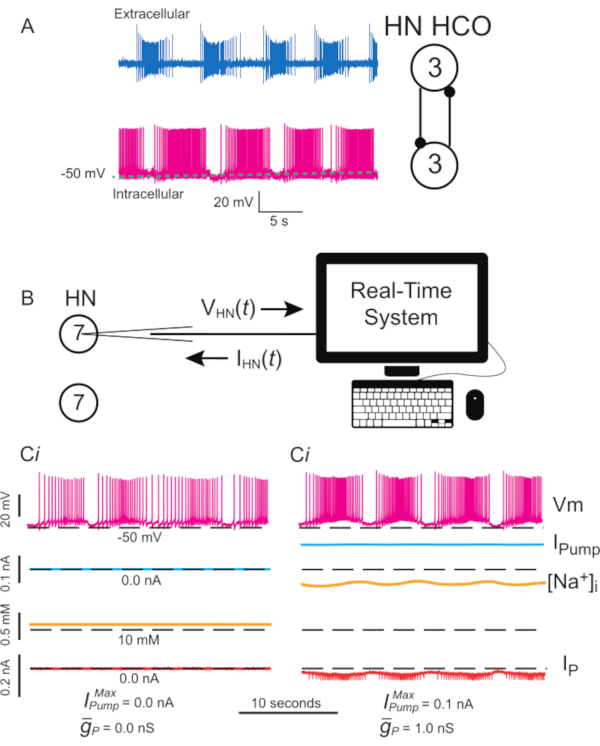
Figura 1: Attività elettrica dell'interneurone del cuore di sanguisuga e implementazione della pompa I e della P con morsetto dinamico. (A) Normale attività di scoppio registrata simultaneamente, extracellulare (in alto) e intracellulare (in basso), in un battito cardiaco sanguisuga HCO da un terzo ganglio, uno schema dei neuroni registrati e le loro connessioni sinaptiche reciprocamente inibitorie a destra. (B) Schema dinamico del morsetto quando si registra un interneurone HN(7) in un ganglio isolato 7; si noti che non vi è alcuna interazione sinaptica tra i due interneuroni HN(7). (Ci) Scoppio in un interneurone HN(7) compromesso dalla perdita. (Cii) Uno scoppio più robusto può essere prodotto aggiungendo la pompa dinamica a morsetto I (  = 0,1 nA), che compensa la perdita indotta dal microelettrodo, ma deprime l'eccitabilità e
= 0,1 nA), che compensa la perdita indotta dal microelettrodo, ma deprime l'eccitabilità e  (1 nS), che aumenta l'eccitabilità. Le linee tratteggiate nere indicano i valori della linea di base. Abbreviazioni: HN = cuore interneurone; HCO = oscillatore semicentro; Pompa I = corrente verso l'esterno; IP = Na persistente+ corrente;
(1 nS), che aumenta l'eccitabilità. Le linee tratteggiate nere indicano i valori della linea di base. Abbreviazioni: HN = cuore interneurone; HCO = oscillatore semicentro; Pompa I = corrente verso l'esterno; IP = Na persistente+ corrente;  = namassimale +/K+ corrente della pompa;
= namassimale +/K+ corrente della pompa;  = conduttanza massima della corrente Na+ persistente; Vm = potenziale di membrana; [Na+] i = concentrazione interna di Na+. Fare clic qui per visualizzare una versione più grande di questa figura.
= conduttanza massima della corrente Na+ persistente; Vm = potenziale di membrana; [Na+] i = concentrazione interna di Na+. Fare clic qui per visualizzare una versione più grande di questa figura.
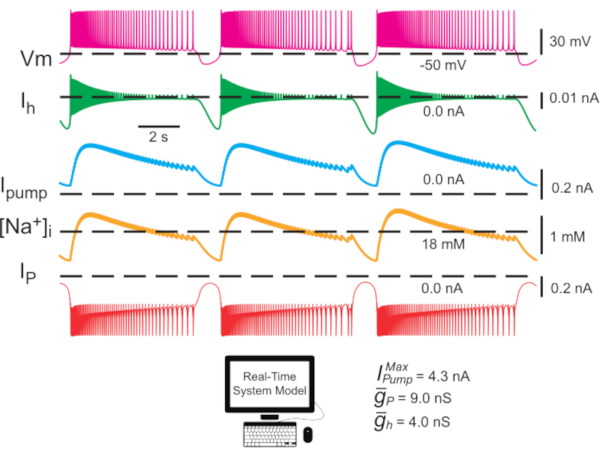
Figura 2: Singolo modello di interneurone HN che mostra tracce per potenziale di membrana (Vm), I h, Ipompa, [Na+]ie IP. Le correnti iperpolarizzanti verso l'esterno sono negative e le correnti depolarizzanti verso l'interno sono positive. Le linee tratteggiate nere indicano i valori della linea di base. Abbreviazioni: HN = cuore interneurone; Pompa I = corrente verso l'esterno; IP = Na persistente+ corrente;  = namassimale +/K+ corrente della pompa; Ih = corrente verso l'interno attivata dall'iperpolarizzazione;
= namassimale +/K+ corrente della pompa; Ih = corrente verso l'interno attivata dall'iperpolarizzazione;  = conduttanza massima della corrente Na+ persistente;
= conduttanza massima della corrente Na+ persistente; 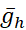 = conduttanza massima della corrente verso l'interno attivata dall'iperpolarizzazione; Vm = potenziale di membrana; [Na+] i = concentrazione interna di Na+. Fare clic qui per visualizzare una versione più grande di questa figura.
= conduttanza massima della corrente verso l'interno attivata dall'iperpolarizzazione; Vm = potenziale di membrana; [Na+] i = concentrazione interna di Na+. Fare clic qui per visualizzare una versione più grande di questa figura.
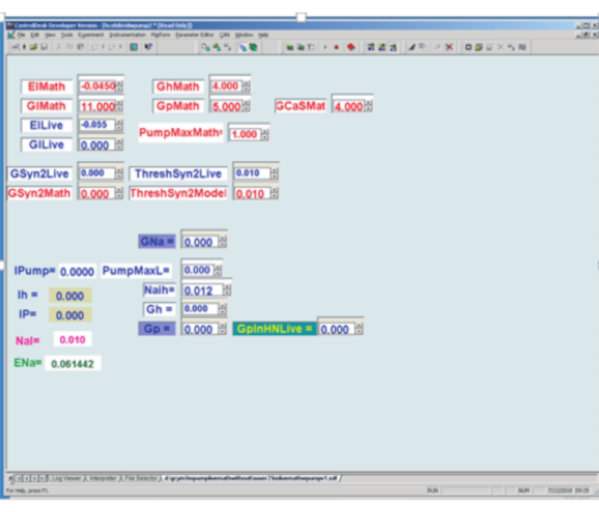
Figura 3: Interfaccia utente grafica del modello HN (Real-time heart interneuron) e morsetto dinamico implementati su una scheda di elaborazione del segnale digitale. In alto a sinistra: le caselle red Math sono caselle di parametri determinate dall'utente per il modello in tempo reale, mentre le caselle Blue Live sono caselle di parametri determinate dall'utente utilizzate nel morsetto dinamico. El = il potenziale di inversione della corrente di dispersione; Gl = conduttanza di perdita; Gh = conduttanza massima h-corrente; Gp = P conduttanza massima di corrente; GCaS = conduttanza massima della corrente di calcio lenta; PumpMax = corrente massima della pompa; [Conduttanza sinaptica massima di GSyn2 al rispettivo neurone; Soglia di attraversamento del picco ThreshSyn2 per mediare un potenziale sinaptico - questi usati per creare un oscillatore semicentro ibrido (vivente / modello) non illustrato qui.]. In basso a sinistra per morsetto dinamico. All'inizio a sinistra ci sono 5 valori calcolati di variabili dinamiche del morsetto: pompa I = corrente della pompa iniettata; Ih = h-corrente iniettata (non usata qui); IP = P corrente iniettata; NaI =na + concentrazione interna calcolata; ENa = potenziale di inversione del sodio calcolato. In basso a sinistra per morsetto dinamico. A destra delle variabili calcolate ci sono 6 caselle di parametri determinate dall'utente: GNa = uso della conduttanza massima del sodio veloce endogeno assunto per calcolare il flusso Na+ associato ai potenziali d'azione; PumpMaxL = corrente massima della pompa da iniettare mediante morsetto dinamico; Naih vedi equazione (2); Gh = conduttanza massima per determinare la corrente h da iniettare mediante morsetto dinamico; Gp = uso della conduttanza massima della corrente P endogena assunta per calcolare il flusso Na+ associato alla corrente P endogena; GpinHNLive = conduttanza massima per determinare la corrente P da iniettare mediante morsetto dinamico. Fare clic qui per visualizzare una versione più grande di questa figura.
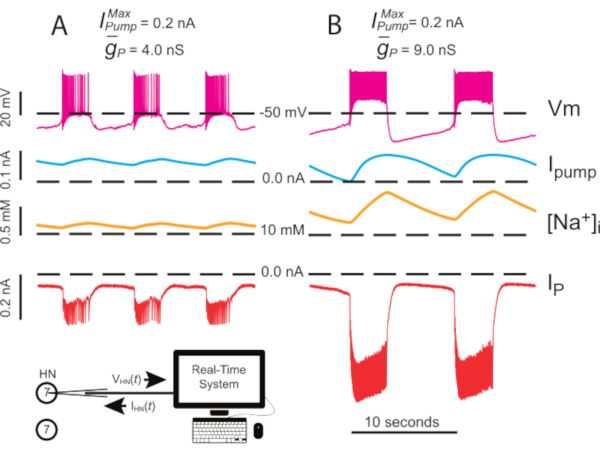
Figura 4: Analisi dinamica del morsetto di scoppio indipendente di HN(7). L'upregulation  da (A) 4.0 nS a (B) 9.0 nS rallenta il ritmo di scoppio HN indipendente. Le tracce sperimentali mostrano scoppi ritmica nel neurone HN(7) isolato con morsetto dinamico. Gli intervalli di oscillazione di [Na+]i e Vm aumentano con l'upregulated
da (A) 4.0 nS a (B) 9.0 nS rallenta il ritmo di scoppio HN indipendente. Le tracce sperimentali mostrano scoppi ritmica nel neurone HN(7) isolato con morsetto dinamico. Gli intervalli di oscillazione di [Na+]i e Vm aumentano con l'upregulated  . Tracce dall'alto verso il basso: Vm registrato, pompaIiniettata, calcolata [Na+]ie iniettata IP. Le linee tratteggiate nere indicano i valori della linea di base. Abbreviazioni: HN = cuore interneurone; Pompa I = corrente verso l'esterno; IP = Na persistente+ corrente;
. Tracce dall'alto verso il basso: Vm registrato, pompaIiniettata, calcolata [Na+]ie iniettata IP. Le linee tratteggiate nere indicano i valori della linea di base. Abbreviazioni: HN = cuore interneurone; Pompa I = corrente verso l'esterno; IP = Na persistente+ corrente;  = namassimale +/K+ corrente della pompa;
= namassimale +/K+ corrente della pompa;  = conduttanza massima della corrente Na+ persistente; Vm = potenziale di membrana; [Na+] i = concentrazione interna di Na+. Fare clic qui per visualizzare una versione più grande di questa figura.
= conduttanza massima della corrente Na+ persistente; Vm = potenziale di membrana; [Na+] i = concentrazione interna di Na+. Fare clic qui per visualizzare una versione più grande di questa figura.
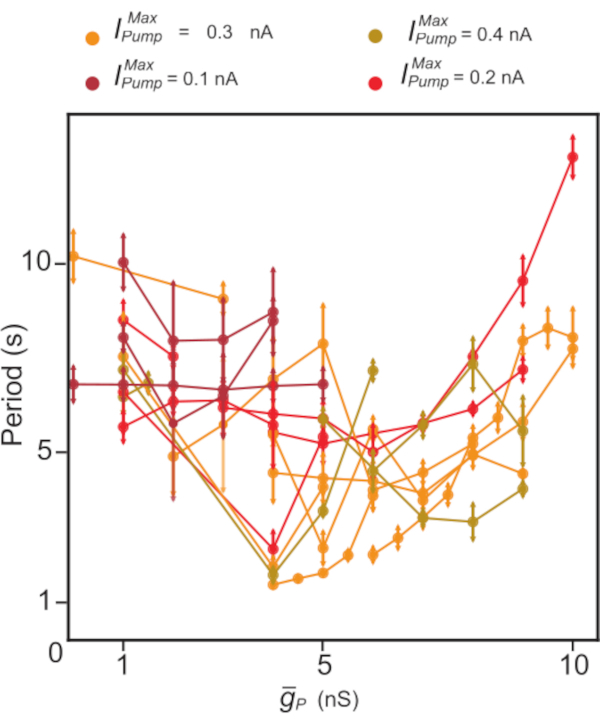
Figura 5: Analisi dinamica del morsetto di scoppio indipendente di HN(7). L'upregulation di  tende a diminuire, seguita da un aumento del periodo di scoppio HN. Nei singoli esperimenti (punti collegati da linee) usando il morsetto dinamico,
tende a diminuire, seguita da un aumento del periodo di scoppio HN. Nei singoli esperimenti (punti collegati da linee) usando il morsetto dinamico,  i valori sono stati spazzati mentre sono stati
i valori sono stati spazzati mentre sono stati  mantenuti costanti. I colori rappresentano diversi livelli costanti di aggiunta
mantenuti costanti. I colori rappresentano diversi livelli costanti di aggiunta  utilizzati in diversi esperimenti. Abbreviazioni: HN = cuore interneurone;
utilizzati in diversi esperimenti. Abbreviazioni: HN = cuore interneurone;  = namassimale +/K+ corrente della pompa;
= namassimale +/K+ corrente della pompa;  = conduttanza massima della corrente Na+ persistente. Fare clic qui per visualizzare una versione più grande di questa figura.
= conduttanza massima della corrente Na+ persistente. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
La modellazione, il morsetto dinamico e le analisi risultanti che abilitano sono tecniche utili per esplorare come individui e gruppi di conduttanza / correnti ioniche contribuiscono all'attività elettrica dei neuroni (Figura 1, Figura 2,Figura 4e Figura 5). L'uso di queste tecniche mostra come la corrente della pompa Na+/ K+ (pompaI) interagisce con le correnti voltaggio-4, in particolare la corrente Na+ persistente (IP), per promuovere un robusto scoppio nel nucleo del generatore di battito cardiaco della sanguisuga. Combinando esperimenti di morsetto dinamico e modellazione, è possibile testare i modelli in modo più diretto di quanto sia possibile con le normali tecniche di registrazione della tensione e di morsetto di corrente. I risultati raccolti dagli esperimenti di morsetto dinamico (Figura 5) saranno utilizzati per perfezionare ulteriormente il modello HN. Il metodo di base del serraggio dinamico qui dimostrato può essere personalizzato per riflettere le proprietà di qualsiasi neurone in studio se un modello matematico di correnti neuronali può essere determinato con esperimenti di morsetto di tensione.
Il completamento con successo degli esperimenti del tipo mostrato qui richiede un'attenta impalatura di un HN o di un altro neurone quando si utilizza un microelettrodo affilato, perché il forte scoppio è limitato dalla penetrazione dell'elettrodo1. (Le tecniche di registrazione dei cerotti a cellule intere, che riducono al minimo le perdite introdotte, sono applicabili anche ad altri neuroni, ma non funzionano bene sui neuroni delle sanguisuga.) È fondamentale che l'impalamento del neurone HN causi danni minimi al neurone (perdita aggiunta) e la resistenza all'input deve essere monitorata e deve essere nell'intervallo di 60-100 MOhms per esperimenti di successo4.
Il morsetto dinamico è una tecnica potente, ma ha limitazioni imposte dalla geometria neuronale perché le conduttanze artificiali sono implementate nel sito dell'elettrodo di registrazione - di solito il corpo cellulare - non nel sito in cui le correnti generatrici di ritmo sono solitamente localizzate5,6,10. Nei neuroni HN della sanguisuga, il corpo cellulare è elettricamente vicino alla zona di integrazione (neurite principale) del neurone in cui sono localizzate le correnti più attive e vengono avviati i picchi.
Divulgazioni
Nessuno
Riconoscimenti
Ringraziamo Christian Erxleben per gli esperimenti preliminari di morsetto dinamico sui neuroni HN(7) che hanno dimostrato le loro capacità di scoppio. Angela Wenning ha aiutato gli esperimenti con la consulenza di esperti. Riconosciamo il NIH per aver finanziato questo lavoro attraverso grant 1 R21 NS111355 a GSC e RLC.
Materiali
| Name | Company | Catalog Number | Comments |
| ANIMALS | |||
| Hirudo verbana | Leech.com, https://www.leech.com/collections/live-leeches | live leeches 2-3 grams | |
| CHEMICALS | |||
| ARTIFICIAL POND WATER | |||
| CaCl2 | Sigma Aldrich | C5670-100G | 1.8 mM add last after adjusting pH |
| glucose | Sigma Aldrich | G7021-100G | 10 mM |
| HEPES | Sigma Aldrich | H4034-100G | 10 mM |
| Instant Ocean (sea salt ) | Spectrum Brands Inc., Madison, WI | 0.05% (w/v) diluted in deionized water | |
| KCl | Sigma Aldrich | P9333-500G | 4 mM |
| NaCl | Sigma Aldrich | S7653-250G | 115 mM |
| NaOH 0.1 N Solution | Sigma Aldrich | 2105-50ML | Adjust to pH 7.4 with NaOH |
| MICROELECTRODES | |||
| K Acetate | Sigma Aldrich | P1190-100G | 2 M |
| KCl | Sigma Aldrich | P9333-500G | 20 mM |
| SALINE | |||
| EQUIPMENT | |||
| #5 Forceps | Fine Science Tools Dumont | 11251-30 OR 11251-20 | For general leech dissection |
| AxoClamp 2A/2B DCC electrometer | Axon Instruments Molecular Devices | 2A/2B | For recording of neuronal membrane potential and discontinuous current clamp |
| Black resin | Dow Sylguard | 170 | Lines general dissect dish |
| Capilary glass 1 mm outer diameter, 0.75 mm inner diameter | A-M Systems | 615000 | For fabricating sharp microelectrodes |
| Clear resin | Dow Sylguard | 184 | Lines Petri dish used to mount ganglion for electrophysilogy |
| Dark field condenser | Nikon | Dry 0.95-0.80 MBL 1210 | For illuminating the ganglion preparation during cell impalement |
| Digidata 1440A | Axon CNS Molecular Devices | 1440A | Performs A to D and D to A for data acquisition and stimulation during electrophysiology |
| Digital signal processing board | dSpace | CLP1104 | Our software implements all the conductances/currents in our model HN neuron on a DS1103 dSPACE PPC Controller Board in real-time at a rate of 20 kHz with a ControlDesk GUI (dSPACE, Paderborn, Germany)9. |
| Falming/Brown Microelectrode Puller | Sutter Instruments | P-97 | For fabricating sharp microelectrodes |
| Fiber-Lite high intensity illuminator | Dolan Jenner Industries | 170D | For illuminating the general dissection and for illuminating the ganglion preparation during cell impalement |
| Headstage amplifier for AxoClamp 2A | Axon Instruments | HS-2A Gain:0.1LU | Now part of Molecular Devices for recording of neuronal membrane potential and discontinuous current clamp |
| Light guide | Dolan Jenner Industries | Rev R 38 08 3729107 | For illuminating the general dissection and for illuminating the ganglion preparation during cell impalement |
| Micromanipulator | Sutter Instruments | MPC-385 | Micromanipulator for cell impalement with microelectrodes |
| Micromanipulator controller | Sutter Instruments | MPC-200 | Controls micromanipulators for cell impalement with microelectrodes |
| Minuten pins | BioQuip | 0.15 mm diameter 1208SA | Should be shortened by curtting to ~5 mm |
| Optical Breadboard 3' x 5' x 8" | Newport | Obsolete | With the 4 pneumatic Isolators below used to construct a vibration free workspace for electrophysiology |
| Oscilloscope | HAMEG Instruments | HM303-6 | To monitor electrode setteling during DCC |
| Pascheff-Wolff spring scissors | Moria | Supplied by Fine Science Tools (Foster City, CA) catalog # 15371-92 | |
| pClamp 9 Software | Axon Instruments | 9 | Now part of Moleculear Devices uses the Digidata 1440 for data acquisition and stimulation during electrophysiology |
| Pneumatic Isolators 28" | Newport | Obsolete | With optical breadboard used to construct a vibration free workspace for electrophysiology |
| Simulink / MATLAB software | MathWorks | 2006 (Obsolete) | Implements dynamic clamp on the digital signal processing board |
| Stereomicroscope | Wild | M5A | 10x Eye Pieces used for dissecting the leech and removingand desheathing ganglia |
| Steromicroscope | Wild | M5 | 20x Eye Pieces used in electrophysiologcal station to visualize neuron for microelectrode penetration |
| Student Vannas Spring Scissors | Fine Science Tools | 91500-09 | For general leech dissection |
Riferimenti
- Cymbalyuk, G. S., Gaudry, Q., Masino, M. A., Calabrese, R. L. Bursting in leech heart interneurons: cell-autonomous and network-based mechanisms. Journal of Neuroscience. 22, 10580-10592 (2002).
- Hill, A. A., Lu, J., Masino, M. A., Olsen, O. H., Calabrese, R. L. A model of a segmental oscillator in the leech heartbeat neuronal network. Journal of Computational Neuroscience. 10, 281-302 (2001).
- Tobin, A. E., Calabrese, R. L. Myomodulin increases Ih and inhibits the NA/K pump to modulate bursting in leech heart interneurons. Journal of Neurophysiology. 94, 3938-3950 (2005).
- Kueh, D., Barnett, W. H., Cymbalyuk, G. S., Calabrese, R. L. Na(+)/K(+) pump interacts with the h-current to control bursting activity in central pattern generator neurons of leeches. eLife. 5, 19322(2016).
- Sharp, A. A., O'Neil, M. B., Abbott, L. F., Marder, E. Dynamic clamp: computer-generated conductances in real neurons. Journal of Neurophysiology. 69, 992-995 (1993).
- Prinz, A. A., Abbott, L. F., Marder, E. The dynamic clamp comes of age. Trends in Neuroscience. 27, 218-224 (2004).
- Barnett, W., Cymbalyuk, G. Hybrid systems analysis: real-time systems for design and prototyping of neural interfaces and prostheses. Biohybrid systems: nerves, interfaces, and machines. Jung, R. , Wiley VCH Verlag. Weinheim. 115-138 (2011).
- Sorensen, M., DeWeerth, S., Cymbalyuk, G., Calabrese, R. L. Using a hybrid neural system to reveal regulation of neuronal network activity by an intrinsic current. Journal of Neuroscience. 24, 5427-5438 (2004).
- Olypher, A., Cymbalyuk, G., Calabrese, R. L. Hybrid systems analysis of the control of burst duration by low-voltage-activated calcium current in leech heart interneurons. Journal of Neurophysiology. 96, 2857-2867 (2006).
- Calabrese, R. L., Prinz, A. A. Realistic modeling of small neuronal networks. Computational Modeling Methods for Neuroscientists. DeSchutter, E. , MIT Press. MA, USA. 285-316 (2010).
- Rybak, I. A., Molkov, Y. I., Jasinski, P. E., Shevtsova, N. A., Smith, J. C. Rhythmic bursting in the pre-Bötzinger complex: mechanisms and models. Progress in Brain Research. 209, 1-23 (2014).
- Picton, L. D., Nascimento, F., Broadhead, M. J., Sillar, K. T., Miles, G. B. Sodium pumps mediate activity-dependent changes in mammalian motor networks. Journal of Neuroscience. 37, 906-921 (2017).
Erratum
Formal Correction: Erratum: Contribution of the Na+/K+ Pump to Rhythmic Bursting, Explored with Modeling and Dynamic Clamp Analyses
Posted by JoVE Editors on 7/28/2021. Citeable Link.
An erratum was issued for: Contribution of the Na+/K+ Pump to Rhythmic Bursting, Explored with Modeling and Dynamic Clamp Analyses. An author name was updated.
The name of the first author was updated from:
Ricardo Javier Erazo Toscano
to:
Ricardo Javier Erazo-Toscano
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon