Method Article
Вклад насоса Na+/ K+ в ритмическое разрывное лопание, исследованный с помощью моделирования и динамического анализа зажима
В этой статье
Erratum Notice
Резюме
Здесь представлен метод исследования ролей насоса Na+/ K+ и постоянного тока Na+ в интернейронах сердца пиявки с использованием динамического зажима.
Аннотация
Насос Na+/ K+, часто считающийся фоновой функцией в нейронной активности, вносит внешний ток(Iнасос),который реагирует на внутреннюю концентрацию Na+ ([Na+]i). В разрывающихся нейронах, таких как те, которые находятся в нейронных сетях центрального генератора паттернов (CPG), которые производят ритмические движения, можно ожидать, что [Na+]i и, следовательно,насосI , будут изменяться на протяжении всего цикла всплеска. Эта реакция на электрическую активность в сочетании с независимостью от мембранного потенциала наделяет I насос динамическими свойствами, не общими для токов на основе каналов (например, каналов с напряжением или передатчиком или протекающих каналов). Более того, во многих нейронах активность насоса модулируется различными модуляторами, что еще больше расширяет потенциальную роль I-насоса в ритмической разрывной активности. В данной работе показано, как использовать комбинацию методов моделирования и динамического зажима для определения того, как янакачиваю и его взаимодействие с постоянным Na+ током влияния ритмической активности в ЦПГ. В частности, в этой статье основное внимание будет уделено протоколу динамического зажима и методам вычислительного моделирования в интернейронах сердца лекарственных пиявок.
Введение
Сердцебиение у пиявок управляется CPG, состоящим из 9 двусторонних пар сердечных интернейронов (HNs), распределенных по столько же сегментарных ганглиев среднего тела. В ядре ЦПГ находятся взаимно тормозные пары интернейронов, расположенных в3-м и 4-м сегментаральныхганглиях, образующих полуцентровые осцилляторы (ГКО)(рисунок 1А). Эти нейроны продолжают лопаться при синаптически изолировании фармакологически с использованием бикукулина1. Другие, такие как пара в7-х сегментных ганглиях (фокус этого протокола), также являются разрывными, способными производить разрывную активность при синаптически изолированном. Они не связаны друг сном и получают только нисходящий вход, и поэтому легко изолируются путем разрыва ганглия от остальной части нервного кана. Эта независимая разрывная активность чувствительна к введению тока утечки, вызванного проникновением с острыми микроэлектродами для записи, но энергично лопается при регистрации методами рыхлого пластыря1.
Были смоделированы как отдельные нейроны HN, так и HN HCP (модели одного изопотенциального компартмента нейронов HN на основе Ходжкина-Хаксли, содержащие все экспериментально идентифицированные напряжения и синаптические токи), и все характеристики всплеска живой системы были успешно захвачены2. Миомодулин, эндогенный нейропептид у пиявок, заметно уменьшает период (Т) ритма разрыва изолированных нейронов HN и HN HPO. Этот модулятор действует для увеличения h-тока (гиперполяризационный активируемый внутренний ток, Iч)и для уменьшения Iнасоса3. Это наблюдение привело к исследованию того, как Ipump взаимодействует с Ih,и как их комодуляция способствует ритмической активности нейронов HN. Активация насоса путем увеличения [Na+]i (с использованием моненсина ионофора) ускоряет ритм всплеска HN как в HN HCP, так и в изолированных нейронах HN4. Это ускорение зависело от Iч. Когда Iч блокировался (2 мМCs+),период разрыва не изменялся этим методом активации насоса; однако продолжительность всплеска (BD) была сокращена, а интервал между вспышками (IBI) увеличился как в HN HCP, так и в изолированных нейронах HN4.
Для этого протокола все токи живого нейрона HN(7), включая ток насоса, Iнасос,включаются в модель HN следующим образом:
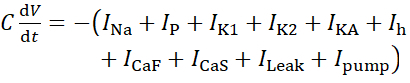 (1)
(1)
где C — емкость мембраны (в nF), V — мембранный потенциал (в V), t — время (в s). Подробные описания и уравнения ионных токов были описаны в других местах2,4. Полная модель нейрона модели HN работает в режиме реальноговремени (рисунок 2). Программное обеспечение будет доступно на GitHub после публикации и будет подходить для работы на плате цифровой обработки сигналов,описанной в Таблице материалов. Здесь в центре внимания находится ток насоса Na+/ K+ (насосI)и токи с напряжением, способствующие значительному потоку Na+: быстрый ток Na+ (INa)и постоянный Ток Na+ (IP). Максимальные проводимости этих токов 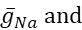
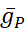 соответственно. Насос Na+/ K+ обменивает три внутриклеточных иона Na+ на два внеклеточных K+ иона, тем самым производя чистый внешний ток. Важно отметить, что он выкачивает в 3 раза больше Na+ из нейрона, чем указывает этот ток, что важно для расчета внутриклеточной концентрации Na+.
соответственно. Насос Na+/ K+ обменивает три внутриклеточных иона Na+ на два внеклеточных K+ иона, тем самым производя чистый внешний ток. Важно отметить, что он выкачивает в 3 раза больше Na+ из нейрона, чем указывает этот ток, что важно для расчета внутриклеточной концентрации Na+.
Ток насоса Na+/K+зависит от внутриклеточных концентрацийNa+ и выражается следующей сигмоидальной функцией:
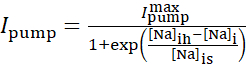 (2)
(2)
где [Na]i — внутриклеточная концентрация Na+,  — максимальный ток насоса Na+/K+, [Na]ih — внутриклеточная концентрация Na+ для полуактивации насоса Na+/K+, а [Na]— чувствительность насоса Na+/K+ к [Na]i. [Na]i строится в результате притоков Na+, переносимых IP и INa, и уменьшается Na+ оттоком Na+/ K+ насоса. Вклад Ih и ILeak в общий потокNa+ невелик и не учитывается в модели реального времени.
— максимальный ток насоса Na+/K+, [Na]ih — внутриклеточная концентрация Na+ для полуактивации насоса Na+/K+, а [Na]— чувствительность насоса Na+/K+ к [Na]i. [Na]i строится в результате притоков Na+, переносимых IP и INa, и уменьшается Na+ оттоком Na+/ K+ насоса. Вклад Ih и ILeak в общий потокNa+ невелик и не учитывается в модели реального времени.
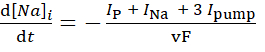 (3)
(3)
где, v — объем (~6,7 пЛ) внутриклеточногоNa+ резервуара, F — постоянная Фарадея, а внеклеточная концентрация Na+ поддерживается постоянной.
Дифференцированы проводимость с напряжением и утечкой - они реагируют на мембранный потенциал - от тока насоса, который регулируется расчетной внутриклеточной концентрацией Na+ ([Na+]i). [На+] i строится через вход Na+ через быстрый ток Na+ (INa),который производит потенциалы действия (пики) и постоянный Ток Na+ (IP),который обеспечивает деполяризацию для поддержки всплеска. [На+] i, в свою очередь, уменьшается под действием насоса через экструзиюNa+. Были приняты исходные значения HN  (5nS) и
(5nS) и 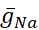 (150 nS), и мы учитываем любой добавленный динамический
(150 nS), и мы учитываем любой добавленный динамический  зажим.
зажим.
Цель протокола, описанного здесь, состоит в том, чтобы манипулировать I насосом точно и обратимо в режиме реального времени, чтобы обнаружить, как он взаимодействует с токами с напряжением (постоянный ток Na+ в текущем протоколе) для управления ритмическим разрывом в одиночных ХН. Для достижения этой цели был использован динамический зажим, который искусственно вводит по команде точное количество любого тока, который может быть рассчитан по мере работы модели. Этот метод имеет преимущества перед фармакологическими манипуляциями с насосом, который влияет на всю ткань, может иметь нецелевые эффекты, которые часто трудно обратить вспять, и которыми нельзя точно манипулировать. Динамический зажим5,6 считывает напряжение записанного нейрона в режиме реальноговремени (рисунок 1B)и вычисляет и вводит в режиме реальноговремени величину любого тока на основе модельных уравнений и заданных значений любого 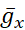 или
или  . Подобные методы могут быть легко применены к любому нейрону, который может быть записан внутриклеточным способом. Однако параметры должны быть перемасштабированы до выбранного нейрона, и нейрон должен быть изолирован от синаптических входов, например, фармакологически.
. Подобные методы могут быть легко применены к любому нейрону, который может быть записан внутриклеточным способом. Однако параметры должны быть перемасштабированы до выбранного нейрона, и нейрон должен быть изолирован от синаптических входов, например, фармакологически.
протокол
ПРИМЕЧАНИЕ: Предметы экспериментального исследования беспозвоночных животных не регулируются NIH или Университетами штата Эмори и Джорджия. Тем не менее, были приняты все меры, чтобы свести к минимуму страдания пиявок, используемых в этой работе.
1. Подготовьте изолированный ганглий 7 из пиявочного нервного канапа
- Выдерживайте пиявок Hirudo verbana в искусственной воде пруда (содержащей 0,05% мас./об.морской соли), разбавленной в деионизированной воде при 16 °C в светло-темном цикле 12:12.
- Подготовьте пиявок к рассечению, обезболив их холодным обезболиванием в ложе измельченного льда в течение >10 мин до неподвижности.
- Наполните черную, покрытую смолой рассекающую посуду на глубину ~1 см охлажденным физиологическим раствором, содержащим 115 мМ NaCl, 4 мМ KCl, 1,7 мМ CaCl2,10 мМ D-глюкозы и 10 мМ HEPES в деионизированной воде; pH скорректирован до 7,4 с 1 M NaOH. Приколоть дорсальную сторону пиявки вверх в камере, выстленной черной смолой (не менее 20 см х 10 см с глубиной не менее 2 см над смолой толщиной не менее 2 см).
- Под стеромикроскопом при 20-кратном увеличении с косой подсветкой световода сделайте продольный разрез длиной не менее 3 см пружинными ножницами 5 мм через стенку тела в ростральной1/3-й части тела. Используйте булавки, чтобы оттянуть в сторону стенку тела и обнажить внутренние органы.
ПРИМЕЧАНИЕ: Любая хранящаяся кровяная мука может быть удалена путем всасывания с помощью огнеполированной пипетки Пастера. - Выделяют отдельный ганглий среднего тела 7 (седьмой свободный сегментарный ганглий каудального к мозгу).
- Откройте синус, в котором находится нервный шнур, с помощью пружинных ножниц 5 мм. Обязательно разделите синус дорсально и вентрально, оставив две полоски пазухи. Используйте острые щипцы No 5, чтобы помочь направить реза и удерживать пазуху.
- Держите синус прикрепленным к каждому из двух двусторонних нервных корешков, которые выходят из ганглия (он плотно прилипает к каждому корню), чтобы использовать эти полоски синуса для закрепления ганглия.
- Удалите ганглий из тела, разрезав ростральные и каудальные соединительные нервные пучки, которые связывают ганглии (как можно дальше от7-го ганглия) и полоски пазух, а затем срежьте корни сбоку туда, где они выходят из пазухи.
- Закрепите ганглий (используя старые притупленные щипцы No 5) укороченными булавками насекомых, вентральной стороной вверх, в прозрачных, покрытых смолой чашках Петри. Вставьте булавки в полоски пазух и рыхлой ткани, прилипшие к корням и ростральным и каудальным соединениям, как можно дальше от ганглия.
ПРИМЕЧАНИЕ: Смола должна быть не толще 3 мм, если во время записи должно быть достигнуто хорошее освещение снизу. Убедитесь, что ганглий подтянут, как продольно, так и с боковой стороны - Увеличьте увеличение стереомикроскопа до 40x или более и отрегулируйте косую освещенность, чтобы тела нейронных клеток можно было легко увидеть на вентральной поверхности ганглия чуть ниже периневриума.
- Удалите периневрию ганглия (дешину) микроцизисторами.
- Начните дешейтинг, разрезав свободную оболочку между корнями с одной стороны, и продолжайте разрез сбоку с другой стороны, следя за тем, чтобы лезвия ножниц были поверхностными и не повредили тела нейронных клеток непосредственно под оболочкой.
- Сделайте аналогичный поверхностный срез каудально из бокового разреза вдоль средней линии.
- Теперь возьмите каудолатеральный лоскут оболочки с одной стороны с помощью тонких щипцов No 5, оттяните его от ганглия и отрежьте его микроциссорами.
- Повторите на другой стороне; эта процедура подвергает оба нейрона HN(7) для записи с помощью микроэлектродов.
- Поместите блюдо для приготовления в регистривную установку и налейте физиологическим раствором со скоростью потока 5 мл/мин при комнатной температуре.
2. Идентификация и запись интернейронов сердца пиявки с острыми микроэлектродами
- В течение всего времени записи нейрона HN(7) (записи длятся от 30 до 60 мин) приобретайте и оцифровывайте внутриклеточные следы тока и напряжения от выборки нейрофизиологического электрометра со скоростью 5 кГц с помощью цифровой системы сбора данных (Analog to Digital, A to D) и стимуляции (Digital to Analog, D to A), и отображение на экране компьютера.
ПРИМЕЧАНИЕ: Для сбора данных можно использовать любое коммерческое или специально созданное программное обеспечение и плату A-D/D to A (от A до D). Для динамического зажима требуется от D до A и специально созданное программное обеспечение. - Под стеромикроскопом в 50-100x с подсветкой темного поля снизу предварительно идентифицируют нейрон HN(7) двусторонней пары по его каноническому расположению в заднеполостном положении в среднем ганглиозе седьмого тела.
- Теперь стремитесь проникнуть в мнимый нейрон HN(7) с помощью острого микроэлектрода, заполненного 2 М ацетата калия и 20 мМ KCl с помощью микроманипулятора.
- Поместите микроэлектрод очень близко к телу клетки-мишени.
- Непрерывно наблюдайте зарегистрированный потенциал с помощью электрометра и устанавливайте этот потенциал на ноль мВ перед проникновением в нейрон.
- Проникайте в нейрон с помощью микроэлектрода, медленно приводя электрод вдоль его длинной оси с манипулятором. С помощью функции жужжания электрометра установите продолжительность гудение 100 мс до тех пор, пока не будет наблюдаться отрицательный сдвиг мембранного потенциала и активная пиковая активность.
- Установите электрометр в прерывистый режим тока-зажима (DCC) ≥ 3 кГц для одновременной регистрации мембранного потенциала и пропуска тока с помощью одного микроэлектрода (компенсация емкости установлена чуть ниже звонка, а затем набирается обратно 10%).
- Следите за оседанием электрода во время DCC на осциллографе.
- Впрыскивайте постоянный ток -0,1 нА с помощью инжектора постоянного тока электрометра в течение минуты или двух для стабилизации записи.
- Окончательно идентифицировать нейрон HN(7) по характерной форме шипа и слабой расщеливающей активности(рисунок 1Ci).
- После завершения эксперимента выполните анализ данных в автономном режиме и сохраните все данные на диске.
3. Постройте HN в реальном времени или другой модельный нейрон
- Создание пользовательского программного обеспечения с использованием платы цифровой обработки сигналов (DSB; D к A и от A до D) в настольного компьютера для реализации в режиме реального времени модельныхтоков,описанных в2,4 или различных модельных токах для других нейронов или экспериментов.
- Используйте уравнения в стиле Ходжкина-Хаксли, поскольку они являются обычно предпочтительным методом представления течений модели.
- Смотрите7 для подробного описания реализации модели HN в реальном времени и динамического зажима до добавления тока насоса. Обратитесь к разделу введения для описания токов, внутриклеточной концентрацииNa+ и проводимости живого нейрона HN(7) в модели HN.
4. Реализуйте и изменяйте динамические проводки/токи зажима
- Используйте специально созданное программное обеспечение динамического зажима для DSB для реализации и изменения в реальном времени динамического зажима любого графического пользовательского интерфейса(рисунок 3)(GUI) - доступные, запрограммированная проводимость и токи модели HN в реальном времени нейрона HN(7).
ПРИМЕЧАНИЕ: Напоминаем и
и  максимальной проводимостью постоянного токаNa+ (IP)и максимального тока насоса(Ipump)соответственно.
максимальной проводимостью постоянного токаNa+ (IP)и максимального тока насоса(Ipump)соответственно. - Используйте поля ввода графического интерфейса в программном обеспечении для внесения изменений по мере работы модели в
 (pumpMaxL box) и
(pumpMaxL box) и  (GpinHNLive box)(рисунок 3).
(GpinHNLive box)(рисунок 3).
ПРИМЕЧАНИЕ: Поля ввода графического интерфейса принимают типированные значения, и шаги 0,1 нА рекомендуются для .
. 
- Добавьте небольшое количество
 и
и  с динамическим зажимом для стабилизации разрыва нейрона HN(7), который ослабляется утечкой, вызванной микроэлектродами, как показано на рисунке 1Cii.
с динамическим зажимом для стабилизации разрыва нейрона HN(7), который ослабляется утечкой, вызванной микроэлектродами, как показано на рисунке 1Cii.
ПРИМЕЧАНИЕ: Резкое проникновение микроэлектрода вызывает повреждение мембраны, которое выражается в увеличении проводимости утечки или снижении входного сопротивления. - Начните с добавления значения
 0,1-0,2 нА, которое компенсирует утечку, вызванную микроэлектродами, но угнетает возбудимость, а затем постепенно
0,1-0,2 нА, которое компенсирует утечку, вызванную микроэлектродами, но угнетает возбудимость, а затем постепенно  увеличивается, что увеличивает возбудимость, пока не последует регулярный разрыв, обычно при
увеличивается, что увеличивает возбудимость, пока не последует регулярный разрыв, обычно при  ~1-4 нс(рисунок 4А).
~1-4 нс(рисунок 4А).
- Добавьте небольшое количество
- Систематически совместно изменять эти токи (приращения 0,1 нА для
 и 1 нс
и 1 нс  для) к зарегистрированным нейронам HN(7) с динамическим зажимом(рисунок 3)и оценивать их влияние на характеристики всплеска: частоту всплеска (f: обратную от среднего межшпийкового интервала во время всплеска), интервал межрыва (IBI: время между последним всплеском в одном всплеске до первого всплеска в следующем всплеске), длительность всплеска (BD: время между первым всплеском в всплеске и последним всплеском в всплеске) и период всплеска (T: время между первым всплеском в всплеске и первым всплеском в последующем всплеске).
для) к зарегистрированным нейронам HN(7) с динамическим зажимом(рисунок 3)и оценивать их влияние на характеристики всплеска: частоту всплеска (f: обратную от среднего межшпийкового интервала во время всплеска), интервал межрыва (IBI: время между последним всплеском в одном всплеске до первого всплеска в следующем всплеске), длительность всплеска (BD: время между первым всплеском в всплеске и последним всплеском в всплеске) и период всплеска (T: время между первым всплеском в всплеске и первым всплеском в последующем всплеске).- Измените значения

 и, как в видео-демонстрации, чтобы ознакомиться с техникой, а затем рискнуть выйти.
и, как в видео-демонстрации, чтобы ознакомиться с техникой, а затем рискнуть выйти.- Удерживайте
 при определенном фиксированном значении и развертывание с шагом 1 нс в
при определенном фиксированном значении и развертывание с шагом 1 нс в  диапазоне поддерживающих регулярную активность разрыва.
диапазоне поддерживающих регулярную активность разрыва. - Теперь увеличьте фиксированное значение
 на 0,1 нА и снова размахнуйте диапазон
на 0,1 нА и снова размахнуйте диапазон  поддерживающей регулярной разрывной активности.
поддерживающей регулярной разрывной активности. - Для каждой реализованной пары параметров соберите данные, содержащие не менее 8 всплесков, чтобы можно было сделать надежные средние измерения f, IBI, BD и T.
- Продолжайте развертки до тех пор, пока нейрон остается жизнеспособным, что оценивается сильным всплеском и стабильным базовым потенциалом колебаний.
- Соберите данные с нескольких нейронов (от разных животных) для создания составного графа(рисунок 5).
- Удерживайте
- Измените значения
Результаты
Моделирование с добавлением насосаI 4 привело экспериментальные результаты, представленные во вводном разделе, в более четкий фокус и начало объяснять насосный механизм разрыва. Модель реального времени, продемонстрированная здесь, была настроена 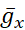 (и
(и  выбраны параметры) таким образом, что она производит регулярную ритмическую активность, попадающую в пределы нормальной активности, наблюдаемой в экспериментах - f, IBI, BD, T - и продолжает производить такую активность, когда параметры, модулированные миомодулином
выбраны параметры) таким образом, что она производит регулярную ритмическую активность, попадающую в пределы нормальной активности, наблюдаемой в экспериментах - f, IBI, BD, T - и продолжает производить такую активность, когда параметры, модулированные миомодулином  (максимальный ток насоса) и
(максимальный ток насоса) и 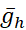 (максимальная проводимость h-тока), варьируются или колеблируются в модели. Заданные значения параметров могут быть использованы в качестве эталонного или канонического набора для экспериментов по моделированию. В этих модельных случаях насос I колеблется на протяжении всего цикла всплеска как [Na+]i вокруг базового уровня. Iнасос способствует прекращению разрыва во время фазы разрыва, а гиперполяризация, которую он производит, активирует Ih во время IBI; Обратите внимание на максимальный уровень Ih вблизи инициации всплеска(рисунок 2).
(максимальная проводимость h-тока), варьируются или колеблируются в модели. Заданные значения параметров могут быть использованы в качестве эталонного или канонического набора для экспериментов по моделированию. В этих модельных случаях насос I колеблется на протяжении всего цикла всплеска как [Na+]i вокруг базового уровня. Iнасос способствует прекращению разрыва во время фазы разрыва, а гиперполяризация, которую он производит, активирует Ih во время IBI; Обратите внимание на максимальный уровень Ih вблизи инициации всплеска(рисунок 2).
Хотя в модели HN в реальном времени реализованы все токи2,4, доступные для динамического зажима, акцент здесь был сделан на и , которые доступны  для
для  изменений, пока модель работает в динамическом зажиме GUI(рисунок 3). Динамический зажим позволяет экспериментатору искусственно добавлять (или вычитать с отрицательным
изменений, пока модель работает в динамическом зажиме GUI(рисунок 3). Динамический зажим позволяет экспериментатору искусственно добавлять (или вычитать с отрицательным 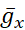
 или) любую проводимость или ток в нейрон, который имитирует напряжение и ионную зависимость реальной проводимости или тока. Таким образом, можно полностью исследовать, как конкретная проводимость/ток взаимодействует с эндогенными проводимостями/токами внутри клеток(рисунок 1). Модель HN в реальном времени показывает, что постоянный ток Na+ (IP)в нейронах HN вносит большую часть записи Na+, сильно влияющей на [Na+]i (рисунок 2)и, таким образом, накачкуI. Поскольку IP активен при относительно отрицательных мембранных потенциалах, он противостоит Ipump даже во время IBI.
или) любую проводимость или ток в нейрон, который имитирует напряжение и ионную зависимость реальной проводимости или тока. Таким образом, можно полностью исследовать, как конкретная проводимость/ток взаимодействует с эндогенными проводимостями/токами внутри клеток(рисунок 1). Модель HN в реальном времени показывает, что постоянный ток Na+ (IP)в нейронах HN вносит большую часть записи Na+, сильно влияющей на [Na+]i (рисунок 2)и, таким образом, накачкуI. Поскольку IP активен при относительно отрицательных мембранных потенциалах, он противостоит Ipump даже во время IBI.
Эти наблюдения показывают, что поучительно исследовать взаимодействия между  и
и  в изолированных нейронах HN с динамическим зажимом, как обсуждалосьранее 8,9,10. Эти эксперименты (продолжаются) проводятся с резкими микроэлектродными записями в одиночных, синаптически изолированных нейронах HN(7) (седьмой ганглий, оторванный от нервного канатика). На сегодняшний день эти эксперименты показывают, что надежное расщепление восстанавливается в тонально активных нейронах HN (за счет введенной утечки проникновения микроэлектрода) путем совместного добавления насоса IP и I с динамическим зажимом(рисунок 4). Это важное наблюдение, указывающее на то, что в этих нейронах доступен механизм разрыва (даже когда утечка скомпрометирована), который является результатом взаимодействия насоса I и IP. Предварительные результаты указывают на их сильное сложное взаимодействие, которое может быть исследовано в модели и экспериментах(рисунок 5).
в изолированных нейронах HN с динамическим зажимом, как обсуждалосьранее 8,9,10. Эти эксперименты (продолжаются) проводятся с резкими микроэлектродными записями в одиночных, синаптически изолированных нейронах HN(7) (седьмой ганглий, оторванный от нервного канатика). На сегодняшний день эти эксперименты показывают, что надежное расщепление восстанавливается в тонально активных нейронах HN (за счет введенной утечки проникновения микроэлектрода) путем совместного добавления насоса IP и I с динамическим зажимом(рисунок 4). Это важное наблюдение, указывающее на то, что в этих нейронах доступен механизм разрыва (даже когда утечка скомпрометирована), который является результатом взаимодействия насоса I и IP. Предварительные результаты указывают на их сильное сложное взаимодействие, которое может быть исследовано в модели и экспериментах(рисунок 5).
В заключение, Iнасос в ответ на периодическое увеличение [Na+]i во время разрывной активности способствует ритму разрыва через прекращение разрыва (уменьшение BD). Взаимодействие насоса IP и I представляет собой механизм, достаточный для поддержания эндогенной разрывной активности; этот механизм может восстановить устойчивый разрыв в интернейронах HN, зарегистрированных внутриклеточным образом в ганглии 7. Взаимодействие между IP и Ipump через [Na+]i влияет на период разрыва HN немонотонно и обеспечивает устойчивость автономного разрыва. Эти выводы соответствуют экспериментам и моделированию в системах позвоночных11,12.
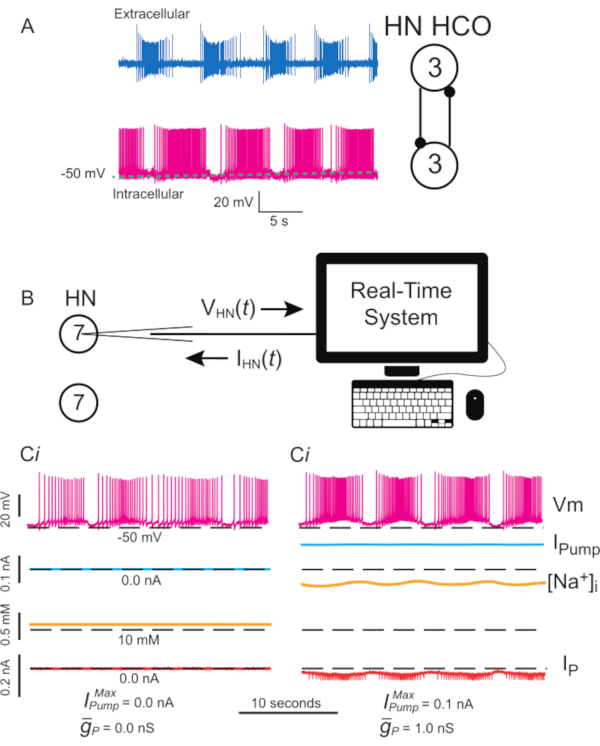
Рисунок 1:Электрическая активность интернейрона сердца пиявки и реализация Iнасоса и IP с динамическим зажимом. (А)Нормальная разрывная активность регистрируется одновременно, внеклеточно (сверху) и внутриклеточно (снизу), в пиявке сердцебиение HCO из третьего ганглия, схема зарегистрированных нейронов и их взаимно тормозных синаптических связей справа. (B)Схема динамического зажима при регистрации интернейрона HN(7) в изолированном ганглии 7; обратите внимание, что нет синаптического взаимодействия между двумя интернейронами HN(7). (Ci) Разрыв в герметичном интернейроне HN(7). (Сii) Более прочное разрывное щелчок может быть произведено путем добавления динамического зажима Iнасоса  (= 0,1 нА), который компенсирует утечку, вызванную микроэлектродами, но снижает возбудимость, и
(= 0,1 нА), который компенсирует утечку, вызванную микроэлектродами, но снижает возбудимость, и  (1 нс), что повышает возбудимость. Черные пунктирные линии обозначают базовые значения. Сокращения: HN = интернейрон сердца; HCO = полуцентровый осциллятор; Iнасос = внешний ток; IP = постоянный Na+ ток;
(1 нс), что повышает возбудимость. Черные пунктирные линии обозначают базовые значения. Сокращения: HN = интернейрон сердца; HCO = полуцентровый осциллятор; Iнасос = внешний ток; IP = постоянный Na+ ток;  = максимальный Na+/K+ ток насоса;
= максимальный Na+/K+ ток насоса;  = максимальная проводимость постоянного Na+ тока; Vm = мембранный потенциал; [На+] i = внутренняя концентрация Na+. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
= максимальная проводимость постоянного Na+ тока; Vm = мембранный потенциал; [На+] i = внутренняя концентрация Na+. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
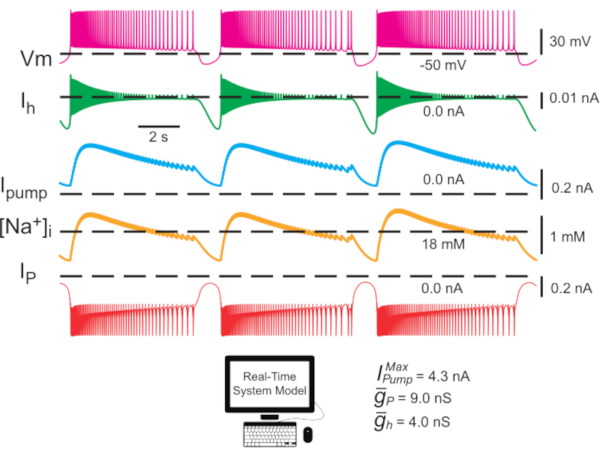
Рисунок 2:Модель одного интернейрона HN, показывающая следы мембранного потенциала (Vm), I h, Iнасоса,[Na+]iи IP. Внешние гиперполяризующие токи отрицательны, а внутренние деполяризующие токи положительны. Черные пунктирные линии обозначают базовые значения. Сокращения: HN = интернейрон сердца; Iнасос = внешний ток; IP = постоянный Na+ ток;  = максимальный Na+/K+ ток насоса; Ih = активируемый гиперполяризацией внутренний ток;
= максимальный Na+/K+ ток насоса; Ih = активируемый гиперполяризацией внутренний ток;  = максимальная проводимость постоянного Na+ тока;
= максимальная проводимость постоянного Na+ тока; 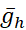 = максимальная проводимость гиперполяризационного активированного внутрь тока; Vm = мембранный потенциал; [На+] i = внутренняя концентрация Na+. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
= максимальная проводимость гиперполяризационного активированного внутрь тока; Vm = мембранный потенциал; [На+] i = внутренняя концентрация Na+. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
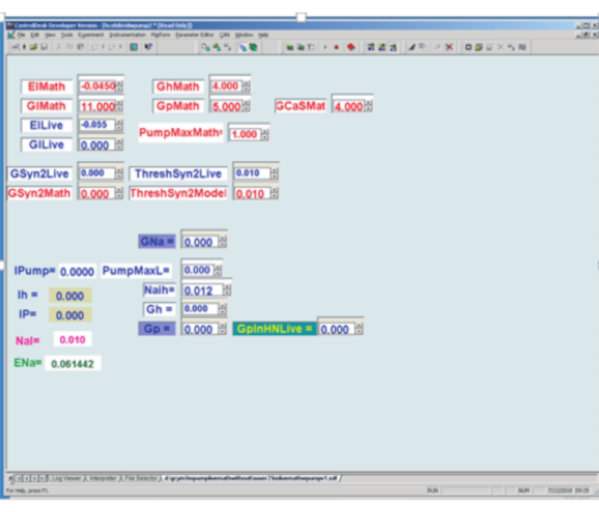
Рисунок 3:Графический пользовательский интерфейс модели интернейрона сердца в реальном времени (HN) и динамического зажима, реализованный на плате цифровой обработки сигналов. Верхний левый: Красные математические поля - это определяемые пользователем поля параметров для модели реального времени, тогда как синие живые поля - это определяемые пользователем поля параметров, используемые в динамическом зажиме. El = потенциал разворота тока утечки; Gl = проводимость утечки; Gh = максимальная проводимость h-тока; Gp = максимальная проводимость тока P; GCaS = максимальная проводимость тока медленного кальция; PumpMax = максимальный ток насоса; [GSyn2 максимальная синаптическая проводимость к соответствующему нейрону; Порог пересечения всплеска ThreshSyn2 для опосредования синаптического потенциала - они используются для создания гибридного (живого/модельного) полуцентрового осциллятора, не проиллюстрированные здесь.]. Внизу слева для динамического зажима. В самом левом углу находятся 5 вычисляемых значений динамических переменных зажима: Ipump = ток насоса, впрыскиваемый; Ih = h-ток впрыскивается (здесь не используется); IP = потребляемый ток P; NaI = расчетная внутренняя Na+ концентрация; ENa = расчетный потенциал обращения натрия. Внизу слева для динамического зажима. Справа от вычисляемых переменных находятся 6 определяемых пользователем поля параметров: GNa = предполагаемое использование эндогенной быстрой максимальной проводимости натрия для расчета Na+ потока, связанного с потенциалами действия; PumpMaxL = максимальный ток насоса, впрыскиваемый динамическим зажимом; Найх см. уравнение (2); Gh = максимальная проводимость для определения h-тока, впрыскиваемого динамическим зажимом; Gp = предполагаемое использование максимальной проводимости эндогенного P-тока для расчетаNa+ потока, связанного с эндогенным током P; GpinHNLive = максимальная проводимость для определения тока P, который должен быть введен динамическим зажимом. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
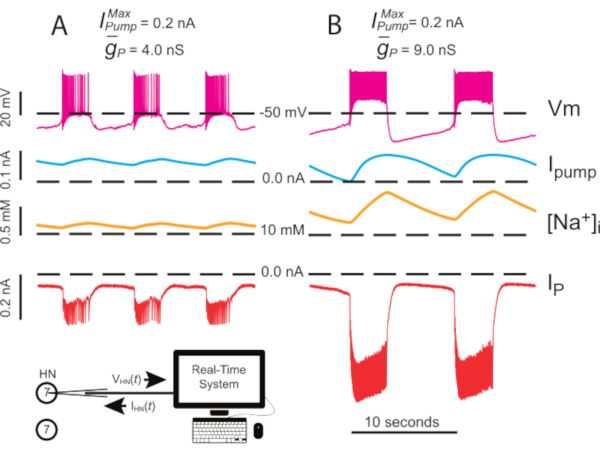
Рисунок 4:Динамический анализ зажима независимого разрыва HN(7). Апрегуляция  от(A)4,0 нС до(В)9,0 нС замедляет независимый ритм всплеска HN. Экспериментальные следы показывают ритмичное разрыв в изолированном нейроне HN(7) с динамическим зажимом. Диапазоны колебаний [Na+]i и Vm увеличиваются с повышением
от(A)4,0 нС до(В)9,0 нС замедляет независимый ритм всплеска HN. Экспериментальные следы показывают ритмичное разрыв в изолированном нейроне HN(7) с динамическим зажимом. Диапазоны колебаний [Na+]i и Vm увеличиваются с повышением  . Следы сверху вниз: записан Vm, впрыскивается Iнасос,вычисляется [Na+]i, и впрыскивается IP. Черные пунктирные линии обозначают базовые значения. Сокращения: HN = интернейрон сердца; Iнасос = внешний ток; IP = постоянный Na+ ток;
. Следы сверху вниз: записан Vm, впрыскивается Iнасос,вычисляется [Na+]i, и впрыскивается IP. Черные пунктирные линии обозначают базовые значения. Сокращения: HN = интернейрон сердца; Iнасос = внешний ток; IP = постоянный Na+ ток;  = максимальный Na+/K+ ток насоса;
= максимальный Na+/K+ ток насоса;  = максимальная проводимость постоянного Na+ тока; Vm = мембранный потенциал; [На+] i = внутренняя концентрация Na+. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
= максимальная проводимость постоянного Na+ тока; Vm = мембранный потенциал; [На+] i = внутренняя концентрация Na+. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
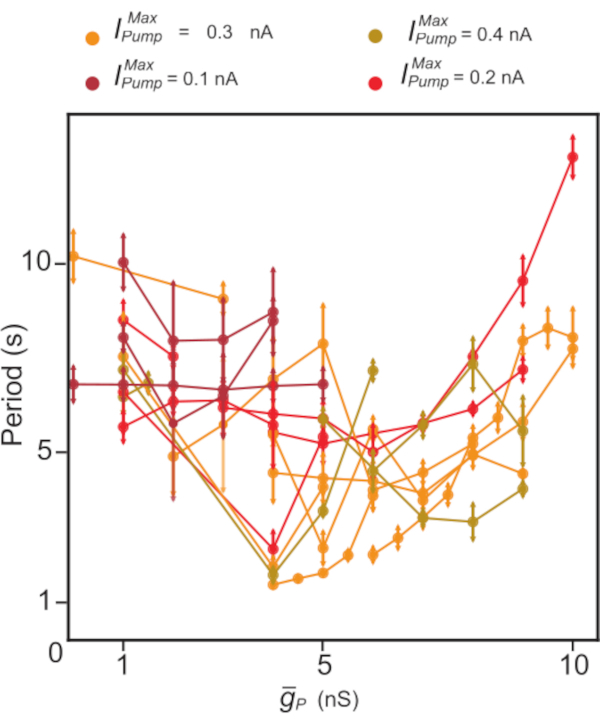
Рисунок 5:Динамический анализ зажима независимого разрыва HN(7). Повышение регуляции  имеет тенденцию к снижению, за которым следует увеличение периода всплеска HN. В отдельных экспериментах (точках, соединенных линиями) с использованием динамического зажима
имеет тенденцию к снижению, за которым следует увеличение периода всплеска HN. В отдельных экспериментах (точках, соединенных линиями) с использованием динамического зажима  значения были смещены, в то время как
значения были смещены, в то время как  удерживались постоянными. Цвета представляют различные постоянные уровни
удерживались постоянными. Цвета представляют различные постоянные уровни  добавленного, используемые в разных экспериментах. Сокращения: HN = интернейрон сердца;
добавленного, используемые в разных экспериментах. Сокращения: HN = интернейрон сердца;  = максимальный Na+/K+ ток насоса;
= максимальный Na+/K+ ток насоса;  = максимальная проводимость постоянного Na+ тока. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
= максимальная проводимость постоянного Na+ тока. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Моделирование, динамический зажим и результирующий анализ, который они позволяют, являются полезными методами для изучения того, как отдельные и группы ионной проводимости / токов способствуют электрической активности нейронов(рисунок 1, рисунок 2,рисунок 4и рисунок 5). Использование этих методов показывает, как ток насоса Na+/ K+ (насосI)взаимодействует с токами с напряжением, особенно постоянным током Na+ (IP),чтобы способствовать надежному разрыву в сердечнике генератора сердцебиения пиявки. Комбинируя эксперименты с динамическими зажимами и моделирование, можно тестировать модели более непосредственно, чем это возможно с помощью обычных методов регистрации напряжения и тока. Результаты, полученные в ходе экспериментов с динамическим зажимом(рисунок 5), будутиспользованы для дальнейшего уточнения модели HN. Основной метод динамического зажима, продемонстрированный здесь, может быть настроен для отражения свойств любого изучаемого нейрона, если математическая модель нейронных токов может быть определена с помощью экспериментов с зажимом напряжения.
Успешное завершение экспериментов показанного здесь типа требует тщательного прокалывания HN или другого нейрона при использовании острого микроэлектрода, поскольку сильное расщепление ограничивается проникновением электрода1. (Методы записи цельноклеточных патчей, которые минимизируют вводимую утечку, также применимы к другим нейронам, но не очень хорошо работают на нейронах пиявки.) Крайне важно, чтобы прокалывание нейрона HN нанесло минимальный ущерб нейрону (добавленная утечка), а входное сопротивление должно контролироваться и должно быть в диапазоне 60-100 МОм для успешных экспериментов4.
Динамический зажим является мощным методом, но он имеет ограничения, налагаемые геометриейнейронов,потому что искусственные проводимости реализуются в месте регистрирующего электрода - обычно тела клетки - а не в месте, где ритм-генерирующие токи обычно локализованы5,6,10. В нейронах HN пиявки тело клетки электрически близко к зоне интеграции (главному нейриту) нейрона, где локализуется наиболее активные токи и инициируются шипы.
Раскрытие информации
Никакой
Благодарности
Мы благодарим Кристиана Эркслебена за предварительные динамические эксперименты с зажимом на нейронах HN(7), которые продемонстрировали их разрывные способности. Анджела Веннинг помогала экспериментам советами экспертов. Мы благодарим NIH за финансирование этой работы через грант 1 R21 NS111355 GSC и RLC.
Материалы
| Name | Company | Catalog Number | Comments |
| ANIMALS | |||
| Hirudo verbana | Leech.com, https://www.leech.com/collections/live-leeches | live leeches 2-3 grams | |
| CHEMICALS | |||
| ARTIFICIAL POND WATER | |||
| CaCl2 | Sigma Aldrich | C5670-100G | 1.8 mM add last after adjusting pH |
| glucose | Sigma Aldrich | G7021-100G | 10 mM |
| HEPES | Sigma Aldrich | H4034-100G | 10 mM |
| Instant Ocean (sea salt ) | Spectrum Brands Inc., Madison, WI | 0.05% (w/v) diluted in deionized water | |
| KCl | Sigma Aldrich | P9333-500G | 4 mM |
| NaCl | Sigma Aldrich | S7653-250G | 115 mM |
| NaOH 0.1 N Solution | Sigma Aldrich | 2105-50ML | Adjust to pH 7.4 with NaOH |
| MICROELECTRODES | |||
| K Acetate | Sigma Aldrich | P1190-100G | 2 M |
| KCl | Sigma Aldrich | P9333-500G | 20 mM |
| SALINE | |||
| EQUIPMENT | |||
| #5 Forceps | Fine Science Tools Dumont | 11251-30 OR 11251-20 | For general leech dissection |
| AxoClamp 2A/2B DCC electrometer | Axon Instruments Molecular Devices | 2A/2B | For recording of neuronal membrane potential and discontinuous current clamp |
| Black resin | Dow Sylguard | 170 | Lines general dissect dish |
| Capilary glass 1 mm outer diameter, 0.75 mm inner diameter | A-M Systems | 615000 | For fabricating sharp microelectrodes |
| Clear resin | Dow Sylguard | 184 | Lines Petri dish used to mount ganglion for electrophysilogy |
| Dark field condenser | Nikon | Dry 0.95-0.80 MBL 1210 | For illuminating the ganglion preparation during cell impalement |
| Digidata 1440A | Axon CNS Molecular Devices | 1440A | Performs A to D and D to A for data acquisition and stimulation during electrophysiology |
| Digital signal processing board | dSpace | CLP1104 | Our software implements all the conductances/currents in our model HN neuron on a DS1103 dSPACE PPC Controller Board in real-time at a rate of 20 kHz with a ControlDesk GUI (dSPACE, Paderborn, Germany)9. |
| Falming/Brown Microelectrode Puller | Sutter Instruments | P-97 | For fabricating sharp microelectrodes |
| Fiber-Lite high intensity illuminator | Dolan Jenner Industries | 170D | For illuminating the general dissection and for illuminating the ganglion preparation during cell impalement |
| Headstage amplifier for AxoClamp 2A | Axon Instruments | HS-2A Gain:0.1LU | Now part of Molecular Devices for recording of neuronal membrane potential and discontinuous current clamp |
| Light guide | Dolan Jenner Industries | Rev R 38 08 3729107 | For illuminating the general dissection and for illuminating the ganglion preparation during cell impalement |
| Micromanipulator | Sutter Instruments | MPC-385 | Micromanipulator for cell impalement with microelectrodes |
| Micromanipulator controller | Sutter Instruments | MPC-200 | Controls micromanipulators for cell impalement with microelectrodes |
| Minuten pins | BioQuip | 0.15 mm diameter 1208SA | Should be shortened by curtting to ~5 mm |
| Optical Breadboard 3' x 5' x 8" | Newport | Obsolete | With the 4 pneumatic Isolators below used to construct a vibration free workspace for electrophysiology |
| Oscilloscope | HAMEG Instruments | HM303-6 | To monitor electrode setteling during DCC |
| Pascheff-Wolff spring scissors | Moria | Supplied by Fine Science Tools (Foster City, CA) catalog # 15371-92 | |
| pClamp 9 Software | Axon Instruments | 9 | Now part of Moleculear Devices uses the Digidata 1440 for data acquisition and stimulation during electrophysiology |
| Pneumatic Isolators 28" | Newport | Obsolete | With optical breadboard used to construct a vibration free workspace for electrophysiology |
| Simulink / MATLAB software | MathWorks | 2006 (Obsolete) | Implements dynamic clamp on the digital signal processing board |
| Stereomicroscope | Wild | M5A | 10x Eye Pieces used for dissecting the leech and removingand desheathing ganglia |
| Steromicroscope | Wild | M5 | 20x Eye Pieces used in electrophysiologcal station to visualize neuron for microelectrode penetration |
| Student Vannas Spring Scissors | Fine Science Tools | 91500-09 | For general leech dissection |
Ссылки
- Cymbalyuk, G. S., Gaudry, Q., Masino, M. A., Calabrese, R. L. Bursting in leech heart interneurons: cell-autonomous and network-based mechanisms. Journal of Neuroscience. 22, 10580-10592 (2002).
- Hill, A. A., Lu, J., Masino, M. A., Olsen, O. H., Calabrese, R. L. A model of a segmental oscillator in the leech heartbeat neuronal network. Journal of Computational Neuroscience. 10, 281-302 (2001).
- Tobin, A. E., Calabrese, R. L. Myomodulin increases Ih and inhibits the NA/K pump to modulate bursting in leech heart interneurons. Journal of Neurophysiology. 94, 3938-3950 (2005).
- Kueh, D., Barnett, W. H., Cymbalyuk, G. S., Calabrese, R. L. Na(+)/K(+) pump interacts with the h-current to control bursting activity in central pattern generator neurons of leeches. eLife. 5, 19322(2016).
- Sharp, A. A., O'Neil, M. B., Abbott, L. F., Marder, E. Dynamic clamp: computer-generated conductances in real neurons. Journal of Neurophysiology. 69, 992-995 (1993).
- Prinz, A. A., Abbott, L. F., Marder, E. The dynamic clamp comes of age. Trends in Neuroscience. 27, 218-224 (2004).
- Barnett, W., Cymbalyuk, G. Hybrid systems analysis: real-time systems for design and prototyping of neural interfaces and prostheses. Biohybrid systems: nerves, interfaces, and machines. Jung, R. , Wiley VCH Verlag. Weinheim. 115-138 (2011).
- Sorensen, M., DeWeerth, S., Cymbalyuk, G., Calabrese, R. L. Using a hybrid neural system to reveal regulation of neuronal network activity by an intrinsic current. Journal of Neuroscience. 24, 5427-5438 (2004).
- Olypher, A., Cymbalyuk, G., Calabrese, R. L. Hybrid systems analysis of the control of burst duration by low-voltage-activated calcium current in leech heart interneurons. Journal of Neurophysiology. 96, 2857-2867 (2006).
- Calabrese, R. L., Prinz, A. A. Realistic modeling of small neuronal networks. Computational Modeling Methods for Neuroscientists. DeSchutter, E. , MIT Press. MA, USA. 285-316 (2010).
- Rybak, I. A., Molkov, Y. I., Jasinski, P. E., Shevtsova, N. A., Smith, J. C. Rhythmic bursting in the pre-Bötzinger complex: mechanisms and models. Progress in Brain Research. 209, 1-23 (2014).
- Picton, L. D., Nascimento, F., Broadhead, M. J., Sillar, K. T., Miles, G. B. Sodium pumps mediate activity-dependent changes in mammalian motor networks. Journal of Neuroscience. 37, 906-921 (2017).
Erratum
Formal Correction: Erratum: Contribution of the Na+/K+ Pump to Rhythmic Bursting, Explored with Modeling and Dynamic Clamp Analyses
Posted by JoVE Editors on 7/28/2021. Citeable Link.
An erratum was issued for: Contribution of the Na+/K+ Pump to Rhythmic Bursting, Explored with Modeling and Dynamic Clamp Analyses. An author name was updated.
The name of the first author was updated from:
Ricardo Javier Erazo Toscano
to:
Ricardo Javier Erazo-Toscano
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены