Method Article
Interferencia de ARN en los escarabajos acuáticos como una poderosa herramienta para manipular la expresión génica en puntos de tiempo de desarrollo específicos
En este artículo
Resumen
La interferencia de ARN es una técnica ampliamente aplicable y poderosa para manipular la expresión génica en etapas específicas del desarrollo. Aquí, describimos los pasos necesarios para implementar esta técnica en el escarabajo de buceo acuático Thermonectus marmoratus,desde la adquisición de secuencias genéticas hasta el derribo de genes que afectan la estructura o el comportamiento.
Resumen
La interferencia de ARN (ARNi) sigue siendo una técnica poderosa que permite la reducción selectiva de la expresión génica a través de la degradación del ARNm. Esta técnica es aplicable a una amplia variedad de organismos y es altamente eficiente en el orden rico en especies Coleoptera (escarabajos). Aquí, resumimos los pasos necesarios para desarrollar esta técnica en un organismo novedoso e ilustramos su aplicación a las diferentes etapas de desarrollo del escarabajo de buceo acuático Thermonectus marmoratus. Las secuencias genéticas diana se pueden obtener de manera rentable mediante el montaje de transcriptomas contra un pariente cercano con genómica o de novo conocida. La clonación de genes candidatos utiliza un vector de clonación específico (el plásmido pCR4-TOPO), que permite la síntesis de ARN de doble cadena (dsRNA) para cualquier gen con el uso de una sola imprimación común. El dsRNA sintetizado se puede inyectar en embriones para procesos de desarrollo tempranos o larvas para procesos de desarrollo posteriores. A continuación, ilustramos cómo se puede inyectar ARNi en larvas acuáticas mediante inmovilización en agarosa. Para demostrar la técnica, proporcionamos varios ejemplos de experimentos de ARNi, generando derribos específicos con fenotipos predichos. Específicamente, el ARNi para el gen bronceado laccasa2 conduce a la iluminación de la cutícula tanto en larvas como en adultos, y el ARNi para el gen de pigmentación ocular blanco produce un aclaramiento / falta de pigmentación en los tubos oculares. Además, el derribo de una proteína de lente clave conduce a larvas con deficiencias ópticas y una capacidad reducida para cazar presas. Combinados, estos resultados ejemplifican el poder de los ARNi como herramienta para investigar tanto el patrón morfológico como los rasgos de comportamiento en organismos con solo bases de datos transcriptómicas.
Introducción
La cuestión de cómo los genes específicos contribuyen a la evolución de diversos rasgos es un tema emocionante en biología. En las últimas décadas, se ha avanzado mucho en cuanto a la disección de los fundamentos genéticos de los procesos de desarrollo en unos pocos organismos modelo, como el nematodo Caenorhabditis elegans,la mosca de la fruta Drosophila melanogaster,y el ratón de la casa Mus musculus1. Más recientemente, la invención de potentes técnicas de edición genética, como las repeticiones palindrómicas cortas agrupadas regularmente entrepacializadas (CRISPR)/Cas92, ha proporcionado la capacidad de cambiar el código genético de los organismos no modelo (porejemplo,véase3,4). Como resultado, ha habido un aumento en los estudios genéticos en una variedad de organismos que no habían sido abordados previamente a través de técnicas moleculares. Teniendo en cuenta la enorme diversidad de nuestro reino animal, con muchos rasgos interesantes o variaciones de rasgo que sólo se representan en especies específicas, este progreso lo ha convertido en un momento emocionante para el trabajo relacionado con la biología evo evo-desarrollo ("evo-devo"). Sin embargo, las técnicas de edición del genoma que están disponibles para los organismos no modelo están relativamente restringidas en lo que respecta a los puntos de tiempo de desarrollo a los que se pueden aplicar, lo que dificulta discernir las propiedades temporales relacionadas con el papel que desempeñan los genes específicos en cualquier rasgo. Además, las técnicas transgénicas a menudo se limitan a genes que no son esenciales para la supervivencia (es decir, cuyo nocaut no resulta en letalidad). Por lo tanto, si bien las técnicas de edición de genes han comenzado a ser populares, sigue siendo necesario contar con técnicas eficaces que sean aplicables a una variedad de organismos diferentes en puntos de tiempo de desarrollo específicos y faciliten derribos parciales (en lugar de una pérdida total de funciones). Aquí, llamamos la atención sobre la interferencia de ARN (ARNi), una técnica de derribo de genes5 algo anticuada pero potente que es particularmente valiosa como enfoque sinérgico para la edición de genes. En concreto, desarrollamos procedimientos que permiten la aplicación de ARNi a escarabajos de buceo acuático como ejemplo que ilustra la implementación de esta técnica, desde la adquisición de las secuencias moleculares necesarias hasta la inyección exitosa de ARN de doble cadena (dsRNA) en huevos y larvas.
El derribo genético basado en ARNi aprovecha un mecanismo de defensa innato de organismos, en el que las moléculas de dsRNA facilitan el silenciamiento de las secuencias de ácido nucleico invasoras, como virus y transposones6. En resumen, el dsRNA se toma en la célula, donde se corta en 20-25 trozos de nucleótidos por la enzima Dicer. Estas piezas activan la formación del complejo de silenciamiento inducido por ARN (RISC), que inhibe el ARNm objetivo mediante la unión a él en sitios específicos utilizando el hilo guía. Este proceso conduce en última instancia a la degradación del ARNm y por lo tanto interfiere con la traducción del ARNm en la proteína respectiva6. Por lo tanto, la técnica de derribo de genes basada en ARNi que se presenta aquí se basa en la inyección de dsRNA. Para los modelos animales, esta técnica fue desarrollada originalmente en C. elegans7 y D. melanogaster8, pero desde entonces ha surgido como una poderosa herramienta genética funcional en organismos no modelo9,,10. Debido a su naturaleza altamente eficaz en algunos insectos, RNAi incluso se puede aplicar en el manejo de plagas11.
Como herramienta de investigación, RNAi se ha utilizado para examinar cómo funcionan las vías clave de desarrollo molecular en modelos de insectos no tradicionales. Por ejemplo, el ARNi en el escarabajo de harina Tribolium castaneum ha sido fundamental para determinar cómo los genes profundamente conservados contribuyen a rasgos específicos en ese escarabajo, como se ejemplifica para el desarrollo de alas de forma específica12,13,14 y los ojos15,16. Las técnicas que subyacen a las manipulaciones en T. castaneum han sido bien descritas17 y dependen de la capacidad de inmovilizar huevos y larvas relativamente secos en una superficie pegajosa. Esta inmovilización, sin embargo, no es posible para las formas de desarrollo húmedo de organismos acuáticos como el Sunburst Diving Beetle Thermonectus marmoratus. Como es el caso de muchos organismos modelo no tradicional, carece de un genoma anotado. Para manipular la expresión génica en cualquier organismo sin un genoma, un primer paso razonable y rentable es generar transcriptomas e identificar las secuencias de nucleótidos putativos de los genes expresados de interés basados en la similitud de la secuencia con organismos modelo relacionados pero más establecidos, en este caso, principalmente genes Tribolium (Coleoptera) y Drosophila.
Aquí, para demostrar cómo el ARNi se puede utilizar en un organismo acuático, primero discutimos protocolos y software para la extracción de ARN y la generación y ensamblaje de transcriptomas, que permiten la identificación de secuencias genéticas específicas dirigidas. A continuación, resumimos los pasos necesarios para sintetizar dsRNA específico del gen. Posteriormente, ilustramos cómo se pueden inyectar los óvulos en un entorno acuático y demostramos los protocolos de incubación para el cultivo de embriones en desarrollo. Además, mostramos cómo el gel de agarosa se puede utilizar para inmovilizar completamente las larvas durante el proceso de inyección, una técnica que es generalmente útil durante varios procedimientos y podría aplicarse a una variedad de artrópodos. Para demostrar cómo se puede aplicar el ARNi a diferentes etapas del desarrollo, incluimos un ejemplo en el que silenciamos el gen de pigmentación ocular blanco en embriones. Además, describimos un ejemplo en el que el gen bronceado laccase2(lac2) fue silenciado durante la segunda estrella larval (para afectar a las larvas de la tercera estrella larval) y la tercera estrella larval (para afectar a los adultos). Finalmente, demostramos que la inyección de una menor concentración de dsRNA conduce a un derribo parcial, lo que demuestra que esta técnica también se puede aplicar a genes donde se sabe que la pérdida de función es letal.
Protocolo
1. Aislamiento de ARN y montaje de de novo transcriptome
- Realizar el aislamiento total de ARN de la tercera etapa tardía tubos oculares larvarios de escarabajo de buceo y escarabajos adultos utilizando un kit de aislamiento de ARN (ver Tabla de materiales) que está diseñado para el tejido rico en lípidos. Aísle el ARN total de T. marmoratus y la secuencia siguiendo los métodos descritos anteriormente18.
- Asamblea de de novo transcriptome
NOTA: Para ensamblar el transcriptoma de novo, se pueden utilizar varias plataformas bioinformáticas (ver Tabla de Materiales). Estas plataformas están disponibles comercialmente y, en algunos casos, existen como scripts de línea de comandos basados en Unix. Dado que el ensamblaje es de novo, se recomienda ensamblar los transcriptomas de forma independiente en dos plataformas y comparar los resultados para excluir falsos positivos o falsos negativos.- Para empezar a ensamblar los transcriptomas, cargue las lecturas en bruto en la plataforma bioinformática respectiva.
NOTA: Estos archivos suelen estar comprimidos y en el formato FASTQSANGER. Gz. No hay necesidad de descomprimir los archivos, ya que este formato se acepta en el siguiente paso. - Con la línea de comandos Trimmomatic, recorte las lecturas sin procesar para quitar secuencias de adaptador o lecturas cortas que estén por debajo del umbral predeterminado. Descomprima las lecturas en bruto recortadas; los archivos ahora estarán en el formato FASTQ. Concatene las lecturas sin procesar DE FASTQ para cada ejemplo para obtener archivos que estén listos para el ensamblado de novo.
- Ensamble las lecturas en bruto concatenadas de novo utilizando cualquier script de línea de comandos que pueda ensamblar transcriptomes de novo. Guarde el transcriptoma ensamblado, que ahora tendrá una lista de contigs con sus respectivas secuencias, como un archivo FASTA. Para aumentar la cobertura del ensamblaje, combine y ensamble múltiples transcriptomas para la misma especie.
NOTA: Este proceso aumenta las posibilidades de generar contigs más precisos y es especialmente importante si los genes de bajo número de copia son de interés. - Una vez montado, evalúe el transcriptoma para obtener integridad calculando las puntuaciones de cobertura (el software de evaluación de cobertura está disponible libremente, consulte Tabla de materiales).
NOTA: Un transcriptoma con una puntuación de cobertura >75% se considera bueno. Sin embargo, la relevancia de esta puntuación depende de la razón de la generación de transcriptomas. Por ejemplo, si el transcriptoma se utiliza para identificar genes de números de copia bajos, entonces una puntuación >85% es mejor, ya que significa una mayor cobertura. - Anote el transcriptoma ensamblado de novo utilizando una herramienta básica de búsqueda de alineación local (BLAST; véase Tabla de materiales).
NOTA: Para este experimento, el transcriptoma fue anotado principalmente contra una base de datos de proteínas Drosophila conocidas y una base de datos de proteínas de escarabajo conocidas. La lista de anotaciones se puede descargar como un archivo de hoja de cálculo y los contig/contigs que indican la similitud de la secuencia con las proteínas de otros organismos se pueden descargar como un archivo FASTA. - Identificar el número/números de la proteína de interés y extraer las secuencias de nucleótidos. Utilice BLAST para identificar si las regiones conservadas específicas de proteínas (como los dominios de homeobox) están presentes en la secuencia de interés de nucleótidos anotados. Compruebe otros contigs con la misma anotación para las superposiciones de secuencia de nucleótidos para generar la secuencia de una transcripción específica del gen.
NOTA: La identificación de contigs con superposición de secuencias no suele ser posible para todos los genes, especialmente para los genes de bajo número de copia. - Si se necesita la secuencia de longitud completa del gen, comience con el contig que tiene la mayor similitud de secuencia como punto de inicio para identificar la secuencia de nucleótidos de toda la transcripción madura utilizando técnicas como extremos de amplificación rápida de 3o y 5o de ADNc (RACE19).
- Anote el ensamblaje obtenido de la segunda plataforma siguiendo los pasos 1.2.4–1.2.7.
NOTA: Idealmente, los resultados deben ser similares para las proteínas de interés; sin embargo, la cobertura puede diferir entre plataformas en cierta medida. - Utilice el transcriptoma ensamblado para sintetizar dsRNA específica de la especie como se describe en la sección 2.
- Para empezar a ensamblar los transcriptomas, cargue las lecturas en bruto en la plataforma bioinformática respectiva.
2. Clonación y síntesis de dsRNA específica del gen
NOTA: La clonación específica de genes y la síntesis de dsRNA se han descrito en detalle para T. castaneum20,21,22. Los pasos siguientes son una breve descripción general.
- Clonación, transformación bacteriana y secuenciación de plásmidos
- Aísle el ARN total del organismo (como se describe en el paso 1.1) y cree ADN complementario (ADNC) utilizando un kit de transcripción inversa (ver Tabla de materiales). Identificar una o dos secuencias de nucleótidos de 100 a 1000 bp a partir de contigs que sean específicos para los genes de interés.
- Diseñe pares de imprimación que abarcan todo el tramo identificado de nucleótidos y amplifica la secuencia a través de una reacción en cadena de la polimerasa (PCR). Agregue un paso adicional de 30 minutos al final para crear voladizos de adenina de 3o en el producto de ADN amplificado. Purifique este producto utilizando un kit de purificación de PCR (ver Tabla de materiales).
- Clonar el producto purificado en un vector plásmido pCR4-TOPO (ver Tabla de materiales)siguiendo el protocolo del proveedor proporcionado con el kit de clonación. El uso del tratamiento de choque térmico transforma los plásmidos clonados en células bacterianas competentes (tensión: E.coli DH10B) siguiendo el protocolo del proveedor para células competentes (ver Tabla de Materiales),y la pantalla para las células transformadas con éxito.
NOTA: Las placas con colonias se pueden envolver en película de parafina para retener la humedad y almacenarse a 4 oC durante un mes. - Escoge colonias de células transformadas usando una punta de pipeta de 10 l y el cultivo en caldo de lisogenia (LB) que contenga ampicilina (50 g/ml) en una incubadora de cocteles a 37oC y 200 rpm durante 24 h.
NOTA: Para el almacenamiento a largo plazo, las células cultivadas se pueden diluir 1:1 con 100% de glicerol y congelarse a -80 oC como poblaciones de glicerol. - Aísle los plásmidos que contienen el gen de interés de este cultivo utilizando un kit de aislamiento miniprep (ver Tabla de materiales). Almacene los plásmidos aislados (minipreps) a -20 oC después de evaluar el rendimiento espectrofotométricamente. Específicamente, mida la absorbancia de la muestra a 260 nm, 280 nm y 230 nm. Calcular las proporciones A260/A280 para cuantificar el ADN, y A260/A230 para cuantificar la pureza del ADN.
NOTA: Una proporción 260/280 de 1,8 se acepta generalmente como ADN suficientemente puro, proporciones inferiores a 1,5 indican la presencia de reactivos de extracción residual como el fenol. La relación 260/230 debe ser mayor o igual que la proporción 260/280. Las relaciones más bajas indican contaminación residual de los reactivos. El rendimiento suele oscilar entre 100 y 500 ng/L. - Secuenciar los minipreps aislados para confirmar que el fragmento específico del gen se ha integrado con éxito, estando flanqueados entre las regiones promotoras de T7 y 3o T3 en el plásmido; esto se puede hacer utilizando imprimaciones universales de secuenciación T7 y T322. Utilice los minipreps con la secuencia de interés específica del gen para la preparación del ARN.
- Aísle el ARN total del organismo (como se describe en el paso 1.1) y cree ADN complementario (ADNC) utilizando un kit de transcripción inversa (ver Tabla de materiales). Identificar una o dos secuencias de nucleótidos de 100 a 1000 bp a partir de contigs que sean específicos para los genes de interés.
- Amplificación de PCR y síntesis in vitro de dsRNA
- Amplificación de PCR y purificación de productos
- Diseñar imprimaciones específicas de plásmido o genéticas que tengan la secuencia promotora T7 en sus lados de 5' (véase la referencia22 para más detalles) para amplificar un fragmento lineal del gen insertado. Optimice el rendimiento configurando al menos 10 reacciones de 20 ml cada una.
NOTA: El producto resultante está flanqueado por dos sitios de unión a la polimerasa T7 de 20 bp. - Purifique el producto PCR utilizando un kit de purificación de productos PCR (consulte la Tabla de materiales),siguiendo el protocolo de elución basado en columnas del proveedor. Para aumentar el rendimiento, repita el paso final de elución hasta 3 veces con el mismo eluyente. Evalúe el rendimiento espectrofotométricamente.
NOTA: El rendimiento suele oscilar entre 100 y 700 ng/L. Este producto purificado se puede almacenar a -20 oC hasta su uso posterior.
- Diseñar imprimaciones específicas de plásmido o genéticas que tengan la secuencia promotora T7 en sus lados de 5' (véase la referencia22 para más detalles) para amplificar un fragmento lineal del gen insertado. Optimice el rendimiento configurando al menos 10 reacciones de 20 ml cada una.
- Síntesis y purificación de dsRNA in vitro
- Utilice el producto purificado de PCR específico del gen para sintetizar dsRNA in vitro de acuerdo con el protocolo de un kit de síntesis de dsRNA de su elección. Si es necesario, amplíe el tiempo de incubación para aumentar la producción de ARDS.
- Evaluar la progresión de la reacción en función de la opacidad de la mezcla de reacción (cuanto mayor sea la cantidad del producto dsRNA, mayor será la turbidez). Al final de la incubación, detener la reacción utilizando un tratamiento con DNase. Para ello, añada 1 l de un stock de 2 U/L, a la mezcla de reacción. Extienda este tratamiento a 1–2 h para asegurar la degradación óptima del ADN de la plantilla.
- Purifique el dsRNA con un kit de purificación o a través de los siguientes pasos.
- Diluir el producto resultante con 115 l de agua libre de nucleasas y añadir 15 l de acetato de sodio de 3 M. Añadir 2 volúmenes de etanol helado al 100% a esta mezcla de reacción y precipitar el dsRNA durante la noche a -20 oC.
NOTA: En este punto, las muestras se pueden almacenar de forma segura sin afectar al rendimiento final. - Centrifugar el precipitado a 0 oC durante 20 min a 9000 x g y desechar el sobrenadante. Lave el producto una vez con hielo de etanol y centrífuga durante 15 minutos a 13000 x g.
- Retire el sobrenadante y seque al aire el pellet durante 5-15 min. Resuspender el pellet en hasta 40 ml de agua libre de nucleasas (este volumen se puede ajustar en función del tamaño aislado del pellet) y evaluar el rendimiento y la pureza espectrotométricamente, como se describe en 2.1.4.
- Conservar el ARNrn purificado a -20 oC hasta su uso posterior. Utilice el ARNR purificado para inyección en la etapa de desarrollo deseada.
- Diluir el producto resultante con 115 l de agua libre de nucleasas y añadir 15 l de acetato de sodio de 3 M. Añadir 2 volúmenes de etanol helado al 100% a esta mezcla de reacción y precipitar el dsRNA durante la noche a -20 oC.
- Amplificación de PCR y purificación de productos
3. Recolección y preparación de embriones T. marmoratus en etapa temprana para inyecciones de dsRNA
- Preparar una placa de agarosa para la incubación de embriones de T. marmoratus.
- En primer lugar, disolver 20 mg de polvo de agarosa de baja fusión en 100 ml de agua destilada autoclave (2% de agarosa) y luego hervir esta mezcla en un microondas hasta obtener una solución clara. Tenga cuidado con la solución caliente, ya que las burbujas de aire pueden hacer que se desborde.
- Dispensar esta solución en un pequeño plato de Petri. Para hacer ranuras (que mantendrán los embriones) en la superficie de la placa de agarosa, coloque tres tubos de plástico de 1-2 mm de ancho (como las puntas de las pipetas de transferencia de plástico) en la superficie de la agarosa líquida antes de que se solidifique.
- Una vez que la agarosa se solidifique, utilice un par de fórceps contundentes para eliminar estos tubos. Añadir 500 l de agua destilada autoclavada con una micropipeta P1000 para cubrir estas hendiduras en la agarosa.
- Usando un fino cepillo de pintura de cabello natural, recoge embriones de T. marmoratus que tienen 5-8 horas de edad de los sitios de anidación de escarabajos en un plato de cavidad de vidrio lleno de agua destilada autoclaba. Monitorear los sitios de anidación con frecuencia para asegurar que los huevos obtenidos son de la edad adecuada.
- Descorionar los embriones bajo un estereomicroscopio usando fórceps de disección fina. Para ello, visualice la tarea bajo el microscopio (con el aumento deseado) colocando la fuente de luz en un ángulo adecuado, luego agarre el chorion desde dos lados con fórceps afilados, ábralo y deslice suavemente el embrión hacia fuera. Como hay dos capas, asegúrese de que ambas se eliminan.
- Usando un fino cepillo de pintura de cabello natural, transfiera cuidadosamente los embriones de la placa de cavidad de vidrio a la placa de agarosa y organízalos en las ranuras bajo un estereomicroscopio. Tenga mucho cuidado durante este proceso, ya que los embriones descorionados son muy frágiles. Utilice los embriones preparados para las inyecciones de ARSNr.
NOTA: El extremo ligeramente más grueso es el lado del embrión en el que se desarrollará la cabeza.
4. microinycciones de dsRNA en embriones T. marmoratus en etapa temprana
- Para inyectar embriones en etapa temprana con dsRNA específico del gen, prepare agujas de microinyección utilizando un tirador de aguja de microinyección (ver Tabla de materiales). Mientras visualiza la punta de la aguja debajo de un estereomicroscopio, usa un par de fórceps finos para romper la punta de la aguja, creando un borde afilado. Idealmente, romper la punta de la aguja diagonalmente para que un borde más agudo permanezca en un lado, lo que le permitirá entrar en el embrión mientras causa una lesión mínima.
- Descongelar la solución de dsRNA de stock purificado sobre hielo, añadir 1 l del tampón de inyección de 10x y recargar con agua destilada doble, para hacer 10 l de solución inyectable. Para las inyecciones, una concentración de dsRNA de 1 g/l suele ser adecuada, pero se puede ajustar de acuerdo con la gravedad fenotípica de los animales resultantes).
NOTA: Preparar 1 ml de tampón de inyección 10x22 añadiendo 10 l de tampón de fosfato sódico de 0,1 M (hecho mezclando 8,5 ml de 1 M Na2HPO4 y 1,5 ml de 1,1 mL M NaH2PO4 ajustado a un pH 7,6 a 25oC con 100 l de 0,5 M KCl, 100 l de tinte alimentario y 790 l de agua doble destilada.- Con una pipeta P10, rellene la aguja de microinyección con la solución dsRNA de trabajo. Una vez que la solución haya llenado la punta de la aguja, adjúntela a un soporte de microinyesión conectado a un sistema de microinyección que utilice tecnología de eyección por presión (ver Tabla de materiales).
- Encienda el sistema de microinyección y el suministro de aire presurizado. Con la microválvsión del sistema de microinyección, ajuste la presión de inyección a 15 psi. Ajuste la duración de la inyección con la perilla de ajuste de tiempo (establézcalo en "Segundos").
- Como la duración de la inyección depende del volumen de inyección requerido, si es necesario, ajuste este parámetro en el sistema de microinyección antes de cada inyección. Utilice un volumen de inyección de 1–2 nL para embriones T. marmoratus en etapa temprana.
NOTA: Los volúmenes de inyección más altos tienden a interferir con la tasa de supervivencia de los embriones.
- Como la duración de la inyección depende del volumen de inyección requerido, si es necesario, ajuste este parámetro en el sistema de microinyección antes de cada inyección. Utilice un volumen de inyección de 1–2 nL para embriones T. marmoratus en etapa temprana.
- Para medir el volumen de líquido de inyección dispensado por el sistema de microinyección, calibre la aguja de inyección evaluando el volumen de la burbuja de fluido que se forma en la punta de la aguja al inyectar en el aire. Para los embriones de T. marmoratus, utilice un tamaño óptimo de burbuja de 100–200 m. La aguja de inyección es de buena calidad si esto se puede lograr a 15 psi con una duración de inyección de 3 s.
- Alinee la aguja y la placa de agarosa que contiene los embriones bajo un estereomicroscopio, de modo que la aguja se acerque a los embriones en un ángulo entre 45o y 60o.
- Usando el micromaniprógrafo, mueva el microneedle lentamente mientras monitorea el progreso a través del estereomicroscopio. Una vez que la punta de la aguja está tocando la superficie de un embrión, mueva cuidadosamente la aguja hacia adelante hasta que perfore la superficie del embrión. No perfore el embrión profundamente con la punta de la aguja, ya que esto puede afectar la supervivencia del embrión. Para reducir la variabilidad, entregue la inyección en el centro del embrión.
- Una vez que la aguja esté dentro del embrión, presione cuidadosamente el botón de inyección del microinyector para administrar la dosis de ARNr. Después de inyectar 1–2 nL de dsRNA, retraiga lentamente la aguja del embrión, de manera que no haga que el embrión se rompa.
- Inyectar los otros embriones de una manera similar. Si la aguja de microinyección se bloquea durante el procedimiento, desbloquee aumentando la presión y la duración de la inyección. Identificar visualmente los embriones inyectados con éxito por la presencia de un punto de color en el lugar de la inyección (ya que el tampón de inyección contiene colorante alimentario).
- Coloque cuidadosamente el plato con embriones inyectados en una cámara de humedad.
- Para construir una cámara de este tipo, tome cualquier caja de plástico con una tapa, esterilizarla con 70% de etanol, deje que se seque y coloque el tejido empapado en agua autoclavada en la parte inferior para proporcionar un ambiente húmedo. Coloque esta cámara de humedad en una incubadora con una temperatura adecuada (en este caso, 25 oC) y un ciclo de luz de 14 h de luz y 10 h de oscuridad.
- Permita que los embriones inyectados se conviertan en las primeras larvas instar, lo que requiere de 4 a 5 días. Supervise el progreso del desarrollo diario de embriones utilizando un estereomicroscopio para identificar fenotipos de knockdown morfológicamente visibles como se muestra en la Figura 2.
- Documente este progreso tomando imágenes digitales con una cámara de alta resolución. Retire los embriones muertos y reponga el agua de la placa de agarosa diariamente para evitar la desceración y la posible propagación de la contaminación microbiana a otros embriones supervivientes durante el período de incubación.
- Realizar controles adecuados para las inyecciones de dsRNA, incluidas las inyecciones de tampón, las inyecciones de dsRNA sintetizadas contra la cadena de detección del gen de interés, y las inyecciones de dsRNA sintetizadas contra secuencias que no existen dentro del organismo objetivo. Confirmar derribo de ARNi utilizando métodos moleculares adicionales22.
5. Preparación de larvas de T. marmoratus para inyecciones de ARSNM
NOTA: A diferencia de los embriones en etapa temprana, las larvas de T. marmoratus son relativamente resistentes y se pueden inyectar con volúmenes más grandes. Por ejemplo, la segunda estrella se puede inyectar con hasta 2 ml de solución de trabajo de dsRNA y terceras estrellas con al menos 3 l sin efectos negativos notables en la tasa de supervivencia. Para inyectar dsRNA, es útil inmovilizar las larvas incrustándolas en la agarosa.
- Antes de recoger las larvas, derrite un 2% de agarosa y guárdala en un baño de agua a 60-70 oC para mantenerla en forma líquida. Preparar un plato de inmovilización vertiendo 2% de agarosa derretida en un pequeño plato de Petri y luego enfriar hasta que se solidifice. Utilice fórceps contundentes para hacer una ranura poco profunda en la placa de agarosa (aproximadamente el tamaño del artrópodo que se va a incrustar) para cada animal que se inyectará.
- Recoger larvas jóvenes en la etapa de desarrollo apropiada (una etapa antes de la etapa deseada para el análisis). Para ello, drena cuidadosamente el agua de las copas de cultivo que contienen las larvas y siga los pasos mencionados a continuación.
- Anestesia en hielo (recoger cuidadosamente la larva de su taza de agua y colocarla suavemente sobre hielo) hasta que la larva no muestre movimientos notables. Utilice fórceps contundentes y de extremo suave para levantar cuidadosamente la larva del hielo y colocarla en la etapa de inmovilización con su cuello y cuerpo en la ranura pero su cola situada por encima de la superficie de la agarosa para que no se cubra, lo que permite a la larva continuar respirando a través de sus espiracles de cola.
- Cubra la larva con una gruesa capa de agarosa que todavía es líquida pero no peligrosamente caliente. Si se cubrió accidentalmente, utilice los fórceps para liberar la cola y los dos segmentos por debajo de ella de la agarosa. Una vez que la agarosa se solidifique, utilice la larva para las inyecciones de ARSNar.
6. microinyeccións dsRNA en larvas de T. marmoratus
- Preparar y rellenar una aguja de microinyección con la cantidad deseada de solución de trabajo dsRNA específica del gen (como se describe en los pasos 4.1–4.2). Coloque la aguja en un soporte de aguja conectado a una jeringa de microinyección controlada manualmente. Antes de colocar la aguja, tire del émbolo de la jeringa hasta el final para evitar quedarse sin presión de inyección a mitad del procedimiento.
- Coloque la larva inmovilizada de tal manera que el lugar de inyección, que se encuentra dorsalmente entre los segmentos del tercer y cuarto cuerpo de la placa, esté alineado con la trayectoria de la aguja de microinyección en un ángulo relativamente plano (casi paralelo a la etapa).
NOTA: Es importante angling la aguja y la larva en esta posición, ya que proporciona el camino de menor resistencia para la punta de la aguja para perforar las larvas con el mínimo daño. - Una vez colocada la aguja y la larva, mueva cuidadosamente la punta de la aguja a la larva utilizando el micromanipulador mientras monitorea el progreso a través de un estereomicroscopio.
- Después de que la punta perfora el tejido, aplique presión lenta y cuidadosamente a la jeringa. Ajuste la presión de inyección observando el movimiento del líquido de inyección de color en la aguja bajo el microscopio.
- Retraiga cuidadosamente la aguja después de la inyección. Utilice fórceps blandos para despegar y por lo tanto liberar la larva de la agarosa. Transfiera la larva de nuevo a un recipiente con agua (a temperatura ambiente) y permita que se desarrolle aún más en una incubadora o sala de cultivo a 25o U201228 oC y un ciclo de luz de 14 horas de luz y 10 h de oscuridad.
- Emplear las inyecciones de control adecuadas y las cuantificaciones de derribo, como se describe en el paso 4.10.
Resultados
Utilizando el protocolo descrito anteriormente, derribamos tres genes diferentes, a saber, blanco, laccase2 (lac2),y Lens3 (Tabla 1),en una variedad de diferentes etapas de desarrollo del Sunburst Diving Beetle T. marmoratus. Realizamos ARNi en T. marmoratus inyectando dsRNA en una etapa muy temprana durante la embriogénesis (Figura 1A). Como algunos de los embriones no sobreviven al proceso y se vuelven necróticos(Figura 1B),es necesario eliminarlos para mantener sanos los embriones restantes. Aquí se ejemplifican las inyecciones de ARN contra el gen blanco. Este gen es bien conocido en Drosophila como uno de los tres transportadores de casete de unión ATP (ABC) involucrados en la absorción y almacenamiento de los precursores del pigmento ocular23. En consecuencia, su pérdida de función da como resultado un fenotipo de ojos blancos sin pigmentar. Nuestros resultados muestran que las inyecciones de dsRNA dirigidas al gen blanco ortologos en embriones de T. marmoratus conducen a la pérdida de pigmentación ocular en larvas recién emergentes. En este caso, las larvas de tipo salvaje se caracterizan por ojos muy pigmentados, y el derribo de RNAi del blanco conduce a varios niveles de reducción e incluso eliminación completa del pigmento ocular. En general, observamos al menos cierta reducción en la coloración de los ojos en el 34% de los embriones supervivientes (n.o 35). La Figura 2A compara a un individuo de control y a un individuo con un color de ojos ligeramente más claro. La Figura 2B ilustra un derribo más grave en un individuo, en el que los ojos más ventrales (Ojos 2–5) del cúmulo están completamente sin pigmentar, mientras que los ojos dorsales todavía muestran algo de pigmentación. Estas diferencias ponen de relieve cómo la eficiencia del derribo puede variar regionalmente, lo que posiblemente está relacionado con las diferencias en la eficacia de la penetración de dsRNA en el tejido denso. Otro individuo muestra esencialmente la pérdida completa de pigmento en todos los ojos(Figura 2C).
Para investigar qué tan bien funciona el ARNi en la etapa larval de T. marmoratus, inyectamos dsRNA apuntando al gen tánico lac2 en larvas de segunda estrella unos días antes de que se fusionaran en terceras estrellas(Figura 3) y evaluamos el efecto sobre la coloración cuticular de las larvas de tercera estrella. Lac2 es un tipo de fenoloxidasa que conjuga oxidativamente las proteínas para hacerlas insolubles, más duras y oscuras. Knockdown en el escarabajo de harina T. castaneum se ha demostrado para conducir a individuos de color más claro en dosis bajas, pero se considera letal en dosis altas24. La Figura 4 ilustra que este tratamiento también conduce a larvas de Sunburst Diving Beetle de color más claro. Específicamente, en este experimento, el 75% de las larvas inyectadas supervivientes (n.o 12) tenían pigmentación reducida (en comparación con el 0% en el grupo de control). La Figura 4A muestra a un individuo con despigmentación relativamente leve, mientras que la Figura 4C ilustra la cabeza de una larva de T. marmoratus en la que la coloración oscura de la cutícula está casi ausente. La despigmentación fue particularmente evidente para el patrón oscuro central que es típico de estas larvas, mientras que este patrón permaneció claramente visible en un individuo con control inyectado (Figura 4B). Además, se observó un aclaramiento de la tráquea de cola, como se muestra en la Figura 4D. En el caso de que lac2 dsRNA se inyectara en larvas de tercera estrella, se obtuvieron individuos adultos más ligeros(Figura 5). Tenga en cuenta que las alas del escarabajo knockdown están algo deformadas, probablemente debido a su suavidad inusual.
Además de alterar los rasgos morfológicos, es posible utilizar arNI para atacar genes que afectan el comportamiento. Para demostrar esto, realizamos ARNi contra un gen clave de codificación de proteínas de lente, Lens318,y lo inyectamos en larvas de segunda estrella para afectar las propiedades ópticas de los ojos larvales de tercera estrella. Cualquier efecto sobre la lente observada aquí es probable porque los ojos de las larvas de T. marmoratus experimentan un crecimiento ocular importante en esta transición, que también implica cambios ópticos importantes de la lente25. El derribo de ARNi en este experimento fue muy eficiente. La verificación a través de qPCR mostró una tasa de éxito del 100%; de 13 individuos probados, 12 fueron derribados a menos del 10% del nivel de expresión de los individuos de control, y el individuo restante tenía un nivel de expresión del 17% del nivel de control (observación inédita). A nivel fenotípico, sólo algunos individuos fueron severamente discapacitados o incapaces de ser presas, como se ilustra en la Figura 6 para un individuo que se acercó repetidamente a su presa desde una distancia muy cercana, pero constantemente la superó.
Tabla 1: Secuencias de imprimación y amplicons para proteínas blancas, lac2 y Lens3. Haga clic aquí para descargar esta tabla.
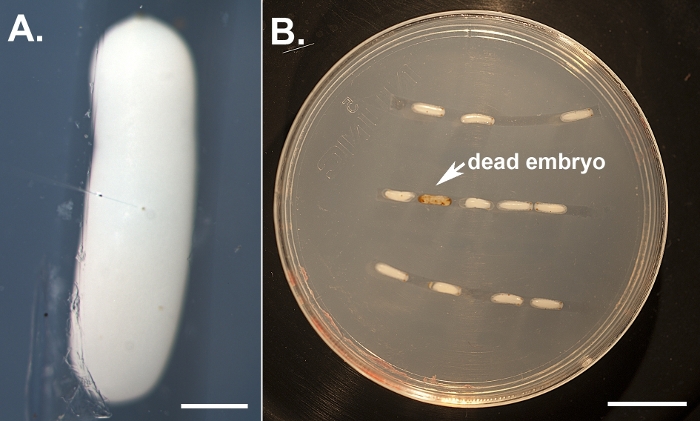
Figura 1: Ilustración de las inyecciones de embriones. (A) Embriones descorionados alineados en una placa de agarosa e inyectados cerca de su centro utilizando una aguja de microinyección llena de ARNd y tampón de inyección que contiene tinte alimentario. La barra de escala representa 500 m. (B) Un individuo con un derribo más grave. Los embriones inyectados se mantienen en una cámara de humedad y se monitorean diariamente para puntuar fenotipos y eliminar a los individuos muertos (que se vuelven marrones). La barra de escala representa 5 mm. Haga clic aquí para ver una versión más grande de esta figura.
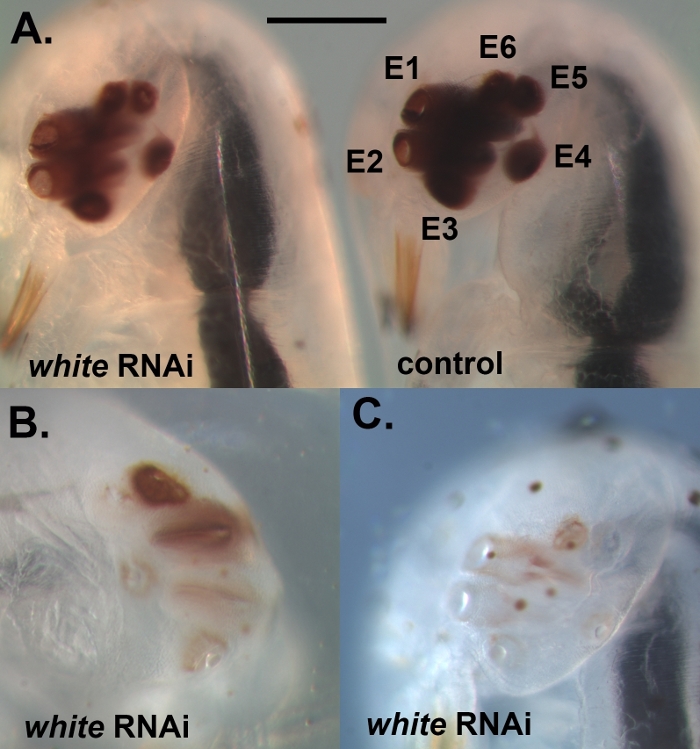
Figura 2: Ejemplo de embriones completamente desarrollados que se inyectaron con dsRNA contra el blanco. (A) Comparación de un individuo con una reducción de la pigmentación ocular (izquierda) y un individuo con inyección de control (derecha). E1–E6 se refieren a Ojos 1–6. (B) Un individuo con un fenotipo de derribo más grave, que ilustra que, a veces, algunos de los ojos dentro del cúmulo se ven más gravemente afectados por el derribo que otros. (C) Individuo con una pérdida casi completa de pigmentación ocular. La barra de la escala representa 200 m; Los paneles B y C se representan a la misma escala. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Ilustración de inyecciones larvarias. (A) Varias larvas inmovilizadas por la incrustación en el 2% de agarosa con sus espiráculos de cola dejados libres de cualquier agarosa. (B) Microelectrodo que contiene la solución inyectable colocada de modo que su punta pueda penetrar la membrana fina entre dos segmentos. (C) Tinte de inyección azul visible en el lugar de inyección después de la inyección. Las barras de escala representan 1 cm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 4: ARNi para lacasse2 aplicado a las larvas de segunda estrella que resultan en una reducción de la coloración de la cutícula en larvas de tercera estrella. (A) Pérdida relativamente leve de coloración en un individuo de ARNi lac2 (abajo) en comparación con un individuo con inyección de control (arriba). La barra de escala representa 5 mm. (B) Cabeza de un individuo de control que muestra el patrón característico de color oscuro en el centro de la cabeza. (C) Derribo relativamente grave de lac2 que conduce a una pérdida casi completa de la coloración central de la cabeza. (D) Pérdida de coloración en la cutícula de cola principal de un individuo de ARNi lac2 (abajo) en comparación con un individuo con inyección de control (arriba). Las barras de escala en B-u2012D representan 1 mm. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: ARNi para lacasse2 aplicado a una tercera larva instar que resulta en una reducción de la coloración de la cutícula en un adulto. El individuo knockdown (izquierda) también se caracteriza por elytra muy suave en comparación con el control (derecha). La barra de escala representa 5 mm. Haga clic aquí para ver una versión más grande de esta figura.
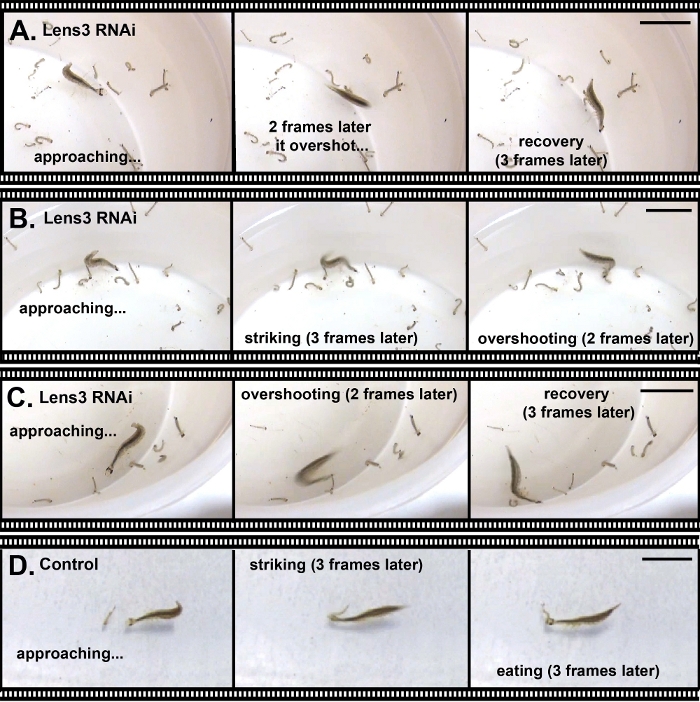
Figura 6: Derribo de una proteína de lente principal que conduce a deficiencias en la captura de presas. (A–C). Tres ejemplos en los que una larva de Escarabajo Buceo Sunburst, en la que se indujeron déficits ópticos a través de ARNi, no pudo capturar presas (larvas de mosquitos). Se seleccionaron imágenes fijas representativas de una grabación de vídeo de capturas de presas características. (D) Controlar la captura de larvas. Todas las barras de escala representan 2 cm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Nuestro objetivo es que esta recopilación de métodos haga que el ARNI esté ampliamente disponible, sobre todo porque esta herramienta sigue siendo una poderosa técnica sinérgica para la edición de genes basados en CRISPR/Cas9, con la ventaja de que se puede aplicar a las etapas de desarrollo deseadas de los organismos estudiados. Para ejemplificar esta fuerza, inyectamos dsRNA en embriones y en diferentes etapas larvales. Las inyecciones en óvulos afectaron al desarrollo de embriones (Figura 2), las inyecciones en la segunda etapa larvaria tuvieron efectos aparentes en la tercera etapa larval(Figura 4 y Figura 6),y las inyecciones en la tercera etapa larval mostraron efectos en los adultos (Figura 5). Mientras que el momento exacto tiene que establecerse experimentalmente, generalmente, las inyecciones surten efecto dentro de unos pocos días. El éxito de este proceso puede verse afectado por la longitud de la secuencia dsRNA. Aquí, presentamos ejemplos usando un poco más de 200 bp a más de 800 bp. Como regla general, las secuencias entre 100 y 600 bp se prefieren para limitar los efectos fuera del objetivo, pero las secuencias de hasta 1000 bp producen buenos resultados22. Una pregunta con respecto al ARNi es la duración del derribo que se puede lograr a través de esta técnica. Dado que los fenotipos eran terminales en cada etapa, no podemos comentar este tema sobre la base de nuestros resultados presentados. Sin embargo, anteriormente se ha observado que los efectos de arNI son generalmente relativamente de larga duración, y que las concentraciones más altas conducen a derribos más duraderos20.
Una limitación de esta técnica es que funciona mejor para algunos organismos que para otros, y parece que no hay una forma directa de predecir qué tan bien funcionará a priori. Sin embargo, se ha encontrado para trabajar bien para una amplia gama de diferentes organismos. Dentro de los artrópodos, esto incluye arácnidos26,crustáceos27,y una variedad de insectos, con tasas de éxito particularmente altas en escarabajos28. Otra complicación es que las diferencias en la gravedad del fenotipo a menudo ocurren entre individuos a pesar de la aplicación de la misma cantidad de ARD. Como se ilustra en la Figura 2B,la variación puede incluso ocurrir dentro de un individuo. En nuestros estudios de ARNi dirigidos a diferentes genes implicados en el desarrollo ocular larvario de T. marmoratus, con frecuencia hemos encontrado que algunos ojos se ven afectados más severamente que otros. Este fenómeno puede estar relacionado con el tejido relativamente denso del grupo ocular, con el dsRNA más capaz de llegar a algunas de las unidades.
Para la ejecución exitosa de experimentos de ARNi, es fundamental que varios parámetros estén optimizados para el gen objetivo. Por ejemplo, la concentración del ARS y la longitud del gen objetivo pueden influir fuertemente en el resultado20. Otro parámetro crítico es cómo se ejecutan las inyecciones, ya que este proceso puede influir en gran medida en la tasa de supervivencia. Para los embriones, logramos los mejores resultados apuntando al centro del embrión. Una placa bien colocada permite la inyección de 100 o más embriones en una sola sesión. Para las larvas, es fundamental insertar la aguja de inyección entre los segmentos. Estas inyecciones requieren más dsRNA, y en función de la disponibilidad de larvas, nuestros conjuntos de inyección aquí típicamente sólo consistía en unos pocos animales a la vez. Para todas las inyecciones, es fundamental evitar que el aire entre en el organismo.
En algunos casos, los bucles de retroalimentación de una red reguladora de genes y la redundancia genética pueden influir en la penetración de los fenotipos de ARNi, a pesar de los derribos constantes. Este parece ser el caso de nuestras observaciones conductuales de larvas con derribos de gran éxito de una proteína de lente prominente, Lens318. Aunque verificamos la alta eficiencia de estos derribos a través de qPCR, se observó una variación considerable en los fenotipos asociados. Este resultado pone de relieve la necesidad de cuantificar correctamente los derribos de ARNI (para obtener más información sobre las opciones, véase22). Si no hay una expectativa clara a priori con respecto a los fenotipos resultantes, una buena manera de controlar los efectos fuera de la diana del ARNi es apuntar al mismo gen con dos secuencias no superpuestas de dsRNA y evaluar los resultados de los fenotipos comunes.
A diferencia de las técnicas de edición de genes, el ARNi también es una poderosa herramienta para estudiar genes letales, y hay dos maneras de hacerlo. Por ejemplo, si uno está interesado en la contribución funcional de un gen donde se sabe que la pérdida de función al principio del desarrollo es letal, se puede lograr una investigación funcional de dicho gen simplemente permitiendo que el animal se desarrolle normalmente y luego derribando el gen a través de ARNi más adelante en el desarrollo (es decir, en el adulto). Alternativamente, un gen donde se sabe que la pérdida completa de la función es letal puede ser investigado a través de un derribo parcial, que se puede lograr mediante la inyección de un rango de concentraciones de dsRNA. Algunos de nuestros resultados muestran derribos de lac2,que se sabe que son letales si la cutícula en insectos se vuelve demasiado suave24. Incluso el escarabajo lac2 RNAi representado en la Figura 5 sería poco probable que sobreviviera fuera de las condiciones de laboratorio. Otro gen letal es el corte,que codifica para un factor de transcripción que es fundamental para la especificación del destino celular en varios sistemas de órganos en artrópodos y se ha relacionado con el desarrollo de glia en el sistema visual Drosophila 29. Basándonos en nuestra experiencia con el corte de ARNi en embriones de T. marmoratus, podemos evocar fenotipos oculares informativos en embriones que son capaces de completar su desarrollo ocular embrionario (observaciones inéditas). Aquí, dosis más altas parecen conducir a mayores tasas de letalidad, mientras que dosis más bajas resultan en fenotipos observables e informativos.
Nuestro protocolo no sólo enumera los pasos necesarios para que un investigador realice experimentos de ARNi en T. marmoratus,como se ilustra, sino que también es generalmente aplicable a otros organismos, especialmente los organismos acuáticos. Entre los organismos acuáticos, ya hay varios ejemplos dentro de los crustáceos como las pulgas de agua Daphnia30 y camarones (para una revisión reciente, véase la referencia31). Hay amplias oportunidades entre los insectos acuáticos, ya que se ha estimado que representan alrededor del 6% de toda la diversidad de insectos, con probablemente más de 200.000 especies32. Además, el ARNI ya se ha realizado en estibas de agua que tienden a habitar la superficie de los ambientes acuáticos33. Si no hay un genoma presente, entonces se puede ensamblar un transcriptoma de novo. Mientras este proceso revele contigs de unos pocos cientos de nucleótidos, se puede diseñar dsRNA contra genes específicos. Nuestro protocolo para inmovilizar insectos en la agarosa probablemente también será útil para otros procedimientos, especialmente para organismos blandos, maleables y acuáticos. En conjunto, el ARNi sigue siendo una técnica poderosa para manipular la expresión génica en un grupo diverso de organismos, incluso cuando no hay otras herramientas moleculares y genéticas disponibles.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Nos gustaría agradecer al Dr. Josh Benoit por su ayuda con la bioinformática Hailey Tobler por su ayuda en la crianza de Sunburst Diving Beetles y Tamara Pace para la ayuda editorial. Esta investigación fue apoyada por la National Science Foundation bajo las becas IOS-1456757 y IOS-1856341 a EKB y IOS1557936 a YT.
Materiales
| Name | Company | Catalog Number | Comments |
| 1. RNA isolation and de novo transcriptome assembly | |||
| liquid nitrogen | University Stockroom | Typically locally available at research institutions | |
| pipette tips | Fisher Scientific | size dependent | Products from other vendors would work equally well |
| RNeasy lipid tissue mini kit (RNA isolation kit) | Qiagen | 74804 | Detailed specific protocol is provided with the kit |
| spectrophotometer (NnanoDrop) | Thermo Fisher | 9836674 | Other models would work equally well |
| 1.2. De novo transcriptome assembly. | |||
| BUSCO.v3 | https://busco.ezlab.org/ | Any freely available software for assessing trasncriptome completeness can be used. | |
| CLC Genomics workbench | Qiagen | 832021 | Other equivalent software packages are also available |
| Galaxy workbench | https://usegalaxy.org/ | An open source online transcriptome assembly & annotation pipeline | |
| NCBI BLASTx | https://blast.ncbi.nlm.nih.gov/Blast.cgi?LINK_LOC=blasthome&PAGE_TYPE=BlastSearch&PROGRAM=blastx | An open source online alignment and annotation pipeline | |
| 2. cDNA synthesis, Cloning & Miniprep isolation | |||
| ampicillin sodium salt | Gibco | 11593-027 | Products from other vendors would work equally well |
| glycerol | Fisher Scientific | G33-500 | Products from other vendors would work equally well |
| LB broth | Fisher Scientific | BP1426-500 | Products from other vendors would work equally well |
| Omniscript RT (reverse trasncription) kit | Qiagen | 205111 | Detailed specific protocol is provided with the kit |
| One Shot™ TOP10 Chemically Competent E. coli | Invitrogen | C404010 | Detailed specific protocol is provided with the kit |
| Petri dishes | Fisher Scientific | FB0875713 | Products from other vendors would work equally well |
| PureLink Quick Plasmid Miniprep Kit | ThermoFischer | 771471 | Detailed specific protocol is provided with the kit |
| QIAquick PCR purification kit | Qiagen | 28104 | Detailed specific protocol is provided with the kit |
| shaker-incubator | Labnet | 211DS | Other models would work equally well |
| spectrophotometer (NnanoDrop) | Thermo Fisher | 9836674 | Other models would work equally well |
| thermal cycler for PCR | BioRad | T100 | Other models would work equally well |
| TOPO TA Cloning kit | Invitrogen | 1845069 | Detailed specific protocol is provided with the kit |
| X-Gal Solution | Thermo Scientific | R0941 | Products from other vendors would work equally well |
| 2.2 PCR amplification & in vitro dsRNA synthesis | |||
| Centrifuge | Fisher Scientific | accuSpin Micro 17R | Other models would work equally well |
| ethanol | Fisher Scientific | A4094 | Products from other vendors would work equally well |
| FastTaq DNA Polymerase, dNTPack | Roche | 13873432 | This kit contains all the reagents necessary for a PCR |
| MEGAclear Transcriiption clean up kit | ThermoFischer | AM1908 | Detailed specific protocol is provided with the kit |
| MEGAscript T7 Transcription kit | ThermoFischer | AM1334 | Detailed specific protocol is provided with the kit |
| nuclease-free water | Fisher Scientific | AM9932 | Products from other vendors would work equally well |
| QIAquick PCR purification kit | Qiagen | 28104 | Detailed specific protocol is provided with the kit |
| sodium acetate | Fisher Scientific | BP333-500 | Make 3M working solution |
| Spectrophotometer (NnanoDrop) | Thermo Fisher | 9836674 | Other models would work equally well |
| 3. Collecting and preparing early stage T. marmoratus embryos for dsRNA injections | |||
| agarose | Fisher Scientific | 9012-36-6 | Products from other vendors would work equally well |
| distilled water | Fisher Scientific | 9180 | Products from other vendors would work equally well |
| forceps (Dumon #4 Biology) | Fine Science Tools | 11242-40 | Products from other vendors would work equally well |
| glass cavity dish (3 well-dish) | Fisher Scientific | 50-243-43 | Products from other vendors would work equally well |
| microwave | Welbilt | turn-table | Other models would work equally well |
| natural hair paintbrush | Amazon | Any fine brush will do | |
| P1000 micro-pipetter | Gilson | F123602 | Other models would work equally well |
| Petri dishes | Fisher Scientific | FB0875713 | Products from other vendors would work equally well |
| stereomicroscope | Microsocope Central | 10446293 | Any good stereomicroscope will work |
| transfer pipettes | Fisher Scientific | 21-200-109 | Products from other vendors would work equally well |
| 4. dsRNA micro-injections in early stage T. marmoratus embryos | |||
| digital camera | Edmund optics (Qimaging) | Retiga 2000R | Other models would work equally well |
| ethanol | Fisher Scientific | A4094 | Products from other vendors would work equally well |
| food dye | Kroger | Any available food dye should work fine | |
| humidity chamber | take any plastic box with a lid, sterilize it with 70% ethanol and let it dry | ||
| incubator | Labline | 203 | Other models would work equally well |
| injection buffer | Prepared for 1 mL following reference #22 : Mix 10 µL of 0.1 M sodium phosphate buffer, 100 µL of 0.5 M potassium chloride solution, 100 µL of food dye and 790 µL of double-distilled water. Store in 4 °C. | ||
| intracellular Microinjection Systems (Picospritzer) | Parker | 052-0500-900 | Currently the model III is available, but older models work also |
| micro needle holder | A-M Systems | 672441 | Other products would work equally well |
| microinjection needles (1.2 mm x 0.68 mm, 4 inches) | A-M Systems | 603000 | Other models would work equally well |
| micromanipulator | Drummond Scientific Company | 3-000-024-R | Any quality micromanipulator will work |
| monosodium phosphate | Fischer scientific | 7558-80-7 | To make 10 mL of 1 M working solution: Add 1.2 g of monosodium phosphate powder to 10 mL of Double distilled water and mix until clear solution is obtained |
| P-1000 Micropipette Puller | Sutter Instrument | P-1000 | Puller settings:Heat 575, Pull 60, Velocity 75 Delay 110, Pressure 700. |
| P10 micro-pipetter | Gilson | F144802 | Other models would work equally well |
| P1000 micro-pipetter | Gilson | F123602 | Other models would work equally well |
| potassium chloride | Fischer scientific | 7447-40-7 | To make 100 mL of 0.5 M potassium chloride solution: Add 3.73 g of potassium chloride crystals to 100 mL of double distilled water and mix until clear solution is obtained. |
| sodium phosphate buffer (0.1M) | To make 10 mL of 0.1 M of this buffer: Mix 8.5 mL of 1 M sodium phosphate dibasic solution with 1.5 mL of 1 M monosodium phosphate solution. Check the pH with a pH meter and adjust accordingly to pH 7.6 at room temprature. | ||
| sodium phosphate dibasic | Fischer scientific | 7558-79-4 | To make 10 mL of 1 M working solution: Add 1.42 g of sodium phosphate dibasic powder to 10 mL of Double distilled water and mix until clear solution is obtained |
| stereomicroscope | Microsocope Central | 10446293 | Any good stereomicroscope will work |
| 5. Preparing T. marmoratus larvae for dsRNA injections | |||
| agarose | Fisher Scientific | 9012-36-6 | Products from other vendors would work equally well |
| forceps (Dumon #4 Biology) | Fine Science Tools | 11242-40 | Products from other vendors would work equally well |
| Petri dishes | Fisher Scientific | FB0875713 | Products from other vendors would work equally well |
| 6. dsRNA micro-injections in T. marmoratus larvae | |||
| injection buffer (10x) | See section 4 | ||
| microinjection needles (1.2 mm x 0.68 mm, 4 inches) | A-M Systems | 603000 | Other models would work equally well |
| microinjection syringe | A-M Systems | 603000 | Other models would work equally well |
| micro needle holder | A-M Systems | 672441 | Other products would work equally well |
| P-1000 Micropipette Puller | Sutter Instrument | P-1000 | Puller settings:Heat 575, Pull 60, Velocity 75 Delay 110, Pressure 700. |
| stereomicroscope | Microsocope Central | 10446293 | Any good stereomicroscope will work |
Referencias
- Muller, B., Grossniklaus, U. Model organisms - A historical perspective. Journal of Proteomics. 73, 2054-2063 (2010).
- Gilbert, L. A., et al. CRISPR-Mediated Modular RNA-Guided Regulation of Transcription in Eukaryotes. Cell. 154, 442-451 (2013).
- Westerman, E. L., et al. Aristaless Controls Butterfly Wing Color Variation Used in Mimicry and Mate Choice. Current Biology. 28, 3469(2018).
- Perry, M., et al. Molecular logic behind the three-way stochastic choices that expand butterfly colour vision. Nature. 535, 280(2016).
- Boettcher, M., McManus, M. T. Choosing the Right Tool for the Job: RNAi, TALEN, or CRISPR. Molecular Cell. 58, 575-585 (2015).
- Meister, G., Tuschl, T. Mechanisms of gene silencing by double-stranded RNA. Nature. 431, 343-349 (2004).
- Fire, A., et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Kennerdell, J. R., Carthew, R. W. Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway. Cell. 95, 1017-1026 (1998).
- Mello, C. C., Conte, D. Revealing the world of RNA interference. Nature. 431, 338-342 (2004).
- Agrawal, N., et al. RNA interference: Biology, mechanism, and applications. Microbiol. Microbiology and Molecular Biology Reviews. 67, 657(2003).
- Gu, L. Q., Knipple, D. C. Recent advances in RNA interference research in insects: Implications for future insect pest management strategies. Crop Protection. 45, 36-40 (2013).
- Ravisankar, P., Lai, Y. T., Sambrani, N., Tomoyasu, Y. Comparative developmental analysis of Drosophila and Tribolium reveals conserved and diverged roles of abrupt in insect wing evolution. Developmental Biology. 409, 518-529 (2016).
- Tomoyasu, Y., Wheeler, S. R., Denell, R. E. Ultrabithorax is required for membranous wing identity in the beetle Tribolium castaneum. Nature. 433, 643-647 (2005).
- Tomoyasu, Y., Arakane, Y., Kramer, K. J., Denell, R. E. Repeated Co-options of Exoskeleton Formation during Wing-to-Elytron Evolution in Beetles. Current Biology. 19, 2057-2065 (2009).
- Yang, X., et al. Probing the Drosophila retinal determination gene network in Tribolium (II): The Pax6 genes eyeless and twin of eyeless. Developmental Biology. 333, 215-227 (2009).
- ZarinKamar, N., et al. The Pax gene eyegone facilitates repression of eye development in Tribolium. Evodevo. 2, 15(2011).
- Linz, D. M., Clark-Hachtel, C. M., Borras-Castells, F., Tomoyasu, Y. Larval RNA Interference in the Red Flour Beetle, Tribolium castaneum. Journal of Visualized Experiments. , e52059(2014).
- Stahl, A., S, B. R., Cook, T. A., Buschbeck, E. K. A complex lens for a complex eye. Integrative and Comparative Biology. 57, 1071-1081 (2017).
- Yeku, O., Frohman, M. A. Rapid Amplification of cDNA Ends (RACE). RNA, Methods In Molecular Biology. , Springer. 107-122 (2011).
- Miller, S. C., Miyata, K., Brown, S. J., Tomoyasu, Y. Dissecting Systemic RNA Interference in the Red Flour Beetle Tribolium castaneum: Parameters Affecting the Efficiency of RNAi. Plos One. 7, (2012).
- Tomoyasu, Y., Denell, R. E. Larval RNAi in Tribolium (Coleoptera) for analyzing adult development. Development Genes and Evolution. 214, 575-578 (2004).
- Philip, B. N., Tomoyasu, Y. Molecular Methods for Evolutionary Genetics. Orgogozo, V., Rockman, M. V. , Humana Press. 471-497 (2011).
- Mackenzie, S. M., Howells, A. J., Cox, G. B., Ewart, G. D. Sub-cellular localisation of the White/Scarlet ABC transporter to pigment granule membranes within the compound eye of Drosophila melanogaster. Genetica. 108, 239-252 (2000).
- Arakane, Y., Muthukrishnan, S., Beeman, R. W., Kanost, M. R., Kramer, K. J. Laccase 2 is the phenoloxidase gene required for beetle cuticle tanning. Proceedings of the National Academy of Sciences of the United States of America. 102, 11337-11342 (2005).
- Werner, S., Buschbeck, E. K. Rapid and step-wise eye growth in molting diving beetle larvae. Journal of Comparative Physiology. 201, 1091-1102 (2015).
- Prpic, N. M., Schoppmeier, M., Damen, W. G. Gene Silencing via Embryonic RNAi in Spider Embryos. Cold Spring Harbor protocols. 3, 1-4 (2008).
- Sagi, A., Manor, R., Ventura, T. Gene Silencing in Crustaceans: From Basic Research to Biotechnologies. Genes. 4, 620-645 (2013).
- Zhu, K. Y., Palli, S. R. Annual Review of Entomology. Douglas, A. E. 65, Annual Reviews. 293-311 (2020).
- Bauke, A. C., Sasse, S., Matzat, T., Klaembt, C. A transcriptional network controlling glial development in the Drosophila visual system. Development. 142, 2184(2015).
- Lin, C. Y., et al. RNAi analysis of doublesex1 expression in Daphnia pulex Leydig, 1860 (Cladocera). Crustaceana. 92, 137-154 (2019).
- Nguyen, D. V., Christiaens, O., Bossier, P., Smagghe, G. RNA interference in shrimp and potential applications in aquaculture. Reviews in Aquaculture. 10, 573-584 (2018).
- Dijkstra, K. D. B., Monaghan, M. T., Pauls, S. U. Annual Review of Entomology. Berenbaum, M. R. 59, Annual Reviews. 143-163 (2014).
- Crumiere, A. J. J., Khila, A. Hox genes mediate the escalation of sexually antagonistic traits in water striders. Biology. Letters. 15, 5(2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados