Method Article
Interferenza dell'RNA nei Coleotteri acquatici come potente strumento per manipolare l'espressione genica in punti specifici del tempo di sviluppo
In questo articolo
Riepilogo
L'interferenza dell'RNA è una tecnica potente e ampiamente applicabile per manipolare l'espressione genica in fasi di sviluppo specifiche. Qui, descriviamo i passaggi necessari per l'implementazione di questa tecnica nel coleottero subacqueo acquatico Thermonectus marmoratus, dall'acquisizione di sequenze geniche al knockdown di geni che influenzano la struttura o il comportamento.
Abstract
L'interferenza dell'RNA (RNAi) rimane una potente tecnica che consente la riduzione mirata dell'espressione genica attraverso la degradazione dell'mRNA. Questa tecnica è applicabile a un'ampia varietà di organismi ed è altamente efficiente nell'ordine ricco di specie Coleoptera (coleotteri). Qui, riassumiamo i passi necessari per sviluppare questa tecnica in un nuovo organismo e illustriamo la sua applicazione alle diverse fasi di sviluppo del coleottero subacqueo acquatico Thermonectus marmoratus. Le sequenze genetiche target possono essere ottenute in modo conveniente attraverso l'assemblaggio di trascrimami contro un parente stretto con genomica nota o de novo. La clonazione genica candidata utilizza un vettore di clonazione specifico (il plasmide pCR4-TOPO), che consente la sintesi dell'RNA a doppio filamento (dsRNA) per qualsiasi gene con l'uso di un singolo primer comune. Il dsRNA sintetizzato può essere iniettato in entrambi gli embrioni per i primi processi di sviluppo o larve per i processi di sviluppo successivi. Illustriamo poi come l'RNAi può essere iniettato nelle larve acquatiche usando l'immobilizzazione nell'agarose. Per dimostrare la tecnica, forniamo diversi esempi di esperimenti RNAi, generando abbattimenti specifici con fenotipi previsti. In particolare, l'RNAi per il gene abbronzante laccase2 porta all'alleggerimento delle cuticola sia nelle larve che negli adulti, e l'RNAi per il gene della pigmentazione degli occhi bianco produce un alleggerimento/mancanza di pigmentazione nei tubi degli occhi. Inoltre, il knockdown di una proteina lente chiave porta a larve con carenze ottiche e una ridotta capacità di caccia alle prede. Combinati, questi risultati esemplificano la potenza dell'RNAi come strumento per studiare sia il patternfismo morfologico che i tratti comportamentali negli organismi con solo database trascrittimici.
Introduzione
La questione di come geni specifici contribuiscano all'evoluzione dei diversi tratti è un argomento interessante in biologia. Nel corso degli ultimi decenni, sono stati fatti molti progressi per quanto riguarda la sezionazione delle basi genetiche dei processi di sviluppo in alcuni organismi modello, come il nematode Caenorhabditis elegans, la mosca della frutta Drosophila melanogaster, e il topo di casa Mus musculus1. Più recentemente, l'invenzione di potenti tecniche di modifica genica come le brevi ripetizioni palindromiche (CRISPR) raggruppate regolarmenteinterspaziate /Cas9 2 ha fornito la possibilità di modificare il codice genetico degli organismi non modello (per esempi vedi3,4). Di conseguenza, c'è stato un aumento degli studi genetici su una varietà di organismi che non erano stati precedentemente affrontati attraverso tecniche molecolari. Considerando l'enorme diversità del nostro regno animale, con molti tratti interessanti o variazioni di tratti che sono rappresentati solo in specie specifiche, questo progresso lo ha reso un momento emozionante per il lavoro correlato alla biologia evolutivo-sviluppo ("evo-devo"). Tuttavia, le tecniche di modifica del genoma disponibili per gli organismi non modello sono relativamente limitate per quanto riguarda i punti temporali di sviluppo a cui possono essere applicate, rendendo difficile discernere le proprietà temporali relative al ruolo che specifici geni svolgono in qualsiasi tratto. Inoltre, le tecniche transgeniche sono spesso limitate a geni che non sono inenziali per la sopravvivenza (cioè, il cui knockout non si traduca in letalità). Pertanto, mentre le tecniche di modifica genica hanno iniziato a diventare popolari, rimane la necessità di tecniche efficaci applicabili a una varietà di organismi diversi in specifici punti di tempo di sviluppo e facilitano i knockdown parziali (piuttosto che la completa perdita di funzione). Qui, prendiamo l'attenzione sull'interferenza dell'RNA (RNAi), una tecnica di abbattimento genico5 un po' datata ma potente che è particolarmente preziosa come approccio sinergico all'editing genico. In particolare, abbiamo sviluppato procedure che consentono l'applicazione dell'RNAi ai coleotteri subacquei acquatici come esempio che illustra l'implementazione di questa tecnica, dall'acquisizione delle sequenze molecolari necessarie all'iniezione di RNA a doppio filamento (dsRNA) in uova e larve.
Il knockdown genico basato su RNAi sfrutta un meccanismo di difesa innato degli organismi, in cui le molecole di dsRNA facilitano il silenziamento delle sequenze di acido nucleico invasori, come virus e trasposoni6. In breve, il dsRNA viene assunto nella cellula, dove viene tagliato in 20-25 pezzi di nucleotidi dall'enzima Dicer. Questi pezzi attivano quindi la formazione del complesso di silenziamento indotto dall'RNA (RISC), che inibisce l'mRNA mirato legandolo ad esso in siti specifici utilizzando il filo guida. Questo processo porta infine alla degradazione dell'mRNA e quindi interferisce con la traduzione dell'mRNA nella rispettiva proteina6. La tecnica di abbattimento genico a base di RNAi qui presentata si basa quindi sull'iniezione di dsRNA. Per i modelli animali, questa tecnica è stata originariamente sviluppata in C. elegans7 e D. melanogaster8, ma da allora è emersa come un potente strumento genetico funzionale negli organismi non modello9,10. A causa della sua natura altamente efficace in alcuni insetti, RNAi può anche essere applicato nella gestione dei parassiti11.
Come strumento di ricerca, l'RNAi è stato utilizzato per esaminare il funzionamento delle principali vie molecolari-sviluppo nei modelli di insetti non tradizionali. Ad esempio, l'RNAi nel coleottero della farina Tribolium castaneum è stato determinante nel determinare quanto profondamente conservati i geni contribuiscono a tratti specifici in quel coleottero, come esemplificato per lo sviluppo di ali appositamente sagomato12,13,14 e occhi15,16. Le tecniche che sono alla base delle manipolazioni in T. castaneum sono stateben descritte 17 e si basano sulla capacità di immobilizzare uova e larve relativamente secche su una superficie appiccicosa. Tale immobilizzazione tuttavia non è possibile per le forme di sviluppo bagnato di organismi acquatici come il Sunburst Diving Beetle Thermonectus marmoratus. Come nel caso di molti organismi modello non-tradizionali, manca di un genoma annotato. Per manipolare l'espressione genica in qualsiasi organismo senza genoma, un primo passo ragionevole ed economico è quello di generare trascrittomi e identificare le sequenze di nucleotidi putativi dei geni espressi di interesse sulla base della somiglianza della sequenza con gli organismi modello correlati ma più consolidati, in questo caso, principalmente tribolium (Coleoptera) e geni Drosophila.
Qui, per dimostrare come l'RNAi può essere utilizzato su un organismo acquatico, discutiamo innanzitutto protocolli e software per l'estrazione dell'RNA e la generazione e assemblaggio del trascrizione, che consentono l'identificazione di specifiche sequenze geniche mirate. Riassumiamo quindi i passi necessari per sintetizzare il dsRNA specifico del gene. Successivamente, illustriamo come le uova possono essere iniettate in un ambiente acquatico e dimostriamo protocolli di incubazione per la ficatura dello sviluppo di embrioni. Inoltre, mostriamo come il gel di agarose può essere utilizzato per immobilizzare completamente le larve durante il processo di iniezione, una tecnica che è generalmente utile durante varie procedure e potrebbe essere applicata a una varietà di artropodi. Per dimostrare come l'RNAi possa essere applicato a diversi stadi di sviluppo, includiamo un esempio in cui abbiamo messo a tacere il gene della pigmentazione degli occhi bianco negli embrioni. Inoltre, descriviamo un esempio in cui il gene abbronzante laccase2(lac2) è stato silenziato sia durante la seconda instar larvale (per influenzare le larve della terza stella larvale) che la terza instar larvale (per colpire gli adulti). Infine, dimostriamo che l'iniezione di una minore concentrazione di dsRNA porta a un abbattimento parziale, il che dimostra che questa tecnica può essere applicata anche ai geni in cui la perdita di funzione è nota per essere letale.
Protocollo
1. Isolamento dell'RNA e assemblaggio del trascrimama de novo
- Eseguire l'isolamento totale dell'RNA dalla terza fase instar diving coleottero larva tubi e coleotteri adulti utilizzando un kit di isolamento RNA (vedi Tabella dei materiali) che è progettato per il tessuto ricco di lipidi. Isolare l'RNA totale da T. marmoratus e sequenziarlo seguendo i metodi descritti inprecedenza 18.
- Assemblaggio del trascrimama De novo
NOTA: Per assemblare il trascrittima de novo, è possibile utilizzare varie piattaforme bioinformatiche (vedere Tabella dei materiali). Queste piattaforme sono disponibili in modo commerciale e, in alcuni casi, esistono come script della riga di comando basati su Unix. Poiché l'assieme è de novo, si consiglia di assemblare i trascrimati in modo indipendente su due piattaforme e confrontare i risultati per escludere falsi positivi o falsi negativi.- Per iniziare ad assemblare i trascrittami, carica le letture grezze sulla rispettiva piattaforma bioinformatica.
NOTA: questi file sono in genere compressi e nel formato FASTQSANGER. Gz. Non è necessario decomprimere i file in quanto questo formato viene accettato nel passaggio successivo. - Utilizzando la riga di comando Trimmomatic, tagliare le letture non prime per rimuovere le sequenze di adattatori o le letture brevi che scendono al di sotto della soglia predefinita. Decomprimere le letture raw tagliate; i file saranno ora in formato FASTQ. Concatenare le letture non elaborati DI FASTQ per ogni esempio per ottenere i file pronti per l'assembly de novo.
- Assemblare le letture non elaborati concatenate de novo utilizzando qualsiasi script della riga di comando in grado di assemblare trascrizioni de novo. Salvare il trascrimatura assemblato, che ora avrà un elenco di conti con le rispettive sequenze, come file FASTA. Per aumentare la copertura dell'assieme, combinare e assemblare più trascrimi per la stessa specie.
NOTA: Questo processo aumenta le probabilità di generare contig più accurati ed è particolarmente importante se i geni a basso numero di copie sono di interesse. - Una volta assemblato, valutare il trascrimamento per la completezza calcolando i punteggi di copertura (il software di valutazione della copertura è liberamente disponibile, vedere Tabella dei materiali).
NOTA: un trascrittoma con un punteggio di copertura >75% è considerato buono. Tuttavia, la pertinenza di questo punteggio dipende dal motivo della generazione del trascrima. Ad esempio, se il trascrittoma viene utilizzato per identificare i geni a basso numero di copie, un punteggio >85% è migliore, in quanto significa una maggiore copertura. - Annotare il trascrimamo assemblato de novo utilizzando uno strumento di ricerca di allineamento locale di base (BLAST; vedere Tabella dei materiali).
NOTA: Per questo esperimento, il trascrittima è stato annotato principalmente contro un database di proteine Drosophila conosciute e un database di proteine di coleotteri conosciute. L'elenco delle annotazioni può essere scaricato come un file di foglio di calcolo e contig / contigs che indicano la somiglianza di sequenza con le proteine di altri organismi possono essere scaricati come un file FASTA. - Identificare il numero/numeri di contig della proteina di interesse ed estrarre le sequenze nucleotidi. Utilizzare BLAST per identificare se le regioni conservate specifiche delle proteine (come i domini homeobox) sono presenti nella sequenza di interesse nucleotide annotata. Controllare altri conti con la stessa annotazione per le sovrapposizioni della sequenza nucleotide per generare la sequenza di una trascrizione specifica del gene.
NOTA: Identificare i contig con sovrapposizione di sequenze non è di solito possibile per tutti i geni, specialmente per i geni a basso numero di copie. - Se è necessaria la sequenza completa del gene, iniziare con il contig che ha la più alta somiglianza di sequenza come punto di iniziazione per identificare la sequenza nucleotide dell'intera trascrizione matura utilizzando tecniche come l'amplificazione rapida di 3 e 5 o più di estremità CDNA (RACE19).
- Annotare l'assembly ottenuto dalla seconda piattaforma seguendo i passaggi 1.2.4–1.2.7.
NOTA: Idealmente, i risultati dovrebbero essere simili per le proteine di interesse; tuttavia, la copertura può differire in una certa misura tra le piattaforme. - Utilizzare il trascrimatore assemblato per sintetizzare il dsRNA specifico della specie come descritto nella sezione 2.
- Per iniziare ad assemblare i trascrittami, carica le letture grezze sulla rispettiva piattaforma bioinformatica.
2. Clonazione e sintesi dsRNA specifica del gene
NOTA: la clonazione e la sintesi dsRNA specifiche del gene sono state descritte in dettaglio per T. castaneum20,21,22. I passaggi seguenti sono una breve panoramica.
- Clonazione, trasformazione batterica e sequenziamento plasmide
- Isolare l'RNA totale dall'organismo (come descritto al punto 1.1) e creare DNA complementare (cDNA) utilizzando un kit di trascrizione inversa (vedi Tabella dei materiali). Identificare una o due sequenze di nucleotidi da 100-1000 bp da contig specifici per i geni di interesse.
- Progetta coppie primer che coprono l'intero tratto identificato di nucleotidi e amplificano la sequenza attraverso una reazione a catena di polimerasi (PCR). Aggiungere un passo extra di 30 minuti alla fine per creare sbalzi di adenina di 3 gradi nel prodotto di DNA amplificato. Purificare questo prodotto utilizzando un kit di purificazione PCR (vedere Tabella dei materiali).
- Clonare il prodotto purificato in un vettore plasmid pCR4-TOPO (vedere Tabella dei materiali) seguendo il protocollo del fornitore fornito con il kit di clonazione. L'utilizzo di un trattamento termo-shock trasforma i plasidi clonati in cellule batteriche competenti (ceppo: E.coli DH10B) seguendo il protocollo del fornitore per le cellule competenti (vedere Tabella dei materiali) e lo screening per le cellule trasformate con successo.
NOTA: Le piastre con colonie possono essere avvolte in pellicola di paraffina per trattenere l'umidità e conservate a 4 gradi centigradi per un massimo di un mese. - Raccogliere le colonie di cellule trasformate utilizzando una punta di pipetta da 10 L e una coltura in brodo di lisogenia (LB) contenente ampicillina (50 g/mL) in uno shaker-incubatore a 37 gradi centigradi e 200 giri/min per 24 h.
NOTA: Per l'immagazzinamento a lungo termine, le cellule sevate possono essere diluite 1:1 con glicerolo al 100% e congelate a -80 gradi centigradi come scorte di glicerolo. - Isolare i plasmidi contenenti il gene di interesse di questa coltura utilizzando un kit di isolamento miniprep (vedere Tabella dei materiali). Conservare i plasmidi isolati (miniprep) a -20 gradi centigradi dopo aver valutato la resa spettrofotometricamente. In particolare, misurare l'assorbimento del campione a 260 nm, 280 nm e 230 nm. Calcolare i rapporti A260/A280 per la quantificazione del DNA e A260/A230 per quantificare la purezza del DNA.
NOTA: Un rapporto 260/280 di 1,8 è generalmente accettato come DNA sufficientemente puro, rapporti inferiori a 1,5 indicano la presenza di reagenti di estrazione residua come il fenolo. Il rapporto 260/230 deve essere maggiore o uguale al rapporto 260/280. Rapporti più bassi indicano la contaminazione residua del reagente. La resa varia in genere da 100 a 500 ng/L. - Sequenziare i miniprep isolati per confermare che il frammento specifico del gene è stato integrato con successo, essendo affiancato tra le regioni promotrice di 5 e 3 T3 nel plasmide; questo può essere fatto utilizzando universali T7 e T3 primer sequenziamento22. Utilizzare i miniprep con la sequenza di interesse genica specifica per la preparazione del dsRNA.
- Isolare l'RNA totale dall'organismo (come descritto al punto 1.1) e creare DNA complementare (cDNA) utilizzando un kit di trascrizione inversa (vedi Tabella dei materiali). Identificare una o due sequenze di nucleotidi da 100-1000 bp da contig specifici per i geni di interesse.
- Amplificazione PCR e sintesi dsRNA in vitro
- Amplificazione PCR e purificazione del prodotto
- Progettare primer specifici o specifici del genere che hanno la sequenza di promotore T7 sui loro lati 5' (vediriferimento 22 per i dettagli) per amplificare un frammento lineare del gene inserito. Ottimizzare la resa impostando almeno 10 reazioni di 20 L ciascuna.
NOTA: Il prodotto risultante è affiancato da due siti di legame polimerasi T7 da 20 pb. - Purificare il prodotto PCR utilizzando un kit di purificazione del prodotto PCR (vedere Tabelladei materiali ), seguendo il protocollo di eluizione basato su colonna del fornitore. Per aumentare la resa, ripetere il passo finale di eluizione fino a 3 volte con lo stesso eluente. Valutare la resa spettrofotometricamente.
NOTA: La resa varia di solito da 100 a 700 ng/L. Questo prodotto purificato può essere conservato a -20 gradi centigradi fino a un ulteriore utilizzo.
- Progettare primer specifici o specifici del genere che hanno la sequenza di promotore T7 sui loro lati 5' (vediriferimento 22 per i dettagli) per amplificare un frammento lineare del gene inserito. Ottimizzare la resa impostando almeno 10 reazioni di 20 L ciascuna.
- Sintesi e purificazione del dsRNA in vitro
- Utilizzare il prodotto purificato PCR specifico per sintetizzare il dsRNA in vitro secondo il protocollo di un kit di sintesi dsRNA di scelta. Se necessario, prolungare il tempo di incubazione per una maggiore produzione di dsRNA.
- Valutare la progressione della reazione in base all'opacità della miscela di reazione (maggiore è la quantità del prodotto dsRNA, maggiore è la torbidità). Alla fine dell'incubazione, interrompere la reazione utilizzando un trattamento DNase. A tal fine aggiungere 1 L da uno stock di 2 U/L, alla miscela di reazione. Estendere questo trattamento a 1-2 h per garantire la degradazione ottimale del DNA modello.
- Purificare il dsRNA con un kit di purificazione o con i seguenti passaggi.
- Diluire il prodotto risultante con 115 L di acqua senza nucleasi e aggiungere 15 L di 3 M di acetato di sodio. Aggiungere 2 volumi di etanolo 100% ghiacciato a questa miscela di reazione e far precipitare il dsRNA durante la notte a -20 gradi centigradi.
NOTA: A questo punto, i campioni possono essere conservati in modo sicuro senza influire sulla resa finale. - Centrifugare il precipitato a 0 gradi centigradi per 20 min a 9000 x g e scartare il supernante. Lavare il prodotto una volta con etanolo e 70% e centrifuga a freddo ghiaccio per 15 min a 13000 x g.
- Rimuovere il supernatante e asciugare l'aria il pellet per 5-15 min. Rispendere il pellet in un massimo di 40 L di acqua senza nucleasi (questo volume può essere regolato in base alla dimensione isolata del pellet) e valutare la resa e la purezza spettrofotometricamente, come descritto al punto 2.1.4.
- Conservare il dsRNA purificato a -20 gradi centigradi fino a nuovo utilizzo. Utilizzare il dsRNA purificato per l'iniezione nella fase di sviluppo desiderata.
- Diluire il prodotto risultante con 115 L di acqua senza nucleasi e aggiungere 15 L di 3 M di acetato di sodio. Aggiungere 2 volumi di etanolo 100% ghiacciato a questa miscela di reazione e far precipitare il dsRNA durante la notte a -20 gradi centigradi.
- Amplificazione PCR e purificazione del prodotto
3. Raccolta e preparazione degli embrioni T. marmoratus in fase iniziale per iniezioni di dsRNA
- Preparare una piastra di agarose per l'incubazione degli embrioni di T. marmoratus.
- In primo luogo, sciogliere 20 mg di polvere di agarose a bassa fusione in 100 mL di acqua distillata autoclave (2% agarose) e poi far bollire questa miscela in un forno a microonde fino a ottenere una soluzione chiara. Fare attenzione con la soluzione calda, come bolle d'aria possono causare l'overflow.
- Eroga questa soluzione in un piccolo piatto Petri. Per fare scanalature (che terranno gli embrioni) sulla superficie della piastra di agarose, posizionare tre tubi di plastica larghi da 1 a 2 mm (come le punte delle pipette di trasferimento di plastica) sulla superficie dell'agarose liquido prima che si solidifica.
- Una volta che l'agarose si solidifica, utilizzare un paio di forcette smussate per rimuovere questi tubi. Aggiungere 500 L di acqua distillata autoclave utilizzando una micropipetta P1000 per coprire queste rientranze nell'agarose.
- Utilizzando una sottile spazzola per capelli naturale, raccogliere gli embrioni di T. marmoratus che sono vecchi di 5-8 h dai siti di nidificazione degli scarabei in un piatto di cavità di vetro pieno di acqua distillata autoclave. Monitorare frequentemente i siti di nidificazione per assicurare che le uova ottenute siano dell'età corretta.
- Dechorionate gli embrioni sotto uno stereomicroscopio usando le force per la dissezione fine. Per farlo, visualizzare il chorion al microscopio (all'ingrandimento desiderato) posizionando la sorgente luminosa ad un angolo appropriato, quindi afferrare il chorion da due lati con le forcende affilate, strapparlo e far scorrere delicatamente l'embrione. Poiché sono presenti due livelli, assicurarsi che entrambi vengano rimossi.
- Utilizzando una sottile spazzola per capelli naturale, trasferire con cura gli embrioni dal piatto di cavità di vetro alla piastra di agarose e disporli nelle scanalature sotto uno stereomicroscopio. Fare molta attenzione durante questo processo, poiché gli embrioni decorresi sono molto fragili. Utilizzare gli embrioni preparati per le iniezioni di dsRNA.
NOTA: L'estremità leggermente più spessa è il lato dell'embrione in cui si svilupperà la testa.
4. microiniezioni dsRNA negli embrioni T. marmoratus in fase iniziale
- Per iniettare embrioni in fase iniziale con dsRNA specifico del gene, preparare gli aghi di microiniezione utilizzando un erettatore di aghi di microiniezione (vedi Tabella dei materiali). Durante la visualizzazione della punta dell'ago sotto uno stereomicroscopio, utilizzare un paio di forcemmi sottili per rompere la punta dell'ago, creando un bordo tagliente. Idealmente, rompere la punta dell'ago in diagonale in modo che un bordo più nitido rimanga su un lato, che gli permetterà di entrare nell'embrione causando lesioni minime.
- Scongelare la soluzione di dsRNA di brodo purificato sul ghiaccio, aggiungere 1 L del tampone di iniezione 10x e completarla con acqua doppia distillata, per fare 10 L di soluzione di iniezione. Per le iniezioni, una concentrazione di dsRNA di 1 g/L di solito è adatta, ma può essere regolata in base alla gravità fenotipico degli animali risultanti).
NOTA: Preparare 1 mL di buffer di iniezione 10x22 aggiungendo 10 L di buffer di fosfato di sodio 0,1 M (realizzato mescolando 8,5 mL di 1 M Na2HPO4 e 1,5 mL di 1 M NaH2PO4 regolato su un pH 7,6 a 25 gradi centigradi con 100 L di 0,5 M KCl), 100 L di colorante alimentare e 790 L di acqua a doppia distillazione.- Utilizzando una pipetta P10, riempire l'ago della microiniezione con la soluzione dsRNA funzionante. Una volta che la soluzione ha riempito la punta dell'ago, attaccarla a un supporto di microneedle collegato a un sistema di microiniezione che utilizza la tecnologia di espulsione della pressione (vedi Tabella dei materiali).
- Accendere il sistema di microiniezione e l'alimentazione d'aria pressurizzata. Utilizzando la microvalve sul sistema di microiniezione, regolare la pressione di iniezione a 15 psi. Regolare la durata dell'iniezione utilizzando la manopola di regolazione del tempo (impostarla su "Secondi").
- Poiché la durata dell'iniezione dipende dal volume di iniezione richiesto, se necessario, regolare questo parametro sul sistema di microiniezione prima di ogni iniezione. Utilizzare un volume di iniezione di 1–2 nL per gli embrioni T. marmoratus in fase iniziale.
NOTA: Volumi di iniezione più elevati tendono a interferire con il tasso di sopravvivenza dell'embrione.
- Poiché la durata dell'iniezione dipende dal volume di iniezione richiesto, se necessario, regolare questo parametro sul sistema di microiniezione prima di ogni iniezione. Utilizzare un volume di iniezione di 1–2 nL per gli embrioni T. marmoratus in fase iniziale.
- Per misurare il volume del fluido di iniezione erogato dal sistema di microiniezione, calibrare l'ago di iniezione valutando il volume della bolla fluida che si forma sulla punta dell'ago durante l'iniezione nell'aria. Per gli embrioni di T. marmoratus, utilizzare una dimensione ottimale della bolla di 100-200 m. L'ago di iniezione è di buona qualità se questo può essere raggiunto a 15 psi con una durata di iniezione di s.
- Allineare l'ago e la piastra di agarose contenente gli embrioni sotto uno stereomicroscopio, in modo che l'ago si avvicini agli embrioni con un angolo compreso tra 45 e 60 gradi.
- Utilizzando il micromanipulatore, spostare lentamente il microneedle monitorando il progresso attraverso lo stereomicroscopio. Una volta che la punta dell'ago tocca la superficie di un embrione, spostare con attenzione l'ago in avanti fino a quando non perfora la superficie dell'embrione. Non perforare l'embrione profondamente con la punta dell'ago poiché questo può influenzare la sopravvivenza dell'embrione. Per ridurre la variabilità, consegnare l'iniezione nel mezzo dell'embrione.
- Una volta che l'ago è all'interno dell'embrione, premere con attenzione il pulsante di iniezione del micro-iniettore per fornire la dose di dsRNA all'embrione. Dopo aver iniettato 1–2 nL di dsRNA, ritrarre lentamente l'ago dall'embrione, in modo che non causi la rottura dell'embrione.
- Iniettare gli altri embrioni in modo simile. Se l'ago della microiniezione viene bloccato durante la procedura, sbloccarlo aumentando la pressione e la durata dell'iniezione. Identificare visivamente gli embrioni iniettati con successo dalla presenza di una macchia colorata nel sito dell'iniezione (poiché il buffer di iniezione contiene colorazione alimentare).
- Posizionare con cura il piatto con gli embrioni iniettati in una camera di umidità.
- Per costruire una camera del genere, prendere qualsiasi scatola di plastica con un coperchio, sterilizzarla con il 70% di etanolo, lasciare asciugare e mettere il tessuto imbevuto di acqua autoclaved sul fondo per fornire un ambiente umido. Collocare questa camera di umidità in un'incubatrice con una temperatura adeguata (in questo caso, 25 gradi centigradi) e un ciclo di luce di 14 h di luce e 10 h di buio.
- Consentire agli embrioni iniettati di svilupparsi in larve first instar, che richiede 4-5 giorni. Monitorare quotidianamente lo stato di avanzamento dello sviluppo embrionale utilizzando uno stereomicroscopio per identificare i fenotipi knockdown morfologicamente visibili come illustrato nella Figura 2.
- Documenta questo progresso scattando immagini digitali utilizzando una fotocamera ad alta risoluzione. Rimuovere gli embrioni morti e ricostituire l'acqua sulla piastra di agarose ogni giorno per evitare la disidricazione e la possibile diffusione della contaminazione microbica ad altri embrioni sopravvissuti durante il periodo di incubazione.
- Eseguire controlli appropriati per le iniezioni di dsRNA, comprese le iniezioni di buffer, le iniezioni di dsRNA sintetizzate contro il filo del senso del gene di interesse e le iniezioni di dsRNA sintetizzate rispetto a sequenze che non esistono all'interno dell'organismo bersaglio. Confermare RNAi knockdown utilizzando metodi molecolari aggiuntivi22.
5. Preparazione delle larve di T. marmoratus per iniezioni di dsRNA
NOTA: A differenza degli embrioni in fase iniziale, le larve di T. marmoratus sono relativamente robuste e possono essere iniettate con volumi più grandi. Ad esempio, i secondi instar possono essere iniettati con fino a 2 L di soluzione di lavoro dsRNA e terzi instar con almeno 3 L senza effetti negativi evidenti sul tasso di sopravvivenza. Per iniettare il dsRNA, è utile immobilizzare le larve incorporandole nell'agarose.
- Prima di raccogliere le larve, sciogliere il 2% di agarose e tenerlo in un bagno d'acqua a 60-70 gradi centigradi per mantenerlo in forma liquida. Preparare un piatto di immobilizzazione versando il 2% di agarose fuso in un piccolo piatto Petri e poi raffreddare fino a solidificarsi. Utilizzare le forcerse smussate per fare una scanalatura poco profonda nella piastra di agarose (circa le dimensioni dell'artropode da incastore) per ogni animale che verrà iniettato.
- Raccogliere le giovani larve nella fase di sviluppo appropriata (una fase precedente alla fase desiderata per l'analisi). Per fare questo, drenare con attenzione l'acqua dalle tazze di coltura contenenti le larve e seguire i passaggi menzionati di seguito.
- Anestetizzare sul ghiaccio (raccogliere con attenzione la larva dalla sua coppa d'acqua e posizionarla delicatamente sul ghiaccio) fino a quando la larva non mostra movimenti notevoli. Utilizzare pinza smussata e morbida per sollevare con cura la larva dal ghiaccio e posizionarla sullo stadio di immobilizzazione con il collo e il corpo nella scanalatura, ma la sua coda si trova sopra la superficie agarose in modo che non venga coperta, il che consente alla larva di continuare a respirare attraverso i suoi spiracoli di coda.
- Coprire la larva con uno spesso strato di agarose che è ancora liquido ma non pericolosamente caldo. Se è stato accidentalmente coperto, utilizzare le pinne per liberare la coda e i due segmenti sotto di esso dal agarose. Una volta che l'agarose si solidifica, utilizzare la larva per le iniezioni di dsRNA.
6. microiniezioni dsRNA nelle larve di T. marmoratus
- Preparare e riempire un ago di microiniezione con la quantità desiderata di soluzione di lavoro dsRNA specifica del gene (come descritto nei punti 4.1–4.2). Attaccare l'ago a un supporto dell'ago collegato a una siringa microiniezione controllata manualmente. Prima di attaccare l'ago, tirare lo stantuffo della siringa fino in fondo per evitare di esaurirlo della pressione di iniezione a metà procedura.
- Posizionare la larva immobilizzata in modo che il sito di iniezione, che si trova dorsalmente tra il terzo e il quarto segmento della piastra del corpo, sia allineato con la traiettoria dell'ago della microiniezione ad un angolo relativamente piatto (quasi parallelo allo stadio).
NOTA: La pesca dell'ago e della larva in questa posizione è importante, in quanto fornisce il percorso di minor resistenza per la punta dell'ago per perforare le larve con danni minimi. - Una volta che l'ago e la larva sono stati posizionati, spostare con attenzione la punta dell'ago nella larva utilizzando il micromanipolatore mentre si monitora il progresso attraverso uno stereomicroscopio.
- Dopo che la punta perfora il tessuto, applicare lentamente e con attenzione la pressione sulla siringa. Regolare la pressione di iniezione osservando il movimento del fluido di iniezione colorato nell'ago al microscopio.
- Ritirare con cura l'ago dopo l'iniezione. Utilizzare le forcerse morbide per staccare e quindi liberare la larva dall'agarose. Trasferire la larva in un contenitore con acqua (a temperatura ambiente) e permettergli di svilupparsi ulteriormente in un'incubatrice o in una stanza di coltura a 25,0228 gradi centigradi e in un ciclo di luce di 14 h di luce e 10 h di buio.
- Impiegare adeguate iniezioni di controllo e quantificazioni di knockdown, come descritto al punto 4.10.
Risultati
Utilizzando il protocollo descritto in precedenza, abbiamo abbattuto tre diversi geni, vale a dire, bianco, laccase2 (lac2) e Lens3 (Tabella 1), in una varietà di diverse fasi di sviluppo del Sunburst Diving Beetle T. marmoratus. Abbiamo eseguito RNAi in T. marmoratus iniettando dsRNA in una fase molto precoce durante l'embriogenesi (Figura 1A). Poiché alcuni degli embrioni non sopravvivono al processo e diventano necrotici (Figura 1B), devono essere rimossi per mantenere sani gli embrioni rimanenti. Esemplificate qui sono le iniezioni di dsRNA contro il gene bianco. Questo gene è ben noto in Drosophila come uno dei tre trasportatori di cassette associazioni ATP (ABC) coinvolti nell'assorbimento e stoccaggio dei precursori del pigmento23. Di conseguenza, la sua perdita di funzione si traduce in un fenotipo senza errori, occhio bianco. I nostri risultati mostrano che le iniezioni di dsRNA mirate al gene bianco ortologo negli embrioni di T. marmoratus portano alla perdita della pigmentazione degli occhi nelle larve appena emergenti. In questo caso, le larve di tipo selvatico sono caratterizzate da occhi fortemente pigmentati, e il knockdown RNAi del bianco porta a vari livelli di riduzione e persino completa eliminazione del pigmento oculare. Complessivamente, abbiamo osservato almeno una certa riduzione della colorazione degli occhi nel 34% degli embrioni sopravvissuti (n - 35). Figura 2A confronta un individuo di controllo e un individuo con un colore degli occhi leggermente più chiaro. Figura 2B illustra un knockdown più grave in un individuo, in cui gli occhi più ventrali (Occhi 2-5) del cluster sono completamente nonpigmented, mentre gli occhi dorsali mostrano ancora una certa pigmentazione. Queste differenze evidenziano come l'efficienza del knockdown possa variare a livello regionale, che è probabilmente correlata alle differenze nell'efficacia della penetrazione del dsRNA nel tessuto denso. Un altro individuo mostra essenzialmente la perdita di pigmento completa in tutti gli occhi( Figura 2C).
Per studiare il modo in cui funziona l'RNAi nella fase larvale di T. marmoratus,abbiamo iniettato il dsRNA che ha iniettato il gene tannico lac2 in seconde larve instar pochi giorni prima che fossero dovute alla muta in terza stella(Figura 3) e valutato l'effetto sulla colorazione cuticolare delle larve della terza stella. Lac2 è un tipo di fenolossida che coniuga ossidativamente le proteine per renderle insolubili, più dure e più scure. Knockdown nel coleottero di farina T. castaneum ha dimostrato di portare a individui di colore più chiaro in basse dosi, ma è considerato letale in dosi elevate24. Figura 4 illustra che questo trattamento porta anche a colori più chiari Sunburst Diving Beetle larve. In particolare, in questo esperimento, il 75% delle larve iniettate sopravvissute (n e 12) aveva ridotto la pigmentazione (rispetto allo 0% nel gruppo di controllo). Figura 4A mostra un individuo con depigmentazione relativamente lieve, mentre Figura 4C illustra la testa di una larva T. marmoratus in cui la colorazione scura della cuticola è quasi assente. La depigmentazione è stata particolarmente evidente per il patterning scuro centrale che è tipico per queste larve, mentre questo modello è rimasto chiaramente visibile in un individuo iniettato da controllo (Figura 4B). Inoltre, è stato osservato un alleggerimento della trachea della coda, come illustrato nella Figura 4D. Nel caso in cui lac2 dsRNA sia stato iniettato nelle larve della terza stella, sono stati ottenuti individui adulti più leggeri (Figura 5). Si noti che le ali dello scarabeo knockdown sono in qualche modo deformate, probabilmente a causa della sua insolita morbidezza.
Oltre ad alterare i tratti morfologici, è possibile utilizzare RNAi per colpire i geni che influenzano il comportamento. Per dimostrarlo, abbiamo eseguito RNAi contro un gene chiave di codifica della proteina della lente, Lens318,e l'abbiamo iniettato nelle seconde larve instar per influenzare le proprietà ottiche degli occhi larvi della terza stella. Eventuali effetti sulla lente qui osservati sono probabili perché gli occhi delle larve di T. marmoratus subiscono una forte crescita oculare in questa transizione, che comporta anche importanti cambiamenti ottici della lente25. L'abbattimento dell'RNAi in questo esperimento è stato altamente efficiente. La verifica tramite qPCR ha mostrato un tasso di successo del 100%; su 13 individui testati, 12 sono stati abbattuti a meno del 10% del livello di espressione degli individui di controllo, mentre l'individuo rimanente ha un livello di espressione del 17% del livello di controllo (osservazione inedita). A livello fenotipico, solo alcuni individui sono stati gravemente handicappati o incapaci di catturare le prede, come illustrato nella Figura 6 per un individuo che si è avvicinato ripetutamente alla sua preda da una distanza molto ravvicinata ma costantemente superato.
Tabella 1: Sequenze primer e amplificani per proteine bianche, lac2 e Lens3. Clicca qui per scaricare questa tabella.
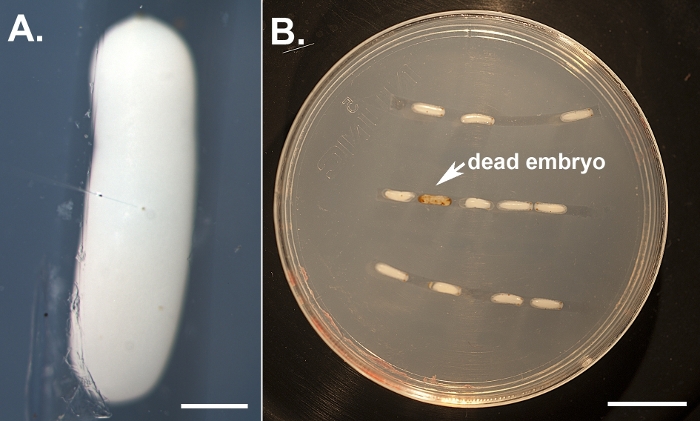
Figura 1: Illustrazione delle iniezioni di embrioni. (A) Embrioni decortiti allineati su una piastra di agarose e iniettati vicino al loro centro utilizzando un ago di microiniezione riempito con dsRNA e tampone di iniezione contenente color alimentare. La barra della scala rappresenta 500 m. (B) Un individuo con un knockdown più grave. Gli embrioni iniettati vengono tenuti in una camera di umidità e monitorati quotidianamente per segnare fenotipi e rimuovere gli individui morti (che diventano marroni). La barra della scala rappresenta 5 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
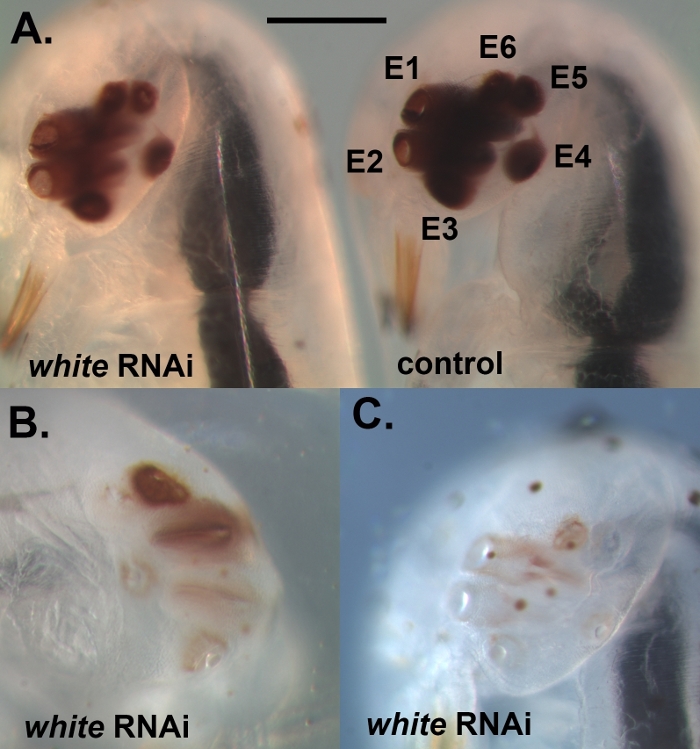
Figura 2: Esempio di embrioni completamente sviluppati che sono stati iniettati con dsRNA contro il bianco. (A) Confronto di un individuo con una riduzione della pigmentazione degli occhi (a sinistra) e di un individuo iniettato dal controllo (a destra). E1-E6 si riferiscono a Occhi 1-6. (B) Un individuo con un fenotipo knockdown più grave, che illustra che, a volte, alcuni degli occhi all'interno del cluster sono più gravemente colpiti dal knockdown rispetto ad altri. (C) Individuo con una perdita quasi completa di pigmentazione degli occhi. La barra della scala rappresenta 200 m; I pannelli B e C sono rappresentati sulla stessa scala. Si prega di fare clic qui per visualizzare una versione più grande di questa figura.

Figura 3: Illustrazione delle iniezioni larvale. (A) Diverse larve immobilizzate incorporando nel 2% agarose con i loro spiracoli di coda lasciati fuori da qualsiasi agarose. (B) Microelectrode contenente la soluzione di iniezione posizionata in modo che la sua punta possa penetrare la membrana fine tra due segmenti. (C) Colorante di iniezione blu visibile nel sito di iniezione dopo l'iniezione. Le barre di scala rappresentano 1 cm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 4: RNAi per laccase2 applicato alla seconda larva instar con conseguente riduzione della colorazione della cuticle nelle larve della terza stella. (A) Perdita relativamente lieve di colorazione in un individuo lac2 RNAi (in basso) rispetto a un individuo iniettato da controllo (in alto). La barra della scala rappresenta 5 mm. (B) Testa di un singolo controllo che mostra il caratteristico motivo di colore scuro al centro della testa. (C) Abbattimento relativamente grave di lac2 che porta ad una perdita quasi completa della colorazione della testa centrale. (D) Perdita di colorazione nella cuticola della coda principale di un individuo lac2 RNAi (in basso) rispetto a un individuo iniettato dal controllo (in alto). Le barre di scala in B-u2012D rappresentano 1 mm. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: RNAi per laccase2 applicato a una terza larva instar con conseguente riduzione della colorazione cuticola in un adulto. L'individuo knockdown (a sinistra) è anche caratterizzato da elytra molto morbido rispetto al controllo (a destra). La barra della scala rappresenta 5 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
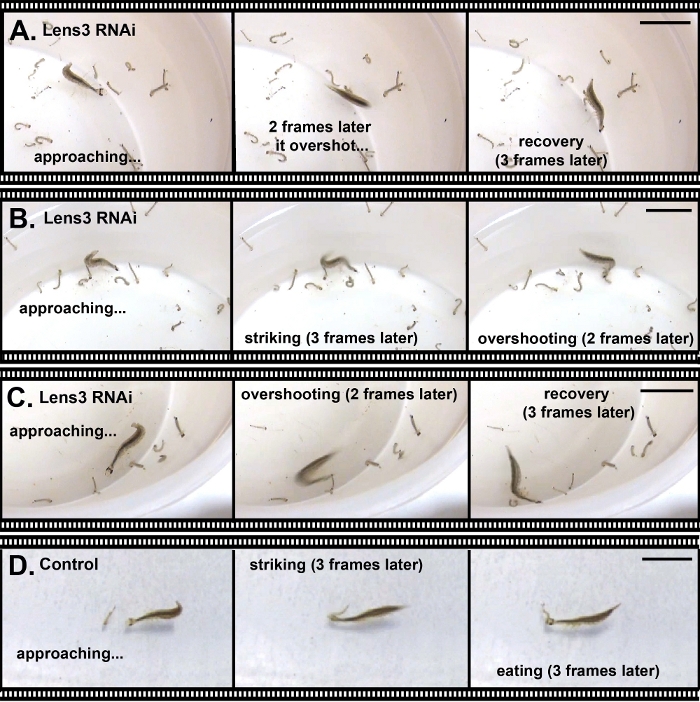
Figura 6: Abbattimento di una proteina lente importante che porta a carenze nella cattura delle prede. (A–C). Tre esempi in cui una larva Sunburst Diving Beetle, in cui i deficit ottici sono stati indotti attraverso l'RNAi, non sono stati in grado di catturare le prede (larve di zanzara). Le immagini fisse rappresentative sono state selezionate da una registrazione video di catture di prede caratteristiche. (D) Controllare la larva cattura preda. Tutte le barre di scala rappresentano 2 cm. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Il nostro obiettivo è che questa compilazione di metodi renderà RNAi ampiamente disponibile, soprattutto perché questo strumento rimane una potente tecnica sinergica per l'editing genico basato su CRISPR/Cas9, con il vantaggio che può essere applicato alle fasi di sviluppo desiderate degli organismi studiati. Per esemplificare questa forza, abbiamo iniettato il dsRNA negli embrioni e in diversi stadi larval. Le iniezioni negli ovuli hanno interessato lo sviluppo di embrioni (Figura 2), le iniezioni nella seconda fase larvale hanno avuto effetti apparenti sulla terza fase larvale (Figura 4 e Figura 6) e le iniezioni nella terza fase larvale hanno mostrato effetti negli adulti (Figura 5). Mentre la tempistica esatta deve essere stabilita sperimentalmente, in generale, le iniezioni hanno effetto entro pochi giorni. Il successo di questo processo può essere influenzato dalla lunghezza della sequenza dsRNA. Qui, abbiamo presentato esempi utilizzando poco più di 200 bp a più di 800 bp. Come regola generale, le sequenze tra 100 e 600 bp sono preferite per limitare gli effetti fuori target, ma sequenze fino a 1000 bp producono buoni risultati22. Una domanda per quanto riguarda RNAi è la durata del knockdown che può essere raggiunto attraverso questa tecnica. Poiché i fenotipi erano terminali in ogni fase, non possiamo commentare questo problema in base ai nostri risultati presentati. Tuttavia, in precedenza è stato osservato che gli effetti RNAi sono generalmente relativamente longevi e che concentrazioni più elevate portano a knockdown più duraturi20.
Una limitazione di questa tecnica è che funziona meglio per alcuni organismi che per altri, e sembra che non ci sia alcun modo diretto di prevedere quanto bene funzionerà a priori. Tuttavia, è stato trovato per funzionare bene per una vasta gamma di organismi diversi. All'interno di artropodi, questo include aracnidi26, crostacei27, e una varietà di insetti, con tassi di successo particolarmente elevati in coleotteri28. Un'ulteriore complicazione è che le differenze nella gravità del fenotipo spesso si verificano tra gli individui nonostante l'applicazione della stessa quantità di dsRNA. Come illustrato nella Figura 2B, la variazione può verificarsi anche all'interno di un individuo. Nei nostri studi RNAi mirati a diversi geni coinvolti nello sviluppo degli occhi larval T. marmoratus, abbiamo spesso scoperto che alcuni occhi sono colpiti più gravemente di altri. Questo fenomeno può essere correlato al tessuto relativamente denso del gruppo oculare, con il dsRNA meglio in grado di raggiungere alcune delle unità.
Per la riuscita dell'esecuzione degli esperimenti RNAi, è fondamentale che diversi parametri siano ottimizzati per il gene bersaglio. Ad esempio, la concentrazione del dsRNA e la lunghezza del gene bersaglio possono influenzare fortemente il risultato20. Un altro parametro critico è come vengono eseguite le iniezioni, in quanto questo processo può influenzare notevolmente il tasso di sopravvivenza. Per gli embrioni, abbiamo ottenuto i migliori risultati prendendo di mira il centro dell'embrione. Una piastra ben posata consente l'iniezione di 100 o più embrioni in una singola sessione. Per le larve, è fondamentale inserire l'ago di iniezione tra i segmenti. Queste iniezioni richiedono più dsRNA, e sulla base della disponibilità di larve, i nostri set di iniezione qui in genere consistevano solo di pochi animali alla volta. Per tutte le iniezioni, è fondamentale impedire all'aria di entrare nell'organismo.
In alcuni casi, i cicli di feedback di una rete di regolamentazione genetica e la ridondanza genetica possono influenzare la penetrazione dei fenotipi RNAi, nonostante i down costanti. Questo sembra essere il caso per le nostre osservazioni comportamentali delle larve con knockdown di grande successo di una proteina lente prominente, Lens318. Anche se abbiamo verificato l'elevata efficienza di questi knockdown attraverso qPCR, è stata osservata una notevole variazione nei fenotipi associati. Questo risultato evidenzia la necessità di quantificare correttamente i knockdown RNAi (per informazioni dettagliate sulle opzioni vedi22). Se non vi è una chiara aspettativa a priori per quanto riguarda i fenotipi risultanti, un buon modo di controllare gli effetti fuori bersaglio dell'RNAi è quello di indirizzare lo stesso gene con due sequenze non sovrapposte di dsRNA e di valutare i risultati per fenotipi comuni.
A differenza delle tecniche di modificazione genica, l'RNAi è anche un potente strumento per studiare geni letali, e ci sono due modi per farlo. Ad esempio, se uno è interessato al contributo funzionale di un gene in cui la perdita di funzione nelle prime fasi dello sviluppo è nota per essere letale, è possibile ottenere uno scoperto funzionale di tale gene semplicemente consentendo all'animale di svilupparsi normalmente e quindi abbattendo il gene tramite RNAi più tardi in fase di sviluppo (cioè nell'adulto). In alternativa, un gene in cui la completa perdita di funzione è nota per essere letale può essere studiato attraverso un knockdown parziale, che può essere raggiunto iniettando una gamma di concentrazioni di dsRNA. Alcuni dei nostri risultati mostrano knockdown di lac2, che sono noti per essere letali se la cuticola negli insetti diventa eccessivamente morbida24. Anche lo scarabeo lac2 RNAi raffigurato nella Figura 5 difficilmente sopravviverebbe al di fuori delle condizioni di laboratorio. Un altro gene letale è iltaglio , che codifica per un fattore di trascrizione che è fondamentale per la specifica cellulare-fato in vari sistemi di organi negli artropodi ed è stato collegato allo sviluppo di glia nel sistema visivo Drosophila 29. Sulla base della nostra esperienza con RNAi tagliati negli embrioni di T. marmoratus, possiamo evocare fenotipi oculari informativi negli embrioni che sono in grado di completare il loro sviluppo oculare embrionale (osservazioni inedite). Qui, dosaggi più elevati sembrano portare a tassi di letalità più elevati, mentre dosi più basse si traducono in fenotipi osservabili e informativi.
Il nostro protocollo non solo elenca i passi necessari per un ricercatore per perseguire esperimenti RNAi su T. marmoratus, come illustrato, ma è anche generalmente applicabile ad altri organismi, in particolare organismi acquatici. Tra gli organismi acquatici, ci sono già diversi esempi all'interno di crostacei come le pulci d'acqua Daphnia30 e gamberetti (per una recente revisione, vediriferimento 31). Ci sono ampie opportunità tra gli insetti acquatici, in quanto sono stati stimati per comprendere circa il 6% di tutta la diversità degli insetti, con probabilmente più di 200.000 specie32. Inoltre, RNAi è già stato eseguito su striders acquatici che tendono ad abitare la superficie degli ambientiacquatici 33. Se non è presente alcun genoma, allora un trascrima può essere assemblato de novo. Finché questo processo rivela contig di alcune centinaia di nucleotidi, il dsRNA contro geni specifici può essere progettato. Il nostro protocollo per immobilizzare gli insetti in agarose sarà probabilmente utile anche per altre procedure, specialmente per gli organismi morbidi, malleabili e acquatici. Nel loro insieme, l'RNAi rimane una potente tecnica per manipolare l'espressione genica in un gruppo eterogeneo di organismi, anche quando non sono disponibili altri strumenti molecolari e genetici.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Vorremmo ringraziare il Dr. Josh Benoit per il suo aiuto con la bioinformatica Hailey Tobler per il suo aiuto nel crescere Sunburst Diving Beetles e Tamara Pace per l'assistenza editoriale. Questa ricerca è stata sostenuta dalla National Science Foundation con sovvenzioni IOS-1456757 e IOS-1856341 a EKB e IOS1557936 a YT.
Materiali
| Name | Company | Catalog Number | Comments |
| 1. RNA isolation and de novo transcriptome assembly | |||
| liquid nitrogen | University Stockroom | Typically locally available at research institutions | |
| pipette tips | Fisher Scientific | size dependent | Products from other vendors would work equally well |
| RNeasy lipid tissue mini kit (RNA isolation kit) | Qiagen | 74804 | Detailed specific protocol is provided with the kit |
| spectrophotometer (NnanoDrop) | Thermo Fisher | 9836674 | Other models would work equally well |
| 1.2. De novo transcriptome assembly. | |||
| BUSCO.v3 | https://busco.ezlab.org/ | Any freely available software for assessing trasncriptome completeness can be used. | |
| CLC Genomics workbench | Qiagen | 832021 | Other equivalent software packages are also available |
| Galaxy workbench | https://usegalaxy.org/ | An open source online transcriptome assembly & annotation pipeline | |
| NCBI BLASTx | https://blast.ncbi.nlm.nih.gov/Blast.cgi?LINK_LOC=blasthome&PAGE_TYPE=BlastSearch&PROGRAM=blastx | An open source online alignment and annotation pipeline | |
| 2. cDNA synthesis, Cloning & Miniprep isolation | |||
| ampicillin sodium salt | Gibco | 11593-027 | Products from other vendors would work equally well |
| glycerol | Fisher Scientific | G33-500 | Products from other vendors would work equally well |
| LB broth | Fisher Scientific | BP1426-500 | Products from other vendors would work equally well |
| Omniscript RT (reverse trasncription) kit | Qiagen | 205111 | Detailed specific protocol is provided with the kit |
| One Shot™ TOP10 Chemically Competent E. coli | Invitrogen | C404010 | Detailed specific protocol is provided with the kit |
| Petri dishes | Fisher Scientific | FB0875713 | Products from other vendors would work equally well |
| PureLink Quick Plasmid Miniprep Kit | ThermoFischer | 771471 | Detailed specific protocol is provided with the kit |
| QIAquick PCR purification kit | Qiagen | 28104 | Detailed specific protocol is provided with the kit |
| shaker-incubator | Labnet | 211DS | Other models would work equally well |
| spectrophotometer (NnanoDrop) | Thermo Fisher | 9836674 | Other models would work equally well |
| thermal cycler for PCR | BioRad | T100 | Other models would work equally well |
| TOPO TA Cloning kit | Invitrogen | 1845069 | Detailed specific protocol is provided with the kit |
| X-Gal Solution | Thermo Scientific | R0941 | Products from other vendors would work equally well |
| 2.2 PCR amplification & in vitro dsRNA synthesis | |||
| Centrifuge | Fisher Scientific | accuSpin Micro 17R | Other models would work equally well |
| ethanol | Fisher Scientific | A4094 | Products from other vendors would work equally well |
| FastTaq DNA Polymerase, dNTPack | Roche | 13873432 | This kit contains all the reagents necessary for a PCR |
| MEGAclear Transcriiption clean up kit | ThermoFischer | AM1908 | Detailed specific protocol is provided with the kit |
| MEGAscript T7 Transcription kit | ThermoFischer | AM1334 | Detailed specific protocol is provided with the kit |
| nuclease-free water | Fisher Scientific | AM9932 | Products from other vendors would work equally well |
| QIAquick PCR purification kit | Qiagen | 28104 | Detailed specific protocol is provided with the kit |
| sodium acetate | Fisher Scientific | BP333-500 | Make 3M working solution |
| Spectrophotometer (NnanoDrop) | Thermo Fisher | 9836674 | Other models would work equally well |
| 3. Collecting and preparing early stage T. marmoratus embryos for dsRNA injections | |||
| agarose | Fisher Scientific | 9012-36-6 | Products from other vendors would work equally well |
| distilled water | Fisher Scientific | 9180 | Products from other vendors would work equally well |
| forceps (Dumon #4 Biology) | Fine Science Tools | 11242-40 | Products from other vendors would work equally well |
| glass cavity dish (3 well-dish) | Fisher Scientific | 50-243-43 | Products from other vendors would work equally well |
| microwave | Welbilt | turn-table | Other models would work equally well |
| natural hair paintbrush | Amazon | Any fine brush will do | |
| P1000 micro-pipetter | Gilson | F123602 | Other models would work equally well |
| Petri dishes | Fisher Scientific | FB0875713 | Products from other vendors would work equally well |
| stereomicroscope | Microsocope Central | 10446293 | Any good stereomicroscope will work |
| transfer pipettes | Fisher Scientific | 21-200-109 | Products from other vendors would work equally well |
| 4. dsRNA micro-injections in early stage T. marmoratus embryos | |||
| digital camera | Edmund optics (Qimaging) | Retiga 2000R | Other models would work equally well |
| ethanol | Fisher Scientific | A4094 | Products from other vendors would work equally well |
| food dye | Kroger | Any available food dye should work fine | |
| humidity chamber | take any plastic box with a lid, sterilize it with 70% ethanol and let it dry | ||
| incubator | Labline | 203 | Other models would work equally well |
| injection buffer | Prepared for 1 mL following reference #22 : Mix 10 µL of 0.1 M sodium phosphate buffer, 100 µL of 0.5 M potassium chloride solution, 100 µL of food dye and 790 µL of double-distilled water. Store in 4 °C. | ||
| intracellular Microinjection Systems (Picospritzer) | Parker | 052-0500-900 | Currently the model III is available, but older models work also |
| micro needle holder | A-M Systems | 672441 | Other products would work equally well |
| microinjection needles (1.2 mm x 0.68 mm, 4 inches) | A-M Systems | 603000 | Other models would work equally well |
| micromanipulator | Drummond Scientific Company | 3-000-024-R | Any quality micromanipulator will work |
| monosodium phosphate | Fischer scientific | 7558-80-7 | To make 10 mL of 1 M working solution: Add 1.2 g of monosodium phosphate powder to 10 mL of Double distilled water and mix until clear solution is obtained |
| P-1000 Micropipette Puller | Sutter Instrument | P-1000 | Puller settings:Heat 575, Pull 60, Velocity 75 Delay 110, Pressure 700. |
| P10 micro-pipetter | Gilson | F144802 | Other models would work equally well |
| P1000 micro-pipetter | Gilson | F123602 | Other models would work equally well |
| potassium chloride | Fischer scientific | 7447-40-7 | To make 100 mL of 0.5 M potassium chloride solution: Add 3.73 g of potassium chloride crystals to 100 mL of double distilled water and mix until clear solution is obtained. |
| sodium phosphate buffer (0.1M) | To make 10 mL of 0.1 M of this buffer: Mix 8.5 mL of 1 M sodium phosphate dibasic solution with 1.5 mL of 1 M monosodium phosphate solution. Check the pH with a pH meter and adjust accordingly to pH 7.6 at room temprature. | ||
| sodium phosphate dibasic | Fischer scientific | 7558-79-4 | To make 10 mL of 1 M working solution: Add 1.42 g of sodium phosphate dibasic powder to 10 mL of Double distilled water and mix until clear solution is obtained |
| stereomicroscope | Microsocope Central | 10446293 | Any good stereomicroscope will work |
| 5. Preparing T. marmoratus larvae for dsRNA injections | |||
| agarose | Fisher Scientific | 9012-36-6 | Products from other vendors would work equally well |
| forceps (Dumon #4 Biology) | Fine Science Tools | 11242-40 | Products from other vendors would work equally well |
| Petri dishes | Fisher Scientific | FB0875713 | Products from other vendors would work equally well |
| 6. dsRNA micro-injections in T. marmoratus larvae | |||
| injection buffer (10x) | See section 4 | ||
| microinjection needles (1.2 mm x 0.68 mm, 4 inches) | A-M Systems | 603000 | Other models would work equally well |
| microinjection syringe | A-M Systems | 603000 | Other models would work equally well |
| micro needle holder | A-M Systems | 672441 | Other products would work equally well |
| P-1000 Micropipette Puller | Sutter Instrument | P-1000 | Puller settings:Heat 575, Pull 60, Velocity 75 Delay 110, Pressure 700. |
| stereomicroscope | Microsocope Central | 10446293 | Any good stereomicroscope will work |
Riferimenti
- Muller, B., Grossniklaus, U. Model organisms - A historical perspective. Journal of Proteomics. 73, 2054-2063 (2010).
- Gilbert, L. A., et al. CRISPR-Mediated Modular RNA-Guided Regulation of Transcription in Eukaryotes. Cell. 154, 442-451 (2013).
- Westerman, E. L., et al. Aristaless Controls Butterfly Wing Color Variation Used in Mimicry and Mate Choice. Current Biology. 28, 3469(2018).
- Perry, M., et al. Molecular logic behind the three-way stochastic choices that expand butterfly colour vision. Nature. 535, 280(2016).
- Boettcher, M., McManus, M. T. Choosing the Right Tool for the Job: RNAi, TALEN, or CRISPR. Molecular Cell. 58, 575-585 (2015).
- Meister, G., Tuschl, T. Mechanisms of gene silencing by double-stranded RNA. Nature. 431, 343-349 (2004).
- Fire, A., et al. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 391, 806-811 (1998).
- Kennerdell, J. R., Carthew, R. W. Use of dsRNA-mediated genetic interference to demonstrate that frizzled and frizzled 2 act in the wingless pathway. Cell. 95, 1017-1026 (1998).
- Mello, C. C., Conte, D. Revealing the world of RNA interference. Nature. 431, 338-342 (2004).
- Agrawal, N., et al. RNA interference: Biology, mechanism, and applications. Microbiol. Microbiology and Molecular Biology Reviews. 67, 657(2003).
- Gu, L. Q., Knipple, D. C. Recent advances in RNA interference research in insects: Implications for future insect pest management strategies. Crop Protection. 45, 36-40 (2013).
- Ravisankar, P., Lai, Y. T., Sambrani, N., Tomoyasu, Y. Comparative developmental analysis of Drosophila and Tribolium reveals conserved and diverged roles of abrupt in insect wing evolution. Developmental Biology. 409, 518-529 (2016).
- Tomoyasu, Y., Wheeler, S. R., Denell, R. E. Ultrabithorax is required for membranous wing identity in the beetle Tribolium castaneum. Nature. 433, 643-647 (2005).
- Tomoyasu, Y., Arakane, Y., Kramer, K. J., Denell, R. E. Repeated Co-options of Exoskeleton Formation during Wing-to-Elytron Evolution in Beetles. Current Biology. 19, 2057-2065 (2009).
- Yang, X., et al. Probing the Drosophila retinal determination gene network in Tribolium (II): The Pax6 genes eyeless and twin of eyeless. Developmental Biology. 333, 215-227 (2009).
- ZarinKamar, N., et al. The Pax gene eyegone facilitates repression of eye development in Tribolium. Evodevo. 2, 15(2011).
- Linz, D. M., Clark-Hachtel, C. M., Borras-Castells, F., Tomoyasu, Y. Larval RNA Interference in the Red Flour Beetle, Tribolium castaneum. Journal of Visualized Experiments. , e52059(2014).
- Stahl, A., S, B. R., Cook, T. A., Buschbeck, E. K. A complex lens for a complex eye. Integrative and Comparative Biology. 57, 1071-1081 (2017).
- Yeku, O., Frohman, M. A. Rapid Amplification of cDNA Ends (RACE). RNA, Methods In Molecular Biology. , Springer. 107-122 (2011).
- Miller, S. C., Miyata, K., Brown, S. J., Tomoyasu, Y. Dissecting Systemic RNA Interference in the Red Flour Beetle Tribolium castaneum: Parameters Affecting the Efficiency of RNAi. Plos One. 7, (2012).
- Tomoyasu, Y., Denell, R. E. Larval RNAi in Tribolium (Coleoptera) for analyzing adult development. Development Genes and Evolution. 214, 575-578 (2004).
- Philip, B. N., Tomoyasu, Y. Molecular Methods for Evolutionary Genetics. Orgogozo, V., Rockman, M. V. , Humana Press. 471-497 (2011).
- Mackenzie, S. M., Howells, A. J., Cox, G. B., Ewart, G. D. Sub-cellular localisation of the White/Scarlet ABC transporter to pigment granule membranes within the compound eye of Drosophila melanogaster. Genetica. 108, 239-252 (2000).
- Arakane, Y., Muthukrishnan, S., Beeman, R. W., Kanost, M. R., Kramer, K. J. Laccase 2 is the phenoloxidase gene required for beetle cuticle tanning. Proceedings of the National Academy of Sciences of the United States of America. 102, 11337-11342 (2005).
- Werner, S., Buschbeck, E. K. Rapid and step-wise eye growth in molting diving beetle larvae. Journal of Comparative Physiology. 201, 1091-1102 (2015).
- Prpic, N. M., Schoppmeier, M., Damen, W. G. Gene Silencing via Embryonic RNAi in Spider Embryos. Cold Spring Harbor protocols. 3, 1-4 (2008).
- Sagi, A., Manor, R., Ventura, T. Gene Silencing in Crustaceans: From Basic Research to Biotechnologies. Genes. 4, 620-645 (2013).
- Zhu, K. Y., Palli, S. R. Annual Review of Entomology. Douglas, A. E. 65, Annual Reviews. 293-311 (2020).
- Bauke, A. C., Sasse, S., Matzat, T., Klaembt, C. A transcriptional network controlling glial development in the Drosophila visual system. Development. 142, 2184(2015).
- Lin, C. Y., et al. RNAi analysis of doublesex1 expression in Daphnia pulex Leydig, 1860 (Cladocera). Crustaceana. 92, 137-154 (2019).
- Nguyen, D. V., Christiaens, O., Bossier, P., Smagghe, G. RNA interference in shrimp and potential applications in aquaculture. Reviews in Aquaculture. 10, 573-584 (2018).
- Dijkstra, K. D. B., Monaghan, M. T., Pauls, S. U. Annual Review of Entomology. Berenbaum, M. R. 59, Annual Reviews. 143-163 (2014).
- Crumiere, A. J. J., Khila, A. Hox genes mediate the escalation of sexually antagonistic traits in water striders. Biology. Letters. 15, 5(2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon