Method Article
Alimentación y cuantificación de sangre de origen animal y comidas artificiales en mosquitos Aedes aegypti
En este artículo
Resumen
El objetivo de este protocolo es entregar comidas de sangre artificiales y derivadas de animales a los mosquitos Aedes aegypti a través de un alimentador de membrana artificial y cuantificar con precisión el volumen de comida ingerida.
Resumen
Las hembras de ciertas especies de mosquitos pueden propagar enfermedades mientras pican a los huéspedes de vertebrados para obtener las comidas de sangre ricas en proteínas necesarias para el desarrollo de óvulos. En el laboratorio, los investigadores pueden entregar comidas de sangre artificiales y derivadas de animales a mosquitos a través de alimentadores de membrana, que permiten la manipulación de la composición de las comidas. Aquí, presentamos métodos para alimentar la sangre y las comidas artificiales de sangre a los mosquitos Aedes aegypti y cuantificar el volumen consumido por las hembras individuales.
La alimentación dirigida y la cuantificación de las comidas artificiales/sanguíneas tienen un uso amplio, incluyendo la prueba de los efectos de los componentes de las comidas en el comportamiento y la fisiología de los mosquitos, la entrega de compuestos farmacológicos sin inyección e la infectación de mosquitos con patógenos específicos. La adición de tinte de fluoresceína a la comida antes de la alimentación permite una cuantificación posterior del tamaño de la comida. El volumen de comidas consumido por los mosquitos se puede medir ya sea en peso, si las hembras deben utilizarse más adelante para experimentos conductuales, o homogeneizando hembras individuales en placas de 96 pozos y midiendo los niveles de fluorescencia utilizando un lector de placas como ensayo de punto final. La cuantificación del tamaño de la comida se puede utilizar para determinar si el cambio de los componentes de la comida altera el volumen de comida ingerido o si el consumo de comida difiere entre las cepas de mosquitos. La cuantificación precisa del tamaño de las comidas también es fundamental para los ensayos posteriores, como los efectos de medición en la atracción del huésped o la fecundidad. Los métodos presentados aquí se pueden adaptar aún más para realizar un seguimiento de la digestión de las comidas en el transcurso de los días o para incluir múltiples marcadores distintivos añadidos a diferentes comidas (como el néctar y la sangre) para cuantificar el consumo de cada comida por un solo mosquito.
Estos métodos permiten a los investigadores realizar mediciones de alto rendimiento de forma individual para comparar el volumen de comidas consumido por cientos de mosquitos individuales. Por lo tanto, estas herramientas serán ampliamente útiles para la comunidad de investigadores de mosquitos para responder a diversas preguntas biológicas.
Introducción
Presentamos un protocolo para alimentar comidas de sangre modificadas a los mosquitos Aedes aegypti utilizando un alimentador de membrana artificial y midiendo con precisión el volumen de comida consumido por cada mosquito individual. Este protocolo se puede adaptar de forma flexible para alterar el contenido de la comida o para comparar el volumen de comidas consumido por diferentes grupos experimentales de mosquitos.
El mosquito Ae. aegypti amenaza la salud mundial al propagar patógenos que causan enfermedades como la fiebre amarilla, el dengue, el chikungunya y el zika1,2,3,4,5. Las hembras ae. aegypti son obligadas a alimentar la sangre; deben consumir sangre vertebrada para obtener la proteína necesaria para el desarrollo del huevo, y cada embrague de huevos requiere una comida completa en la sangre de al menos un huésped6,7,8. El mosquito hembra primero muerde a su huésped perforando la piel con su estilización e inyectando saliva, que contiene compuestos que desencadenan la respuesta inmune del huésped9. Luego se alimenta bombeando sangre a través de su estilo en su midgut. Mientras consume una comida de sangre de un huésped infectado, puede ingerir patógenos transmitidos por la sangre6,8, que luego migran desde el midgut del mosquito a sus glándulas salivales10. Los mosquitos hembra infectados de esta manera pueden propagar la enfermedad inyectando patógenos junto con saliva al picar a los huéspedes posteriores11,12. Comprender y cuantificar los mecanismos del comportamiento de la alimentación sanguínea son medidas cruciales para controlar la transmisión de enfermedades transmitidas por mosquitos.
Muchos protocolos de laboratorio para la cría y experimentación de mosquitos utilizan animales vivos, incluidos ratones, conejillos de indias o humanos como fuente de sangre13,14,15,16. El uso de animales vivos impone preocupaciones éticas, así como requisitos complejos para la capacitación del personal, la vivienda y el cuidado de animales, y el cumplimiento de las políticas del Comité Institucional de Cuidado y Uso de Animales (IACUC). También limita los tipos de compuestos que se pueden entregar a los mosquitos, lo que limita los estudios que se pueden llevar a cabo17.
Los aparatos artificiales de alimentación sanguínea, que normalmente utilizan un sistema de membrana para simular la piel huésped, son herramientas útiles para estudiar comportamientos de alimentación sanguínea que eluden la necesidad de mantenimiento de los huéspedes vivos. Sangre entera se puede comprar a un número de proveedores y alimentado a mosquitos utilizando calentado, alimentadores de membrana artificial con chaqueta de agua o dispositivos similares18,19. En este protocolo, demostramos el uso de pequeños alimentadores de membrana desechables denominados "Glytubes". Este alimentador de membranas, publicado previamente por Costa-da-Silva et al. (2013)20, se puede ensamblar fácilmente desde equipos de laboratorio estándar, por lo que es ideal para entregar comidas de sangre a un número moderado de mosquitos y fácil de escalar para probar grupos más grandes o formulaciones de múltiples comidas. El Glytube es una alternativa barata y eficiente a otros alimentadores artificiales comerciales, que pueden requerir mayores volúmenes de comidas y son más adecuados para alimentar por lotes a grandes grupos de mosquitos en una sola formulación de comida21.
Este protocolo incluye dos secciones: preparación/entrega de comidas artificiales y cuantificación del consumo. En la primera sección, los Glytubes se utilizan como un medio eficiente para ofrecer dietas manipuladas. La sangre entera puede sustituirse por una comida totalmente artificial para comparar los efectos de los sustitutos de la sangre en lugar de una comida de sangre. Aquí se presenta una receta adaptada de Kogan (1990)22, aunque se han desarrollado múltiples formulaciones de comidas artificiales23,24. Además, la alimentación es un método menos invasivo y menos laborioso para introducir compuestos farmacológicos que la inyección. Debido al bajo volumen total requerido para cada comida (1-2 ml), este protocolo proporciona un método de entrega atractivo para reducir las cantidades de reactivos caros. Ae. aegypti las hembras consumen fácilmente comidas sin proteínas de solución salina con adenosina 5′-tripfosfato (ATP)25,26, que proporciona una línea de base para medir los efectos de los componentes de una sola comida. Por ejemplo, Neuropeptide Y-like receptor 7 (NPYLR7) en Ae. aegypti es conocido por mediar en la supresión de la búsqueda del huésped después de una comida de sangre rica en proteínas, y cuando npylr7 agonistas se añaden a una comida salina libre de proteínas, los mosquitos hembra exhiben supresión de búsqueda de huésped similar a los que han consumido sangre entera7.
En la segunda sección, se presentan pasos para cuantificar el volumen de cada comida consumida por un mosquito hembra individual. Este ensayo se basa en la fluorescencia y captura el estado de alimentación en una resolución más alta que los métodos en los que las hembras se clasifican como "alimentadas" o "no alimentadas" basándose solo en la evaluación visual de la distensión abdominal. Al añadir fluoresceína a la comida antes de la alimentación, los volúmenes de comidas ingeridos por individuos pueden cuantificarse homogeneizando cada mosquito en un plato de 96 pozos y midiendo la intensidad de la fluorescencia como lectura. Este ensayo puede medir las diferencias en la alimentación del vigor en respuesta a variables como la composición de las comidas o el trasfondo genético de los mosquitos. La cuantificación precisa es fundamental para los tamaños intermedios de las comidas, por ejemplo, cuando a las hembras se les ofrecen comidas subóptimas que contienen disuasivos de alimentación o cuando consumen comidas de sacarosa de tamaños variables27. Si se requieren mosquitos alimentados para ensayos conductuales posteriores después de la cuantificación del tamaño de las comidas, el tamaño de las comidas se puede calcular sopesando a las hembras anestesiadas en grupos y estimando el aumento promedio de la masa por individuo. Aunque es menos preciso que el marcado de fluoresceína, el pesaje todavía proporciona una estimación agregada del volumen de las comidas y permite examinar el efecto de la comida en los procesos aguas abajo, como la fecundidad o la posterior atracción del huésped. Mientras que el tamaño de las comidas en la sangre es variable y puede ser influenciado por una miríada de factores11,28,29,tamaños de comida ingeridos medidos con los métodos descritos aquí son consistentes con las cuantificaciones anteriores7,30,31.
Protocolo
Los procedimientos de alimentación sanguínea no se realizaron utilizando animales vivos o anfitriones humanos y cumplieron con las directrices establecidas por el Comité Institucional de Cuidado y Uso de Animales (IACUC) de la Universidad Rockefeller y la Junta de Revisión Institucional (IRB).
1. Preparación de la comida
- Preparación del fagostimulante, adenosina 5′-tripfosfato
- Preparar una solución de 25 mM de NaHCO3 acuoso (peso molecular, MW = 84.006 g/mol). Para 100 ml de 25 mM NaHCO3, añadir 210 mg de NaHCO3 a un matraz volumétrico y llenar con agua de doble destilado (ddH2O) a un volumen total de 100 ml. Con una barra de agitación magnética, mezcle bien la solución hasta que se disuelva todo el NaHCO3.
- Reconstituir el hidrato de sal disódico ATP (MW = 551,14 g/mol) en el acuoso NaHCO3 de 25 mM a una concentración final de ATP de 200 mM. Para un volumen total de 10 ml de ATP de 200 mM en búfer NaHCO3 de 25 mM, agregue 1,1 g de hidrato de sal disódica ATP a un matraz volumétrico y llénelo con 25 mM NaHCO3 buffer a un volumen total de 10 mL. Con una barra de agitación magnética, mezcle bien la solución hasta que se disuelva todo el ATP.
NOTA: Para minimizar la hidrólisis de ATP, debe ser amortiguada por una solución de sal como NaHCO3. - Aliquot la solución ATP y almacenar a -20 °C.
NOTA: Esta solución de stock de ATP normalmente se hace fresca cada seis meses y se utiliza para todas las comidas que se describen a continuación. Para evitar la degradación, los alíquesas ATP no deben someterse a múltiples ciclos de congelación o calentarse junto con otros componentes de la comida.
- Preparación de la solución de trazador fluorescente, fluoresceína
- Preparar una solución de 2% (w/v) de fluoresceína acuosa. Para un volumen total de solución de stock de 10 ml, mezcle 0,2 g de sal de desódium de fluoresceína con 10 ml de ddH2O en un tubo cónico de 15 ml envuelto en papel de aluminio a temperatura ambiente. Esta solución de material de fluoresceína se puede utilizar para la dilución en todas las comidas descritas a continuación.
NOTA: Como la fluoresceína es sensible a la luz, evite la exposición a la luz envolviendo recipientes en papel de aluminio.
- Preparar una solución de 2% (w/v) de fluoresceína acuosa. Para un volumen total de solución de stock de 10 ml, mezcle 0,2 g de sal de desódium de fluoresceína con 10 ml de ddH2O en un tubo cónico de 15 ml envuelto en papel de aluminio a temperatura ambiente. Esta solución de material de fluoresceína se puede utilizar para la dilución en todas las comidas descritas a continuación.
- Preparación de comidas de sangre derivadas de animales
- Calcular el número de comidas necesarias para alimentar a todos los mosquitos; cada Glytube tiene una comida de 2 ml y alimenta aproximadamente a 25 mosquitos. Prepare una comida adicional para calibrar la curva estándar para lecturas de fluorescencia. A menos que se indique lo contrario, todos los pasos de esta sección describen las cantidades de reactivos necesarias para preparar una comida con un volumen final de 2 ml.
- Para las comidas de sangre derivadas de animales, transfiera 1,98–2 ml de sangre de oveja desfibrinada en un tubo cónico de 15 ml (ver paso 3.3 para el volumen deseado de sangre).
NOTA: Se pueden utilizar fuentes de sangre de vertebrados desfibriladas comercialmente, incluso de ovejas, conejillos de indias y humanos,13. Antes de su uso, asegúrese de que la sangre comprada no haya pasado su fecha de caducidad y mezcle bien invirtiendo la botella, especialmente si hay separación visible de los componentes sanguíneos. - Para una alimentación óptima, agregue ATP a una concentración final de 1-2 mM después de que la sangre de las ovejas se haya calentado a 45 °C en un baño de agua. Para una concentración final de ATP de 1 mM, agregue 10 μL de la solución de stock ATP de 200 mM a 1,99 ml de sangre pre-calentada y mezcla. Para una concentración final de ATP de 2 mM, agregue 20 μL de la acción ATP de 200 mM a 1,98 ml de sangre pre-calentada y mezcle. Si no se va a añadir ATP, caliente 2 ml de sangre de oveja desfibrinada.
- Si posteriormente se va a llevar a cabo la cuantificación del tamaño de las comidas a base de fluorescencia, añada la solución de fluoresceína a una concentración final del 0,002% (2 μL de 2% de material de fluoresceína en un volumen total de comida de 2 ml). Reduzca el volumen de sangre en la misma cantidad que la fluoresceína añadida. Conservar 1 ml de la formulación final de la comida que contiene 0,002% fluoresceína para generar la curva estándar de referencia. Tratar el volumen retenido de manera idéntica a la comida que se está entregando a los mosquitos; exponer a las mismas condiciones de luz y temperatura durante toda la duración del experimento, y posteriormente congelar esto junto con la comida entregada.
- Preparación de comidas artificiales de sangre
- Calcular el número de comidas necesarias para alimentar a todos los mosquitos; cada Glytube tiene una comida de 2 ml y alimenta aproximadamente a 25 mosquitos. Prepare una comida adicional para calibrar la curva estándar para lecturas de fluorescencia. A menos que se indique lo contrario, todos los pasos de esta sección describen las cantidades de reactivos necesarias para preparar una comida de 2 ml.
- Para preparar sangre artificial (adaptada de Kogan (1990)22),como en la Tabla 1,primero haga una solución de stock de 400 mM NaHCO3. Para un volumen total de 10 mL de 400 mM NaHCO3 (MW = 84.006 g/mol), añadir 336 mg de NaHCO3 a un matraz volumétrico y llenar con agua de doble destilado (ddH2O) a un volumen total de 10 ml. Con una barra de agitación magnética, mezcle bien la solución hasta que se disuelva todo el NaHCO3.
- Para los componentes proteicos de la sangre artificial, preparar soluciones de stock de 50 mg/ml de γ-globulinas en 400 mM NaHCO3,35 mg/ml de hemoglobina en ddH2O, y 300 mg/ml de albúmina en ddH2O. Las soluciones de stock de proteínas se pueden almacenar a 4 °C durante un plazo de hasta 2 meses. La concentración final de proteínas humanas totales en sangre artificial es de 125 mg/ml. Esto incluye concentraciones finales de 15 mg/ml de γ-globulinas, 8 mg/mL de hemoglobina y 102 mg/mL de albúmina.
- Para cada comida de 2 ml, combine 600 μL de γ-globulinas, 460 μL de hemoglobina, 680 μL de albúmina y 250 μL de ddH2O de soluciones de stock enumeradas en la Tabla 1. Espere para añadir 10 μL de solución de stock ATP de 200 mM hasta después de que la comida se haya calentado a 45 °C, inmediatamente antes de presentar la comida.
- Si posteriormente se va a llevar a cabo la cuantificación del tamaño de las comidas a base de fluorescencia, añada la solución de fluoresceína a una concentración final del 0,002% (2 μL de 2% de material de fluoresceína en un volumen total de comida de 2 ml). Reduzca el volumen de ddH2O en el paso 4.4 en la misma cantidad que la fluoresceína añadida. Conservar al menos 1 ml de la formulación final de la comida que contenga 0,002% fluoresceína para generar la curva estándar de referencia. Tratar el volumen retenido de manera idéntica a la comida que se está entregando a los mosquitos; exponer a las mismas condiciones de luz y temperatura durante toda la duración del experimento, y posteriormente congelar esto junto con la comida entregada.
- Preparación de comidas salinas sin proteínas ejemplo (adaptadas de Duvall et al. (2019)7)
NOTA: Las comidas salinas sin proteínas se pueden preparar de múltiples maneras7,27,32. La comida salina presentada aquí es una versión libre de proteínas de la receta de sangre artificial descrita anteriormente.- Calcular el número de comidas necesarias para alimentar a todos los mosquitos; cada Glytube tiene una comida de 2 ml y alimenta aproximadamente a 25 mosquitos Prepare una comida adicional para calibrar la curva estándar para mediciones de fluorescencia. A menos que se indique lo contrario, todos los pasos de esta sección describen las cantidades de reactivos necesarias para preparar una comida de 2 ml.
- Para preparar la comida salina, haga una solución de stock de 400 mM NaHCO3. Para un volumen total de 10 mL de 400 mM NaHCO3 (MW = 84.006 g/mol), añadir 336 mg de NaHCO3 a un matraz volumétrico y llenar con ddH2O a un volumen total de 10 mL. Con una barra de agitación magnética, mezcle bien la solución hasta que se disuelva todo el NaHCO3.
- Por cada comida de 2 ml, combine en un tubo cónico de 15 ml 600 μL de NaHCO3 de 400 mM con 1,39 ml de ddH2O. Espere a añadir 10 μL de la solución de 200 mM de stock ATP hasta después de que la comida se haya calentado a 45 °C en un baño de agua.
- Si posteriormente se va a llevar a cabo la cuantificación del tamaño de las comidas a base de fluorescencia, añada la solución de fluoresceína a una concentración final del 0,002% (2 μL de 2% de material de fluoresceína en 2 ml del volumen total de la comida). Reduzca el volumen de ddH2O en el paso 5.3 en la misma cantidad que la fluoresceína añadida. Conservar al menos 1 ml de la formulación final de la comida que contenga 0,002% fluoresceína para generar la curva estándar de referencia. Tratar el volumen retenido de manera idéntica a la comida que se está entregando a los mosquitos; exponer a las mismas condiciones de luz y temperatura durante toda la duración del experimento, y posteriormente congelar esto junto con la comida entregada.
2. Entrega de comidas a mosquitos
- Creación de recipientes para mosquitos para la alimentación
NOTA: Los mosquitos se pueden alimentar en una variedad de recipientes siempre y cuando se cumplan los siguientes criterios. Asegúrese de que el recipiente sea lo suficientemente grande como para que los mosquitos vuelen, pero no tan grande que será difícil para los mosquitos localizar la superficie de malla y comenzar a alimentarse. La malla utilizada para cubrir el recipiente puede variar en el material y el tamaño del taladro. Los agujeros deben ser lo suficientemente grandes como para que la estilista del mosquito hembra perfore, pero no tan grande como para que el mosquito pueda escapar. Asegure la malla firmemente para que esté tensa, y el Glytube puede descansar establemente sobre su superficie durante todo el período de alimentación.- Un contenedor de ejemplo (Figura 1) es un cubo de plástico modificado de polietileno de alta densidad (HDPE) de 946 ml (32 oz). Para replicar esta configuración, utilice una cuchilla de afeitar para cortar un orificio central de ~ 10 cm de diámetro en la tapa del cubo. Para ensamblar el recipiente para su ocupación por mosquitos, asegure una piezacuadrada de 0,8 mm de mosquitera blanca de 0,8 mm en la parte superior del cubo, empujando firmemente la tapa perforada hacia abajo sobre él para que encaje firmemente.
- Recoger mosquitos hembra que son al menos 3 días después del eclosión para asegurarse de que son lo suficientemente maduros como para alimentar la sangre. Se observan tasas óptimas de alimentación después de 7 días33.
- Coloque los mosquitos hembra en el recipiente y cubra con malla. Si el recipiente está densamente poblado de mosquitos, aumente el número de Glytubes utilizados. La alimentación óptima se logra con ~25 mosquitos/Glytube. Esto reduce la competencia por el acceso a la membrana de alimentación.
- Reserva un grupo de control de mosquitos no fáceros a los que no se les ofrecerá una comida. En el protocolo de medición de peso, sopese el grupo no alimentado por separado y utilice este peso para estimar el aumento de peso en el grupo experimental que se alimentaba de una comida. En el protocolo de cuantificación basado en la fluorescencia, agregue el grupo no modificado de mosquitos a los pozos para los cálculos de curva estándar y para controles negativos. Para que coincida con la autofluorescencia del tejido de mosquitos basal en el grupo experimental, asegúrese de que la curva estándar y los pozos de control negativos contengan un mosquito no controlado.
- Construcción y configuración del Glytube (adaptado de Costa-da-Silva et al. (2013)20)
- Como se muestra en la Figura 1,para generar una fuente de calor, llene un tubo cónico de 50 ml con 40 ml de glicerol 100%. Selle el tubo cónico abierto con una pieza de parafilm de 5 cm × de 5 cm y repita con una pieza adicional de 5 cm × parafilm de 5 cm para minimizar la posibilidad de fugas. Opcionalmente, el parafilm se puede realizar en su lugar utilizando bandas de goma. Invertir el tubo para asegurarse de que no hay agujeros o huecos.
- Para crear el dispositivo de entrega de comidas, corte un orificio centrado de 2,5 cm de diámetro en la tapa del tornillo del tubo cónico utilizando una cuchilla de afeitar afilada o, para una mejor consistencia, un torno. Estirar un trozo de parafilm de 5 cm × 5 cm uniformemente para que duplique su tamaño. El parafilm debe ser lo suficientemente delgado como para que los mosquitos puedan perforarlo fácilmente, pero no debe haber fugas. Selle sobre la superficie exterior de la tapa del tornillo para cubrir completamente el orificio y dejar la tapa a un lado.
NOTA: Para aumentar la atracción al Glytube, antes de estirar el parafilm, perfumarlo con olor humano frotándolo suavemente en un parche de piel humana sin cosméticos aplicados, teniendo cuidado de que no se creen agujeros. Esto se recomienda si el experimento no está dirigido a investigar las señales sensoriales necesarias para que los mosquitos se acerquen a la comida. - Caliente tanto el tubo sellado de glicerol como la comida (con todos los componentes excepto ATP) en un baño de agua de 42-45 °C durante al menos 15 minutos. No pre-calor ATP; añadir inmediatamente antes de iniciar el experimento.
- Agregue ATP a la comida caliente y al vórtice a fondo. Pipeta 2 ml de la comida caliente en la cámara interna de la tapa del tornillo y coloque suavemente el tubo cónico invertido, caliente y lleno de glicerol de 50 ml. Atornille parcialmente la tapa con la comida en el tubo lleno de glicerol, lo suficiente para evitar fugas de la comida o del glicerol.
NOTA: El volumen de comida utilizado puede oscilar entre 1 ml y 2,5 ml. Los volúmenes más bajos pueden ser especialmente útiles cuando las comidas se utilizan para entregar compuestos que son escasos o caros. Es importante trabajar rápidamente a este paso para que la comida no se enfríe a temperatura ambiente y reduzca la probabilidad de alimentación máxima. La velocidad de enfriamiento dependerá de la temperatura ambiente de la habitación donde se llevan a cabo estos pasos, pero normalmente deben completarse en un plazo de 5 minutos a 25 °C. - Coloque el Glytube ensamblado en la parte superior del recipiente para mosquitos y permita que los mosquitos tengan acceso a la alimentación durante al menos 15 minutos para alcanzar las tasas máximas de alimentación.
- Para una alimentación óptima, coloque recipientes de mosquitos dentro de una cámara equipada con una almohadilla de CO2 y permita al menos 15 minutos de aclimatación a 25-28 °C y 70-80% de humedad antes de entregar la comida. La cámara de ensayo utilizada aquí es una modificación simple y de bajo costo de una configuración previamente publicada16. Utiliza una caja de almacenamiento translúcido de polipropileno de tamaño 36 cm L × 31 cm W × 32 cm H con tapa extraíble. Un agujero de 1,5 cm de diámetro hecho en la pared de la cámara permite la entrega de CO2 a través de tubos de silicona. La almohadilla de difusión de CO2 se fija al centro interior de la tapa para la entrega de aire purificado y CO2 para acondicionar la atmósfera de la cámara durante el ensayo.
NOTA: Asegúrese de que las señales del huésped (calor y CO2,con olor opcional del huésped16)estén presentes para que los mosquitos se sientan atraídos por el alimentador de membranas. Si los mosquitos no se amontonan debajo del Glytube, compruebe que el CO2 se entrega correctamente y que la comida y Glytube están lo suficientemente calientes. Si no hay una fuente externa de CO2 disponible, el CO2 se puede entregar a través de bocanadas de aliento humano exhalado. - Después de la alimentación, la tapa de Glytube se puede desechar como residuos de riesgo biológico o reutilizarse después de sumergirse en una solución de lejía de bajo porcentaje y enjuagar a fondo en agua.
3. Cuantificación de las comidas consumidas
- Los mosquitos de pesaje se utilizarán para nuevos experimentos
NOTA: Pesar a los mosquitos para cuantificar el tamaño de las comidas permite que se utilicen para una mayor experimentación en vivo, pero este método requiere tomar mediciones de peso de un grupo de 5 mosquitos. Dado que los pesos de los mosquitos individuales son difíciles de medir con precisión utilizando la mayoría de los equilibrios de laboratorio, la variabilidad en el tamaño de las comidas individuales no se puede cuantificar fácilmente midiendo los pesos. El pesaje sólo se recomienda para situaciones en las que las hembras se engordan visiblemente en la comida.- Mosquitos anestesiados en frío moviendo su recipiente a una sala fría de 4 °C o colocándolo en hielo.
- Pesar grupos de 5 hembras de la cohorte no alimentado (es decir, mosquitos a los que nunca se les ofreció una comida) y calcular su peso promedio como la estimación del peso "prealimentado". El peso promedio de un mosquito no fácido depende del genotipo, el sexo y las condiciones de cría. Los mosquitos Ae. aegypti femeninos no modificados criados con acceso ad libitum a la sacarosa suelen pesar aproximadamente 2 mg cada uno.
- De la cohorte experimental (es decir, mosquitos a los que se les ofreció una comida), ordene a las hembras en pilas "alimentadas" y "no alimentadas" basadas en la distensión abdominal observable por el ojo7. Divida cada una de las pilas "alimentadas" y "no alimentadas", respectivamente, en grupos de 5 mosquitos para pesar. Los mosquitos dentro de cada grupo de 5 deben derivarse de la misma cohorte experimental para tomar mediciones de peso grupal. Calcular el peso promedio por hembra de cada una de las pilas "alimentadas" y "no alimentadas" del grupo experimental.
- Medición de fluorescencia para análisis de punto final7,27,34
NOTA: Para obtener mediciones precisas del tamaño de las comidas de mosquitos individuales que ya no son necesarias para una mayor experimentación en vivo, almacene los mosquitos y los 1 ml restantes de comida que contengan 0,002% de fluoresceína a -20 °C inmediatamente después de la alimentación. El experimento se puede pausar aquí. Este método se describe en Figura 2.- Para generar una curva estándar de referencia, prepare una dilución en serie de la misma comida que contenga 0,002% fluoresceína que se ofreció al grupo experimental de mosquitos. Habrá un total de 8 soluciones de curva estándar. En cada una de estas soluciones, el volumen final de comida que contenga fluoresceína del 0,002% será de 5, 2,5, 1,25, 0,625, 0,3125, 0,15625, 0,078125, o 0 μL, y cada uno estará en 1x solución salina tamponada por fosfato (PBS) para un volumen total de 100 μL (por ejemplo, 5 μL de comida que contenga 0,002% fluoresceína en 95 μL de 1x PBS).
- Para hacer la primera solución de la curva estándar, añadir 50 μL de comida que contenga 0.002% de fluoresceína a 950 μL de 1x PBS y vórtice a fondo (volumen final: 5 μL de comida que contenga 0.002% fluoresceína en 95 μL de 1x PBS). Para hacer el resto de las soluciones de curva estándar, realice una dilución de 2 veces para cada paso tomando 500 μL del tubo anterior y agregándolo a un nuevo tubo que contenga 500 μL de 1x PBS. Vórtice mucho antes de preparar la próxima dilución de 2 veces.
- Para preparar pozos que se utilizarán para generar una curva estándar de referencia, pipeta 100 μL de cada una de las soluciones de curva estándar en cada uno de los 8 pozos en la primera columna de una placa PCR de 96 pozos. Agregue 1 mosquito de control no controlado a cada uno de los mismos 8 pozos en la primera columna de la placa. Repita en la segunda columna de la placa para una medición de réplica.
NOTA: Si a los grupos experimentales se les ofrecen diferentes tipos de comidas, se debe preparar una curva estándar de referencia independiente para cada tipo de comida. - Añadir 100 μL de 1x PBS en cada pozo restante para el control no controlado y los grupos experimentales. Si el tejido debe interrumpirse en pasos posteriores utilizando un homogeneizador o vórtice de molino de cuentas, agregue un cordón de vidrio sólido borosilicato de 3 mm a cada pozo.
- Como control negativo, agregue 1 mosquito no sefed a cada pozo en las siguientes 2 columnas de la placa. La fluorescencia medida en este grupo establece un corte basal para tener en cuenta la autofluorescencia tisular y se utilizará para determinar si un mosquito del grupo experimental se alimenta de la comida.
- Agregue 1 mosquito por pozo a los pozos restantes de los grupos experimentales a los que se les ofreció una comida.
- Selle la placa cuidadosamente e interrumpa el tejido mediante la molienda manual. El abdomen debe homogeneizarse a fondo para liberar la comida. Los métodos para interrumpir el tejido incluyen el uso de un homogeneizador de molino de cuentas con cuentas de vidrio sólido borosilicato de 3 mm (30 Hz durante 30 segundos), mezclador de vórtice con cuentas de vidrio sólido borosilicato de 3 mm, o una trituradora de pestle sin cuentas.
- Centrífuga la placa a 2000 rpm durante 1-2 min para recoger el lisato.
- Prepare una placa negra de 96 pozos con 180 μL de 1x PBS en cada pozo.
- Transfiera 20 μL de lysate a cada pozo con 180 μL de 1x PBS y mezcle. Si está disponible, utilice una pipeta multicanal en este paso para aumentar la velocidad y una mejor consistencia.
- Mida la intensidad de fluorescencia de cada pozo utilizando un lector de placas en el canal de excitación/emisión 485/520. Genere la curva estándar de referencia trazando el volumen conocido de comida contra la medición de intensidad de fluorescencia correspondiente.
- Utilizando la curva estándar de referencia generada, extrapolar el volumen de comida ingerido por cada uno de los mosquitos del grupo experimental. Resta la lectura media de intensidad de fluorescencia del grupo de control negativo de mosquitos no controlados de la lectura de intensidad de fluorescencia de cada individuo del grupo experimental para corregir la autofluorescencia del tejido basal.
Resultados
La Figura 1 presenta un esquema para ensamblar el Glytube, mientras que la Figura 2 muestra una visión general del diseño experimental para medir el tamaño de las comidas utilizando el ensayo basado en fluorescencia descrito aquí. La Figura 3 proporciona mediciones representativas del tamaño de las comidas de fluoresceína de un experimento de alimentación en sangre. La Figura 4, la Figura 5y la Figura 6 ilustran una muestra de preguntas biológicas que se pueden abordar mediante este protocolo. Las aplicaciones del protocolo son amplias e incluyen alterar la composición de las comidas en la sangre, alimentar compuestos farmacológicos, cuantificar con precisión comidas de sangre sub-óptimas o comidas de néctar más pequeñas, y comparar el comportamiento de alimentación entre los genotipos de mosquitos.
Para generar una curva estándar para los cálculos del volumen de comidas, las lecturas de fluorescencia se trazan a partir de los pozos de referencia designados que contienen cada uno un mosquito sin engendrada y un volumen conocido de la comida con 0,002% fluoresceína(Figura 3A). Las lecturas de fluorescencia de los pozos restantes, que contienen mosquitos del grupo de control negativo de mosquitos no sefados o del grupo experimental de mosquitos que ofrecen una comida, se comparan con esta curva estándar para cuantificar el volumen de comida (μL) consumido por cada mosquito(Figura 3B). Para validar las lecturas basales en este ensayo, debe confirmarse que a los mosquitos del grupo de control negativo no controlado no se les asigna un valor positivo de μL consumido (Figura 3B, izquierda). Aunque a todas las hembras del grupo experimental se les ofreció la harina de sangre, algunos mosquitos alimentados(Figura 3B, medio)y otros no(Figura 3B, derecha). Este resultado demuestra que se pueden obtener dos tipos de datos de este protocolo: 1) el porcentaje de hembras totales que se alimentan de una comida determinada, y 2) el volumen ingerido por las hembras que se alimentan de una comida dada.
Este protocolo se puede utilizar para entregar y cuantificar comidas con varias composiciones proteicas. Figura 4A,B mostrar datos recogidos con comidas con fluoresceína añadida. La proporción de mosquitos que alimentaron y el volumen de comida que ingirieron, respectivamente, se calcularon a partir de las lecturas de fluorescencia. Estas lecturas son altamente sensibles y permiten una cuantificación precisa de μL, pero tienen la limitación de que los mosquitos no pueden ser utilizados para futuros experimentos en vivo. La Figura 4C,D muestra los datos recogidos de un experimento independiente con mosquitos que fueron puntuados como alimentados o no alimentados por los ojos después de que se les ofrecieron comidas sin fluoresceína. El tamaño de la comida se calculó como peso promedio/hembra de grupos de 5 mosquitos. Aunque estas mediciones de peso son menos sensibles que las mediciones de fluorescencia, permiten que las hembras sean recuperadas y utilizadas para una mayor experimentación en vivo. La proporción de mosquitos que se alimentan puede variar a través de diferentes días experimentales, como se refleja en la Figura 4A y la Figura 4C.
La Figura 5 muestra el volumen consumido de comidas que contienen medicamentos que regulan el comportamiento de búsqueda de mosquitos. En estos experimentos, a las hembras se les ofreció sangre, solución salina + ATP, o salina + comidas ATP con 100 μM del agonista receptor humano NPY Y2, TM30338. Este medicamento altera el comportamiento de búsqueda de host a través de la activación de Ae. aegypti NPY-like receptor 7. Medir el tamaño de las comidas es fundamental para la interpretación de experimentos para evaluar el efecto de este fármaco en el comportamiento posterior a la alimentación de la sangre, ya que permite al investigador calcular la dosis consumida por cada hembra.
En los ejemplos anteriores, las hembras eran alimentadas con sangre o comidas de sangre sustitutivas, todas las cuales resultaron en comidas de 3-5 μL(Figura 3, Figura 4, Figura 5). Este ensayo basado en fluorescencia también se puede utilizar para medir tamaños de comida más pequeños y/o variables que no se pueden discernir con precisión de las mediciones de peso promedio del grupo. En la Figura 6,se utilizó el mismo protocolo de cuantificación de fluorescencia para medir el comportamiento de alimentación de néctar intercambiando el Glytube por una bola de algodón saturada con 10% sacarosa que contiene 0,002% fluoresceína. Los azúcares de néctar no se pueden presentar en el ensayo de Glytube porque las hembras no pueden detectar la presencia de azúcares de néctar con la stylet y no inician la alimentación27. Estos datos permiten al investigador determinar que las comidas azucaradas son consistentemente más pequeñas que las comidas en la sangre, de acuerdo con el trabajo anterior34 (Figura 6).
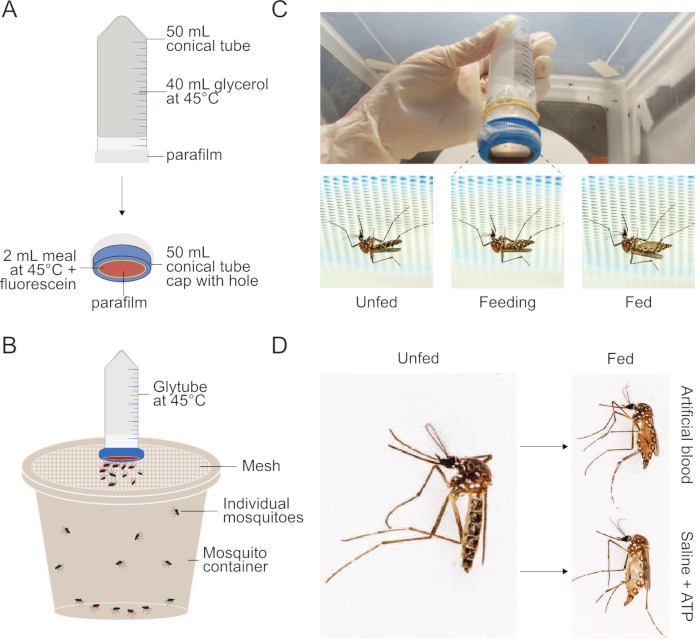
Figura 1: Configuración del método Glytube utilizado para alimentar las comidas a los mosquitos. (A) Esquema de un Glytube deconstruido utilizado para alimentar sangre y otras comidas a los mosquitos. (B) Esquema de un Glytube presentado en lo alto de un recipiente de mosquitos con una tapa de malla. Los mosquitos hembra pueden atravesar la tapa de malla para alimentarse. (C) Fotografías del Glytube (arriba), y mosquitos hembra Aedes aegypti antes, durante y después de la alimentación (abajo, de izquierda a derecha) en una comida entregada por Glytube. Se muestra a los mosquitos perforando a través de la malla que cubre su recipiente para acceder al alimentador de membranas. (D) Fotografías que muestran la aparición de mosquitos Ae. aegypti hembras que no están alimentados (izquierda) y que se han engordado en una comida de sangre artificial (derecha, arriba) o una comida salina + ATP (derecha, abajo). El método Glytube fue publicado previamente en Costa-da-Silva et al. (2013)20. Las fotografías en (C) y (D) son cortesía de Alex Wild. Haga clic aquí para ver una versión más grande de esta figura.
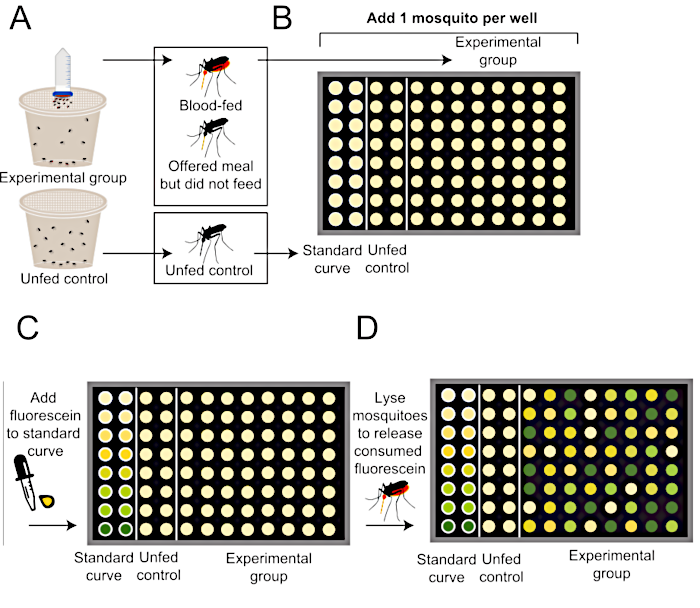
Figura 2: Esquema de cómo cuantificar el tamaño de las comidas después del protocolo de alimentación sanguínea de Glytube. (A) A los mosquitos se les ofrece una comida con fluoresceína (parte superior, grupo experimental) o ninguna comida (inferior, grupo de control negativo no alimentado). (B) Los mosquitos individuales se añaden a una placa de 96 pozos después de terminar el experimento de alimentación. (C) La curva estándar se genera utilizando cantidades conocidas de comida que contienen 0.002% fluoresceína. (D) Los mosquitos son homogeneizados para liberar cualquier fluoresceína consumida, y los niveles de fluorescencia en cada pozo se cuantifican utilizando un lector de placas. Este método de cuantificación de fluorescencia se modifica desde Liesch et al. (2013)34. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Experimento de alimentación sanguínea de Glytube con cuantificación basada en fluoresceína. (A) Mediciones de curva estándar obtenidas de los pozos donde se añadió un mosquito del grupo de control no controlado a una cantidad conocida de comida que contenía 0,002% fluoresceína (escala del eje y = unidades arbitrarias). B) Volumen de comida calculado con lecturas de fluorescencia para hembras en el grupo de control no alimentado (izquierda, negro, n = 40), el grupo experimental que se alimentaba de sangre (medio, rojo, n = 37), y el grupo experimental que no se alimentaba de sangre (derecha, rojo, n = 23). Cada punto representa una medida de una hembra individual. Los datos se muestran como mediana con rango. Las letras indican grupos estadísticamente distintos, prueba Kruskal-Wallis con la comparación múltiple de Dunn, p<0.01. Estos datos se publicaron en Jové et al. (2020)27. Haga clic aquí para ver una versión más grande de esta figura.
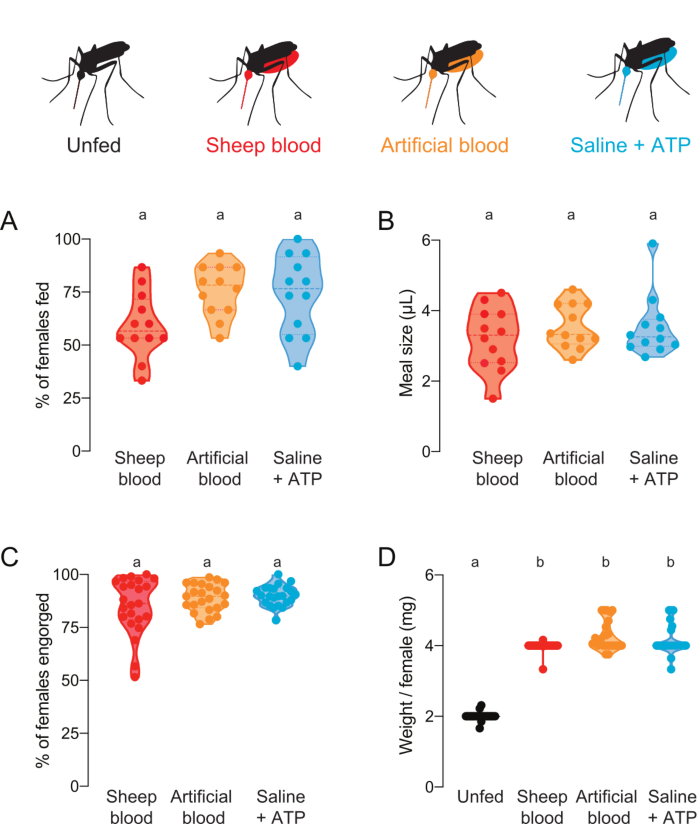
Figura 4: Cuantificación de comidas con diferente composición proteica. A las hembras se les ofrecieron comidas de sangre de oveja (roja), sangre artificial con proteínas de sangre humana (Kogan (1990)22) (naranja), o solución salina sin proteínas + comida ATP (aqua)7. (A) Porcentaje de hembras alimentadas con lecturas de fluorescencia. Cada punto representa un grupo de 12–16 mujeres. Los datos se muestran como medianas con rangos, n = 12. B) Volumen de comida calculado con lecturas de fluorescencia. Cada punto representa una medida de una hembra individual en un solo ensayo de la Figura 4A. Los datos se muestran como medianas con rangos, n = 12. (C) Porcentaje de hembras completamente engordadas después de la alimentación por membrana artificial, puntuada por ojo. Cada punto representa el porcentaje de mujeres que provienen de grupos de 20-30 mujeres. Los datos se muestran como medianas con rangos, n = 23. (D) Los tamaños de las comidas puntuadas como peso/hembra después de la condición de alimentación se puntuó por ojo. Los pesos se calcularon como el promedio de grupos de 5 mosquitos. Los datos se muestran como medianas con rangos, n = 23. R–D: Las letras indican grupos estadísticamente distintos, prueba Kruskal-Wallis con la comparación múltiple de Dunn, p<0.05. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Cuantificación de comidas con compuestos farmacológicos. Las hembras consumen comidas del mismo tamaño de sangre de oveja (rojo), solución salina + ATP (agua) y solución salina + ATP + 100 μM dosis de receptor humano NPY Y2 agonista TM30338 (azul oscuro). Volumen de comida calculado con lecturas de fluorescencia. Cada punto representa una medida de una hembra individual. Los datos se muestran como medianas con rangos, n = 12. Las letras indican grupos estadísticamente distintos, prueba Kruskal-Wallis con la comparación múltiple de Dunn, p<0.05. Haga clic aquí para ver una versión más grande de esta figura.

Figura 6: Cuantificación de comidas de néctar más pequeñas. (A) Esquema del ensayo de alimentación de néctar. B) El volumen de comida calculado con lecturas de fluorescencia para hembras de tipo salvaje ofrecía comidas de agua (azul, n = 36) o 10% sacarosa (verde, n = 53), cada una con 0,002% fluoresceína, en el ensayo de alimentación de néctar. Cada punto representa una medida de una hembra individual. Los datos se muestran como medianas con rangos. Las cartas indican grupos estadísticamente distintos, prueba Mann-Whitney, p<0.05. Estos datos se publicaron en Jové et al. (2020)27. Haga clic aquí para ver una versión más grande de esta figura.
| Harina de sangre artificial | |||
| Concentración de solución de stock (mg/ml) | Volumen de solución de stock en harina (μL/ml) | Concentración final de la comida (mg/ml) | |
| Componentes proteicos* | |||
| γ-Globulins | 50 | 300 | 15 |
| Hemoglobina | 35 | 230 | 8 |
| Albúmina | 300 | 340 | 102 |
| Proteína total | - | - | 125 |
| Componentes no proteicos | |||
| Concentración de solución de stock (mM) | Volumen de solución de stock en harina (μL/ml) | Concentración final de comidas (mM) | |
| Nacl | En stock de γ globulina | - | 5-10 |
| NaHCO3 | En stock de γ globulina | - | 120 |
| Atp | 200 | 5 | 1 |
| Agua | - | 125 | - |
| *Los componentes proteicos se preparan en solución de stock de agua de doble destilado, a excepción de γ-Globulinas, que se disuelven en 400 mM NaHCO3 e incluyen una cantidad variable de NaCl (2-4%) en el producto. | |||
Tabla 1: Receta para preparar comidas artificiales de sangre (adaptadas de Kogan (1990)22). La sangre artificial consiste en proteínas y componentes no proteicos que se encuentran regularmente en la sangre humana y proporciona la opción de variar las proporciones de estos componentes. Los mosquitos pueden producir huevos después de alimentarse con sangre artificial7,22.
| Comida salina | |||
| Componente | Concentración de solución de stock (mM) | Volumen de solución de stock en harina (μL/ml) | Concentración final de comidas (mM) |
| Nacl | - | - | - |
| NaHCO3 | 400 | 300 | 120 |
| Atp | 200 | 5 | 1 |
| Agua | - | 695 | - |
Tabla 2: Receta para comida salina con ATP (adaptada de Duvall et al. (2019)7). Las comidas salinas sin proteínas se pueden utilizar para entregar compuestos de interés a los mosquitos mientras todavía imitan la distensión abdominal que ocurre después de la alimentación en la sangre, pero sin desencadenar el desarrollo del huevo que ocurre cuando las proteínas se ingiere.
Discusión
Para muchas aplicaciones de laboratorio, los alimentadores de membrana artificial ofrecen beneficios distintos en comparación con los huéspedes vivos al permitir a los investigadores la capacidad de manipular directamente el contenido de la comida. Aunque hay múltiples métodos disponibles para la alimentación por membrana artificial, el método descrito aquí ofrece ventajas en flexibilidad, costo y rendimiento. En comparación con otros alimentadores de membranas comerciales, el ensayo de Glytube requiere un pequeño volumen de comida, lo que lo convierte en un mecanismo de entrega eficiente para reactivos costosos, incluidos fármacos o patógenos, minimizando el volumen total requerido7,35. A medida que las comidas salinas y artificiales sin proteínas promueven el engorgement, los compuestos o patógenos se pueden agregar a cualquiera de las comidas como una alternativa de alto rendimiento y no invasiva a las inyecciones. Además, cada componente del Glytube se puede lavar, reemplazar o escalar fácilmente para entregar y cuantificar múltiples tipos de comidas sin contaminación cruzada del aparato de alimentación.
Para cuantificar los volúmenes de comida consumidos por los mosquitos, el método basado en la fluorescencia permite una cuantificación más precisa del tamaño de las comidas que pesar a los mosquitos antes y después de la alimentación. Cabe señalar que este método es un ensayo de punto final. Por el contrario, el pesaje permite mantener vivos a los mosquitos para una mayor experimentación. Mediante el uso de un lector de placas, el método basado en la fluorescencia se puede escalar fácilmente para la cuantificación de alto rendimiento de las comidas consumidas por cientos de hembras individuales.
Para lograr altas tasas de alimentación, debe haber una combinación de suficientes señales de huésped para activar el comportamiento femenino de búsqueda de huésped y atraer a las hembras al alimentador. Si los mosquitos no se amontonan debajo del Glytube, es posible que la comida no se caliente correctamente o que el parto con CO2 no sea suficiente. La adición de olor humano a la superficie de la membrana aumenta de forma fiable el atractivo de la membrana artificial. Si se observan mosquitos debajo del Glytube pero no se alimentan, la composición de la comida puede tener la culpa. Las hembras no pueden alimentarse si la comida en sí no está caliente, la sangre es demasiado vieja, o si los aditivos de la comida son intrínsecamente aversivos o causan una reacción química indeseable36. Atp adicional también aumenta confiablemente las tasas de alimentación y se puede escalar hasta una concentración final de 2 mM en cada una de las recetas proporcionadas. Las hembras pueden no alimentarse si el parafilm no se tira tenso a través de la tapa de Glytube; el parafilm debe ser uniformemente transparente y no debe hebilla, ya que esto evita que la hembra sea capaz de perforar eficazmente el parafilm con su stylet. Si la comida se filtra a través del Glytube en la malla, el parafilm puede haberse roto durante el proceso de estiramiento y debe ser reemplazado.
Cambiar la composición de las comidas también puede permitir a los investigadores manipular el tiempo necesario para limpiar la comida del midgut, así como el comportamiento posterior de búsqueda de anfitriones. Las comidas presentadas aquí requieren 24-36 h para la digestión7 similar a la sangre derivada de animales. Después de alimentarse de cualquiera de estas comidas, las hembras suprimirán la búsqueda del huésped durante la ventana de tiempo de digestión. Dado que la comida salina carece de proteínas, las hembras regresan a la búsqueda del huésped después de que la comida se borra. Si es deseable un retorno más rápido, los investigadores pueden elegir comidas salinas alternativas de "limpieza rápida" que se excretan en aproximadamente 6 h27. Mientras que la composición de la comida salina presentada aquí se combina para comparar directamente los resultados con la harina de sangre artificial, la comida de "limpieza rápida" coincide más estrechamente con los niveles de sal fisiológica que se encuentran en la sangre de vertebrado.
Los métodos descritos aquí tienen limitaciones que deben ser consideradas antes de seleccionar el ensayo que es más adecuado para los objetivos experimentales del investigador. Las mediciones de fluoresceína descritas no permiten que los mosquitos se vuelvan a utilizar para la experimentación adicional. Sin embargo, las mediciones de peso se pueden tomar antes de la cuantificación del tamaño de la comida utilizando el ensayo de fluoresceína. Si el peso y el tamaño de las comidas son consistentes en múltiples ensayos para una comida determinada, el peso se puede utilizar como proxy en futuros experimentos. Además, este protocolo no distingue entre los déficits en la búsqueda de acogida frente a los comportamientos de alimentación sanguínea; los mosquitos que muestren deficiencias en la búsqueda del alimentador de membranas tendrán una reducción en las tasas de alimentación y/o en el tamaño de las comidas. Al agregar una cámara para registrar el comportamiento a lo largo del ensayo, los investigadores pueden determinar si las hembras no pueden encontrar el Glytube, o si encuentran el Glytube, pero no se alimentan.
El ensayo descrito aquí se puede adaptar para explorar muchas preguntas pendientes relacionadas con el comportamiento de alimentación en mosquitos. Por ejemplo, la contribución de proteínas sanguíneas específicas se puede explorar alterando la proporción de proteínas constituyentes o la concentración total de proteínas en la harina de sangre artificial. Para evaluar el tamaño de las comidas de múltiples eventos de alimentación, se pueden añadir colorantes con espectros de fluorescencia distintos para diferenciar las comidas de fuentes únicas37. Este protocolo también se puede modificar para estimular por separado las partes internas de la boca que detectan la sangre y que se utilizan para la ingestión (es decir, stylet), y los apéndices quimioensory que contactan con la piel (es decir, labium, piernas) como el mosquito aterriza para comenzar la alimentación de la sangre36. Por ejemplo, si los ligandos se añaden directamente a la comida, no se contactan con el labium y las piernas, ya que la membrana es perforada sólo por la stylet. Si los ligandos se añaden a la superficie exterior del parafilm en su lugar, permanecen separados de la comida y pueden ser contactados por el labium y las piernas36. Por último, la cinética detallada del comportamiento de la alimentación sanguínea no se entiende bien y el método presentado aquí podría modificarse para combinar el seguimiento de alta resolución con herramientas de aprendizaje automático para extraer lecturas conductuales de locomoción, postura y dinámica de alimentación38.
Este protocolo está dirigido a ser fácil de usar y rentable, con la capacidad de servir a los investigadores que emplean manipulaciones farmacológicas y genéticas para estudiar la alimentación de mosquitos en la sangre y el comportamiento posterior a la alimentación de la sangre.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Nipun Basrur, Adriana K. Rosas Villegas, Nadav Shai y Trevor Sorrells por sus comentarios sobre los manuscritos, y Zhongyan Gong y Kyrollos Barsoum por asistencia técnica. Agradecemos a Alex Wild por las fotografías utilizadas en la Figura 1. K.V. recibió el apoyo de la beca de doctorado Boehringer Ingelheim Fonds. V.J. fue compatible en parte con NIH T32-MH095246. Este trabajo fue apoyado en parte por una subvención a la Universidad Rockefeller del Instituto Médico Howard Hughes a través del programa James H. Gilliam Fellowships for Advanced Study a V.J. Este material se basa en el trabajo apoyado por el Programa de Becas de Investigación de Posgrado de la Fundación Nacional de Ciencias bajo la Beca No. NSF DGE-1325261 a V.J. Cualquier opinión, hallazgo y conclusión o recomendación expresada en este material son las del autor o autores y no reflejan necesariamente las opiniones de la Fundación Nacional de Ciencias.
Materiales
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | Fisher Scientific | 14-959-70C | |
| 3 mm diameter borosilicate solid-glass bead | MilliporeSigma | Z143928 | For use for bead mill homogenizer; not required if using pellet pestle grinder |
| 32 oz. high-density polyethylene (HDPE) plastic cup | VWR | 89009-668 | Example mosquito container used for feeding assays shown; alternate options can be used |
| 50 mL conical tubes | Fisher Scientific | 14-959-49A | |
| 96-well black polystyrene plate | ThermoFisher | 12-566-09 | |
| 96-well PCR plate sealing film | Bio-Rad | MSB1001 | Alternate options can be used |
| 96-well PCR plates | Bio-Rad | HSP9621 | Alternate options can be used |
| Adenosine 5′-triphosphate (ATP) disodium salt hydrate | MilliporeSigma | A6419 | |
| Albumin (human serum) | MilliporeSigma | A9511 | |
| Aluminum foil | Fisher Scientific | 01-213 | Alternate options can be used to block light entering fluorescein container |
| Balance | Fisher Scientific | 01-911 | Alternate options can be used |
| Bead mill homogenizer | Qiagen | 85300 | Not required if using pellet pestle grinder |
| Cotton ball | Fisher Scientific | 22456880 | For nectar-feeding; alternate options can be used |
| Defibrinated sheep blood | Hemostat Laboratories | DSB100 | Alternate options can be used |
| Drosophila CO2 fly pad | Tritech Research | MINJ-DROS-FP | Alternate options can be used |
| Fluorescein | MilliporeSigma | F6377 | |
| Fluorescence plate-reader | ThermoFisher | VL0000D0 | Alternate options can be used |
| Gamma-globulin (human blood) | MilliporeSigma | H7379 | |
| Glycerol | MilliporeSigma | G7893 | |
| Hemoglobin (human) | MilliporeSigma | G4386 | |
| Laboratory wrapping film - parafilm | Fisher Scientific | 13-374 | |
| Magnetic stirrer | Fisher Scientific | 90-691 | Alternate magnetic stirrers can be used |
| Microcentrifuge for 96-well plate | VWR | 80094-180 | Alternate options can be used |
| Microcentrifuge Tubes | MilliporeSigma | 2236412 | Alternate options can be used |
| Pellet pestle grinder | VWR | KT749521-1500 | Not required if using bead mill homogenizer |
| Phosphate buffered solution (PBS) | Fisher Scientific | BW17-516F | Optional |
| Razor blades | Fisher Scientific | 12-640 | Alternate options can be used, such as a lathe for better consistency of cutting |
| Rubber bands | |||
| Silicone tubing | McMaster Carr | Needed if using a fly pad for CO2 delivery | |
| Sodium bicarbonate (NaHCO3) | Fisher Scientific | S233 | |
| Sodium chloride (NaCl) | MilliporeSigma | S9888 | |
| Stir bars | Fisher Scientific | 14-512 | Alternate magnetic stir bars can be used |
| Translucent polypropylene storage box with removable lid | Example box used for feeding assays shown | ||
| Vortex mixer | |||
| Water bath | Alternate heating device may be used | ||
| White 0.8 mm polyester mosquito netting | American Home & Habit Inc. | F03A-PONO-MOSQ-M008-WT | Alternate options can be used |
Referencias
- Bhatt, S., et al. The global distribution and burden of dengue. Nature. 496 (7446), 504-507 (2014).
- Rogers, D. J., Wilson, A. J., Hay, S. I., Graham, A. J. The global distribution of yellow fever and dengue. Advances in Parasitology. 62 (05), 181-220 (2006).
- Chouin-Carneiro, T., et al. Differential susceptibilities of Aedes aegypti and Aedes albopictus from the Americas to Zika virus. PLoS Neglected Tropical Diseases. 10 (3), (2016).
- Guerbois, M., et al. Outbreak of Zika virus infection, Chiapas State, Mexico, 2015, and first confirmed transmission by Aedes aegypti mosquitoes in the Amercias. Journal of Infectious Diseases. 214 (9), 1349-1356 (2016).
- Weaver, S. C., et al. Zika virus: history, emergence, biology, and prospects for control. Antiviral Research. 130, 69-80 (2016).
- Attardo, G. M., Hansen, I. A., Raikhel, A. S. Nutritional regulation of vitellogenesis in mosquitoes: implications for anautogeny. Insect Biochemistry and Molecular Biology. 35 (7), 661-675 (2005).
- Duvall, L. B., Ramos-Espiritu, L., Barsoum, K. E., Glickman, J. F., Vosshall, L. B. Small-molecule agonists of Ae. aegypti neuropeptide Y receptor block mosquito biting. Cell. 176 (4), 687-701 (2019).
- Dimond, J. B., Lea, A. O., Hahnert, W. F., DeLong, D. M. The amino acids required for egg production in Aedes aegypti. The Canadian Entomologist. 88 (2), 57-62 (1956).
- Guerrero, D., Cantaert, T., Missé, D. Aedes mosquito salivary components and their effect on the immune response to arboviruses. Frontiers in Cellular and Infection Microbiology. 10, 1-11 (2020).
- Raquin, V., Lambrechts, L. Dengue virus replicates and accumulates in Aedes aegypti salivary glands. Virology. 507, 75-81 (2017).
- Farjana, T., Tuno, N. Multiple blood feeding and host-seeking behavior in Aedes aegypti and Aedes albopictus (diptera: Culicidae). Journal of Medical Entomology. 50 (4), 838-846 (2013).
- Scott, T. W., Takken, W. Feeding strategies of anthropophilic mosquitoes result in increased risk of pathogen transmission. Trends in Parasitology. 28 (3), 114-121 (2012).
- Ross, P. A., Lau, M. J., Hoffmann, A. A. Does membrane feeding compromise the quality of Aedes aegypti mosquitoes. PLoS ONE. 14 (11), 1-19 (2019).
- Ross, P. A., Axford, J. K., Richardson, K. M., Endersby-Harshman, N. M., Hoffmann, A. A. Maintaining Aedes aegypti mosquitoes infected with wolbachia. Journal of Visualized Experiments. 2017 (126), 1-8 (2017).
- Briegel, H., Hefti, M., DiMarco, E. Lipid metabolism during sequential gonotrophic cycles in large and small female Aedes aegypti. Journal of Insect Physiology. 48 (5), 547-554 (2002).
- McMeniman, C. J., Corfas, R. A., Matthews, B. J., Ritchie, S. A. S., Vosshall, L. B. Multimodal integration of carbon dioxide and other sensory cues drives mosquito attraction to humans. Cell. 156 (5), 1060-1071 (2014).
- Pakes, S. P., et al. . Guide for the Care and Use of Laboratory Animals. , (2011).
- Deng, L., Koou, S. Y., Png, A. B., Ng, L. C., Lam-Phua, S. G. A novel mosquito feeding system for routine blood-feeding of Aedes aegypti and Aedes albopictus. Tropical Biomedicine. 29 (1), 169-174 (2012).
- Gunathilaka, N., Ranathunge, T., Udayanga, L., Abeyewickreme, W. Efficacy of blood sources and artificial blood feeding methods in rearing of Aedes aegypti (Diptera: Culicidae) for sterile insect technique and incompatible insect technique approaches in Sri Lanka. BioMed Research International. 2017, 3196924 (2017).
- Costa-da-Silva, A. L., et al. Glytube: a conical tube and parafilm M-based method as a simplified device to artificially blood-feed the Dengue vector mosquito, Aedes aegypti. PLoS ONE. 8 (1), 53816 (2013).
- Carvalho, D. O., et al. Mass production of genetically modified Aedes aegypti for field releases in Brazil. Journal of Visualized Experiments. 83 (83), 1-10 (2014).
- Kogan, P. H. H. Substitute blood meal for investigating and maintaining Aedes aegypti (Diptera: Culicidae). Journal of Medical Entomology. 27 (4), 1-4 (1990).
- Gonzales, K. K., Hansen, I. A. Artificial diets for mosquitoes. International Journal of Environmental Research and Public Health. 13 (12), (2016).
- Baughman, T., et al. A highly stable blood meal alternative for rearing Aedes and Anopheles mosquitoes. PLoS Neglected Tropical Diseases. 11 (12), 0006142 (2017).
- Galun, R. Feeding stimuli and artificial feeding. Bulletin of the World Health Organization. 36, 590-593 (1967).
- Galun, R. Feeding response in Aedes aegypti: stimulation by adenosine triphosphate. Science. 142, 1674-1675 (1963).
- Jové, V., et al. Sensory Discrimination of Blood and Floral Nectar by Aedes aegypti Mosquitoes. Neuron. 108, 1-18 (2020).
- Petersen, M. T., et al. The impact of the age of first blood meal and Zika virus infection on Aedes aegypti egg production and longevity. PLoS ONE. 13 (7), 1-15 (2018).
- Sissoko, F., et al. Frequent sugar feeding behavior by Aedes aegypti in Bamako, Mali makes them ideal candidates for control with Attractive Toxic Sugar Baits (ATSB). PLoS ONE. 14 (6), 0214170 (2019).
- Houseman, J. G., Downe, A. E. R. Methods of measuring blood meal size and proteinase activity for determining the effects of mated state of digestive processes of female Aedes aegypti (L.) (Diperta: Culicidae). The Canadian Entomologist. 18, 241-248 (1986).
- Redington, B. C., Hockmeyer, W. T. A method for estimating blood meal volume in Aedes aegypti using a radioisotope. Journal of Insect Physiology. 22 (7), 961-966 (1976).
- Gonzales, K. K., et al. The effect of SkitoSnack, an artificial blood meal replacement, on Aedes aegypti life history traits and gut microbiota. Scientific Reports. 8 (1), 1-14 (2018).
- Klowden, M. J. The endogenous regulation of mosquito reproductive behavior. Experientia. 46 (7), 660-670 (1990).
- Liesch, J., Bellani, L. L., Vosshall, L. B. Functional and genetic characterization of neuropeptide Y-like receptors in Aedes aegypti. PLoS Neglected Tropical Diseases. 7 (10), 22486 (2013).
- Frances, S. P., Sithiprasasna, R., Linthicum, K. J. Laboratory evaluation of the response of Aedes aegypti and Aedes albopictus uninfected and infected with Dengue virus to Deet. Journal of Medical Entomology. 48 (2), (2011).
- Dennis, E. J., Goldman, O. V., Vosshall, L. B. Aedes aegypti mosquitoes use their legs to sense DEET on contact. Current Biology. 29 (9), 1551-1556 (2019).
- Harrington, L. C., et al. Heterogeneous feeding patterns of the Dengue vector, Aedes aegypti, on individual human hosts in rural Thailand. PLoS Neglected Tropical Diseases. 8 (8), 3048 (2014).
- Hol, F. J., Lambrechts, L., Prakash, M. BiteOscope, an open platform to study mosquito biting behavior. eLife. 9, 1-24 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados