Method Article
האכלה וכימות של דם שמקורו בבעלי חיים וארוחות מלאכותיות יתושים Aedes aegypti
In This Article
Summary
מטרת פרוטוקול זה היא לספק ארוחות דם שמקורן בבעלי חיים ומלאכותיות ליתושים Aedes aegypti באמצעות מאכיל קרום מלאכותי ולכמת במדויק את נפח הארוחה שנבלעה.
Abstract
נקבות ממין יתושים מסוימים יכולות להפיץ מחלות תוך נשיכת מארחי בעלי חוליות כדי להשיג ארוחות דם עשירות בחלבון הנדרשות להתפתחות ביצים. במעבדה, חוקרים יכולים לספק ארוחות דם שמקורן בבעלי חיים ומלאכותיות ליתושים באמצעות מאכילי קרום, המאפשרים מניפולציה של הרכב הארוחות. כאן, אנו מציגים שיטות להאכלת דם וארוחות דם מלאכותיות ליתושים Aedes aegypti וכימות הנפח הנצרך על ידי נקבות בודדות.
האכלה ממוקדת וכימות של ארוחות מלאכותיות /דם יש שימושים נרחבים, כולל בדיקת ההשפעות של מרכיבי ארוחה על התנהגות יתושים ופיזיולוגיה, אספקת תרכובות פרמקולוגיות ללא הזרקה, והדבקת יתושים עם פתוגנים ספציפיים. הוספת צבע פלואורסצנטי לארוחה לפני האכלה מאפשרת כימות גודל הארוחה הבאים. נפח הארוחה הנצרכת על ידי יתושים ניתן למדוד גם לפי משקל, אם הנקבות ישמשו מאוחר יותר לניסויים התנהגותיים, או על ידי הומוגניזציה של נקבות בודדות בצלחות 96 באר ומדידת רמות פלואורסצנטיות באמצעות קורא צלחת כמו בדיקת נקודת קצה. כימות גודל הארוחה יכול לשמש כדי לקבוע אם שינוי מרכיבי הארוחה משנה את נפח הארוחה לבלוע או אם צריכת הארוחה שונה בין זני יתושים. כימות מדויק של גודל הארוחה הוא קריטי גם למבחנים במורד הזרם, כגון אלה המודדים השפעות על משיכה מארחת או על פוריות. השיטות המוצגות כאן יכולות להיות מותאמות עוד יותר כדי לעקוב אחר עיכול הארוחות במהלך הימים או לכלול סמנים בולטים מרובים שנוספו לארוחות שונות (כמו צוף ודם) כדי לכמת את הצריכה של כל ארוחה על ידי יתוש אחד.
שיטות אלה מאפשרות לחוקרים לבצע לבדו מדידות תפוקה גבוהה כדי להשוות את נפח הארוחות הנצרך על ידי מאות יתושים בודדים. כלים אלה יהיו אפוא שימושיים באופן נרחב לקהילת חוקרי היתושים למענה על שאלות ביולוגיות מגוונות.
Introduction
אנו מציגים פרוטוקול להאכלת ארוחות דם מותאמות ליתושים Aedes aegypti באמצעות מאכיל קרום מלאכותי ומדידה מדויקת של נפח הארוחה הנצרכת על ידי כל יתוש בודד. פרוטוקול זה יכול להיות מותאם בגמישות כדי לשנות את התוכן של הארוחה או להשוות את נפח הארוחה הנצרכת על ידי קבוצות ניסיוניות שונות של יתושים.
יתוש Ae. aegypti מאיים על הבריאות העולמית על ידי הפצת פתוגנים הגורמים למחלות כולל קדחת צהובה, קדחת דנגה, chikungunya, ו זיקה1,2,3,4,5. נקבות Ae. aegypti מחייבות מאכילי דם; הם חייבים לצרוך דם בעלי חוליות כדי להשיג את החלבון הדרוש להתפתחות הביצית, וכל מצמד ביצים דורש ארוחתדםמלאה לפחות ממארח אחד 6,7,8. היתוש הנשי נושך לראשונה את המארח שלה על ידי פירסינג העור עם סגנון שלה הזרקת רוק, אשר מכיל תרכובות המפעילות את התגובה החיסונית של המארח9. לאחר מכן היא ניזון על ידי שאיבת דם דרך הסגנון שלה לתוך midgut שלה. בזמן שהיא צורכת ארוחת דם ממארח נגוע, היא עלולה לבלוע פתוגנים המועברים בדם6,8, אשר לאחר מכן נודדים מן midgut של היתוש אל בלוטות הרוק שלה10. יתושים נקבה נגועים בדרך זו יכול להפיץ מחלות על ידי הזרקת פתוגנים יחד עם רוק כאשר נושך המארחים הבאים11,12. הבנה וכימות המנגנונים של התנהגות האכלת דם הם צעדים חיוניים בשליטה על העברת מחלות המועברות על ידי יתושים.
פרוטוקולי מעבדה רבים לגידול יתושים וניסויים משתמשים בבעלי חיים כולל עכברים, שרקנים או בני אדם כמקורדם 13,14,15,16. השימוש בבעלי חיים מטיל חששות אתיים כמו גם דרישות מורכבות להכשרת כוח אדם, דיור וטיפול בבעלי חיים, ועמידה במדיניות הוועדה המוסדית לטיפול ושימוש בבעלי חיים (IACUC). זה גם מגביל את סוגי תרכובות שניתן להעביר יתושים, אשר מגביל את המחקרים שניתן לבצע17.
מנגנוני הזנת דם מלאכותיים, אשר בדרך כלל משתמשים במערכת קרום כדי לדמות עור מארח, הם כלים שימושיים לחקר התנהגויות האכלת דם העוקפות את הצורך בשמירה על מארחים חיים. דם שלם ניתן לרכוש ממספר ספקים ולהאכיל יתושים באמצעות מחומם, מאכילי קרום מלאכותי מעיל מים או מכשירים דומים18,19. בפרוטוקול זה, אנו מדגימים את השימוש במאכילי קרום חד פעמיים קטנים המונחים "גליטובים". מאכיל קרום זה, שפורסם בעבר על ידי קוסטה דה סילבה ואח '(2013)20, ניתן להרכיב בקלות מציוד מעבדה סטנדרטי, מה שהופך אותו אידיאלי עבור אספקת ארוחות דם למספר מתון של יתושים וישיר כדי להגדיל את לבדיקת קבוצות גדולות יותר או ניסוחים ארוחה מרובים. Glytube היא חלופה זולה ויעילה מאכילים מלאכותיים מסחריים אחרים, אשר עשוי לדרוש נפחי ארוחות גדולים יותר והם מתאימים יותר עבור אצווה להאכיל קבוצות גדולות של יתושים על ניסוח ארוחה אחת21.
פרוטוקול זה כולל שני סעיפים: הכנה/אספקה של ארוחות מלאכותיות וכימות הצריכה. בחלק הראשון, גליטובים משמשים כאמצעי יעיל כדי לספק דיאטות מניפולציה. דם שלם עשוי להיות מוחלף בארוחה מלאכותית לחלוטין כדי להשוות את ההשפעות של תחליפי דם במקום ארוחת דם. מתכון מותאם קוגן (1990)22 מוצג כאן, אם כי ניסוחים ארוחה מלאכותית מרובים פותחו23,24. יתר על כן, האכלה היא שיטה פחות פולשנית ופחות מייגעת להציג תרכובות פרמקולוגיות מאשר הזרקה. בשל הנפח הכולל הנמוך הנדרש עבור כל ארוחה (1-2 מ"ל), פרוטוקול זה מספק שיטת משלוח אטרקטיבית כדי להפחית את כמויות ריאגנטים יקרים. Ae. נקבות aegypti צורכות בקלות ארוחות ללא חלבון של תמיסת מלח עם אדנוזין 5′-טריפוספט (ATP)25,26, אשר מספק בסיס למדידת ההשפעות של רכיבי ארוחה אחת. לדוגמה, נוירופפטיד Y כמו קולטן 7 (NPYLR7) ב Ae. aegypti ידוע לתווך דיכוי מחפש מארח לאחר ארוחת דם עשירה בחלבון, וכאשר אגוניסטים NPYLR7 מתווספים לארוחה מלוחה ללא חלבון, יתושים נקבה להפגין דיכוי מחפש מארח דומה לאלה שצרכו דם שלם7.
בחלק השני, צעדים לכימות הנפח של כל ארוחה הנצרכת על ידי יתוש נקבה בודדים מוצגים. בדיקה זו מבוססת פלואורסצנטיות ולוכדת את מעמד ההזנה ברזולוציה גבוהה יותר מאשר שיטות שבהן נקבות מסווגות כ"מוזנות" או "unfed" בהתבסס על הערכה חזותית של התנפחות הבטן בלבד. על ידי הוספת פלואורסצנטין לארוחה לפני האכלה, נפחי הארוחות שנבלעו על ידי אנשים יכולים להיות מכמתים על ידי הומוגניזציה של כל יתוש בצלחת של 96 באר ומדידת עוצמת הפלואורסצנטיות כקריאה. בדיקה זו יכולה למדוד הבדלים במרץ האכלה בתגובה למשתנים כגון הרכב הארוחות או הרקע הגנטי של היתושים. כימות מדויק הוא קריטי עבור גדלי ארוחות ביניים, למשל כאשר הנקבות מוצעות ארוחות תת אופטימליות המכילות הרתעת האכלה או כאשר הם צורכים ארוחות סוכרוז בגדלים משתנים27. אם יתושים ניזונים נדרשים למבחנים התנהגותיים עוקבים לאחר כימות גודל הארוחה, ניתן לחשב את גודל הארוחה במקום זאת על ידי שקילה של נקבות מורדמות בקבוצות ולהעריך את המסה המוגברת הממוצעת לאדם. למרות שפחות מדויק מסימון פלואורסצנטין, שקילה עדיין מספקת הערכה מצטברת של נפח הארוחות ומאפשרת לבחון את השפעת הארוחה על תהליכים במורד הזרם, כגון פוריות או משיכה מארחת עוקבת. בעוד גודל ארוחת הדם משתנה והוא יכול להיות מושפע על ידי מספר עצום של גורמים11,28,29, בלע את גודל הארוחה נמדד עם השיטות המתוארות כאן עולים בקנה אחד עם כימותיםקודמים 7,30,31.
Protocol
הליכי האכלת הדם לא בוצעו באמצעות בעלי חיים חיים או מארחים אנושיים ועמידה בהנחיות שנקבעו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים באוניברסיטת רוקפלר (IACUC) והוועדה לבדיקה מוסדית (IRB).
1. הכנת ארוחה
- הכנת phagostimulant, אדנוזין 5′-טריפוספט
- הכן פתרון 25 מ"מ של מימית NaHCO3 (משקל מולקולרי, MW = 84.006 גרם / מול). עבור 100 מ"ל של 25 מ"מ NaHCO3, להוסיף 210 מ"ג של NaHCO3 לבקבוק נפחי ולמלא במים מזוקקים כפולים (ddH2O) לנפח כולל של 100 מ"ל. בעזרת מוט ערבוב מגנטי, מערבבים היטב את התמיסה עד להמסת כל ה-NaHCO3.
- לשקם ATP disodium מלח הידרט (MW = 551.14 גרם / מול) במים 25 mM NaHCO3 לריכוז הסופי של 200 מ"מ כספומט. עבור נפח כולל של 10 מ"ל של 200 מ"מ ATP ב 25 mM NaHCO3 חוצץ, להוסיף 1.1 גרם של מלח דיסודיום ATP hydrate לבקבוק נפחי ולמלא עם 25 מ"מ NaHCO3 חוצץ לנפח כולל של 10 מ"ל. בעזרת מוט ערבוב מגנטי, מערבבים היטב את הפתרון עד להמסת כל ה-ATP.
הערה: כדי למזער את ההידרוליזה של ATP, זה חייב להיות אגירה על ידי פתרון מלח כגון NaHCO3. - Aliquot פתרון ATP ולאחסן ב -20 מעלות צלזיוס.
הערה: פתרון מלאי זה של ATP נעשה בדרך כלל טרי כל שישה חודשים ומשמש לכל הארוחות המתוארות להלן. כדי למנוע השפלה, ALIQUOTS ATP לא צריך לעבור מחזורי הפשרה מרובים או להיות מחומם יחד עם מרכיבי ארוחה אחרים.
- הכנת פתרון המעקב הפלואורסצנטי, פלואורסצנטין
- הכן 2% (w / v) פתרון המניה של פלואורסצנטי מימית. עבור נפח פתרון מלאי כולל של 10 מ"ל, מערבבים 0.2 גרם של מלח פלורסצין דיסודיום עם 10 מ"ל של ddH2O בצינור חרוט 15 מ"ל עטוף בנייר אלומיניום בטמפרטורת החדר. פתרון מלאי זה של פלואורסצנטין יכול לשמש לדילול בכל הארוחות המתוארות להלן.
הערה: מכיוון שפלואורסצנטין רגיש לאור, הימנע מחשיפה לאור על-ידי עטיפת מיכלים בנייר אלומיניום.
- הכן 2% (w / v) פתרון המניה של פלואורסצנטי מימית. עבור נפח פתרון מלאי כולל של 10 מ"ל, מערבבים 0.2 גרם של מלח פלורסצין דיסודיום עם 10 מ"ל של ddH2O בצינור חרוט 15 מ"ל עטוף בנייר אלומיניום בטמפרטורת החדר. פתרון מלאי זה של פלואורסצנטין יכול לשמש לדילול בכל הארוחות המתוארות להלן.
- הכנת ארוחות דם שמקורן בבעלי חיים
- לחשב את מספר הארוחות הדרושות כדי להאכיל את כל היתושים; כל גליטובה מחזיקה ארוחה של 2 מ"ל ומאכילה כ-25 יתושים. הכינו ארוחה נוספת כדי לכייל את העקומה הסטנדרטית לקריאות פלואורסצנטיות. אלא אם צוין אחרת, כל השלבים בסעיף זה מתארים כמויות ריאגנטיות הנדרשות להכנת ארוחה אחת עם נפח סופי של 2 מ"ל.
- לארוחות דם שמקורן בבעלי חיים, יש להעביר 1.98-2 מ"ל דם כבשים דפיבריני לצינור חרוט של 15 מ"ל (ראו שלב 3.3 לכמות הדם הרצויה).
הערה: מקורות מסחריים של דם בעלי חוליות, כולל כבשים, שרקנים ובני אדם, ניתן להשתמש13. לפני השימוש, ודא כי הדם שנרכש לא עבר את תאריך התפוגה שלו ומערבבים אותו היטב על ידי היפוך הבקבוק, במיוחד אם יש הפרדה גלויה של מרכיבי הדם. - להאכלה אופטימלית, הוסיפו ATP לריכוז סופי של 1-2 מ"מ לאחר שדם הכבשים התחמם ל-45 מעלות צלזיוס באמבט מים. לקבלת ריכוז סופי של 1 מ"מ ATP, להוסיף 10 μL של 200 מ"מ ATP פתרון מלאי 1.99 מ"ל של דם מחומם מראש לערבב. לקבלת ריכוז סופי של 2 מ"מ ATP, להוסיף 20 μL של מלאי ATP 200 מ"מ ל 1.98 מ"ל של דם מחומם מראש לערבב. אם אין להוסיף ATP, חם 2 מ"ל של דם כבשים defibrinated.
- אם כימות מבוסס פלואורסצנטיות של גודל הארוחה הוא להתבצע לאחר מכן, להוסיף פתרון פלואורסצנטין לריכוז הסופי של 0.002% (2 μL של 2% מלאי פלואורסצנטין ב 2 מ"ל נפח הארוחה הכולל). להפחית את נפח הדם באותה כמות כמו פלואורסצנטין הוסיף. שמור 1 מ"ל של ניסוח הארוחה הסופית המכיל 0.002% פלואורסצנטין כדי ליצור את העקומה הסטנדרטית התייחסות. לטפל בנפח שנשמר באופן זהה לארוחה המועברת ליתושים; לחשוף לאותם תנאי אור וטמפרטורה לאורך כל הניסוי, ולאחר מכן להקפיא את זה יחד עם הארוחה נמסר.
- הכנת ארוחות דם מלאכותיות
- לחשב את מספר הארוחות הדרושות כדי להאכיל את כל היתושים; כל גליטובה מחזיקה ארוחה של 2 מ"ל ומאכילה כ-25 יתושים. הכינו ארוחה נוספת כדי לכייל את העקומה הסטנדרטית לקריאות פלואורסצנטיות. אלא אם כן צוין אחרת, כל השלבים בסעיף זה מתארים כמויות ריאגנט הנדרשות להכנת ארוחה אחת של 2 מ"ל.
- כדי להכין דם מלאכותי (מותאם קוגן (1990)22), כמו בטבלה 1, הראשון לעשות פתרון מלאי של 400 מ"מ NaHCO3. עבור נפח כולל של 10 מ"ל של 400 מ"מ NaHCO3 (MW = 84.006 גרם / מול), להוסיף 336 מ"ג של NaHCO3 לבקבוק נפחי ולמלא במים מזוקקים כפול (ddH2O) לנפח כולל של 10 מ"ל. בעזרת מוט ערבוב מגנטי, מערבבים היטב את התמיסה עד להמסת כל ה-NaHCO3.
- עבור רכיבי החלבון של דם מלאכותי, להכין פתרונות מלאי של 50 מ"ג / מ"ל של γ-גלובולין ב 400 מ"מ NaHCO3, 35 מ"ג / מ"ל של המוגלובין ב ddH2O, ו 300 מ"ג / מ"ל של אלבומין ב ddH2O. פתרונות מלאי חלבון ניתן לאחסן ב 4 °C (60 °F) עד 2 חודשים. הריכוז הסופי של סך החלבונים האנושיים בדם מלאכותי הוא 125 מ"ג/מ"ל. זה כולל ריכוזים סופיים של 15 מ"ג / מ"ל γ גלובולין, 8 המוגלובין מ"ג / מ"ל, ו 102 אלבומין מ"ג / מ"ל.
- עבור כל ארוחה 2 מ"ל, לשלב 600 μL של γ-globulins, 460 μL של המוגלובין, 680 μL של אלבומין, ו 250 μL של ddH2O מפתרונות מלאי המפורטים בטבלה 1. המתן להוסיף 10 μL של 200 מ"מ תמיסת מלאי ATP עד לאחר הארוחה התחממו ל 45 מעלות צלזיוס, מיד לפני הצגת הארוחה.
- אם כימות מבוסס פלואורסצנטיות של גודל הארוחה הוא להתבצע לאחר מכן, להוסיף פתרון פלואורסצנטין לריכוז הסופי של 0.002% (2 μL של 2% מלאי פלואורסצנטין ב 2 מ"ל נפח הארוחה הכולל). הפחת את נפח ה- ddH2O בשלב 4.4 באותה כמות כמו הפלואורסצנטין שנוסף. שמור לפחות 1 מ"ל של ניסוח הארוחה הסופית המכיל 0.002% פלואורסצנטין כדי ליצור את העקומה הסטנדרטית הפניה. לטפל בנפח שנשמר באופן זהה לארוחה המועברת ליתושים; לחשוף לאותם תנאי אור וטמפרטורה לאורך כל הניסוי, ולאחר מכן להקפיא את זה יחד עם הארוחה נמסר.
- הכנת ארוחות מלוחות ללא חלבון לדוגמה (מותאמות מ-Duvall et al. (2019)7)
הערה: ניתן להכין ארוחות מלוחות ללא חלבונים במספר דרכים7,27,32. הארוחה מלוחה המוצגת כאן היא גרסה ללא חלבון של מתכון הדם המלאכותי המתואר לעיל.- לחשב את מספר הארוחות הדרושות כדי להאכיל את כל היתושים; כל גליטובה מחזיקה ארוחה של 2 מ"ל ומאכילה כ-25 יתושים הכן ארוחה נוספת אחת כדי לכייל את העקומה הסטנדרטית למדידות פלואורסצנטיות. אלא אם כן צוין אחרת, כל השלבים בסעיף זה מתארים כמויות ריאגנט הנדרשות להכנת ארוחה אחת של 2 מ"ל.
- כדי להכין את הארוחה מלוחים, לעשות פתרון מלאי של 400 מ"מ NaHCO3. עבור נפח כולל של 10 מ"ל של 400 מ"מ NaHCO3 (MW = 84.006 g /mol), להוסיף 336 מ"ג של NaHCO3 בקבוק נפחי ולמלא ddH2O לנפח כולל של 10 מ"ל. בעזרת מוט ערבוב מגנטי, מערבבים היטב את התמיסה עד להמסת כל ה-NaHCO3.
- עבור כל ארוחה 2 מ"ל, לשלב בצינור חרוט 15 מ"ל 600 μL של 400 מ"מ NaHCO3 עם 1.39 מ"ל של ddH2O. לחכות להוסיף 10 μL של 200 מ"מ ATP פתרון מלאי עד לאחר הארוחה התחמם ל 45 מעלות צלזיוס באמבט מים.
- אם כימות מבוסס פלואורסצנטיות של גודל הארוחה הוא להתבצע לאחר מכן, להוסיף פתרון פלואורסצנטין לריכוז הסופי של 0.002% (2 μL של 2% מלאי פלואורסצנטין ב 2 מ"ל של נפח הארוחה הכולל). הפחת את נפח ה- ddH2O בשלב 5.3 באותה כמות כמו הפלואורסצנטין שנוסף. שמור לפחות 1 מ"ל של ניסוח הארוחה הסופית המכיל 0.002% פלואורסצנטין כדי ליצור את העקומה הסטנדרטית הפניה. לטפל בנפח שנשמר באופן זהה לארוחה המועברת ליתושים; לחשוף לאותם תנאי אור וטמפרטורה לאורך כל הניסוי, ולאחר מכן להקפיא את זה יחד עם הארוחה נמסר.
2. משלוח ארוחות ליתושים
- הגדרת מיכלי יתושים להאכלה
הערה: יתושים ניתן להאכיל במגוון של מיכלים כל עוד הקריטריונים הבאים מתקיימים. ודא כי המיכל גדול מספיק עבור יתושים לטוס מסביב, אבל לא כל כך גדול כי זה יהיה קשה עבור יתושים לאתר את משטח רשת ולהתחיל להאכיל. רשת שינוי המשמשת לכיסוי המיכל יכולה להשתנות בגודל החומר והחור. החורים חייבים להיות גדולים מספיק כדי שסגנון היתוש הנשי יחדור דרך, אבל לא כל כך גדול שהיתוש יכול לברוח. לאבטח את הרשת בחוזקה, כך שהוא מתוח, ואת Glytube יכול לנוח ביציבות על פני השטח שלה לאורך כל תקופת ההאכלה.- גורם מכיל לדוגמה (איור 1)הוא דלי פלסטיק פוליאתילן (HDPE) בצפיפות גבוהה בגודל 946 מ"ל(32 אונקיות). כדי לשכפל התקנה זו, השתמש בסכין גילוח כדי לחתוך חור מרכזי בקוטר ~ 10 ס"מ במכסה הדלי. כדי להרכיב את המיכל לכיבוש על ידי יתושים, לאבטח ~ 400 ס"מ2 חתיכה מרובעת של לבן 0.8 מ"מ פוליאסטר יתושים רשתות על גבי הדלי, בבטחה דוחף את המכסה המחורר למטה על זה כדי לצלם בחוזקה.
- לאסוף יתושים נקבה כי הם לפחות 3 ימים לאחר eclosion כדי להבטיח כי הם בוגרים מספיק כדי להאכיל את הדם. שיעורי האכלה אופטימליים נצפים לאחר 7 ימים33.
- מניחים יתושים נקבה לתוך המיכל לכסות עם רשת. אם המיכל מאוכלס בצפיפות עם יתושים, להגדיל את מספר Glytubes בשימוש. האכלה אופטימלית מושגת עם ~ 25 יתושים / גליטובה. זה מפחית את התחרות על גישה לקרום ההזנה.
- מניחים בצד קבוצת ביקורת של יתושים לא משוחדים שלא יוצעו להם ארוחה. בפרוטוקול מדידת המשקל, לשקול את הקבוצה unfed בנפרד ולהשתמש במשקל זה כדי להעריך עלייה במשקל בקבוצה הניסיונית שניזונה מארוחה. בפרוטוקול הכימות המבוסס על פלואורסצנטיות, הוסף את קבוצת היתושים הלא מנומקת לבארות לחישוב העקומה הסטנדרטית ולפקדים שליליים. כדי להתאים לשפעת אוטומטית של רקמת יתוש בסיסית בקבוצת הניסוי, ודאו שהעקומה הסטנדרטית ובארות הבקרה השליליות מכילות יתוש לא מזוהם.
- בנייה והקמה של גליטובה (עיבוד מקוסטה-דה-סילבה ואח ' (2013)20)
- כפי שמתואר באיור 1, כדי ליצור מקור חום, מלא צינור חרוט של 50 מ"ל ב-40 מ"ל של 100% גליצרול. לאטום את הצינור חרוט פתוח עם 5 ס"מ × 5 ס"מ חתיכת parafilm ולחזור עם חתיכה נוספת של 5 ס"מ × 5 ס"מ parafilm כדי למזער את הסיכוי של דליפה. באופן אופציונלי, הפרפילם יכול להיות מוחזק במקום באמצעות גומיות. הפוך את הצינור כדי להבטיח שאין חורים או רווחים.
- כדי ליצור את התקן משלוח הארוחות, חותכים חור ממורכז בקוטר 2.5 ס"מ בכובע הבורג של הצינור החרוט באמצעות סכין גילוח חד או, לקבלת עקביות טובה יותר, מחרטה. למתוח 5 ס"מ × 5 ס"מ חתיכת parafilm באופן שווה, כך שהוא בערך מכפיל את גודל. הפרפילם צריך להיות דק מספיק כי יתושים יכולים בקלות לנקב דרכו, אבל לא צריך להיות דליפות. לאטום מעל המשטח החיצוני של מכסה הבורג כדי לכסות את החור באופן מלא ולהניח את הכובע בצד.
הערה: כדי להגדיל את המשיכה Glytube, לפני מתיחת parafilm, בושם אותו עם ריח אנושי על ידי בעדינות לשפשף אותו על חלקה של עור אנושי ללא קוסמטיקה להחיל, דואג כי לא נוצרים חורים. זה מומלץ אם הניסוי אינו מכוון לחקור את הרמזים החושיים הדרושים ליתושים להתקרב לארוחה. - מחממים גם את הצינור האטום של גליצרול וגם את הארוחה (עם כל הרכיבים למעט ATP) באמבט מים של 42-45 מעלות צלזיוס למשך 15 דקות לפחות. אין לחמם מראש ATP; להוסיף אותו מיד לפני תחילת הניסוי.
- הוסיפו ATP לארוחה המחוממת ולמערבולת ביסודיות. פיפט 2 מ"ל של הארוחה מחוממת לתוך התא הפנימי של כובע הבורג בעדינות למקם את הפוך, מחומם, גליצרול מלא צינור חרוט 50 מ"ל בו. לדפוק חלקית את הכובע עם הארוחה על הצינור מלא גליצרול - בדיוק מספיק כדי למנוע דליפה של הארוחה או גליצרול.
הערה: נפח הארוחות בשימוש יכול לנוע בין 1 מ"ל ל 2.5 מ"ל. כמויות נמוכות יותר עשוי להיות שימושי במיוחד כאשר הארוחות משמשות כדי לספק תרכובות כי הם נדירים או יקרים. חשוב לעבוד במהירות בשלב זה, כך הארוחה לא להתקרר לטמפרטורת הסביבה ולהפחית את הסבירות של האכלה מקסימלית. קצב הקירור יהיה תלוי בטמפרטורת הסביבה של החדר שבו צעדים אלה מתבצעים, אבל הם בדרך כלל צריכים להסתיים בתוך 5 דקות ב 25 מעלות צלזיוס. - מניחים את Glytube התאספו על גבי מיכל יתוש ולאפשר את הגישה יתושים להאכיל לפחות 15 דקות כדי להשיג שיעורי האכלה מקסימלית.
- להאכלה מיטבית, הניחו מיכלי יתושים בתוך תא המצויד בפנקס CO2, ואפשרו התאקלמות של לפחות 15 דקות ב-25-28 מעלות צלזיוס ולחות של 70%-80% לפני אספקת הארוחה. תא ההסתעפות המשמש כאן הוא שינוי פשוט וזולה של התקנה שפורסמה בעבר16. הוא משתמש בתיבת אחסון פוליפרופילן שקופה בגודל 36 ס"מ L × 31 ס"מ W × 32 ס"מ H עם מכסה נשלף. חור בקוטר 1.5 ס"מ שנעשה בקיר התא מאפשר אספקת CO 2 דרךצינורות סיליקון. משטח דיפוזיה CO2 מודבק למרכז הפנימי של המכסה למסירת אוויר מטוהר CO2 כדי להתנות את האווירה התאית במהלך המשפט.
הערה: ודא רמזים מארח (חום CO2,עם ריח מארח אופציונלי16)נוכחים כך היתושים נמשכים מאכיל הממברנה. אם יתושים אינם מצטופפים מתחת לגליטובה, בדוק כי CO2 מועבר כראוי וכי הארוחה וגליטוב חמים מספיק. אם מקור CO2 חיצוני אינו זמין, ניתן להעביר CO2 באמצעות נשיפות של נשימה אנושית נושפת. - לאחר האכלה, ניתן להשליך את כובע גליטובה כפסולת biohazard או לעשות בו שימוש חוזר לאחר השרייה בתמיסת אקונומיקה באחוז נמוך ושטיפה יסודית במים.
3. כימות הארוחות הנצרכות
- שקילה יתושים שישמשו לניסויים נוספים
הערה: שקילה של יתושים כדי לכמת את גודל הארוחה מאפשרת להם לשמש לניסויים חיים נוספים, אך שיטה זו דורשת מדידת משקל מקבוצה של 5 יתושים. מאז משקולות של יתושים בודדים קשה למדוד במדויק באמצעות רוב יתרות המעבדה, שונות בגודל הארוחה הפרט לא ניתן לכמת בקלות על ידי מדידת משקולות. שקילה מומלצת רק למצבים שבהם הנקבות מתלהבות באופן ניכר מהארוחה.- יתושים קרים מרדים על ידי הזזת המיכל שלהם לחדר קר 4 מעלות צלזיוס או הנחתו על קרח.
- לשקול קבוצות של 5 נקבות מן הקבוצה unfed (כלומר, יתושים שמעולם לא הוצעו ארוחה) ולחשב את המשקל הממוצע שלהם כהערכה של משקל "האכלה מראש". המשקל הממוצע של יתוש unfed תלוי גנוטיפ, מין, ותנאי גידול. יתושים Ae. aegypti נקבה unfed גדל עם גישה libitum המודעה סוכרוז בדרך כלל שוקלים כ 2 מ"ג כל אחד.
- מתוך הקבוצה הניסיונית (כלומר, יתושים שהוצעו ארוחה), למיין נקבות לתוך "מוזן" ו "לא מוזן" ערימות המבוססות על distension הבטן נצפתה על ידיעין 7. מחלקים כל אחת מהערימות "מוזן" ו"לא מוזן", בהתאמה, לקבוצות של 5 יתושים לשקלול. יתושים בתוך כל קבוצה של 5 צריך להיגזר מאותה קבוצת ניסויים עבור לקיחת מדידות משקל קבוצתיות. לחשב את המשקל הממוצע לנקבה מכל ערימות "מוזן" ו "לא מוזן" של קבוצת הניסוי.
- מדידת פלואורסצנטיות לניתוח נקודת קצה7,27,34
הערה: כדי לקבל מדידות מדויקות של גודל הארוחה מיתושים בודדים שאינם נדרשים עוד לניסויים חיים נוספים, אחסן את היתושים ואת 1 מ"ל הנותרים של ארוחה המכילה 0.002% פלואורסצנטין ב -20 מעלות צלזיוס מיד לאחר האכלה. ניתן לעצור את הניסוי כאן. שיטה זו מחולקת לרמות ב- איור 2.- כדי ליצור עקומת ייחוס סטנדרטית, הכינו דילול סדרתי של אותה ארוחה המכילה 0.002% פלואורסצנטין שהוצע לקבוצת היתושים הניסיונית. יהיו בסך הכל 8 פתרונות עקומה סטנדרטיים. בכל אחד מהפתרונות הללו, הנפח הסופי של ארוחה המכילה 0.002% פלואורסצנטין יהיה 5, 2.5, 1.25, 0.625, 0.3125, 0.15625, 0.078125, או 0 μL, וכל אחד מהם יהיה 1x פוספט אגירה מלוחים (PBS) עבור נפח כולל של 100 μL (למשל, 5 μL של ארוחה המכילה 0.002% פלואורסצנטין ב 95 μL של 1x PBS).
- כדי להפוך את הפתרון הראשון של העקומה הסטנדרטית, להוסיף 50 μL של ארוחה המכילה 0.002% פלואורסצנטין ל 950 μL של 1x PBS ומערבולת ביסודיות (נפח סופי: 5 μL של ארוחה המכילה 0.002% פלואורסצנטין ב 95 μL של 1x PBS). כדי להפוך את שאר פתרונות העקומה הסטנדרטיים, בצע דילול פי 2 עבור כל שלב על ידי לקיחת 500 μL מהצינור הקודם והוספתו לצינור חדש המכיל 500 μL של 1x PBS. וורטקס הרבה לפני הכנת הדילול הבא פי 2.
- כדי להכין בארות שישמשו ליצירת עקומה סטנדרטית ייחוס, פיפטה 100 μL של כל אחד מפתרונות העקומה הסטנדרטיים לכל אחת מ-8 הבארות בעמודה הראשונה של לוח PCR של 96 באר. מוסיפים 1 יתוש שליטה unfed לכל אחד מאותם 8 בארות בעמודה הראשונה של הצלחת. חזור על הפעולה בעמודה השניה של הלוח עבור מדידת שכפול.
הערה: אם לקבוצות ניסיוניות מוצעים סוגי ארוחות שונים, יש להכין עקומת ייחוס סטנדרטית נפרדת לכל סוג ארוחה. - הוסף 100 μL של 1x PBS בכל באר שנותרה עבור קבוצות בקרה וניסיון unfed. אם יש לשבש את הרקמה בשלבים הבאים באמצעות הומוגניזר טחנת חרוזים או מערבולת, להוסיף חרוז אחד 3 מ"מ בורוסיליקט זכוכית מוצקה לכל באר.
- כפקד שלילי, מוסיפים 1 יתוש unfed לכל באר ב 2 העמודים הבאים של הצלחת. הפלואורסצנטיות הנמדדת בקבוצה זו קובעת ניתוק בסיסי כדי להסביר את שפעת הרקמות האוטומטית ותשמש כדי לקבוע אם יתוש בקבוצת הניסוי ניזון מהארוחה.
- הוסיפו 1 יתוש לבאר לבארות הנותרות מקבוצות הניסוי שהוצעו להם ארוחה.
- לאטום את הצלחת בזהירות לשבש את הרקמה על ידי שחיקה ידנית. הבטן צריכה להיות הומוגנית ביסודיות כדי לשחרר את הארוחה. שיטות לשבש את הרקמות כוללות שימוש homogenizer טחנת חרוזים עם חרוזי זכוכית מוצקה 3 מ"מ בורוסיליקט (30 הרץ במשך 30 שניות), מערבל מערבולת עם חרוזי זכוכית מוצקה 3 מ"מ borosilicate, או מטחנת עלים ללא חרוזים.
- צנטריפוגה הצלחת ב 2000 סל"ד במשך 1-2 דקות כדי לאסוף את lysate.
- הכינו צלחת שחורה של 96 באר עם 180 μL של 1x PBS בכל באר.
- העבר 20 μL של ליזלת לכל באר עם 180 μL של 1x PBS ומערבבים. אם זמין, השתמש פיפטה רב ערוצית בשלב זה עבור מהירות מוגברת ועקביות טובה יותר.
- מדוד את עוצמת הפלואורסצנטיות של כל באר באמצעות קורא לוחות בערוץ עירור/פליטה 485/520. צור את עקומת תקן הייחוס על-ידי התוויית נפח הארוחה הידוע כנגד מדידת עוצמת הפלואורסצנטיות המתאימה.
- באמצעות עקומת הייחוס הסטנדרטית שנוצרה, לשער את נפח הארוחה שנבלע על ידי כל יתושים קבוצת הניסוי. הפחת את הקריאה הממוצעת בעוצמת הפלואורסצנטיות של קבוצת הביקורת השלילית של יתושים unfed מקריאת עוצמת הפלואורסצנטיות של כל אדם בקבוצה ניסיונית כדי לתקן את שפעת הרקמה הבסיסית.
תוצאות
איור 1 מציג סכמטי להרכבת ה-Glytube, ואילו איור 2 מציג סקירה כללית של העיצוב הניסיוני למדידת גודל הארוחה באמצעות ההסתעפות המבוססת על פלואורסצנטיות המתוארת כאן. איור 3 מספק מדידות מייצגות של גודל ארוחות פלואורסצנטיות מניסוי להזנת דם. איור 4, איור 5 ואיור 6 ממחישים מדגם של שאלות ביולוגיות שניתן לטפל בהן באמצעות פרוטוקול זה. היישומים של הפרוטוקול הם נרחבים וכוללים שינוי הרכב ארוחות הדם, האכלת תרכובות תרופתיות, כימות מדויק של ארוחות דם תת אופטימליות או ארוחות צוף קטנות יותר, והשוואת התנהגות האכלה על פני גנוטיפים יתושים.
כדי ליצור עקומה סטנדרטית לחישוב נפח הארוחות, קריאות הפלואורסצנטיות מותוות מבארות הייחוס הייעודיות שכל אחת מהן מכילה יתוש לא מזוהה ונפח ידוע של הארוחה עם 0.002% פלואורסצנטין(איור 3A). קריאות פלואורסצנטיות מהבארות הנותרות, המכילות יתושים מקבוצת הביקורת השלילית של יתושים לא משוחדים או מקבוצת היתושים הניסיונית שהציעה ארוחה, מושווים לעקומה סטנדרטית זו כדי לכמת את נפח הארוחות (μL) הנצרך על ידי כל יתוש(איור 3B). כדי לאמת את הקריאות הבסיסיות במבחן זה, יש לאשר כי יתושים מקבוצת הביקורת השלילית unfed אינם מוקצים ערך חיובי של μL הנצרך (איור 3B, שמאל). למרות שלכל הנקבות בקבוצת הניסוי הוצעה ארוחת הדם, חלק מהיתושים האכילו(איור 3B, אמצע)וחלקם לא (איור 3B, נכון). תוצאה זו מוכיחה כי ניתן לקבל שני סוגים של נתונים מפרוטוקול זה: 1) אחוז הנשים הכוללות הניזנות מארוחה נתונה, ו -2) הנפח שנבלע על ידי הנקבות הניזונים מארוחה נתונה.
פרוטוקול זה יכול לשמש כדי לספק ולכמת ארוחות עם קומפוזיציות חלבון שונות. איור 4A,B מציג נתונים שנאספו באמצעות ארוחות עם פלואורסצנטין נוסף. שיעור היתושים שהאכילו ונפח הארוחות שהם בלעו, בהתאמה, חושבו מקריאות הפלואורסצנטיות. קריאות אלה רגישות מאוד ומאפשרות כימות מדויק של μL, אך יש להן מגבלה שלא ניתן להשתמש ביתושים לניסויים חיים עתידיים. איור 4C,D מציג נתונים שנאספו מניסוי עצמאי עם יתושים שקיבלו ציון של מזון או unfed על ידי העין לאחר שהוצעו להם ארוחות ללא פלואורסצנטין. גודל הארוחה חושב כמשקל ממוצע / נקבה מקבוצות של 5 יתושים. למרות שמדידות משקל אלה רגישות פחות ממדידות פלואורסצנטיות, הן מאפשרות לנקבות להתאושש ולהשתמש בהן לניסויים חיים נוספים. שיעור היתושים הניזונים יכול להשתנות בימים ניסיוניים שונים, כפי שמשתקף באיור 4A ובאיור 4C.
איור 5 מראה את הנפח הנצרך של ארוחות המכילות תרופות המווסתות התנהגות של מארח יתושים. בניסויים אלה, הנקבות הוצעו דם, מלוחים + ATP, או מלוחים + ארוחות ATP עם 100 מיקרומטר של אגוניסט קולטן NPY Y2 האנושי, TM30338. תרופה זו משנה התנהגות המארח מחפש באמצעות הפעלה של Ae. aegypti NPY כמו קולטן 7. מדידת גודל הארוחות היא קריטית עבור הפרשנות של ניסויים כדי להעריך את ההשפעה של תרופה זו על התנהגות לאחר האכלת דם כי זה מאפשר לחוקר לחשב את המינון הנצרך על ידי כל נקבה.
בדוגמאות הקודמות הוזנו הנקבות בדם או בארוחות דם חלופיות, שכולן הביאו לארוחות של 3-5 מיקרומטר(איור 3, איור 4, איור 5). ניתן להשתמש בפקודה מבוססת פלואורסצנטיות זו גם למדידת גדלי ארוחות קטנים יותר ו/או משתנים יותר שלא ניתן להבחין בהם במדויק ממדידות המשקל הקבוצתי הממוצעות. באיור 6, אותו פרוטוקול כימות פלואורסצנטי שימש למדידת התנהגות האכלת צוף על ידי החלפת גליטוב לכדור צמר גפן רווי ב-10% סוכרוז המכיל 0.002% פלואורסצנטין. סוכרי צוף לא ניתן להציג ב- Glytube assay כי הנקבות לא יכול לזהות את נוכחותם של סוכרים צוף עם סגנון ולא ליזום האכלה27. נתונים אלה מאפשרים לחוקר לקבוע כי ארוחות הסוכר קטנות באופן עקבי מארוחות דם, בהתאם לעבודההקודמת 34 (איור 6).
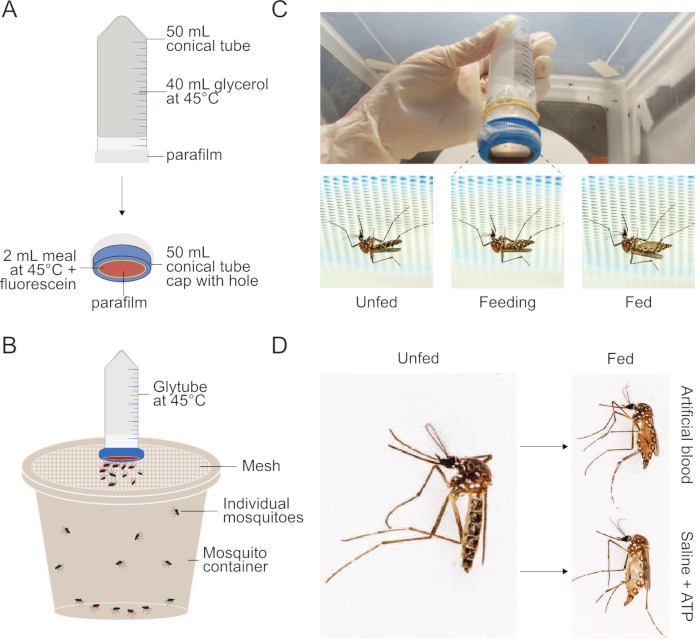
איור 1: הגדרת שיטת גליטוב המשמשת להזנת ארוחות ליתושים. (A)סכמטי של גליטובה מפורקת המשמשת להזנת דם וארוחות אחרות ליתושים. (B)סכמטי של גליטובה הציג על גבי מיכל של יתושים עם מכסה רשת. נקבת יתושים יכולה לנקב דרך מכסה הרשת כדי להאכיל. (ג)תצלומים של הגליטובה (למעלה), ונקבת יתושים Aedes aegypti לפני, במהלך ואחרי האכלה (למטה, משמאל לימין) על ארוחה שנמסרה על ידי גליטובה. יתושים מוצגים פירסינג דרך הרשת מכסה את המיכל שלהם כדי לגשת מאכיל הממברנה. (ד)תצלומים המראים את המראה של יתושים Ae. aegypti נקבה כי הם unfed (שמאל) וכי יש engorged על ארוחת דם מלאכותית (ימין, למעלה) או מלוחים + ארוחת ATP (ימין, למטה). שיטת גליטובה פורסמה בעבר בקוסטה-דה-סילבה ואח ' (2013)20. הצילומים ב-( C) ו- (D) באדיבות אלכס ויילד. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
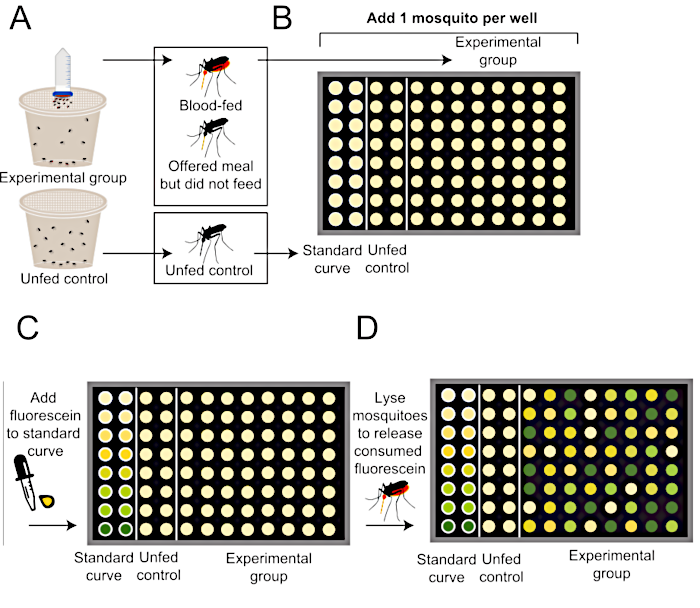
איור 2: סכמטי כיצד לכמת את גודל הארוחה לאחר פרוטוקול האכלת הדם של גליטוב. (A)יתושים מוצעים ארוחה עם פלואורסצנטין (למעלה, קבוצת ניסיוני) או לא ארוחה (למטה, קבוצת ביקורת שלילית unfed). (B)יתושים בודדים מתווספים לצלחת של 96 באר לאחר סיום ניסוי ההאכלה. (C) עקומה סטנדרטית נוצרת באמצעות כמויות ידועות של ארוחה המכילה 0.002% פלואורסצנטין. (D)יתושים הם הומוגניים כדי לשחרר את כל פלואורסצנטין נצרך, ורמות פלואורסצנטיות בכל באר מכמתים באמצעות קורא צלחת. שיטת כימות פלואורסצנטיות זו משתנה מ- Liesch et al. (2013)34. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: ניסוי האכלת דם של גליטובה עם כימות מבוסס פלואורסצנטין. (A)מדידות עקומה סטנדרטיות שהתקבלו מהבארות שבהן יתוש מקבוצת הביקורת unfed התווסף לכמות ידועה של ארוחה המכילה 0.002% פלואורסצנטין (סולם ציר y = יחידות שרירותיות). (ב)נפח הארוחה מחושב באמצעות קריאות פלואורסצנטיות לנקבות בקבוצת הביקורת unfed (שמאל, שחור, n = 40), הקבוצה הניסיונית שניזונה מדם (אמצע, אדום, n = 37), וקבוצת הניסוי שלא ניזון מדם (ימין, אדום, n = 23). כל נקודה מייצגת מדידה של נקבה בודדת. הנתונים מוצגים כחציון עם טווח. מכתבים מצביעים על קבוצות שונות סטטיסטית, מבחן קרוסקל-וואליס עם ההשוואה המרובת של דאן, p<0.01. נתונים אלה פורסמו ב Jové et al. (2020)27. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
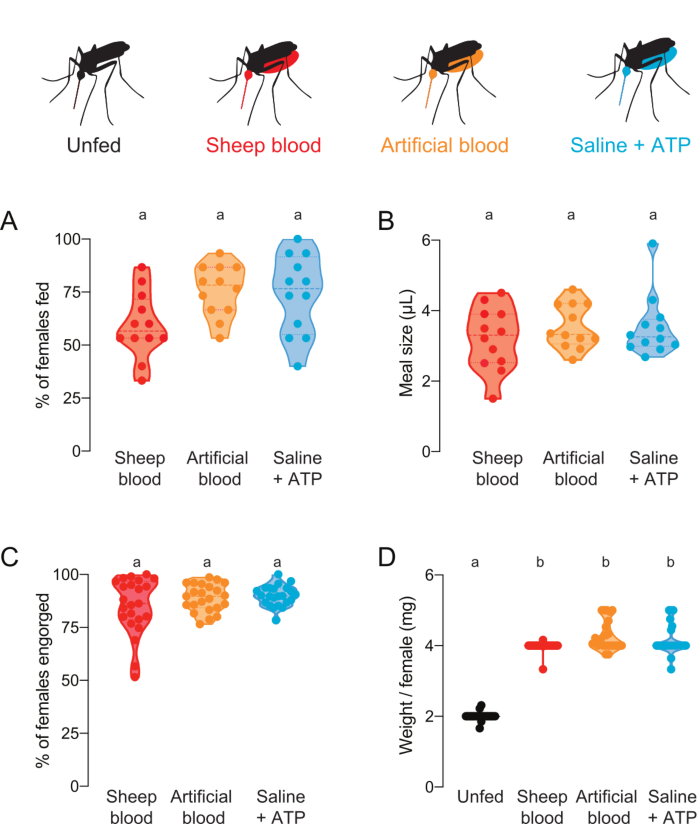
איור 4: כימות ארוחות עם הרכב חלבונים שונה. לנקבות הוצעו ארוחות של דם כבשים (אדום), דם מלאכותי עם חלבוני דם אנושיים (קוגן (1990)22) (כתום), או מלוחים ללא חלבון + ארוחת ATP (אקווה)7. (A)אחוז הנקבות שניזונו מציון באמצעות קריאות פלואורסצנטיות. כל נקודה מייצגת קבוצה של 12-16 נקבות. הנתונים מוצגים כחציבונים עם טווחים, n = 12. (B) נפח הארוחה מחושב באמצעות קריאות פלואורסצנטיות. כל נקודה מייצגת מדידה של נקבה בודדת במשפט אחד מאיור 4A. הנתונים מוצגים כחציבונים עם טווחים, n = 12. (ג)אחוז הנקבות ספוג לחלוטין לאחר הזנת קרום מלאכותי, הבקיע על ידי העין. כל נקודה מייצגת את אחוז הנקבות המחולקות מקבוצות של 20-30 נקבות. הנתונים מוצגים כחציבונים עם טווחים, n = 23. (D)מידות הארוחה הבקיע כמשקל / נקבה לאחר מצב האכלה היה הבקיע על ידי העין. משקולות חושבו כממוצע של קבוצות של 5 יתושים. הנתונים מוצגים כחציבונים עם טווחים, n = 23. A–D: אותיות מצביעות על קבוצות שונות סטטיסטית, מבחן קרוסקל-וואליס עם ההשוואה המרובות של דאן, p<0.05. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: כימות ארוחות בתרכובות תרופתיות. נקבות צורכות ארוחות באותו גודל של דם כבשים (אדום), מלוחים + ATP (אקווה), מלוחים + ATP + 100 מינון מיקרומטר של אגוניסט קולטן NPY Y2 אנושי TM30338 (כחול כהה). נפח הארוחות מחושב באמצעות קריאות פלואורסצנטיות. כל נקודה מייצגת מדידה של נקבה בודדת. הנתונים מוצגים כחציבונים עם טווחים, n = 12. מכתבים מצביעים על קבוצות שונות סטטיסטית, מבחן קרוסקל-וואליס עם ההשוואה המרובת של דאן, p<0.05. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 6: כימות ארוחות צוף קטנות יותר. (A)סכמטי של מבחני האכלת צוף. (B) נפח הארוחה מחושב באמצעות קריאות פלואורסצנטיות עבור נקבות מסוג בר הציע ארוחות של מים או (כחול, n = 36) או 10% סוכרוז (ירוק, n = 53), כל אחד עם 0.002% פלואורסצנטין, בצריף האכלה מבחנים. כל נקודה מייצגת מדידה של נקבה בודדת. הנתונים מוצגים כחציון עם טווחים. מכתבים מצביעים על קבוצות שונות סטטיסטית, מבחן מאן-וויטני, p<0.05. נתונים אלה פורסמו ב Jové et al. (2020)27. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| ארוחת דם מלאכותית | |||
| ריכוז תמיסת מלאי (מ"ג/מ"ל) | נפח של פתרון מלאי בארוחה (μL / מ"ל) | ריכוז ארוחה סופי (מ"ג/מ"ל) | |
| רכיבי חלבון* | |||
| γ-גלובולין | 50 | 300 | 15 |
| המוגלובין | 35 | 230 | 8 |
| אלבומין (שם) | 300 | 340 | 102 |
| סה"כ חלבון | - | - | 125 |
| רכיבים שאינם חלבונים | |||
| ריכוז פתרון מלאי (mM) | נפח של פתרון מלאי בארוחה (μL / מ"ל) | ריכוז הארוחה הסופית (mM) | |
| נקלה (נקל) | במניית γ גלובולין | - | 5-10 |
| נהקו3 | במניית γ גלובולין | - | 120 |
| Atp | 200 | 5 | 1 |
| מים | - | 125 | - |
| *רכיבי החלבון מוכנים בתמיסת מלאי של מים מזוקקים כפולים, למעט γ-גלובולין, המומסים ב-400 מ"מ NaHCO3 וכוללים כמות משתנה של NaCl (2-4%) במוצר. | |||
טבלה 1: מתכון להכנת ארוחות דם מלאכותיות (מותאם מקוגן (1990)22). דם מלאכותי מורכב מרכיבי חלבון ולא חלבון המצויים באופן קבוע בדם אנושי ומספק את האפשרות לשנות את היחסים בין רכיבים אלה. יתושים יכולים לייצר ביצים לאחר האכלה עלדםמלאכותי 7,22.
| ארוחה מלוחה | |||
| רכיב | ריכוז פתרון מלאי (mM) | נפח של פתרון מלאי בארוחה (μL / מ"ל) | ריכוז הארוחה הסופית (mM) |
| נקלה (נקל) | - | - | - |
| נהקו3 | 400 | 300 | 120 |
| Atp | 200 | 5 | 1 |
| מים | - | 695 | - |
טבלה 2: מתכון לארוחה מלוחה עם ATP (מותאם מ-Duvall et al. (2019)7). ניתן להשתמש בארוחות מלוחות נטולות חלבונים כדי לספק תרכובות מעניינות ליתושים ועדיין לחקות את התפזרות הבטן המתרחשת לאחר האכלת הדם, אך מבלי לעורר את התפתחות הביצית המתרחשת כאשר חלבונים נבלעים.
Discussion
עבור יישומי מעבדה רבים, מאכילי ממברנות מלאכותיות מציעים יתרונות ברורים בהשוואה למארחים חיים בכך שהם מאפשרים לחוקרים את היכולת לתפעל ישירות את תוכן הארוחה. למרות ששיטות מרובות זמינות להזנת קרום מלאכותי, השיטה המתוארת כאן מציעה יתרונות בגמישות, עלות ותפוקה. בהשוואה למאכילי קרום מסחריים אחרים, מבחני גליטוב דורשים נפח ארוחה קטן, מה שהופך אותו למנגנון אספקה יעיל עבור ריאגנטים יקרים, כולל תרופות או פתוגנים, על ידי מזעור הנפח הכולל הנדרש7,35. כמו גם מלוחים ללא חלבון וארוחות דם מלאכותיות לקדם engorgement, תרכובות או פתוגנים ניתן להוסיף לכל ארוחה כחלופה תפוקה גבוהה ולא פולשנית זריקות. בנוסף, ניתן לשטוף, להחליף או לשנות בקלות כל רכיב של גליטובה כדי לספק ולכמת סוגי ארוחות מרובים ללא זיהום צולב של מנגנון ההזנה.
כדי לכמת את נפחי הארוחות הנצרכים על ידי יתושים, השיטה המבוססת על פלואורסצנטיות מאפשרת כימות מדויק יותר של גודל הארוחה מאשר שקילה של היתושים לפני ואחרי האכלה. יש לציין כי שיטה זו היא חקירה נקודתית. לעומת זאת, שקילה מאפשרת לשמור על היתושים בחיים לניסויים נוספים. באמצעות קורא צלחות, ניתן לשנות בקלות את השיטה המבוססת על פלואורסצנטיות לכימות תפוקה גבוהה של ארוחות הנצרכות על ידי מאות נקבות בודדות.
כדי להשיג שיעורי הזנה גבוהים, שילוב של רמזים מארחים מספיק חייב להיות נוכח כדי להפעיל את ההתנהגות הנשית המארחת ולמשוך נקבות למאכיל. אם יתושים אינם מצטופפים מתחת לגלייטוב, ייתכן שהארוחה לא תחומם כראוי, או שמשלוח CO2 לא יספיק. הוספת ריח אנושי לפני השטח של הממברנה מגבירה באופן אמין את האטרקטיביות של הממברנה המלאכותית. אם יתושים נצפו מתחת לגליטוב אך אינם מצליחים להאכיל, הרכב הארוחה עשוי להיות אשם. הנקבות אינן רשאיות לאכול אם הארוחה עצמה אינה חמה, הדם ישן מדי, או אם התוספים לארוחה מרתיעים באופן מהותי או גורמים לתגובה כימית לא רצויה36. ATP נוסף גם מגדיל באופן אמין את שיעורי ההזנה וניתן לשנות את קנה המידה עד לריכוז סופי של 2 מ"מ בכל אחד מהמתכונים המסופקים. נקבות לא יכולות להאכיל אם הפרפילם לא נמשך מתוח על פני כובע גליטובה; הפרפילם צריך להיות שקוף באופן אחיד ולא צריך לקרוס, שכן זה מונע מהנקבה להיות מסוגל לנקב ביעילות את הפרפילם עם הסגנון שלה. אם הארוחה דולפת דרך גליטובה לרשת, ייתכן שהפרפילם נקרע במהלך תהליך המתיחה ויש להחליף אותו.
שינוי הרכב הארוחה יכול גם לאפשר לחוקרים לתפעל את משך הזמן הדרוש כדי לנקות את הארוחה מן midgut, כמו גם את ההתנהגות המארחת הבאים מחפש. הארוחות המוצגות כאן דורשות 24-36 שעות לעיכול7 בדומה לדם שמקורו בבעלי חיים. לאחר האכלה על כל הארוחות האלה, הנקבות ידכאו המארח מחפש במהלך חלון זמן העיכול. מכיוון שארוחת תמיסת מלח חסרה חלבון, הנקבות חוזרות למארחים לאחר פינוי הארוחה. אם חזרה מהירה יותר רצויה, החוקרים יכולים לבחור ארוחות מלוחות חלופיות "סליקה מהירה" המופרשות בכ 6 שעות27. בעוד ההרכב של הארוחה מלוחים המוצג כאן מותאם ישירות להשוות תוצאות עם ארוחת הדם המלאכותית, הארוחה "ניקוי מהיר" תואם באופן הדוק יותר את רמות המלח הפיזיולוגי נמצא בדם בעלי חוליות.
לשיטות המתוארות כאן יש מגבלות שיש לקחת בחשבון לפני בחירת ההסתעפות המתאימה ביותר למטרות הניסוי של החוקר. מדידות הפלואורסצנטין המתוארות אינן מאפשרות שימוש חוזר ביתושים לניסויים נוספים. עם זאת, מדידות משקל ניתן לבצע לפני כימות גודל הארוחה באמצעות מבחני פלואורסצנטין. אם משקל וגודל הארוחה עקביים על פני ניסויים מרובים לארוחה נתונה, משקל יכול לשמש פרוקסי בניסויים עתידיים. יתר על כן, פרוטוקול זה אינו מבחין בין ליקויים בהתנהגות המארחת לעומת האכלת הדם; יתושים המראים ליקויים במציאת מאכיל הממברנה יהיו ירידה בשיעורי האכלה ו / או גודל הארוחה. על ידי הוספת מצלמה כדי להקליט התנהגות לאורך כל ההסתערות, החוקרים יכולים לקבוע אם הנקבות לא יכולות למצוא את גליטובה, או אם הן מוצאות את גליטובה, אך אינן מזינות.
ניתן להתאים את ההסתעפות המתוארת כאן כדי לחקור שאלות רבות יוצאות דופן הקשורות להתנהגות האכלה אצל יתושים. לדוגמה, ניתן לחקור את תרומתם של חלבוני דם ספציפיים על ידי שינוי היחס בין חלבונים מרכיבים או ריכוז החלבון הכולל בארוחה המלאכותית בדם. כדי להעריך את גודל הארוחות מאירועי האכלה מרובים, ניתן להוסיף צבעים עם ספקטרום פלואורסצנטי מובהק כדי להבדיל בין ארוחות ממקורות ייחודיים37. פרוטוקול זה יכול גם להיות שונה כדי לעורר בנפרד את חלקי הפה הפנימיים המזהים דם ומשמשים לבליעה (כלומר, stylet), ואת נספחים כימוסנסוריים כי מגע העור (כלומר, labium, הרגליים) כמו אדמות יתוש להתחיל להאכילדם 36. לדוגמה, אם ליגנדים מתווספים ישירות לארוחה, הם אינם יוצרים קשר עם הלביום והרגליים, שכן הממברנה מנוקבת רק על ידי הסגנון. אם ליגנדים מתווספים לפני השטח החיצוניים של הפרפילם במקום, הם נשארים מופרדים מהארוחה וניתן ליצור קשר עם השפתיים והרגליים36. לבסוף, הקינטיקה המפורטת של התנהגות האכלת הדם אינה מובנת היטב ואת השיטה המוצגת כאן ניתן לשנות לשלב מעקב ברזולוציה גבוהה עם כלי למידת מכונה כדי לחלץ קריאות התנהגותיות של תנועה, יציבה, ודינמיקת האכלה38.
פרוטוקול זה נועד להיות ידידותי למשתמש וחסכוני, עם היכולת לשרת חוקרים המשתמשים במניפולציות תרופתיות וגנטיות כדי לחקור האכלת דם של יתושים והתנהגות שלאחר האכלת דם.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לניפון בסרור, אדריאנה ק. רוזס וילגס, נדב שי וטרבור סורלס על הערותיהם על כתבי היד, ולז'ונגיאן גונג וקיירולוס ברסום על הסיוע הטכני. אנו מודים לאלכס ווילד על התצלומים בהם נעשה שימוש באיור 1. K.V. נתמך על ידי מלגת הדוקטורט של בוהרינג'ר אינגלהיים פונדס. V.J. נתמך בחלקו על ידי NIH T32-MH095246. עבודה זו נתמכה בחלקה על ידי מענק לאוניברסיטת רוקפלר מהמכון הרפואי ע"ש הווארד יוז באמצעות מלגת ג'יימס ה. גיליאם למחקר מתקדם ל-V.J. חומר זה מבוסס על עבודה הנתמכת על ידי הקרן הלאומית למדע בוגרי תכנית מחקר תחת גרנט לא. NSF DGE-1325261 לוי.ג'יי. כל חוות דעת, ממצאים ומסקנות או המלצות המתבטאים בחומר זה הם של המחברים ואינם משקפים בהכרח את עמדות הקרן הלאומית למדע.
Materials
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | Fisher Scientific | 14-959-70C | |
| 3 mm diameter borosilicate solid-glass bead | MilliporeSigma | Z143928 | For use for bead mill homogenizer; not required if using pellet pestle grinder |
| 32 oz. high-density polyethylene (HDPE) plastic cup | VWR | 89009-668 | Example mosquito container used for feeding assays shown; alternate options can be used |
| 50 mL conical tubes | Fisher Scientific | 14-959-49A | |
| 96-well black polystyrene plate | ThermoFisher | 12-566-09 | |
| 96-well PCR plate sealing film | Bio-Rad | MSB1001 | Alternate options can be used |
| 96-well PCR plates | Bio-Rad | HSP9621 | Alternate options can be used |
| Adenosine 5′-triphosphate (ATP) disodium salt hydrate | MilliporeSigma | A6419 | |
| Albumin (human serum) | MilliporeSigma | A9511 | |
| Aluminum foil | Fisher Scientific | 01-213 | Alternate options can be used to block light entering fluorescein container |
| Balance | Fisher Scientific | 01-911 | Alternate options can be used |
| Bead mill homogenizer | Qiagen | 85300 | Not required if using pellet pestle grinder |
| Cotton ball | Fisher Scientific | 22456880 | For nectar-feeding; alternate options can be used |
| Defibrinated sheep blood | Hemostat Laboratories | DSB100 | Alternate options can be used |
| Drosophila CO2 fly pad | Tritech Research | MINJ-DROS-FP | Alternate options can be used |
| Fluorescein | MilliporeSigma | F6377 | |
| Fluorescence plate-reader | ThermoFisher | VL0000D0 | Alternate options can be used |
| Gamma-globulin (human blood) | MilliporeSigma | H7379 | |
| Glycerol | MilliporeSigma | G7893 | |
| Hemoglobin (human) | MilliporeSigma | G4386 | |
| Laboratory wrapping film - parafilm | Fisher Scientific | 13-374 | |
| Magnetic stirrer | Fisher Scientific | 90-691 | Alternate magnetic stirrers can be used |
| Microcentrifuge for 96-well plate | VWR | 80094-180 | Alternate options can be used |
| Microcentrifuge Tubes | MilliporeSigma | 2236412 | Alternate options can be used |
| Pellet pestle grinder | VWR | KT749521-1500 | Not required if using bead mill homogenizer |
| Phosphate buffered solution (PBS) | Fisher Scientific | BW17-516F | Optional |
| Razor blades | Fisher Scientific | 12-640 | Alternate options can be used, such as a lathe for better consistency of cutting |
| Rubber bands | |||
| Silicone tubing | McMaster Carr | Needed if using a fly pad for CO2 delivery | |
| Sodium bicarbonate (NaHCO3) | Fisher Scientific | S233 | |
| Sodium chloride (NaCl) | MilliporeSigma | S9888 | |
| Stir bars | Fisher Scientific | 14-512 | Alternate magnetic stir bars can be used |
| Translucent polypropylene storage box with removable lid | Example box used for feeding assays shown | ||
| Vortex mixer | |||
| Water bath | Alternate heating device may be used | ||
| White 0.8 mm polyester mosquito netting | American Home & Habit Inc. | F03A-PONO-MOSQ-M008-WT | Alternate options can be used |
References
- Bhatt, S., et al. The global distribution and burden of dengue. Nature. 496 (7446), 504-507 (2014).
- Rogers, D. J., Wilson, A. J., Hay, S. I., Graham, A. J. The global distribution of yellow fever and dengue. Advances in Parasitology. 62 (05), 181-220 (2006).
- Chouin-Carneiro, T., et al. Differential susceptibilities of Aedes aegypti and Aedes albopictus from the Americas to Zika virus. PLoS Neglected Tropical Diseases. 10 (3), (2016).
- Guerbois, M., et al. Outbreak of Zika virus infection, Chiapas State, Mexico, 2015, and first confirmed transmission by Aedes aegypti mosquitoes in the Amercias. Journal of Infectious Diseases. 214 (9), 1349-1356 (2016).
- Weaver, S. C., et al. Zika virus: history, emergence, biology, and prospects for control. Antiviral Research. 130, 69-80 (2016).
- Attardo, G. M., Hansen, I. A., Raikhel, A. S. Nutritional regulation of vitellogenesis in mosquitoes: implications for anautogeny. Insect Biochemistry and Molecular Biology. 35 (7), 661-675 (2005).
- Duvall, L. B., Ramos-Espiritu, L., Barsoum, K. E., Glickman, J. F., Vosshall, L. B. Small-molecule agonists of Ae. aegypti neuropeptide Y receptor block mosquito biting. Cell. 176 (4), 687-701 (2019).
- Dimond, J. B., Lea, A. O., Hahnert, W. F., DeLong, D. M. The amino acids required for egg production in Aedes aegypti. The Canadian Entomologist. 88 (2), 57-62 (1956).
- Guerrero, D., Cantaert, T., Missé, D. Aedes mosquito salivary components and their effect on the immune response to arboviruses. Frontiers in Cellular and Infection Microbiology. 10, 1-11 (2020).
- Raquin, V., Lambrechts, L. Dengue virus replicates and accumulates in Aedes aegypti salivary glands. Virology. 507, 75-81 (2017).
- Farjana, T., Tuno, N. Multiple blood feeding and host-seeking behavior in Aedes aegypti and Aedes albopictus (diptera: Culicidae). Journal of Medical Entomology. 50 (4), 838-846 (2013).
- Scott, T. W., Takken, W. Feeding strategies of anthropophilic mosquitoes result in increased risk of pathogen transmission. Trends in Parasitology. 28 (3), 114-121 (2012).
- Ross, P. A., Lau, M. J., Hoffmann, A. A. Does membrane feeding compromise the quality of Aedes aegypti mosquitoes. PLoS ONE. 14 (11), 1-19 (2019).
- Ross, P. A., Axford, J. K., Richardson, K. M., Endersby-Harshman, N. M., Hoffmann, A. A. Maintaining Aedes aegypti mosquitoes infected with wolbachia. Journal of Visualized Experiments. 2017 (126), 1-8 (2017).
- Briegel, H., Hefti, M., DiMarco, E. Lipid metabolism during sequential gonotrophic cycles in large and small female Aedes aegypti. Journal of Insect Physiology. 48 (5), 547-554 (2002).
- McMeniman, C. J., Corfas, R. A., Matthews, B. J., Ritchie, S. A. S., Vosshall, L. B. Multimodal integration of carbon dioxide and other sensory cues drives mosquito attraction to humans. Cell. 156 (5), 1060-1071 (2014).
- Pakes, S. P., et al. . Guide for the Care and Use of Laboratory Animals. , (2011).
- Deng, L., Koou, S. Y., Png, A. B., Ng, L. C., Lam-Phua, S. G. A novel mosquito feeding system for routine blood-feeding of Aedes aegypti and Aedes albopictus. Tropical Biomedicine. 29 (1), 169-174 (2012).
- Gunathilaka, N., Ranathunge, T., Udayanga, L., Abeyewickreme, W. Efficacy of blood sources and artificial blood feeding methods in rearing of Aedes aegypti (Diptera: Culicidae) for sterile insect technique and incompatible insect technique approaches in Sri Lanka. BioMed Research International. 2017, 3196924 (2017).
- Costa-da-Silva, A. L., et al. Glytube: a conical tube and parafilm M-based method as a simplified device to artificially blood-feed the Dengue vector mosquito, Aedes aegypti. PLoS ONE. 8 (1), 53816 (2013).
- Carvalho, D. O., et al. Mass production of genetically modified Aedes aegypti for field releases in Brazil. Journal of Visualized Experiments. 83 (83), 1-10 (2014).
- Kogan, P. H. H. Substitute blood meal for investigating and maintaining Aedes aegypti (Diptera: Culicidae). Journal of Medical Entomology. 27 (4), 1-4 (1990).
- Gonzales, K. K., Hansen, I. A. Artificial diets for mosquitoes. International Journal of Environmental Research and Public Health. 13 (12), (2016).
- Baughman, T., et al. A highly stable blood meal alternative for rearing Aedes and Anopheles mosquitoes. PLoS Neglected Tropical Diseases. 11 (12), 0006142 (2017).
- Galun, R. Feeding stimuli and artificial feeding. Bulletin of the World Health Organization. 36, 590-593 (1967).
- Galun, R. Feeding response in Aedes aegypti: stimulation by adenosine triphosphate. Science. 142, 1674-1675 (1963).
- Jové, V., et al. Sensory Discrimination of Blood and Floral Nectar by Aedes aegypti Mosquitoes. Neuron. 108, 1-18 (2020).
- Petersen, M. T., et al. The impact of the age of first blood meal and Zika virus infection on Aedes aegypti egg production and longevity. PLoS ONE. 13 (7), 1-15 (2018).
- Sissoko, F., et al. Frequent sugar feeding behavior by Aedes aegypti in Bamako, Mali makes them ideal candidates for control with Attractive Toxic Sugar Baits (ATSB). PLoS ONE. 14 (6), 0214170 (2019).
- Houseman, J. G., Downe, A. E. R. Methods of measuring blood meal size and proteinase activity for determining the effects of mated state of digestive processes of female Aedes aegypti (L.) (Diperta: Culicidae). The Canadian Entomologist. 18, 241-248 (1986).
- Redington, B. C., Hockmeyer, W. T. A method for estimating blood meal volume in Aedes aegypti using a radioisotope. Journal of Insect Physiology. 22 (7), 961-966 (1976).
- Gonzales, K. K., et al. The effect of SkitoSnack, an artificial blood meal replacement, on Aedes aegypti life history traits and gut microbiota. Scientific Reports. 8 (1), 1-14 (2018).
- Klowden, M. J. The endogenous regulation of mosquito reproductive behavior. Experientia. 46 (7), 660-670 (1990).
- Liesch, J., Bellani, L. L., Vosshall, L. B. Functional and genetic characterization of neuropeptide Y-like receptors in Aedes aegypti. PLoS Neglected Tropical Diseases. 7 (10), 22486 (2013).
- Frances, S. P., Sithiprasasna, R., Linthicum, K. J. Laboratory evaluation of the response of Aedes aegypti and Aedes albopictus uninfected and infected with Dengue virus to Deet. Journal of Medical Entomology. 48 (2), (2011).
- Dennis, E. J., Goldman, O. V., Vosshall, L. B. Aedes aegypti mosquitoes use their legs to sense DEET on contact. Current Biology. 29 (9), 1551-1556 (2019).
- Harrington, L. C., et al. Heterogeneous feeding patterns of the Dengue vector, Aedes aegypti, on individual human hosts in rural Thailand. PLoS Neglected Tropical Diseases. 8 (8), 3048 (2014).
- Hol, F. J., Lambrechts, L., Prakash, M. BiteOscope, an open platform to study mosquito biting behavior. eLife. 9, 1-24 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved