Method Article
Alimentation et quantification du sang d’origine animale et des repas artificiels chez les moustiques Aedes aegypti
Dans cet article
Résumé
L’objectif de ce protocole est de livrer des repas de sang artificiels et d’origine animale aux moustiques Aedes aegypti par l’intermédiaire d’une mangeoire à membrane artificielle et de quantifier avec précision le volume de repas ingérés.
Résumé
Les femelles de certaines espèces de moustiques peuvent propager des maladies tout en mordant les hôtes vertébrés pour obtenir des repas sanguins riches en protéines nécessaires au développement des œufs. En laboratoire, les chercheurs peuvent livrer des repas de sang artificiels et d’origine animale aux moustiques par l’intermédiaire de mangeoires membranaires, ce qui permet de manipulation de la composition des repas. Ici, nous présentons des méthodes pour nourrir le sang et les repas de sang artificiels aux moustiques Aedes aegypti et quantifier le volume consommé par les femelles individuelles.
L’alimentation ciblée et la quantification des repas artificiels/sanguins ont de larges utilisations, y compris l’essai des effets des composants de repas sur le comportement et la physiologie des moustiques, la livraison de composés pharmacologiques sans injection et l’infection des moustiques par des agents pathogènes spécifiques. L’ajout de colorant fluoréscéine au repas avant l’alimentation permet une quantification ultérieure de la taille des repas. Le volume de repas consommé par les moustiques peut être mesuré soit par le poids, si les femelles doivent être utilisées plus tard pour des expériences comportementales, soit par l’homogénéisation des femelles individuelles dans des assiettes de 96 puits et la mesure des niveaux de fluorescence à l’aide d’un lecteur de plaques comme test de point final. La quantification de la taille des repas peut être utilisée pour déterminer si le changement des composants des repas modifie le volume de repas ingéré ou si la consommation de repas diffère entre les souches de moustiques. La quantification précise de la taille des repas est également essentielle pour les analyses en aval, comme celles qui mesurent les effets sur l’attraction ou la fécondité de l’hôte. Les méthodes présentées ici peuvent être encore adaptées pour suivre la digestion des repas au fil des jours ou pour inclure de multiples marqueurs distinctifs ajoutés à différents repas (comme le nectar et le sang) pour quantifier la consommation de chaque repas par un seul moustique.
Ces méthodes permettent aux chercheurs d’effectuer à eux seul des mesures à haut débit pour comparer le volume de repas consommé par des centaines de moustiques individuels. Ces outils seront donc largement utiles à la communauté des chercheurs sur les moustiques pour répondre à diverses questions biologiques.
Introduction
Nous présentons un protocole pour l’alimentation des repas sanguins modifiés aux moustiques Aedes aegypti à l’aide d’une mangeoire à membrane artificielle et mesurant précisément le volume de repas consommé par chaque moustique individuel. Ce protocole peut être adapté avec souplesse pour modifier le contenu du repas ou pour comparer le volume de repas consommé par différents groupes expérimentaux de moustiques.
Le moustique Ae. aegypti menace la santé mondiale en propageant des agents pathogènes qui causent des maladies telles que la fièvre jaune, la dengue, le chikungunya et zika1,2,3,4,5. Ae. aegypti femelles sont obliger les mangeurs de sang; ils doivent consommer du sang vertébré pour obtenir la protéine nécessaire au développement des œufs, et chaque couvée d’œufs nécessite un repas sanguin complet d’au moinsun hôte 6,7,8. Le moustique femelle pique d’abord son hôte en perçant la peau avec son stylet et en injectant de la salive, qui contient des composés qui déclenchent la réponse immunitaire del’hôte 9. Elle se nourrit ensuite en pompant le sang à travers son stylet dans son midgut. Tout en consommant un repas de sang d’un hôte infecté, elle peut ingérer des agents pathogènestransmissibles par le sang 6,8, qui migrent ensuite de la médiane du moustique à ses glandes salivaires10. Les moustiques femelles infectés de cette façon peuvent propager la maladie en injectant des agents pathogènes ainsi que de la salive lorsqu’ils mordentles hôtes suivants 11,12. Comprendre et quantifier les mécanismes du comportement d’alimentation sanguine sont des étapes cruciales dans le contrôle de la transmission des maladies transmises par les moustiques.
De nombreux protocoles de laboratoire pour l’élevage et l’expérimentation des moustiques utilisent des animaux vivants, y compris des souris, des cobayes ou des humains comme source desang 13,14,15,16. L’utilisation d’animaux vivants impose des préoccupations éthiques ainsi que des exigences complexes en matière de formation du personnel, de logement et de soins aux animaux, et de conformité aux politiques du Comité institutionnel de soins et d’utilisation des animaux (IACUC). Il limite également les types de composés qui peuvent être livrés aux moustiques, ce qui limite les études qui peuvent être menées17.
Les appareils artificiels d’alimentation sanguine, qui utilisent généralement un système membranaire pour simuler la peau de l’hôte, sont des outils utiles pour étudier les comportements d’alimentation sanguine qui contournent la nécessité de l’entretien des hôtes vivants. Le sang entier peut être acheté auprès d’un certain nombre de vendeurs et donné aux moustiques à l’aide de mangeoires à membrane artificielles chauffées et en vested’eau ou d’appareils similaires 18,19. Dans ce protocole, nous démontrons l’utilisation de petites mangeoires membranaires jetables appelés « Glytubes ». Cette mangeoire membranaire, précédemment publiée par Costa-da-Silva et coll. (2013)20, peut être facilement assemblée à partir d’équipement de laboratoire standard, ce qui le rend idéal pour livrer des repas sanguins à un nombre modéré de moustiques et simple à mettre à l’échelle pour tester de plus grands groupes ou des formulations de repas multiples. Le Glytube est une alternative peu coûteuse et efficace à d’autres mangeoires artificielles commerciales, qui peuvent nécessiter de plus grands volumes de repas et sont plus appropriés pour l’alimentation par lots de grands groupes de moustiques sur une formulation de repasunique 21.
Ce protocole comprend deux sections : la préparation/livraison de repas artificiels et la quantification de la consommation. Dans la première section, les Glytubes sont utilisés comme un moyen efficace de fournir des régimes manipulés. Le sang entier peut être remplacé par un repas entièrement artificiel pour comparer les effets des substituts sanguins au lieu d’un repas sanguin. Une recette adaptée de Kogan (1990)22 est présentée ici, bien que plusieurs formulations artificielles de repasaient été développées 23,24. En outre, l’alimentation est une méthode moins invasive et moins laborieuse pour introduire des composés pharmacologiques que l’injection. En raison du faible volume total requis pour chaque repas (1-2 mL), ce protocole fournit une méthode de livraison attrayante pour réduire les quantités de reagents coûteux. Ae. aegypti femelles consomment facilement des repas sans protéines de solution saline avec adénosine 5′-triphosphate (ATP)25,26, qui fournit une base de référence pour mesurer les effets des composants de repas unique. Par exemple, neuropeptide Y-like récepteur 7 (NPYLR7) dans Ae. aegypti est connu pour médiation de l’hôte à la recherche de suppression après un repas de sang riche en protéines, et lorsque les agonistes NPYLR7 sont ajoutés à un repas salin sans protéines, les moustiques femelles présentent la suppression de recherche d’hôte similaire à ceux qui ont consommé du sang entier7.
Dans la deuxième section, des étapes pour quantifier le volume de chaque repas consommé par un moustique femelle individuel sont présentées. Cet essai est basé sur la fluorescence et capture l’état d’alimentation dans une résolution plus élevée que les méthodes dans lesquelles les femelles sont classées comme « nourries » ou « non nourries » sur la base de l’évaluation visuelle de la distension abdominale seule. En ajoutant de la fluorescéine au repas avant l’alimentation, les volumes de repas ingérés par les individus peuvent être quantifiés en homogénéisant chaque moustique dans une assiette de 96 puits et en mesurant l’intensité de la fluorescence en lecture. Cet essai peut mesurer les différences dans la vigueur de l’alimentation en réponse à des variables telles que la composition des repas ou le fond génétique des moustiques. Une quantification précise est essentielle pour les tailles de repas intermédiaires, par exemple lorsque les femelles se voient offrir des repas sous-optimaux contenant des moyens de dissuasion alimentaires ou lorsqu’elles consomment des repas au saccharose de tailles variables27. Si des moustiques nourris sont nécessaires pour des analyses comportementales ultérieures après la quantification de la taille des repas, la taille des repas peut plutôt être calculée en pesant les femelles anesthésiées en groupes et en estimant la masse moyenne accrue par individu. Bien que moins précis que le marquage à la fluorescéine, le pesage fournit toujours une estimation agrégée du volume des repas et permet d’examiner l’effet du repas sur les processus en aval, comme la fécondité ou l’attraction subséquente de l’hôte. Alors que la taille des farines sanguines est variable et peut être influencée par une myriadede facteurs 11,28,29, tailles de repas ingérées mesurées avec les méthodes décrites ici sont compatibles avec les quantificationsprécédentes 7,30,31.
Protocole
Les procédures d’alimentation sanguine n’ont pas été effectuées à l’aide d’animaux vivants ou d’hôtes humains et ont respecté les lignes directrices établies par le Rockefeller University Institutional Animal Care and Use Committee (IACUC) et la Institutional Review Board (IRB).
1. Préparation des repas
- Préparation du phagostimulant, adénosine 5′-triphosphate
- Préparer une solution de 25 mM de NaHCO3 aqueux (poids moléculaire, MW = 84,006 g/mol). Pour 100 mL de 25 mM NaHCO3, ajouter 210 mg de NaHCO3 à un flacon volumétrique et remplir d’eau double-distillée (ddH2O) à un volume total de 100 mL. À l’aide d’une barre magnétique, bien mélanger la solution jusqu’à ce que tous les NaHCO3 soient dissous.
- Reconstituer l’hydrate de sel de disodium ATP (MW = 551,14 g/mol) dans l’aqueux 25 mM NaHCO3 à une concentration finale de 200 mM ATP. Pour un volume total de 10 mL de 200 mM ATP en tampon NaHCO3 de 25 mM, ajoutez 1,1 g d’hydrate de sel disodique ATP à une fiole volumétrique et remplissez-le de tampon NaHCO3 de 25 mM à un volume total de 10 mL. À l’aide d’une barre magnétique, bien mélanger la solution jusqu’à ce que tout l’ATP soit dissous.
REMARQUE : Pour minimiser l’hydrolyse de l’ATP, elle doit être tamponnée par une solution salée telle que NaHCO3. - Aliquot la solution ATP et stocker à -20 °C.
REMARQUE : Cette solution de stock d’ATP est généralement faite fraîche tous les six mois et est employée pour tous les repas décrits ci-dessous. Pour éviter la dégradation, les aliquots ATP ne doivent pas subir plusieurs cycles de gel-dégel ou être chauffés avec d’autres composants de repas.
- Préparation de la solution de traceur fluorescent, fluorescéine
- Préparez une solution de stock de fluorescéine aqueuse à 2 % (w/v). Pour un volume total de solution de stock de 10 mL, mélanger 0,2 g de sel disodium de fluorescéine avec 10 mL de ddH2O dans un tube conique de 15 mL enveloppé dans du papier d’aluminium à température ambiante. Cette solution de stock de fluorescéine peut être utilisée pour la dilution dans tous les repas décrits ci-dessous.
REMARQUE : Comme la fluorescéine est sensible à la lumière, évitez l’exposition à la lumière en enveloppant les contenants dans du papier d’aluminium.
- Préparez une solution de stock de fluorescéine aqueuse à 2 % (w/v). Pour un volume total de solution de stock de 10 mL, mélanger 0,2 g de sel disodium de fluorescéine avec 10 mL de ddH2O dans un tube conique de 15 mL enveloppé dans du papier d’aluminium à température ambiante. Cette solution de stock de fluorescéine peut être utilisée pour la dilution dans tous les repas décrits ci-dessous.
- Préparation de repas sanguins d’origine animale
- Calculer le nombre de repas nécessaires pour nourrir tous les moustiques; chaque Glytube contient un repas de 2 mL et nourrit environ 25 moustiques. Préparez un repas supplémentaire pour calibrer la courbe standard pour les lectures de fluorescence. Sauf indication contraire, toutes les étapes de cette section décrivent les quantités de reagent nécessaires pour préparer un repas avec un volume final de 2 mL.
- Pour les repas sanguins d’origine animale, transférer 1,98 à 2 mL de sang de mouton défibriné dans un tube conique de 15 mL (voir l’étape 3.3 pour le volume désiré de sang).
REMARQUE : Des sources commercialement défibrigées de sang vertébré, y compris des moutons, des cobayes, et des humains, peuvent êtreemployées 13. Avant l’utilisation, assurez-vous que le sang acheté n’a pas dépassé sa date d’expiration et mélangez-le bien en inversant la bouteille, surtout s’il y a séparation visible des composants sanguins. - Pour une alimentation optimale, ajouter l’ATP à une concentration finale de 1 à 2 mM après que le sang des moutons a été réchauffé à 45 °C dans un bain d’eau. Pour une concentration finale de 1 mM ATP, ajouter 10 μL de la solution de stock ATP de 200 mM à 1,99 mL de sang préchauffé et mélanger. Pour une concentration finale de 2 mM ATP, ajouter 20 μL du stock ATP de 200 mM à 1,98 mL de sang préchauffé et mélanger. Si l’ATP ne doit pas être ajouté, réchauffer 2 mL de sang de mouton défibriné.
- Si la quantification de la taille des repas à base de fluorescence doit être effectuée par la suite, ajouter une solution de fluorescéine à une concentration finale de 0,002 % (2 μL de bouillon de fluorescéine de 2 % en volume total de repas de 2 mL). Réduisez le volume de sang de la même quantité que la fluorescéine ajoutée. Conserver 1 mL de la formulation finale des repas contenant 0,002 % de fluorescéine pour générer la courbe standard de référence. Traiter le volume retenu de la même façon que le repas qui est livré aux moustiques; exposer aux mêmes conditions de lumière et de température pendant toute la durée de l’expérience, puis congeler cela avec le repas livré.
- Préparation de repas de sang artificiels
- Calculer le nombre de repas nécessaires pour nourrir tous les moustiques; chaque Glytube contient un repas de 2 mL et nourrit environ 25 moustiques. Préparez un repas supplémentaire pour calibrer la courbe standard pour les lectures de fluorescence. Sauf indication contraire, toutes les étapes de cette section décrivent les quantités de reagent nécessaires pour préparer un repas de 2 mL.
- Pour préparer le sang artificiel (adapté de Kogan (1990)22), comme dans le tableau 1, d’abord faire une solution de stock de 400 mM NaHCO3. Pour un volume total de 10 mL de 400 mM NaHCO3 (MW = 84,006 g/mol), ajouter 336 mg de NaHCO3 à un flacon volumétrique et remplir d’eau double distillée (ddH2O) à un volume total de 10 mL. À l’aide d’une barre magnétique, bien mélanger la solution jusqu’à ce que tous les NaHCO3 soient dissous.
- Pour les composants protéiques du sang artificiel, préparer des solutions de stock de 50 mg/mL de γ-globulines dans 400 mM NaHCO3,35 mg/mL d’hémoglobine en ddH2O, et 300 mg/mL d’albumine dans des solutions de stock de protéines ddH2O. peuvent être stockés à 4 °C jusqu’à 2 mois. La concentration finale de protéines humaines totales dans le sang artificiel est de 125 mg/mL. Cela comprend les concentrations finales de 15 mg/mL γ-globulines, 8 mg/mL d’hémoglobine et 102 mg/mL d’albumine.
- Pour chaque repas de 2 mL, mélanger 600 μL de γ-globulines, 460 μL d’hémoglobine, 680 μL d’albumine et 250 μL de ddH2O provenant de solutions de stock énumérées dans le tableau 1. Attendez d’ajouter 10 μL de solution de stock ATP de 200 mM jusqu’à ce que le repas ait été réchauffé à 45 °C, immédiatement avant de présenter le repas.
- Si la quantification de la taille des repas à base de fluorescence doit être effectuée par la suite, ajouter une solution de fluorescéine à une concentration finale de 0,002 % (2 μL de bouillon de fluorescéine de 2 % en volume total de repas de 2 mL). Réduisez le volume de ddH2O à l’étape 4.4 de la même quantité que la fluorescéine ajoutée. Conserver au moins 1 mL de la formulation finale des repas contenant de la fluorescéine à 0,002 % pour générer la courbe standard de référence. Traiter le volume retenu de la même façon que le repas qui est livré aux moustiques; exposer aux mêmes conditions de lumière et de température pendant toute la durée de l’expérience, puis congeler cela avec le repas livré.
- Préparation d’exemples de repas salins sans protéines (adaptés de Duvall et coll. (2019)7)
REMARQUE : Les repas salins sans protéines peuvent être préparés de multiplesfaçons 7,27,32. Le repas salin présenté ici est une version sans protéines de la recette de sang artificiel décrite ci-dessus.- Calculer le nombre de repas nécessaires pour nourrir tous les moustiques; chaque Glytube contient un repas de 2 mL et nourrit environ 25 moustiques Préparer un repas supplémentaire pour calibrer la courbe standard pour les mesures de fluorescence. Sauf indication contraire, toutes les étapes de cette section décrivent les quantités de reagent nécessaires pour préparer un repas de 2 mL.
- Pour préparer le repas salin, faire une solution de stock de 400 mM NaHCO3. Pour un volume total de 10 mL de 400 mM NaHCO3 (MW = 84,006 g/mol), ajouter 336 mg de NaHCO3 à un flacon volumétrique et remplir de ddH2O à un volume total de 10 mL. À l’aide d’une barre magnétique, bien mélanger la solution jusqu’à ce que tous les NaHCO3 soient dissous.
- Pour chaque repas de 2 mL, mélanger dans un tube conique de 15 mL 600 μL de 400 mM NaHCO3 avec 1,39 mL de ddH2O. Attendez d’ajouter 10 μL de la solution de stock ATP de 200 mM jusqu’à ce qu’après le repas ait été réchauffé à 45 °C dans un bain d’eau.
- Si la quantification de la taille des repas à base de fluorescence doit être effectuée par la suite, ajouter une solution de fluorescéine à une concentration finale de 0,002 % (2 μL de bouillon de fluorescéine de 2 % dans 2 mL de volume total de repas). Réduisez le volume de ddH2O à l’étape 5.3 de la même quantité que la fluorescéine ajoutée. Conserver au moins 1 mL de la formulation finale des repas contenant de la fluorescéine à 0,002 % pour générer la courbe standard de référence. Traiter le volume retenu de la même façon que le repas qui est livré aux moustiques; exposer aux mêmes conditions de lumière et de température pendant toute la durée de l’expérience, puis congeler cela avec le repas livré.
2. Livraison de repas aux moustiques
- Mise en place de contenants à moustiques pour l’alimentation
REMARQUE : Les moustiques peuvent être nourris dans une variété de contenants tant que les critères suivants sont respectés. Assurez-vous que le contenant est assez grand pour que les moustiques volent autour, mais pas si grand qu’il sera difficile pour les moustiques de localiser la surface du maillage et commencer à se nourrir. Le maillage utilisé pour couvrir le récipient peut varier en matériau et en taille de trou. Les trous doivent être suffisamment grands pour que le stylet du moustique femelle puisse percer, mais pas si grand que le moustique puisse s’échapper. Fixez fermement le maillage de sorte qu’il soit tendu, et le Glytube peut reposer solidement sur sa surface tout au long de la période d’alimentation.- Un récipient d’exemple (figure 1) est un seau en plastique modifié de 946 mL (32 oz) de polyéthylène de haute densité (HDPE). Pour reproduire cette configuration, utilisez une lame de rasoir pour couper un trou central d’environ 10 cm de diamètre dans le couvercle du seau. Pour assembler le récipient pour l’occupation par les moustiques, fixez un morceau carré ~400 cm2 de filet blanc de moustique de polyester de 0,8 mm sur le dessus du seau, poussant solidement le couvercle perforé vers le bas au-dessus de lui pour casser étroitement.
- Recueillir les moustiques femelles qui sont au moins 3 jours après l’éclosion pour s’assurer qu’ils sont suffisamment matures pour nourrir le sang. Des taux d’alimentation optimaux sont observés après 7jours 33.
- Placer les moustiques femelles dans le récipient et couvrir de maille. Si le contenant est densément peuplé de moustiques, augmentez le nombre de Glytubes utilisés. L’alimentation optimale est réalisée avec ~25 moustiques/Glytube. Cela réduit la concurrence pour l’accès à la membrane d’alimentation.
- Mettez de côté un groupe témoin de moustiques nonfed qui ne se verront pas offrir un repas. Dans le protocole de mesure du poids, peser le groupe non nourri séparément et utiliser ce poids pour estimer le gain de poids dans le groupe expérimental qui s’est nourri d’un repas. Dans le protocole de quantification à base de fluorescence, ajouter le groupe non fed de moustiques aux puits pour les calculs de courbe standard et pour les contrôles négatifs. Pour correspondre à l’autofluorescence des tissus moustique de base dans le groupe expérimental, assurez-vous que la courbe standard et les puits de contrôle négatifs contiennent un moustique non fisé.
- Construction et mise en place du Glytube (adapté de Costa-da-Silva et coll. (2013)20)
- Tel que représenté dans la figure 1,pour générer une source de chaleur, remplissez un tube conique de 50 mL avec 40 mL de 100 % de glycérol. Sceller le tube conique ouvert avec un parafilm de 5 cm × 5 cm et répéter avec un morceau supplémentaire de 5 cm × parafilm de 5 cm pour minimiser les risques de fuite. En option, le parafilm peut être maintenu en place à l’aide d’élastiques. Inverser le tube pour s’assurer qu’il n’y a pas de trous ou de lacunes.
- Pour créer le dispositif de livraison de repas, coupez un trou centré de 2,5 cm de diamètre dans le bouchon de vis du tube conique à l’aide d’une lame de rasoir tranchante ou, pour une meilleure consistance, d’un garçon. Étirez un morceau de × de 5 cm de parafilm uniformément de sorte qu’il double approximativement dans la taille. Le parafilm doit être assez mince pour que les moustiques puissent facilement percer à travers elle, mais il ne devrait pas y avoir de fuites. Sceller sur la surface extérieure du bouchon de vis pour couvrir complètement le trou et mettre le bouchon de côté.
NOTE: Pour augmenter l’attraction pour le Glytube, avant d’étirer le parafilm, parfumez-le avec l’odeur humaine en le frottant doucement sur un patch de peau humaine sans cosmétiques appliqués, en prenant soin qu’aucun trou ne soit créé. Ceci est recommandé si l’expérience n’a pas pour but d’étudier les indices sensoriels nécessaires pour que les moustiques s’approchent du repas. - Chauffer à la fois le tube scellé de glycérol et le repas (avec tous les composants sauf l’ATP) dans un bain d’eau de 42-45 °C pendant au moins 15 min. Ne pas préchauffer l’ATP; l’ajouter immédiatement avant de commencer l’expérience.
- Ajouter l’ATP au repas réchauffé et au vortex à fond. Pipette 2 mL du repas réchauffé dans la chambre intérieure du bouchon à vis et y placer délicatement le tube conique de 50 mL inversé, réchauffé et rempli de glycérol. Vissez partiellement le bouchon avec le repas sur le tube rempli de glycérol, juste assez pour éviter les fuites du repas ou du glycérol.
REMARQUE : Le volume de repas utilisé peut varier entre 1 mL et 2,5 mL. Des volumes plus faibles peuvent être particulièrement utiles lorsque les repas sont utilisés pour fournir des composés rares ou coûteux. Il est important de travailler rapidement à cette étape afin que le repas ne refroidisse pas à la température ambiante et ne réduise pas la probabilité d’une alimentation maximale. Le taux de refroidissement dépendra de la température ambiante de la pièce où ces étapes sont effectuées, mais elles devraient généralement être terminées dans les 5 minutes à 25 °C. - Placez le Glytube assemblé sur le contenant de moustiques et laissez aux moustiques l’accès à l’alimentation pendant au moins 15 minutes pour atteindre des taux d’alimentation maximaux.
- Pour une alimentation optimale, placez les contenants de moustiques à l’intérieur d’une chambreéquipée d’une garniture de CO 2 et prévoyez au moins 15 minutes d’acclimation à 25-28 °C et 70 à 80 % d’humidité avant de livrer le repas. La chambre d’analyse utilisée ici est une modification simple et peu coûteux d’une configuration précédemment publiée16. Il utilise une boîte de rangement translucide en polypropylène de taille 36 cm L × 31 cm W × 32 cm H avec couvercle amovible. Un trou de 1,5 cm de diamètre fait dans le mur de chambre permet la livraison de CO2 par tube de silicone. La garniture de diffusion de CO2 est fixée au centre intérieur du couvercle pour la livraison de l’air purifié et du CO2 pour conditionner l’atmosphère de chambre pendant l’essai.
REMARQUE : Assurez-vous que les signaux d’hôte (chaleur et CO2, avec odeur d’hôtefacultative 16)sont présents afin que les moustiques soient attirés par la mangeoire membranaire. Si les moustiques ne s’entant pas sous le Glytube, vérifiez que le CO2 est correctement livré et que le repas et Glytube sont suffisamment chauds. Si une source externe de CO2 n’est pas disponible, le CO2 peut être livré par bouffées de souffle humain expiré. - Après l’alimentation, le bouchon Glytube peut être jeté sous forme de déchets biorisques ou réutilisé après avoir trempé dans une solution d’eau de Javel à faible pourcentage et soigneusement rincer dans l’eau.
3. Quantification des repas consommés
- Pesage des moustiques à utiliser pour d’autres expériences
REMARQUE : Peser les moustiques pour quantifier la taille des repas leur permet d’être utilisés pour d’autres expériences vivantes, mais cette méthode nécessite de prendre des mesures de poids à partir d’un groupe de 5 moustiques. Étant donné que le poids des moustiques individuels est difficile à mesurer avec précision en utilisant la plupart des équilibres de laboratoire, la variabilité de la taille des repas individuels ne peut pas être facilement quantifiée en mesurant les poids. Le pesage n’est recommandé que pour les situations où les femelles s’engorgent visiblement sur le repas.- Anesthésier froidement les moustiques en déplaçant leur contenant dans une pièce froide de 4 °C ou en le plaçant sur de la glace.
- Peser les groupes de 5 femelles de la cohorte non nourrie (c.-à-d. les moustiques qui n’ont jamais été offerts un repas) et calculer leur poids moyen comme estimation du poids « pré-alimentation ». Le poids moyen d’un moustique non fisé dépend du génotype, du sexe et des conditions d’élevage. Les moustiques Ae. aegypti femelles nonfed élevés avec l’accès ad libitum au saccharose pèsent généralement approximativement 2 mg chacun.
- De la cohorte expérimentale (c.-à-d. les moustiques qui se sont vu offrir un repas), trier les femelles en piles « nourries » et « non nourries » en fonction de la distension abdominale observable parl’œil 7. Divisez chacun des piles « nourries » et « non nourries », respectivement, en groupes de 5 moustiques pour le pesage. Les moustiques de chaque groupe de 5 devraient être dérivés de la même cohorte expérimentale pour prendre des mesures de poids de groupe. Calculez le poids moyen par femelle à partir de chacun des piles « nourries » et « non nourries » du groupe expérimental.
- Mesure de la fluorescence pour l’analyse du point final7,27,34
REMARQUE : Pour obtenir des mesures précises de la taille des repas à partir de moustiques individuels qui ne sont plus nécessaires pour poursuivre l’expérimentation en direct, entreposez les moustiques et les 1 mL restants de repas contenant 0,002 % de fluorescéine à -20 °C immédiatement après l’alimentation. L’expérience peut être interrompue ici. Cette méthode est décrite dans Figure 2.- Pour générer une courbe standard de référence, préparez une dilution en série du même repas contenant 0,002 % de fluorescéine qui a été offerte au groupe expérimental de moustiques. Il y aura un total de 8 solutions de courbe standard. Dans chacune de ces solutions, le volume final de repas contenant 0,002 % de fluorescéine sera de 5, 2,5, 1,25, 0,625, 0,3125, 0,15625, 0,078125, ou 0 μL, et chacun sera en saline 1x tamponné phosphate (PBS) pour un volume total de 100 μL (p. ex., 5 μL de farine contenant 0,002 % de fluoréscéine en 95 μL de 1 x PBS).
- Pour faire la première solution de la courbe standard, ajouter 50 μL de farine contenant 0,002% de fluorescéine à 950 μL de 1x PBS et vortex à fond (volume final: 5 μL de repas contenant 0,002% de fluorescéine en 95 μL de 1x PBS). Pour faire le reste des solutions de courbe standard, effectuez une dilution 2 fois pour chaque étape en prenant 500 μL du tube précédent et en l’ajoutant à un nouveau tube contenant 500 μL de 1x PBS. Vortex bien avant de préparer la prochaine dilution 2 fois.
- Pour préparer les puits à utiliser pour générer une courbe standard de référence, pipette 100 μL de chacune des solutions de courbe standard dans chacun des 8 puits de la première colonne d’une plaque PCR de 96 puits. Ajouter 1 moustique de contrôle nonfed à chacun des 8 mêmes puits dans la première colonne de la plaque. Répétez l’répétition dans la deuxième colonne de la plaque pour une mesure de répétition.
REMARQUE : Si des groupes expérimentaux se voient offrir différents types de repas, une courbe standard de référence distincte doit être préparée pour chaque type de repas. - Ajouter 100 μL de 1x PBS dans chaque puits restant pour le contrôle nonfed et les groupes expérimentaux. Si les tissus doivent être perturbés dans les étapes subséquentes à l’aide d’un homogénéisateur ou d’un vortex de moulin à perles, ajouter une perle en verre massif borosilicate de 3 mm à chaque puits.
- Comme un contrôle négatif, ajouter 1 moustique nonfed à chaque puits dans les 2 colonnes suivantes de la plaque. La fluorescence mesurée dans ce groupe établit une limite de base pour tenir compte de l’autofluorescence tissulaire et sera utilisée pour déterminer si un moustique du groupe expérimental s’est nourri du repas.
- Ajouter 1 moustique par puits aux puits restants des groupes expérimentaux qui se sont vu offrir un repas.
- Sceller soigneusement la plaque et perturber le tissu par broyage manuel. L’abdomen doit être complètement homogénéisé pour libérer le repas. Les méthodes pour perturber les tissus comprennent l’utilisation d’un homogénéiseur moulin à perles avec des perles de verre solide borosilicate de 3 mm (30 Hz pendant 30 secondes), mélangeur vortex avec perles de verre solide borosilicate de 3 mm, ou un broyeur de pilons sans perles.
- Centrifugeuse de la plaque à 2000 rpm pendant 1-2 min pour recueillir le lysate.
- Préparer une assiette noire de 96 puits avec 180 μL de 1 x PBS dans chaque puits.
- Transférer 20 μL de lysate à chaque puits avec 180 μL de 1x PBS et mélanger. Si disponible, utilisez une pipette multicanal à cette étape pour une vitesse accrue et une meilleure consistance.
- Mesurer l’intensité de fluorescence de chaque puits à l’aide d’un lecteur de plaques sur le canal d’excitation/émission 485/520. Générer la courbe standard de référence en traçant le volume connu de repas par rapport à la mesure correspondante de l’intensité de fluorescence.
- À l’aide de la courbe standard de référence générée, extrapoler le volume de repas ingéré par chacun des moustiques du groupe expérimental. Soustrayez la lecture moyenne de l’intensité de fluorescence du groupe témoin négatif des moustiques nonfed de la lecture d’intensité de fluorescence de chaque individu expérimental de groupe pour corriger pour l’autofluorescence de tissu de ligne de base.
Résultats
La figure 1 présente un schéma d’assemblage du Glytube, tandis que la figure 2 montre une vue d’ensemble de la conception expérimentale pour mesurer la taille des repas à l’aide de l’analyse à base de fluorescence décrite ici. La figure 3 fournit des mesures représentatives de la taille des farines de fluorescéine à partir d’une expérience d’alimentation sanguine. La figure 4, la figure 5 etla figure 6 illustrent un échantillon de questions biologiques qui peuvent être abordées à l’aide de ce protocole. Les applications du protocole sont de grande envergure et comprennent la modification de la composition des farines sanguines, l’alimentation des composés pharmacologiques, la quantification précise de repas sanguins sous-optimaux ou de petits repas nectariques, et la comparaison du comportement alimentaire entre les génotypes de moustiques.
Pour générer une courbe standard pour les calculs du volume des repas, des lectures de fluorescence sont tracées à partir des puits de référence désignés contenant chacun un moustique nonfed et un volume connu du repas avec 0,002 % de fluorescéine (figure 3A). Les relevés de fluorescence des puits restants, qui contiennent des moustiques du groupe témoin négatif des moustiques nonfed ou du groupe expérimental de moustiques offerts un repas, sont comparés à cette courbe standard pour quantifier le volume de repas (μL) consommé par chaque moustique (figure 3B). Pour valider les relevés de base de cet essai, il convient de confirmer que les moustiques du groupe témoin négatif nonfed ne se voient pas attribuer une valeur positive de μL consommée (figure 3B, gauche). Bien que toutes les femelles du groupe expérimental se soient vu offrir le repas sanguin, certains moustiques se sont nourris (figure 3B, milieu)et d’autres pas (figure 3B, à droite). Ce résultat démontre que deux types de données peuvent être obtenus à partir de ce protocole : 1) le pourcentage de femelles totales qui se nourrissent d’un repas donné, et 2) le volume ingéré par les femelles qui se nourrissent d’un repas donné.
Ce protocole peut être utilisé pour livrer et quantifier les repas avec diverses compositions protéiques. La figure 4A,B montre les données recueillies à l’aide de repas contenant de la fluorescéine ajoutée. La proportion de moustiques qui se nourrissaient et le volume de repas qu’ils ont ingéré, respectivement, ont été calculés à partir des lectures de fluorescence. Ces lectures sont très sensibles et permettent une quantification précise du μL, mais ont la limitation que les moustiques ne peuvent pas être utilisés pour de futures expériences vivantes. La figure 4C,D montre les données recueillies à partir d’une expérience indépendante avec des moustiques qui ont été marqués comme nourris ou non nourris par les yeux après qu’on leur a offert des repas sans fluorescéine. La taille des repas a été calculée comme poids moyen/femelle à partir de groupes de 5 moustiques. Bien que ces mesures de poids soient moins sensibles que les mesures de fluorescence, elles permettent aux femelles d’être récupérées et utilisées pour d’autres expériences vivantes. La proportion de moustiques qui se nourrissent peut varier d’un jour à l’autre, comme en témoignent la figure 4A et la figure 4C.
La figure 5 montre le volume consommé de repas contenant des médicaments qui régulent le comportement de recherche d’hôtes de moustiques. Dans ces expériences, les femelles ont été offertes sang, solution saline + ATP, ou saline + REPAS ATP avec 100 μM de l’agoniste récepteur humain NPY Y2, TM30338. Ce médicament modifie le comportement de recherche de l’hôte par l’activation d’Ae. aegypti NPY-like récepteur 7. La mesure de la taille des repas est essentielle à l’interprétation d’expériences pour évaluer l’effet de ce médicament sur le comportement post-alimentation sanguine, car il permet au chercheur de calculer la dose consommée par chaque femelle.
Dans les exemples précédents, les femelles étaient nourries soit de sang, soit de substituts sanguins, ce qui a donné lieu à des repas de 3 à 5 μL(figure 3, figure 4, figure 5). Cet essai à base de fluorescence peut également être utilisé pour mesurer des tailles de repas plus petites et/ou plus variables qui ne peuvent pas être discernées avec précision à partir des mesures moyennes du poids du groupe. À la figure 6, le même protocole de quantification par fluorescence a été utilisé pour mesurer le comportement d’alimentation du nectar en échangeant le Glytube contre une boule de coton saturée de saccharose à 10 % contenant de la fluorescéine à 0,002 %. Les sucres nectarifiques ne peuvent pas être présentés dans l’analyse de Glytube parce que les femelles ne peuvent pas détecter la présence de sucres nectarifiques avec le stylet et ne commencent pas à senourrir 27. Ces données permettent au chercheur de déterminer que les repas sucrés sont constamment plus petits que les repas sanguins, en accord avecles travaux antérieurs 34 (figure 6).
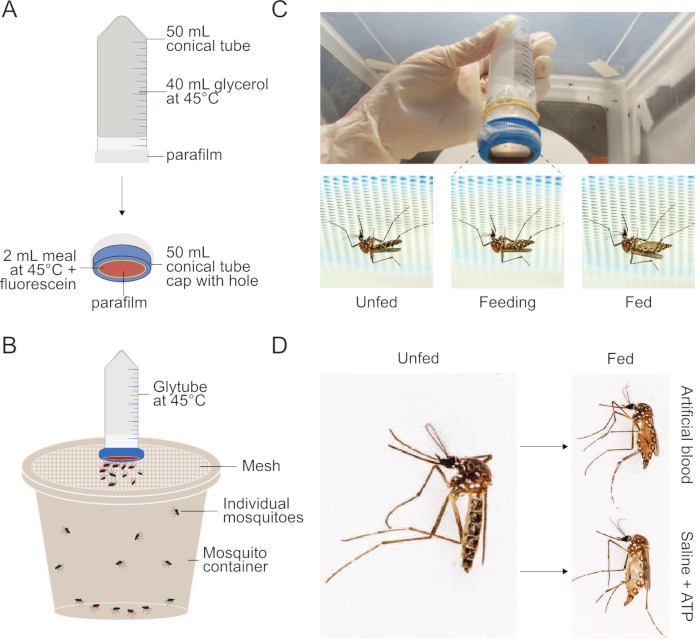
Figure 1 : Mise en place de la méthode Glytube utilisée pour nourrir les moustiques. (A) Schéma d’un Glytube déconstruit utilisé pour nourrir le sang et d’autres repas aux moustiques. (B) Schéma d’un Glytube présenté au sommet d’un récipient de moustiques avec un couvercle en maille. Les moustiques femelles peuvent percer à travers le couvercle en maille pour se nourrir. (C) Photographies du Glytube (en haut) et des moustiques femelles Aedes aegypti avant, pendant et après l’alimentation (en bas, de gauche à droite) sur un repas livré par Glytube. Les moustiques sont montrés perçant à travers le maillage couvrant leur récipient pour accéder à la mangeoire membranaire. (D) Photographies montrant l’apparition de moustiques femelles Ae. aegypti qui ne sont pas fed (à gauche) et qui ont engorgé soit sur un repas de sang artificiel (à droite, en haut) ou un saline + repas ATP (droite, bas). La méthode Glytube a déjà été publiée dans Costa-da-Silva et coll. (2013)20. Les photographies dans (C) et (D) sont gracieuseté d’Alex Wild. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
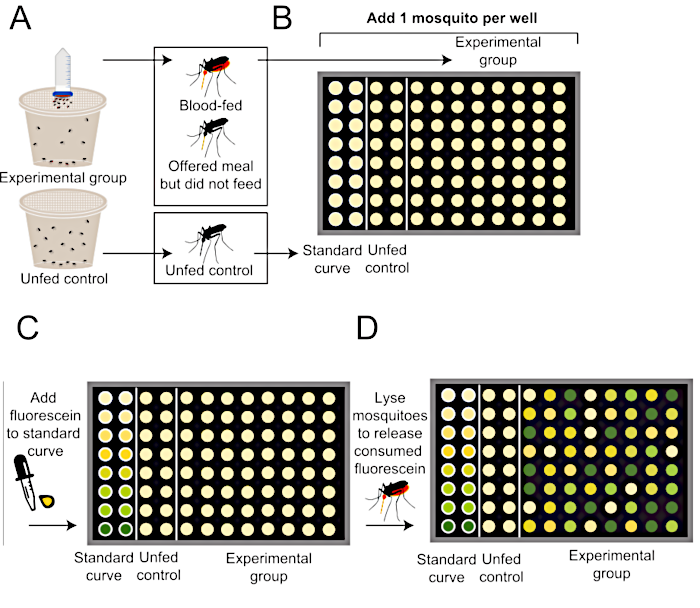
Figure 2 : Schéma de la façon de quantifier la taille des repas après le protocole d’alimentation sanguine de Glytube. (A) Les moustiques se voient offrir un repas avec de la fluorescéine (en haut, groupe expérimental) ou pas de repas (en bas, groupe témoin négatif nonfed). (B) Les moustiques individuels sont ajoutés à une plaque de 96 puits après la fin de l’expérience d’alimentation. (C) La courbe standard est générée à l’aide de quantités connues de farine contenant 0,002 % de fluorescéine. (D) Les moustiques sont homogénéisés pour libérer toute fluorescéine consommée, et les niveaux de fluorescence dans chaque puits sont quantifiés à l’aide d’un lecteur de plaques. Cette méthode de quantification par fluorescence est modifiée à partir de Liesch et coll. (2013)34. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 3 : Expérience d’alimentation sanguine de Glytube avec quantification à base de fluorescéine. (A) Mesures standard de la courbe obtenues à partir des puits où un moustique du groupe témoin nonfed a été ajouté à une quantité connue de repas contenant 0,002% de fluorescéine (échelle y-axe = unités arbitraires). (B) Volume des repas calculé à l’aide de lectures de fluorescence pour les femelles du groupe témoin non nourri (gauche, noir, n = 40), le groupe expérimental qui s’est nourri de sang (moyen, rouge, n = 37), et le groupe expérimental qui ne se nourrissait pas de sang (droite, rouge, n = 23). Chaque point représente une mesure d’une femelle individuelle. Les données sont indiquées comme médianes avec portée. Les lettres indiquent des groupes statistiquement distincts, test kruskal-wallis avec la comparaison multiple de Dunn, p<0.01. Ces données ont été publiées dans Jové et coll. (2020)27. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
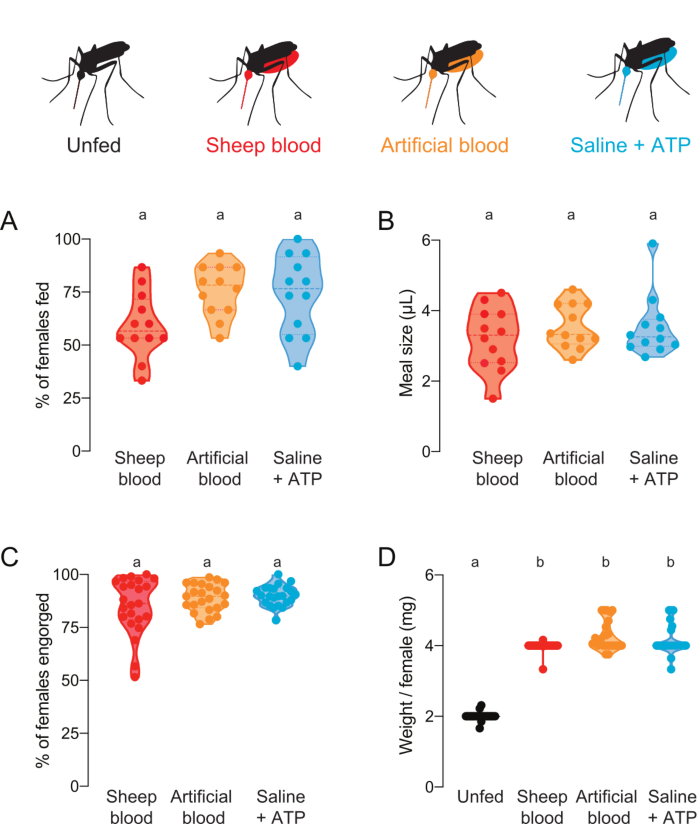
Figure 4 : Quantification des repas dont la composition protéique diffère. Les femelles se sont vu offrir des repas de sang de mouton (rouge), de sang artificiel avec des protéines sanguines humaines (Kogan (1990)22) (orange), ou de farine saline sans protéines + ATP (aqua)7. (A) Pourcentage de femelles nourries à l’aide de lectures de fluorescence. Chaque point représente un groupe de 12 à 16 femelles. Les données sont indiquées sous forme de médianes avec des plages, n = 12. (B) Volume des repas calculé à l’aide de lectures de fluorescence. Chaque point représente une mesure d’une femme individuelle dans un seul essai de la figure 4A. Les données sont indiquées sous forme de médianes avec des plages, n = 12. (C) Pourcentage de femelles entièrement engorgées après l’alimentation artificielle de membrane, marqué par l’oeil. Chaque point représente le pourcentage de femmes engorgées de groupes de 20 à 30 femelles. Les données sont indiquées sous forme de médianes avec des plages, n = 23. ( D )Taillesdes repas marqués comme poids / femme après l’état d’alimentation a été marqué par l’œil. Les poids ont été calculés comme la moyenne des groupes de 5 moustiques. Les données sont indiquées sous forme de médianes avec des plages, n = 23. A–D: Les lettres indiquent des groupes statistiquement distincts, test kruskal-wallis avec la comparaison multiple de Dunn, p<0.05. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 5 : Quantification des repas avec des composés pharmacologiques. Les femelles consomment des repas de la même taille de sang de mouton (rouge), salin + ATP (aqua), et salin + ATP + 100 μM dose de npy humain récepteur Y2 agoniste TM30338 (bleu foncé). Volume des repas calculé à l’aide de lectures de fluorescence. Chaque point représente une mesure d’une femelle individuelle. Les données sont indiquées sous forme de médianes avec des plages, n = 12. Les lettres indiquent des groupes statistiquement distincts, test kruskal-wallis avec la comparaison multiple de Dunn, p<0.05. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.

Figure 6 : Quantification des petits repas nectarifs. (A) Schéma d’analyse d’alimentation au nectar. (B) Volume des repas calculé à l’aide de lectures de fluorescence pour les femelles de type sauvage offert des repas de l’eau (bleu, n = 36) ou 10% saccharose (vert, n = 53), chacun avec 0,002% de fluorescéine, dans l’analyse nectar-alimentation. Chaque point représente une mesure d’une femelle individuelle. Les données sont indiquées sous forme de médianes avec des plages. Les lettres indiquent des groupes statistiquement distincts, essai de Mann-Whitney, p<0.05. Ces données ont été publiées dans Jové et coll. (2020)27. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
| Farine de sang artificiel | |||
| Concentration de solution de stock (mg/mL) | Volume de solution stock dans le repas (μL/mL) | Concentration finale des repas (mg/mL) | |
| Composants protéiques* | |||
| γ-Globulins | 50 | 300 | 15 |
| Hémoglobine | 35 | 230 | 8 |
| Albumine | 300 | 340 | 102 |
| Protéines totales | - | - | 125 |
| Composants non protéiques | |||
| Concentration de stock solution (mM) | Volume de solution stock dans le repas (μL/mL) | Concentration finale des repas (mM) | |
| Nacl | En stock γ-globulin | - | 5-10 |
| NaHCO3 | En stock γ-globulin | - | 120 |
| Atp | 200 | 5 | 1 |
| Eau | - | 125 | - |
| *Les composants protéiques sont préparés en solution de stock d’eau double distillée, à l’exception des γ-Globulines, qui sont dissoutes en NaHCO3 de 400 mM et comprennent une quantité variable de NaCl (2-4 %) dans le produit. | |||
Tableau 1 : Recette de préparation de repas de sang artificiel (adapté de Kogan (1990)22). Le sang artificiel se compose de protéines et de composants non protéiques que l’on trouve régulièrement dans le sang humain et offre la possibilité de varier les ratios de ces composants. Les moustiques peuvent produire des œufs après s’êtrenourris de sang artificiel 7,22.
| Repas salin | |||
| Composant | Concentration de stock solution (mM) | Volume de solution stock dans le repas (μL/mL) | Concentration finale des repas (mM) |
| Nacl | - | - | - |
| NaHCO3 | 400 | 300 | 120 |
| Atp | 200 | 5 | 1 |
| Eau | - | 695 | - |
Tableau 2 : Recette de repas salin avec ATP (adapté de Duvall et coll. (2019)7). Les repas salins sans protéines peuvent être utilisés pour fournir des composés d’intérêt aux moustiques tout en imitant la distension abdominale qui se produit après l’alimentation sanguine, mais sans déclencher le développement des œufs qui se produit lorsque les protéines sont ingérées.
Discussion
Pour de nombreuses applications de laboratoire, les mangeoires à membrane artificielle offrent des avantages distincts par rapport aux hôtes vivants en permettant aux chercheurs de manipuler directement le contenu du repas. Bien que de multiples méthodes soient disponibles pour l’alimentation artificielle des membranes, la méthode décrite ici offre des avantages en termes de flexibilité, de coût et de débit. Par rapport à d’autres mangeoires à membrane commerciale, l’analyse Glytube nécessite un petit volume de repas, ce qui en fait un mécanisme efficace de livraison pour les réacgages coûteux, y compris les médicaments ou les agents pathogènes, en minimisant le volume totalrequis 7,35. Comme les repas salins et artificiels sans protéines favorisent l’engorgement, des composés ou des agents pathogènes peuvent être ajoutés à l’un ou l’autre repas comme alternative à haut débit et non invasive aux injections. En outre, chaque composant du Glytube peut facilement être lavé, remplacé ou mis à l’échelle pour livrer et quantifier plusieurs types de repas sans contamination croisée de l’appareil d’alimentation.
Pour quantifier les volumes de repas consommés par les moustiques, la méthode à base de fluorescence permet une quantification plus précise de la taille des repas que le pesage des moustiques avant et après l’alimentation. Il convient de noter que cette méthode est un test de fin de point. En revanche, la pesée permet de garder les moustiques en vie pour d’autres expérimentations. En utilisant un lecteur d’assiettes, la méthode à base de fluorescence peut être facilement mise à l’échelle pour la quantification à haut débit des repas consommés par des centaines de femelles individuelles.
Pour atteindre des taux d’alimentation élevés, une combinaison de signaux d’hôte suffisants doit être présente pour activer le comportement féminin à la recherche d’un hôte et attirer les femelles à la mangeoire. Si les moustiques ne s’entant pas sous le Glytube, le repas peut ne pas être bien réchauffé, ou la livraison de CO2 peut ne pas être suffisante. L’ajout d’odeur humaine à la surface de la membrane augmente de façon fiable l’attrait de la membrane artificielle. Si des moustiques sont observés sous le Glytube mais ne se nourrissent pas, la composition des repas peut être en faute. Les femelles peuvent ne pas se nourrir si le repas lui-même n’est pas chaud, le sang est trop vieux, ou si les additifs au repas sont intrinsèquement aversifs ou provoquent une réaction chimiqueindésirable 36. L’ATP supplémentaire augmente également de manière fiable les taux d’alimentation et peut être augmenté jusqu’à une concentration finale de 2 mM dans chacune des recettes fournies. Les femelles peuvent ne pas se nourrir si le parafilm n’est pas tendu à travers le bouchon Glytube; le parafilm doit être uniformément transparent et ne doit pas boucler, car cela empêche la femelle d’être en mesure de percer efficacement le parafilm avec son stylet. Si le repas fuit à travers le Glytube sur le maillage, le parafilm peut avoir déchiré pendant le processus d’étirement et doit être remplacé.
Changer la composition des repas peut également permettre aux chercheurs de manipuler la durée nécessaire pour effacer le repas à partir du mi-temps ainsi que le comportement ultérieur de recherche de l’hôte. Les repas présentés ici nécessitent 24-36 h pour la digestion7 semblable au sang d’origine animale. Après s’être nourries de l’un de ces repas, les femelles supprimeront la recherche d’hôtes pendant la fenêtre de temps de digestion. Comme le repas salin manque de protéines, les femelles retournent à la recherche d’un hôte après le repas. Si un retour plus rapide est souhaitable, les chercheurs peuvent choisir d’autres repas salins de « compensation rapide » qui sont excrétés en environ 6 h27. Alors que la composition du repas salin présenté ici est appariée pour comparer directement les résultats avec le repas de sang artificiel, le repas de « compensation rapide » correspond plus étroitement aux niveaux physiologiques de sel trouvés dans le sang vertébré.
Les méthodes décrites ici ont des limites qui devraient être prises en considération avant de choisir l’analyse qui convient le mieux aux objectifs expérimentaux du chercheur. Les mesures de fluorescéine décrites ne permettent pas aux moustiques d’être utilisés à nouveau pour des expérimentations supplémentaires. Cependant, des mesures de poids peuvent être prises avant la quantification de taille de repas utilisant l’essai de fluorescéine. Si le poids et la taille des repas sont cohérents dans plusieurs essais pour un repas donné, le poids peut être utilisé comme un proxy dans de futures expériences. En outre, ce protocole ne fait pas de distinction entre les déficits dans la recherche de l’hôte par rapport au comportement d’alimentation sanguine; les moustiques qui présentent des déficiences dans la recherche de la mangeoire membranaire auront une réduction des taux d’alimentation et /ou de la taille des repas. En ajoutant une caméra pour enregistrer le comportement tout au long de l’analyse, les chercheurs peuvent déterminer si les femelles ne peuvent pas trouver le Glytube, ou si elles trouvent le Glytube, mais ne se nourrissent pas.
L’analyse décrite ici peut être adaptée pour explorer de nombreuses questions en suspens liées au comportement alimentaire chez les moustiques. Par exemple, la contribution de protéines sanguines spécifiques peut être explorée en modifiant le rapport entre les protéines constituantes ou la concentration totale de protéines dans le farine de sang artificiel. Pour évaluer la taille des repas à partir de multiples événements d’alimentation, des colorants avec des spectres de fluorescence distincts peuvent être ajoutés pour différencier les repas des sourcesuniques 37. Ce protocole peut également être modifié pour stimuler séparément les parties buccales internes qui détectent le sang et qui sont utilisées pour l’ingestion (c.-à-d., stylet), et les appendices chimiosensoriels qui contactent la peau (c.-à-d. labium, jambes) pendant que le moustique atterrit pour commencerl’alimentation de sang 36. Par exemple, si des ligands sont ajoutés directement au repas, ils ne contactent pas le labium et les jambes, puisque la membrane n’est percée que par le stylet. Si des ligands sont ajoutés à la surface extérieure du parafilm à la place, ils restent séparés du repas et peuvent être contactés par le labium et les jambes36. Enfin, la cinétique détaillée du comportement d’alimentation du sang ne sont pas bien comprises et la méthode présentée ici pourrait être modifiée pour combiner le suivi à haute résolution avec des outils d’apprentissage automatique pour extraire les lectures comportementales de la locomotion, de la posture et de la dynamique del’alimentation 38.
Ce protocole vise à être convivial et rentable, avec la capacité de servir les chercheurs utilisant des manipulations pharmacologiques et génétiques pour étudier l’alimentation sanguine des moustiques et le comportement post-alimentation du sang.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions Nipun Basrur, Adriana K. Rosas Villegas, Nadav Shai et Trevor Sorrells pour leurs commentaires sur les manuscrits, ainsi que Zhongyan Gong et Kyrollos Barsoum pour leur assistance technique. Nous remercions Alex Wild pour les photographies utilisées dans la figure 1. K.V. a été soutenu par la bourse Boehringer Ingelheim Fonds PhD. V.J. a été soutenu en partie par nih T32-MH095246. Ce travail a été soutenu en partie par une subvention accordée à l’Université Rockefeller par le Howard Hughes Medical Institute par l’intermédiaire du programme de bourses James H. Gilliam pour l’étude avancée à V.J. Ce matériel est basé sur des travaux appuyés par le Programme de bourses d’études supérieures de la Fondation nationale des sciences dans le cadre de la subvention no. NSF DGE-1325261 à V.J. Les opinions, conclusions, conclusions ou recommandations exprimées dans ce matériel sont celles de l’auteur et ne reflètent pas nécessairement les vues de la National Science Foundation.
matériels
| Name | Company | Catalog Number | Comments |
| 15 mL conical tubes | Fisher Scientific | 14-959-70C | |
| 3 mm diameter borosilicate solid-glass bead | MilliporeSigma | Z143928 | For use for bead mill homogenizer; not required if using pellet pestle grinder |
| 32 oz. high-density polyethylene (HDPE) plastic cup | VWR | 89009-668 | Example mosquito container used for feeding assays shown; alternate options can be used |
| 50 mL conical tubes | Fisher Scientific | 14-959-49A | |
| 96-well black polystyrene plate | ThermoFisher | 12-566-09 | |
| 96-well PCR plate sealing film | Bio-Rad | MSB1001 | Alternate options can be used |
| 96-well PCR plates | Bio-Rad | HSP9621 | Alternate options can be used |
| Adenosine 5′-triphosphate (ATP) disodium salt hydrate | MilliporeSigma | A6419 | |
| Albumin (human serum) | MilliporeSigma | A9511 | |
| Aluminum foil | Fisher Scientific | 01-213 | Alternate options can be used to block light entering fluorescein container |
| Balance | Fisher Scientific | 01-911 | Alternate options can be used |
| Bead mill homogenizer | Qiagen | 85300 | Not required if using pellet pestle grinder |
| Cotton ball | Fisher Scientific | 22456880 | For nectar-feeding; alternate options can be used |
| Defibrinated sheep blood | Hemostat Laboratories | DSB100 | Alternate options can be used |
| Drosophila CO2 fly pad | Tritech Research | MINJ-DROS-FP | Alternate options can be used |
| Fluorescein | MilliporeSigma | F6377 | |
| Fluorescence plate-reader | ThermoFisher | VL0000D0 | Alternate options can be used |
| Gamma-globulin (human blood) | MilliporeSigma | H7379 | |
| Glycerol | MilliporeSigma | G7893 | |
| Hemoglobin (human) | MilliporeSigma | G4386 | |
| Laboratory wrapping film - parafilm | Fisher Scientific | 13-374 | |
| Magnetic stirrer | Fisher Scientific | 90-691 | Alternate magnetic stirrers can be used |
| Microcentrifuge for 96-well plate | VWR | 80094-180 | Alternate options can be used |
| Microcentrifuge Tubes | MilliporeSigma | 2236412 | Alternate options can be used |
| Pellet pestle grinder | VWR | KT749521-1500 | Not required if using bead mill homogenizer |
| Phosphate buffered solution (PBS) | Fisher Scientific | BW17-516F | Optional |
| Razor blades | Fisher Scientific | 12-640 | Alternate options can be used, such as a lathe for better consistency of cutting |
| Rubber bands | |||
| Silicone tubing | McMaster Carr | Needed if using a fly pad for CO2 delivery | |
| Sodium bicarbonate (NaHCO3) | Fisher Scientific | S233 | |
| Sodium chloride (NaCl) | MilliporeSigma | S9888 | |
| Stir bars | Fisher Scientific | 14-512 | Alternate magnetic stir bars can be used |
| Translucent polypropylene storage box with removable lid | Example box used for feeding assays shown | ||
| Vortex mixer | |||
| Water bath | Alternate heating device may be used | ||
| White 0.8 mm polyester mosquito netting | American Home & Habit Inc. | F03A-PONO-MOSQ-M008-WT | Alternate options can be used |
Références
- Bhatt, S., et al. The global distribution and burden of dengue. Nature. 496 (7446), 504-507 (2014).
- Rogers, D. J., Wilson, A. J., Hay, S. I., Graham, A. J. The global distribution of yellow fever and dengue. Advances in Parasitology. 62 (05), 181-220 (2006).
- Chouin-Carneiro, T., et al. Differential susceptibilities of Aedes aegypti and Aedes albopictus from the Americas to Zika virus. PLoS Neglected Tropical Diseases. 10 (3), (2016).
- Guerbois, M., et al. Outbreak of Zika virus infection, Chiapas State, Mexico, 2015, and first confirmed transmission by Aedes aegypti mosquitoes in the Amercias. Journal of Infectious Diseases. 214 (9), 1349-1356 (2016).
- Weaver, S. C., et al. Zika virus: history, emergence, biology, and prospects for control. Antiviral Research. 130, 69-80 (2016).
- Attardo, G. M., Hansen, I. A., Raikhel, A. S. Nutritional regulation of vitellogenesis in mosquitoes: implications for anautogeny. Insect Biochemistry and Molecular Biology. 35 (7), 661-675 (2005).
- Duvall, L. B., Ramos-Espiritu, L., Barsoum, K. E., Glickman, J. F., Vosshall, L. B. Small-molecule agonists of Ae. aegypti neuropeptide Y receptor block mosquito biting. Cell. 176 (4), 687-701 (2019).
- Dimond, J. B., Lea, A. O., Hahnert, W. F., DeLong, D. M. The amino acids required for egg production in Aedes aegypti. The Canadian Entomologist. 88 (2), 57-62 (1956).
- Guerrero, D., Cantaert, T., Missé, D. Aedes mosquito salivary components and their effect on the immune response to arboviruses. Frontiers in Cellular and Infection Microbiology. 10, 1-11 (2020).
- Raquin, V., Lambrechts, L. Dengue virus replicates and accumulates in Aedes aegypti salivary glands. Virology. 507, 75-81 (2017).
- Farjana, T., Tuno, N. Multiple blood feeding and host-seeking behavior in Aedes aegypti and Aedes albopictus (diptera: Culicidae). Journal of Medical Entomology. 50 (4), 838-846 (2013).
- Scott, T. W., Takken, W. Feeding strategies of anthropophilic mosquitoes result in increased risk of pathogen transmission. Trends in Parasitology. 28 (3), 114-121 (2012).
- Ross, P. A., Lau, M. J., Hoffmann, A. A. Does membrane feeding compromise the quality of Aedes aegypti mosquitoes. PLoS ONE. 14 (11), 1-19 (2019).
- Ross, P. A., Axford, J. K., Richardson, K. M., Endersby-Harshman, N. M., Hoffmann, A. A. Maintaining Aedes aegypti mosquitoes infected with wolbachia. Journal of Visualized Experiments. 2017 (126), 1-8 (2017).
- Briegel, H., Hefti, M., DiMarco, E. Lipid metabolism during sequential gonotrophic cycles in large and small female Aedes aegypti. Journal of Insect Physiology. 48 (5), 547-554 (2002).
- McMeniman, C. J., Corfas, R. A., Matthews, B. J., Ritchie, S. A. S., Vosshall, L. B. Multimodal integration of carbon dioxide and other sensory cues drives mosquito attraction to humans. Cell. 156 (5), 1060-1071 (2014).
- Pakes, S. P., et al. . Guide for the Care and Use of Laboratory Animals. , (2011).
- Deng, L., Koou, S. Y., Png, A. B., Ng, L. C., Lam-Phua, S. G. A novel mosquito feeding system for routine blood-feeding of Aedes aegypti and Aedes albopictus. Tropical Biomedicine. 29 (1), 169-174 (2012).
- Gunathilaka, N., Ranathunge, T., Udayanga, L., Abeyewickreme, W. Efficacy of blood sources and artificial blood feeding methods in rearing of Aedes aegypti (Diptera: Culicidae) for sterile insect technique and incompatible insect technique approaches in Sri Lanka. BioMed Research International. 2017, 3196924 (2017).
- Costa-da-Silva, A. L., et al. Glytube: a conical tube and parafilm M-based method as a simplified device to artificially blood-feed the Dengue vector mosquito, Aedes aegypti. PLoS ONE. 8 (1), 53816 (2013).
- Carvalho, D. O., et al. Mass production of genetically modified Aedes aegypti for field releases in Brazil. Journal of Visualized Experiments. 83 (83), 1-10 (2014).
- Kogan, P. H. H. Substitute blood meal for investigating and maintaining Aedes aegypti (Diptera: Culicidae). Journal of Medical Entomology. 27 (4), 1-4 (1990).
- Gonzales, K. K., Hansen, I. A. Artificial diets for mosquitoes. International Journal of Environmental Research and Public Health. 13 (12), (2016).
- Baughman, T., et al. A highly stable blood meal alternative for rearing Aedes and Anopheles mosquitoes. PLoS Neglected Tropical Diseases. 11 (12), 0006142 (2017).
- Galun, R. Feeding stimuli and artificial feeding. Bulletin of the World Health Organization. 36, 590-593 (1967).
- Galun, R. Feeding response in Aedes aegypti: stimulation by adenosine triphosphate. Science. 142, 1674-1675 (1963).
- Jové, V., et al. Sensory Discrimination of Blood and Floral Nectar by Aedes aegypti Mosquitoes. Neuron. 108, 1-18 (2020).
- Petersen, M. T., et al. The impact of the age of first blood meal and Zika virus infection on Aedes aegypti egg production and longevity. PLoS ONE. 13 (7), 1-15 (2018).
- Sissoko, F., et al. Frequent sugar feeding behavior by Aedes aegypti in Bamako, Mali makes them ideal candidates for control with Attractive Toxic Sugar Baits (ATSB). PLoS ONE. 14 (6), 0214170 (2019).
- Houseman, J. G., Downe, A. E. R. Methods of measuring blood meal size and proteinase activity for determining the effects of mated state of digestive processes of female Aedes aegypti (L.) (Diperta: Culicidae). The Canadian Entomologist. 18, 241-248 (1986).
- Redington, B. C., Hockmeyer, W. T. A method for estimating blood meal volume in Aedes aegypti using a radioisotope. Journal of Insect Physiology. 22 (7), 961-966 (1976).
- Gonzales, K. K., et al. The effect of SkitoSnack, an artificial blood meal replacement, on Aedes aegypti life history traits and gut microbiota. Scientific Reports. 8 (1), 1-14 (2018).
- Klowden, M. J. The endogenous regulation of mosquito reproductive behavior. Experientia. 46 (7), 660-670 (1990).
- Liesch, J., Bellani, L. L., Vosshall, L. B. Functional and genetic characterization of neuropeptide Y-like receptors in Aedes aegypti. PLoS Neglected Tropical Diseases. 7 (10), 22486 (2013).
- Frances, S. P., Sithiprasasna, R., Linthicum, K. J. Laboratory evaluation of the response of Aedes aegypti and Aedes albopictus uninfected and infected with Dengue virus to Deet. Journal of Medical Entomology. 48 (2), (2011).
- Dennis, E. J., Goldman, O. V., Vosshall, L. B. Aedes aegypti mosquitoes use their legs to sense DEET on contact. Current Biology. 29 (9), 1551-1556 (2019).
- Harrington, L. C., et al. Heterogeneous feeding patterns of the Dengue vector, Aedes aegypti, on individual human hosts in rural Thailand. PLoS Neglected Tropical Diseases. 8 (8), 3048 (2014).
- Hol, F. J., Lambrechts, L., Prakash, M. BiteOscope, an open platform to study mosquito biting behavior. eLife. 9, 1-24 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon