Method Article
Monitoreo De La ElastasA NeutrófiloS Y La Actividad De La Catepsina G En Muestras De Esputo Humano
* Estos autores han contribuido por igual
En este artículo
Resumen
Los protocolos aquí descritos proporcionan una guía para visualizar y cuantificar la actividad de las proteasas de neutrófilos en el esputo humano. Las aplicaciones de este tipo de análisis abarcan desde la evaluación de tratamientos antiinflamatorios hasta la validación de biomarcadores, el cribado de fármacos y los estudios clínicos de cohortes grandes.
Resumen
Las proteasas son reguladores de innumerables procesos fisiológicos y la investigación precisa de sus actividades sigue siendo un desafío biomédico intrigante. Entre las ~600 proteasas codificadas por el genoma humano, las proteasas de serina de neutrófilos (NSP) se investigan a fondo por su implicación en la aparición y progresión de afecciones inflamatorias, incluidas las enfermedades respiratorias. De manera única, los NSP secretados no solo difunden dentro de los fluidos extracelulares, sino que también se localizan en las membranas plasmáticas. Durante la formación de trampa extracelular de neutrófilos (NETs), los NSP se convierten en una parte integral de la cromatina secretada. Tal comportamiento complejo hace la comprensión de la fisiopatología NSPs una tarea desafiadora. Aquí, se muestran protocolos detallados para visualizar, cuantificar y discriminar las actividades libres y unidas a membrana de la elastasa de neutrófilos (NE) y la catepsina G (CG) en muestras de esputo. Ne y CG son NSP cuyas actividades tienen papeles pleiotrópicos en la patogénesis de la fibrosis quística (FQ) y la enfermedad pulmonar obstructiva crónica (EPOC): promueven la remodelación de los tejidos, regulan las respuestas inmunes aguas abajo y se correlacionan con la gravedad de la enfermedad pulmonar. Los protocolos muestran cómo separar el fluido y la fracción celular, así como el aislamiento de neutrófilos del esputo humano para la cuantificación de la actividad enzimática a través de reporteros basados en la transferencia de energía de resonancia Förster de molécula pequeña (FRET). Para recopilar información específica sobre el papel relativo de las actividades ne y cg, una lectura fret se puede medir por diferentes tecnologías: i) mediciones de lector de placas in vitro permiten un alto rendimiento y la detección a granel de la actividad de la proteasa; ii) la microscopia confocal espaciotemporal resuelve actividad membrana-limitada en la superficie celular; iii) la citometría de flujo FRET de molécula pequeña permite la evaluación rápida de tratamientos antiinflamatorios a través de la cuantificación y fenotipado de la actividad de la proteasa unicelular. La implementación de tales métodos abre las puertas para explorar la patobiología de los NSP y su potencial como biomarcadores de la gravedad de la enfermedad para la FQ y la EPOC. Dado su potencial de estandarización, su sólida lectura y la simplicidad de la transferencia, las técnicas descritas se pueden compartir inmediatamente para su implementación entre laboratorios de investigación y diagnóstico.
Introducción
La elastasa de neutrófilos (NE), la catepsina G (CG), la proteinasa 3 (PR3) y la proteasa de serina de neutrófilos 4 (NSP4) son las cuatro proteasas de serina de neutrófilos (NSP)1. Se almacenan, junto con mieloperoxidasa, dentro de gránulos neutrófilos primarios o azurófilos. Debido a su elevado contenido proteolítico, la secreción de gránulos primarios está estrechamente regulada y los neutrófilos tienen que ser desafiados secuencialmente con estímulos cebados y activadores2.
Dentro del fagolinosoma, los NSP funcionan como agentes bactericidas intracelulares3. Cuando se secretan, los NSP se convierten en fuertes mediadores de la inflamación: escinden citoquinas y receptores superficiales, activando vías proinflamatorias paralelas3. Es importante destacar que las condiciones inflamatorias presentan una secreción incontrolada de NSP. Por ejemplo, dentro de las vías respiratorias inflamadas, la actividad excesiva de NE causa hipersecreción de moco, metaplasia de células caliciformes, inactivación de CFTR y remodelación de la matriz extracelular4,5. La catepsina G también participa en la inflamación: escinde y activa específicamente dos componentes de la familia IL-1, IL-36α e IL-36β6. En concierto con NE, CG escinde los receptores activados por proteasa en el epitelio de las vías respiratorias y también activa TNF-α e IL-1β.
Las antiprotasas endógenas como la alfa-1-antitripsina, la alfa-1-antiquimotripsina y el inhibidor secretor de la proteasa leucocitaria regulan la actividad neutrophil elastasa y la catepsina G5. Sin embargo, en el transcurso de la progresión de la enfermedad pulmonar, la secreción continua de proteasas excede estequiométricamente el escudo antiprotease, lo que lleva a la neutrofilia no resolutiva en las vías respiratorias, empeoramiento de la inflamación y daño tisular5,7. Aunque la concentración de NE y la actividad en fracciones solubles de las vías respiratorias de los pacientes ha demostrado ser un biomarcador prometedor de la gravedad de la enfermedad8,NE y CG también se asocian a la membrana plasmática de neutrófilos y al ADN extracelular a través de interacciones electrostáticas9,10 donde se vuelven menos accesibles a las anti-proteasas. Es importante destacar que los estudios preclínicos definieron un escenario en el que la actividad de la proteasa asociada a la superficie celular aparece antes y/o independientemente de su contraparte soluble4,11. De hecho, para llegar a ser detectable, la actividad libre de la proteasa primero necesita abrumar el escudo de la anti-proteasa. En cambio, en la superficie celular, la actividad de la proteasa unida a la membrana permanece al menos parcialmente intacta debido a la inaccesibilidad de los inhibidores grandes de la membrana plasmática celular12. Tal comportamiento complejo de la proteasa tiene consecuencias importantes sobre inicio y la propagación neutrófilo-mediados de la inflamación, y por lo tanto necesita ser investigado con las herramientas exactas e informativas.
A lo largo de los años, las sondas basadas en la transferencia de energía de resonancia de Förster (FRET) encontraron numerosas aplicaciones biomédicas como herramientas que evalúan de manera eficiente y rápida una actividad proteasa específica en muestras humanas13. Para funcionar, los reporteros de proteasas se componen de un motivo de reconocimiento (es decir, un péptido), que es reconocido por la enzima diana y se basan en FRET, un proceso físico donde, tras la excitación, un fluoróforo donante transfiere energía a una molécula aceptora. El procesamiento operado por la enzima en el reportero, es decir, la escisión de la parte de reconocimiento, da lugar a que el aceptor se difunda lejos del donante: por lo tanto, la actividad enzimática se mide como un cambio dependiente del tiempo en el donante sobre la fluorescencia del aceptor. Dicha lectura es auto-normalizante y ratiométrica, por lo tanto, sólo marginalmente afectada por condiciones ambientales como el pH y la concentración local de la sonda. NEmo-114 y sSAM15 son sondas FRET que informan específicamente sobre la actividad NE y CG, respectivamente. Sin embargo, tales reporteros no localizan específicamente a ningún compartimiento celular, por lo tanto se emplean para supervisar la actividad de la proteasa presente en líquidos humanos. Con el fin de monitorear la actividad de la proteasa de una manera espacialmente localizada, nosotros y otros desarrollamos sondas FRET que se asocian a componentes subcelulares a través de etiquetas moleculares14,15,16,17,18,19. Tal estrategia sintética permitió el desarrollo de NEmo-2 y mSAM, dos sondas FRET equipadas con anclajes lipídicos que se localizan en la membrana plasmática. Estos reporteros impulsaron una comprensión más profunda de las proteasas NE y CG en la fibrosis quística y las enfermedades pulmonares obstructivas crónicas14,15.
Aquí, se proporcionan protocolos detallados para la visualización y cuantificación de actividades solubles y unidas a membranas NE y CG en esputo humano por medio de la serie NEmo y SAM de sondas FRET. Para abordar diversos aspectos de la fisiopatología NSP y proporcionar una serie de métodos que se pueden emplear de acuerdo con la necesidad específica del usuario, se muestra el análisis a través de espectroscopia de fluorescencia, microscopía de fluorescencia y citometría de flujo.
Protocolo
Los siguientes protocolos describen el análisis realizado en esputo humano. El manejo de muestras en humanos fue aprobado por el comité de ética de la Universidad de Heidelberg y se obtuvo el consentimiento informado por escrito de todos los pacientes o de sus padres/tutores legales (S-370/2011) y controles sanos (S-046/2009).
NOTA: Los siguientes protocolos describen la preparación de la muestra y la cuantificación de la actividad de las proteasas de serina de neutrófilos (NSP). Los procedimientos experimentales presentados aquí se centran en el esputo humano y la elastasa14,20,21 (NE) o la medición de la actividad de la catepsina G15 (CG). Sin embargo, las adaptaciones leves en el protocolo de la preparación de la muestra hacen el análisis de las células sangre-derivadas y de los homogenados del tumor posibles. Además, las actividades de la metaloproteinasa 12 y de la catepsina S de la matriz se pueden investigar semejantemente por medio de las puntas de prueba dedicadas22,23,24,25,26.
1. Preparación de la muestra: aislamiento celular y separación de sobrenadantes
NOTA: Si es posible, el tratamiento del esputo debe llevarse a cabo dentro de los 120 minutos después de la expectoración y el esputo debe almacenarse en el hielo hasta su posterior procesamiento.
- Si la expectoración espontánea del esputo no es posible, induzca el esputo como se describió anteriormente19. Brevemente, inhale 200 μg del salbutamol β-2-receptor-antagonista antes de comenzar el procedimiento de inducción del esputo. Después, inhale una solución salina hipertónica (6%) durante 15 min usando un nebulizador. Recoger el esputo expectorado en una placa de Petri.
- Separe los grupos de moco de la saliva en una placa de Petri con la ayuda de una punta de pipeta.
- Pesar el moco.
NOTA: El peso promedio de una muestra de moco es de 0.8 g (variando entre 0.1 g y 5 g); 0,1 g suelen ser suficientes para realizar los procedimientos mencionados. - Añadir 4 partes (v/p) de Sputolysin al 10% (en PBS) al esputo (por ejemplo: 4 mL de Sputolysin al 10% por cada gramo de esputo).
PRECAUCIÓN: Sputolysin se compone de ditiothreitol concentrado en tampón de fosfato, por lo tanto, manejarlo con cuidado. - Incubar la mezcla a temperatura ambiente (RT) en una coctelera oscilante durante 15 min para disolver el moco. Por razones de seguridad, coloque la coctelera en una campana extractora de humos.
- Apaje la reacción añadiendo el mismo volumen de PBS frío (por ejemplo: 1 mL de PBS frío por cada mL de Sputolysin del 10%).
- Mezclar mediante pipeteo para obtener una solución homogénea.
- Filtre la mezcla a través de un colador de células de nylon de 100 μm en un tubo de 50 mL.
- Repita el paso de filtración a través de un colador de células de nylon de 40 μm.
- Centrifugar la solución durante 10 min a 300 x g a 4 °C.
- Transfiera la fracción sobrenadante cuidadosamente a un tubo fresco y guárdelo en el hielo.
NOTA: Las fracciones sobrenadantes se pueden almacenar a -20 °C o -80 °C hasta su posterior análisis. - Resuspend suavemente el pellet celular en 500 μL de PBS frío y colóquelo sobre hielo.
Nota : la fracción de celda debe procesarse inmediatamente.
2. Medición de la actividad de la proteasa de la serina de neutrófilos
NOTA: Aquí, se introducen diferentes métodos para cuantificar la actividad de los NSP por medio de reporteros FRET. La elección de la tecnología está dictada por la pregunta biomédica específica y el propósito del experimento. Las sondas presentadas fueron ampliamente probadas para su especificidad contra un conjunto de enzimas pulmonares relevantes14,15. Aunque las sondas son específicas hacia su enzima diana, compruebe siempre la especificidad de la sonda en la muestra clínica de interés. Esto se puede lograr incubando la muestra con un inhibidor específico de la proteasa antes de la adición de la sonda, que debe abolir cualquier aumento en la relación D/A.
- Cuantificación de la actividad de los NSP solubles mediante fluorímetro o ensayo de lector de placas
NOTA: La actividad de la proteasa en fracciones solubles de la muestra se puede detectar con cualquier instrumento capaz de detección de fluorescencia.- Descongelar las enzimas en el hielo.
- Hasta su uso, mantenga ne y CG en tampón de almacenamiento ácido (50 mM acetato de sodio, 200 mM NaCl, pH 5.5) para evitar la auto-escisión.
- Para establecer una curva estándar de enzimas, prepare una dilución en serie 1:2 de la enzima (33,9 - 0,271 nM para NE; 42,6 - 0,333 nM para CG) en tampón de activación (10 mM Tris-HCl, 500 mM NaCl a pH 7,5). El tampón de activación tiene un pH neutro y, por lo tanto, permite que la catálisis enzimática se produzca de manera eficiente.
- Para preparar la concentración estándar más alta (concentración de NE: 33,9 nM), diluya 1 μL de NE (33,9 μM) en 999 μL de tampón de activación.
- Para preparar el segundo estándar (concentración ne: 16,95 nM), mezclar 200 μL de la primera dilución con 200 μL de tampón de activación.
- Proceda en consecuencia a preparar las diluciones 1:2 restantes.
- El último estándar, que es el espacio en blanco, se compone de búfer de activación puro. Se recomienda la medición de duplicados técnicos o triplicados. Durante la preparación estándar y de la muestra, trate de mantener los viales en el hielo.
- En paralelo a la preparación estándar, diluya las muestras de esputo en el búfer de activación. Diluir las muestras humanas antes de evaluar su actividad proteasa para permanecer en el rango lineal de aumento de la señal del reportero (relación donante/aceptor). Si las muestras de los pacientes se dejaron sin diluir, la escisión ocurriría demasiado rápido para un ajuste confiable. Dado que el esputo de donante sano contiene menos proteasas activas en comparación con las muestras de pacientes con FQ y EPOC, generalmente se realizan diferentes diluciones (1:10 para el sobrenadante de esputo sano, 1:20-500 para el sobrenadante de esputo de pacientes con EPOC o FQ).
NOTA: Con el fin de medir cuantitativamente la actividad de la proteasa en muestras donde su concentración es desconocida, una curva estándar con concentraciones enzimáticas conocidas debe medirse en paralelo, idealmente en la misma placa. La concentración de enzima activa en el esputo humano se calcula interpolando las pendientes medidas en muestras de esputo humano con las medidas con las curvas estándar. - Antes de preparar las muestras para la medición, configure el instrumento. Establezca la longitud de onda de excitación para la sonda NE FRET (NEmo-114)en 354 nm, y establezca la longitud de onda de detección en 400 nm para el donante y 490 nm para el aceptor. Establezca la longitud de onda de excitación para la sonda CG FRET (sSAM15)en 405 nm, y establezca la emisión en 485 (donante) y 580 nm (aceptor).
- Agregue 40 μL de muestras, estándar o en blanco en los pozos de una placa negra de media área de 96 pozos.
- Para preparar la mezcla maestra que contiene los reporteros (concentración del reportero en la mezcla maestra: 10 μM), diluya la culata de la sonda (1 mM en DMSO) 1:100 en el tampón de activación. Prepare el volumen de mezcla maestra necesario multiplicando 10 μL x el número de pozos de placa requeridos. Para alcanzar la concentración final óptima (2 μM) para la medición de fluorescencia de los reporteros NEmo-1 y sSAM, agregue 10 μL de la mezcla maestra a cada pozo (que contiene 40 μL de cualquier muestra, estándar o en blanco) e inicie la lectura. Por lo tanto, los reporteros de NEmo-1 y sSAM monitorearán la actividad soluble de la elastasa de neutrófilos y la catepsina G, respectivamente.
NOTA: Si un inyector de reactivos no está disponible, asegúrese de iniciar la lectura tan pronto como sea posible después de la adición del informador a las muestras. - Inicie la medición del lector de placas y registre el aumento de la relación donante/aceptor cada 60-90 segundos durante al menos 20 minutos o hasta que el aumento de la señal alcance una meseta.
- Una vez que se exportan los datos, calcule la relación donante/aceptor (relación D/A) dividiendo las unidades de fluorescencia relativa del donante (RFU) con la RFU aceptora para cada punto de tiempo y muestra.
- Calcular la media de la relación D/A y la desviación estándar de cada muestra.
- Determine la pendiente dentro del crecimiento lineal del cambio de relación D/A. La pendiente es un indicador de la tasa de escisión enzimática para una sonda FRET. Calcular la concentración de enzima activa en esputo ajustando las pendientes de regresión lineal derivadas de las muestras humanas con las calculadas a partir de la enzima estándar.
- Cuantificación de la actividad de los NSP unidos a membranas mediante fluorímetro o ensayo de lector de placas
- Aísle las células del esputo como se describió arriba. Resuspend 3 x 104 células en un volumen de 40 μL de PBS. Agregue bien las celdas al lector de placas.
- Configure el instrumento. Establezca la longitud de onda de excitación para la sonda NE FRET unida a la membrana (NEmo-214)en 405 nm, y establezca la longitud de onda de detección en 485 nm para el donante y 580 nm para el aceptor. Establezca la longitud de onda de excitación para la sonda CG FRET unida a membrana (mSAM15)a 405 nm, y establezca la emisión en 485 (donante) y 580 nm (aceptor).
- Para preparar la mezcla maestra que contiene los reporteros, diluya la culata de la sonda en tampón de activación a una concentración de 10 μM. Prepare el volumen de mezcla maestra necesario multiplicando 10 μL X el número de pozos de placa requeridos. Para alcanzar la concentración final óptima (2 μM) para la medición de fluorescencia de los reporteros NEmo-2 y mSAM, agregue 10 μL de la mezcla maestra a cada pozo (que contiene 40 μL de muestra, estándar o en blanco) e inicie la lectura. Por lo tanto, los reporteros de NEmo-2 y mSAM monitorearán la actividad de la elastasa de neutrophil unida a la membrana y a la catepsina G, respectivamente.
NOTA: Un control negativo celular se puede utilizar, por ejemplo, las células que no secretan activamente NSP. Por ejemplo, la incubación de los reporteros con 3 x 104 progenitores leucocitarios HL-60 células promielocíticas representa un control negativo de escisión válida. - Cambio récord en la relación donante/aceptor durante al menos 20 min o hasta que el aumento de la señal alcance una meseta. Analice los datos como se describió anteriormente.
- Medición de la actividad de los NSP unidos a membranas mediante microscopía de fluorescencia
- Determinar el número de condiciones que necesitan ser analizadas.
NOTA: Para cada medición de la muestra de esputo, se recomienda la preparación y el análisis de controles adicionales positivos (PC) y negativos (NC). - Para cada medición, resuspend 3 x 104 células de esputo en un volumen de 50 μL de PBS en un tubo de 1,5 mL.
- Como control negativo, incubar las células de esputo con un inhibidor específico (Sivelestat, inhibidor específico de NE, o inhibidor I de la catepsina G, inhibidor específico de CG, a una concentración final de 100 μM). Incubar durante 10 min en RT.
- Como control positivo, incubar las células de esputo con la enzima apropiada (NE o CG a 340 nM o 200 nM, respectivamente) durante 10 min en RT.
- Añadir 50 μL de PBS que contenga el reportero FRET y una mancha nuclear (en una dilución final de 1:1000) a cada tubo (células tratadas con control positivo, células tratadas con control negativo y células no tratadas) para alcanzar una concentración final de sonda de 2 μM. Incubar durante 10-20 min a RT.
IMPORTANTE: La adición de una mancha nuclear facilita la proyección de imagen de la microscopia de la fluorescencia pues permite buscar para las células del esputo del interés sin utilizar los canales de la sonda del traste y por lo tanto evitar el blanqueo del reportero. Además, la tinción de ADN permite segmentar las células de esputo de acuerdo con la forma de su núcleo. Por ejemplo, los neutrófilos pueden ser fácilmente identificados por sus núcleos multilobulares. Además, se puede recuperar información adicional sobre la viabilidad de las células (los neutrófilos con un núcleo más segmentado tienen más probabilidades de estar vivos).
NOTA: Además de la unida a la membrana, la actividad de NE o CG unido al ADN en el esputo humano se puede medir de la misma manera por medio de H-NE y H-CG, sondas FRET extracelulares asociadas al ADN27. Al preparar la mezcla maestra, se puede añadir H-NE y H-CG a la concentración de 10 μM e incubar con esputo antes de la preparación del citoespino y el portaobjetos. La cuantificación de la relación D/A en el ADN extracelular procede idénticamente a NEmo-2 y mSAM, con la única diferencia de que los agregados de ADN extracelular están segmentados en lugar de las células individuales27. - Apaúde la reacción añadiendo 100 μL de PBS helado y transfiera muestras sobre hielo.
- Cytospin la mezcla en portaobjetos de microscopía, secar al aire, fijar con metanol helado al 10% durante 10 min, secar al aire y montar con un medio de montaje adecuado.
NOTA: Los portaobjetos de microscopía se pueden almacenar a 4 °C en la oscuridad durante un mes hasta un análisis adicional. - Adquiera imágenes de microscopía utilizando un microscopio confocal con un objetivo de aceite PL APO 40x o 63x. Para aumentar la calidad de la imagen y reducir el tiempo de adquisición, se recomienda un modo de adquisición secuencial de imágenes.
- Imagen de la mancha nuclear primero a través de la excitación de 633 nm con la línea helio-neón-láser y registrar su emisión entre 650 y 715 nm.
- Registre el donante (cumarina 343) del reportero del TRASTE entre 470 y 510 nanómetro sobre la excitación en 458 nanómetro con un laser de argón. Adquirir la emisión del aceptor sensibilizado (5,6-TAMRA) entre 570 y 610 nm después de la excitación del único donante.
- Registre la emisión directa del aceptor en un canal separado entre 470 y 510 nm sobre la excitación óptima del aceptor a 561 nm utilizando el láser de estado sólido bombeado por diodo (DPSS).
- Fije el agujero de alfiler al principio del experimento y su mantenimiento durante el transcurso de la sesión de imágenes.
NOTA: Debido a su pequeño tamaño, se recomienda el uso de un objetivo de microscopio 40x o 63x para visualizar los neutrófilos correctamente. Por lo general, las imágenes se adquieren en varios canales consecutivos, comenzando con la longitud de onda de excitación más larga para evitar el fotoblanqueo del reportero durante la adquisición.
- Imagen de al menos 100 celdas por condición para obtener estadísticas concluyentes. Para el análisis de imágenes de microscopía utilice un software apropiado: segmente las células y calcule la relación D/A píxel píxel por píxel, luego calcule la media o mediana de una región de interés dada que es seleccionada manualmente por el usuario. Para obtener resultados representativos, consulte la Figura 1.
- Determinar el número de condiciones que necesitan ser analizadas.
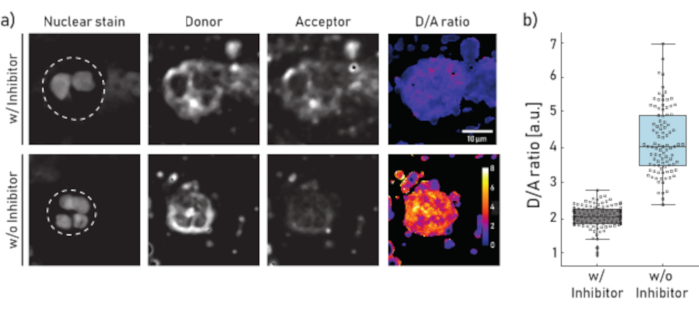
Figura 1:Imágenes representativas y cuantificación de la actividad del NE unido a la membrana en neutrófilos aislados del esputo del paciente con FQ. a)Imágenes representativas de microscopía confocal de neutrófilos preincubados (panel superior) durante 10 min con 100 μM de Sivelestat (w/) o no tratados (sin o) (panel inferior) antes de la adición del reportero NEmo-2 (2 μM). La primera columna de la izquierda muestra la mancha nuclear, la segunda el canal donante, la tercera el canal aceptor y la última la relación D/A calculada obtenida dividiendo los canales donante y aceptor píxel por píxel. Los bordes de la región de interés (neutrófilo único) se representan como una línea discontinua. Se indican la escala (10 μm) y las barras de calibración (relación D/A). b)Diagramas de caja y puntos que muestran la relación D/A de neutrófilos de esputo de un paciente representativo con FQ. Las células incubadas con células inhibidoras y no tratadas se muestran en gris y azul, respectivamente. Cada punto representa una célula (N: con inhibidor = 113 y sin inhibidor = 96). Haga clic aquí para ver una versión más amplia de esta figura.
- Medición de la actividad de los NSP unidos a membrana a través de citometría de flujo
- Resuspend 1 x 106 células en 100 μL de PBS en un tubo de fondo redondo de poliestireno FACS de 5 mL y coloque el tubo sobre hielo.
- Para bloquear los neutrófilos del esputo, use los siguientes anticuerpos: CD14 (1:50), CD16 (1:50), CD45 (1:33) y CD66b (1:50). Prepare suficiente mezcla maestra para todas las muestras. Coloque la mezcla maestra en el hielo en la oscuridad.
- Configure la estrategia de gating como se describe en la figura 2. Los neutrófilos están bloqueados como 7AAD-CD45+CD14-CD16+CD66b+ eventos. Los eventos cerrados se analizarán para su actividad de proteasa unida a la membrana para su donante (λexc = 405 nm, λem = 450/50 nm) y aceptor (λexc = 405 nm, λem = 585/42 nm) intensidades fluorescentes medias (IMF).
- Agregue 2 μL de FcBlock a cada muestra e incube durante 5 min en RT.
- Agregue los anticuerpos elegidos a cada tubo e incube durante 30 minutos en hielo en la oscuridad.
- Lave las células añadiendo 2 mL de PBS frío, y centrífuga durante 5 min a 300 x g y 4 °C. Deseche las células sobrenadantes y resuspentes en 200 μL de PBS frío.
- Divida los 200 μL en dos tubos con 100 μL cada uno y agregue 5 μL de solución de tinción de viabilidad celular en cada tubo. Coloque tubos sobre hielo.
- Añadir un inhibidor específico apropiado de NSP (para el uso de NE Sivelestat a 225 μM de concentración final, para el uso de CG catepsina G Inhibidor I a 100 μM) al tubo de ensayo de control negativo (NC). Incubar las muestras en RT durante 10 min en la oscuridad.
- Agregue 100 μL de PBS frío a la muestra, filtre a través de un filtro de 40 μm en un tubo FACS limpio para evitar la obstrucción del instrumento.
- Añadir el reportero (para NE, NEmo-2 a una concentración final de 4 μM, para CG, mSAM a una concentración final de 2 μM) a la muestra NC, vórtice suavemente el tubo.
- Comience a adquirir células incubadas con el inhibidor específico para ajustar ligeramente, si es necesario, las puertas, así como los voltajes de los PMTs reporteros.
- Registre al menos 1000 neutrófilos. Mantenga la muestra a temperatura ambiente.
Nota : aunque se pueden registrar más eventos, 1000 celdas garantizan un buen compromiso entre las estadísticas adecuadas y el tiempo de registro. - Proceda con los siguientes tubos (muestras de esputo no tratadas) en consecuencia.
- Para registrar los cambios en la relación D/A debido a la actividad de la proteasa unida a la membrana, registre 1000 neutrófilos de cada tubo cada 5 a 10 min.
NOTA: Después de la escisión exitosa del reportero fret, la intensidad de las IMF del canal donante aumentará con el tiempo. La intensidad de las IMF del canal aceptor debe disminuir o permanecer constante con el tiempo. - Calcule la relación FRET dividiendo al donante por los valores del canal aceptor para las muestras medidas en los neutrófilos individuales viables bloqueados.
- Normalice las mediciones de muestras dividiéndolas con el correspondiente punto de tiempo de 0 min (para obtener resultados y análisis representativos, consulte la Figura 2).
NOTA: El registro de al menos dos puntos de tiempo (es decir, 0 y 10 min) es necesario para una medición dinámica del cambio de relación D/A. Para normalizar la medición de la actividad para cada muestra, la relación D/A medida en puntos de tiempo posteriores (por ejemplo, 10 min) se divide por la relación calculada inmediatamente después de la adición de la sonda (0 min).
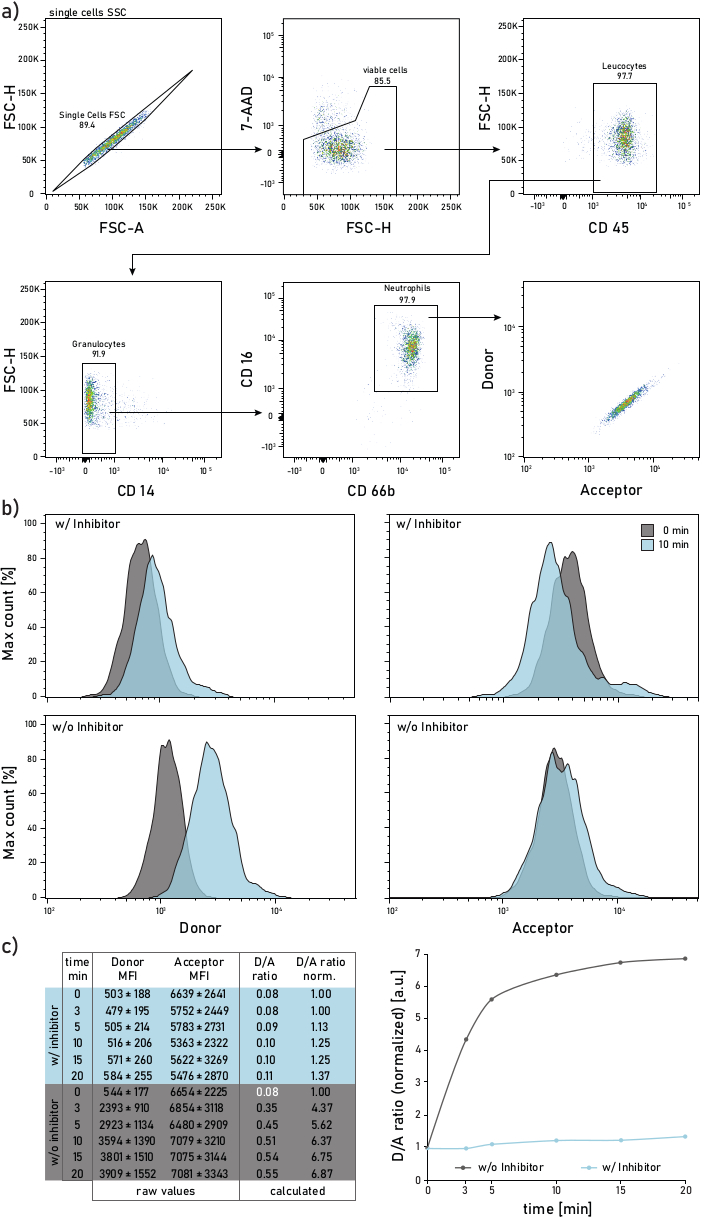
Figura 2:Estrategia de gating y gráficas representativas de la actividad ne unida a la membrana medida en neutrófilos aislados del esputo de los pacientes con FQ. a)Para gatear neutrófilos de esputo se utilizan los siguientes anticuerpos: CD14 (1:50), CD16 (1:50), CD45 (1:33) y CD66b (1:50). Los neutrófilos están bloqueados como 7-AAD-CD45+CD14-CD16+CD66b+ eventos. Los eventos cerrados se analizan para su donante (λexc= 405 nm, λem= 450/50 nm) y aceptor (λexc= 405 nm, λem= 585/42 nm) intensidades medias de fluorescencia (IMF). b)Histogramas representativos de neutrófilos de esputo CF analizados por su actividad ne unida a la membrana. La columna izquierda muestra la señal donante, la columna derecha muestra la señal aceptora. La fila superior muestra las intensidades medias de fluorescencia de las células tratadas con Sivelestat (w/) durante 10 min antes de la adición del reportero. La fila inferior muestra células no tratadas (sin o) cuya fluorescencia del reportero se mide inmediatamente (0 min, gris) y 10 min (azul) después de la adición del reportero. Los neutrófilos están bloqueados de acuerdo con la estrategia mostrada en el panel a. c)La tabla de datos muestra un conjunto de datos representativo que consiste en IMF crudas para el donante y la señal aceptora en neutrófilos medidos en varios puntos de tiempo (0-3-5-10-15-20 min), así como la relación D/A calculada. La relación D/A se puede normalizar, es decir, al punto de tiempo de 0 min (fuente blanca). 0 min indica una grabación realizada tan pronto como sea posible después de la adición del reportero al tubo de flujo con células de esputo teñidas. Los datos de las IMF se muestran como desviación estándar media ± para 1000 neutrófilos. Haga clic aquí para ver una versión más amplia de esta figura.
Resultados
Los resultados mostrados en la Figura 1a ilustran un conjunto de datos de microscopía representativo. La señal nuclear se utiliza para identificar neutrófilos por sus característicos núcleos segmentados. La región de interés (ROI) se selecciona manualmente (línea discontinua en la Figura 1a). La imagen de la relación D/A se calcula dividiendo las intensidades del canal donante por las intensidades del canal aceptor píxel por píxel. En el último paso se calcula la relación D/A media por celda (ROI). En la Figura 1b cada punto representa la media de un ROI (neutrófilo). Se recomienda tomar imágenes y evaluar unas 100 células por condición.
En la Figura 2ase muestra una estrategia representativa de gating de citometría de flujo. Tal gating permite discriminar y estudiar neutrófilos del esputo. Para evitar derrames de fluorescencia o artefactos de compensación, se recomienda dedicar una línea láser (por ejemplo, láser azul) a la detección de fluorescencia de la sonda FRET. La compensación de fluorescencia de citometría de flujo debe realizarse para los anticuerpos y no para la sonda FRET. La Figura 2b representa la distribución de la IMF a 0 y 10 minutos después de la adición del reportero. Cada fila de la Figura 2c indica los valores medios de las IMF donante y aceptor para 1000 neutrófilos de esputo. La relación D/A se calcula dividiendo las IMF donante y aceptora. El curso del tiempo en la Figura 2c en el lado derecho muestra la progresión de la medición: después de un rápido aumento inicial, la relación D/A alcanza una meseta, de acuerdo con la actividad de la enzima unida a la membrana.
Discusión
Los protocolos divulgados explican diversos acercamientos para cuantificar la actividad de la elastasa y de la catepsina G del neutrófilo en muestras humanas del esputo. Los puntos críticos para una medición exitosa de la actividad enzimática son el i) el momento preciso y la estandarización del procedimiento operativo y ii) el uso de controles negativos y positivos confiables. Si se cumplen estas condiciones, los métodos descritos no se limitan al esputo, sino que también se pueden adaptar fácilmente al análisis de la actividad de la proteasa en sangre, líquidos de lavado broncoalveolares y secciones de tejido u homogeneados.
Cada una de las tres técnicas tiene sus fortalezas y limitaciones, que a menudo se complementan entre sí. Por ejemplo, la citometría de flujo permite el análisis rápido de poblaciones celulares raras, así como el fenotipado celular, pero carece de información de resolución espacial, que se puede lograr mediante microscopía. En su lugar, las mediciones del lector de placas permiten la evaluación paralela de varias muestras o condiciones de una manera de alto rendimiento. Dado que las células de esputo frescas no se pueden congelar y almacenar, los tres métodos requieren que las muestras se procesen rápidamente después de la expectoración. Esto limita la flexibilidad o el rendimiento de las mediciones de actividad ligadas a la membrana. El desarrollo de un protocolo de citometría de flujo que permita fijar las células después de la adición de la sonda y la escisión enzimática se abriría a la medición paralela de un mayor número de tubos. Además, se debe prestar especial atención a la manipulación y el almacenamiento de las sondas FRET. De hecho, algunos aminoácidos presentes en el sustrato peptídico, como la metionina, experimentan oxidación que conduce a una disminución de la sensibilidad del reportero. Para aumentar la vida útil del reportero (estimado en unos tres meses a 20 °C), se pueden almacenar en alícuotas de pequeño volumen (1-2 μL) bajo gas inerte como nitrógeno o argón.
En la FQ y otras enfermedades pulmonares inflamatorias crónicas es importante detectar la inflamación lo antes posible, y los biomarcadores confiables tienen el potencial de lograr tal objetivo. La posibilidad de detectar la actividad de los PNS unidos a la superficie, que se ha demostrado que es perjudicial para el tejido circundante, también en condiciones en las que no hay actividad libre de NE o es escasa, añade otro nivel de información valiosa, que difícilmente puede lograrse mediante otros métodos existentes4,11.
Los reporteros se pueden utilizar para estudiar el vínculo de la actividad asociada membrana-limitada de NSP con severidad y la progresión de la enfermedad pulmonar, especialmente en su temprano-inicio. Los métodos se pueden utilizar para supervisar la eficacia del tratamiento (por ejemplo, tratamientos antiinflamatorios o moduladores y potenciadores de CFTR altamente efectivos28)e investigar la amortiguación resultante de la inflamación impulsada por neutrófilos. Además, los protocolos se basan en procedimientos de muestra no invasivos que conllevan un riesgo muy bajo para el paciente y, por lo tanto, se pueden utilizar a una escala muy amplia y abrir las puertas a numerosas aplicaciones interesantes.
Divulgaciones
Los autores declaran que no hay conflicto de intereses.
Agradecimientos
Este proyecto contó con el apoyo de subvenciones del Ministerio alemán de Educación e Investigación (FKZ 82DZL004A1 a M.A.M) y la Fundación Alemana de Investigación (SFB-TR84TP B08 a M.A.M). El trabajo descrito en este manuscrito fue apoyado por el Centro Alemán de Investigación Pulmonar (DZL) y el EMBL Heidelberg a través de una beca de doctorado para M.G. Agradecemos a J. Schatterny, S. Butz y H. Scheuermann su asistencia técnica experta.
Materiales
| Name | Company | Catalog Number | Comments |
| 100 µm Nylon cell strainer | Corning Inc. | 431752 | |
| 2300 EnSpire (Multilabel Plate Reader) | PerkinElmer | ||
| 35x10mm Dish, Nunclon Delta | Thermo Fisher Scientific | 150318 | |
| 40 µm Nylon cell strainer | Corning Inc. | 431750 | |
| 50 mL tubes | Sarstedt | 10535253 | |
| 7-AAD, viability dye | Bio Legend | 420404 | 5 µL/100 µL |
| Balance | OHAUS Instruments (Shanghai) Co., Ltd. | PR124 | |
| BD Falcon Round-Bottom Tubes 5 mL | BD Bioscience | 352054 | |
| BD LSRFortessa cell analyzer | BD Bioscience | ||
| black flat bottom 96 well half area plate | Corning Life Science | 3694 | |
| Cathepsin G | Elastin Products Company | SG623 | |
| Cathepsin G Inhibitor I | Merck KGaA | 219372 | |
| Centrifuge 5418R | Eppendorf AG | EP5401000137 | |
| Combitips advanced 1.0 mL | Eppendorf AG | 0030 089 430 | |
| cOmplete proteinase inhibitor | Roche | 11697498001 | |
| Countig chambers improved Neubauer | Glaswarenfabrik Karl Hecht GmbH & Co KG | 40442 | |
| coverslips Ø 25mm | Thermo Fisher Scientific | MENZCB00250RA003 | |
| Cytospin 4 | Thermo Fisher Scientific | ||
| DRAQ5 (nuclear stain) | BioStatus Limited | DR50050 | 1:10000 |
| FACSDiva software, v8.0.1 | BD Bioscience | ||
| FcBlock | BD Bioscience | 564219 | |
| Fiji (Fiji Is Just ImageJ) | fiji.sc | ||
| Flow Jo software, v10 | TreeStar | ||
| FluoQ Plugin, v3-97 | |||
| Heraeus Megafuge 16R | Thermo Fisher Scientific | ||
| Human Sputum Leucocyte Elastase | Elastin Products Company | SE563 | |
| Leica SP8 confocal microscope | Leica Microsystems | ||
| Mini Rock-Shaker | PEQLAB Biotechnologie GmbH | MR-1 | |
| mouse anti-human CD14, Pe-Cy7, clone M5E2 | BD Bioscience | 557742 Lot:8221983 | 1:50 |
| mouse anti-human CD16, AF700, clone 3G8 | BD Bioscience | 557820 Lot:8208791 | 1:50 |
| mouse anti-human CD45, APC-Cy7, clone 2D1 | BD Bioscience | 557833 Lot:8059688 | 1:33 |
| mouse anti-human CD66b, PE/Dazzel 594, clone G10F5 | BioLegend | 305122 Lot:B241921 | 1:50 |
| mSAM | in house | 2 mM | |
| Multipette plus | Eppendorf AG | ||
| NEmo-1 | SiChem | SC-0200 | 1 mM |
| NEmo-2E | SiChem | SC-0201 | 2 mM |
| Pari Boy SX with an LC Sprint jet nebulizer | Pari | 085G3001 | |
| phosphate buffered saline | Gibco | 10010-015 | |
| ROTI Histokitt (mounting medium) | Carl Roth GmbH + Co.KG | 6638.1 | |
| Salbutamol | Teva GmbH | ||
| Sivelestat | Cayman Chemicals | 17779 | |
| Sputolysin | Calbiochem | 560000-1SET | |
| sSAM | in house | 2 mM | |
| SuperFrost Plus Adhesion slides | Thermo Fisher Scientific | 10149870 | |
| Trypan Blue solution | Sigma-Aldrich | T8154 |
Referencias
- Korkmaz, B., Moreau, T., Gauthier, F. Neutrophil elastase, proteinase 3 and cathepsin G: Physicochemical properties, activity and physiopathological functions. Biochimie. 90 (2), 227-242 (2008).
- Sheshachalam, A., Srivastava, N., Mitchell, T., Lacy, P., Eitzen, G. Granule Protein Processing and Regulated Secretion in Neutrophils. Frontiers in Immunology. 5, 448 (2014).
- Pham, C. T. N. Neutrophil serine proteases: Specific regulators of inflammation. Nature Reviews Immunology. 6 (7), 541-550 (2006).
- Gehrig, S., et al. Lack of neutrophil elastase reduces inflammation, mucus hypersecretion, and emphysema, but not mucus obstruction, in mice with cystic fibrosislike lung disease. American Journal of Respiratory and Critical Care Medicine. 189 (9), 1082-1092 (2014).
- McKelvey, M. C., Weldon, S., McAuley, D. F., Mall, M. A., Taggart, C. C. Targeting proteases in cystic fibrosis lung disease paradigms, progress, and potential. American Journal of Respiratory and Critical Care Medicine. 201 (2), 141-147 (2020).
- Clancy, D. M., et al. Extracellular Neutrophil Proteases Are Efficient Regulators of IL-1, IL-33, and IL-36 Cytokine Activity but Poor Effectors of Microbial Killing. Cell Reports. 22 (11), 2937-2950 (2018).
- Giacalone, V. D., Margaroli, C., Mall, M. A., Tirouvanziam, R. Neutrophil adaptations upon recruitment to the lung: New concepts and implications for homeostasis and disease. International Journal of Molecular Sciences. 21 (3), 1-21 (2020).
- Sly, P. D., et al. Risk Factors for Bronchiectasis in Children with Cystic Fibrosis. New England Journal of Medicine. 368 (21), 1963-1970 (2013).
- Owen, C. A., Campbell, M. A., Sannes, P. L., Boukedes, S. S., Campbell, E. J. Cell surface-bound elastase and cathepsin G on human neutrophils: A novel, non-oxidative mechanism by which neutrophils focus and preserve catalytic activity of serine proteinases. Journal of Cell Biology. 131 (3), 775-789 (1995).
- Brinkmann, V., et al. Neutrophil Extracellular Traps Kill Bacteria. Science. 303 (5663), 1532-1535 (2004).
- Margaroli, C., et al. Elastase Exocytosis by Airway Neutrophils Associates with Early Lung Damage in Cystic Fibrosis Children. American Journal of Respiratory and Critical Care Medicine. , (2018).
- Owen, C., Campbell, M. A., Sannes, P. L., Boukedes, S. S., Carolina, N. Cell surface-bound elastase and cathepsin G on human neutrophils: a novel, non-oxidative mechanism by which neutrophils focus and preserve catalytic activity of serine proteinases. The Journal of cell biology. 131 (3), 775-789 (1995).
- Garland, M., Yim, J. J., Bogyo, M. A Bright Future for Precision Medicine: Advances in Fluorescent Chemical Probe Design and Their Clinical Application. Cell chemical biology. 23 (1), 122-136 (2016).
- Gehrig, S., Mall, M. A., Schultz, C. Spatially resolved monitoring of neutrophil elastase activity with ratiometric fluorescent reporters. Angewandte Chemie - International Edition. 51 (25), 6258-6261 (2012).
- Guerra, M., et al. Cathepsin G Activity as a New Marker for Detecting Airway Inflammation by Microscopy and Flow Cytometry. ACS Central Science. 5 (3), 539-548 (2019).
- Hu, H. Y., et al. In vivo imaging of mouse tumors by a lipidated cathepsin S substrate. Angewandte Chemie - International Edition. 53 (29), 7669-7673 (2014).
- Korkmaz, B., et al. Measuring elastase, proteinase 3 and cathepsin G activities at the surface of human neutrophils with fluorescence resonance energy transfer substrates. Nature Protocols. 3 (6), 991-1000 (2008).
- Craven, T. H., et al. Super-silent FRET Sensor Enables Live Cell Imaging and Flow Cytometric Stratification of Intracellular Serine Protease Activity in Neutrophils. Scientific Reports. 8 (1), 13490 (2018).
- Mu, J., et al. A small-molecule fret reporter for the real-time visualization of cell-surface proteolytic enzyme functions. Angewandte Chemie - International Edition. 53 (52), 14357-14362 (2014).
- Hagner, M., et al. New method for rapid and dynamic quantification of elastase activity on sputum neutrophils from patients with cystic fibrosis using flow cytometry. European Respiratory Journal. 55 (4), 1902355 (2020).
- Dittrich, A. S., et al. Elastase activity on sputum neutrophils correlates with severity of lung disease in cystic fibrosis. European Respiratory Journal. , 1701910 (2018).
- Cobos-Correa, A., Trojanek, J. B., Diemer, S., Mall, M. A., Schultz, C. Membrane-bound FRET probe visualizes MMP12 activity in pulmonary inflammation. Nature Chemical Biology. 5 (9), 628-630 (2009).
- Hu, H. -. Y., et al. FRET-based and other fluorescent proteinase probes. Biotechnology Journal. 9 (2), 266-281 (2014).
- Trojanek, J. B., et al. Airway mucus obstruction triggers macrophage activation and matrix metalloproteinase 12-dependent emphysema. American Journal of Respiratory Cell and Molecular Biology. 51 (5), 709-720 (2014).
- Wagner, C. J., Schultz, C., Mall, M. A. Neutrophil elastase and matrix metalloproteinase 12 in cystic fibrosis lung disease. Molecular and Cellular Pediatrics. 3 (1), 25 (2016).
- Gaggar, A., et al. The role of matrix metalloproteinases in cystic fibrosis lung disease. The European respiratory journal. 38 (3), 721-727 (2011).
- Guerra, M., et al. Protease FRET Reporters Targeting Neutrophil Extracellular Traps. Journal of the American Chemical Society. 142 (48), 20299-20305 (2020).
- Middleton, P. G., et al. Elexacaftor-Tezacaftor-Ivacaftor for Cystic Fibrosis with a Single Phe508del Allele. New England Journal of Medicine. 381 (19), 1809-1819 (2019).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados