Method Article
Surveillance de l’activité de l’élastase neutrophile et de la cathepsine G dans les échantillons d’expectorations humaines
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les protocoles décrits ci-dessus fournissent un guide pour visualiser et quantifier l’activité des protéases neutrophiles dans les expectorations humaines. Les applications de cette analyse vont de l’évaluation des traitements anti-inflammatoires à la validation des biomarqueurs, au dépistage des médicaments et aux études cliniques de grandes cohortes.
Résumé
Les protéases sont des régulateurs d’innombrables processus physiologiques et l’étude précise de leurs activités reste un défi biomédical intrigant. Parmi les ~600 protéases codées par le génome humain, les protéases de sérine neutrophile (PSN) sont étudiées en profondeur pour leur implication dans l’apparition et la progression des conditions inflammatoires, y compris les maladies respiratoires. De manière unique, les PSN sécrétés diffusent non seulement dans les fluides extracellulaires, mais se localisent également aux membranes plasmiques. Pendant la formation du piège extracellulaire de neutrophile (TNE), les PSN deviennent une partie intégrante de la chromatine sécrétée. Un tel comportement complexe rend l’entente de la pathophysiologie de NSPs une tâche provocante. Ici, des protocoles détaillés sont montrés pour visualiser, quantifier et discriminer les activités libres et liées à la membrane de l’élastase de neutrophile (Ne) et de la cathepsine G (CG) dans des échantillons d’expectorations. Ne et CG sont des NSP dont les activités ont des rôles pleiotropic dans la pathogénie de la mucoviscidose (CF) et de la maladie pulmonaire obstructive chronique (COPD) : ils favorisent le remodelage de tissu, règlent des immuno-réactions en aval et se corrèlent avec la sévérité de maladie pulmonaire. Les protocoles montrent comment séparer la fraction fluide et la fraction cellulaire, ainsi que l’isolement des neutrophiles des expectorations humaines pour la quantification de l’activité enzymatique via des rapporteurs basés sur le transfert d’énergie de résonance Förster (FRET) à petites molécules. Pour recueillir des informations spécifiques sur le rôle relatif des activités NE et CG, une lecture FRET peut être mesurée par différentes technologies: i) les mesures in vitro des lecteurs de plaques permettent une détection à haut débit et en vrac de l’activité de la protéase; ii) la microscopie confocale résout spatiotemporally l’activité liée à la membrane à la surface de la cellule ; iii) la cytométrie en flux FRET à petites molécules permet l’évaluation rapide des traitements anti-inflammatoires via la quantification et le phénotypage de l’activité de la protéase unicellulaire. La mise en œuvre de telles méthodes ouvre la voie à l’exploration de la pathobiologie des PSN et de leur potentiel en tant que biomarqueurs de la gravité de la maladie pour la FK et la MPOC. Compte tenu de leur potentiel de normalisation, de leur lecture robuste et de la simplicité du transfert, les techniques décrites sont immédiatement partageables pour une mise en œuvre entre les laboratoires de recherche et de diagnostic.
Introduction
L’élastase neutrophile (NE), la cathepsine G (CG), la protéinase 3 (PR3) et la sérine protéase neutrophile 4 (NSP4) sont les quatre protéases de sérine neutrophile (PSN)1. Ils sont stockés, avec la myéloperoxydase, dans des granules neutrophiles primaires ou azurophiles. En raison de leur contenu protéolytique élevé, la sécrétion de granules primaires est étroitement régulée et les neutrophiles doivent être défiées séquentiellement avec des stimuli d’amorçage et d’activation2.
À l’intérieur du phagolysosome, les PSN fonctionnent comme des agents bactéricides intracellulaires3. Lorsqu’ils sont sécrétés, les PSN deviennent de puissants médiateurs de l’inflammation: ils clivent les cytokines et les récepteurs de surface, activant des voies pro-inflammatoires parallèles3. Il est important de faire en 19005,2005, les affections inflammatoires sont en mesure de s’enserrer dans des conditions incendiaires. Par exemple, dans les voies respiratoires enflammées, une activité excessive de NE provoque une hypersécrétion de mucus, une métaplasie des cellules de gobelet, une inactivation cftr et un remodelage de la matrice extracellulaire4,5. La cathepsine G participe également à l’inflammation: elle fend spécifiquement et active deux composants de la famille IL-1, IL-36α et IL-36β6. De concert avec ne, CG fend les récepteurs protéase-activés sur l’épithélium de voie aérienne et active également TNF-α et IL-1β.
Les anti-protéases endogènes telles que l’alpha-1-antitrypsine, l’alpha-1-antichymotrypsine et l’inhibiteur sécrétoire de la leucocyte protéase régulent l’élastase neutrophile et l’activité de la cathepsine G5. Cependant, au cours de la progression de la maladie pulmonaire, la sécrétion continue de protéases dépasse stœchiométriquement le bouclier anti-protéase, conduisant à une neutrophilie non résolvante dans les voies respiratoires, à une aggravation de l’inflammation et à des lésions tissulaires5,7. Bien que la concentration et l’activité de NE dans les fractions solubles des voies respiratoires patientes se soient avérées être un biomarqueur prometteur de la gravité de la maladie8,le NE et le CG s’associent également à la membrane plasmique des neutrophiles et à l’ADN extracellulaire via des interactions électrostatiques9,10 où ils deviennent moins accessibles aux anti-protéases. Il est important de faire en sorte que les études précliniques ont défini un scénario où l’activité protéase associée à la surface des cellules apparaît plus tôt et/ou indépendamment de son homologue soluble4,11. En fait, pour devenir détectable, l’activité de la protéase libre doit d’abord submerger le bouclier anti-protéase. Au lieu de cela, à la surface cellulaire, l’activité de la protéase liée à la membrane reste au moins partiellement intacte en raison de l’inaccessibilité des grands inhibiteurs de la membrane plasmique cellulaire12. Un tel comportement complexe de protéase a des conséquences importantes sur le début et la propagation neutrophile-négociés d’inflammation, et doit donc être étudié avec des outils précis et informatifs.
Au fil des ans, les sondes à base de transfert d’énergie par résonance de Förster (FRET) ont trouvé de nombreuses applications biomédicales en tant qu’outils qui évaluent efficacement et rapidement une activité protéase spécifique dans des échantillons humains13. Pour fonctionner, les rapporteurs de protéase sont composés d’un motif de reconnaissance (c’est-à-dire un peptide), qui est reconnu par l’enzyme cible et s’appuient sur FRET, un processus physique où, lors de l’excitation, un fluorophore donneur transfère de l’énergie à une molécule acceptrice. Le traitement opéré par l’enzyme sur le rapporteur, à savoir le clivage de la partie reconnaissance, aboutit à ce que l’accepteur diffuse loin du donneur : l’activité enzymatique est donc mesurée comme un changement dépendant du temps du donneur sur la fluorescence de l’accepteur. Une telle lecture est auto-normalisante et ratiométrique, donc seulement marginalement affectée par les conditions environnementales telles que le pH et la concentration locale de la sonde. NEmo-114 et sSAM15 sont des sondes FRET qui rendent compte spécifiquement de l’activité NE et CG, respectivement. Cependant, ces rapporteurs ne se localisent pas spécifiquement dans un compartiment cellulaire, ils sont donc employés pour surveiller l’activité de la protéase présente dans les fluides humains. Afin de surveiller l’activité de la protéase de manière spatialement localisée, nous et d’autres avons développé des sondes FRET qui s’associent à des composants subcellulaires via des balises moléculaires14,15, 16,17,18,19. Une telle stratégie synthétique a permis le développement de NEmo-2 et mSAM, deux sondes FRET équipées d’ancres lipidiques qui se localisent à la membrane plasmique. Ces journalistes ont alimenté une compréhension plus approfondie des protéases ne et cg dans la mucoviscidose et les maladies pulmonaires obstructives chroniques14,15.
Ici, des protocoles détaillés sont fournis pour la visualisation et la quantification des activités solubles et membranaires ne et cg dans les expectorations humaines au moyen des séries NEmo et SAM de sondes FRET. Pour aborder divers aspects de la physiopathologie des PSN et fournir un éventail de méthodes qui peuvent être utilisées en fonction du besoin spécifique à l’utilisateur, l’analyse par spectroscopie de fluorescence, microscopie à fluorescence et cytométrie en flux sont présentées.
Protocole
Les protocoles suivants décrivent l’analyse effectuée sur les expectorations humaines. Le traitement des échantillons humains a été approuvé par le comité d’éthique de l’Université de Heidelberg et le consentement éclairé écrit a été obtenu de tous les patients ou de leurs parents/tuteurs légaux (S-370/2011) et des témoins sains (S-046/2009).
REMARQUE: Les protocoles suivants décrivent la préparation de l’échantillon et la quantification de l’activité des protéases de sérine neutrophile (PSN). Les procédures expérimentales présentées ici se concentrent sur les expectorations humaines et la mesure de l’activité de l’élastase14,20,21 (Ne) ou de la cathepsine G15 (CG). Cependant, de légères adaptations dans le protocole de préparation de l’échantillon rendent possible l’analyse des cellules dérivées du sang et des homogénats tumoraux. De plus, les activités de la métalloprotéinase matricielle 12 et de la cathepsine S peuvent être étudiées de manière similaire au moyen de sondes FRET dédiées22,23,24,25,26.
1. Préparation de l’échantillon: isolement cellulaire et séparation des surnageants
NOTA : Si possible, le traitement des expectorations doit être effectué dans les 120 minutes suivant l’expectoration et les expectorations doivent être conservées sur de la glace jusqu’à un traitement ultérieur.
- Si l’expectoration spontanée des expectorations n’est pas possible, induire des expectorations comme décrit précédemment19. En bref, inhalez 200 μg du salbutamol antagoniste des récepteurs β-2 avant de commencer la procédure d’induction des expectorations. Ensuite, inhalez une solution saline hypertonique (6%) pendant 15 min à l’aide d’un nébuliseur. Recueillir les expectorations expectorées dans une boîte de Pétri.
- Séparez les touffes de mucus de la salive dans une boîte de Pétri à l’aide d’une pointe de pipette.
- Peser le mucus.
REMARQUE: Le poids moyen d’un échantillon de mucus est de 0,8 g (variant entre 0,1 g et 5 g); 0,1 g sont généralement suffisants pour effectuer les procédures mentionnées. - Ajouter 4 parties (v/p) de 10 % de sputolysine (en PBS) aux expectorations (par exemple : 4 mL de sputolysine à 10 % pour chaque gramme d’expectorations).
ATTENTION : La sputolysine est composée de dithiothreitol concentré dans un tampon phosphate, donc manipulez-le avec soin. - Incuber le mélange à température ambiante (RT) sur un agitateur à bascule pendant 15 min pour dissoudre le mucus. Pour des raisons de sécurité, placez le shaker dans une hotte.
- Éteindre la réaction en ajoutant le même volume de PBS froid (par exemple: 1 mL de PBS froid pour chaque mL de 10% de Sputolysine).
- Mélanger par pipetage pour obtenir une solution homogène.
- Filtrer le mélange à travers une passoire à cellules en nylon de 100 μm dans un tube de 50 mL.
- Répétez l’étape de filtration à travers une passoire à cellules en nylon de 40 μm.
- Centrifuger la solution pendant 10 min à 300 x g à 4 °C.
- Transférez soigneusement la fraction surnageante dans un tube frais et conservez-la sur de la glace.
REMARQUE: Les fractions surnageantes peuvent être stockées à -20 °C ou -80 °C jusqu’à une analyse plus approfondie. - Remettre doucement la pastille cellulaire dans 500 μL de PBS froid et la placer sur de la glace.
Remarque : la fraction de cellule doit être traitée immédiatement.
2. Mesure de l’activité de la sérine protéase neutrophile
NOTE: Ici, différentes méthodes sont introduites pour quantifier l’activité des PSN au moyen de déclarants fret. Le choix de la technologie est dicté par la question biomédicale spécifique et le but de l’expérience. Les sondes présentées ont été largement testées pour leur spécificité par rapport à un ensemble d’enzymes pulmonaires pertinentes14,15. Bien que les sondes soient spécifiques à leur enzyme cible, vérifiez toujours la spécificité de la sonde sur l’échantillon clinique d’intérêt. Ceci peut être réalisé en incubant l’échantillon avec un inhibiteur spécifique de protéase avant l’addition de sonde, qui devrait abolir toute augmentation du rapport D/A.
- Quantification de l’activité des PSN solubles par fluorimètre ou essai de lecteur de plaque
REMARQUE: L’activité de la protéase dans les fractions solubles de l’échantillon peut être détectée avec n’importe quel instrument capable de détecter la fluorescence.- Dégeler les enzymes sur la glace.
- Jusqu’à l’utilisation, conserver ne et cg dans le tampon de stockage acide (acétate de sodium 50 mM, NaCl 200 mM, pH 5,5) pour éviter l’auto-clivage.
- Pour établir une courbe standard enzymatique, préparer une dilution en série de 1:2 de l’enzyme (33,9 - 0,271 nM pour NE; 42,6 - 0,333 nM pour CG) dans le tampon d’activation (10 mM Tris-HCl, 500 mM NaCl à pH 7,5). Le tampon d’activation a un pH neutre et permet donc à la catalyse enzymatique de se produire efficacement.
- Pour préparer la concentration standard la plus élevée (concentration en NE : 33,9 nM), diluer 1 μL de NE (33,9 μM) dans 999 μL de tampon d’activation.
- Pour préparer le deuxième étalon (concentration en NE : 16,95 nM), mélanger 200 μL de la première dilution avec 200 μL de tampon d’activation.
- Procédez en conséquence pour préparer les dilutions 1:2 restantes.
- La dernière norme, qui est le blanc, est composée d’un tampon d’activation pur. La mesure des doublons techniques ou des triples est recommandée. Pendant la préparation de l’étalon et de l’échantillon, essayez de garder les flacons sur la glace.
- Parallèlement à la préparation standard, diluer les échantillons d’expectorations dans un tampon d’activation. Diluer les échantillons humains avant d’évaluer leur activité protéase pour rester dans la plage linéaire d’augmentation du signal rapporteur (rapport donneur/accepteur). Si les échantillons de patients n’étaient pas dilués, le clivage se produirait trop rapidement pour un raccord fiable. Étant donné que les expectorations de donneurs sains contiennent moins de protéases actives que les échantillons provenant de patients atteints de mucoviscidose et de MPOC, différentes dilutions sont généralement effectuées (1:10 pour les expectorations saines surnageantes, 1:20-500 pour les expectorations surnageantes des patients atteints de MPOC ou de mucoviscidose).
NOTA : Afin de mesurer quantitativement l’activité de la protéase dans des échantillons où leur concentration est inconnue, une courbe standard avec des concentrations enzymatiques connues doit être mesurée en parallèle, idéalement sur la même plaque. La concentration d’enzymes actives dans les expectorations humaines est calculée en interpolant les pentes mesurées dans les échantillons d’expectorations humaines avec celles mesurées avec les courbes standard. - Avant de préparer les échantillons pour la mesure, configurez l’instrument. Réglez la longueur d’onde d’excitation de la sonde NE FRET (NEmo-114)sur 354 nm et réglez la longueur d’onde de détection sur 400 nm pour le donneur et 490 nm pour l’accepteur. Réglez la longueur d’onde d’excitation de la sonde CG FRET (sSAM15)sur 405 nm et réglez l’émission sur 485 (donneur) et 580 nm (accepteur).
- Ajouter 40 μL d’échantillons, standard ou vierge, dans les puits d’une plaque noire de 96 puits demi-surface.
- Pour préparer le mélange maître contenant les rapporteurs (concentration du rapporteur dans le mélange maître : 10 μM), diluer le stock de sonde (1 mM en DMSO) 1:100 dans le tampon d’activation. Préparer le volume de mélange principal nécessaire en multipliant 10 μL x le nombre de puits de plaque requis. Pour atteindre la concentration finale optimale (2 μM) pour la mesure de la fluorescence des rapporteurs NEmo-1 et sSAM, ajoutez 10 μL du mélange maître à chaque puits (contenant 40 μL d’échantillon, standard ou blanc) et commencez la lecture. Les rapporteurs NEmo-1 et sSAM surveilleront donc l’activité de l’élastase neutrophile soluble et de la cathepsine G, respectivement.
Remarque : Si un injecteur de réactif n’est pas disponible, veillez à démarrer la lecture dès que possible après l’ajout de reporter aux échantillons. - Démarrez la mesure du lecteur de plaque et enregistrez l’augmentation du rapport donneur / accepteur toutes les 60-90 secondes pendant au moins 20 minutes ou jusqu’à ce que l’augmentation du signal atteigne un plateau.
- Une fois les données exportées, calculez le rapport donneur/accepteur (rapport D/A) en divisant les unités de fluorescence relative (UFC) du donneur par l’UFC accepteur pour chaque point temporel et échantillon.
- Calculer la moyenne du rapport D/A et l’écart type de chaque échantillon.
- Déterminer la pente dans la croissance linéaire du changement de rapport D/A. La pente est un indicateur du taux de clivage enzymatique d’une sonde FRET. Calculer la concentration d’enzymes actives dans les expectorations en ajustant les pentes de régression linéaire dérivées des échantillons humains avec celles calculées à partir de l’étalon enzymatique.
- Quantification de l’activité des PSN liés à la membrane par fluorimètre ou essai de lecteur de plaque
- Isoler les expectorations comme décrit ci-dessus. Ressusciter 3 x 104 cellules dans un volume de 40 μL de PBS. Ajoutez bien les cellules au lecteur de plaque.
- Configurez l’instrument. Réglez la longueur d’onde d’excitation de la sonde NE FRET liée à la membrane (NEmo-214)sur 405 nm et réglez la longueur d’onde de détection sur 485 nm pour le donneur et 580 nm pour l’accepteur. Réglez la longueur d’onde d’excitation de la sonde CG FRET liée à la membrane (mSAM15)sur 405 nm et réglez l’émission sur 485 (donneur) et 580 nm (accepteur).
- Pour préparer le mélange maître contenant les rapporteurs, diluer le stock de sonde dans le tampon d’activation à une concentration de 10 μM. Préparer le volume de mélange maître nécessaire en multipliant 10 μL X le nombre de puits de plaque requis. Pour atteindre la concentration finale optimale (2 μM) pour la mesure de la fluorescence des rapporteurs NEmo-2 et mSAM, ajoutez 10 μL du mélange maître à chaque puits (contenant 40 μL d’échantillon, étalon ou blanc) et commencez la lecture. Les rapporteurs NEmo-2 et mSAM surveilleront donc l’activité de l’élastase et de la cathepsine G liées à la membrane, respectivement.
REMARQUE: Un contrôle négatif cellulaire peut être utilisé, par exemple, des cellules qui ne sécrètent pas activement les PSN. Par exemple, l’incubation des rapporteurs avec 3 x 104 progéniteurs de leucocyte HL-60 cellules promyélocytaires représente un contrôle négatif de clivage valide. - Enregistrer le changement dans le rapport donneur/accepteur pendant au moins 20 min ou jusqu’à ce que l’augmentation du signal atteigne un plateau. Analysez les données comme décrit ci-dessus.
- Mesure de l’activité des PSN liés à la membrane par microscopie à fluorescence
- Déterminez le nombre de conditions qui doivent être analysées.
NOTA : Pour chaque mesure d’échantillon d’expectorations, il est recommandé de préparer et d’analyser des témoins positifs (PC) et négatifs (NC) supplémentaires. - Pour chaque mesure, remise en suspension de 3 x 104 cellules d’expectoration dans un volume de PBS de 50 μL dans un tube de 1,5 mL.
- Comme témoin négatif, incuber les expectorations avec un inhibiteur spécifique (Siveléstat, inhibiteur spécifique de NE, ou inhibiteur de la cathepsine G I, inhibiteur spécifique de CG, à une concentration finale de 100 μM). Incuber pendant 10 min à TA.
- Comme témoin positif, incuber des cellules d’expectoration avec l’enzyme appropriée (NE ou CG à 340 nM ou 200 nM, respectivement) pendant 10 min à droite.
- Ajouter 50 μL de PBS contenant le rapporteur fret et une coloration nucléaire (dans une dilution finale de 1:1000) à chaque tube (cellules traitées par témoin positif, cellules traitées par témoin négatif et cellules non traitées) afin d’atteindre une concentration finale de sonde de 2 μM. Incuber pendant 10-20 min à RT.
IMPORTANT: L’ajout d’une tache nucléaire facilite l’imagerie par microscopie à fluorescence car elle permet de rechercher des cellules d’expectoration d’intérêt sans utiliser les canaux de sonde FRET et donc d’éviter le blanchiment du rapporteur. De plus, la tache d’ADN permet de segmenter les cellules d’expectorations en fonction de la forme de leur noyau. Par exemple, les neutrophiles peuvent être facilement identifiés par leurs noyaux multilobulaires. En outre, des informations supplémentaires sur la viabilité des cellules peuvent être récupérées (les neutrophiles avec un noyau plus segmenté sont plus susceptibles d’être vivants).
NOTE: En plus de celle liée à la membrane, l’activité du NE ou du CG lié à l’ADN dans les expectorations humaines peut être mesurée de la même manière au moyen de sondes FRET associées à l’ADN extracellulaire27. Lors de la préparation du mélange maître, H-NE et H-CG peuvent être ajoutés à la concentration de 10 μM et incubés avec des expectorations avant la préparation de la cytospin et de la lame. La quantification du rapport D/A sur l’ADN extracellulaire procède de manière identique à NEmo-2 et mSAM, à la seule différence que les agrégats d’ADN extracellulaire sont segmentés au lieu de cellules individuelles27. - Éteindre la réaction en ajoutant 100 μL de PBS glacé et transférer des échantillons sur de la glace.
- Cytospin le mélange sur des lames de microscopie, sec à l’air, fixer avec du méthanol glacé 10% pendant 10 min, sécher à l’air et monter avec un milieu de montage approprié.
REMARQUE: Les lames de microscopie peuvent être conservées à 4 ° C dans l’obscurité jusqu’à un mois jusqu’à une analyse plus approfondie. - Acquérir des images de microscopie à l’aide d’un microscope confocal avec un objectif d’huile PL APO 40x ou 63x. Pour augmenter la qualité de l’image et réduire le temps d’acquisition, un mode d’acquisition d’image séquentiel est recommandé.
- Imagez d’abord la tache nucléaire via une excitation de 633 nm avec la ligne hélium-néon-laser et enregistrez son émission entre 650 et 715 nm.
- Enregistrer le donneur (coumarine 343) du rapporteur FRET entre 470 et 510 nm lors de l’excitation à 458 nm avec un laser à argon. Acquérir l’émission de l’accepteur sensibilisé (5,6-TAMRA) entre 570 et 610 nm après excitation du seul donneur.
- Enregistrer l’émission directe de l’accepteur dans un canal séparé entre 470 et 510 nm lors de l’excitation optimale de l’accepteur à 561 nm à l’aide du laser à semi-conducteurs pompé par diode (DPSS).
- Réglez le trou d’épingle au début de l’expérience et maintenez-le au cours de la séance d’imagerie.
REMARQUE: En raison de leur petite taille, l’utilisation d’un objectif de microscope 40x ou 63x est recommandée pour visualiser correctement les neutrophiles. Habituellement, les images sont acquises dans plusieurs canaux consécutifs, en commençant par la longueur d’onde d’excitation plus longue pour empêcher le photobleaching du rapporteur lors de l’acquisition.
- Imagez au moins 100 cellules par condition pour obtenir des statistiques concluantes. Pour l’analyse d’images de microscopie, utilisez un logiciel approprié: segmentez les cellules et calculez le rapport D / A pixel par pixel, puis calculez la moyenne ou la médiane d’une région d’intérêt donnée qui est sélectionnée manuellement par l’utilisateur. Pour des résultats représentatifs, voir figure 1.
- Déterminez le nombre de conditions qui doivent être analysées.
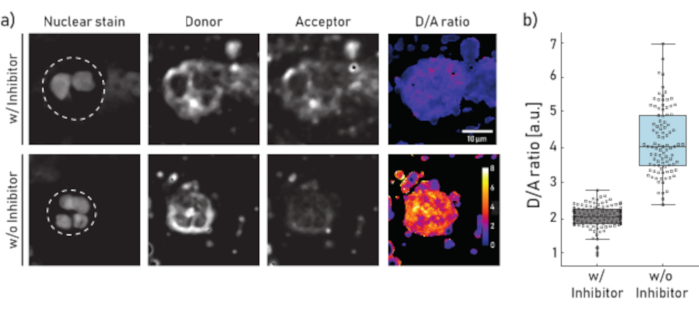
Figure 1: Images représentatives et quantification de l’activité de l’EN liée à la membrane sur des neutrophiles isolés à partir d’expectorations de patients atteints de FK. a) Images représentatives en microscopie confocale de neutrophiles pré-incubées (panneau supérieur) pendant 10 min avec 100 μM de Sivelestat (w/) ou laissées non traitées (p/o) (panneau inférieur) avant ajout de NEmo-2 (2 μM) du déclarant. La première colonne à partir de la gauche montre la tache nucléaire, la seconde le canal donneur, la troisième le canal accepteur et la dernière le rapport D/A calculé obtenu en divisant les canaux donneur et accepteur pixel par pixel. Les bordures de la région d’intérêt (neutrophile unique) sont représentées par une ligne pointillée. L’échelle (10 μm) et les barres d’étalonnage (rapport D/A) sont indiquées. b)Boîtes et diagrammes à points montrant le rapport D/A des neutrophiles d’expectorations d’un patient cf représentatif. Les cellules incubées avec des inhibiteurs et les cellules non traitées sont représentées en gris et en bleu, respectivement. Chaque point représente une cellule (N : w/ inhibiteur = 113 et w/o inhibiteur = 96). Veuillez cliquer ici pour voir une version plus grande de cette figure.
- Mesure de l’activité des PSN liés à la membrane par cytométrie de flux
- Ressusciter 1 x 106 cellules dans 100 μL de PBS dans un tube à fond rond en polystyrène FACS de 5 mL et placer le tube sur de la glace.
- Pour porter les neutrophiles aux expectorations, utilisez les anticorps suivants : CD14 (1:50), CD16 (1:50), CD45 (1:33) et CD66b (1:50). Préparer un mélange maître suffisant pour tous les échantillons. Placez le mélange maître sur la glace dans l’obscurité.
- Configurez la stratégie de gating comme décrit à la figure 2. Les neutrophiles sont fermées comme 7AAD-CD45+CD14-CD16+CD66b+ événements. Les événements dépendants seront ensuite analysés pour leur activité protéase liée à la membrane pour leur donneur (λexc = 405 nm, λem = 450/50 nm) et accepteur (λexc = 405 nm, λem = 585/42 nm) intensités fluorescentes moyennes (IMF).
- Ajouter 2 μL de FcBlock à chaque échantillon et incuber pendant 5 min à RT.
- Ajouter les anticorps choisis à chaque tube, et incuber pendant 30 min sur la glace dans l’obscurité.
- Laver les cellules en ajoutant 2 mL de PBS froid, et centrifuger pendant 5 min à 300 x g et 4 °C. Jeter les cellules surnageantes et remises en suspension dans 200 μL de PBS froid.
- Diviser les 200 μL en deux tubes avec 100 μL chacun et ajouter 5 μL de solution de coloration de viabilité cellulaire dans chaque tube. Placez les tubes sur la glace.
- Ajouter un inhibiteur spécifique approprié du NSP (pour l’utilisation du NE Sivelestat à une concentration finale de 225 μM, pour l’inhibiteur de la cathepsine G I à 100 μM) dans le tube à essai témoin négatif (NC). Incuber les échantillons à RT pendant 10 min dans l’obscurité.
- Ajoutez 100 μL de PBS froid à l’échantillon, filtrez-le à travers un filtre de 40 μm dans un tube FACS propre pour éviter le colmatage de l’instrument.
- Ajouter le rapporteur (pour ne, NEmo-2 à une concentration finale de 4 μM, pour CG, mSAM à une concentration finale de 2 μM) à l’échantillon NC, vortex doucement le tube.
- Commencez à acquérir des cellules incubées avec l’inhibiteur spécifique pour ajuster légèrement, si nécessaire, les portes ainsi que les tensions des PMT rapporteurs.
- Enregistrer au moins 1000 neutrophiles. Conserver l’échantillon à température ambiante.
Remarque : Bien que plus d’événements peuvent être enregistrés, 1000 cellules assurent un bon compromis entre les statistiques appropriées et le temps d’enregistrement. - Procédez avec les tubes suivants (échantillons d’expectorations non traitées) en conséquence.
- Pour enregistrer les changements du rapport D/A dus à l’activité de la protéase liée à la membrane, enregistrez 1000 neutrophiles de chaque tube toutes les 5 à 10 minutes.
REMARQUE: Après un clivage réussi du déclarant FRET, l’intensité des IMF du canal donneur augmentera au fil du temps. L’intensité des IMF du canal accepteur doit diminuer ou rester constante au fil du temps. - Calculer le rapport fret en divisant le donneur par les valeurs de canal accepteur pour les échantillons mesurés sur les neutrophiles simples viables fermées.
- Normaliser les mesures d’échantillon en les divisant par le point de temps correspondant de 0 min (pour des résultats et des analyses représentatifs, voir la figure 2).
NOTA : L’enregistrement d’au moins deux points temporels (c.-à-d. 0 et 10 min) est nécessaire pour une mesure dynamique du changement de rapport D/A. Pour normaliser la mesure de l’activité pour chaque échantillon, le rapport D/A mesuré dans les points temporels ultérieurs (p. ex. 10 min) est divisé par le rapport calculé immédiatement après l’addition de la sonde (0 min).
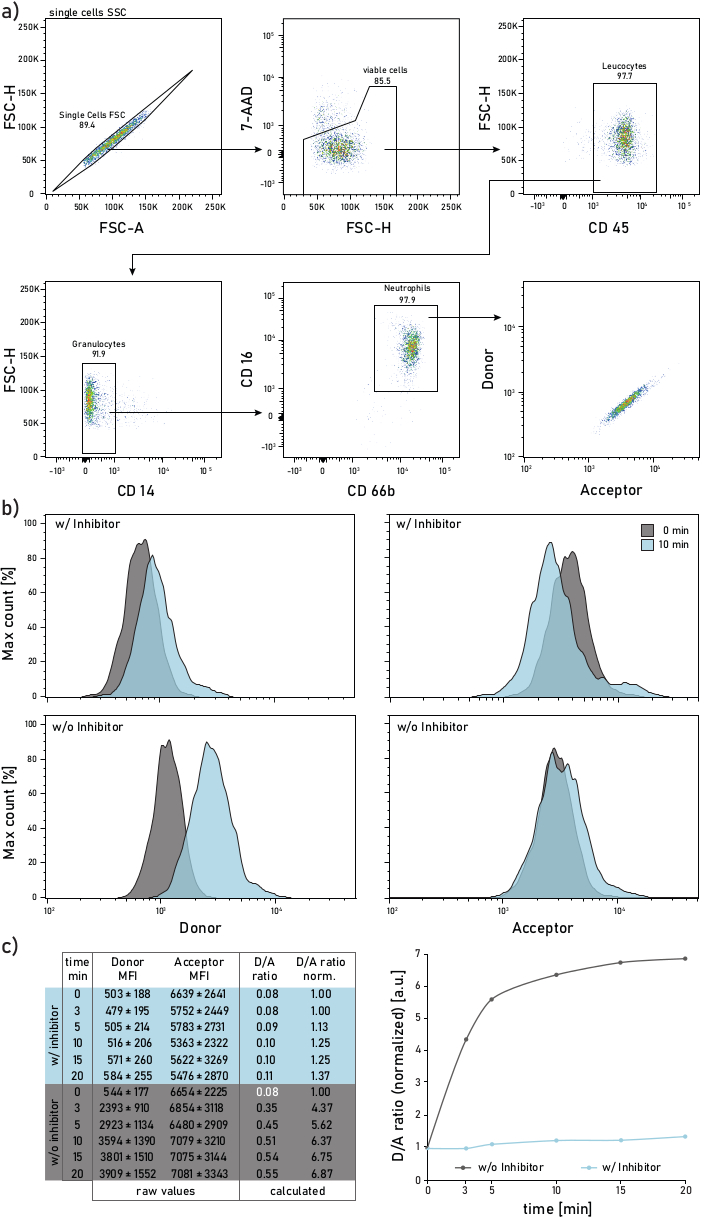
Figure 2: Stratégie de contrôle et graphiques représentatifs de l’activité de l’HOMME liée à la membrane mesurée sur des neutrophiles isolés dans des expectorations de patients atteints de FK. a)Pour les neutrophiles d’expectorations de porte, les anticorps suivants sont utilisés: CD14 (1:50), CD16 (1:50), CD45 (1:33) et CD66b (1:50). Les neutrophiles sont fermées comme 7-AAD-CD45+CD14-CD16+CD66b+ événements. Les événements à comité d’état d’au cœur sont analysés pour leur donneur (λexc= 405 nm, λem= 450/50 nm) et accepteur (λexc= 405 nm, λem= 585/42 nm) intensités moyennes de fluorescence (IMF). b)Histogrammes représentatifs des neutrophiles d’expectoration de CF analysés pour leur activité membrane-liée de Ne. La colonne de gauche montre le signal du donneur, la colonne de droite montre le signal de l’accepteur. La rangée du haut montre les intensités de fluorescence moyennes des cellules traitées avec Sivelestat (w/) pendant 10 minutes avant l’addition du rapporteur. La rangée du bas montre les cellules non traitées (p/o) dont la fluorescence rapporteure est mesurée immédiatement (0 min, gris) et 10 min (bleu) après l’addition du rapporteur. Les neutrophiles sont fermées selon la stratégie indiquée dans le panneau a. c)Le tableau de données montre un ensemble de données représentatif composé de MFI bruts pour le signal donneur et accepteur sur les neutrophiles mesurés sur plusieurs points de temps (0-3-5-10-15-20 min) ainsi que le rapport D / A calculé. Le rapport D/A peut être normalisé, c’est-à-dire au point de temps de 0 min (police blanche). 0 min indique un enregistrement effectué dès que possible après l’ajout du rapporteur au tube d’écoulement avec des cellules d’expectoration colorées. Les données des IMF sont présentées sous forme de moyenne ±'écart-type pour 1000 neutrophiles. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Résultats
Les résultats présentés à la figure 1a illustrent un ensemble de données de microscopie représentatif. Le signal nucléaire est utilisé pour identifier les neutrophiles par leurs noyaux segmentés caractéristiques. La région d’intérêt (ROI) est sélectionnée manuellement (ligne pointillée de la figure 1a). L’image du rapport D/A est calculée en divisant les intensités du canal donneur par les intensités du canal accepteur pixel par pixel. Dans la dernière étape, le rapport D/A moyen par cellule (ROI) est calculé. Dans la figure 1b, chaque point représente la moyenne d’un retour sur investissement (neutrophile). Il est recommandé d’imager et d’évaluer environ 100 cellules par condition.
Une stratégie de contrôle de cytométrie de flux représentative est illustrée à la figure 2a. Un tel contrôle permet de discriminer et d’étudier les neutrophiles des expectorations. Pour éviter les débordements de fluorescence ou les artefacts de compensation, il est recommandé de dédier une ligne laser (p. ex. laser bleu) à la détection de fluorescence de la sonde FRET. La compensation de fluorescence de cytométrie de flux doit être effectuée pour les anticorps et non pour la sonde FRET. La figure 2b illustre la distribution de l’IFM à 0 et 10 min après l’ajout du déclarant. Chaque rangée de la figure 2c indique les valeurs moyennes des IMF du donneur et de l’accepteur pour 1000 neutrophiles d’expectorations. Le ratio D/A est calculé en divisant les IMF du donneur et de l’accepteur. L’évolution temporelle de la figure 2c sur le côté droit montre la progression de la mesure : après une augmentation initiale rapide, le rapport D/A atteint un plateau, en fonction de l’activité de l’enzyme liée à la membrane.
Discussion
Les protocoles rapportés expliquent différentes approches pour quantifier l’activité de l’élastase de neutrophile et de la cathepsine G dans des échantillons humains d’expectorations. Les points critiques pour une mesure réussie de l’activité enzymatique sont i) le calendrier précis et la normalisation de la procédure opératoire et ii) l’utilisation de contrôles négatifs et positifs fiables. Si ces conditions sont remplies, les méthodes décrites ne se limitent pas aux expectorations mais peuvent également être facilement adaptées à l’analyse de l’activité de la protéase dans le sang, les liquides de lavage bronchoalvéolaires et les sections tissulaires ou homogénatées.
Chacune des trois techniques a ses forces et ses limites, qui se complètent souvent. Par exemple, la cytométrie en flux permet l’analyse rapide des populations de cellules rares ainsi que le phénotypage cellulaire, mais manque d’informations de résolution spatiale, ce qui peut être réalisé par microscopie. Au lieu de cela, les mesures de lecteur de plaque permettent l’évaluation parallèle de plusieurs échantillons ou conditions d’une manière à haut débit. Étant donné que les cellules d’expectorations fraîches ne peuvent pas être congelées et stockées, les trois méthodes exigent que les échantillons soient traités rapidement après l’expectoration. Cela limite la flexibilité ou le débit des mesures d’activité liées à la membrane. Le développement d’un protocole de cytométrie en flux qui permet de fixer des cellules après l’addition de sondes et le clivage enzymatique ouvrirait la voie à la mesure parallèle d’un nombre plus élevé de tubes. En outre, une attention particulière devrait être accordée à la manipulation et au stockage des sondes FRET. En fait, certains acides aminés présents dans le substrat peptidique, tels que la méthionine, subissent une oxydation qui entraîne une diminution de la sensibilité du rapporteur. Pour augmenter la durée de conservation du déclarant (estimée à environ trois mois à 20 °C), ils peuvent être stockés dans des aliquotes de petit volume (1-2 μL) sous un gaz inerte tel que l’azote ou l’argon.
Dans la mucoviscidose et d’autres maladies pulmonaires inflammatoires chroniques, il est important de détecter l’inflammation le plus tôt possible, et des biomarqueurs fiables ont le potentiel d’atteindre un tel objectif. La possibilité de détecter l’activité des PSN liée à la surface, qui s’est avérée nocive pour les tissus environnants, également dans des conditions où il n’y a pas ou peu d’activité libre ne, ajoute un autre niveau d’information précieuse, qui peut difficilement être atteint au moyen d’autres méthodes existantes4,11.
Les rapporteurs peuvent être utilisés pour étudier le lien entre l’activité associée au NSP liée à la membrane et la gravité et la progression de la maladie pulmonaire, en particulier à son apparition précoce. Les méthodes peuvent être utilisées pour surveiller l’efficacité du traitement (par exemple, les traitements anti-inflammatoires ou les modulateurs et potentiateurs CFTR très efficaces28)et étudier l’amortissement résultant de l’inflammation causée par les neutrophiles. En outre, les protocoles sont basés sur des procédures d’échantillonnage non invasives qui comportent un risque très faible pour le patient et, par conséquent, peuvent être utilisées à très grande échelle et ouvrir les portes à de nombreuses applications passionnantes.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Ce projet a été soutenu par des subventions du ministère allemand de l’Éducation et de la Recherche (FKZ 82DZL004A1 à M.A.M) et de la Fondation allemande pour la recherche (SFB-TR84TP B08 à M.A.M). Les travaux décrits dans ce manuscrit ont été soutenus par le Centre allemand de recherche pulmonaire (DZL) et l’EMBL Heidelberg grâce à une bourse de doctorat pour M.G. Nous remercions J. Schatterny, S. Butz et H. Scheuermann pour leur assistance technique experte.
matériels
| Name | Company | Catalog Number | Comments |
| 100 µm Nylon cell strainer | Corning Inc. | 431752 | |
| 2300 EnSpire (Multilabel Plate Reader) | PerkinElmer | ||
| 35x10mm Dish, Nunclon Delta | Thermo Fisher Scientific | 150318 | |
| 40 µm Nylon cell strainer | Corning Inc. | 431750 | |
| 50 mL tubes | Sarstedt | 10535253 | |
| 7-AAD, viability dye | Bio Legend | 420404 | 5 µL/100 µL |
| Balance | OHAUS Instruments (Shanghai) Co., Ltd. | PR124 | |
| BD Falcon Round-Bottom Tubes 5 mL | BD Bioscience | 352054 | |
| BD LSRFortessa cell analyzer | BD Bioscience | ||
| black flat bottom 96 well half area plate | Corning Life Science | 3694 | |
| Cathepsin G | Elastin Products Company | SG623 | |
| Cathepsin G Inhibitor I | Merck KGaA | 219372 | |
| Centrifuge 5418R | Eppendorf AG | EP5401000137 | |
| Combitips advanced 1.0 mL | Eppendorf AG | 0030 089 430 | |
| cOmplete proteinase inhibitor | Roche | 11697498001 | |
| Countig chambers improved Neubauer | Glaswarenfabrik Karl Hecht GmbH & Co KG | 40442 | |
| coverslips Ø 25mm | Thermo Fisher Scientific | MENZCB00250RA003 | |
| Cytospin 4 | Thermo Fisher Scientific | ||
| DRAQ5 (nuclear stain) | BioStatus Limited | DR50050 | 1:10000 |
| FACSDiva software, v8.0.1 | BD Bioscience | ||
| FcBlock | BD Bioscience | 564219 | |
| Fiji (Fiji Is Just ImageJ) | fiji.sc | ||
| Flow Jo software, v10 | TreeStar | ||
| FluoQ Plugin, v3-97 | |||
| Heraeus Megafuge 16R | Thermo Fisher Scientific | ||
| Human Sputum Leucocyte Elastase | Elastin Products Company | SE563 | |
| Leica SP8 confocal microscope | Leica Microsystems | ||
| Mini Rock-Shaker | PEQLAB Biotechnologie GmbH | MR-1 | |
| mouse anti-human CD14, Pe-Cy7, clone M5E2 | BD Bioscience | 557742 Lot:8221983 | 1:50 |
| mouse anti-human CD16, AF700, clone 3G8 | BD Bioscience | 557820 Lot:8208791 | 1:50 |
| mouse anti-human CD45, APC-Cy7, clone 2D1 | BD Bioscience | 557833 Lot:8059688 | 1:33 |
| mouse anti-human CD66b, PE/Dazzel 594, clone G10F5 | BioLegend | 305122 Lot:B241921 | 1:50 |
| mSAM | in house | 2 mM | |
| Multipette plus | Eppendorf AG | ||
| NEmo-1 | SiChem | SC-0200 | 1 mM |
| NEmo-2E | SiChem | SC-0201 | 2 mM |
| Pari Boy SX with an LC Sprint jet nebulizer | Pari | 085G3001 | |
| phosphate buffered saline | Gibco | 10010-015 | |
| ROTI Histokitt (mounting medium) | Carl Roth GmbH + Co.KG | 6638.1 | |
| Salbutamol | Teva GmbH | ||
| Sivelestat | Cayman Chemicals | 17779 | |
| Sputolysin | Calbiochem | 560000-1SET | |
| sSAM | in house | 2 mM | |
| SuperFrost Plus Adhesion slides | Thermo Fisher Scientific | 10149870 | |
| Trypan Blue solution | Sigma-Aldrich | T8154 |
Références
- Korkmaz, B., Moreau, T., Gauthier, F. Neutrophil elastase, proteinase 3 and cathepsin G: Physicochemical properties, activity and physiopathological functions. Biochimie. 90 (2), 227-242 (2008).
- Sheshachalam, A., Srivastava, N., Mitchell, T., Lacy, P., Eitzen, G. Granule Protein Processing and Regulated Secretion in Neutrophils. Frontiers in Immunology. 5, 448 (2014).
- Pham, C. T. N. Neutrophil serine proteases: Specific regulators of inflammation. Nature Reviews Immunology. 6 (7), 541-550 (2006).
- Gehrig, S., et al. Lack of neutrophil elastase reduces inflammation, mucus hypersecretion, and emphysema, but not mucus obstruction, in mice with cystic fibrosislike lung disease. American Journal of Respiratory and Critical Care Medicine. 189 (9), 1082-1092 (2014).
- McKelvey, M. C., Weldon, S., McAuley, D. F., Mall, M. A., Taggart, C. C. Targeting proteases in cystic fibrosis lung disease paradigms, progress, and potential. American Journal of Respiratory and Critical Care Medicine. 201 (2), 141-147 (2020).
- Clancy, D. M., et al. Extracellular Neutrophil Proteases Are Efficient Regulators of IL-1, IL-33, and IL-36 Cytokine Activity but Poor Effectors of Microbial Killing. Cell Reports. 22 (11), 2937-2950 (2018).
- Giacalone, V. D., Margaroli, C., Mall, M. A., Tirouvanziam, R. Neutrophil adaptations upon recruitment to the lung: New concepts and implications for homeostasis and disease. International Journal of Molecular Sciences. 21 (3), 1-21 (2020).
- Sly, P. D., et al. Risk Factors for Bronchiectasis in Children with Cystic Fibrosis. New England Journal of Medicine. 368 (21), 1963-1970 (2013).
- Owen, C. A., Campbell, M. A., Sannes, P. L., Boukedes, S. S., Campbell, E. J. Cell surface-bound elastase and cathepsin G on human neutrophils: A novel, non-oxidative mechanism by which neutrophils focus and preserve catalytic activity of serine proteinases. Journal of Cell Biology. 131 (3), 775-789 (1995).
- Brinkmann, V., et al. Neutrophil Extracellular Traps Kill Bacteria. Science. 303 (5663), 1532-1535 (2004).
- Margaroli, C., et al. Elastase Exocytosis by Airway Neutrophils Associates with Early Lung Damage in Cystic Fibrosis Children. American Journal of Respiratory and Critical Care Medicine. , (2018).
- Owen, C., Campbell, M. A., Sannes, P. L., Boukedes, S. S., Carolina, N. Cell surface-bound elastase and cathepsin G on human neutrophils: a novel, non-oxidative mechanism by which neutrophils focus and preserve catalytic activity of serine proteinases. The Journal of cell biology. 131 (3), 775-789 (1995).
- Garland, M., Yim, J. J., Bogyo, M. A Bright Future for Precision Medicine: Advances in Fluorescent Chemical Probe Design and Their Clinical Application. Cell chemical biology. 23 (1), 122-136 (2016).
- Gehrig, S., Mall, M. A., Schultz, C. Spatially resolved monitoring of neutrophil elastase activity with ratiometric fluorescent reporters. Angewandte Chemie - International Edition. 51 (25), 6258-6261 (2012).
- Guerra, M., et al. Cathepsin G Activity as a New Marker for Detecting Airway Inflammation by Microscopy and Flow Cytometry. ACS Central Science. 5 (3), 539-548 (2019).
- Hu, H. Y., et al. In vivo imaging of mouse tumors by a lipidated cathepsin S substrate. Angewandte Chemie - International Edition. 53 (29), 7669-7673 (2014).
- Korkmaz, B., et al. Measuring elastase, proteinase 3 and cathepsin G activities at the surface of human neutrophils with fluorescence resonance energy transfer substrates. Nature Protocols. 3 (6), 991-1000 (2008).
- Craven, T. H., et al. Super-silent FRET Sensor Enables Live Cell Imaging and Flow Cytometric Stratification of Intracellular Serine Protease Activity in Neutrophils. Scientific Reports. 8 (1), 13490 (2018).
- Mu, J., et al. A small-molecule fret reporter for the real-time visualization of cell-surface proteolytic enzyme functions. Angewandte Chemie - International Edition. 53 (52), 14357-14362 (2014).
- Hagner, M., et al. New method for rapid and dynamic quantification of elastase activity on sputum neutrophils from patients with cystic fibrosis using flow cytometry. European Respiratory Journal. 55 (4), 1902355 (2020).
- Dittrich, A. S., et al. Elastase activity on sputum neutrophils correlates with severity of lung disease in cystic fibrosis. European Respiratory Journal. , 1701910 (2018).
- Cobos-Correa, A., Trojanek, J. B., Diemer, S., Mall, M. A., Schultz, C. Membrane-bound FRET probe visualizes MMP12 activity in pulmonary inflammation. Nature Chemical Biology. 5 (9), 628-630 (2009).
- Hu, H. -. Y., et al. FRET-based and other fluorescent proteinase probes. Biotechnology Journal. 9 (2), 266-281 (2014).
- Trojanek, J. B., et al. Airway mucus obstruction triggers macrophage activation and matrix metalloproteinase 12-dependent emphysema. American Journal of Respiratory Cell and Molecular Biology. 51 (5), 709-720 (2014).
- Wagner, C. J., Schultz, C., Mall, M. A. Neutrophil elastase and matrix metalloproteinase 12 in cystic fibrosis lung disease. Molecular and Cellular Pediatrics. 3 (1), 25 (2016).
- Gaggar, A., et al. The role of matrix metalloproteinases in cystic fibrosis lung disease. The European respiratory journal. 38 (3), 721-727 (2011).
- Guerra, M., et al. Protease FRET Reporters Targeting Neutrophil Extracellular Traps. Journal of the American Chemical Society. 142 (48), 20299-20305 (2020).
- Middleton, P. G., et al. Elexacaftor-Tezacaftor-Ivacaftor for Cystic Fibrosis with a Single Phe508del Allele. New England Journal of Medicine. 381 (19), 1809-1819 (2019).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon