Method Article
Мониторинг активности нейтрофильной эластазы и катепсина G в образцах мокроты человека
* Эти авторы внесли равный вклад
В этой статье
Резюме
Описанные в настоящем описании протоколы обеспечивают руководство по визуализации и количественной оценке активности нейтрофильных протеаз в мокроте человека. Применение такого анализа простирается от оценки противовоспалительных методов лечения до валидации биомаркеров, скрининга лекарств и крупных когортных клинических исследований.
Аннотация
Протеазы являются регуляторами бесчисленных физиологических процессов, и точное исследование их деятельности остается интригующей биомедицинской проблемой. Среди ~ 600 протеаз, кодируемых геномом человека, нейтрофильные сериновые протеазы (NSP) тщательно исследуются на их участие в возникновении и прогрессировании воспалительных состояний, включая респираторные заболевания. Уникально, что секретируемые НСП не только диффундируют во внеклеточных жидкостях, но и локализуются в плазматических мембранах. Во время формирования внеклеточной ловушки нейтрофилов (NETs) НСП становятся неотъемлемой частью секретируемого хроматина. Такое сложное поведение делает понимание патофизиологии НСП сложной задачей. Здесь показаны подробные протоколы для визуализации, количественной оценки и различения активности свободной и связанной с мембраной нейтрофильной эластазы (NE) и катепсина G (CG) в образцах мокроты. NE и CG являются НСП, деятельность которых имеет плейотропную роль в патогенезе муковисцидоза (МВ) и хронической обструктивной болезни легких (ХОБЛ): они способствуют ремоделированию тканей, регулируют иммунные реакции и коррелируют с тяжестью заболевания легких. Протоколы показывают, как отделить жидкую и клеточную фракцию, а также выделение нейтрофилов из мокроты человека для количественной оценки ферментативной активности с помощью маломолекулярных репортеров на основе резонансного переноса энергии Фёрстера (FRET). Для сбора конкретной информации об относительной роли активности NE и CG показания FRET могут быть измерены с помощью различных технологий: i) измерения считывателя пластин in vitro позволяют высокопроизводительно и объемно обнаруживать активность протеазы; ii) конфокальная микроскопия пространственно-временно разрешает мембранно-связанную активность на поверхности клетки; iii) маломолекулярная проточная цитометрия FRET позволяет быстро оценивать противовоспалительные методы лечения с помощью количественной оценки активности одноклеточной протеазы и фенотипирования. Внедрение таких методов открывает двери для изучения патобиологии НСП и их потенциала в качестве биомаркеров тяжести заболевания муковисцидозом и ХОБЛ. Учитывая их потенциал стандартизации, надежное считывание и простоту передачи, описанные методы немедленно могут быть распределены для внедрения в исследовательских и диагностических лабораториях.
Введение
Нейтрофильная эластаза (NE), катепсин G (CG), протеиназа 3 (PR3) и нейтрофильная сериновая протеаза 4 (NSP4) являются четырьмя нейтрофильными сериновыми протеазами (NSP)1. Они хранятся вместе с миелопероксидазой в первичных или азурофильных гранулах нейтрофилов. Из-за их повышенного протеолитического содержания секреция первичных гранул жестко регулируется, и нейтрофилы должны последовательно оспариваться с помощью прайминговых и активирующих стимулов2.
Внутри фаголизосомы НСП функционируют как внутриклеточные бактерицидные агенты3. При секреции НСП становятся сильными медиаторами воспаления: они расщепляют цитокины и поверхностные рецепторы, активируя параллельные провоспалительныепути 3. Важно отметить, что воспалительные состояния имеют неконтролируемую секрецию НСП. Например, в воспаленных дыхательных путях чрезмерная активность NE вызывает гиперсекрецию слизи, метаплазию клеток-шарманов, инактивацию CFTR и ремоделирование внеклеточного матрикса4,5. Катепсин G также участвует в воспалении: он специфически расщепляет и активирует два компонента семейства IL-1, IL-36α и IL-36β6. В сочетании с NE CG расщепляет рецепторы, активированные протеазой, на эпителии дыхательных путей, а также активирует TNF-α и IL-1β.
Эндогенные антипротеазы, такие как альфа-1-антитрипсин, альфа-1-антихимотрипсин и секреторный ингибитор лейкоцитарной протеазы, регулируют активность нейтрофильной эластазы и катепсина G5. Однако в ходе прогрессирования заболевания легких непрерывная секреция протеаз превышает стехиометрически антипротеазный щит, что приводит к неразрешающей нейтрофилии в дыхательных путях, обострению воспаления и повреждению тканей5,7. Хотя было показано, что концентрация и активность NE в растворимых фракциях дыхательных путей пациента являются многообещающим биомаркером тяжести заболевания8,NE и CG также связываются с нейтрофильной плазматической мембраной и внеклеточной ДНК посредством электростатических взаимодействий9,10, где они становятся менее доступными для антипротеаз. Важно отметить, что доклинические исследования определили сценарий, в котором клеточная поверхностно-ассоциированная активность протеазы проявляется раньше и/или независимо от ее растворимогоаналога4,11. Фактически, чтобы стать обнаруживаемой, активность свободной протеазы сначала должна подавить антипротеазный щит. Вместо этого на поверхности клетки мембранно-связанная активность протеазы остается, по меньшей мере, частично неповрежденной из-за недоступности крупных ингибиторов к клеточной плазматической мембране12. Такое сложное поведение протеазы имеет важные последствия для начала и распространения воспаления, опосредованного нейтрофилами, и поэтому должно быть исследовано с помощью точных и информативных инструментов.
На протяжении многих лет зонды на основе резонансного переноса энергии Förster (FRET) находили многочисленные биомедицинские применения в качестве инструментов, которые эффективно и быстро оценивают специфическую активность протеазы в образцах человека13. Для функционирования протеазы репортеры состоят из мотива распознавания (то есть пептида), который распознается ферментом-мишенью и полагается на FRET, физический процесс, где при возбуждении донорский флуорофор передает энергию молекуле-акцептору. Обработка, управляемая ферментом на репортере, а именно расщепление распознаваемой части, приводит к тому, что акцептор диффундирует от донора: поэтому активность фермента измеряется как зависящие от времени изменения донора по сравнению с акцепторной флуоресценцией. Такое считывание является самонормализующимся и ратиометрическим, поэтому на него лишь незначительно влияют условия окружающей среды, такие как рН и концентрация в локальном зонде. NEmo-114 и sSAM15 являются зондами FRET, которые сообщают конкретно об активности NE и CG соответственно. Однако такие репортеры не локализуются конкретно в каком-либо клеточном компартменте, поэтому они используются для мониторинга активности протеазы, присутствующей в жидкостях человека. Чтобы контролировать активность протеазы пространственно локализованным образом, мы и другие разработали зонды FRET, которые связываются с субклеточными компонентами через молекулярные метки14,15,16,17,18,19. Такая синтетическая стратегия позволила разработать NEmo-2 и mSAM, два зонда FRET, оснащенные липидными якорями, которые локализуются на плазматической мембране. Эти репортеры способствовали более глубокому пониманию протеаз NE и CG при муковисцидозе и хронических обструктивных заболеваниях легких14,15.
Здесь представлены подробные протоколы для визуализации и количественной оценки растворимой и связанной с мембраной активности NE и CG в мокроте человека с помощью зондов NEmo и SAM серий FRET. Для решения различных аспектов патофизиологии NSP и предоставления массива методов, которые могут быть использованы в соответствии с потребностями конкретного пользователя, показан анализ с помощью флуоресцентной спектроскопии, флуоресцентной микроскопии и проточной цитометрии.
протокол
Следующие протоколы описывают анализ, выполненный на мокроте человека. Обработка образцов человека была одобрена комитетом по этике Гейдельбергского университета, и письменное информированное согласие было получено от всех пациентов или их родителей / законных опекунов (S-370/2011) и здоровых контрольных (S-046/2009).
ПРИМЕЧАНИЕ: Следующие протоколы описывают пробоподготовку и количественную оценку активности нейтрофильных сериновых протеаз (NSP). Экспериментальные процедуры, представленные в настоящем описании, сосредоточены на измерении активности мокроты человека и нейтрофильной эластазы14,20,21 (NE) или катепсина G15 (CG). Однако незначительные изменения в протоколе пробоподготовки делают возможным анализ клеток крови и гомогенатов опухоли. Кроме того, активность матриксной металлопротеиназы 12 и катепсина S может быть исследована аналогичным образом с помощью специализированных зондов FRET22,23,24,25,26.
1. Пробоподготовка: изоляция клеток и разделение супернатантов
ПРИМЕЧАНИЕ: По возможности обработку мокроты следует проводить в течение 120 мин после отхаркивания и хранить мокроту на льду до дальнейшей обработки.
- Если спонтанное отхаркивание мокроты невозможно, индуцируйте мокроту, как описаноранее 19. Кратко вдохните 200 мкг β-2-рецептор-антагониста сальбутамола перед началом процедуры индукции мокроты. После этого вдыхайте гипертонический (6%) физиологический раствор в течение 15 мин с помощью небулайзера. Соберите отхаркившую мокроту в чашку Петри.
- Отделите сгустки слизи из слюны в чашку Петри с помощью кончика пипетки.
- Взвесьте слизь.
ПРИМЕЧАНИЕ: Средний вес образцов слизи составляет 0,8 г (варьируется от 0,1 г до 5 г); 0,1 г обычно достаточно для выполнения указанных процедур. - Добавьте в мокроту 4 части (v/w) 10% Спутолизина (в PBS) (например: 4 мл 10% Спутолизина на каждый грамм мокроты).
ВНИМАНИЕ: Спутолизин состоит из концентрированного дитиотрейтола в фосфатном буфере, поэтому относитесь к нему с осторожностью. - Инкубировать смесь при комнатной температуре (RT) на качающей шейкере в течение 15 мин до растворения слизи. По соображениям безопасности поместите шейкер в вытяжной капюшон.
- Утвеняют реакцию добавлением такого же объема холодного PBS (например: 1 мл холодного PBS на каждый мл 10% Sputolysin).
- Перемешать путем пипетки до получения однородного раствора.
- Отфильтруйте смесь через сетчатый фильтр нейлоновых клеток 100 мкм в пробирку с 50 мл.
- Повторите этап фильтрации через сетчатый фильтр нейлоновых клеток 40 мкм.
- Центрифугировать раствор в течение 10 мин при 300 х г при 4 °С.
- Осторожно переложите фракцию надменителя в свежую трубку и храните на льду.
ПРИМЕЧАНИЕ: Фракции супернатантов могут храниться при -20 °C или -80 °C до дальнейшего анализа. - Аккуратно повторно суспендируйте гранулу клетки в 500 мкл холодного PBS и поместите ее на лед.
ПРИМЕЧАНИЕ: Фракция клеток должна быть немедленно обработана.
2. Измерение активности нейтрофильной сериновой протеазы
ПРИМЕЧАНИЕ: Здесь представлены различные методы количественной оценки активности НСП с помощью репортеров FRET. Выбор технологии продиктован конкретным биомедицинским вопросом и целью эксперимента. Представленные зонды были тщательно протестированы на их специфичность по отношению к набору легочных соответствующих ферментов14,15. Хотя зонды специфичны для их целевого фермента, всегда проверяйте специфичность зонда на интересуемом клиническом образце. Это может быть достигнуто путем инкубации образца со специфическим ингибитором протеазы перед добавлением зонда, что должно отменить любое увеличение соотношения D/A.
- Количественная оценка активности растворимых НСП с помощью флуориметра или анализа считывателя пластин
ПРИМЕЧАНИЕ: Активность протеазы в растворимых фракциях образца может быть обнаружена с помощью любого прибора, способного к флуоресцентной детекции.- Оттаивать ферменты на льду.
- До использования храните NE и CG в кислом буфере хранения (50 мМ ацетата натрия, 200 мМ NaCl, рН 5,5) для предотвращения саморасщепления.
- Чтобы установить стандартную кривую фермента, подготовьте последовательное разбавление фермента 1:2 (33,9 - 0,271 нМ для NE; 42,6 - 0,333 нМ для CG) в буфере активации (10 мМ Tris-HCl, 500 мМ NaCl при рН 7,5). Буфер активации имеет нейтральный рН и, следовательно, позволяет эффективно протекать ферментативный катализ.
- Для приготовления наивысшей стандартной концентрации (концентрация NE: 33,9 нМ) разбавляют 1 мкл NE (33,9 мкМ) в 999 мкл буфера активации.
- Для приготовления второго стандарта (концентрация NE: 16,95 нМ) смешайте 200 мкл первого разбавления с 200 мкл буфера активации.
- Приступайте соответственно к приготовлению оставшихся разведений 1:2.
- Последний стандарт, который является пустым, состоит из чистого буфера активации. Рекомендуется измерение технических дубликатов или тройных размеров. Во время стандартной и пробоподготовки старайтесь держать флаконы на льду.
- Параллельно со стандартным препаратом разводят образцы мокроты в буфер активации. Разбавляют образцы человека перед оценкой их протеазной активности, чтобы они оставались в линейном диапазоне увеличения репортерного сигнала (соотношение донор/акцептор). Если бы образцы пациентов оставались неразбавленными, расщепление происходило бы слишком быстро для надежной подгонки. Поскольку здоровая донорская мокрота содержит меньше активных протеаз по сравнению с образцами от пациентов с муковисцидозом и ХОБЛ, обычно проводятся различные разведения (1:10 для здорового супернатанта мокроты, 1:20-500 для супернатанта мокроты пациентов с ХОБЛ или МУКОВ).
ПРИМЕЧАНИЕ: Чтобы количественно измерить активность протеазы в образцах, где их концентрация неизвестна, стандартная кривая с известными концентрациями ферментов должна измеряться параллельно, в идеале на одной и той же пластине. Концентрация активного фермента в мокроте человека рассчитывается путем интерполяции склонов, измеренных в образцах мокроты человека, с теми, которые измеряются стандартными кривыми. - Перед подготовкой образцов к измерению настройте прибор. Установите длину волны возбуждения для зонда NE FRET (NEmo-114)на 354 нм, а длину волны обнаружения на 400 нм для донора и 490 нм для акцептора. Установите длину волны возбуждения для зонда CG FRET (sSAM15)на 405 нм, а излучение установите на 485 (донор) и 580 нм (акцептор).
- Добавьте 40 мкл образцов, стандартных или заготовок, в скважины черной пластины с половиной площади 96 скважин.
- Чтобы приготовить мастер-микс, содержащий репортеры (концентрация репортера в мастер-миксе: 10 мкМ), разбавляют запас зонда (1 мМ в ДМСО) 1:100 в буфере активации. Подготовьте необходимый объем основной смеси, умножив 10 мкл на количество требуемых пластинчатых скважин. Чтобы достичь оптимальной конечной концентрации (2 мкМ) для измерения флуоресценции репортеров NEmo-1 и sSAM, добавьте 10 мкл главной смеси в каждую скважину (содержащую 40 мкл образца, стандартного или пустого) и начните считывание. Поэтому репортеры NEmo-1 и sSAM будут контролировать активность растворимой нейтрофильной эластазы и катепсина G соответственно.
ПРИМЕЧАНИЕ: Если инжектор реагента недоступен, обязательно запустите считывание как можно скорее после репортерного добавления к образцам. - Начинают измерение пластинчатого считывателя и регистрируют увеличение соотношения донор/акцептор каждые 60-90 секунд в течение не менее 20 мин или до тех пор, пока увеличение сигнала не достигнет плато.
- После экспорта данных рассчитайте соотношение донор/акцептор (отношение D/A), разделив единицы относительной флуоресценции донора (RFU) на акцептор RFU для каждой точки времени и образца.
- Рассчитайте среднее значение коэффициента D/A и стандартное отклонение каждого образца.
- Определите наклон в пределах линейного роста изменения отношения D/A. Наклон является индикатором скорости расщепления ферментов для зонда FRET. Рассчитайте концентрацию активного фермента в мокроте, установив склоны линейной регрессии, полученные из образцов человека, с теми, которые рассчитаны по стандарту фермента.
- Количественная оценка активности NSP с мембраной с помощью флуориметра или анализа считывателя пластин
- Изолируйте клетки мокроты, как описано выше. Повторное суспенд 3 х10 4 ячейки в объеме 40 мкл PBS. Добавьте ячейки в считыватель пластин хорошо.
- Настройте инструмент. Установите длину волны возбуждения для мембранно-связанного зонда NE FRET (NEmo-214)на 405 нм, а длину волны обнаружения на 485 нм для донора и 580 нм для акцептора. Установите длину волны возбуждения для мембранно-связанного зонда CG FRET (mSAM15)на 405 нм, а излучение на 485 (донор) и 580 нм (акцептор).
- Чтобы приготовить мастер-микс, содержащий репортеры, разбавьте запас зонда в буфере активации до концентрации 10 мкМ. Подготовьте необходимый объем основной смеси, умножив на 10 мкл X количество требуемых пластинчатых скважин. Для достижения оптимальной конечной концентрации (2 мкМ) для измерения флуоресценции репортеров NEmo-2 и mSAM добавьте 10 мкл основной смеси в каждую скважину (содержащую 40 мкл образца, стандартного или пустого) и начните считывание. Поэтому репортеры NEmo-2 и mSAM будут контролировать активность нейтрофильной эластазы и катепсина G, связанных с мембраной, соответственно.
ПРИМЕЧАНИЕ: Клеточный отрицательный контроль может быть использован, например, клетками, которые активно не секретируют НСП. Например, инкубация репортеров с 3 х 104 лейкоцитарными прародителями HL-60 промиелоцитарных клеток представляет собой действительный отрицательный контроль расщепления. - Регистрировать изменение соотношения донор/акцептор в течение не менее 20 мин или до тех пор, пока увеличение сигнала не достигнет плато. Проанализируйте данные, как описано выше.
- Измерение активности NSP с мембранной связкой с помощью флуоресцентной микроскопии
- Определите количество условий, которые необходимо проанализировать.
ПРИМЕЧАНИЕ: Для каждого измерения образца мокроты рекомендуется подготовка и анализ дополнительного положительного (ПК) и отрицательного (NC) контроля. - Для каждого измерения повторно суспендирует 3 х10 4 клетки мокроты в объеме 50 мкл PBS в трубке 1,5 мл.
- В качестве отрицательного контроля инкубируют клетки мокроты со специфическим ингибитором (Sivelestat, специфический ингибитор NE, или ингибитор катепсина G I, специфический ингибитор CG, в конечной концентрации 100 мкМ). Инкубировать в течение 10 мин на РТ.
- В качестве положительного контроля инкубируют клетки мокроты соответствующим ферментом (NE или CG при 340 нМ или 200 нМ соответственно) в течение 10 мин при РТ.
- Добавьте 50 мкл PBS, содержащего репортер FRET и ядерное пятно (в конечном разведении 1:1000) в каждую трубку (положительные контрольные обработанные клетки, отрицательные контрольные обработанные клетки и необработанные клетки), чтобы достичь конечной концентрации зонда 2 мкМ. Инкубировать в течение 10-20 мин при RT.
ВАЖНО: Добавление ядерного пятна облегчает флуоресцентную микроскопию, поскольку позволяет искать интересующие клетки мокроты без использования зондовых каналов FRET и, следовательно, избежать репортерного отбеливания. Кроме того, пятно ДНК позволяет сегментировать клетки мокроты в соответствии с формой их ядра. Например, нейтрофилы можно легко идентифицировать по их многодольковых ядрам. Также может быть получена дополнительная информация о жизнеспособности клеток (нейтрофилы с более сегментоядерным ядром с большей вероятностью будут живыми).
ПРИМЕЧАНИЕ: В дополнение к мембраносвязанному, активность ДНК-связанного NE или CG в мокроте человека может быть измерена таким же образом с помощью H-NE и H-CG, внеклеточных ДНК-ассоциирующих зондовFRET 27. При приготовлении мастер-микса H-NE и H-CG могут быть добавлены в концентрации 10 мкМ и инкубированы с мротой перед цитоспином и горкой приготовления. Количественное измерение соотношения D/A на внеклеточной ДНК протекает идентично NEmo-2 и mSAM, с той лишь разницей, что внеклеточные агрегаты ДНК сегментированы вместо одиночных клеток27. - Погасите реакцию, добавив 100 мкл ледяного PBS, и перенесите образцы на лед.
- Цитоспин смеси на микроскопических слайдах, сушка на воздухе, фиксируется ледяным холодным метанолом 10% в течение 10 мин, воздухом сухой и монтируется с соответствующей монтажной средой.
ПРИМЕЧАНИЕ: Слайды микроскопии могут храниться при 4 °C в темноте до одного месяца до дальнейшего анализа. - Получение микроскопических изображений с помощью конфокального микроскопа с масляным объективом PL APO 40x или 63x. Для повышения качества изображения и сокращения времени получения рекомендуется использовать режим последовательной получения изображения.
- Сначала визуйте ядерное пятно через возбуждение 633 нм с помощью гелий-неоново-лазерной линии и запишите его излучение между 650 и 715 нм.
- Запишите донора (кумарин 343) репортера FRET между 470 и 510 нм при возбуждении на 458 нм с помощью аргонового лазера. Приобретите сенсибилизированное акцепторное (5,6-TAMRA) излучение между 570 и 610 нм после возбуждения единственного донора.
- Регистрировать прямое акцепторное излучение в отдельном канале между 470 и 510 нм при оптимальном возбуждении акцептора при 561 нм с помощью твердотельного лазера с диодной накачкой (DPSS).
- Установите точечный отверстие в начале эксперимента и поддерживайте его в течение сеанса визуализации.
ПРИМЕЧАНИЕ: Из-за их небольшого размера для правильной визуализации нейтрофилов рекомендуется использовать объектив микроскопа 40x или 63x. Обычно изображения получаются в нескольких последовательных каналах, начиная с более длинной длины волны возбуждения, чтобы предотвратить фотоотбеливание репортера во время захвата.
- Изображение не менее 100 ячеек на условие для окончательной статистики. Для микроскопического анализа изображений используют соответствующее программное обеспечение: сегментируйте ячейки и вычисляйте соотношение D/A на попиксельной основе, после чего вычисляйте среднее или медиану заданной области интереса, которая выбирается пользователем вручную. Репрезентативные результаты см. на рисунке 1.
- Определите количество условий, которые необходимо проанализировать.
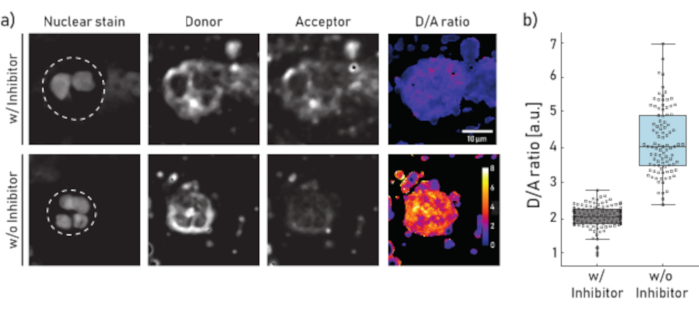
Рисунок 1:Репрезентативные изображения и количественная оценка мембранно-связанной NE-активности на нейтрофилах, выделенных из мокроты пациента с муковисцидозом. a) Репрезентативные конфокальные микроскопические изображения нейтрофилов, предварительно инкубированных (верхняя панель) в течение 10 мин со 100 мкМ Сивелестата (ж/) или оставленных без обработки (без/о) (нижняя панель) перед добавлением репортера NEmo-2 (2 мкМ). В первом столбце слева показано ядерное пятно, во втором — донорский канал, в третьем — акцепторный канал и в последнем — расчетное соотношение D/A, полученное путем деления донорского и акцепторного каналов на попиксельной основе. Границы интересуемой области (одиночный нейтрофил) изображены пунктирной линией. Указаны шкала (10 мкм) и калибровочные стержни (отношение D/A). b)Коробочные и точечные графики, показывающие соотношение D/A нейтрофилов мокроты у репрезентативного пациента с муковисцидозом. Клетки, инкубированные с ингибиторными и необработанными клетками, показаны серым и синим цветом соответственно. Каждая точка представляет одну клетку (N: w/ ингибитор = 113 и без ингибитора = 96). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
- Измерение активности NSP с мембраной с помощью проточной цитометрии
- Повторно суспендирует 1 х 106 ячеек в 100 мкл PBS в 5 мл полистирольной трубки FACS с круглым дном и поместите трубку на лед.
- Для защиты нейтрофилов мокроты используйте следующие антитела: CD14 (1:50), CD16 (1:50), CD45 (1:33) и CD66b (1:50). Подготовьте достаточное количество мастер-микса для всех образцов. Поместите мастер-микс на лед в темное время суток.
- Настройте стратегию гайинга, как описано на рисунке 2. Нейтрофилы закрыты как 7AAD-CD45+CD14-CD16+CD66b+ события. Затем закрытые события будут проанализированы на их мембранно-связанную протеазную активность для их донора (λexc = 405 нм, λem = 450/50 нм) и акцепторной (λexc = 405 нм, λem = 585/42 нм) средней интенсивности флуоресцентной активности (MFIs).
- Добавьте 2 мкл FcBlock к каждому образцу и инкубируйте в течение 5 минут на RT.
- Добавьте выбранные антитела в каждую трубку, и высиживая в течение 30 мин на льду в темноте.
- Промыть клетки, добавив 2 мл холодного PBS, и центрифугу в течение 5 мин при 300 х г и 4 °C. Выбрасывайте супернатант и повторно суспендировали клетки в 200 мкл холодного PBS.
- Разделите 200 мкл в двух пробирках по 100 мкл в каждой и добавьте 5 мкл раствора для окрашивания жизнеспособности клеток в каждую пробирку. Поместите трубки на лед.
- Добавьте соответствующий специфический ингибитор NSP (для применения NE Sivelestat при конечной концентрации 225 мкМ, для CG используют ингибитор катепсина G I при 100 мкМ) в отрицательную контрольную (NC) пробирку. Инкубировать образцы на RT в течение 10 мин в темноте.
- Добавьте 100 мкл холодного PBS в образец, отфильтруйте его через фильтр 40 мкм в чистой трубке FACS, чтобы предотвратить засорение инструмента.
- Добавьте репортер (для NE, NEmo-2 при конечной концентрации 4 мкМ, для CG, mSAM при конечной концентрации 2 мкМ) к образцу NC, осторожно вихрев трубку.
- Начните приобретать клетки, инкубированные со специфическим ингибитором, чтобы немного отрегулировать, при необходимости, затворы, а также напряжения репортерных PMT.
- Регистрируют не менее 1000 нейтрофилов. Держите образец при комнатной температуре.
ПРИМЕЧАНИЕ: Хотя можно записать больше событий, 1000 ячеек обеспечивают хороший компромисс между правильной статистикой и временем записи. - Приступайте к следующим пробиркам (необработанным образцам мокроты) соответственно.
- Чтобы записать изменения в соотношении D/A из-за мембранно-связанной протеазной активности, регистрируют 1000 нейтрофилов из каждой трубки каждые 5-10 мин.
ПРИМЕЧАНИЕ: После успешного декольте репортера FRET интенсивность МФО донорского канала со временем будет увеличиваться. Интенсивность МФИ акцепторного канала должна уменьшаться или оставаться постоянной с течением времени. - Рассчитайте коэффициент FRET, разделив донора на значения акцепторного канала для образцов, измеренных на закрытых жизнеспособных одиночных нейтрофилах.
- Нормализуйте выборочные измерения, разделив их на соответствующую точку времени 0 мин (репрезентативные результаты и анализ см. на рисунке 2).
ПРИМЕЧАНИЕ: Запись по меньшей мере двух временных точек (т.е. 0 и 10 мин) необходима для динамического измерения изменения отношения D/A. Чтобы нормализовать измерение активности для каждого образца, отношение D/A, измеренное в более поздних временных точках (например, 10 мин), делится на отношение, рассчитанное сразу после добавления зонда (0 мин).
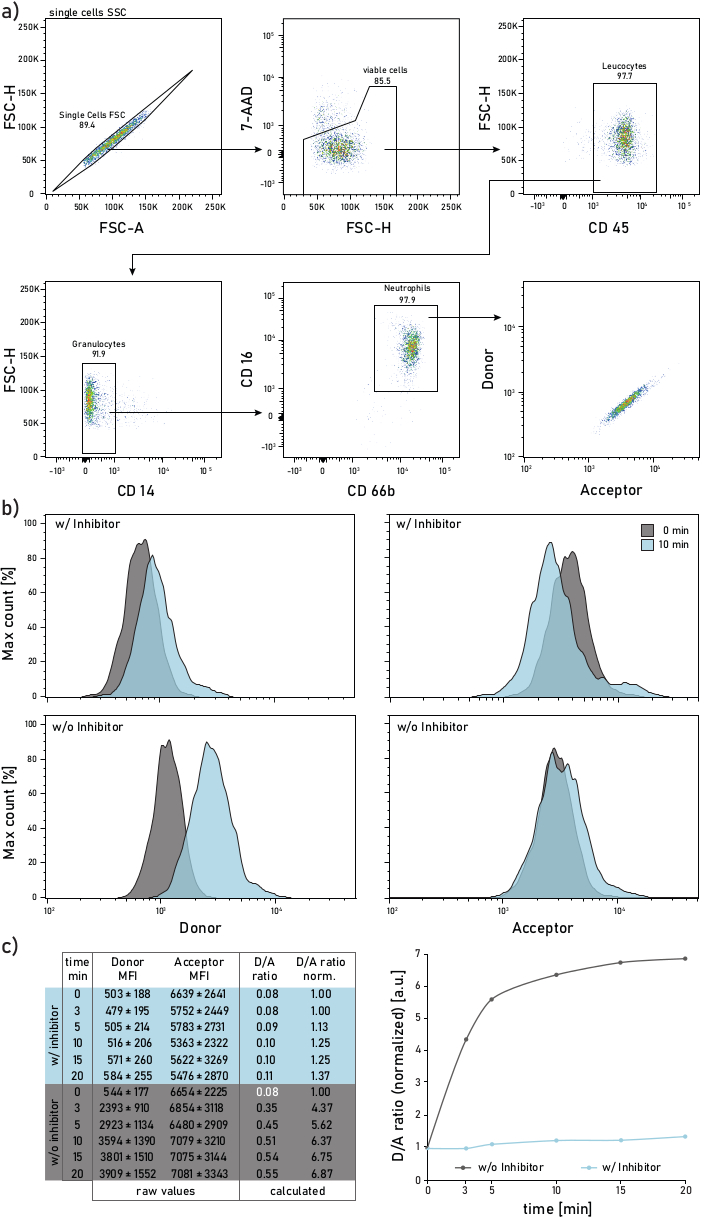
Рисунок 2:Стратегия гастировки и репрезентативные графики мембранно-связанной NE активности, измеренные на нейтрофилах, выделенных из мокроты пациента с муковисцидозом. Длязащиты нейтрофилов мокроты используются следующие антитела: CD14 (1:50), CD16 (1:50), CD45 (1:33) и CD66b (1:50). Нейтрофилы закрыты как 7-AAD-CD45+CD14-CD16+CD66b+ события. Закрытые события анализируются для их донора (λexc= 405 нм, λem= 450/50 нм) и акцептора (λexc= 405 нм, λem= 585/42 нм) средней интенсивности флуоресценции (MFIs). b)Репрезентативные гистограммы нейтрофилов мокроты CF, проанализированные на предмет их мембранно-связанной NE активности. Левый столбец показывает сигнал донора, правый столбец показывает сигнал акцептора. Верхняя строка показывает среднюю интенсивность флуоресценции клеток, обработанных Сивелестатом (w/) в течение 10 мин до добавления репортера. В нижнем ряду показаны необработанные (без) клетки, репортерная флуоресценция которых измеряется сразу (0 мин, серый) и 10 мин (синий) после добавления репортера. Нейтрофилы закрыты в соответствии со стратегией, показанной на панели a. c)В таблице данных показан репрезентативный набор данных, состоящий из необработанных МФУ для донора и акцепторного сигнала о нейтрофилах, измеренных в течение нескольких временных точек (0-3-5-10-15-20 мин), а также расчетное соотношение D/A. Соотношение D/A можно нормализовать, т.е. до 0 мин точки времени (белый шрифт). 0 мин указывает на запись, сделанную как можно скорее после добавления репортера в проточную трубку с окрашенными клетками мокроты. Данные МФО показаны как среднее ± стандартного отклонения для 1000 нейтрофилов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Результаты
Результаты, показанные на рисунке 1a, иллюстрируют репрезентативный набор данных микроскопии. Ядерный сигнал используется для идентификации нейтрофилов по их характерным сегментодержатым ядрам. Интересуемая область (ROI) выбирается вручную (пунктирная линия на рисунке 1a). Изображение с соотношением D/A рассчитывается путем деления интенсивностей донорского канала на интенсивности акцепторного канала по попикселям. На последнем этапе рассчитывается среднее отношение D/A на ячейку (ROI). На рисунке 1b каждая точка представляет собой среднее значение одного ROI (нейтрофила). Рекомендуется изобразить и оценить около 100 клеток на состояние.
Репрезентативная стратегия гетирования проточной цитометрии показана на рисунке 2а. Такое гатирование позволяет различать и изучать нейтрофилы мокроты. Чтобы избежать флуоресцентных побочных эффектов или компенсационных артефактов, рекомендуется посвятить лазерную линию (например, синий лазер) для обнаружения флуоресценции зонда FRET. Флуоресцентная компенсация проточной цитометрии должна выполняться для антител, а не для зонда FRET. На рисунке 2b показано распределение МФО через 0 и 10 минут после добавления репортера. Каждая строка на рисунке 2c показывает средние значения донорских и акцепторных МФО для 1000 нейтрофилов мокроты. Коэффициент D/A рассчитывается путем деления донорских и акцепторных МФО. Течение времени на рисунке 2c с правой стороны показывает прогрессию измерения: после быстрого начального увеличения соотношение D/A достигает плато, в соответствии с активностью мембранно-связанного фермента.
Обсуждение
Представленные протоколы объясняют различные подходы к количественной оценке активности нейтрофильной эластазы и катепсина G в образцах мокроты человека. Критическими точками для успешного измерения активности ферментов являются: i) точное время и стандартизация оперативной процедуры и ii) использование надежных отрицательных и положительных средств контроля. При условии, что эти условия соблюдены, описанные методы не ограничиваются мокротой, но также могут быть легко адаптированы к анализу активности протеазы в крови, жидкостях бронхоальвеолярного лаважа и срезах тканей или гомогенатах.
Каждая из трех техник имеет свои сильные стороны и ограничения, которые часто дополняют друг друга. Например, проточная цитометрия позволяет проводить быстрый анализ редких клеточных популяций, а также фенотипирование клеток, но не имеет пространственной информации о разрешении, что может быть достигнуто с помощью микроскопии. Вместо этого измерения считывателя пластин позволяют проводить параллельную оценку нескольких образцов или условий с высокой пропускной способностью. Поскольку свежие клетки мокроты не могут быть заморожены и сохранены, три метода требуют, чтобы образцы были быстро обработаны после отхаркивания. Это ограничивает гибкость или пропускную способность измерений активности, связанной с мембраной. Разработка протокола проточной цитометрии, позволяющее фиксировать клетки после добавления зонда и ферментативного расщепления, открыла бы параллельное измерение большего числа трубок. Кроме того, особое внимание следует уделять обращению и хранению зондов FRET. Фактически, некоторые аминокислоты, присутствующие в пептидном субстрате, такие как метионин, подвергаются окислению, что приводит к снижению репортерной чувствительности. Для увеличения срока годности репортера (по оценкам, около трех месяцев при 20 °C) их можно хранить в небольших объемных аликвотах (1-2 мкл) под инертным газом, таким как азот или аргон.
При муковисцидозе и других хронических воспалительных заболеваниях легких важно обнаружить воспаление как можно раньше, а надежные биомаркеры имеют потенциал для достижения такой цели. Возможность обнаружения поверхностно-связанной активности НСП, которая, как было показано, вредна для окружающих тканей, также в условиях, когда отсутствует или мало свободной активности NE, добавляет еще один уровень ценной информации, который вряд ли может быть достигнут с помощью других существующих методов4,11.
Репортеры могут быть использованы для изучения связи связанной с мембраной активности НСП с тяжестью и прогрессированием заболевания легких, особенно в его раннем начале. Методы могут быть использованы для мониторинга эффективности лечения (например, противовоспалительных методов лечения или высокоэффективных модуляторов CFTR и потенциаторов28)и исследования результирующего ослабления воспаления, вызванного нейтрофилами. Кроме того, протоколы основаны на неинвазивных процедурах отбора проб, которые несут очень низкий риск для пациента и, следовательно, могут использоваться в очень широком масштабе и открывать двери для многочисленных захватывающих применений.
Раскрытие информации
Авторы заявляют об отсутствии конфликта интересов.
Благодарности
Этот проект был поддержан грантами Министерства образования и исследований Германии (FKZ 82DZL004A1 до M.A.M) и Немецкого исследовательского фонда (SFB-TR84TP B08 to M.A.M). Работа, описанная в этой рукописи, была поддержана Немецким центром исследований легких (DZL) и EMBL Heidelberg через стипендию PhD для M.G. Мы благодарим Й. Шаттерни, С. Бутца и Х. Шойермана за экспертную техническую помощь.
Материалы
| Name | Company | Catalog Number | Comments |
| 100 µm Nylon cell strainer | Corning Inc. | 431752 | |
| 2300 EnSpire (Multilabel Plate Reader) | PerkinElmer | ||
| 35x10mm Dish, Nunclon Delta | Thermo Fisher Scientific | 150318 | |
| 40 µm Nylon cell strainer | Corning Inc. | 431750 | |
| 50 mL tubes | Sarstedt | 10535253 | |
| 7-AAD, viability dye | Bio Legend | 420404 | 5 µL/100 µL |
| Balance | OHAUS Instruments (Shanghai) Co., Ltd. | PR124 | |
| BD Falcon Round-Bottom Tubes 5 mL | BD Bioscience | 352054 | |
| BD LSRFortessa cell analyzer | BD Bioscience | ||
| black flat bottom 96 well half area plate | Corning Life Science | 3694 | |
| Cathepsin G | Elastin Products Company | SG623 | |
| Cathepsin G Inhibitor I | Merck KGaA | 219372 | |
| Centrifuge 5418R | Eppendorf AG | EP5401000137 | |
| Combitips advanced 1.0 mL | Eppendorf AG | 0030 089 430 | |
| cOmplete proteinase inhibitor | Roche | 11697498001 | |
| Countig chambers improved Neubauer | Glaswarenfabrik Karl Hecht GmbH & Co KG | 40442 | |
| coverslips Ø 25mm | Thermo Fisher Scientific | MENZCB00250RA003 | |
| Cytospin 4 | Thermo Fisher Scientific | ||
| DRAQ5 (nuclear stain) | BioStatus Limited | DR50050 | 1:10000 |
| FACSDiva software, v8.0.1 | BD Bioscience | ||
| FcBlock | BD Bioscience | 564219 | |
| Fiji (Fiji Is Just ImageJ) | fiji.sc | ||
| Flow Jo software, v10 | TreeStar | ||
| FluoQ Plugin, v3-97 | |||
| Heraeus Megafuge 16R | Thermo Fisher Scientific | ||
| Human Sputum Leucocyte Elastase | Elastin Products Company | SE563 | |
| Leica SP8 confocal microscope | Leica Microsystems | ||
| Mini Rock-Shaker | PEQLAB Biotechnologie GmbH | MR-1 | |
| mouse anti-human CD14, Pe-Cy7, clone M5E2 | BD Bioscience | 557742 Lot:8221983 | 1:50 |
| mouse anti-human CD16, AF700, clone 3G8 | BD Bioscience | 557820 Lot:8208791 | 1:50 |
| mouse anti-human CD45, APC-Cy7, clone 2D1 | BD Bioscience | 557833 Lot:8059688 | 1:33 |
| mouse anti-human CD66b, PE/Dazzel 594, clone G10F5 | BioLegend | 305122 Lot:B241921 | 1:50 |
| mSAM | in house | 2 mM | |
| Multipette plus | Eppendorf AG | ||
| NEmo-1 | SiChem | SC-0200 | 1 mM |
| NEmo-2E | SiChem | SC-0201 | 2 mM |
| Pari Boy SX with an LC Sprint jet nebulizer | Pari | 085G3001 | |
| phosphate buffered saline | Gibco | 10010-015 | |
| ROTI Histokitt (mounting medium) | Carl Roth GmbH + Co.KG | 6638.1 | |
| Salbutamol | Teva GmbH | ||
| Sivelestat | Cayman Chemicals | 17779 | |
| Sputolysin | Calbiochem | 560000-1SET | |
| sSAM | in house | 2 mM | |
| SuperFrost Plus Adhesion slides | Thermo Fisher Scientific | 10149870 | |
| Trypan Blue solution | Sigma-Aldrich | T8154 |
Ссылки
- Korkmaz, B., Moreau, T., Gauthier, F. Neutrophil elastase, proteinase 3 and cathepsin G: Physicochemical properties, activity and physiopathological functions. Biochimie. 90 (2), 227-242 (2008).
- Sheshachalam, A., Srivastava, N., Mitchell, T., Lacy, P., Eitzen, G. Granule Protein Processing and Regulated Secretion in Neutrophils. Frontiers in Immunology. 5, 448 (2014).
- Pham, C. T. N. Neutrophil serine proteases: Specific regulators of inflammation. Nature Reviews Immunology. 6 (7), 541-550 (2006).
- Gehrig, S., et al. Lack of neutrophil elastase reduces inflammation, mucus hypersecretion, and emphysema, but not mucus obstruction, in mice with cystic fibrosislike lung disease. American Journal of Respiratory and Critical Care Medicine. 189 (9), 1082-1092 (2014).
- McKelvey, M. C., Weldon, S., McAuley, D. F., Mall, M. A., Taggart, C. C. Targeting proteases in cystic fibrosis lung disease paradigms, progress, and potential. American Journal of Respiratory and Critical Care Medicine. 201 (2), 141-147 (2020).
- Clancy, D. M., et al. Extracellular Neutrophil Proteases Are Efficient Regulators of IL-1, IL-33, and IL-36 Cytokine Activity but Poor Effectors of Microbial Killing. Cell Reports. 22 (11), 2937-2950 (2018).
- Giacalone, V. D., Margaroli, C., Mall, M. A., Tirouvanziam, R. Neutrophil adaptations upon recruitment to the lung: New concepts and implications for homeostasis and disease. International Journal of Molecular Sciences. 21 (3), 1-21 (2020).
- Sly, P. D., et al. Risk Factors for Bronchiectasis in Children with Cystic Fibrosis. New England Journal of Medicine. 368 (21), 1963-1970 (2013).
- Owen, C. A., Campbell, M. A., Sannes, P. L., Boukedes, S. S., Campbell, E. J. Cell surface-bound elastase and cathepsin G on human neutrophils: A novel, non-oxidative mechanism by which neutrophils focus and preserve catalytic activity of serine proteinases. Journal of Cell Biology. 131 (3), 775-789 (1995).
- Brinkmann, V., et al. Neutrophil Extracellular Traps Kill Bacteria. Science. 303 (5663), 1532-1535 (2004).
- Margaroli, C., et al. Elastase Exocytosis by Airway Neutrophils Associates with Early Lung Damage in Cystic Fibrosis Children. American Journal of Respiratory and Critical Care Medicine. , (2018).
- Owen, C., Campbell, M. A., Sannes, P. L., Boukedes, S. S., Carolina, N. Cell surface-bound elastase and cathepsin G on human neutrophils: a novel, non-oxidative mechanism by which neutrophils focus and preserve catalytic activity of serine proteinases. The Journal of cell biology. 131 (3), 775-789 (1995).
- Garland, M., Yim, J. J., Bogyo, M. A Bright Future for Precision Medicine: Advances in Fluorescent Chemical Probe Design and Their Clinical Application. Cell chemical biology. 23 (1), 122-136 (2016).
- Gehrig, S., Mall, M. A., Schultz, C. Spatially resolved monitoring of neutrophil elastase activity with ratiometric fluorescent reporters. Angewandte Chemie - International Edition. 51 (25), 6258-6261 (2012).
- Guerra, M., et al. Cathepsin G Activity as a New Marker for Detecting Airway Inflammation by Microscopy and Flow Cytometry. ACS Central Science. 5 (3), 539-548 (2019).
- Hu, H. Y., et al. In vivo imaging of mouse tumors by a lipidated cathepsin S substrate. Angewandte Chemie - International Edition. 53 (29), 7669-7673 (2014).
- Korkmaz, B., et al. Measuring elastase, proteinase 3 and cathepsin G activities at the surface of human neutrophils with fluorescence resonance energy transfer substrates. Nature Protocols. 3 (6), 991-1000 (2008).
- Craven, T. H., et al. Super-silent FRET Sensor Enables Live Cell Imaging and Flow Cytometric Stratification of Intracellular Serine Protease Activity in Neutrophils. Scientific Reports. 8 (1), 13490 (2018).
- Mu, J., et al. A small-molecule fret reporter for the real-time visualization of cell-surface proteolytic enzyme functions. Angewandte Chemie - International Edition. 53 (52), 14357-14362 (2014).
- Hagner, M., et al. New method for rapid and dynamic quantification of elastase activity on sputum neutrophils from patients with cystic fibrosis using flow cytometry. European Respiratory Journal. 55 (4), 1902355 (2020).
- Dittrich, A. S., et al. Elastase activity on sputum neutrophils correlates with severity of lung disease in cystic fibrosis. European Respiratory Journal. , 1701910 (2018).
- Cobos-Correa, A., Trojanek, J. B., Diemer, S., Mall, M. A., Schultz, C. Membrane-bound FRET probe visualizes MMP12 activity in pulmonary inflammation. Nature Chemical Biology. 5 (9), 628-630 (2009).
- Hu, H. -. Y., et al. FRET-based and other fluorescent proteinase probes. Biotechnology Journal. 9 (2), 266-281 (2014).
- Trojanek, J. B., et al. Airway mucus obstruction triggers macrophage activation and matrix metalloproteinase 12-dependent emphysema. American Journal of Respiratory Cell and Molecular Biology. 51 (5), 709-720 (2014).
- Wagner, C. J., Schultz, C., Mall, M. A. Neutrophil elastase and matrix metalloproteinase 12 in cystic fibrosis lung disease. Molecular and Cellular Pediatrics. 3 (1), 25 (2016).
- Gaggar, A., et al. The role of matrix metalloproteinases in cystic fibrosis lung disease. The European respiratory journal. 38 (3), 721-727 (2011).
- Guerra, M., et al. Protease FRET Reporters Targeting Neutrophil Extracellular Traps. Journal of the American Chemical Society. 142 (48), 20299-20305 (2020).
- Middleton, P. G., et al. Elexacaftor-Tezacaftor-Ivacaftor for Cystic Fibrosis with a Single Phe508del Allele. New England Journal of Medicine. 381 (19), 1809-1819 (2019).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены