Method Article
인간 가래 샘플에서 호중구 엘라스테아제 및 카테프신 G 활동 모니터링
* 이 저자들은 동등하게 기여했습니다
요약
본 명세서에 설명된 프로토콜은 인간 가래에서 호중구 프로테아제의 활성을 시각화하고 정량화하는 가이드를 제공한다. 이러한 분석의 적용은 항염증제 치료의 평가에서부터 바이오마커 검증, 약물 스크리닝 및 대형 코호트 임상 연구에 이르기까지 지속됩니다.
초록
Proteases는 수많은 생리 과정의 규제 기관이며 활동의 정확한 조사는 흥미로운 생물 의학 과제로 남아 있습니다. 인간 게놈에 의해 인코딩된 ~600개의 프로테아제 중 호중구 세린 프로테아제(NSP)는 호흡기 질환을 포함한 염증조건의 발병 및 진행에 관여하는 것에 대해 철저히 조사된다. 유일하게, 분비된 NSP는 세포외 유체 내에서 확산될 뿐만 아니라 플라즈마 멤브레인에 국한됩니다. 호중구 세포 외 함정 (NETs) 형성 중, NSP는 분비 된 크로마틴의 필수적인 부분이된다. 이러한 복잡한 동작은 NSP 병리학에 대한 이해를 어려운 작업으로 만듭니다. 여기서, 상세한 프로토콜은 가래 샘플에서 무료 및 막 바인딩 호중구 엘라스테아제(NE) 및 카테신 G(CG) 활동을 시각화, 정량화 및 차별하는 것으로 나타났다. NE와 CG는 낭포성 섬유증 (CF) 및 만성 폐쇄성 폐 질환 (COPD)의 발병기막에 흉골 역할을하는 NSP입니다 : 그들은 조직 리모델링을 촉진하고 다운 스트림 면역 반응을 조절하며 폐 질환 심각도와 상관 관계가 있습니다. 프로토콜은 작은 분자 Förster 공명 에너지 전송 기지를 둔 (FRET) 기자를 통해 효소 활동 정량화를 위한 인간 가래에서 neutrophils의 격리뿐만 아니라 액체 및 세포 분획을 분리하는 방법을 보여줍니다. NE 및 CG 활동의 상대적 역할에 대한 구체적인 통찰력을 수집하기 위해 FRET 판독값은 다양한 기술로 측정할 수 있습니다: i) 시험관 내 플레이트 판독기 측정은 프로테아제 활성의 높은 처리량 및 대량 검출을 허용합니다. ii) 공초점 현미경 검사는 세포 표면에서 막 결합 활성을 현체적으로 해결; iii) 소분자 FRET 유동 세포측정은 단일 세포 프로테아제 활성 정량화 및 페노티핑을 통한 항염증제 치료의 신속한 평가를 가능하게 한다. 이러한 방법의 구현은 CF 및 COPD에 대한 질병 심각도의 바이오 마커로 NSP 병리학 및 잠재력을 탐구하는 문을 엽니 다. 표준화 잠재력, 강력한 판독 가능성 및 전송 단순성을 감안할 때, 설명된 기술은 연구 및 진단 실험실 전반에 걸쳐 구현을 위해 즉시 공유할 수 있습니다.
서문
호중구 엘라스타제(NE), 카테핀 G(CG), 단백질라제 3(PR3) 및 호중구 세린 프로테아제 4(NSP4)는 4개의 호중구 세린 프로테아제(NSP)1이다. 그(것)들은 호중구 1차 또는 azurophilic 과립 내의 myeloperoxidase와 더불어 저장됩니다. 그들의 높은 proteolytic 콘텐츠로 인해, 1 차 과립의 분비성은 엄격하게 통제되고 호중구는 자극2를프라이밍하고 활성화로 순차적으로 도전되어야 합니다.
phagolysosome 내부, NSP는 세포 내 bactericidal 에이전트로 기능3. 분비될 때, NSP는 염증의 강한 중재자가 된다: 그들은 사이토카인과 표면 수용체를 갈라, 병렬 프로 염증 경로활성화 3. 중요한 것은, 선동적인 조건은 통제되지 않는 NSP 분비를 특징으로 합니다. 예를 들어, 염증이 있는 기도 내에서, 과도한 NE 활성은 점액 과분비, 잔세포 대사증, CFTR 불활성화 및 세포외 매트릭스 리모델링4,5를일으킨다. 카테신 G는 염증에도 참여한다: 특히 IL-1 제품군, IL-36α 및 IL-36β6의2개의 성분을 절단하고 활성화한다. NE와 함께, CG 는 기도 상피에 프로테아제 활성화 수용체를 만들고 또한 TNF-α 및 IL-1β를 활성화합니다.
알파-1-항트립신, 알파-1-항키모트립신 및 분비류 백혈구 프로테아제 억제제와 같은 내인성 항프로테아제는 호중구 엘라스타제 및 카테프신 G 활성5를조절한다. 그러나, 폐질환 진행 과정에서 프로테아제의 지속적인 분비액은 항프로테아제 쉴드를 능가하여 기도내의 비해결 호중구증, 염증 악화 및 조직 손상5,7을초과한다. 환자 기도의 수용성 분획에서 의 NE 농도 및 활성은 질병 심각도8의유망한 바이오마커로 나타났지만, NE및 CG는 또한 정전기상호 작용을 통해 호중구 막 및 세포외 DNA에 연관되어 항 프로테아제에 덜 접근할 수 있게 된다. 중요한 것은, 전임상 연구는 세포 표면 관련 프로테아제 활성이 수용성 대응4,11과독립적으로 나타나는 시나리오를 정의하였다. 사실, 검출될 수 있게 하려면, 무료 프로테아제 활동은 먼저 프로테아제 방지 방패를 압도해야 합니다. 대신, 세포 표면에서 막 결합 프로테아제 활성은 세포 플라즈마멤브레인(12)에큰 억제제가 접근할 수 없기 때문에 적어도 부분적으로 그대로 남아 있다. 이러한 복잡한 protease 행동은 호중구 매개 염증 발병 및 전파에 중요한 결과를 가지고, 따라서 정확하고 유익한 도구로 조사 할 필요가있다.
수년에 걸쳐, Förster 공명 에너지 전송 (FRET) 기반 프로브는 효율적이고 빠르게 인간의 샘플에서 특정 protease 활동을 평가하는 도구로 수많은 생체 의학 응용 프로그램을 발견13. 프로테아제 기자는 표적 효소에 의해 인식되고, 내분에 기증자 불소호가 수용체 분자로 에너지를 전달하는 물리적 과정인 FRET에 의존하는 인식 모티프(즉, 펩티드)로 구성된다. 리포터에 효소에 의해 작용하는 처리, 즉 인식 부분의 분열, 기증자로부터 확산되는 수용인의 결과: 효소 활성은 따라서 수용자 형광을 통해 기증자의 시간 의존적 변화로 측정된다. 이러한 판독은 자체 정상화 및 비율 메트릭이므로 pH 및 로컬 프로브 농도와 같은 환경 조건에 의해 약간만 영향을 받습니다. NEmo-114 및 sSAM15는 NE 및 CG 활성에 대해 각각 구체적으로 보고하는 FRET 프로브입니다. 그러나, 이러한 리포터는 임의의 셀룰러 구획에 특별히 국소화하지 않으므로 인간의 유체에 존재하는 프로테아제 활동을 모니터링하기 위해 사용됩니다. 공간적으로 국소화된 방식으로 프로테아제활성을 모니터링하기 위해, 우리 및 다른 사람들은 분자태그(14,15,16,17,18,19)를통해 세포전 과소 성분과 연관된 FRET 프로브를 개발하였다. 이러한 합성 전략은 혈장 멤브레인에 국한지질 앵커가 장착 된 두 개의 FRET 프로브인 NEmo-2 및 mSAM의 개발을 허용했습니다. 이 기자들은 낭포성 섬유증과 만성 폐쇄성 폐질환14,15에서NE와 CG 프로테아제의 깊은 이해를 촉진시켰다.
여기서, 상세한 프로토콜은 NEmo 및 SAM 시리즈 FRET 프로브를 통해 인간 가래에서 수용성 및 멤브레인 바운드 NE 및 CG 활동의 시각화 및 정량화를 위해 제공됩니다. NSP 병리학의 다양한 측면을 해결하고 사용자 별 필요에 따라 사용할 수 있는 다양한 방법을 제공하기 위해 형광 분광법, 형광 현미경 및 유동 세포측정법을 통한 분석이 도시되어 있다.
프로토콜
다음 프로토콜은 인간의 가래에 수행 된 분석을 설명합니다. 인간 샘플 처리는 하이델베르크 대학의 윤리위원회에 의해 승인되었으며 모든 환자 또는 부모 / 법적 보호자 (S-370/2011) 및 건강한 통제 (S-046/2009)로부터 서면 통보 된 동의를 얻었습니다.
참고: 다음 프로토콜은 호중구 세린 프로테아제(NSP) 활성의 샘플 준비 및 정량화를 설명합니다. 본 원에 제시된 실험 절차는 인간 가래 및 호중구 엘라서아제14,20,21(NE) 또는 카테핀 G15(CG) 활동 측정에 초점을 맞춥니다. 그러나, 시료 제제 프로토콜에서 약간의 적응은 혈액 유래 세포 및 종양균질의 분석을 가능하게 합니다. 또한, 매트릭스 메탈로프로테나아제(12) 및 카테핀 S 활동은 전용 FRET프로브(22,23,24,25, 25,26)를통해 유사하게 조사할 수 있다.
1. 샘플 준비 : 세포 격리 및 상피 분리
참고: 가능하면 가래 처리는 예상 후 120분 이내에 수행되어야 하며 추가 처리가 있을 때까지 가래를 얼음에 보관해야 합니다.
- 가래의 자발적인 기대가 불가능한 경우, 이전에 설명된 바와 같이 가래를유도한다 19. 간단히, 가래 유도 절차를 시작하기 전에 β-2 수용체 길항제 살부타몰의 200 μg를 흡입한다. 그 후, 분무기를 사용하여 15 분 동안 고토닉 (6 %) 식염수 용액을 흡입하십시오. 페트리 요리로 기대되는 가래를 모으세요.
- 점액 덩어리를 타액에서 페트리 팁의 도움으로 페트리 접시에 분리합니다.
- 점액의 무게를 측정합니다.
참고: 점액 샘플의 평균 중량은 0.8g(0.1g에서 5g 사이변화); 0.1 g는 일반적으로 언급 된 절차를 수행하기에 충분합니다. - 가래에 10% 스푸톨리신(PBS)의 4개 부품(v/w)을 가래에 넣습니다(예: 가래 각 그램당 10% 스푸톨리신 4mL).
주의: 스푸톨리신은 인산염 완충제에 농축 된 디티오스레이톨로 구성되어 있으므로 주의해서 처리하십시오. - 점액을 용해하기 위해 15 분 동안 흔들 셰이커에 실온 (RT)에서 혼합물을 배양합니다. 안전상의 이유로 셰이커를 연기 후드에 넣습니다.
- 감기 PBS의 동일한 볼륨을 추가하여 반응을 담금질 (예를 들어: 10% Sputolysin의 각 mL에 대 한 차가운 PBS의 1 mL).
- 균일 한 용액을 얻기 위해 파이펫팅에 의해 혼합.
- 100 μm 나일론 셀 스트레이너를 통해 혼합물을 50mL 튜브로 필터링합니다.
- 40 μm 나일론 셀 스트레이너를 통해 여과 단계를 반복합니다.
- 원심 분리는 4 °C에서 300 x g에서 10 분 용용액을 제공합니다.
- 상체 분수를 신선한 튜브에 조심스럽게 옮기고 얼음 위에 보관하십시오.
참고: 상체 분획은 추가 분석이 될 때까지 -20°C 또는 -80°C로 저장할 수 있습니다. - 차가운 PBS의 500 μL에서 셀 펠릿을 부드럽게 다시 중단하고 얼음 위에 놓습니다.
참고: 셀 분획은 즉시 처리해야 합니다.
2. 호중구 세린 프로테아제 활동 측정
참고: 여기에서는 FRET 리포터를 통해 NSP 활동을 정량화하기 위해 다양한 방법이 도입됩니다. 기술의 선택은 실험의 특정 생물 의학 질문 및 목적에 의해 결정된다. 제시된 프로브는 폐 관련 효소14,15세트에대한 특이성을 광범위하게 테스트하였다. 프로브는 표적 효소에 특이적이지만 항상 관심있는 임상 샘플에 대한 프로브 특이성을 확인하십시오. 이는 프로브 첨가 전에 특정 프로테아제 억제제로 시료를 배양함으로써 달성될 수 있으며, 이는 D/A 비율의 증가를 폐지해야 한다.
- 불소계 또는 플레이트 판독기를 통한 용해성 NSPs 활성 정량화
참고: 시료의 수용성 분획에서프로테제 활성은 형광 검출이 가능한 모든 계측기에서 검출될 수 있다.- 얼음에 효소를 해동.
- 사용 전까지, NE와 CG를 산성 저장 버퍼(50mM 나트륨 아세테이트, 200m M M NaCl, pH 5.5)에 보관하여 자가 분열을 방지한다.
- 효소 표준 곡선을 설정하려면 활성화 버퍼(10m Tris-HCl, pH 7.5에서 500mM NaCl)에서 효소(NE용 33.9 - 0.271 nM, CG용 42.6 -0.333 nM)의 1:2 직렬 희석을 준비한다. 활성화 버퍼는 중립 pH를 가지므로 효소 촉매가 효율적으로 발생할 수 있습니다.
- 최고 표준 농도(NE 농도: 33.9nM)를 준비하려면 활성화 버퍼의 999μL에서 NE(33.9 μM)의 1μL을 희석한다.
- 두 번째 표준(NE 농도: 16.95 nM)을 준비하려면 제1 희석의 200 μL을 활성화 버퍼 200 μL과 혼합합니다.
- 나머지 1:2 희석을 준비하기 위해 그에 따라 진행합니다.
- 공백인 마지막 표준은 순수한 활성화 버퍼로 구성됩니다. 기술 중복 또는 삼중 의 측정을 권장합니다. 표준 및 샘플 준비 중에 바이알을 얼음 위에 유지하십시오.
- 표준 준비와 병행하여 가래 샘플을 활성화 버퍼에서 희석시. 프로테아제 활성을 평가하기 전에 인간 샘플을 희석하여 리포터 신호의 증가의 선형 범위(기증자/수용자 비율)에 남아 있습니다. 환자 샘플이 희석되지 않은 상태로 방치되면 절단이 신뢰할 수 있는 피팅을 위해 너무 빠르게 발생합니다. 건강한 기증자 가래는 CF와 COPD 환자에서 견본에 비교된 더 적은 액티브 한 proteases를 포함하기 때문에, 다른 희석은 일반적으로 능력을 발휘합니다 (건강한 가래 상수에 대한 1:10, COPD 또는 CF 환자의 가래 상응을 위한 1:20-500).
참고: 농도가 알려지지 않은 시료에서 프로테아제 활성을 정량적으로 측정하려면 알려진 효소 농도를 가진 표준 곡선을 동일한 플레이트에서 이상적으로 병렬로 측정해야 합니다. 인간 가래에서 활성 효소의 농도는 표준 곡선으로 측정된 것과 함께 인간 가래 샘플에서 측정된 슬로프를 보보아 계산됩니다. - 측정을 위해 샘플을 준비하기 전에 계측기를 설정합니다. NE FRET 프로브(NEmo-114)에대한 흥분 파장을 354nm로 설정하고, 검출 파장을 기증자의 경우 400nm로 설정하고 수용자에 대한 490 nm를 설정한다. CG FRET 프로브(sSAM15)에대한 흥분 파장을 405nm로 설정하고 방출을 485(기증자) 및 580nm(수용자)로 설정합니다.
- 40 μL의 샘플, 표준 또는 블랭크를 검정 96웰 반 영역 플레이트의 우물에 넣습니다.
- 기자(마스터 믹스에서 기자의 농도: 10 μM)를 포함하는 마스터 믹스를 준비하려면, 프로브 스톡(DMSO1mM) 1:100을 활성화 버퍼로 희석한다. 필요한 플레이트 웰 의 수를 10 μL x곱을 곱하여 필요한 마스터 믹스 볼륨을 준비합니다. NEmo-1 및 sSAM 리포터의 형광 측정을 위한 최적의 최종 농도(2 μM)에 도달하기 위해 각 웰(샘플, 표준 또는 공백의 40 μL 포함)에 마스터 믹스 10μL을 추가하고 판독을 시작합니다. 따라서 NEmo-1 및 sSAM 리포터는 수용성 호중구 엘라서아제 및 카테신 G 활성을 각각 모니터링합니다.
참고: 시약 인젝터를 사용할 수 없는 경우 리포터가 샘플을 추가한 후 가능한 한 빨리 판독을 시작해야 합니다. - 플레이트 판독기 측정을 시작하고 최소 20분 동안 또는 신호의 증가가 고원에 도달할 때까지 60-90초마다 기증자/수용률 증가를 기록합니다.
- 데이터가 내보내지면, 기증자 상대형형광단위(RFU)를 각 시간점 및 시료에 대한 수락자 RFU로 나누어 기증자/수락률(D/A 비율)을 계산합니다.
- 각 샘플의 D/A 비율 평균 및 표준 편차를 계산합니다.
- D/A 비율 변경의 선형 성장 내의 경사를 결정합니다. 경사는 FRET 프로브에 대한 효소 분열 속도의 지표입니다. 효소 표준에서 계산된 효소와 인간 샘플에서 유래된 선형 회귀 경사면을 피팅하여 가래에 활성 효소의 농도를 계산합니다.
- 형광계 또는 플레이트 판독기를 통한 멤브레인 바인딩 NSPs 활성 정량화
- 위에서 설명한 바와 같이 가래 세포를 분리합니다. PBS의 40 μL의 부피에서 3 x 104 셀을 다시 중단합니다. 플레이트 리더에 셀을 잘 추가합니다.
- 계측기를 설정합니다. 멤브레인 바운드 NE FRET 프로브(NEmo-214)를위한 흥분 파장을 405nm로 설정하고, 검출 파장을 기증자의 경우 485nm로 설정하고, 수용자에 대한 580 nm를 설정한다. 멤브레인 바운드 CG FRET 프로브(mSAM15)를위한 난초파장을 405nm로 설정하고, 방출을 485(기증자) 및 580nm(수용자)로 설정한다.
- 기자를 포함하는 마스터 믹스를 준비하기 위해, 활성화 버퍼에서 프로브 스톡을 10 μM의 농도로 희석. 필요한 플레이트 우물의 수를 10 μL X로 곱하여 필요한 마스터 믹스 부피를 준비한다. NEmo-2 및 mSAM 리포터의 형광 측정을 위한 최적의 최종 농도(2 μM)에 도달하기 위해 각 우물(시료, 표준 또는 빈 40μL 포함)에 마스터 믹스 10μL을 추가하고 판독을 시작합니다. 따라서 NEmo-2 및 mSAM 리포터는 멤브레인 결합 호중구 엘라서아제 및 카테프신 G 활성을 각각 모니터링합니다.
참고: 세포 음성 제어는 예를 들어 NSP를 적극적으로 분비하지 않는 세포를 사용할 수 있습니다. 예를 들어, 3 x 104 백혈구 선조HL-60 의 분동 세포를 가진 기자의 인큐베이션은 유효한 분열 음성 제어를 나타낸다. - 최소 20분 동안 또는 신호의 증가가 고원에 도달할 때까지 기증자/수용률의 기록적인 변화. 위에서 설명한 데이터를 분석합니다.
- 형광 현미경 검사를 통한 멤브레인 바인딩 NSPs 활동 측정
- 분석해야 하는 조건 수를 결정합니다.
참고: 각 가래 샘플 측정에 대해 추가 양수(PC) 및 음수(NC) 제어의 준비 및 분석이 권장됩니다. - 각 측정에 대해 1.5mL 튜브에서 50 μL PBS의 부피로 3 x 104 가래 세포를 다시 중단합니다.
- 부정적인 대조군으로서, 특정 억제제(Sivelestat, 특정 NE 억제제, 또는 카테신 G 억제제 I, 특정 CG 억제제, 100 μM의 최종 농도)를 가진 가래 세포를 배양한다. RT에서 10 분 동안 배양하십시오.
- 양성 대조군으로서, 적절한 효소(340nM 또는 200 nM에서 각각)를 가진 가래 세포를 RT에서 10분 동안 배양한다.
- 각 튜브(양성 대조군 처리 세포, 음의 대조구 처리 세포 및 처리되지 않은 세포)에 FRET 리포터와 핵 얼룩(1:1000 최종 희석)을 함유한 PBS의 50μL을 추가하여 RT에서 10-20분 동안 2μM의 프로브 최종 농도에 도달합니다.
중요: 핵 얼룩의 첨가는 FRET 프로브 채널을 사용하지 않고 관심있는 가래 세포를 검색할 수 있으므로 형광 현미경 이미징을 용이하게하므로 리포터 표백을 피할 수 있습니다. 또한 DNA 얼룩은 핵의 모양에 따라 가래 세포를 분할할 수 있습니다. 예를 들어, 호중구는 그들의 다중 형 핵에 의해 쉽게 식별 될 수있다. 또한 세포의 생존 가능성에 대한 추가 정보는 검색 할 수 있습니다 (더 세분화 된 핵을 가진 호중구는 살아있을 가능성이 더 높습니다).
참고: 막 바인딩 하나 이외에, 인간 가래에서 DNA 결합 NE 또는 CG의 활성은 H-NE 및 H-CG, 세포외 DNA-연관 FRET프로브(27)를통해 동일한 방식으로 측정될 수 있다. 마스터 믹스를 준비할 때 H-NE 및 H-CG는 10 μM의 농도로 첨가하고 사이토스핀 및 슬라이드 준비 전에 가래로 배양할 수 있습니다. 세포외 DNA에 대한 D/A 비율 정량화는 NEmo-2 및 mSAM과 동일하게 진행되며, 세포외 DNA 응집체가 단일세포(27)대신 세분화되는 유일한 차이점이 있습니다. - 얼음 차가운 PBS의 100 μL을 추가하여 반응을 담금질하고 얼음에 샘플을 전달합니다.
- Cytospin 현미경 슬라이드에 혼합물, 공기 건조, 얼음 차가운 메탄올 10% 10 분 동안 수정, 공기 건조 및 적절한 장착 매체와 마운트.
참고: 현미경 슬라이드는 추가 분석이 끝날 때까지 최대 1개월 동안 어둠 속에서 4°C로 저장할 수 있습니다. - PL APO 40x 또는 63배 오일 목표를 가진 공초점 현미경을 사용하여 현미경 이미지를 획득합니다. 이미지 품질을 높이고 획득 시간을 줄이려면 순차적인 이미지 수집 모드를 권장합니다.
- 헬륨-네온 레이저 라인으로 633 nm 암분과 함께 핵 얼룩을 먼저 이미지하고 650에서 715 nm 사이의 방출을 기록합니다.
- 458 nm에서 아르곤 레이저로 470~510nm 사이 FRET 기자의 기증자(쿠마린 343)를 기록한다. 단독 기증자 여기 후 570에서 610 nm 사이의 감세 수용자 (5,6-TAMRA) 방출을 획득하십시오.
- 다이오드 펌핑 솔리드 스테이트(DPSS) 레이저를 이용하여 561nm에서 470~510nm 사이의 별도의 채널에서 직접 수용체 방출을 기록한다.
- 실험 의 시작 부분에 핀홀을 설정하고 이미징 세션 의 과정에서 유지 관리합니다.
참고: 크기가 작기 때문에 40배 또는 63배 현미경 목표를 사용하면 호중구를 제대로 시각화하는 것이 좋습니다. 일반적으로 이미지는 수집 중에 리포터의 광표백을 방지하기 위해 더 긴 흥분 파장을 시작으로 여러 연속 채널에서 획득됩니다.
- 결정적인 통계를 위해 조건당 적어도 100개의 셀을 이미지. 현미경 이미지 분석의 경우 적절한 소프트웨어를 사용합니다: 세포를 분할하고 픽셀단위로 D/A 비율을 계산한 후 사용자가 수동으로 선택한 관심 영역의 평균 또는 중앙값을 계산합니다. 대표적인 결과는 그림 1을참조하십시오.
- 분석해야 하는 조건 수를 결정합니다.
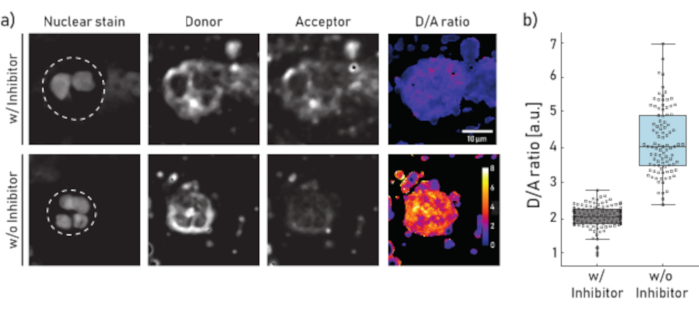
그림 1: CF 환자 가래로부터 분리된 호중구에 대한 멤브레인 바운드 NE 활성의 대표적인 영상 및 정량화. a)주중구의 대표적인 공초점 현미경 이미지 (상단 패널) 10 분 동안 Sivelestat (w/) 또는 왼쪽 치료되지 않은 (w/o) (하단 패널) 기자 NEmo-2 μ-2M 전에 왼쪽의 첫 번째 열은 핵 얼룩, 두 번째 기증자 채널, 세 번째 수락채널 및 기증자 및 수락자 채널을 픽셀단위로 나누어 얻은 마지막 계산된 D/A 비율을 나타낸다. 관심 영역(단일 호중구)의 경계는 파선선으로 묘사됩니다. 배율(10μm) 및 교정 막대(D/A 비율)가 표시됩니다. b)대표적인 CF 환자로부터 가래 호중구의 D/A 비율을 나타내는 상자 및 도트 플롯. 억제제 및 처리되지 않은 세포로 배양된 세포는 각각 회색과 파란색으로 표시됩니다. 각 점은 하나의 세포를 나타낸다(N: w/억제제 = 113 및 w/o 억제제 = 96). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
- 유동 세포측정을 통한 멤브레인 바인딩 NSP 활동 측정
- 5mL FACS 폴리스티렌 라운드 하단 튜브에서 PBS의 100 μL에 1 x 106 세포를 다시 중단하고 얼음에 튜브를 배치합니다.
- 가래 호중구를 게이트하려면 CD14(1:50), CD16(1:50), CD45(1:33) 및 CD66b(1:50)를 사용한다. 모든 샘플에 대한 충분한 마스터 믹스를 준비합니다. 어둠 속에서 얼음에 마스터 믹스를 놓습니다.
- 도 2에설명된 대로 게이팅 전략을 설정합니다. 호중구는 7AAD-CD45+CD14-CD16+CD66b+ 이벤트로 게이트됩니다. 게이트 이벤트는 기증자(λexc = 405 nm, λem = 450/50 nm) 및 수용자(λexc = 405 nm, λem = 585/42 nm)에 대한 막 바인딩 프로테아제 활성을 분석합니다.
- 각 샘플에 2 μL의 FcBlock을 추가하고 RT에서 5분 동안 배양합니다.
- 각 튜브에 선택한 항체를 추가하고 어둠 속에서 얼음에 30 분 동안 배양하십시오.
- 차가운 PBS2mL, 원심분리기는 300 x g 및 4°C에서 5분 동안 세척합니다. 차가운 PBS의 200 μL에서 슈퍼 나tant를 버리고 세포를 다시 중단하십시오.
- 200 μL을 두 개의 튜브에 각각 100 μL로 분할하고 각 튜브에 5 μL의 세포 생존 성 스테인딩 솔루션을 추가합니다. 얼음 에 튜브를 배치합니다.
- 적절한 특정 NSP 억제제(NE 사용 시벨레스타트의 경우 225 μM 최종 농도) CG용 카테프신 G 억제제 I를 100 μM에서 음수 제어(NC) 테스트 튜브에 추가합니다. 어둠 속에서 10 분 동안 RT에서 샘플을 배양하십시오.
- 샘플에 차가운 PBS 100 μL을 추가하고 깨끗한 FACS 튜브의 40 μm 필터를 통해 필터링하여 기기의 막힘을 방지합니다.
- 기자(NE, NEmo-2의 최종 농도에서 4 μM, CG, mSAM의 최종 농도 2 μM)를 NC 샘플에 추가하여 튜브를 부드럽게 소용돌이시다.
- 필요한 경우 게이트뿐만 아니라 기자 PMTs의 전압을 약간 조정하기 위해 특정 억제제로 인큐베이션된 세포를 획득하기 시작합니다.
- 적어도 1000호중구를 기록합니다. 샘플을 실온에서 유지합니다.
참고: 더 많은 이벤트를 기록할 수 있지만 1000개의 셀은 적절한 통계와 기록 시간 사이에 좋은 타협을 보장합니다. - 그에 따라 다음 튜브(처리되지 않은 가래 샘플)를 진행합니다.
- 막 바인딩 프로테아제 활성으로 인한 D/A 비율의 변화를 기록하려면 각 튜브에서 5~10분마다 1000개의 호중구를 기록하십시오.
참고 : 성공적인 FRET 기자 분열 후, 기증자 채널 MF의 강도는 시간이 지남에 따라 증가합니다. 수락채널 MF의 강도는 시간이 지남에 따라 감소하거나 일정하게 유지되어야 합니다. - 게이트된 실행 가능한 단일 호중구에서 측정된 샘플에 대한 수락자 채널 값으로 기증자를 분할하여 FRET 비율을 계산합니다.
- 샘플 측정을 해당 0분 시간점으로 나누어 샘플 측정을 정규화합니다(대표 결과 및 분석은 그림 2참조).
참고: D/A 비율 변경의 동적 측정을 위해서는 최소 두 시간 포인트(예: 0 및 10분)의 기록이 필요합니다. 각 샘플에 대한 활성 측정을 정상화하기 위해, 후기 시점에서 측정된 D/A 비율(예를 들어, 10분)은 프로브 추가 후 즉시 계산된 비율로 나뉩니다(0분).
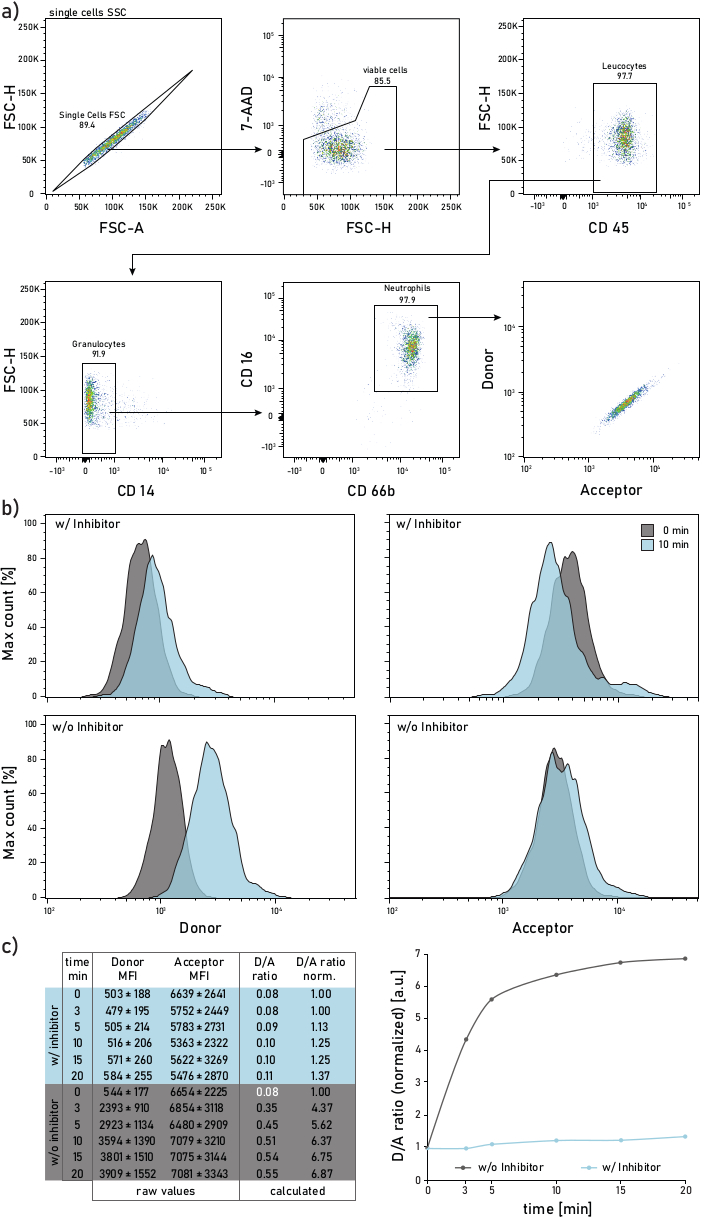
그림 2: CF 환자 가래로부터 분리된 호중구에서 측정된 멤브레인 결합 NE 활성의 게이팅 전략 및 대표적인 플롯. a)게이트 가래 호중구에 다음 항체가 사용된다: CD14 (1:50), CD16 (1:50), CD45 (1:33) 및 CD66b (1:50). 호중구는 7-AAD-CD45+CD14-CD16+CD66b+ 이벤트로 게이트됩니다. 게이트 이벤트는 기증자(λexc= 405 nm, λem= 450/50 nm) 및 수용자(λexc= 405 nm, λem= 585/42 nm)에 대해 분석된다. b)그들의 막 바인딩 NE 활동을 위해 분석된 CF 가래 호중구의 대표적인 히스토그램. 왼쪽 열은 기증자 신호를 나타내고 오른쪽 열에는 수락자 신호가 표시됩니다. 맨 위 행은 리포터를 추가하기 전에 10 분 동안 Sivelestat (w/)로 처리 된 세포의 형광 강도를 의미합니다. 맨 아래 행은 기자가 추가한 후 즉시(0분, 회색) 및 10분(파란색)을 측정하는 처리되지 않은 세포를 보여줍니다. 호중구는 패널 a.c)에도시된 전략에 따라 게이트되어 있으며, 데이터 테이블은 여러 시간 지점(0-3-5-10-15-20분)에 걸쳐 측정된 호중구에 대한 기증자 및 수용자 신호에 대한 원시 MFIs및 수용자 신호로 구성된 대표적인 데이터 집합과 계산된 D/A 비율을 나타낸다. D/A 비율은 0분 시간 점(흰색 글꼴)으로 정규화될 수 있습니다. 0분은 기자가 스테인드 가래 세포를 가진 유동관에 추가한 후 가능한 한 빨리 수행된 기록을 나타냅니다. MFIs 데이터는 1000호중성구에 대한 표준 편차를 평균 ± 나타내고 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
결과
도 1a에 표시된 결과는 대표적인 현미경 데이터 집합을 도시한다. 핵 신호는 그들의 특징적인 분할된 핵에 의해 호중구를 확인하기 위하여 이용됩니다. 관심 영역(ROI)은 수동으로 선택됩니다(도 1a의파선). D/A 비율 이미지는 기증자 채널의 강도를 픽셀단위로 수락자 채널의 강도로 나누어 계산합니다. 마지막 단계에서 셀당 평균 D/A 비율이 계산됩니다.] 도 1b에서 각 점은 하나의 ROI(호중구)의 평균을 나타낸다. 조건당 약 100개의 세포를 이미지화하고 평가하는 것이 좋습니다.
대표적인 유동 세포측정제 게이팅 전략은 도 2a에도시된다. 이러한 게이팅은 가래 호중구를 차별하고 연구할 수 있습니다. 형광 유출 또는 보상 아티팩트를 방지하려면 FRET 프로브 형광 검출에 레이저 라인(예: 블루 레이저)을 헌납하는 것이 좋습니다. 유동 세포종형 보정은 FRET 프로브가 아닌 항체에 대해 수행되어야 한다. 그림 2b는 리포터 추가 후 0분과 10분 후에 MFI 분포를 묘사합니다. 도 2c의 각 행은 1000 개의 가래 호중구에 대한 평균 기증자 및 수용자 MFIs 값을 나타냅니다. D/A 비율은 기증자와 수락자 MF를 분할하여 계산됩니다. 오른쪽 도 2c의 시간 과정은 측정의 진행을 보여줍니다 : 빠른 초기 증가 후, D / A 비율은 막 바인딩 효소의 활성에 따라 고원에 도달한다.
토론
보고된 프로토콜은 인간 가래 견본에 있는 호중구 엘라스테아제 및 카테핀 G의 활동을 정량화하기 위하여 다른 접근을 설명합니다. 성공적인 효소 활성 측정을 위한 중요 점은 i) 수술 절차및 ii)의 정확한 타이밍 및 표준화이며, 신뢰할 수 있는 음수 및 양성 제어의 사용이다. 이러한 조건이 충족되는 경우, 기술된 방법은 가래에 국한되지 않고 혈액, 기관지정맥용암혈액 및 조직 단면 또는 균질화의 프로테아제 활성 분석에 쉽게 적응될 수 있다.
세 가지 기술은 각각 강점과 한계를 가지고 있으며, 종종 서로를 보완합니다. 예를 들어, 유동 세포측정은 세포 피노핑뿐만 아니라 희귀 세포 집단의 신속한 분석을 허용하지만 현미경 검사법에 의해 달성 될 수있는 공간 해상도 정보가 부족합니다. 대신 플레이트 판독기 측정을 통해 여러 샘플 또는 조건의 병렬 평가를 높은 처리량 방식으로 허용합니다. 신선한 가래 세포를 동결하고 저장할 수 없기 때문에 세 가지 방법은 시료를 예상 후 신속하게 처리해야합니다. 이를 통해 멤브레인 결합 활동 측정의 유연성이나 처리량을 제한합니다. 프로브 추가 및 효소 분열 후 세포를 고칠 수 있는 유동 세포측정 프로토콜의 개발은 더 많은 수의 튜브의 병렬 측정에 개방될 것이다. 또한 FRET 프로브의 처리 및 보관에 특히 주의를 기울여야 합니다. 실제로, 메티오닌과 같은 펩티드 기판에 존재하는 일부 아미노산은 산화를 거쳐 기자 민감도가 저하된다. 기자의 유통기한(20°C에서 약 3개월 추정)을 높이기 위해 질소 나 아르곤과 같은 불활성 가스 하에서 소량 의 알리쿼트(1-2 μL)에 보관할 수 있다.
CF 및 기타 만성 염증성 폐 질환에서는 가능한 한 빨리 염증을 감지하는 것이 중요하며 신뢰할 수 있는 바이오마커는 그러한 목표를 달성할 수 있는 잠재력을 가지고 있다. 주변 조직에 유해한 것으로 나타난 표면 경계 NSP 활성을 검출할 수 있는 가능성은 또한 자유 NE 활성이 없거나 거의 없는 조건에서, 다른 기존 방법4,11을통해 거의 달성될 수 없는 또 다른 수준의 귀중한 정보를 추가한다.
기자는 폐 질환의 심각도 및 진행, 특히 초기 발병시 막 에 묶인 NSP 활동의 링크를 연구하는 데 사용할 수 있습니다. 이 방법은 치료 효능(예를 들어, 항염증제 치료 또는 매우 효과적인 CFTR 변조기 및전위제(28)을모니터링하고 호중구 구동 염증의 결과 완화를 조사하는 데 활용될 수 있다. 또한, 프로토콜은 환자를 위한 아주 낮은 리스크를 전송하는 비침습적 견본 절차를 기반으로 하고, 그러므로, 아주 넓은 규모로 이용되고 수많은 흥미진진한 응용에 문을 열 수 있습니다.
공개
저자는 이해 상충을 선언하지 않습니다.
감사의 말
이 프로젝트는 독일 교육 연구부(FKZ 82DZL004A1~M.A.M)와 독일 연구 재단(SFB-TR84TP B08~M.A.M)의 보조금에 의해 지원되었다. 이 원고에 설명된 작품은 M.G.에 대한 박사 펠로우십을 통해 독일 폐 연구 센터 (DZL)와 EMBL 하이델베르크에 의해 지원되었다. J. S. 채터니, S. Butz 및 H. Scheuermann에게 전문적인 기술 지원을 해 주셔서 감사합니다.
자료
| Name | Company | Catalog Number | Comments |
| 100 µm Nylon cell strainer | Corning Inc. | 431752 | |
| 2300 EnSpire (Multilabel Plate Reader) | PerkinElmer | ||
| 35x10mm Dish, Nunclon Delta | Thermo Fisher Scientific | 150318 | |
| 40 µm Nylon cell strainer | Corning Inc. | 431750 | |
| 50 mL tubes | Sarstedt | 10535253 | |
| 7-AAD, viability dye | Bio Legend | 420404 | 5 µL/100 µL |
| Balance | OHAUS Instruments (Shanghai) Co., Ltd. | PR124 | |
| BD Falcon Round-Bottom Tubes 5 mL | BD Bioscience | 352054 | |
| BD LSRFortessa cell analyzer | BD Bioscience | ||
| black flat bottom 96 well half area plate | Corning Life Science | 3694 | |
| Cathepsin G | Elastin Products Company | SG623 | |
| Cathepsin G Inhibitor I | Merck KGaA | 219372 | |
| Centrifuge 5418R | Eppendorf AG | EP5401000137 | |
| Combitips advanced 1.0 mL | Eppendorf AG | 0030 089 430 | |
| cOmplete proteinase inhibitor | Roche | 11697498001 | |
| Countig chambers improved Neubauer | Glaswarenfabrik Karl Hecht GmbH & Co KG | 40442 | |
| coverslips Ø 25mm | Thermo Fisher Scientific | MENZCB00250RA003 | |
| Cytospin 4 | Thermo Fisher Scientific | ||
| DRAQ5 (nuclear stain) | BioStatus Limited | DR50050 | 1:10000 |
| FACSDiva software, v8.0.1 | BD Bioscience | ||
| FcBlock | BD Bioscience | 564219 | |
| Fiji (Fiji Is Just ImageJ) | fiji.sc | ||
| Flow Jo software, v10 | TreeStar | ||
| FluoQ Plugin, v3-97 | |||
| Heraeus Megafuge 16R | Thermo Fisher Scientific | ||
| Human Sputum Leucocyte Elastase | Elastin Products Company | SE563 | |
| Leica SP8 confocal microscope | Leica Microsystems | ||
| Mini Rock-Shaker | PEQLAB Biotechnologie GmbH | MR-1 | |
| mouse anti-human CD14, Pe-Cy7, clone M5E2 | BD Bioscience | 557742 Lot:8221983 | 1:50 |
| mouse anti-human CD16, AF700, clone 3G8 | BD Bioscience | 557820 Lot:8208791 | 1:50 |
| mouse anti-human CD45, APC-Cy7, clone 2D1 | BD Bioscience | 557833 Lot:8059688 | 1:33 |
| mouse anti-human CD66b, PE/Dazzel 594, clone G10F5 | BioLegend | 305122 Lot:B241921 | 1:50 |
| mSAM | in house | 2 mM | |
| Multipette plus | Eppendorf AG | ||
| NEmo-1 | SiChem | SC-0200 | 1 mM |
| NEmo-2E | SiChem | SC-0201 | 2 mM |
| Pari Boy SX with an LC Sprint jet nebulizer | Pari | 085G3001 | |
| phosphate buffered saline | Gibco | 10010-015 | |
| ROTI Histokitt (mounting medium) | Carl Roth GmbH + Co.KG | 6638.1 | |
| Salbutamol | Teva GmbH | ||
| Sivelestat | Cayman Chemicals | 17779 | |
| Sputolysin | Calbiochem | 560000-1SET | |
| sSAM | in house | 2 mM | |
| SuperFrost Plus Adhesion slides | Thermo Fisher Scientific | 10149870 | |
| Trypan Blue solution | Sigma-Aldrich | T8154 |
참고문헌
- Korkmaz, B., Moreau, T., Gauthier, F. Neutrophil elastase, proteinase 3 and cathepsin G: Physicochemical properties, activity and physiopathological functions. Biochimie. 90 (2), 227-242 (2008).
- Sheshachalam, A., Srivastava, N., Mitchell, T., Lacy, P., Eitzen, G. Granule Protein Processing and Regulated Secretion in Neutrophils. Frontiers in Immunology. 5, 448 (2014).
- Pham, C. T. N. Neutrophil serine proteases: Specific regulators of inflammation. Nature Reviews Immunology. 6 (7), 541-550 (2006).
- Gehrig, S., et al. Lack of neutrophil elastase reduces inflammation, mucus hypersecretion, and emphysema, but not mucus obstruction, in mice with cystic fibrosislike lung disease. American Journal of Respiratory and Critical Care Medicine. 189 (9), 1082-1092 (2014).
- McKelvey, M. C., Weldon, S., McAuley, D. F., Mall, M. A., Taggart, C. C. Targeting proteases in cystic fibrosis lung disease paradigms, progress, and potential. American Journal of Respiratory and Critical Care Medicine. 201 (2), 141-147 (2020).
- Clancy, D. M., et al. Extracellular Neutrophil Proteases Are Efficient Regulators of IL-1, IL-33, and IL-36 Cytokine Activity but Poor Effectors of Microbial Killing. Cell Reports. 22 (11), 2937-2950 (2018).
- Giacalone, V. D., Margaroli, C., Mall, M. A., Tirouvanziam, R. Neutrophil adaptations upon recruitment to the lung: New concepts and implications for homeostasis and disease. International Journal of Molecular Sciences. 21 (3), 1-21 (2020).
- Sly, P. D., et al. Risk Factors for Bronchiectasis in Children with Cystic Fibrosis. New England Journal of Medicine. 368 (21), 1963-1970 (2013).
- Owen, C. A., Campbell, M. A., Sannes, P. L., Boukedes, S. S., Campbell, E. J. Cell surface-bound elastase and cathepsin G on human neutrophils: A novel, non-oxidative mechanism by which neutrophils focus and preserve catalytic activity of serine proteinases. Journal of Cell Biology. 131 (3), 775-789 (1995).
- Brinkmann, V., et al. Neutrophil Extracellular Traps Kill Bacteria. Science. 303 (5663), 1532-1535 (2004).
- Margaroli, C., et al. Elastase Exocytosis by Airway Neutrophils Associates with Early Lung Damage in Cystic Fibrosis Children. American Journal of Respiratory and Critical Care Medicine. , (2018).
- Owen, C., Campbell, M. A., Sannes, P. L., Boukedes, S. S., Carolina, N. Cell surface-bound elastase and cathepsin G on human neutrophils: a novel, non-oxidative mechanism by which neutrophils focus and preserve catalytic activity of serine proteinases. The Journal of cell biology. 131 (3), 775-789 (1995).
- Garland, M., Yim, J. J., Bogyo, M. A Bright Future for Precision Medicine: Advances in Fluorescent Chemical Probe Design and Their Clinical Application. Cell chemical biology. 23 (1), 122-136 (2016).
- Gehrig, S., Mall, M. A., Schultz, C. Spatially resolved monitoring of neutrophil elastase activity with ratiometric fluorescent reporters. Angewandte Chemie - International Edition. 51 (25), 6258-6261 (2012).
- Guerra, M., et al. Cathepsin G Activity as a New Marker for Detecting Airway Inflammation by Microscopy and Flow Cytometry. ACS Central Science. 5 (3), 539-548 (2019).
- Hu, H. Y., et al. In vivo imaging of mouse tumors by a lipidated cathepsin S substrate. Angewandte Chemie - International Edition. 53 (29), 7669-7673 (2014).
- Korkmaz, B., et al. Measuring elastase, proteinase 3 and cathepsin G activities at the surface of human neutrophils with fluorescence resonance energy transfer substrates. Nature Protocols. 3 (6), 991-1000 (2008).
- Craven, T. H., et al. Super-silent FRET Sensor Enables Live Cell Imaging and Flow Cytometric Stratification of Intracellular Serine Protease Activity in Neutrophils. Scientific Reports. 8 (1), 13490 (2018).
- Mu, J., et al. A small-molecule fret reporter for the real-time visualization of cell-surface proteolytic enzyme functions. Angewandte Chemie - International Edition. 53 (52), 14357-14362 (2014).
- Hagner, M., et al. New method for rapid and dynamic quantification of elastase activity on sputum neutrophils from patients with cystic fibrosis using flow cytometry. European Respiratory Journal. 55 (4), 1902355 (2020).
- Dittrich, A. S., et al. Elastase activity on sputum neutrophils correlates with severity of lung disease in cystic fibrosis. European Respiratory Journal. , 1701910 (2018).
- Cobos-Correa, A., Trojanek, J. B., Diemer, S., Mall, M. A., Schultz, C. Membrane-bound FRET probe visualizes MMP12 activity in pulmonary inflammation. Nature Chemical Biology. 5 (9), 628-630 (2009).
- Hu, H. -. Y., et al. FRET-based and other fluorescent proteinase probes. Biotechnology Journal. 9 (2), 266-281 (2014).
- Trojanek, J. B., et al. Airway mucus obstruction triggers macrophage activation and matrix metalloproteinase 12-dependent emphysema. American Journal of Respiratory Cell and Molecular Biology. 51 (5), 709-720 (2014).
- Wagner, C. J., Schultz, C., Mall, M. A. Neutrophil elastase and matrix metalloproteinase 12 in cystic fibrosis lung disease. Molecular and Cellular Pediatrics. 3 (1), 25 (2016).
- Gaggar, A., et al. The role of matrix metalloproteinases in cystic fibrosis lung disease. The European respiratory journal. 38 (3), 721-727 (2011).
- Guerra, M., et al. Protease FRET Reporters Targeting Neutrophil Extracellular Traps. Journal of the American Chemical Society. 142 (48), 20299-20305 (2020).
- Middleton, P. G., et al. Elexacaftor-Tezacaftor-Ivacaftor for Cystic Fibrosis with a Single Phe508del Allele. New England Journal of Medicine. 381 (19), 1809-1819 (2019).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유