Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Esferas bacterianas de celulosa que encapsulan materiales sólidos
En este artículo
Resumen
Este protocolo presenta un método fácil y barato de formar esferas bacterianas de celulosa (BC). Este biomaterial puede funcionar como un medio de encapsulación para materiales sólidos, incluyendo biocarbón, esferas de polímeros y residuos mineros.
Resumen
Las esferas de celulosa bacteriana (BC) se han investigado cada vez más desde la popularización de BC como un material nuevo. Este protocolo presenta un método asequible y simple para la producción de esferas BC. Además de producir estas esferas, también se ha identificado un método de encapsulación para partículas sólidas. Para producir esferas bc, el agua, el té negro, el azúcar, el vinagre y el cultivo bacteriano se combinan en un matraz desconcertado y el contenido se agita. Después de determinar las condiciones de cultivo adecuadas para la formación de esferas BC, su capacidad para encapsular partículas sólidas se probó utilizando biocarbón, perlas de polímero y desechos de minas. Las esferas se caracterizaron utilizando el software ImageJ y el análisis gravimétrico térmico (TGA). Los resultados indican que las esferas con 7,5 mm de diámetro se pueden hacer en 7 días. La adición de varias partículas aumenta el rango de tamaño promedio de las cápsulas BC. Las esferas encapsularon 10 - 20% de su masa seca. Este método muestra la producción de esferas de bajo costo y la encapsulación que es posible con materiales fácilmente obtenibles. Las esferas BC se pueden utilizar en el futuro como una ayuda para la eliminación de contaminantes, recubrimiento de fertilizantes de liberación controlada o enmienda del suelo.
Introducción
La celulosa bacteriana (BC) se ha destacado por su uso potencial en la industria debido a su resistencia mecánica, alta pureza y cristalinidad, capacidades de retención de agua e intrincada estructura de fibra1,2,3,4. Estas características hacen de BC un biomaterial favorable para una variedad de aplicaciones, incluyendo usos biomédicos, de procesamiento de alimentos y de remediación ambiental1. La formación de una película BC se puede hacer con cultivos de un solo organismo o cultivos mixtos como los utilizados para la kombucha5,una bebida de té fermentada. La kombucha cervecera se basa en un "cultivo simbiótico de bacterias y levaduras", comúnmente conocido como SCOBY. Usando esta cultura simbiótica de organismos, se emplea una técnica similar para crear esferas BC. Este biomaterial puede emplearse para ayudar a aislar los contaminantes ambientales y anclar las enmiendas agrícolas como el biocarbón para lograr una producción de cultivos más eficiente.
La literatura anterior ha discutido cómo las características de BC producidas en condiciones agitadas se comparan con BC producidas en una cultura estacionaria. Un cultivo estacionario da como resultado una película que se forma en la interfaz líquido-aire, mientras que un cultivo sacudido resulta en partículas, hebras y esferas BC variables suspendidas dentro del líquido6. Muchos estudios han hecho referencia a la afirmación de que la producción comercial de BC es más factible en las condiciones dinámicas6,7,proporcionando la justificación para la aplicación del método de este trabajo. Además, se han llevado a cabo varias investigaciones sobre la estructura y las propiedades de las esferas de BC. Toyosaki et al.6 compararon frascos erlenmeyer desconcertados y de paredes lisas en su agitada producción de BC. Un estudio realizado por Hu y Catchmark4 determinó las condiciones para las esferas BC que se utilizaron como directrices para el proceso de producción actual de la esfera BC, y sus resultados indican que el tamaño de la esfera no continúa aumentando después de 60 horas. Una revisión de la producción de BC por Mohammad et al.1 indica que sacudir la cultura de BC asegura incluso el suministro y la distribución de oxígeno, que es necesario para el crecimiento exitoso de BC. Holland et al.8 han estudiado la cristalinidad y la estructura química de BC utilizando difracción de rayos X y espectroscopia infrarroja de transformada de Fourier. Se supone que las cápsulas bc exhibirán características similares y futuras investigaciones investigarán las propiedades estructurales. Los estudios también han explorado los efectos beneficiosos del uso de BC para producir biocompuestos mejorados. Utilizando resina epoxi como base, los investigadores han demostrado que la adición de BC mejora las características del material como la vida útil de la fatiga, la tenacidad a la fractura y la resistencia a la tracción yla flexión 9,10. Como lo muestran las investigaciones pasadas y actuales, muchos están interesados en comercializar el uso de BC.
Muchos investigadores han investigado la celulosa bacteriana en sistemas de liberación controlada, y el método descrito aquí genera cápsulas que podrían utilizarse como sistemas de liberación controlada. Gran parte de esta investigación se centra en la liberación controlada en el campo biomédico, así como en cierta exploración en la administración de fertilizantes de liberación controlada (CRF). De acuerdo con el éxito de la liberación controlada de BC de amoxicilina11,lidocaína12e ibuprofeno13,BC puede exhibir características de administración similares con otras sustancias, como un fertilizante peletizado. Una visión general de los CRF de Shaviv y Mikkelsen14 reconoce que los CRF son más eficientes, ahorran mano de obra y, en general, causan menos degradación ambiental que la aplicación de fertilizantes convencionales. La celulosa bacteriana puede funcionar como un material encapsulante favorable para los CRF. Los fertilizantes pueden lixiviarse fuera de las membranas de BC o descargarse como biodegrados de BC15,16. La alta capacidad de hinchazón de agua de BC también puede actuar como una enmienda beneficiosa del suelo17,18,19 porque tanto los nutrientes del fertilizante como la humedad pueden liberarse en el suelo a través de la aplicación de esferas de BC. Con estos rasgos, un CRF formado por encapsulación de esfera BC puede tener una ventaja sobre otros materiales de recubrimiento de fertilizantes que podrían tener efectos negativos durante sus etapas de producción y eliminación. La adaptación de BC en un recubrimiento de fertilizantes puede mejorar aún más las tecnologías de CRF. Al reducir la tasa de liberación de fertilizantes, los cultivos tendrán tiempo suficiente para absorber el fertilizante y evitar el exceso de escorrentía en cuerpos de agua, reduciendo así la eutrofización y las zonas no oxigenadas. Se han preparado y puesto a prueba fertilizantes similares de liberación lenta utilizando recubrimientos poliméricos20.
A diferencia de los protocolos descritos en investigaciones anteriores, este se centra en la producción uniforme y cohesiva de esferas en lugar de un alto rendimiento de celulosa. Por otra parte, la encapsulación bc de otros sólidos se ha estudiado con películas de celulosa, pero no esferas21. Al ampliar la investigación sobre las esferas de celulosa bacteriana, se pueden dar más pasos para producir BC comercialmente, lo que es beneficioso debido a las características ambientalmente seguras de BC. Este método de fabricación de esferas BC utiliza ingredientes culinarios baratos y fácilmente disponibles. Después del ensamblaje inicial, las esferas BC comienzan a formarse dentro de los 2 días sin interferencias. La producción de esferas bc a través de esta estrategia requiere poco espacio y tiene un subproducto comestible, el té fermentado 'kombucha'. Las técnicas de encapsulación mencionadas en otros estudios incluyen recubrimientos formados mediante la técnica de inversión de fase22,23,formación de matriz24,secado por aspersión25,y encapsulación directa durantela síntesis 26. El método de encapsulación directa descrito en este manuscrito es útil para aquellos que desean un proceso fácil y económico que utilice materiales fácilmente disponibles.
A través de esta investigación, se creó un protocolo exitoso para la producción y encapsulación de esferas BC. Las esferas BC pueden encapsular partículas sólidas de biocarbón, relaves mineros y microperlas de poliestireno dentro de sus estructuras individuales. Aunque todavía no se utiliza ampliamente en la industria, BC es un material práctico, hecho de manera sostenible y natural que podría usarse para futuras aplicaciones.
Protocolo
1. Creación y mantenimiento del cultivo de arranque de celulosa bacteriana
- Obtener un cultivo iniciador de celulosa bacteriana, aproximadamente 50 g, en forma de scoby. Se puede comprar comercialmente (por ejemplo, de Cultures for Health). Coloque el SCOBY en un casto de 1 L, cubierto con una toalla de papel.
- Hervir 700 mL de agua desionizada, transferirla a un recipiente separado del que contiene el SCOBY, y añadir 85 g de sacarosa.
- Una vez que la sacarosa se haya disuelto, añadir 2 bolsas de té negro (4,87 g). Empinar el té durante 1 h, a continuación, retire cuidadosamente las bolsas de té con una varilla de agitación.
- Añadir 200 mL de vinagre blanco destilado al té. Dejar enfriar la mezcla a 25 °C. Una vez enfriado, agregue 700 mL del té a temperatura ambiente al beaker que contiene el SCOBY.
PRECAUCIÓN: Agregar el té ácido mientras está demasiado caliente puede dañar a los organismos en el SCOBY. - Cubra el casto con una toalla de papel y asegúrelo con una banda elástica, y coloque el casto en un área de almacenamiento que mantenga una temperatura de 25 °C. Este buque se conoce comúnmente como cultivo de stock o un hotel.
- Para mantener el SCOBY saludable, se requiere mantenimiento aproximadamente 2 veces al mes.
- Usando las manos enguantadas para retener las esteras SCOBY, drene el líquido del hotel en un casto separado. En el recipiente con el líquido, añadir suficiente té ácido para un total de 700 mL de solución.
- Disolver 65 g de sacarosa en el recipiente con el té ácido. Mientras espera a que la sacarosa se disuelva, enjuague cuidadosamente las esteras SCOBY en agua DI.
- Una vez que la sacarosa está completamente disuelta, el líquido se puede agregar al casto que contiene las esteras SCOBY enjuagadas. Cubra el casto y devuélvalo a la zona de incubación.
2. Producción de esferas de celulosa bacteriana
NOTA: Tenga cuidado al trabajar con agua hirviendo. Asegúrese de que la cristalería pueda soportar las temperaturas del agua hirviendo, esté libre de defectos y tenga el tamaño adecuado. Un esquema que describe la producción de esferas BC se da en la Figura 1.
- Hervir 350 mL de agua desionizada usando una tetera. Transfiera el agua caliente a un beaker de 500 mL. Disolver 42,5 g de sacarosa granulada en el agua caliente utilizando una varilla de agitación.
- Cuando la sacarosa está completamente disuelta, empinada 1 bolsa de té negro (2,54 g) en el matraz que contiene la sacarosa y el agua durante 1 h. Después de esto, retire la bolsa de té con una varilla de agitación, teniendo cuidado de evitar romper la bolsa de té, y luego desechela en la basura.
- Agregue 100 mL de vinagre blanco destilado al casto y luego revuelva bien la mezcla. Transferir 80 ml de la mezcla de té ácido a un matraz desconcertado de 250 ml. Deje que la mezcla de té se enfríe a temperatura ambiente, 20 - 25 °C.
NOTA: En este punto, la mezcla se puede dejar enfriar durante la noche o hasta que se prepare para el siguiente paso. - Una vez que la temperatura del líquido esté a temperatura ambiente (20 - 25 °C), agregue 20 ml de líquido de cultivo de arranque microbiano al matraz desconcertado. Este líquido se puede obtener en un hotel scoby. Cubra el matraz con parafilm.
- Coloque el matraz desconcertado en una mesa de agitación orbital y establezca la velocidad en 125 rotaciones por minuto (rpm). Deje que la mezcla se agite durante 3 días en una habitación o incubadora con una temperatura de 20 - 25 °C para producir esferas BC.
NOTA: Si se forman formas irregulares en el contenido del matraz o si los grupos de celulosa se adhieren a las paredes del matraz, deben retirarse para evitar que se formen más masas irregulares de BC. Utilice pinzas para eliminar masas BC no deseadas, incluyendo cuerdas delgadas, anillos, formas tubulares y otras formas claramente no esféricas. - Una vez que las esferas se hayan formado, vierta suavemente desde el matraz y analizarlas, desecharlas o usarlas de una manera no descrita en este documento.
3. Uso de esferas de celulosa bacteriana para encapsular partículas o contaminantes
- Siga los pasos 2.1-2.5 anteriores.
- Después de agitar durante 3 días, agregue aproximadamente 0,01 g de material particulado finamente molido al matraz desconcertado. Los sólidos apropiados incluyen biocarbón (260 ± 140 μm), desechos mineros (350 ± 140 μm) y microperlas de poliestireno (3 μm). Los datos de estos materiales se describen en la sección Resultados representativos. Consulte la Tabla de materiales adjunta para obtener más descripciones del biocarbón, los desechos de las minas y las microperlas.
- Vuelva a cubrir el matraz con el parafilm y colóquelo de nuevo en una coctelera orbital, utilizando la misma velocidad y temperatura ambiente (20 - 25 °C) durante 3 días más. Quite las partículas encapsuladas BC para su análisis, eliminación u otros usos.
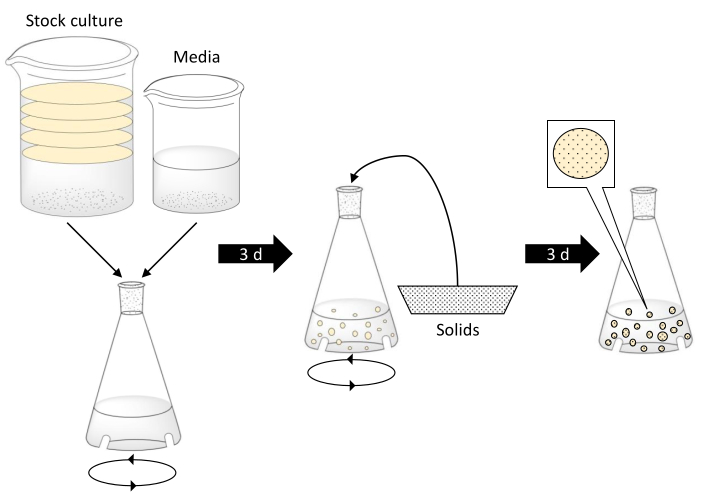
Figura 1. Fabricación de esferas de celulosa bacteriana y encapsulación de partículas sólidas. El paso 1 implica la combinación de cultivos de cepas bacterianas con té negro, azúcar y medios de vinagre en un matraz desconcertado. Los discos en la cultura de stock representan tapetes BC. Luego, el matraz desconcertado se coloca en una mesa de agitación orbital durante 3 días. El paso central muestra los sólidos que se añaden al matraz una vez que se han formado las esferas BC. El matraz se agita durante 3 días más. En el paso final, las esferas BC han seguido aumentando de tamaño y encapsulado las partículas sólidas. Haga clic aquí para ver una versión más amplia de esta figura.
Resultados
Las esferas BC tienen la tasa de crecimiento más rápida durante las primeras 48 h de cultivo (Figura 2). La Figura 2 también muestra cómo las esferas tienden a alcanzar un tamaño promedio máximo y luego permanecen constantes. En este experimento, las esferas alcanzaron un diámetro promedio de 7,5 ± 0,2 mm. Aunque las esferas bc nunca se deterioran por completo dentro del período de crecimiento de 10 días, comenzaron a formar zarcillos que se extienden ...
Discusión
Este protocolo describe los métodos de producción y encapsulación de la esfera BC que son fáciles de conducir y rentables. A través de varios ajustes al protocolo original, se ha identificado un proceso adecuado. Se deben seguir medidas críticas para garantizar esferas viables. Todos los ingredientes involucrados en la formación de BC juegan un papel clave en la salud y durabilidad de las esferas. La sacarosa alimenta a los organismos, el té aporta nitrógeno y el vinagre baja el pH a condiciones óptimas para pr...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo es una continuación de un proyecto del Programa de Mentoría asistente de investigación de Montana Tech por Adolfo Martínez, Catherine Mulholland, Tyler Somerville y Laurel Bitterman. La investigación fue patrocinada por la Fundación Nacional de Ciencias en el marco de la Subvención No. OIA-1757351 y el Laboratorio de Investigación del Ejército del Comando de Desarrollo de Capacidades de Combate (Acuerdo de Cooperación Número W911NF-15-2-0020). Todas las opiniones, hallazgos y conclusiones, o recomendaciones expresadas en este material son las de los autores y no reflejan necesariamente los puntos de vista de la Fundación Nacional de Ciencias o el Laboratorio de Investigación del Ejército. También nos gustaría agradecer a Amy Kuenzi, Lee Richards, Katelyn Alley, Chris Gammons, Max Wohlgenant y Kris Bosch por sus contribuciones.
Materiales
| Name | Company | Catalog Number | Comments |
| 100 mL graduated cylinder | |||
| 1000 mL beaker | |||
| 25 mL graduated cylinder | |||
| 250 mL Erlenmeyer baffled flask | Chemglass | CLS-2040-02 | |
| 500 mL beaker | |||
| Balance | |||
| Biochar | Ponderosa pine heat treated under argon gas, heated at 15 °C per minute to 800 °C | ||
| Black tea | |||
| Deionized water | |||
| Distilled white vinegar | |||
| Elastic band | |||
| Microbial starter culture | Cultures for Health | ||
| Mine waste | Collected from Butte, MT: 46.001978,-112.582465. Mine waste contains soil and metals originating from past copper mining. Mn, Si, Ca, Al, and Fe were the five most prevalent elements measured in the mine waste through x-ray diffraction. | ||
| Mortar and pestle | |||
| Orbital shaker | Used various brands | ||
| Paper towel | |||
| Polystyrene microbeads | Polybead | 17138 | 3 micron diameter |
| Stir rod | |||
| Sucrose | |||
| Tea kettle | |||
| TGA | TA Instruments | TA Q500 | 400 °C/min to 800 °C, 100 mL/min N2 |
| Thermometer | |||
| XRF Analyzer | ThermoFisher Scientific | 10131166 |
Referencias
- Mohainin Mohammad, S., Abd Rahman, N., Sahaid Khalil, M., Rozaimah Sheikh Abdullah, S. An Overview of Biocellulose Production Using Acetobacter xylinum Culture. Advances in Biological Research. 8 (6), 307-313 (2014).
- Dufresne, A. Bacterial cellulose. Nanocellulose. , 125-146 (2017).
- Czaja, W., Romanovicz, D., Brown, R. M. Structural investigations of microbial cellulose produced in stationary and agitated culture. Cellulose. 11 (3-4), 403-411 (2004).
- Hu, Y., Catchmark, J. M. Formation and characterization of spherelike bacterial cellulose particles produced by acetobacter xylinum JCM 9730 strain. Biomacromolecules. 11 (7), 1727-1734 (2010).
- Goh, W. N., Rosma, A., Kaur, B., Fazilah, A., Karim, A. A., Bhat, R. Microstructure and physical properties of microbial cellulose produced during fermentation of black tea broth (kombucha). International Food Research Journal. 19 (1), 153-158 (2012).
- Toyosaki, H., Naritomi, T., Seto, A., Matsuoka, M., Tsuchida, T., Yoshinaga, F. Screening of Bacterial Cellulose-producing Acetobacter Strains Suitable for Agitated Culture. Bioscience, Biotechnology, and Biochemistry. 59 (8), 1498-1502 (1995).
- Shi, Z., Zhang, Y., Phillips, G. O., Yang, G. Utilization of bacterial cellulose in food. Food Hydrocolloids. 35, 539-545 (2014).
- Holland, M. C., Eggensperger, C. G., Giagnorio, M., Schiffman, J. D., Tiraferri, A., Zodrow, K. R. Facile Postprocessing Alters the Permeability and Selectivity of Microbial Cellulose Ultrafiltration Membranes. Environmental Science and Technology. 54 (20), 13249-13256 (2020).
- Le Hoang, S., Vu, C. M., Pham, L. T., Choi, H. J. Preparation and physical characteristics of epoxy resin/ bacterial cellulose biocomposites. Polymer Bulletin. 75 (6), 2607-2625 (2018).
- Vu, C. M., Nguyen, D. D., Sinh, L. H., Pham, T. D., Pham, L. T., Choi, H. J. Environmentally benign green composites based on epoxy resin/bacterial cellulose reinforced glass fiber: Fabrication and mechanical characteristics. Polymer Testing. 61, 150-161 (2017).
- Pavaloiu, R. D., Stoica, A., Stroescu, M., Dobre, T. Controlled release of amoxicillin from bacterial cellulose membranes. Central European Journal of Chemistry. 12 (9), 962-967 (2014).
- Trovatti, E., et al. Biocellulose membranes as supports for dermal release of lidocaine. Biomacromolecules. 12 (11), 4162-4168 (2011).
- Trovatti, E., et al. Bacterial cellulose membranes applied in topical and transdermal delivery of lidocaine hydrochloride and ibuprofen: In vitro diffusion studies. International Journal of Pharmaceutics. 435 (1), 83-87 (2012).
- Shaviv, A., Mikkelsen, R. L. Controlled-release fertilizers to increase efficiency of nutrient use and minimize environmental degradation - A review. Fertilizer Research. 35 (1-2), 1-12 (1993).
- Eggensperger, C. G., et al. Sustainable living filtration membranes. Environmental Science and Technology Letters. 7 (3), 213-218 (2020).
- Schröpfer, S. B., et al. Biodegradation evaluation of bacterial cellulose, vegetable cellulose and poly (3-hydroxybutyrate) in soil. Polimeros. 25 (2), 154-160 (2015).
- Orts, W. J., Glenn, G. M. Reducing soil erosion losses with small applications of biopolymers. ACS Symposium Series. 723, 235-247 (1999).
- Mohite, B. V., Patil, S. V. A novel biomaterial: Bacterial cellulose and its new era applications. Biotechnology and Applied Biochemistry. 61 (2), 101-110 (2014).
- Mikkelsen, R. L. Using hydrophilic polymers to control nutrient release. Fertilizer Research. 38 (1), 53-59 (1994).
- Du, C. W., Zhou, J. M., Shaviv, A. Release characteristics of nutrients from polymer-coated compound controlled release fertilizers. Journal of Polymers and the Environment. 14 (3), 223-230 (2006).
- Serafica, G., Mormino, R., Bungay, H. Inclusion of solid particles in bacterial cellulose. Applied Microbiology and Biotechnology. 58 (6), 756-760 (2002).
- Tomaszewska, M., Jarosiewicz, A. Use of polysulfone in controlled-release NPK fertilizer formulations. Journal of Agricultural and Food Chemistry. 50 (16), 4634-4639 (2002).
- González, M. E., et al. Evaluation of biodegradable polymers as encapsulating agents for the development of a urea controlled-release fertilizer using biochar as support material. Science of the Total Environment. 505, 446-453 (2015).
- Shavit, U., Shaviv, A., Shalit, G., Zaslavsky, D. Release characteristics of a new controlled release fertilizer. Journal of Controlled Release. 43 (2-3), 131-138 (1997).
- Kolakovic, R., Laaksonen, T., Peltonen, L., Laukkanen, A., Hirvonen, J. Spray-dried nanofibrillar cellulose microparticles for sustained drug release. International Journal of Pharmaceutics. 430 (1-2), 47-55 (2012).
- Zaharia, A., et al. Bacterial cellulose-poly(acrylic acid-: Co-N, N ′-methylene-bis-acrylamide) interpenetrated networks for the controlled release of fertilizers. RSC Advances. 8 (32), 17635-17644 (2018).
- Peterson, J. D., Vyazovkin, S., Wight, C. A. Kinetics of the thermal and thermo-oxidative degradation of polystyrene, polyethylene and poly(propylene). Macromolecular Chemistry and Physics. 202 (6), 775-784 (2001).
- Goh, W. N., Rosma, A., Kaur, B., Fazilah, A., Karim, A. A., Bhat, R. Fermentation of black tea broth (kombucha): I. effects of sucrose concentration and fermentation time on the yield of microbial cellulose. International Food Research Journal. 19 (1), 109-117 (2012).
- Zhu, H., Jia, S., Yang, H., Jia, Y., Yan, L., Li, J. Preparation and application of bacterial cellulose sphere: A novel biomaterial. Biotechnology and Biotechnological Equipment. 25 (1), 2233-2236 (2011).
- Nguyen, V. T., Flanagan, B., Gidley, M. J., Dykes, G. A. Characterization of cellulose production by a Gluconacetobacter xylinus strain from Kombucha. Current Microbiology. 57 (5), 449-453 (2008).
- Costa, A. F. S., Almeida, F. C. G., Vinhas, G. M., Sarubbo, L. A. Production of bacterial cellulose by Gluconacetobacter hansenii using corn steep liquor as nutrient sources. Frontiers in Microbiology. 8, 1-12 (2017).
- Watanabe, K., Tabuchi, M., Morinaga, Y., Yoshinaga, F. Structural features and properties of bacterial cellulose produced in agitated culture. Cellulose. 5 (3), 187-200 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados