Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Bakterielle Cellulosekugeln, die feste Materialien verkapseln
In diesem Artikel
Zusammenfassung
Dieses Protokoll stellt eine einfache, kostengünstige Methode zur Bildung von bakteriellen Cellulosekugeln (BC) dar. Dieses Biomaterial kann als Verkapselungsmedium für feste Materialien, einschließlich Pflanzenkohle, Polymerkugeln und Minenabfälle, fungieren.
Zusammenfassung
Bakterielle Cellulosekugeln (BC) wurden seit der Popularisierung von BC als neuartiges Material zunehmend erforscht. Dieses Protokoll stellt eine erschwingliche und einfache Methode für die BC-Kugelproduktion dar. Neben der Herstellung dieser Kugeln wurde auch ein Verkapselungsverfahren für feste Partikel identifiziert. Zur Herstellung von BC-Kugeln werden Wasser, schwarzer Tee, Zucker, Essig und Bakterienkultur in einem verfackelten Kolben kombiniert und der Inhalt gerührt. Nach der Bestimmung der richtigen Kulturbedingungen für die BC-Kugelbildung wurde ihre Fähigkeit, feste Partikel zu verkapseln, mit Pflanzenkohle, Polymerperlen und Minenabfällen getestet. Die Sphären wurden mit der ImageJ-Software und der thermischen gravimetrischen Analyse (TGA) charakterisiert. Die Ergebnisse zeigen, dass Kugeln mit 7,5 mm Durchmesser in 7 Tagen hergestellt werden können. Die Zugabe verschiedener Partikel erhöht den durchschnittlichen Größenbereich der BC-Kapseln. Die Kugeln verkapselten 10 - 20% ihrer Trockenmasse. Diese Methode zeigt eine kostengünstige Kugelherstellung und Verkapselung, die mit leicht erhältlichen Materialien möglich ist. BC-Kugeln können in Zukunft als Hilfsmittel zur Entfernung von Verunreinigungen, als Düngemittelbeschichtung mit kontrollierter Freisetzung oder als Bodenverbesserung verwendet werden.
Einleitung
Bakterielle Cellulose (BC) ist aufgrund ihrer mechanischen Festigkeit, hohen Reinheit und Kristallinität, Wasserrückhaltefähigkeit und kompliziertenFaserstruktur 1, 2,3,4für ihre potenzielle Verwendung in der Industrie bekannt. Diese Eigenschaften machen BC zu einem günstigen Biomaterial für eine Vielzahl von Anwendungen, einschließlich biomedizinischer, lebensmittelverarbeitender und Umweltsanierungsanwendungen1. Die Bildung eines BC-Films kann mit Einzelorganismuskulturen oder Mischkulturen erfolgen, wie sie für Kombucha5,ein fermentiertes Teegetränk, verwendet werden. Das Brauen von Kombucha beruht auf einer "symbiotischen Kultur von Bakterien und Hefe", allgemein bekannt als SCOBY. Unter Verwendung dieser symbiotischen Kultur von Organismen wird eine ähnliche Technik verwendet, um BC-Kugeln zu erzeugen. Dieses Biomaterial kann verwendet werden, um Umweltschadstoffe zu isolieren und landwirtschaftliche Ergänzungen wie Pflanzenkohle zu verankern, um eine effizientere Pflanzenproduktion zu erreichen.
In der früheren Literatur wurde diskutiert, wie die Eigenschaften von BC, die unter bewegten Bedingungen produziert werden, mit BC verglichen werden, die in einer stationären Kultur produziert werden. Eine stationäre Kultur führt zu einem Film, der sich an der Flüssigkeit-Luft-Grenzfläche bildet, während eine geschüttelte Kultur zu unterschiedlichen BC-Partikeln, Strängen und Kugeln führt, die in der Flüssigkeit6suspendiert sind. Viele Studien haben sich auf die Behauptung bezogen, dass die kommerzielle Produktion von BC unter den dynamischenBedingungen 6,7praktikabler ist, was eine Begründung für die Anwendung der Methode dieses Papiers liefert. Darüber hinaus wurden verschiedene Untersuchungen zur Struktur und den Eigenschaften von BC-Kugeln durchgeführt. Toyosaki et al.6 verglichen verwirrte und glattwandige Erlenmeyerkolben in ihrer bewegten BC-Produktion. Eine Studie von Hu und Catchmark 4 bestimmtedie Bedingungen für BC-Kugeln, die als Richtlinien für den aktuellen BC-Kugelproduktionsprozess verwendet wurden, und ihre Ergebnisse deuten darauf hin, dass die Kugelgröße nach 60 Stunden nicht weiter zunimmt. Eine Überprüfung der BC-Produktion durch Mohammad et al.1 zeigt, dass das Schütteln der BC-Kultur eine gleichmäßige Sauerstoffversorgung und -verteilung gewährleistet, die für ein erfolgreiches BC-Wachstum notwendig ist. Holland et al.8 haben die Kristallinität und chemische Struktur von BC mittels Röntgenbeugung und Fourier-Transformations-Infrarotspektroskopie untersucht. Es wird angenommen, dass BC-Kapseln ähnliche Eigenschaften aufweisen und zukünftige Forschung strukturelle Eigenschaften untersuchen wird. Studien haben auch die positiven Auswirkungen der Verwendung von BC zur Herstellung verbesserter Biokomposite untersucht. Unter Verwendung von Epoxidharz als Basis haben Forscher gezeigt, dass die Zugabe von BC Materialeigenschaften wie Ermüdungslebensdauer, Bruchzähigkeit sowie Zug- undBiegefestigkeit verbessert 9,10. Wie frühere und aktuelle Forschungen zeigen, sind viele an der Kommerzialisierung der BC-Nutzung interessiert.
Viele Forscher haben bakterielle Cellulose in kontrollierten Freisetzungssystemen untersucht, und die hier beschriebene Methode erzeugt Kapseln, die als kontrollierte Freisetzungssysteme verwendet werden könnten. Ein Großteil dieser Forschung konzentriert sich auf die kontrollierte Freisetzung im biomedizinischen Bereich sowie auf einige Untersuchungen in der Verabreichung von Düngemitteln mit kontrollierter Freisetzung (CRF). Basierend auf dem Erfolg der kontrollierten Freisetzung von Amoxicillin11, Lidocain12und Ibuprofen13durch BC kann BC ähnliche Abgabeeigenschaften wie bei anderen Substanzen wie einem pelletierten Dünger aufweisen. Ein Überblick über CRFs von Shaviv und Mikkelsen14 erkennt an, dass CRFs effizienter sind, Arbeit sparen und im Allgemeinen weniger Umweltzerstörung verursachen als herkömmliche Düngemittelanwendungen. Bakterielle Cellulose kann als günstiges Verkapselungsmaterial für CRFs wirken. Düngemittel können aus BC-Membranen austreten oder als BC-Biologisch abbaubarsein 15,16. Die hohe Quellfähigkeit von BC kann auch als vorteilhafte Bodenverbesserung17 , 18,19wirken, da sowohl Düngemittelnährstoffe als auch Feuchtigkeit durch die Anwendung von BC-Kugeln in den Boden gelangen können. Mit diesen Eigenschaften kann ein CRF, das durch BC-Kugelverkapselung gebildet wird, einen Vorteil gegenüber anderen Düngemittelbeschichtungsmaterialien haben, die während ihrer Produktions- und Entsorgungsphasen negative Auswirkungen haben könnten. Die Anpassung von BC an eine Düngemittelbeschichtung kann die CRF-Technologien weiter verbessern. Durch die Senkung der Düngemittelfreisetzungsrate haben die Pflanzen genügend Zeit, um den Dünger zu aufnehmen und einen übermäßigen Abfluss in Gewässer zu verhindern, wodurch eutrophierende und nicht sauerstoffreiche Zonen reduziert werden. Ähnliche langsam freisetzende Düngemittel wurden mit Polymerbeschichtungen hergestellt und pilotiert20.
Im Gegensatz zu Protokollen, die in früheren Forschungen beschrieben wurden, konzentriert sich dieses auf eine gleichmäßige, kohäsive Kugelproduktion und nicht auf eine hohe Celluloseausbeute. Darüber hinaus wurde die BC-Verkapselung anderer Feststoffe mit Cellulosefilmen, aber nicht mit Kugeln21untersucht. Durch die Ausweitung der Forschung an bakteriellen Cellulosekugeln können weitere Schritte unternommen werden, um BC kommerziell herzustellen, was aufgrund der umweltverträglichen Eigenschaften von BC von Vorteil ist. Diese Methode der BC-Kugelherstellung verwendet kostengünstige, leicht verfügbare kulinarische Zutaten. Nach der ersten Montage beginnen sich BC-Kugeln innerhalb von 2 Tagen ohne Störungen zu bilden. Die Herstellung von BC-Kugeln durch diese Strategie benötigt wenig Platz und hat ein essbares Nebenprodukt, den fermentierten Tee "Kombucha". Verkapselungstechniken, die in anderen Studien erwähnt werden, umfassenBeschichtungen,die durch die Phaseninversionstechnik22,23, Matrixbildung24,Sprühtrocknung 25und direkte Verkapselung während der Synthese gebildet werden26. Die in diesem Manuskript beschriebene methode der direkten Verkapselung ist nützlich für diejenigen, die einen einfachen, kostengünstigen Prozess wünschen, der leicht verfügbare Materialien verwendet.
Durch diese Forschung wurde ein erfolgreiches Protokoll für die Bc-Kugelproduktion und -verkapselung erstellt. BC-Kugeln können feste Partikel aus Pflanzenkohle, Minenhalden und Polystyrol-Mikroperlen in ihren individuellen Strukturen einkapseln. Obwohl BC in der Industrie noch nicht weit verbreitet ist, ist es ein praktisches, nachhaltig hergestelltes und natürlich vorkommendes Material, das für zukünftige Anwendungen verwendet werden könnte.
Protokoll
1. Erstellung und Pflege einer bakteriellen Cellulose-Starterkultur
- Erhalten Sie eine Starterkultur von bakterieller Cellulose, ca. 50 g, in Form eines SCOBY. Es kann kommerziell erworben werden (z. B. von Cultures for Health). Legen Sie den SCOBY in ein 1 L Becherglas, bedeckt mit einem Papiertuch.
- Kochen Sie 700 ml entionisiertes Wasser, geben Sie es in ein separates Gefäß von dem, das das SCOBY enthält, und fügen Sie 85 g Saccharose hinzu.
- Sobald sich die Saccharose aufgelöst hat, fügen Sie 2 Beutel schwarzen Tee (4,87 g) hinzu. Den Tee 1 h ziehen lassen, dann die Teebeutel vorsichtig mit einem Rührstab entfernen.
- Fügen Sie 200 ml destillierten weißen Essig zum Tee hinzu. Die Mischung auf 25 °C abkühlen lassen. Nach dem Abkühlen 700 ml des Tees bei Raumtemperatur in das Becherglas geben, das den SCOBY enthält.
VORSICHT: Das Hinzufügen des sauren Tees, während es zu heiß ist, kann die Organismen im SCOBY schädigen. - Decken Sie das Becherglas mit einem Papiertuch ab, befestiger Sie es mit einem elastischen Band und stellen Sie das Becherglas in einen Lagerbereich, der eine Temperatur von 25 ° C beibehält. Dieses Schiff wird allgemein als Stockkultur oder Hotel bezeichnet.
- Um den SCOBY gesund zu halten, ist eine Wartung etwa 2 Mal im Monat erforderlich.
- Mit behandschuhten Händen, um die SCOBY-Matten zurückzuhalten, lassen Sie die Flüssigkeit aus dem Hotel in ein separates Becherglas ab. In den Behälter mit der Flüssigkeit genügend sauren Tee für insgesamt 700 ml Lösung geben.
- 65 g Saccharose im Behälter mit dem sauren Tee auflösen. Während Sie darauf warten, dass sich die Saccharose aufgelöst hat, spülen Sie die SCOBY-Matten vorsichtig in DI-Wasser ab.
- Sobald die Saccharose vollständig gelöst ist, kann die Flüssigkeit in das Becherglas mit den gespülten SCOBY-Matten geben. Decken Sie das Becherglas ab und bringen Sie es in den Inkubationsbereich zurück.
2. Herstellung von bakteriellen Cellulosekugeln
HINWEIS: Seien Sie vorsichtig, wenn Sie mit kochendem Wasser arbeiten. Stellen Sie sicher, dass Glaswaren den kochenden Wassertemperaturen standhalten, frei von Defekten sind und die richtige Größe haben. Ein Schema, das die Herstellung von BC-Kugeln beschreibt, ist in Abbildung 1 dargestellt.
- Kochen Sie 350 ml entionisiertes Wasser mit einem Teekessel. Das heiße Wasser in ein 500 ml Becherglas geben. 42,5 g granulierte Saccharose mit einem Rührstab in das heiße Wasser auflösen.
- Wenn die Saccharose vollständig aufgelöst ist, 1 Beutel schwarzen Tee (2,54 g) in den Kolben mit saccharose und Wasser für 1 h ziehen. Danach entfernen Sie den Teebeutel mit einem Rührstab, achten Sie darauf, dass der Teebeutel nicht aufgebrochen wird, und entsorgen Sie ihn dann im Müll.
- Fügen Sie 100 ml destillierten weißen Essig zum Becherglas hinzu und rühren Sie die Mischung dann gründlich um. 80 ml der sauren Teemischung in einen 250 ml geblendeten Kolben geben. Die Teemischung auf Raumtemperatur von 20 - 25 °C abkühlen lassen.
HINWEIS: An dieser Stelle kann die Mischung über Nacht oder bis zur Vorbereitung für den nächsten Schritt abkühlen gelassen werden. - Sobald die Flüssigkeitstemperatur raumtemperatur (20 - 25 °C) erreicht ist, fügen Sie 20 ml mikrobielle Starterkulturflüssigkeit in den schallgefassten Kolben hinzu. Diese Flüssigkeit kann von einem SCOBY Hotel bezogen werden. Decken Sie den Kolben mit Parafilm ab.
- Legen Sie den verblüfften Kolben auf einen Orbital-Schütteltisch und stellen Sie die Geschwindigkeit auf 125 Umdrehungen pro Minute (U /min) ein. Lassen Sie die Mischung 3 Tage in einem Raum oder Inkubator mit einer Temperatur von 20 - 25 ° C schütteln, um BC-Kugeln herzustellen.
HINWEIS: Wenn sich im Kolbeninhalt unregelmäßige Formen bilden oder zellulose Klumpen an den Wänden des Kolbens haften, sollten sie entfernt werden, um die Bildung weiterer unregelmäßiger BC-Massen zu verhindern. Verwenden Sie eine Pinzette, um unerwünschte BC-Massen zu entfernen, einschließlich dünner Schnüre, Ringe, Rohrformen und anderer eindeutig nicht kugelförmiger Formen. - Sobald sich die Kugeln gebildet haben, gießen Sie sie vorsichtig aus dem Kolben und analysieren, entsorgen oder verwenden Sie sie auf eine Weise, die in diesem Papier nicht beschrieben wird.
3. Verwendung von bakteriellen Cellulosekugeln zur Verkapselung von Partikeln oder Verunreinigungen
- Führen Sie die Schritte 2.1-2.5 oben aus.
- Nach 3 Tagen Schütteln etwa 0,01 g fein gemahlenen Feinstaub in den verunrätzten Kolben geben. Geeignete Feststoffe sind Pflanzenkohle (260 ± 140 μm), Minenabfälle (350 ± 140 μm) und Polystyrol-Mikroperlen (3 μm). Die Daten für diese Materialien finden Sie im Abschnitt Repräsentative Ergebnisse. Weitere Beschreibungen von Pflanzenkohle, Minenabfällen und Mikroperlen finden Sie in der beigefügten Materialtabelle.
- Decken Sie den Kolben erneut mit dem Parafilm ab und legen Sie ihn bei gleicher Geschwindigkeit und Umgebungstemperatur (20 - 25 °C) für weitere 3 Tage wieder auf einen Orbitalschüttler. Entfernen Sie die BC-verkapselten Partikel zur Analyse, Entsorgung oder zu anderen Verwendungszwecken.
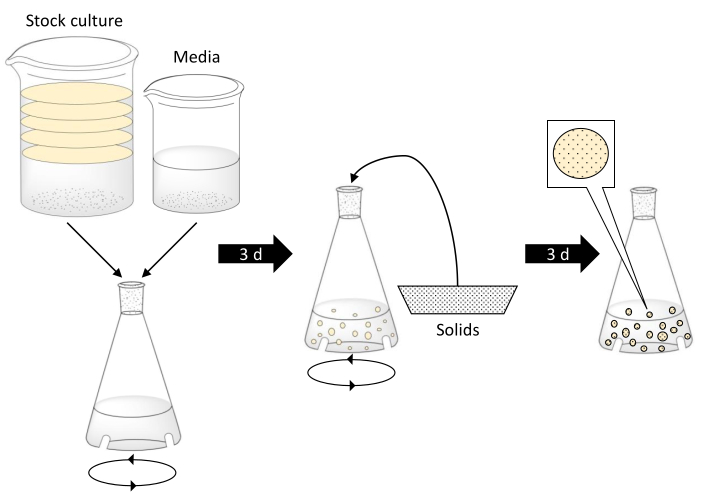
Abbildung 1. Bakterielle Cellulosekugelherstellung und Verkapselung fester Partikel. Schritt 1 beinhaltet die Kombination von bakterieller Stammkultur mit schwarzem Tee, Zucker und Essigmedien in einem verblüfften Kolben. Die Scheiben in der Stammkultur stellen BC-Matten dar. Dann wird der verblüffene Kolben für 3 Tage auf einen Orbital-Schütteltisch gelegt. Der mittlere Schritt zeigt, wie Feststoffe dem Kolben zugesetzt werden, sobald sich BC-Kugeln gebildet haben. Der Kolben wird für weitere 3 Tage geschüttelt. Im letzten Schritt haben BC-Kugeln weiter an Größe zugenommen und die festen Partikel eingekapselt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
BC-Kugeln haben die schnellste Wachstumsrate während der ersten 48 Stunden der Kultur (Abbildung 2). Abbildung 2 zeigt auch, wie die Kugeln dazu neigen, eine maximale durchschnittliche Größe zu erreichen und dann konstant zu bleiben. In diesem Experiment erreichten die Kugeln einen durchschnittlichen Durchmesser von 7,5 ± 0,2 mm. Obwohl sich die BC-Kugeln innerhalb der 10-tägigen Wachstumsperiode nie vollständig verschlechtern, begannen sie, Ranken zu bild...
Diskussion
Dieses Protokoll beschreibt BC-Kugelproduktions- und Verkapselungsmethoden, die einfach durchzuführen und kostengünstig sind. Durch verschiedene Anpassungen des ursprünglichen Protokolls wurde ein adäquater Prozess identifiziert. Kritische Schritte müssen befolgt werden, um lebensfähige Sphären zu gewährleisten. Alle Inhaltsstoffe, die an der BC-Bildung beteiligt sind, spielen eine Schlüsselrolle für die Gesundheit und Haltbarkeit der Kugeln. Die Saccharose ernährt Organismen, der Tee liefert Stickstoff und de...
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Diese Arbeit ist eine Fortsetzung eines Montana Tech Research Assistant Mentorship Program-Projekts von Adolfo Martinez, Catherine Mulholland, Tyler Somerville und Laurel Bitterman. Die Forschung wurde von der National Science Foundation unter der Fördernummer gefördert. OIA-1757351 und das Combat Capabilities Development Command Army Research Laboratory (Kooperationsvertragsnummer W911NF-15-2-0020). Alle Meinungen, Ergebnisse und Schlussfolgerungen oder Empfehlungen, die in diesem Material zum Ausdruck gebracht werden, sind die der Autoren und spiegeln nicht unbedingt die Ansichten der National Science Foundation oder des Army Research Lab wider. Wir danken auch Amy Kuenzi, Lee Richards, Katelyn Alley, Chris Gammons, Max Wohlgenant und Kris Bosch für ihre Beiträge.
Materialien
| Name | Company | Catalog Number | Comments |
| 100 mL graduated cylinder | |||
| 1000 mL beaker | |||
| 25 mL graduated cylinder | |||
| 250 mL Erlenmeyer baffled flask | Chemglass | CLS-2040-02 | |
| 500 mL beaker | |||
| Balance | |||
| Biochar | Ponderosa pine heat treated under argon gas, heated at 15 °C per minute to 800 °C | ||
| Black tea | |||
| Deionized water | |||
| Distilled white vinegar | |||
| Elastic band | |||
| Microbial starter culture | Cultures for Health | ||
| Mine waste | Collected from Butte, MT: 46.001978,-112.582465. Mine waste contains soil and metals originating from past copper mining. Mn, Si, Ca, Al, and Fe were the five most prevalent elements measured in the mine waste through x-ray diffraction. | ||
| Mortar and pestle | |||
| Orbital shaker | Used various brands | ||
| Paper towel | |||
| Polystyrene microbeads | Polybead | 17138 | 3 micron diameter |
| Stir rod | |||
| Sucrose | |||
| Tea kettle | |||
| TGA | TA Instruments | TA Q500 | 400 °C/min to 800 °C, 100 mL/min N2 |
| Thermometer | |||
| XRF Analyzer | ThermoFisher Scientific | 10131166 |
Referenzen
- Mohainin Mohammad, S., Abd Rahman, N., Sahaid Khalil, M., Rozaimah Sheikh Abdullah, S. An Overview of Biocellulose Production Using Acetobacter xylinum Culture. Advances in Biological Research. 8 (6), 307-313 (2014).
- Dufresne, A. Bacterial cellulose. Nanocellulose. , 125-146 (2017).
- Czaja, W., Romanovicz, D., Brown, R. M. Structural investigations of microbial cellulose produced in stationary and agitated culture. Cellulose. 11 (3-4), 403-411 (2004).
- Hu, Y., Catchmark, J. M. Formation and characterization of spherelike bacterial cellulose particles produced by acetobacter xylinum JCM 9730 strain. Biomacromolecules. 11 (7), 1727-1734 (2010).
- Goh, W. N., Rosma, A., Kaur, B., Fazilah, A., Karim, A. A., Bhat, R. Microstructure and physical properties of microbial cellulose produced during fermentation of black tea broth (kombucha). International Food Research Journal. 19 (1), 153-158 (2012).
- Toyosaki, H., Naritomi, T., Seto, A., Matsuoka, M., Tsuchida, T., Yoshinaga, F. Screening of Bacterial Cellulose-producing Acetobacter Strains Suitable for Agitated Culture. Bioscience, Biotechnology, and Biochemistry. 59 (8), 1498-1502 (1995).
- Shi, Z., Zhang, Y., Phillips, G. O., Yang, G. Utilization of bacterial cellulose in food. Food Hydrocolloids. 35, 539-545 (2014).
- Holland, M. C., Eggensperger, C. G., Giagnorio, M., Schiffman, J. D., Tiraferri, A., Zodrow, K. R. Facile Postprocessing Alters the Permeability and Selectivity of Microbial Cellulose Ultrafiltration Membranes. Environmental Science and Technology. 54 (20), 13249-13256 (2020).
- Le Hoang, S., Vu, C. M., Pham, L. T., Choi, H. J. Preparation and physical characteristics of epoxy resin/ bacterial cellulose biocomposites. Polymer Bulletin. 75 (6), 2607-2625 (2018).
- Vu, C. M., Nguyen, D. D., Sinh, L. H., Pham, T. D., Pham, L. T., Choi, H. J. Environmentally benign green composites based on epoxy resin/bacterial cellulose reinforced glass fiber: Fabrication and mechanical characteristics. Polymer Testing. 61, 150-161 (2017).
- Pavaloiu, R. D., Stoica, A., Stroescu, M., Dobre, T. Controlled release of amoxicillin from bacterial cellulose membranes. Central European Journal of Chemistry. 12 (9), 962-967 (2014).
- Trovatti, E., et al. Biocellulose membranes as supports for dermal release of lidocaine. Biomacromolecules. 12 (11), 4162-4168 (2011).
- Trovatti, E., et al. Bacterial cellulose membranes applied in topical and transdermal delivery of lidocaine hydrochloride and ibuprofen: In vitro diffusion studies. International Journal of Pharmaceutics. 435 (1), 83-87 (2012).
- Shaviv, A., Mikkelsen, R. L. Controlled-release fertilizers to increase efficiency of nutrient use and minimize environmental degradation - A review. Fertilizer Research. 35 (1-2), 1-12 (1993).
- Eggensperger, C. G., et al. Sustainable living filtration membranes. Environmental Science and Technology Letters. 7 (3), 213-218 (2020).
- Schröpfer, S. B., et al. Biodegradation evaluation of bacterial cellulose, vegetable cellulose and poly (3-hydroxybutyrate) in soil. Polimeros. 25 (2), 154-160 (2015).
- Orts, W. J., Glenn, G. M. Reducing soil erosion losses with small applications of biopolymers. ACS Symposium Series. 723, 235-247 (1999).
- Mohite, B. V., Patil, S. V. A novel biomaterial: Bacterial cellulose and its new era applications. Biotechnology and Applied Biochemistry. 61 (2), 101-110 (2014).
- Mikkelsen, R. L. Using hydrophilic polymers to control nutrient release. Fertilizer Research. 38 (1), 53-59 (1994).
- Du, C. W., Zhou, J. M., Shaviv, A. Release characteristics of nutrients from polymer-coated compound controlled release fertilizers. Journal of Polymers and the Environment. 14 (3), 223-230 (2006).
- Serafica, G., Mormino, R., Bungay, H. Inclusion of solid particles in bacterial cellulose. Applied Microbiology and Biotechnology. 58 (6), 756-760 (2002).
- Tomaszewska, M., Jarosiewicz, A. Use of polysulfone in controlled-release NPK fertilizer formulations. Journal of Agricultural and Food Chemistry. 50 (16), 4634-4639 (2002).
- González, M. E., et al. Evaluation of biodegradable polymers as encapsulating agents for the development of a urea controlled-release fertilizer using biochar as support material. Science of the Total Environment. 505, 446-453 (2015).
- Shavit, U., Shaviv, A., Shalit, G., Zaslavsky, D. Release characteristics of a new controlled release fertilizer. Journal of Controlled Release. 43 (2-3), 131-138 (1997).
- Kolakovic, R., Laaksonen, T., Peltonen, L., Laukkanen, A., Hirvonen, J. Spray-dried nanofibrillar cellulose microparticles for sustained drug release. International Journal of Pharmaceutics. 430 (1-2), 47-55 (2012).
- Zaharia, A., et al. Bacterial cellulose-poly(acrylic acid-: Co-N, N ′-methylene-bis-acrylamide) interpenetrated networks for the controlled release of fertilizers. RSC Advances. 8 (32), 17635-17644 (2018).
- Peterson, J. D., Vyazovkin, S., Wight, C. A. Kinetics of the thermal and thermo-oxidative degradation of polystyrene, polyethylene and poly(propylene). Macromolecular Chemistry and Physics. 202 (6), 775-784 (2001).
- Goh, W. N., Rosma, A., Kaur, B., Fazilah, A., Karim, A. A., Bhat, R. Fermentation of black tea broth (kombucha): I. effects of sucrose concentration and fermentation time on the yield of microbial cellulose. International Food Research Journal. 19 (1), 109-117 (2012).
- Zhu, H., Jia, S., Yang, H., Jia, Y., Yan, L., Li, J. Preparation and application of bacterial cellulose sphere: A novel biomaterial. Biotechnology and Biotechnological Equipment. 25 (1), 2233-2236 (2011).
- Nguyen, V. T., Flanagan, B., Gidley, M. J., Dykes, G. A. Characterization of cellulose production by a Gluconacetobacter xylinus strain from Kombucha. Current Microbiology. 57 (5), 449-453 (2008).
- Costa, A. F. S., Almeida, F. C. G., Vinhas, G. M., Sarubbo, L. A. Production of bacterial cellulose by Gluconacetobacter hansenii using corn steep liquor as nutrient sources. Frontiers in Microbiology. 8, 1-12 (2017).
- Watanabe, K., Tabuchi, M., Morinaga, Y., Yoshinaga, F. Structural features and properties of bacterial cellulose produced in agitated culture. Cellulose. 5 (3), 187-200 (1998).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten