Method Article
Resonancia magnética cuantitativa de la permeabilidad endotelial y la (dis)función en la aterosclerosis
En este artículo
Resumen
Hemos desarrollado un método preciso, no invasivo y fácil de usar para cuantificar la permeabilidad y disfunción endotelial en las arterias mediante resonancia magnética (RM), denominado qMETRIC. Esta técnica permite evaluar el daño vascular y el riesgo cardiovascular asociado a la aterosclerosis en modelos preclínicos y humanos.
Resumen
Las enfermedades cardiovasculares son las principales causas de muerte en todo el mundo. Un endotelio permeable/permeable y disfuncional se considera el marcador más temprano de daño vascular y se cree que impulsa la aterosclerosis. Sería deseable un método para identificar estos cambios in vivo en la clínica. Las herramientas basadas en imágenes por resonancia magnética (RM) y otras tecnologías han permitido una comprensión profunda del papel del endotelio en las enfermedades cardiovasculares y el riesgo in vivo. Sin embargo, se necesitan enfoques reproducibles y sencillos para extraer datos cuantificables que reflejen el daño endotelial a partir de un solo estudio de imagen. Se desarrolló un flujo de trabajo de resonancia magnética cuantitativo, no invasivo, fácil de implementar para adquirir y analizar imágenes que permiten la cuantificación de dos biomarcadores de imagen de daño endotelial arterial (permeabilidad/permeabilidad y disfunción). Aquí, el protocolo describe la aplicación de este método en la arteria braquiocefálica de ratones ateroscleróticos ApoE-/- utilizando un escáner de resonancia magnética clínica. En primer lugar, se describen los protocolos de mapeo T1 de mejora tardía de gadolinio (LGE) y recuperación de inversión modificada (MOLLI) para cuantificar la fuga endotelial utilizando una sonda de unión a albúmina. En segundo lugar, se describen secuencias anatómicas y cuantitativas de flujo sanguíneo para medir la disfunción endotelial en respuesta a la acetilcolina. Es importante destacar que el método descrito aquí permite la adquisición de imágenes 3D de alta resolución espacial con una gran cobertura volumétrica, lo que permite una segmentación precisa de las estructuras de la pared de los vasos para mejorar la variabilidad entre observadores e intraobservador y aumentar la fiabilidad y la reproducibilidad. Además, proporciona datos cuantitativos sin necesidad de una alta resolución temporal para el modelado cinético complejo, lo que lo hace independiente del modelo e incluso permite obtener imágenes de vasos altamente móviles (arterias coronarias). Por lo tanto, el enfoque simplifica y agiliza el análisis de datos. Finalmente, este método se puede implementar en diferentes escáneres, se puede extender para obtener imágenes de diferentes lechos arteriales y es clínicamente aplicable para su uso en humanos. Este método podría utilizarse para diagnosticar y tratar a los pacientes con aterosclerosis mediante la adopción de un enfoque de medicina de precisión.
Introducción
Las enfermedades cardiovasculares (ECV) siguen siendo la principal causa de mortalidad y morbilidad en todo el mundo, representando casi un tercio de las muertes1, y la causa de discapacidades a lo largo de la vida que ejercen un alto costo financiero para los sistemas de salud1. Entre las ECV, la cardiopatía isquémica y el accidente cerebrovascular son causados principalmente por placas ateroscleróticas. La aterosclerosis es una enfermedad multifactorial; Sin embargo, un rasgo distintivo común es el daño temprano de las células endoteliales vasculares que conduce a la formación, progresión y eventuales complicaciones de la aterosclerosis. Un endotelio vascular intacto tiene propiedades vasculoprotectoras fundamentales2. El endotelio regula la permeabilidad vascular controlando la translocación de células y moléculas entre la circulación sistémica y la pared del vaso; controla el tono vascular equilibrando la producción de vasodilatadores (p. ej., óxido nítrico, prostaciclina) y vasoconstrictores (p. ej., endotelina-1, angiotensina II); y también tiene propiedades anticoagulantes. Sin embargo, tanto la función como la permeabilidad de las células endoteliales pueden deteriorarse en presencia de factores de riesgo cardiovascular (p. ej., tabaquismo, colesterol alto, diabetes, inflamación sistémica, estrés oxidativo) y por los patrones hemodinámicos del flujo sanguíneo. Un endotelio disfuncional ha reducido la vasodilatación en respuesta a los factores estresantes, lo que aumenta la rigidez arterial. Además, un endotelio permeable/permeable ha ensanchado las uniones estrechas entre las células adyacentes 3,4,5,6,7. Este cambio se produce tanto en el endotelio luminal como en los microvasos de la placa recién formados que parecen frágiles, permeables y dismórficos8. Las células endoteliales permeables actúan como puntos de entrada para las moléculas y células transportadas por plasma, lo que exacerba el riesgo de enfermedad cardiovascular.
Sobre la base de este conocimiento, en los últimos 15 años, la permeabilidad y la función endotelial se han convertido en un objetivo terapéutico y de imagen prometedor para diagnosticar mejor a los sujetos con riesgo de enfermedad cardiovascular y evaluar los efectos de fármacos conocidos o nuevos. Sin embargo, las imágenes directas y cuantitativas de la función del endotelio son limitadas 9,10,11,12. En la actualidad, gran parte de la interpretación de la función endotelial in vivo se basa en estudios de dilatación endotelial dependiente (DMF) en vasos periféricos, cuya función se correlaciona modestamente con la carga de aterosclerosis en lechos vasculares que causan eventos clínicos 13,14,15. Solo un número limitado de estudios de imagen han demostrado una relación directa entre la disfunción endotelial y la carga de aterosclerosis in vivo 9,10,11,12. Por el contrario, los enfoques más accesibles basados en la resonancia magnética han permitido una permeabilidad endotelial de imágenes más amplia. El uso del porcentaje de realce de la señal de la pared del vaso después de la administración de agentes de gadolinio en la RMN ha proporcionado una medición semicuantitativa de la permeabilidad endotelial16,17. Posteriormente, el desarrollo de protocolos dinámicos con contraste (DCE) ha permitido una medición mejorada y más cuantitativa de la permeabilidad endotelial vascular. Parámetros cuantitativos como la tasa de extravasación de contraste (Ktrans) y el volumen microvascular (Vρ) derivados del modelado cinético o del área bajo la curva (AUC), la pendiente ascendente, el tiempo hasta el pico y la concentración máxima extraída de métodos no modelados correlacionaron no solo con la permeabilidad endotelial sino también con la vascularización de la placa 18,19,20. Sin embargo, la aplicación de la DCE vascular sigue siendo un reto a pesar de los importantes avances técnicos porque: (i) requiere una alta resolución espacial (0,5-0,7mm2) y temporal21 para una delineación precisa de la pared del vaso. El muestreo de la concentración de agente de contraste en la sangre para calcular la función arterial de entrada también requiere un modelado cinético, lo que conduce a una compensación entre limitar la cobertura anatómica22,23 para obtener resolución temporal o viceversa24,25; (ii) el análisis de datos puede requerir un modelado farmacocinético complejo (por ejemplo, Patlak vs. Tofts); (iii) proporciona una calidad de imagen limitada, una reproducibilidad deficiente del escaneo y la reproducibilidad promedio entre observadores e intraobservadores26,27. Por lo tanto, todavía se necesitan enfoques reproducibles y sencillos para extraer datos directos y cuantificables de la permeabilidad endotelial y la (dis)función de estudios de imagen únicos que podrían tener una mejor utilidad clínica.
En este trabajo, hemos desarrollado una resonancia magnética cuantitativa, no invasiva, fácil de implementar y para adquirir y analizar imágenes que permite la cuantificación directa de dos marcadores de daño endotelial arterial (permeabilidad/permeabilidad y disfunción) utilizando modelos preclínicos de aterosclerosis en una sola exploración. El método se denomina Quantitative MRI of EndoThelial peRmeabIlidad ydisfuncición (qMETRIC). Consiste en la adquisición de protocolos de mapeo T1 de mejora tardía de gadolinio (LGE) y recuperación de inversión modificada (MOLLI) para cuantificar la fuga endotelial, después de la administración de una sonda intravascular de unión a albúmina; y adquisición de secuencias anatómicas y cuantitativas de flujo sanguíneo para medir la disfunción endotelial, en respuesta a un bolo de acetilcolina. Hemos demostrado que qMETRIC detecta con precisión: la gravedad de la aterosclerosis y el riesgo de complicaciones; respuestas al tratamiento; y puede adaptarse para su uso en pacientes 5,6,7. Es importante destacar que el método descrito aquí permite la adquisición de imágenes de alta resolución espacial para permitir una segmentación precisa de la pared del vaso para minimizar el sesgo inter/intraobservador y aumentar la fiabilidad y la reproducibilidad con una gran cobertura anatómica. Por último, este método puede adaptarse para su uso en diferentes escáneres y puede extenderse a la obtención de imágenes de diferentes lechos arteriales (incluso arterias coronarias28). El flujo de trabajo sencillo hace que este enfoque sea más accesible para la comunidad de imágenes cardiovasculares.
Protocolo
Todos los componentes de este estudio se llevaron a cabo de acuerdo con la Ley de Animales (Procedimientos Científicos) del Reino Unido de 1986 y con la aprobación del Panel de Revisión Ética del King's College de Londres.
El flujo de trabajo experimental se resume en la Figura 1.
1. Preparación animal
- Inducir la aterosclerosis alimentando a ratones ApoE-/- con una dieta alta en grasas que contiene un 21% de grasa de manteca de cerdo y un 0,15% (peso/peso) de colesterol en promedio durante un máximo de 12 semanas.
- Cargue una jeringa de insulina con aguja de 29 G con el volumen adecuado del agente de contraste (gadofosveset trisordium) para lograr una dosis de 0,03 mmol/kg. Mantenga el volumen de inyección entre 50-150 μL.
- Coloque la jaula sobre una almohadilla térmica ajustada a 37 °C para precalentar al animal y mantener la temperatura corporal.
- Inducir la anestesia colocando al ratón en una caja de inducción forrada con pañuelos absorbentes. Ajuste el caudalímetro al 3%-5% de isoflurano a 1 L/min de O2 durante unos 3-5 min.
NOTA: Asegúrese de que la profundidad de la anestesia sea correcta identificando la frecuencia respiratoria que disminuye, que debe disminuir a menos de 70 respiraciones por minuto (lpm). - Confirme la anestesia con el método de pinzamiento de los dedos de los pies (es decir, pérdida del reflejo de abstinencia al pellizco de los dedos de los pies). Transfiera al animal a un soporte e inserte su nariz en un cono de nariz. Coloque el soporte en una almohadilla térmica para mantener la temperatura corporal de los animales.
- Mantenga la anestesia, administrada a través de la nariz, ajustando el flujo de aire de la anestesia en el soporte a 1%-2% de isoflurano a 1 L/min de O2.
- Aplique ungüento veterinario en los ojos del animal para evitar la sequedad mientras está bajo anestesia.
- Coloque al animal boca abajo o de lado y limpie la cola con un hisopo con alcohol. Ubica una de las dos venas de la cola. Si es necesario, caliente la cola con una lámpara UV para que las venas de la cola sean más visibles.
- Inserte la aguja de insulina de 29 g paralela a la vena con el bisel de la aguja hacia arriba. Inyecte suavemente el volumen de la jeringa precargada que contiene gadofosveset trisódico. Asegúrese de que no haya sangrado en el lugar de la inyección después de retirar la aguja.
- Espere 30 segundos para que gadofosveset circule y luego transfiera el ratón a la cama de resonancia magnética.
2. Preparación del escáner de resonancia magnética (ver figura 1)
- Cubra la mesa de resonancia magnética con pañuelos absorbentes.
- Coloque la bobina receptora de bucle único para resonancia magnética en la cama de resonancia magnética. Utilice una plataforma para elevar la bobina receptora y evite el contacto directo entre la bobina receptora y la mesa de resonancia magnética.
- Asegure la bobina a la plataforma con cinta quirúrgica.
- Coloque y asegure el tubo conectado a una bomba de calor de circulación alrededor del serpentín y ajústelo a 37 °C para mantener la temperatura corporal del animal durante la toma de imágenes.
- Coloque el tubo de administración de anestesia en el orificio del escáner de resonancia magnética y péguelo con cinta adhesiva para que el cono de la nariz llegue a la punta de la bobina receptora donde se colocará la cabeza del animal.
- Encienda la cámara en el orificio para monitorear al animal desde la sala de la consola.
- En la sala de la consola de resonancia magnética, utilice la interfaz del software para iniciar un nuevo estudio para el animal (paciente).
3. Posicionamiento de los animales en el escáner de resonancia magnética y monitoreo (ver Figura 2)
- Transfiera al animal anestesiado a la sala de escáneres. Coloque el ratón en posición prona en la bobina receptora y asegúrese de que su hocico encaje en el cono de la nariz para mantener la anestesia. Aumente el flujo de aire de la anestesia a 1%-1,5% de isoflurano a 1 L/min de O2.
- Asegúrese de colocar al animal en la bobina de resonancia magnética con las regiones del corazón y el cuello ubicadas en el centro de la bobina receptora.
- Asegure la nariz del ratón en el cono de la nariz, el abdomen y la cola del ratón en la plataforma con cinta adhesiva.
- Coloque cuatro electrodos en las patas anterior y trasera, asegurándose de que la palma de los pies esté completamente abierta para registrar el electrocardiograma (ECG). Use gel conductor de ECG en las patas del ratón antes de colocar las almohadillas de ECG para mejorar la conductividad.
- Asegúrese de usar cinta adhesiva para sujetar firmemente los electrodos a la plataforma.
- Alinee el láser de la cama del escáner con la base (extremo proximal) del corazón; Usa la clavícula y la línea anterior de la pata como punto de referencia. Coloque el animal en el isocentro del imán utilizando una mesa de resonancia magnética automática.
4. Planificación y adquisición de imágenes de resonancia magnética
- Inicie una exploración para ejecutar las calibraciones estándar del sistema de resonancia magnética.
- Configure el equipo de monitoreo para detectar la onda R del ECG. Ajuste los umbrales para cada ratón y dentro de las sesiones de imagen para que haya una activación fiable.
NOTA: La frecuencia cardíaca del ratón bajo anestesia profunda suele oscilar entre 400 y 600 latidos por minuto (lpm). - Adquiera un escaneo de eco de gradiente 3D (GRE) para obtener imágenes piloto multiplanares (imágenes de exploración) para planificar el resto de las exploraciones (consulte la Tabla 1 para los parámetros de adquisición de RM y la Figura 3 para la planificación).
- Identifique el corazón en las imágenes de exploración, particularmente en la vista coronal, más fácilmente por sus artefactos de flujo.
NOTA: Si las imágenes muestran que el ratón no está bien centrado sobre la bobina o el isocentro, retraiga la cama y repita la posición. - Planifique una angiografía por resonancia magnética (ARM) con contraste en 3D (consulte la Tabla 1 para la exploración de los parámetros de adquisición de la RMN y la Figura 3 para la planificación) en un plano transversal que se extienda desde la base del corazón hacia el cuello y las arterias carótidas con un campo de visión (FOV) de 8 mm.
- Utilice las imágenes de proyección de máxima intensidad (MIP, por sus siglas en inglés) para visualizar el arco aórtico, las arterias braquiocefálicas y carótidas y planificar el realce tardío de gadolinio (LGE, por sus siglas en inglés) posterior, el mapeo de T1 y las exploraciones de cine (consulte la Figura 3 para obtener imágenes representativas).
NOTA: Si el nivel del volumen de la imagen no es correcto, repita la adquisición moviendo los cortes proximal o distalmente. - Adquisición de imágenes de resonancia magnética para medir la permeabilidad endotelial.
- Utilice las imágenes de MIP y ARM transversal adquiridas anteriormente para planificar una adquisición de 2D-Look-Locker (LL) de un solo corte perpendicular a la aorta ascendente o a las arterias carótidas (consulte la Tabla 1 para la exploración de los parámetros de adquisición de RMN y la Figura 3 para imágenes representativas).
- Ajuste la frecuencia cardíaca a 60 lpm cuando se utilice una señal de ECG simulada o establezca un período de supresión para garantizar que el pulso de recuperación de inversión entre los pulsos de recuperación de inversión posteriores sea de 1000 ms cuando se utilice la señal de ECG registrada.
- Utilice las imágenes de Look-Locker para determinar el tiempo de inversión (TI) óptimo para la anulación de la señal sanguínea necesaria para la exploración de LGE.
- Imagen de LGE: Después de 20-30 min de inyección de gadofosveset, e inmediatamente después de la exploración de LL (descrita en los pasos 4.7.1-4.7.3) adquiera una exploración de LGE utilizando una secuencia de eco de gradiente rápido 3D de recuperación de inversión (ver Tabla 1 para los parámetros de adquisición de RM y Figura 3 para imágenes representativas).
- Planifique una ecoografía LGE transversal de gradiente rápido en 3D para cubrir la base del corazón (para incluir parte de la raíz aórtica), la arteria braquiocefálica (entre la raíz aórtica y la bifurcación subclavia) y parte de las arterias carótidas con un campo de visión (FOV) de 8 mm en la dirección del pie y la cabeza utilizando la misma geometría que para la ARM anterior (consulte la Figura 3 para obtener imágenes representativas).
- Ajuste la frecuencia cardíaca a 60 lpm, cuando se utilice una señal de ECG simulada, o establezca un período de supresión para garantizar que se produzcan pulsos de recuperación de inversión sucesivos cada 1000 ms para la exploración LGE cuando se utilice la señal de ECG registrada (como para el paso 4.7.2 anterior).
NOTA: Esto es importante para la recuperación constante e independiente de la frecuencia cardíaca de la magnetización entre pulsos de recuperación de inversión sucesivos. - Inserte el T1 obtenido del Look-Locker en la secuencia LGE en Contrast > Inversion Delay.
- Imágenes de mapeo T1: Utilice una adquisición de eco de gradiente rápido en 3D para adquirir imágenes de mapeo T1 transversal 45 min después de la inyección de gadofosveset. Planifique la secuencia en la misma orientación y geometría que la exploración LGE anterior (consulte la Tabla 1 para los parámetros de adquisición de RMN y la Figura 3 para imágenes representativas).
- Ajuste la frecuencia cardíaca a 120 lpm, cuando se utilice un ECG simulado, o establezca un período de supresión para garantizar que el pulso de recuperación de inversión entre los dos trenes de imágenes se produzca cada 500 ms cuando se utilice la traza de ECG registrada.
NOTA: La secuencia de mapeo T1 utiliza dos pulsos de inversión no selectivos con tiempos de inversión entre 20 y 2000 ms, seguidos de ocho lecturas segmentadas para ocho imágenes individuales. La combinación de las dos estelas de imágenes da como resultado un total de dieciséis imágenes por corte con diferentes tiempos de inversión. Las imágenes se reconstruyen automáticamente en el escáner utilizando un modelo de ajuste de tres parámetros. Las ecuaciones utilizadas para generar los mapas paramétricos T1 son:
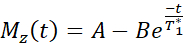
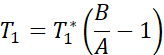
- Adquisición de imágenes de resonancia magnética para medir la función endotelial
- Prepare una solución de acetilcolina diluida en solución salina. Cargue una jeringa de insulina con aguja de 29 G con el volumen adecuado de solución para lograr (16,6 mg/kg). Mantenga el volumen de inyección entre 50-150 μL.
- Utilizando la ARM transversal y las imágenes MIP correspondientes, coloque un corte transversal a través de la arteria braquiocefálica, entre la raíz aórtica y la bifurcación subclavia (Figura 3 para imágenes representativas).
- Utilice un eco de gradiente 2D transversal (GRE) con activación retrospectiva de ECG para adquirir imágenes de cine resueltas temporalmente de la arteria braquiocefálica (consulte la Tabla 1 para los parámetros de adquisición de RM, Figura 3 para imágenes representativas).
- Ajustar el número de fases cardíacas máximas a la frecuencia cardíaca de cada animal.
NOTA: Normalmente, 14 fases cardíacas proporcionan una resolución temporal suficiente. - Después de adquirir las imágenes de referencia, ingrese a la sala de escáner de resonancia magnética. Mientras el ratón está anestesiado en el escáner, inyecte suavemente acetilcolina por vía intraperitoneal (IP). Evite mover el mouse sobre la bobina.
- Espere de 6 a 10 minutos para que la frecuencia cardíaca se estabilice y repita la adquisición.
- Al final del procedimiento de diagnóstico por imágenes, regrese el ratón a su jaula y colóquela sobre una almohadilla térmica para su recuperación.
NOTA: Los ratones se recuperan cuando recuperan la conciencia suficiente para mantener la decúbito esternal. - Exporte las imágenes adquiridas en un formato digital de imágenes y comunicaciones en medicina (DICOM) y utilice un software de análisis de imágenes de plataforma abierta.
5. Segmentación por resonancia magnética y análisis de datos (ver figura 4)
- Arrastre y suelte los archivos Dicom en la base de datos de un software de plataforma abierta para cargar todas las imágenes.
- Utilice las imágenes de LGE para visualizar la absorción de contraste en la pared del vaso y calcular el área de realce como marcador sustituto de la fuga de células endoteliales.
- Seleccione los análisis de recuperación de ARM y de inversión. Pulse Intro para cargar estas imágenes una al lado de la otra. Haga clic en el icono pequeño junto al nombre del escaneo y arrastre y suelte las imágenes de ARM en las imágenes de LGE.
- Seleccione la opción Remuestrear para volver a cortar las imágenes de ARM utilizando las imágenes LGE como referencia para tener en cuenta las diferencias en el grosor del corte.
- Haga clic en el icono pequeño junto al nombre del escaneo. Arrastre y suelte las imágenes LGE en las imágenes MRA (como en el paso 5.4 anterior). En el menú, elija Image Fusion (Fusión de imágenes ) para superponer las imágenes LGE y MRA.
- En la barra de herramientas, haga clic en Visor 2D y, a continuación, elija Panel de posición 3D. Utilice los botones para corregir manualmente los cambios en el avión para tener en cuenta los posibles desplazamientos pequeños debido a la respiración de los animales.
- Utilice la herramienta Polígono cerrado ubicada en la barra de herramientas para segmentar manualmente el segmento visualmente mejorado de la pared del recipiente. Utilice las imágenes MRA y LGE registradas conjuntamente para guiar la segmentación.
- Segmentar todas las imágenes de LGE que abarcan la arteria braquiocefálica.
NOTA: Si el realce de la pared del vaso tiene una apariencia difusa o irregular, segmente estos individualmente en cada rebanada. - Haga clic en el botón Plugins de la barra de herramientas y elija Herramientas de ROI, y luego Exportar ROI para exportar el área segmentada (mm2) para cada región de interés (ROI) en una hoja de cálculo.
- Suma el área de cada corte para calcular el área total de realce en la arteria braquiocefálica en la hoja de cálculo.
NOTA: El área total de realce se puede utilizar como marcador cuantitativo de la permeabilidad endotelial. - Utilice los mapas T1 que se generan automáticamente en la computadora del escáner de resonancia magnética para calcular el valor medio de T1 de la pared del vaso que refleja la cantidad de absorción de gadofosveset en la pared del vaso, este es otro marcador cuantitativo de la permeabilidad endotelial.
- Cargue las imágenes cartográficas de MRA y T1 y siga un enfoque similar al descrito anteriormente (pasos 5.3-5.9) para segmentar la pared del recipiente y extraer los valores de T1 (ms).
- En una hoja de cálculo, invierta los valores T1 y multiplíquelos por 1000 para calcular el tiempo de relajación R1 = 1/T1 en segundos. Calcular la media R1 para todos los cortes que cubren la arteria braquiocefálica en cada animal.
- Cargue las imágenes de angiografía con contraste de fase y los mapas de velocidad para calcular los cambios en el área del vaso y la velocidad del flujo sanguíneo, respectivamente, durante el ciclo cardíaco.
- Segmentar las imágenes adquiridas antes y después de la inyección de acetilcolina para calcular la vasorreactividad endotelial dependiente, un marcador sustituto de la (dis)función endotelial.
- Utilice la herramienta semiautomática Región de crecimiento disponible en la pestaña ROI o utilice la opción Polígono cerrado disponible en la barra de herramientas (como se describe en el paso 5.7) para segmentar el área de luz (mm2) de la arteria braquiocefálica en las imágenes de angiografía.
NOTA: La herramienta semiautomática utiliza el umbral de píxeles para agrupar los píxeles que abarcan el depósito de sangre en función de la intensidad de la señal. - Utilice la herramienta Cerrar polígono para segmentar los mapas codificados de velocidad de flujo sanguíneo correspondientes para calcular la velocidad del flujo sanguíneo (cm/s).
- Exporte el área lumínica (mm2) y la velocidad del flujo sanguíneo (cm/s) en una hoja de cálculo (como se describe en el paso 5.9) e identifique las que corresponden a las fases cardíacas telediastólica (área máxima) y telesistólica (área mínima).
- Utilice la hoja de cálculo tabulada para calcular la vasodilatación dependiente del endotelio (calcule el cambio porcentual en el área de la luz diastólica final (DE) y la velocidad del flujo sanguíneo antes y después de la inyección de acetilcolina). Utilice las siguientes fórmulas:
cambio de área=
Cambio de flujo=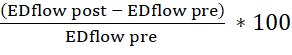
- Para cada animal, tabular los datos correspondientes derivados de las imágenes LGE, los mapas T1 y la prueba de acetilcolina en un software estadístico para su análisis.
Resultados
En este informe, se demuestra laaplicación de un método Quantitativo MRI para medir lamedida yla (dis)diversión(qMETRIC) en la arteria braquiocefálica de ratones ateroscleróticos ApoE-/-. Este método proporciona datos directos y cuantificables de dos marcadores de daño endotelial: la permeabilidad y la (dis)función, que pueden extraerse de exploraciones in vivo de la pared de los vasos adquiridas en una sola sesión de imagen. En primer lugar, los LGE se utilizan para medir el área de realce de la pared del vaso (mm3), y los mapas T1 (o R1) se utilizan para cuantificar la tasa de relajación de la pared del vaso (s-1) después de la administración de gadofosveset, ambos marcadores sustitutos de permeabilidad (ver Figura 5 para resultados representativos). La tasa de relajación de la pared del vaso R1 varió de 2,42 s-1 ± 0,35 s-1 a 3,45 s-1 ± 0,54 s-1 a 3,83 s-1 ± 0,52 s-1 a las 4 semanas, 8 semanas y 12 semanas de una dieta alta en grasas, respectivamente. Por el contrario, los ratones de tipo salvaje (R1 = 2,15 ± 0,34 s-1) y tratados con estatinas ApoE-/- (R1 = 3,0 ± 0,65 s-1) mostraron menos mejora. En ratones ApoE-/- alimentados con una dieta alta en grasas durante un máximo de 12 meses, el estudio muestra con análisis histológico, colorante azul de Evans y microscopía electrónica que la permeabilidad endotelial aumenta durante la progresión de la aterosclerosis, lo que estuvo de acuerdo con el aumento del volumen de la pared vascular LGE, el aumento del cambio en la relajación de la pared vascular R1 y la vasoconstricción paradójica después de la inyección de acetilcolina5. Por el contrario, las estatinas y otros tratamientos dirigidos al endotelio disminuyeron la permeabilidad endotelial y el tamaño de la placa, lo que se reflejó en un menor volumen de LGE, valores más bajos de R1 5,7 y una mejor vasodilatación. Mecánicamente, el gadofosveset se une de forma reversible a la albúmina sérica. Esto da como resultado un aumento de 5-6 veces en la relajabilidad T1 de la sonda29, lo que la hace detectable por resonancia magnética con alta sensibilidad. Aquí, el estudio muestra que unida a la albúmina, la absorción de la sonda refleja la permeabilidad endotelial porque se correlaciona con la absorción del tinte azul de Evan, un método ex vivo estándar de oro para cuantificar la fuga endotelial (Figura 5), y uniones de espacio estrechomás amplias 5. En segundo lugar, se demuestra una prueba sencilla para medir la (dis)función endotelial, en respuesta a la acetilcolina. En los vasos control, la acetilcolina provoca una relajación vascular dependiente del endotelio que conduce a un aumento del área/volumen arterial y del flujo sanguíneo. Para medir la (dis)función endotelial, se utilizaron imágenes de angiografía activadas por ECG adquiridas antes y después de la administración de acetilcolina. El estudio calcula el cambio en el área (o volumen) final diastólica de la luz del vaso antes y después de la administración de acetilcolina. Se encontró que, a diferencia de los vasos normales que vasodilatan en respuesta a la acetilcolina, los vasos ateroscleróticos muestran una disminución de la función vasodilatadora dependiente del endotelio que se manifiesta como un cambio reducido en el área (o volumen) del vaso o incluso una vasoconstricción paradójica del vaso (Figura 5). Curiosamente, el tratamiento con estatinas mejoró las propiedades vasodilatadoras del endotelio13.
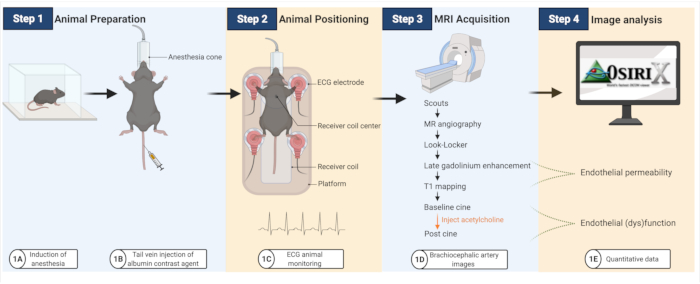
Figura 1: Flujo de trabajo para obtener imágenes de la permeabilidad endotelial y la (dis)función en ratones ateroscleróticos. (A-B) Primero se anestesia a los ratones y luego se les inyecta el agente de contraste de albúmina. (C) Luego, los ratones se transfieren a una bobina de resonancia magnética, donde se usan almohadillas de ECG para monitorear la actividad cardíaca. (D-E) Se adquieren imágenes de resonancia magnética para cuantificar la permeabilidad y la (dis)función endotelial que posteriormente se analizan utilizando un software de plataforma abierta (creado con BioRender.com). Haga clic aquí para ver una versión más grande de esta figura.
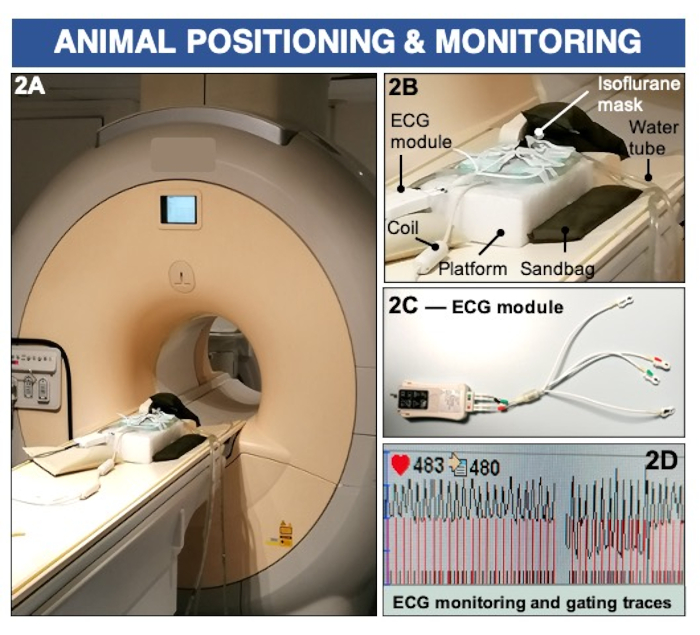
Figura 2: Posicionamiento de los animales y monitorización del ECG para obtener imágenes de permeabilidad endotelial y (dis)función utilizando un escáner clínico de resonancia magnética de 3 Tesla. (A-B) El animal se coloca boca abajo sobre un serpentín de superficie y se mantiene anestesiado con isoflurano inhalable. Los sacos de arena se utilizan para estabilizar la plataforma de imágenes. (C-D) Las almohadillas de ECG se colocan en las patas y se conectan a un módulo de ECG clínico para registrar la actividad cardíaca. Haga clic aquí para ver una versión más grande de esta figura.
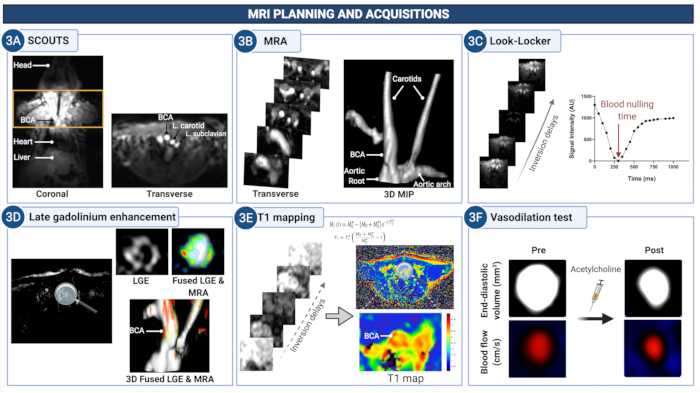
Figura 3: Planificación de la resonancia magnética y adquisición de imágenes para cuantificar la permeabilidad endotelial y la (dis)función en la arteria braquiocefálica de ratones ateroscleróticos. (A) Se adquieren imágenes de exploración para identificar la región anatómica entre la raíz aórtica y las arterias carótidas. (B) La angiografía por resonancia magnética se utiliza para visualizar la vasculatura y planificar las exploraciones posteriores. (C) Las imágenes Look-Locker se adquieren a nivel de la arteria braquiocefálica para determinar el retardo de tiempo adecuado para anular la señal de la sangre en las imágenes posteriores de realce de gadolinio (LGE). (D) Las imágenes LGE proporcionan una evaluación visual del realce de la pared del vaso. (E) El mapeo T1 se utiliza para calcular la tasa de relajación de la pared del vaso que es indicativa de la concentración de gadolinio. (F) Las propiedades vasodilatadoras de la pared del vaso dependientes del endotelio se cuantifican después de la administración de acetilcolina. Haga clic aquí para ver una versión más grande de esta figura.
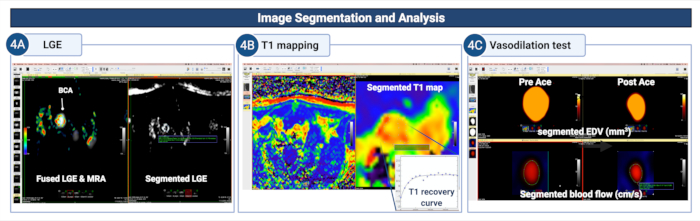
Figura 4: Segmentación y análisis de imágenes para cuantificar la permeabilidad endotelial y la (dis)función en la arteria braquiocefálica de ratones ateroscleróticos. (A) La pared del vaso se segmenta manualmente en las imágenes de LGE para cuantificar el área/volumen de captación de contraste. (B) La pared del recipiente se segmenta en el mapeo T1 para calcular la tasa de relajación T1 de la pared del recipiente. (C) La pared del vaso segmentada en las angiografías de resonancia magnética y las imágenes codificadas por flujo sanguíneo se utiliza para estudiar las propiedades vasodilatadoras de la pared del vaso mediante el cálculo de los cambios en los cambios en el flujo sanguíneo.
área (o volumen) de la luz diastólica y flujo sanguíneo después de la administración de acetilcolina. Haga clic aquí para ver una versión más grande de esta figura.
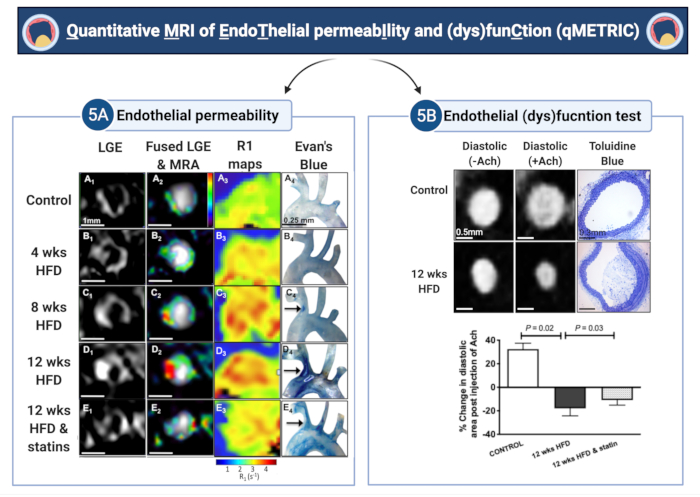
Figura 5: Imágenes cuantitativas de la permeabilidad endotelial y la (dis)función (qMETRIC) en ratones ateroscleróticos. (A) Las imágenes de LGE y los mapas de relajación R1 muestran una mayor absorción del agente de contraste que se une a la albúmina dentro de la pared del vaso durante la progresión de la aterosclerosis y la mejora después del tratamiento con estatinas. Los datos de imagen se corroboran mediante la acumulación ex vivo del tinte azul de Evan, un colorante que se une a la albúmina. (B) Los cambios en las propiedades vasodilatadoras de la pared del vaso, en respuesta a la administración de acetilcolina, permiten cuantificar la vasodilatación dependiente del endotelio. Los vasos de control son vasodilatados, mientras que los vasos ateroscleróticos se vasoconstriñen en respuesta a la acetilcolina, lo que sugiere daño endotelial. El tratamiento con estatinas mejora el daño endotelial. Los términos "semanas" y "HFD" en la figura representan "semanas" y "dieta alta en grasas", respectivamente. Esta cifra ha sido modificada a partir de Phinikaridou, A. et al.5. Haga clic aquí para ver una versión más grande de esta figura.
| Escaneo / Secuencia | Parámetros de adquisición | ||
| Escaneo de explorador / piloto | 3D, eco de gradiente rápido Transversal: FOV = 50 mm x 27 mm x 14 mm, matriz = 96 x 52, resolución en el plano = 0,5 mm x 0,5 mm, espesor de corte = 0,5 mm, TR/TE = 15/6,1 ms, ángulo de giro = 30°, promedios = 1 Coronal: FOV = 200 mm x 102 mm x 14 mm, matriz = 336 x 173, resolución en el plano = 0,5 mm x 0,5 mm, espesor de corte = 0,5 mm, TR/TE = 12/6 ms, ángulo de giro = 30°, promedios = 1 | ||
| ARM | Eco de gradiente rápido 3D, FOV = 30 mm x 30 mm x 8 mm, matriz = 200 x 200, resolución en el plano = 0,15 mm x 0,15 mm, espesor de corte = 0,5 mm, TR/TE = 15/6,1 ms, ángulo de giro = 40°, promedios = 1 | ||
| Escaneo de Look-Locker | Eco de gradiente rápido 2D, FOV = 30 mm x 30 mm, matriz = 80 x 80, resolución en el plano = 0,38 mm x 0,38 mm, espesor de corte = 2 mm, TR/TE = 19/8,6 ms, TR entre pulsos IR posteriores = 1000 ms y ángulo de giro = 10°, promedios = 1. | ||
| Escaneo LGE | Eco de gradiente rápido 3D, FOV = 30 mm x 30 mm x 8 mm, matriz = 304 x 304, resolución en el plano = 0,1 mm x 0,1 mm, espesor de corte medido = 0,5 mm, cortes = 32, TR/TE = 28/8 ms, TR entre pulsos IR posteriores = 1000 ms y ángulo de giro = 30°, promedios = 1. | ||
| Escaneo de mapeo T1 | Eco de gradiente rápido 3D, FOV = 36 mm x 22 mm x 8 mm, matriz = 192 x 102, resolución en el plano = 0,18 mm x 0,22 mm, espesor de corte medido = 0,5 mm, cortes = 16, TR/TE = 9,6/4,9 ms, ángulo de volteo = 10°, promedios = 1. | ||
| Angiografía con contraste de fase | 2D, eco de gradiente rápido, campo de visión = 40 mm x 23 mm, matriz = 132 x 77, resolución en el plano = 0,3 mm x 0,3 mm x 1 mm, TR/TE = 9,8/4,9 ms, ángulo de giro = 30°, fases cardíacas = 14, promedios = 6, velocidad de flujo (dirección pie-cabeza) = 30 cm/s. | ||
TABLA 1: Parámetros de adquisición de RM
Discusión
La determinación de la salud endotelial vascular es un biomarcador de imagen atractivo que puede utilizarse potencialmente para diagnosticar el riesgo relacionado con el aterosclerótico y para controlar los efectos del tratamiento. El protocolo qMETRIC descrito aquí se puede utilizar para cuantificar de forma reproducible la permeabilidad/permeabilidad endotelial y la (dis)función en un protocolo de resonancia magnética completo, rápido y clínicamente aplicable. Este enfoque puede proporcionar una alternativa más sencilla o una herramienta complementaria a los protocolos existentes de DCE-RM para cuantificar la permeabilidad endotelial. También puede proporcionar una herramienta no invasiva para la evaluación directa de la (dis)función endotelial en lechos vasculares, como las arterias coronaria y carótida, en lugar de utilizar técnicas invasivas o mediciones sustitutivas en las arterias periféricas que están menos gravemente afectadas por la enfermedad. La medición de la permeabilidad endotelial mediante este método permite cubrir la aorta, el arco aórtico y las arterias braquiocefálica y carótida a una alta resolución espacial (0,1 mm para las imágenes LGE y 0,22 mm para el mapeo T1) que es crucial para la segmentación precisa de la pared del vaso en roedores. El análisis de las imágenes se puede llevar a cabo utilizando una plataforma de código abierto y solo requiere una simple segmentación de la pared del vaso sin la necesidad de un modelado farmacocinético complejo. Es importante destacar que este protocolo se puede adaptar para ser utilizado en una serie de diferentes escáneres disponibles comercialmente y se puede ampliar para ser utilizado en diferentes modelos animales y también en humanos. Aunque este protocolo describe la metodología utilizando una configuración de escáner clínico, los protocolos de resonancia magnética también se pueden implementar cuando se utilizan escáneres de animales pequeños de alto campo. Estos escáneres suelen ofrecer protocolos de recuperación de inversión, mapeo T1 y angiografía que se pueden utilizar o programar en colaboración con los fabricantes de escáneres.
Para obtener resultados precisos y reproducibles, se debe prestar especial atención a algunos pasos críticos del protocolo. En primer lugar, cuando se obtienen imágenes de animales pequeños en un escáner clínico, se necesitan bobinas receptoras adecuadas y hechas a medida para maximizar la relación señal-ruido para una alta calidad de imagen. El posicionamiento del animal en la bobina también es crucial, evitando la separación y los espacios llenos de aire entre el animal y la bobina para mejorar la relación señal-ruido. Por esta razón, el área anatómica de interés debe colocarse en el centro de la bobina y luego moverse al isocentro del imán para exponerlos al campo magnético con la máxima homogeneidad. En segundo lugar, una señal de ECG estable, fuerte y precisa es primordial para la activación/activación fiable de las imágenes. Esto es importante para la excitación constante de la magnetización y la temporización de la ventana de adquisición de imágenes en puntos de tiempo específicos y para la adquisición de imágenes precisas con resolución temporal que incluyen la fase diastólica final para la prueba funcional. Los electrodos basados en almohadillas o agujas para animales pequeños son opciones más adecuadas cuando se utilizan en escáneres de mayor intensidad de campo, que están mejor protegidos en comparación con los escáneres clínicos. Cuando se utilizan estas opciones en escáneres de campo clínicos, los cables de ECG deben deformarse para evitar la formación de circuitos resonantes a la frecuencia de Lamour de la RMN que pueden deteriorar la señal de ECG durante la secuencia de pulsos. Alternativamente, proponemos el uso del módulo de ECG y las almohadillas utilizadas para las exploraciones humanas con ajuste del tamaño de la almohadilla al de la pata del ratón y estabilización adicional de las almohadillas con cinta adhesiva para mejorar la conductividad. En tercer lugar, al adquirir imágenes de LGE mientras el agente de contraste aún está circulando en el torrente sanguíneo, es crucial elegir el momento de anulación correcto para suprimir de manera eficiente la acumulación de sangre para delinear la pared del vaso. Se debe ejecutar una secuencia de bloqueo de búsqueda antes de cada secuencia LGE, y el tiempo de retardo de inversión debe ajustarse en consecuencia. En cuarto lugar, para que la cartografía T1 sea exacta y precisa utilizando una secuencia modificada de recuperación de inversión de bloqueo de la mirada (MOLLI), el esquema de adquisición de imágenes propuesto debe aplicarse para cubrir una gama de retardos de inversión que oscile al menos entre 20 ms y 2000 ms para capturar las especies T1 cortas y largas. Por último, la segmentación de los datos de resonancia magnética debe ser rigurosa y se deben aplicar criterios estrictos para evitar sesgos intra y/o interobservador en los cálculos de los valores de área/volumen y T1.
A diferencia de la DCE-MRI, el procedimiento descrito aquí no proporciona datos cinéticos del lavado y lavado del agente de contraste en la pared del vaso. Más bien, proporciona una instantánea de la permeabilidad endotelial en un momento específico después de la inyección del agente de contraste que se une a la albúmina, gadofosveset. Sin embargo, los datos cuantitativos extraídos de estos puntos de tiempo se correlacionaron altamente con otros colorantes de albúmina, como el tinte azul de Evan, que se considera un estándar de oro para medir la permeabilidad endotelial y el aumento del ancho de la unión entre espacios endoteliales. Desde el punto de vista mecánico, tanto la fracción unida a la albúmina como la no unida de gadofosveset son lo suficientemente pequeñas como para pasar a través de roturas en las uniones endoteliales y conducir a una mejora de la señal de resonancia magnética. Además, es posible que la fracción no unida también se una a la albúmina intraplaca después de entrar en la pared del vaso y dar lugar a un aumento de la señal. Se observó que la relajabilidad de la pared del vaso es der 1≈17 mmol/L/s, cuando se inyecta gadofosveset a dosis clínica. Este valor es más cercano al reportado para la fracción unida a la albúmina (r1≈25 mmol/L/s) en comparación con la fracción libre (r1≈6,6 mmol/L/s)5,29.
Las aplicaciones futuras de este método de imagen incluyen estudios de ciencia básica en diferentes modelos animales y otros segmentos arteriales y el uso de este método para evaluar las respuestas biológicas a agentes farmacéuticos existentes o nuevos. Los estudios se pueden realizar de forma transversal o longitudinal para recopilar datos mecanicistas y de resultados, respectivamente. El flujo de trabajo sencillo hace que este enfoque sea accesible y clínicamente aplicable también para su uso en humanos. La adaptación de este método para la obtención de imágenes de las arterias carótidas y periféricas humanas es más inminente, pero la aplicación de este método para la obtención de imágenes de las arterias coronarias requiere nuevos avances en la adquisición de imágenes, la reconstrucción y la corrección del movimiento que se están desarrollando actualmente30,31.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos la financiación a: (1) la Fundación Británica del Corazón (beca A.P Early Career Development Fellowship, subvención del proyecto-PG/2019/34897, y subvenciones de proyectos y programas R.M.B. PG/10/044/28343, RG/12/1/29262 Y RG/20/1/34802); (2) el Centro de Excelencia en Investigación King's BHF RE/18/2/34213; 3) el Centro de Ingeniería Médica Wellcome EPSRC (NS/A000049/1); (4) el Departamento de Salud, a través de la Cooperativa de Tecnología de Salud Cardiovascular (HTC) del Instituto Nacional de Investigación en Salud Sanitaria (NIHR) y el Centro de Investigación Biomédica integral, otorgado a Guy's & St Thomas' NHS Foundation Trust en asociación con King's College London y King's College Hospital NHS Foundation Trust; (5) Agencia Chilena de Investigación y Desarrollo (ANID) - Programa Iniciativa Científica del Milenio - NCN17_129 y FONDECYT 1180525.
Materiales
| Name | Company | Catalog Number | Comments |
| Acetylcholine | Sigma Aldrich | A6625- 100G, 16.6 mg/kg | |
| Anesthesia equipment | General Anesthetic Services | General Anesthetic Services | |
| Circulating heating pump | ThermoFisher Scientific, USA | BOM: 152510101 | |
| ECG conductive gel (Nuprep) | Waever and Company, USA | 10-30-T | |
| ECG monitoring module | Invivo, USA | REF 0700-1002 | |
| Gadofosveset trisordium (Vasovist/ Ablavar) | Lantheus Medical Imaging Inc, North Billerica, MA, USA | 0.03 mmol/kg | |
| High fat diet | Special Diets Services, Witham, UK | 21% fat from lard, 0.15% (wt/wt) cholesterol | |
| Induction box | Vet Tech Solutions LTD | ||
| Insulin syringes | BD Biosciences | 0.5 mL, 29 G | |
| OsirixX software | OsiriX Foundation, Geneva, Switzerland | Open-source platform | |
| Philips Achieva MRI Scanner (3 Tesla) | Philips Healthcare, Best, The Netherlands | Equipped with a clinical gradient system (30 mT m-1, 200 mT m-1 ms-1) | |
| Single–loop surface microscopy receiver coil | Phillips Hamburg | Diameter = 23 mm | Custom built |
Referencias
- Lloyd-Jones, D. M., et al. Defining and setting national goals for cardiovascular health promotion and disease reduction: The American heart association's strategic impact goal through 2020 and beyond. Circulation. 121 (4), 586-613 (2010).
- Davignon, J., Ganz, P. Role of endothelial dysfunction in atherosclerosis. Circulation. 109 (23), Suppl 1 27-32 (2004).
- Ludmer, P. L., et al. Paradoxical vasoconstriction induced by acetylcholine in atherosclerotic coronary arteries. New England Journal of Medicine. 315 (17), 1046-1051 (1986).
- Crauwels, H. M., Van Hove, C. E., Holvoet, P., Herman, A. G., Bult, H. Plaque-associated endothelial dysfunction in apolipoprotein E-deficient mice on a regular diet. Effect of human apolipoprotein AI. Cardiovascular Research. 59 (1), 189-199 (2003).
- Phinikaridou, A., et al. Non-invasive magnetic resonance imaging evaluation of endothelial permeability in murine atherosclerosis using an albumin-binding contrast agent. Circulation. 126 (6), 707-719 (2012).
- Phinikaridou, A., et al. Increased vascular permeability measured with an albumin-binding magnetic resonance contrast agent is a surrogate marker of rupture-prone atherosclerotic plaque. Circulation; Cardiovascular Imaging. 9 (12), (2016).
- Phinikaridou, A., Andia, M. E., Passacquale, G., Ferro, A., Botnar, R. M. Noninvasive MRI monitoring of the effect of interventions on endothelial permeability in murine atherosclerosis using an albumin-binding contrast agent. Journal of the American Heart Association. 2 (5), 000402(2013).
- Sluimer, J. C., et al. Thin-walled microvessels in human coronary atherosclerotic plaques show incomplete endothelial junctions relevance of compromised structural integrity for intraplaque microvascular leakage. Journal of the American College of Cardiology. 53 (17), 1517-1527 (2009).
- Rubenfire, M., Cao, N., Smith, D. E., Mosca, L. Carotid artery reactivity to isometric hand grip exercise identifies persons at risk and with coronary disease. Atherosclerosis. 160 (1), 241-248 (2002).
- Nguyen, P. K., Meyer, C., Engvall, J., Yang, P., McConnell, M. V. Non-invasive assessment of coronary vasodilation using cardiovascular magnetic resonance in patients at high risk for coronary artery disease. Journal of Cardiovascular Magnetic Resonance. 10, 28(2008).
- Terashima, M., et al. Impaired coronary vasodilation by magnetic resonance angiography is associated with advanced coronary artery calcification. Journal of the American College of Cardiology; Cardiovascular Imaging. 1 (2), 167-173 (2008).
- Hays, A. G., et al. Non-invasive visualization of coronary artery endothelial function in healthy subjects and in patients with coronary artery disease. Journal of the American College of Cardiology. 56 (20), 1657-1665 (2010).
- Hirooka, Y., et al. Effect of L-arginine on acetylcholine-induced endothelium-dependent vasodilation differs between the coronary and forearm vasculatures in humans. Journal of the American College of Cardiology. 24 (4), 948-955 (1994).
- Takase, B., et al. Endothelium-dependent flow-mediated vasodilation in coronary and brachial arteries in suspected coronary artery disease. American Journal of Cardiology. 82 (12), 1535-1539 (1998).
- Al-Badri, A., Kim, J. H., Liu, C., Mehta, P. K., Quyyumi, A. A. Peripheral microvascular function reflects coronary vascular function. Arteriosclerosis Thrombosis and Vascular Biology. 39 (7), 1492-1500 (2019).
- Calcagno, C., et al. Detection of neovessels in atherosclerotic plaques of rabbits using dynamic contrast enhanced MRI and 18F-FDG PET. Arteriosclerosis Thrombosis and Vascular Biology. 28 (7), 1311-1317 (2008).
- Lobbes, M. B., et al. Atherosclerosis: contrast-enhanced MR imaging of vessel wall in rabbit model--comparison of gadofosveset and gadopentetate dimeglumine. Radiology. 250 (3), 682-691 (2009).
- Kerwin, W. S., Oikawa, M., Yuan, C., Jarvik, G. P., Hatsukami, T. S. MR imaging of adventitial vasa vasorum in carotid atherosclerosis. Magnetic Resonance Medicine. 59 (3), 507-514 (2008).
- van Hoof, R. H., et al. Vessel wall and adventitial DCE-MRI parameters demonstrate similar correlations with carotid plaque microvasculature on histology. Journal of Magnetic Resonance Imaging. 46 (4), 1053-1059 (2017).
- Calcagno, C., Mani, V., Ramachandran, S., Fayad, Z. A. Dynamic contrast enhanced (DCE) magnetic resonance imaging (MRI) of atherosclerotic plaque angiogenesis. Angiogenesis. 13 (2), 87-99 (2010).
- van Wijk, D. F., et al. Increasing spatial resolution of 3T MRI scanning improves reproducibility of carotid arterial wall dimension measurements. Magnetic Resonance Materials in Physics, Biology, and Medicine. 27 (3), 219-226 (2014).
- Li, B., et al. Turbo fast three-dimensional carotid artery black-blood MRI by combining three-dimensional MERGE sequence with compressed sensing. Magnetic Resonance Medicine. 70 (5), 1347-1352 (2013).
- Fan, Z., et al. Carotid arterial wall MRI at 3T using 3D variable-flip-angle turbo spin-echo (TSE) with flow-sensitive dephasing (FSD). Journal of Magnetic Resonance Imaging. 31 (3), 645-654 (2010).
- Li, X., Huang, W., Rooney, W. D. Signal-to-noise ratio, contrast-to-noise ratio and pharmacokinetic modeling considerations in dynamic contrast-enhanced magnetic resonance imaging. Magnetic Resonance Imaging. 30 (9), 1313-1322 (2012).
- Heisen, M., et al. The influence of temporal resolution in determining pharmacokinetic parameters from DCE-MRI data. Magnetic Resonance Medicine. 63 (3), 811-816 (2010).
- Chen, H., et al. Scan-rescan reproducibility of quantitative assessment of inflammatory carotid atherosclerotic plaque using dynamic contrast-enhanced 3T CMR in a multi-center study. Journal of Cardiovascular Magnetic Resonance. 16, 51(2014).
- Calcagno, C., Vucic, E., Mani, V., Goldschlager, G., Fayad, Z. A. Reproducibility of black blood dynamic contrast-enhanced magnetic resonance imaging in aortic plaques of atherosclerotic rabbits. Journal of Magnetic Resonance Imaging. 32 (1), 191-198 (2010).
- Engel, L. C., et al. Non-invasive imaging of endothelial damage in patients with different HbA1c levels: A proof-of-concept study. Diabetes. 68 (2), 387-394 (2019).
- Caravan, P., et al. The interaction of MS-325 with human serum albumin and its effect on proton relaxation rates. Journal of the American Chemical Society. 124 (12), 3152-3162 (2002).
- Munoz, C., et al. Motion-corrected 3D whole-heart water-fat high-resolution late gadolinium enhancement cardiovascular magnetic resonance imaging. Journal of Cardiovascular Magnetic Resonance. 22 (1), 53(2020).
- Milotta, G., et al. 3D whole-heart isotropic-resolution motion-compensated joint T1 /T2 mapping and water/fat imaging. Magnetic Resonance Medicine. 84 (6), 3009-3026 (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados