Method Article
IRM quantitative de la perméabilité endothéliale et de la (dys)fonction dans l’athérosclérose
Dans cet article
Résumé
Nous avons mis au point une méthode précise, non invasive et facile à utiliser pour quantifier la perméabilité endothéliale et le dysfonctionnement des artères à l’aide de l’imagerie par résonance magnétique (IRM), appelée qMETRIC. Cette technique permet d’évaluer les lésions vasculaires et le risque cardiovasculaire associés à l’athérosclérose dans des modèles précliniques et chez l’homme.
Résumé
Les maladies cardiovasculaires sont les principales causes de décès dans le monde. Un endothélium perméable/perméable / perméable et dysfonctionnel est considéré comme le marqueur le plus précoce des lésions vasculaires et serait à l’origine de l’athérosclérose. Une méthode permettant d’identifier ces changements in vivo serait souhaitable en clinique. Les outils basés sur l’imagerie par résonance magnétique (IRM) et d’autres technologies ont permis de comprendre en profondeur le rôle de l’endothélium dans les maladies cardiovasculaires et le risque in vivo. Il est toutefois nécessaire de mettre en place des approches simples et reproductibles pour extraire des données quantifiables reflétant les lésions endothéliales à partir d’une seule étude d’imagerie. Un flux de travail IRM non invasif, facile à mettre en œuvre et quantitatif a été développé pour acquérir et analyser des images permettant la quantification de deux biomarqueurs d’imagerie de lésions endothéliales artérielles (fuite/perméabilité et dysfonctionnement). Ici, le protocole décrit l’application de cette méthode dans l’artère brachiocéphale de souris athéroscléreuses ApoE-/- à l’aide d’un scanner IRM clinique. Tout d’abord, les protocoles de cartographie T1 de l’amélioration tardive du gadolinium (LGE) et de la récupération par inversion modifiée (MOLLI) pour quantifier les fuites endothéliales à l’aide d’une sonde de liaison à l’albumine sont décrits. Deuxièmement, des séquences anatomiques et quantitatives du flux sanguin pour mesurer le dysfonctionnement endothélial, en réponse à l’acétylcholine, sont décrites. Il est important de noter que la méthode décrite ici permet l’acquisition d’images 3D à haute résolution spatiale avec une large couverture volumétrique, ce qui permet une segmentation précise des structures de la paroi des navires afin d’améliorer la variabilité inter- et intra-observateur et d’augmenter la fiabilité et la reproductibilité. De plus, il fournit des données quantitatives sans avoir besoin d’une résolution temporelle élevée pour la modélisation cinétique complexe, ce qui le rend indépendant du modèle et permet même l’imagerie de vaisseaux très mobiles (artères coronaires). Par conséquent, l’approche simplifie et accélère l’analyse des données. Enfin, cette méthode peut être mise en œuvre sur différents scanners, peut être étendue à l’imagerie de différents lits artériels et est cliniquement applicable pour une utilisation chez l’homme. Cette méthode pourrait être utilisée pour diagnostiquer et traiter les patients atteints d’athérosclérose en adoptant une approche de médecine de précision.
Introduction
Les maladies cardiovasculaires (MCV) restent la principale cause de mortalité et de morbidité dans le monde, représentant près d’un tiers des décès1, et la cause d’incapacités permanentes qui ont un coût financier élevé sur les systèmes de santé1. Parmi les MCV, les cardiopathies ischémiques et les accidents vasculaires cérébraux sont principalement causés par des plaques d’athérosclérose. L’athérosclérose est une maladie multifactorielle ; Cependant, une caractéristique commune est l’endommagement précoce des cellules endothéliales vasculaires qui conduisent à la formation, à la progression et aux complications éventuelles de l’athérosclérose. Un endothélium vasculaire intact a des propriétés vasculo-protectrices fondamentales2. L’endothélium régule la perméabilité vasculaire en contrôlant la translocation des cellules et des molécules entre la circulation systémique et la paroi vasculaire ; contrôle le tonus vasculaire en équilibrant la production de vasodilatateurs (par exemple, l’oxyde nitrique, la prostacycline) et les vasoconstricteurs (par exemple, l’endothéline-1, l’angiotensine II) ; et possède également des propriétés anticoagulantes. Cependant, la fonction et la perméabilité des cellules endothéliales peuvent se détériorer en présence de facteurs de risque cardiovasculaires (par exemple, le tabagisme, l’hypercholestérolémie, le diabète, l’inflammation systémique, le stress oxydatif) et par les schémas hémodynamiques du flux sanguin. Un endothélium dysfonctionnel a réduit la vasodilatation en réponse aux facteurs de stress, augmentant ainsi la rigidité artérielle. De plus, un endothélium perméable/perméable a des jonctions étroites élargies entre les cellules adjacentes3, 4, 5, 6, 7. Un tel changement se produit à la fois sur l’endothélium luminal et sur les microvaisseaux de plaque nouvellement formés qui semblent fragiles, perméables et dysmorphiques8. Les cellules endothéliales perméables servent de points d’entrée pour les molécules et les cellules plasmatiques, ce qui exacerbe le risque de maladies cardiovasculaires.
S’appuyant sur ces connaissances, au cours des 15 dernières années, la perméabilité et la fonction endothéliales sont apparues comme une cible prometteuse en imagerie et en thérapie pour mieux diagnostiquer les sujets à risque de maladies cardiovasculaires et pour évaluer les effets de médicaments connus ou nouveaux. Cependant, l’imagerie directe et quantitative de la fonction endothéliale est limitée 9,10,11,12. À l’heure actuelle, une grande partie de l’interprétation de la fonction endothéliale in vivo repose sur des études de dilatation dépendante de l’endothélium (DFM) dans les vaisseaux périphériques dont la fonction est modestement corrélée à la charge de l’athérosclérose dans les lits vasculaires qui causent des événements cliniques 13,14,15. Seul un nombre limité d’études d’imagerie ont montré un lien direct entre le dysfonctionnement endothélial et la charge de l’athérosclérose in vivo 9,10,11,12. À l’inverse, des approches plus accessibles basées sur l’IRM ont permis d’imager la perméabilité endothéliale plus largement. L’utilisation du pourcentage d’amélioration du signal de la paroi vasculaire après l’administration d’agents IRM au gadolinium a permis d’obtenir une mesure semi-quantitative de la perméabilité endothéliale16,17. Par la suite, le développement de protocoles dynamiques avec contraste amélioré (DCE) a permis une mesure améliorée et plus quantitative de la perméabilité endothéliale vasculaire. Les paramètres quantitatifs tels que le taux d’extravasation du contraste (Ktrans) et le volume microvasculaire (Vρ) dérivés de la modélisation cinétique ou de l’aire sous la courbe (AUC), de la pente ascendante, du temps jusqu’au pic et de la concentration du pic extraits de méthodes non modélisées étaient corrélés non seulement avec la perméabilité endothéliale, mais aussi avec la vascularisation de la plaque 18,19,20. Cependant, l’application de l’éthylène divorcé vasculaire reste difficile malgré des progrès techniques significatifs pour les raisons suivantes : (i) il nécessite à la fois une résolution spatiale (0,5-0,7 mm2) et temporelle élevée21 pour une délimitation précise de la paroi vasculaire. L’échantillonnage de la concentration de l’agent de contraste dans le sang pour calculer la fonction d’entrée artérielle nécessite également une modélisation cinétique, ce qui conduit à un compromis entre limiter la couverture anatomique22,23 pour obtenir une résolution temporelle ou vice versa24,25 ; (ii) l’analyse des données peut nécessiter une modélisation pharmacocinétique complexe (p. ex., Patlak contre Tofts) ; (iii) offre une qualité d’image limitée, une faible reproductibilité du balayage et une variabilité moyenne entre les observateurs et les intra-observateurs26,27. Par conséquent, il reste nécessaire de trouver des approches simples et reproductibles pour extraire des données directes et quantifiables sur la perméabilité endothéliale et la (dys)fonction à partir d’études d’imagerie uniques qui pourraient avoir une meilleure utilité clinique.
Ici, nous avons développé une IRM non invasive, facile à mettre en œuvre et quantitative pour acquérir et analyser des images qui permet de quantifier directement deux marqueurs de lésions endothéliales artérielles (fuite/perméabilité et dysfonctionnement) à l’aide de modèles précliniques d’athérosclérose en un seul scan. La méthode est appelée Quantitative MRI of EndoThelial peRIlity and dysfunCtion (qMETRIC). Il implique l’acquisition de protocoles de cartographie T1 d’amélioration tardive du gadolinium (LGE) et de récupération d’inversion modifiée (MOLLI) pour quantifier les fuites endothéliales, après l’administration d’une sonde de liaison à l’albumine intravasculaire ; et l’acquisition de séquences anatomiques et quantitatives du flux sanguin pour mesurer la dysfonction endothéliale, en réponse à un bolus d’acétylcholine. Nous avons démontré que qMETRIC détecte avec précision : la gravité de l’athérosclérose et le risque de complications ; les réponses au traitement ; et peut être adapté pour une utilisation chez les patients 5,6,7. Il est important de noter que la méthode décrite ici permet l’acquisition d’images à haute résolution spatiale pour permettre une segmentation précise de la paroi du vaisseau afin de minimiser le biais inter/intra-observateur et d’augmenter la fiabilité et la reproductibilité avec une large couverture anatomique. Enfin, cette méthode peut être adaptée pour être utilisée sur différents scanners et peut être étendue à l’imagerie de différents lits artériels (même des artères coronaires28). La simplicité du flux de travail rend cette approche plus accessible à la communauté de l’imagerie cardiovasculaire.
Protocole
Tous les éléments de cette étude ont été réalisés conformément à la loi britannique de 1986 sur les animaux (procédures scientifiques) et avec l’approbation du comité d’éthique du King’s College de Londres.
Le flux de travail expérimental est résumé à la figure 1.
1. Préparation des animaux
- Induisez l’athérosclérose en nourrissant les souris ApoE-/- avec un régime riche en graisses contenant 21 % de matières grasses provenant du saindoux et 0,15 % (poids / poids) de cholestérol en moyenne jusqu’à 12 semaines.
- Chargez une seringue à insuline à aiguille de 29 g avec le bon volume d’agent de contraste (gadofosveset trisordium) pour obtenir une dose de 0,03 mmol/kg. Maintenez le volume d’injection entre 50 et 150 μL.
- Placez la cage sur un coussin chauffant réglé à 37 °C pour préchauffer l’animal et maintenir la température corporelle.
- Induisez l’anesthésie en plaçant la souris dans une boîte d’induction tapissée de tissus absorbants. Réglez le débitmètre à 3 % à 5 % d’isoflurane à 1 L/min de O2 pendant environ 3 à 5 min.
REMARQUE : Assurez-vous que la profondeur de l’anesthésie est correcte en identifiant le ralentissement de la fréquence respiratoire, qui doit diminuer à moins de 70 respirations par minute (bpm). - Confirmez l’anesthésie à l’aide de la méthode du pincement des orteils (c.-à-d. perte du réflexe de retrait par pincement des orteils). Transférez l’animal dans un support et insérez son nez dans un cône nasal. Placez le support sur un coussin chauffant pour maintenir la température corporelle des animaux.
- Maintenez l’anesthésie, délivrée par le nez, en réglant le débit d’air d’anesthésie dans le support à 1 % à 2 % d’isoflurane à 1 L/min d’O2.
- Appliquez une pommade vétérinaire sur les yeux de l’animal pour prévenir la sécheresse sous anesthésie.
- Placez l’animal sur le ventre ou sur le côté et nettoyez la queue avec un tampon imbibé d’alcool. Localisez l’une des deux nervures de la queue. Si nécessaire, réchauffez la queue avec une lampe UV pour rendre les veines de la queue plus visibles.
- Insérez l’aiguille à insuline 29 G parallèlement à la veine avec le biseau de l’aiguille vers le haut. Injectez doucement le volume de la seringue préremplie contenant du gadofosveset trisodique. Assurez-vous qu’il n’y a pas de saignement au site d’injection après avoir retiré l’aiguille.
- Attendez 30 secondes pour que gadofosveset circule, puis transférez la souris sur le lit d’IRM.
2. Préparation de l’IRM (voir Figure 1)
- Couvrez la table d’IRM avec des mouchoirs absorbants.
- Placez la bobine réceptrice d’IRM à boucle unique sur le lit d’IRM. Utilisez une plate-forme pour soulever la bobine réceptrice et éviter tout contact direct entre la bobine réceptrice et la table IRM.
- Fixez la bobine à la plate-forme à l’aide de ruban chirurgical.
- Placez et fixez le tube relié à une pompe de chauffage à circulation autour du serpentin et réglez-le à 37 °C pour maintenir la température corporelle de l’animal pendant l’imagerie.
- Placez le tube d’administration de l’anesthésie dans l’alésage de l’appareil d’IRM et collez-le de manière à ce que le cône nasal atteigne l’extrémité de la bobine réceptrice où la tête de l’animal sera placée.
- Allumez la caméra intégrée pour surveiller l’animal depuis la salle des consoles.
- Dans la salle de la console IRM, utilisez l’interface du logiciel pour démarrer une nouvelle étude pour l’animal (patient).
3. Positionnement de l’animal dans l’IRM et surveillance (voir figure 2)
- Transférez l’animal anesthésié dans la salle de scanner. Placez la souris en position couchée sur la bobine réceptrice et assurez-vous que son museau s’insère dans le cône nasal pour maintenir l’anesthésie. Réglez le débit d’air de l’anesthésie à 1 % à 1,5 % d’isoflurane à 1 L/min deO2.
- Assurez-vous de placer l’animal sur la bobine d’IRM avec ses régions du cœur et du cou situées au centre de la bobine réceptrice.
- Fixez le nez de la souris dans le cône du nez, l’abdomen et la queue de la souris sur la plate-forme avec du ruban adhésif.
- Placez quatre électrodes sur les pattes antérieures et arrière, en vous assurant que la paume des orteils est complètement ouverte pour enregistrer l’électrocardiogramme (ECG). Utilisez du gel conducteur ECG sur les pattes de la souris avant de fixer les coussinets ECG pour améliorer la conductivité.
- Assurez-vous d’utiliser du ruban adhésif pour fixer fermement les électrodes à la plate-forme.
- Alignez le laser du lit du scanner avec la base (extrémité proximale) du cœur ; Utilisez la clavicule et la ligne de la patte antérieure comme point de repère. Positionnez l’animal dans l’isocentre de l’aimant à l’aide d’une table IRM automatique.
4. Planification et acquisition d’images IRM
- Démarrez un balayage de reconnaissance pour exécuter les étalonnages standard du système IRM.
- Réglez l’équipement de surveillance pour détecter l’onde R de l’ECG. Ajustez les seuils pour chaque souris et au sein des sessions d’imagerie afin qu’il y ait un déclenchement fiable.
REMARQUE : La fréquence cardiaque de la souris sous anesthésie profonde se situe généralement entre 400 et 600 battements par minute (bpm). - Acquérir un écho de gradient (GRE) 3D pour obtenir des images pilotes multiplanaires (images scoutes) afin de planifier le reste des balayages (voir le Tableau 1 pour les paramètres d’acquisition de l’IRM et la Figure 3 pour la planification).
- Identifiez le cœur sur les images de repérage, en particulier sur la vue coronale, le plus facilement par ses artefacts de flux.
REMARQUE : Si les images montrent que la souris n’est pas bien centrée sur la bobine ou l’isocentre, rétractez le lit et répétez le positionnement. - Planifiez une angiographie par IRM (ARM) avec contraste 3D (voir le Tableau 1 pour les paramètres d’acquisition de l’IRM et la Figure 3 pour la planification) dans un plan transversal s’étendant de la base du cœur vers le cou et les artères carotides avec un champ de vision de 8 mm.
- Utilisez les images de projection d’intensité maximale (MIP) pour visualiser l’arc aortique, les artères brachiocéphalique et carotide et planifier l’amélioration tardive du gadolinium (LGE), la cartographie T1 et les scintigraphies cinétiques ultérieures (voir la figure 3 pour des images représentatives).
REMARQUE : Si le niveau du volume d’imagerie n’est pas correct, répétez l’acquisition en déplaçant les tranches vers la proximale ou vers la distale. - Acquisition d’images IRM pour mesurer la perméabilité endothéliale.
- Utilisez les images MIP et ARM transverses acquises auparavant pour planifier une acquisition 2D-Look-Locker (LL) à tranche unique perpendiculaire à l’aorte ascendante ou aux artères carotides (voir le tableau 1 pour le balayage des paramètres d’acquisition de l’IRM et la figure 3 pour les images représentatives).
- Réglez la fréquence cardiaque à 60 bpm lors de l’utilisation d’un signal ECG simulé ou définissez une période de suppression pour vous assurer que l’impulsion de récupération d’inversion entre les impulsions de récupération d’inversion suivantes est de 1000 ms lors de l’utilisation du signal ECG enregistré.
- Utilisez les images Look-Locker pour déterminer le temps d’inversion (TI) optimal pour l’annulation du signal sanguin requis pour l’analyse LGE.
- Imagerie LGE : Après 20 à 30 minutes d’injection de gadofosveset, et immédiatement après le balayage LL (décrit aux étapes 4.7.1 à 4.7.3), acquérir un balayage LGE à l’aide d’une séquence d’écho à gradient rapide 3D à récupération d’inversion (voir le tableau 1 pour les paramètres d’acquisition de l’IRM et la figure 3 pour les images représentatives).
- Planifier un balayage LGE par écho 3D transversal à gradient rapide pour couvrir la base du cœur (pour inclure une partie de la racine aortique), l’artère brachiocéphalique (entre la racine aortique et la bifurcation sous-clavière) et une partie des artères carotides avec un champ de vision (FOV) de 8 mm dans la direction pied-tête en utilisant la même géométrie que pour l’ARM ci-dessus (voir la figure 3 pour des images représentatives).
- Réglez la fréquence cardiaque à 60 bpm, lors de l’utilisation d’un signal ECG simulé, ou définissez une période de suppression pour vous assurer que des impulsions successives de récupération d’inversion se produisent toutes les 1000 ms pour le balayage LGE lors de l’utilisation du signal ECG enregistré (comme pour l’étape 4.7.2 ci-dessus).
REMARQUE : Ceci est important pour une récupération cohérente et indépendante de la fréquence cardiaque de l’aimantation entre les impulsions successives de récupération d’inversion. - Insérez le T1 obtenu à partir du Look-Locker dans la séquence LGE sous Contraste > Délai d’inversion.
- Imagerie de cartographie T1 : Utilisez une acquisition d’écho de gradient rapide 3D pour acquérir des images de cartographie transversale T1 45 min après l’injection de gadofosveset. Planifiez la séquence dans la même orientation et la même géométrie que le balayage LGE ci-dessus (voir le tableau 1 pour les paramètres d’acquisition de l’IRM et la figure 3 pour les images représentatives).
- Réglez la fréquence cardiaque à 120 bpm, lors de l’utilisation d’un ECG simulé, ou définissez une période de suppression pour vous assurer que l’impulsion de récupération d’inversion entre les deux trains d’imagerie se produit toutes les 500 ms lors de l’utilisation de la trace ECG enregistrée.
REMARQUE : La séquence de mappage T1 utilise deux impulsions d’inversion non sélectives avec des temps d’inversion compris entre 20 et 2000 ms, suivies de huit lectures segmentées pour huit images individuelles. La combinaison des deux traînées d’imagerie donne un total de seize images par tranche avec des temps d’inversion variables. Les images sont automatiquement reconstruites sur le scanner à l’aide d’un modèle d’ajustement à trois paramètres. Les équations utilisées pour générer les cartes paramétriques T1 sont les suivantes :
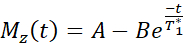
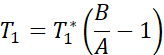
- Acquisition d’images IRM pour mesurer la fonction endothéliale
- Préparez une solution d’acétylcholine diluée dans une solution saline. Chargez une seringue à insuline à aiguille de 29 g avec le bon volume de solution pour obtenir (16,6 mg/kg). Maintenez le volume d’injection entre 50 et 150 μL.
- À l’aide de l’ARM transverse et des images MIP correspondantes, placez une tranche transversale à travers l’artère brachiocéphale, entre la racine aortique et la bifurcation sous-clavière (Figure 3 pour des images représentatives).
- Utilisez un écho de gradient 2D transversal (GRE) avec déclenchement ECG rétrospectif pour acquérir des images cine résolues temporellement de l’artère brachiocéphale (voir le tableau 1 pour les paramètres d’acquisition de l’IRM, la figure 3 pour les images représentatives).
- Ajustez le nombre de phases cardiaques maximales à la fréquence cardiaque de chaque animal.
REMARQUE : En règle générale, 14 phases cardiaques fournissent une résolution temporelle suffisante. - Après avoir acquis les images de base, entrez dans la salle du scanner IRM. Pendant que la souris est anesthésiée dans le scanner, injectez doucement de l’acétylcholine par voie intrapéritonéale (IP). Évitez de déplacer la souris sur la bobine.
- Attendez 6 à 10 minutes pour que la fréquence cardiaque se stabilise et répétez l’acquisition.
- À la fin de la procédure d’imagerie, remettez la souris dans sa cage et placez la cage sur un coussin chauffant pour la récupération.
REMARQUE : Les souris sont récupérées lorsqu’elles retrouvent une conscience suffisante pour maintenir la décubitus sternal. - Exportez les images acquises au format DICOM (Digital Imaging and Communications in Medicine) et utilisez un logiciel d’analyse d’images à plate-forme ouverte.
5. Segmentation de l’IRM et analyse des données (voir Figure 4)
- Faites glisser et déposez les fichiers Dicom dans la base de données d’un logiciel à plate-forme ouverte pour charger toutes les images.
- Utilisez les images LGE pour visualiser l’absorption de contraste dans la paroi du vaisseau et calculer la zone d’amélioration en tant que marqueur de substitution de la fuite des cellules endothéliales.
- Sélectionnez les analyses MRA et de récupération d’inversion. Appuyez sur Entrée pour charger ces images côte à côte. Cliquez sur la petite icône à côté du nom du scan et faites glisser et déposez les images MRA sur les images LGE.
- Sélectionnez l’option Rééchantillonner pour redécouper les images MRA en utilisant les images LGE comme référence pour tenir compte des différences d’épaisseur de tranche.
- Cliquez sur la petite icône à côté du nom du scan. Faites glisser et déposez les images LGE sur les images MRA (comme à l’étape 5.4 ci-dessus). Dans le menu, choisissez Image Fusion pour superposer les images LGE et MRA.
- Dans la barre d’outils, cliquez sur Visionneuse 2D, puis choisissez Panneau de position 3D. Utilisez les boutons pour corriger manuellement les décalages dans le plan afin de tenir compte des petits déplacements potentiels dus à la respiration animale.
- Utilisez l’outil Polygone fermé situé dans la barre d’outils pour segmenter manuellement le segment visuellement amélioré de la paroi du navire. Utilisez les images MRA et LGE co-enregistrées pour guider la segmentation.
- Segmentez toutes les images LGE qui englobent l’artère brachiocéphale.
REMARQUE : Si l’amélioration de la paroi du récipient a un aspect diffus ou inégal, segmentez-les individuellement dans chaque tranche. - Cliquez sur le bouton Plug-ins dans la barre d’outils et choisissez Outils de retour sur investissement, puis Exporter les retours sur investissement pour exporter la zone segmentée (mm2) pour chaque région d’intérêt (ROI) dans une feuille de calcul.
- Additionnez l’aire de chaque tranche pour calculer l’aire totale d’amélioration de l’artère brachiocéphale dans la feuille de calcul.
REMARQUE : La surface totale d’amélioration peut être utilisée comme marqueur quantitatif de la perméabilité endothéliale. - Utilisez les cartes T1 qui sont générées automatiquement sur l’ordinateur de l’IRM pour calculer la valeur moyenne T1 de la paroi du vaisseau qui reflète la quantité d’absorption de gadofosveset dans la paroi du vaisseau - il s’agit d’un autre marqueur quantitatif de la perméabilité endothéliale.
- Chargez les images cartographiques MRA et T1 et suivez une approche similaire à celle décrite ci-dessus (étapes 5.3 à 5.9) pour segmenter la paroi du navire et extraire les valeurs T1 (ms).
- Dans une feuille de calcul, inversez les valeurs T1 et multipliez par 1000 pour calculer le temps de relaxation R1 = 1/T1 en secondes. Calculer la valeur moyenne R1 pour toutes les tranches recouvrant l’artère brachiocéphale chez chaque animal.
- Chargez les images d’angiographie à contraste de phase et les cartes de vitesse pour calculer les changements dans la zone du vaisseau et la vitesse du flux sanguin, respectivement, au cours du cycle cardiaque.
- Segmentez à la fois les images acquises avant et après l’injection d’acétylcholine pour calculer la vasoréactivité endothéliale, un marqueur de substitution de la (dys)fonction endothéliale.
- Utilisez l’outil semi-automatisé Région de croissance disponible dans l’onglet ROI ou utilisez l’option Polygone fermé disponible dans la barre d’outils (comme décrit à l’étape 5.7) pour segmenter la zone lumineuse (mm2) de l’artère brachiocéphale dans les images d’angiographie.
REMARQUE : L’outil semi-automatisé utilise le seuillage des pixels pour regrouper les pixels englobant le pool sanguin en fonction de l’intensité de leur signal. - Utilisez l’outil Fermer le polygone pour segmenter les cartes codées correspondantes de la vitesse du flux sanguin afin de calculer la vitesse du flux sanguin (cm/s).
- Exportez la surface de la lumière (mm2) et la vitesse du flux sanguin (cm/s) dans une feuille de calcul (comme décrit à l’étape 5.9) et identifiez celles qui correspondent aux phases cardiaques de fin diastolique (surface maximale) et de fin systolique (surface minimale).
- À l’aide du tableur tablaire, calculer la vasodilatation dépendante de l’endothélium (calculer la variation en pourcentage de la surface de la lumière diastolique finale (DE) et de la vitesse du flux sanguin avant et après l’injection d’acétylcholine). Utilisez les formules suivantes :
changement de zone=
changement de flux=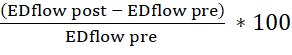
- Pour chaque animal, compilez les données correspondantes dérivées des images LGE, des cartes T1 et du test à l’acétylcholine dans un logiciel statistique à des fins d’analyse.
Résultats
Dans ce rapport, l’application d’une méthode MRI quantitative est mise en évidence pour mesurer lapesémicitéhélialeet la (dys)plaisir (qMETRIC) dans l’artère brachiocéphale de souris ApoE-/- athérosclérotiques. Cette méthode fournit des données directes et quantifiables de deux marqueurs de lésions endothéliales - la perméabilité et la (dys)fonction, qui peuvent être extraites de balayages in vivo de la paroi des vaisseaux acquis au cours d’une seule séance d’imagerie. Tout d’abord, les LGE sont utilisées pour mesurer l’aire d’amélioration de la paroi vasculaire (mm3), et les cartes T1 (ou R1) sont utilisées pour quantifier le taux de relaxation de la paroi vasculaire (s-1) après l’administration de gadofosveset, deux marqueurs de substitution de la perméabilité (voir la figure 5 pour des résultats représentatifs). Le taux de relaxation R1 de la paroi vasculaire variait de 2,42 s-1 ± 0,35 s-1 à 3,45 s-1 ± 0,54 s-1 à 3,83 s-1 ± 0,52 s-1 à 4 semaines, 8 semaines et 12 semaines d’un régime riche en graisses, respectivement. À l’inverse, les souris de type sauvage (R1 = 2,15 ± 0,34 s-1) et les souris ApoE-/- traitées aux statines (R1 = 3,0 ± 0,65 s-1) ont montré moins d’amélioration. Chez des souris ApoE-/- nourries avec un régime riche en graisses jusqu’à 12 mois, l’étude montre, avec une analyse histologique, un colorant Evans Blue et une microscopie électronique que la perméabilité endothéliale augmente au cours de la progression de l’athérosclérose, ce qui était en accord avec une augmentation du volume de la paroi vasculaire LGE, une augmentation de la relaxivité R1 de la paroi vasculaire et une vasoconstriction paradoxale après injection d’acétylcholine5. À l’inverse, les statines et d’autres traitements ciblant l’endothélium ont diminué la perméabilité endothéliale et la taille de la plaque, ce qui s’est traduit par un volume LGE plus petit, des valeurs R1 plus faibles 5,7 et une meilleure vasodilatation. Mécaniquement, le gadofosveset se lie de manière réversible à l’albumine sérique. Il en résulte une augmentation de 5 à 6 fois de la relaxivité T1 de la sonde29, ce qui la rend détectable par IRM avec une sensibilité élevée. Ici, l’étude montre que, liée à l’albumine, l’absorption de la sonde reflète la fuite endothéliale car elle est corrélée à l’absorption du colorant bleu d’Evan - une méthode ex vivo de référence pour quantifier les fuites endothéliales (Figure 5) - et des jonctions à espace serré plus larges5. Deuxièmement, il a été démontré qu’un test simple permet de mesurer la (dys)fonction endothéliale, en réponse à l’acétylcholine. Dans les vaisseaux témoins, l’acétylcholine provoque une relaxation vasculaire dépendante de l’endothélium, entraînant une augmentation de la surface/du volume artériel et du flux sanguin. Pour mesurer la (dys)fonction endothéliale, des images d’angiographie déclenchées par ECG acquises avant et après l’administration d’acétylcholine ont été utilisées. L’étude calcule la modification de la zone diastolique finale (ou volume) de la lumière du vaisseau avant et après l’administration d’acétylcholine. Il a été constaté que, contrairement aux vaisseaux normaux qui vasodilent en réponse à l’acétylcholine, les vaisseaux athérosclérotiques présentent une diminution de la fonction vasodilatatrice endothéliale qui se manifeste soit par une réduction de la surface (ou du volume) des vaisseaux, soit même par une vasoconstriction paradoxale du vaisseau (Figure 5). Il est intéressant de noter que le traitement par statines a amélioré les propriétés vasodilatatrices de l’endothélium13.
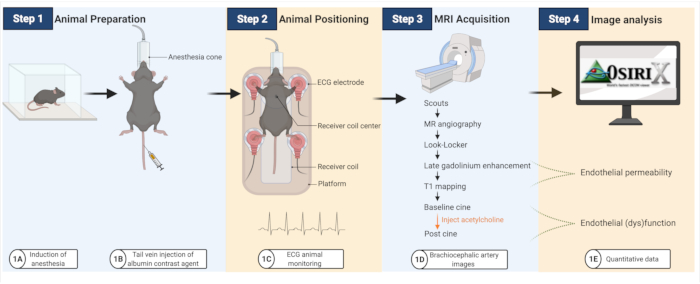
Figure 1 : Flux de travail pour imager la perméabilité endothéliale et la (dys)fonction chez les souris athérosclérotiques. (A-B) Les souris sont d’abord anesthésiées, puis injectées avec l’agent de contraste à base d’albumine. (C) Les souris sont ensuite transférées sur une bobine d’IRM, où des coussinets ECG sont utilisés pour surveiller l’activité cardiaque. (D-E) Des images IRM sont acquises pour quantifier la perméabilité endothéliale et la (dys)fonction, qui sont ensuite analysées à l’aide d’un logiciel à plateforme ouverte (créé avec BioRender.com). Veuillez cliquer ici pour voir une version agrandie de cette figure.
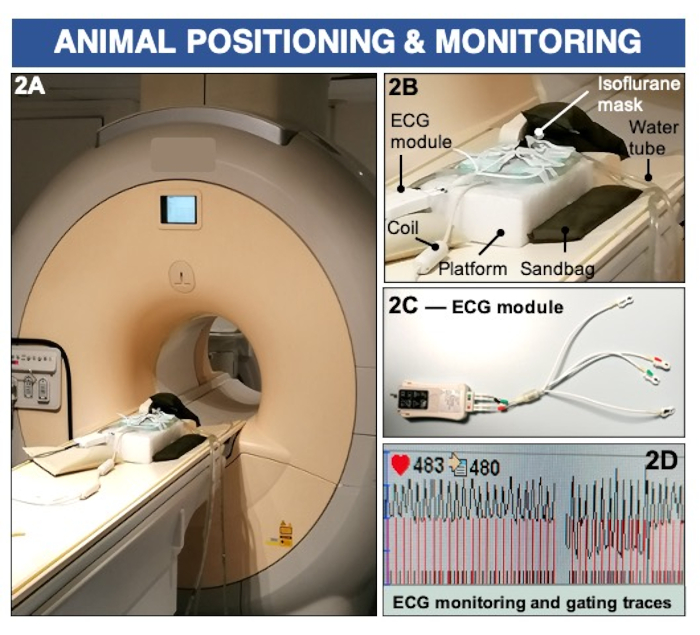
Figure 2 : Positionnement de l’animal et surveillance ECG pour imager la perméabilité endothéliale et la (dys)fonction à l’aide d’un scanner IRM clinique de 3 Tesla. (A-B) L’animal est positionné sur le ventre sur une bobine de surface et maintenu anesthésié à l’aide d’isoflurane inhalable. Des sacs de sable sont utilisés pour stabiliser la plate-forme d’imagerie. (C-D) Des coussinets ECG sont placés sur les pattes et reliés à un module ECG clinique pour enregistrer l’activité cardiaque. Veuillez cliquer ici pour voir une version agrandie de cette figure.
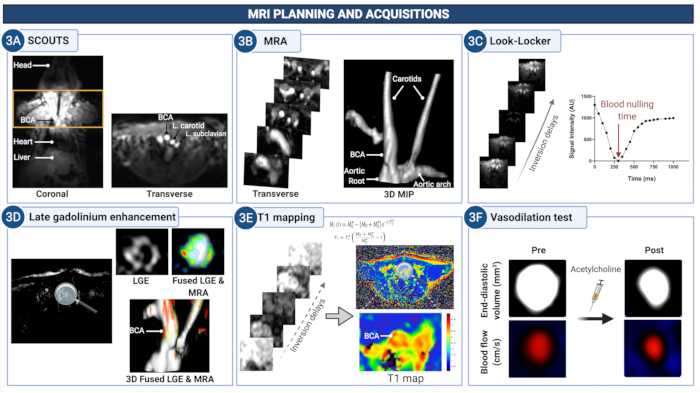
Figure 3 : Planification IRM et acquisition d’images pour quantifier la perméabilité endothéliale et la (dys)fonction dans l’artère brachiocéphale de souris athérosclérotiques. (A) Des images scoutes sont acquises pour identifier la région anatomique entre la racine aortique et les artères carotides. (B) L’angiographie IRM est utilisée pour visualiser le système vasculaire et planifier les examens ultérieurs. (C) Les images Look-Locker sont acquises au niveau de l’artère brachiocéphale afin de déterminer le délai approprié pour annuler le signal du sang dans les images ultérieures d’amélioration du gadolinium (LGE). (D) Les images LGE fournissent une évaluation visuelle de l’amélioration de la paroi du navire. (E) La cartographie T1 est utilisée pour calculer le taux de relaxation de la paroi de la cuve qui est indicatif de la concentration de gadolinium. (F) Les propriétés vasodilatatrices de la paroi vasculaire dépendantes de l’endothélium sont quantifiées après l’administration d’acétylcholine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
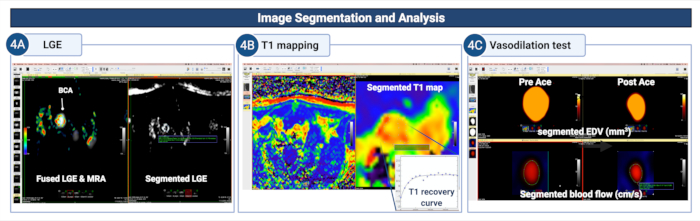
Figure 4 : Segmentation et analyse d’images pour quantifier la perméabilité endothéliale et la (dys)fonction dans l’artère brachiocéphale de souris athérosclérotiques. (A) La paroi du vaisseau est segmentée manuellement sur les images LGE pour quantifier la surface/le volume d’absorption de contraste. (B) La paroi du récipient est segmentée sur la cartographie T1 pour calculer le taux de relaxation T1 de la paroi du récipient. (C) La paroi vasculaire segmentée sur les angiographies IRM et les images codées par flux sanguin est utilisée pour étudier les propriétés vasodilatatrices de la paroi vasculaire en calculant les changements dans les changements dans les
Zone (ou volume) de la lumière diastolique et flux sanguin après l’administration d’acétylcholine. Veuillez cliquer ici pour voir une version agrandie de cette figure.
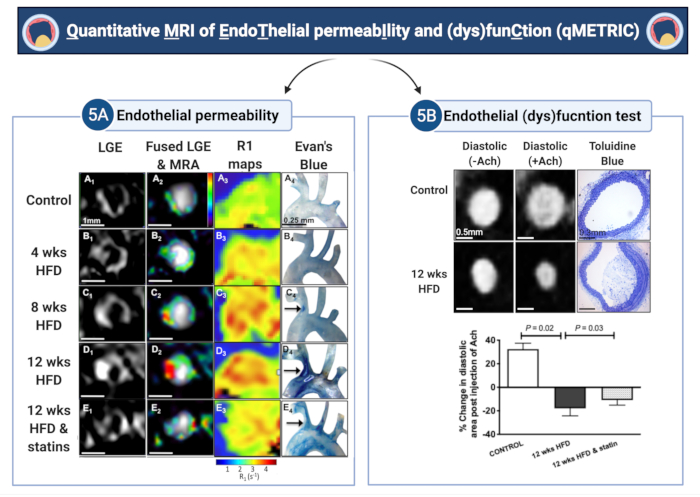
Figure 5 : Imagerie quantitative de la perméabilité endothéliale et de la (dys)fonction (qMETRIC) chez les souris athérosclérotiques. (A) Les images LGE et les cartes de relaxation R1 montrent une augmentation de l’absorption de l’agent de contraste liant l’albumine dans la paroi vasculaire au cours de la progression de l’athérosclérose et l’amélioration après le traitement par statine. Les données d’imagerie sont corroborées par l’accumulation ex vivo du colorant bleu d’Evan, un colorant liant l’albumine. (B) Les modifications des propriétés vasodilatatrices de la paroi vasculaire, en réponse à l’administration d’acétylcholine, permettent de quantifier la vasodilatation endothéliale. Les vaisseaux témoins vasodilates, tandis que les vaisseaux athérosclérotiques se vasoconstrictent en réponse à l’acétylcholine, ce qui suggère des lésions endothéliales. Le traitement par statine améliore les lésions endothéliales. Les termes « semaines » et « HFD » dans la figure représentent respectivement les termes « semaines » et « régime riche en graisses ». Cette figure a été modifiée d’après Phinikaridou, A. et al.5. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| Balayage / Séquence | Paramètres d’acquisition | ||
| Balayage éclaireur / pilote | 3D, écho dégradé rapide Transversal : champ de vision = 50 mm x 27 mm x 14 mm, matrice = 96 x 52, résolution dans le plan = 0,5 mm x 0,5 mm, épaisseur de la tranche = 0,5 mm, TR/TE = 15/6,1 ms, angle de retournement = 30°, moyennes = 1 Coronal : champ de vision = 200 mm x 102 mm x 14 mm, matrice = 336 x 173, résolution dans le plan = 0,5 mm x 0,5 mm, épaisseur de la tranche = 0,5 mm, TR/TE = 12/6 ms, angle de retournement = 30°, moyennes = 1 | ||
| Scan ARM | Écho à gradient rapide 3D, champ de vision = 30 mm x 30 mm x 8 mm, matrice = 200 x 200, résolution dans le plan = 0,15 mm x 0,15 mm, épaisseur de la tranche = 0,5 mm, TR/TE = 15/6,1 ms, angle de retournement = 40°, moyennes = 1 | ||
| Analyse Look-Locker | Écho à gradient rapide 2D, champ de vision = 30 mm x 30 mm, matrice = 80 x 80, résolution dans le plan = 0,38 mm x 0,38 mm, épaisseur de la tranche = 2 mm, TR/TE = 19/8,6 ms, TR entre les impulsions IR suivantes = 1000 ms, et angle de retournement = 10°, moyennes = 1. | ||
| Balayage LGE | Écho à gradient rapide 3D, FOV = 30 mm x 30 mm x 8 mm, matrice = 304 x 304, résolution dans le plan = 0,1 mm x 0,1 mm, épaisseur de tranche mesurée = 0,5 mm, tranches = 32, TR/TE = 28/8 ms, TR entre les impulsions IR suivantes = 1000 ms et angle de retournement = 30°, moyennes = 1. | ||
| Balayage de cartographie T1 | Écho à gradient rapide 3D, champ de vision = 36 mm x 22 mm x 8 mm, matrice = 192 x 102, résolution dans le plan = 0,18 mm x 0,22 mm, épaisseur de tranche mesurée = 0,5 mm, tranches = 16, TR/TE = 9,6/4,9 ms, angle de retournement = 10°, moyennes = 1. | ||
| Angiographie à contraste de phase | 2D, écho à gradient rapide, champ de vision = 40 mm x 23 mm, matrice = 132 x 77, résolution dans le plan = 0,3 mm x 0,3 mm x 1 mm, TR/TE = 9,8/4,9 ms, angle de retournement = 30°, phases cardiaques = 14, moyennes = 6, vitesse d’écoulement (direction pied-tête) = 30 cm/s. | ||
TABLEAU 1 : Paramètres d’acquisition de l’IRM
Discussion
La détermination de la santé de l’endothélium vasculaire est un biomarqueur d’imagerie attrayant qui peut potentiellement être utilisé pour diagnostiquer le risque lié à l’athérosclérose et pour surveiller les effets du traitement. Le protocole qMETRIC décrit ici peut être utilisé pour quantifier de manière reproductible la perméabilité/fuite endothéliale et la (dys)fonction dans un protocole d’IRM complet, rapide et cliniquement applicable. Une telle approche peut fournir une alternative plus simple ou un outil complémentaire aux protocoles DCE-MRI existants pour quantifier la perméabilité endothéliale. Il peut également fournir un outil non invasif pour l’évaluation directe de la (dys)fonction endothéliale dans les lits vasculaires, tels que les artères coronaires et carotides, au lieu d’utiliser des techniques invasives ou des mesures de substitution dans les artères périphériques moins gravement touchées par la maladie. La mesure de la perméabilité endothéliale à l’aide de cette méthode permet de couvrir l’aorte, l’arc aortique et les artères brachiocéphale et carotide à une haute résolution spatiale (0,1 mm pour les images LGE et 0,22 mm pour la cartographie T1) qui est cruciale pour une segmentation précise de la paroi vasculaire chez les rongeurs. L’analyse des images peut être effectuée à l’aide d’une plate-forme open-source et ne nécessite qu’une simple segmentation de la paroi du vaisseau sans avoir besoin d’une modélisation pharmacocinétique complexe. Il est important de noter que ce protocole peut être adapté pour être utilisé dans un certain nombre de scanners différents disponibles dans le commerce et peut être étendu pour être utilisé dans différents modèles animaux et également chez l’homme. Bien que ce protocole décrive la méthodologie à l’aide d’un scanner clinique, les protocoles IRM peuvent également être mis en œuvre lors de l’utilisation de scanners de petits animaux à haut champ. Ces scanners proposent fréquemment des protocoles de récupération par inversion, de cartographie T1 et d’angiographie qui peuvent être utilisés ou programmés en collaboration avec les fabricants de scanners.
Pour obtenir des résultats précis et reproductibles, une attention particulière doit être portée à certaines étapes critiques du protocole. Tout d’abord, lors de l’imagerie de petits animaux dans un scanner clinique, des bobines réceptrices appropriées et sur mesure sont nécessaires pour maximiser le rapport signal/bruit pour une qualité d’image élevée. Le positionnement de l’animal sur la bobine est également crucial, évitant la séparation et les espaces remplis d’air entre l’animal et la bobine afin d’améliorer le rapport signal/bruit. Pour cette raison, la zone anatomique d’intérêt doit être placée au centre de la bobine, puis déplacée vers l’isocentre de l’aimant pour les exposer au champ magnétique avec une homogénéité maximale. Deuxièmement, un signal ECG stable, fort et précis est primordial pour un déclenchement/déclenchement fiable de l’imagerie. Ceci est important pour l’excitation constante de l’aimantation et le timing de la fenêtre d’acquisition d’images à des points temporels spécifiques et pour l’acquisition d’images précises résolues en temps qui incluent la phase diastolique finale pour le test fonctionnel. Les électrodes à coussinets ou à aiguille pour petits animaux sont des options plus appropriées lorsqu’elles sont utilisées sur des scanners à champ plus élevé, qui sont mieux blindés que les scanners cliniques. Lorsque ces options sont utilisées sur des scanners de terrain cliniques, les câbles ECG doivent être déformés ensemble pour éviter la formation de circuits de résonance à la fréquence IRM Lamour qui peuvent détériorer le signal ECG pendant la séquence d’impulsions. Alternativement, nous proposons l’utilisation du module ECG et des coussinets utilisés pour les scans humains avec ajustement de la taille du coussinet à celle de la patte de la souris et stabilisation supplémentaire des coussinets avec du ruban adhésif pour améliorer la conductivité. Troisièmement, lors de l’acquisition d’images LGE alors que l’agent de contraste circule encore dans la circulation sanguine, il est crucial de choisir le bon moment d’annulation pour supprimer efficacement le pool sanguin afin de délimiter la paroi du vaisseau. Une séquence Look-locker doit être exécutée avant chaque séquence LGE, et le temps de retard d’inversion doit être ajusté en conséquence. Quatrièmement, pour une cartographie T1 précise et précise à l’aide d’une séquence modifiée de récupération d’inversion de look-locker (MOLLI), le schéma d’acquisition d’images proposé devrait être mis en œuvre pour couvrir une gamme de retards d’inversion allant d’au moins 20 ms à 2000 ms pour capturer les espèces T1 courtes et longues. Enfin, la segmentation des données IRM doit être soumise à des critères rigoureux et stricts afin d’éviter les biais intra et/ou inter-observateurs dans les calculs de surface/volume et de valeur T1.
Contrairement à l’IRM-DCE, la procédure décrite ici ne fournit pas de données cinétiques sur le lavage et le lavage de l’agent de contraste dans la paroi du vaisseau. Il fournit plutôt un instantané de la perméabilité endothéliale à un moment précis après l’injection de l’agent de contraste liant l’albumine, le gadofosveset. Cependant, les données quantitatives extraites de ces points temporels sont fortement corrélées avec d’autres colorants à base d’albumine, tels que le colorant bleu d’Evan, qui est considéré comme un étalon-or pour mesurer la perméabilité endothéliale et l’augmentation de la largeur des jonctions endothéliales. D’un point de vue mécanistique, les fractions liée à l’albumine et non liée du gadofosveset sont suffisamment petites pour passer à travers les cassures des jonctions endothéliales et conduire à une amélioration du signal IRM. De plus, il est possible que la fraction non liée se lie également à l’albumine intraplaque après avoir pénétré dans la paroi du vaisseau et entraîne une augmentation du signal. Il a été observé que la relaxivité de la paroi vasculaire est der 1≈17 mmol/L/s, lorsque le gadofosveset est injecté à une dose clinique. Cette valeur est plus proche de celle rapportée pour la fraction liée à l’albumine (r1≈25 mmol/L/s) par rapport à la fraction libre (r1≈6,6 mmol/L/s)5,29.
Les applications futures de cette méthode d’imagerie comprennent des études scientifiques fondamentales dans différents modèles animaux et d’autres segments artériels et l’utilisation de cette méthode pour évaluer les réponses biologiques à des agents pharmaceutiques existants ou nouveaux. Les études peuvent être réalisées de manière transversale ou longitudinale pour recueillir des données mécanistes et des données sur les résultats, respectivement. La simplicité du flux de travail rend cette approche accessible et cliniquement applicable également chez l’homme. L’adaptation de cette méthode pour l’imagerie de la carotide humaine et des artères périphériques est plus imminente, mais l’application de cette méthode pour l’imagerie des artères coronaires nécessite d’autres progrès dans l’acquisition d’images, la reconstruction et la correction de mouvement qui sont actuellement en cours de développement30,31.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous sommes reconnaissants du financement accordé à : (1) British Heart Foundation (A.P Early Career Development Fellowship, Project grant-PG/2019/34897, et R.M.B. Project and Programme grants PG/10/044/28343, RG/12/1/29262 et RG/20/1/34802) ; (2) le Centre d’excellence en recherche de la BHF du Roi RE/18/2/34213 ; 3) le Wellcome EPSRC Centre for Medical Engineering (NS/A000049/1) ; (4) le ministère de la Santé, par l’intermédiaire de l’Institut national de recherche en santé (NIHR), la Cardiovascular Health Technology Cooperative (HTC) et le centre de recherche biomédicale complet, attribué au Guy’s & St Thomas' NHS Foundation Trust en partenariat avec le King’s College London et le King’s College Hospital NHS Foundation Trust ; (5) Agence chilienne pour la recherche et le développement (ANID) - Programme de l’Initiative scientifique du millénaire - NCN17_129 et FONDECYT 1180525.
matériels
| Name | Company | Catalog Number | Comments |
| Acetylcholine | Sigma Aldrich | A6625- 100G, 16.6 mg/kg | |
| Anesthesia equipment | General Anesthetic Services | General Anesthetic Services | |
| Circulating heating pump | ThermoFisher Scientific, USA | BOM: 152510101 | |
| ECG conductive gel (Nuprep) | Waever and Company, USA | 10-30-T | |
| ECG monitoring module | Invivo, USA | REF 0700-1002 | |
| Gadofosveset trisordium (Vasovist/ Ablavar) | Lantheus Medical Imaging Inc, North Billerica, MA, USA | 0.03 mmol/kg | |
| High fat diet | Special Diets Services, Witham, UK | 21% fat from lard, 0.15% (wt/wt) cholesterol | |
| Induction box | Vet Tech Solutions LTD | ||
| Insulin syringes | BD Biosciences | 0.5 mL, 29 G | |
| OsirixX software | OsiriX Foundation, Geneva, Switzerland | Open-source platform | |
| Philips Achieva MRI Scanner (3 Tesla) | Philips Healthcare, Best, The Netherlands | Equipped with a clinical gradient system (30 mT m-1, 200 mT m-1 ms-1) | |
| Single–loop surface microscopy receiver coil | Phillips Hamburg | Diameter = 23 mm | Custom built |
Références
- Lloyd-Jones, D. M., et al. Defining and setting national goals for cardiovascular health promotion and disease reduction: The American heart association's strategic impact goal through 2020 and beyond. Circulation. 121 (4), 586-613 (2010).
- Davignon, J., Ganz, P. Role of endothelial dysfunction in atherosclerosis. Circulation. 109 (23), Suppl 1 27-32 (2004).
- Ludmer, P. L., et al. Paradoxical vasoconstriction induced by acetylcholine in atherosclerotic coronary arteries. New England Journal of Medicine. 315 (17), 1046-1051 (1986).
- Crauwels, H. M., Van Hove, C. E., Holvoet, P., Herman, A. G., Bult, H. Plaque-associated endothelial dysfunction in apolipoprotein E-deficient mice on a regular diet. Effect of human apolipoprotein AI. Cardiovascular Research. 59 (1), 189-199 (2003).
- Phinikaridou, A., et al. Non-invasive magnetic resonance imaging evaluation of endothelial permeability in murine atherosclerosis using an albumin-binding contrast agent. Circulation. 126 (6), 707-719 (2012).
- Phinikaridou, A., et al. Increased vascular permeability measured with an albumin-binding magnetic resonance contrast agent is a surrogate marker of rupture-prone atherosclerotic plaque. Circulation; Cardiovascular Imaging. 9 (12), (2016).
- Phinikaridou, A., Andia, M. E., Passacquale, G., Ferro, A., Botnar, R. M. Noninvasive MRI monitoring of the effect of interventions on endothelial permeability in murine atherosclerosis using an albumin-binding contrast agent. Journal of the American Heart Association. 2 (5), 000402(2013).
- Sluimer, J. C., et al. Thin-walled microvessels in human coronary atherosclerotic plaques show incomplete endothelial junctions relevance of compromised structural integrity for intraplaque microvascular leakage. Journal of the American College of Cardiology. 53 (17), 1517-1527 (2009).
- Rubenfire, M., Cao, N., Smith, D. E., Mosca, L. Carotid artery reactivity to isometric hand grip exercise identifies persons at risk and with coronary disease. Atherosclerosis. 160 (1), 241-248 (2002).
- Nguyen, P. K., Meyer, C., Engvall, J., Yang, P., McConnell, M. V. Non-invasive assessment of coronary vasodilation using cardiovascular magnetic resonance in patients at high risk for coronary artery disease. Journal of Cardiovascular Magnetic Resonance. 10, 28(2008).
- Terashima, M., et al. Impaired coronary vasodilation by magnetic resonance angiography is associated with advanced coronary artery calcification. Journal of the American College of Cardiology; Cardiovascular Imaging. 1 (2), 167-173 (2008).
- Hays, A. G., et al. Non-invasive visualization of coronary artery endothelial function in healthy subjects and in patients with coronary artery disease. Journal of the American College of Cardiology. 56 (20), 1657-1665 (2010).
- Hirooka, Y., et al. Effect of L-arginine on acetylcholine-induced endothelium-dependent vasodilation differs between the coronary and forearm vasculatures in humans. Journal of the American College of Cardiology. 24 (4), 948-955 (1994).
- Takase, B., et al. Endothelium-dependent flow-mediated vasodilation in coronary and brachial arteries in suspected coronary artery disease. American Journal of Cardiology. 82 (12), 1535-1539 (1998).
- Al-Badri, A., Kim, J. H., Liu, C., Mehta, P. K., Quyyumi, A. A. Peripheral microvascular function reflects coronary vascular function. Arteriosclerosis Thrombosis and Vascular Biology. 39 (7), 1492-1500 (2019).
- Calcagno, C., et al. Detection of neovessels in atherosclerotic plaques of rabbits using dynamic contrast enhanced MRI and 18F-FDG PET. Arteriosclerosis Thrombosis and Vascular Biology. 28 (7), 1311-1317 (2008).
- Lobbes, M. B., et al. Atherosclerosis: contrast-enhanced MR imaging of vessel wall in rabbit model--comparison of gadofosveset and gadopentetate dimeglumine. Radiology. 250 (3), 682-691 (2009).
- Kerwin, W. S., Oikawa, M., Yuan, C., Jarvik, G. P., Hatsukami, T. S. MR imaging of adventitial vasa vasorum in carotid atherosclerosis. Magnetic Resonance Medicine. 59 (3), 507-514 (2008).
- van Hoof, R. H., et al. Vessel wall and adventitial DCE-MRI parameters demonstrate similar correlations with carotid plaque microvasculature on histology. Journal of Magnetic Resonance Imaging. 46 (4), 1053-1059 (2017).
- Calcagno, C., Mani, V., Ramachandran, S., Fayad, Z. A. Dynamic contrast enhanced (DCE) magnetic resonance imaging (MRI) of atherosclerotic plaque angiogenesis. Angiogenesis. 13 (2), 87-99 (2010).
- van Wijk, D. F., et al. Increasing spatial resolution of 3T MRI scanning improves reproducibility of carotid arterial wall dimension measurements. Magnetic Resonance Materials in Physics, Biology, and Medicine. 27 (3), 219-226 (2014).
- Li, B., et al. Turbo fast three-dimensional carotid artery black-blood MRI by combining three-dimensional MERGE sequence with compressed sensing. Magnetic Resonance Medicine. 70 (5), 1347-1352 (2013).
- Fan, Z., et al. Carotid arterial wall MRI at 3T using 3D variable-flip-angle turbo spin-echo (TSE) with flow-sensitive dephasing (FSD). Journal of Magnetic Resonance Imaging. 31 (3), 645-654 (2010).
- Li, X., Huang, W., Rooney, W. D. Signal-to-noise ratio, contrast-to-noise ratio and pharmacokinetic modeling considerations in dynamic contrast-enhanced magnetic resonance imaging. Magnetic Resonance Imaging. 30 (9), 1313-1322 (2012).
- Heisen, M., et al. The influence of temporal resolution in determining pharmacokinetic parameters from DCE-MRI data. Magnetic Resonance Medicine. 63 (3), 811-816 (2010).
- Chen, H., et al. Scan-rescan reproducibility of quantitative assessment of inflammatory carotid atherosclerotic plaque using dynamic contrast-enhanced 3T CMR in a multi-center study. Journal of Cardiovascular Magnetic Resonance. 16, 51(2014).
- Calcagno, C., Vucic, E., Mani, V., Goldschlager, G., Fayad, Z. A. Reproducibility of black blood dynamic contrast-enhanced magnetic resonance imaging in aortic plaques of atherosclerotic rabbits. Journal of Magnetic Resonance Imaging. 32 (1), 191-198 (2010).
- Engel, L. C., et al. Non-invasive imaging of endothelial damage in patients with different HbA1c levels: A proof-of-concept study. Diabetes. 68 (2), 387-394 (2019).
- Caravan, P., et al. The interaction of MS-325 with human serum albumin and its effect on proton relaxation rates. Journal of the American Chemical Society. 124 (12), 3152-3162 (2002).
- Munoz, C., et al. Motion-corrected 3D whole-heart water-fat high-resolution late gadolinium enhancement cardiovascular magnetic resonance imaging. Journal of Cardiovascular Magnetic Resonance. 22 (1), 53(2020).
- Milotta, G., et al. 3D whole-heart isotropic-resolution motion-compensated joint T1 /T2 mapping and water/fat imaging. Magnetic Resonance Medicine. 84 (6), 3009-3026 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon