Method Article
アテローム性動脈硬化症における内皮透過性と(障害)機能の定量的MRI
要約
私たちは、磁気共鳴画像法(MRI)を使用して動脈の内皮透過性と機能障害を定量化するための正確で非侵襲的で使いやすい方法を開発しました。この技術により、前臨床モデルとヒトのアテローム性動脈硬化症に関連する血管損傷と心血管リスクの評価が可能になります。
要約
心血管疾患は、世界の主要な死因です。透過性/漏れ性で機能不全の内皮は、血管損傷の最も初期のマーカーと考えられており、アテローム性動脈硬化症を引き起こすと考えられています。これらの変化を in vivo で同定する方法が臨床で望ましいでしょう。磁気共鳴画像法(MRI)ベースのツールやその他の技術により、心血管疾患における内皮の役割と in vivoでのリスクについて深く理解することが可能になりました。しかし、単一のイメージング研究から内皮損傷を反映した定量化可能なデータを抽出するには、再現性のあるシンプルなアプローチが必要です。動脈内皮損傷の 2 つのイメージング バイオマーカー (漏出/透過性および機能不全) の定量化を可能にする画像を取得および分析するために、非侵襲的で実装が容易な定量的 MRI ワークフローが開発されました。ここで、プロトコルは、臨床MRIスキャナーを使用して、アテローム性動脈硬化性ApoE-/- マウスの腕頭動脈におけるこの方法の適用について説明しています。まず、アルブミン結合プローブを使用して内皮漏出を定量化するための後期ガドリニウム増強(LGE)およびModified Look-Locker Inversion Recovery(MOLLI)T1マッピングプロトコルについて説明します。次に、アセチルコリンに応答した内皮機能障害を測定するための解剖学的および定量的血流配列について説明します。重要なことは、ここで概説した方法により、大きな体積カバレッジで高空間解像度の3D画像を取得できるため、血管壁構造の正確なセグメンテーションが可能になり、オブザーバー間およびオブザーバー内の変動性が向上し、信頼性と再現性が向上することです。さらに、複雑な動態モデリングのための高時間分解能を必要とせずに定量的データを提供するため、モデルに依存せず、可動性の高い血管(冠状動脈)のイメージングも可能です。したがって、このアプローチにより、データ分析が簡素化され、迅速化されます。最後に、この方法は、さまざまなスキャナーに実装でき、さまざまな動脈床を画像化するように拡張でき、ヒトでの使用に臨床的に適用できます。この方法は、精密医療アプローチを採用することにより、アテローム性動脈硬化症の患者を診断および治療するために使用できます。
概要
心血管疾患(CVD)は、依然として世界中の死亡および罹患率の主要な原因であり、死亡のほぼ3分の1を占めており1、医療システムに高い財政的コストをもたらす生涯にわたる障害の原因となっています1。CVDの中で、虚血性心疾患と脳卒中は主にアテローム性動脈硬化性プラークによって引き起こされます。アテローム性動脈硬化症は多因子性疾患です。しかし、一般的な特徴は、アテローム性動脈硬化症の形成、進行、および最終的な合併症につながる血管内皮細胞の早期損傷です。無傷の血管内皮は、基本的な血管保護特性を持っています2。内皮は、体循環と血管壁との間の細胞と分子の転座を制御することにより、血管透過性を調節します。血管拡張薬(一酸化窒素、プロスタサイクリンなど)と血管収縮薬(エンドセリン-1、アンジオテンシンIIなど)の産生のバランスをとることにより、血管緊張を制御します。また、抗凝固特性もあります。しかし、内皮細胞の機能と透過性は、心血管リスク因子(喫煙、高コレステロール、糖尿病、全身性炎症、酸化ストレスなど)の存在下や血流の血行動態パターンによって低下する可能性があります。機能不全の内皮は、ストレッサーに反応して血管拡張を減少させ、その結果、動脈硬化を増加させます。さらに、透過性/漏出性内皮は、隣接する細胞3,4,5,6,7間のタイトギャップ接合部を広げた。このような変化は、管腔内皮と、壊れやすく、漏れやすく、異形に見える新しく形成されたプラーク微小血管の両方で発生します8。透過性内皮細胞は、血漿媒介性分子や細胞の侵入口として機能し、心血管疾患のリスクを悪化させます。
この知識に基づいて、過去15年間で、内皮透過性と機能は、心血管疾患のリスクのある被験者をより適切に診断し、既知または新規の薬剤の影響を評価するための有望なイメージングおよび治療標的として浮上してきました。しかし、内皮機能の直接的かつ定量的なイメージングは限られています9,10,11,12。現在、in vivoでの内皮機能の解釈の多くは、末梢血管における内皮依存性拡張(FMD)の研究に基づいており、その機能は臨床イベントを引き起こす血管床のアテローム性動脈硬化症の負担とわずかに相関しています13,14,15。限られた数の画像研究のみが、内皮機能障害と生体内アテローム性動脈硬化症の負担との間に直接的な関連性を示しています9,10,11,12。逆に、よりアクセスしやすいMRIベースのアプローチにより、内皮透過性のイメージングがより広く可能になりました。MRIガドリニウム剤の投与後の血管壁シグナル増強の割合を使用して、内皮透過性の半定量的測定が得られました16,17。その後、動的造影(DCE)プロトコルの開発により、血管内皮透過性の改善されたより定量的な測定が可能になりました。キネティックモデリングから導き出された造影剤の血管外出率(Ktrans)や微小血管容積(Vρ)、または非モデル化された方法から抽出された曲線下面積(AUC)、上り勾配、ピークまでの時間、ピーク濃度などの定量的パラメータは、内皮透過性だけでなくプラーク血管とも相関していた18,19,20.しかし、血管DCEの適用は、大幅な技術的進歩にもかかわらず、(i)血管壁の正確な描写のために高い空間分解能(0.5-0.7 mm2)と時間分解能21の両方を必要とするため、依然として課題となっています。動脈入力関数を計算するために血液中の造影剤の濃度をサンプリングするには、運動論的モデリングも必要であり、これは、時間分解能を得るために解剖学的被覆22,23を制限するか、またはその逆のトレードオフにつながる24,25;(ii)データ分析には、複雑な薬物動態モデリングが必要になる場合があります(例:Patlak対Tofts)。(iii)限られた画像品質、低いスキャン再スキャン再現性、および平均的な観察者間および観察者内の変動性26,27を提供します。したがって、より優れた臨床的有用性を持つ可能性のある単一の画像研究から、内皮透過性と(機能障害)の直接的かつ定量化可能なデータを抽出するための再現性のあるシンプルなアプローチが依然として必要です。
本研究では、動脈内皮損傷の2つのマーカー(漏出性/透過性および機能障害)を1回のスキャンでアテローム性動脈硬化症の前臨床モデルを用いて直接定量化できる画像を取得・解析するための非侵襲的で実装が容易な定量的MRIを開発しました。この方法は、Q uantitative MRI of EndoT helialpeRmeabIlity and dysfunCtion (qMETRIC) と名付けられています。これには、血管内アルブミン結合プローブの投与後に内皮漏出を定量化するための後期ガドリニウム増強 (LGE) および Modified Look-Locker Inversion Recovery (MOLLI) T1 マッピング プロトコルの取得が含まれます。アセチルコリンボーラスに応答した内皮機能障害を測定するための解剖学的および定量的血流配列の取得。私たちは、qMETRICが正確に検出することを実証しました:アテローム性動脈硬化症の重症度と合併症のリスク。治療反応;また、患者5,6,7での使用に適合させることができます。重要なことは、ここで概説した方法により、高空間解像度の画像を取得できるため、血管壁の正確なセグメンテーションが可能になり、観察者間/観察者内のバイアスが最小限に抑えられ、大きな解剖学的カバレッジで信頼性と再現性が向上することです。最後に、この方法は、異なるスキャナーでの使用に適応させることができ、異なる動脈床(冠状動脈28でさえも)を画像化するために拡張することができる。ワークフローが簡単なため、このアプローチは心血管イメージングコミュニティにとってよりアクセスしやすくなっています。
プロトコル
この研究のすべての要素は、1986年の英国動物(科学的手続き)法に従って、キングスカレッジロンドン倫理審査委員会の承認を得て実施されました。
実験ワークフローを 図 1 にまとめます。
1.動物の調理
- ApoE-/- マウスに、ラード由来の21%の脂肪と平均0.15%(wt/wt)コレステロールを含む高脂肪食を最大12週間与えることにより、アテローム性動脈硬化症を誘発します。
- 29 G針インスリン注射器に適切な量の造影剤(gadofosveset trisordium)をロードして、0.03 mmol / kgの用量を達成します。.注入量を50〜150μLに保ちます。
- ケージを37°Cに設定された加熱パッドに置き、動物を予熱して体温を維持します。
- 吸収性組織で裏打ちされた誘導ボックスにマウスを入れて麻酔を誘発します。流量計をO2 の1 L / minでイソフルランの3%〜5%に約3〜5分間調整します。
注:毎分70呼吸(bpm)未満に減少するはずの遅い呼吸数を特定することにより、正しい麻酔の深さを確認します。 - つま先つまみ法(つまり、つま先つまみに対する離脱反射の喪失)を使用して麻酔を確認します。動物をホルダーに移し、鼻をノーズコーンに挿入します。動物の体温を維持するために、ホルダーを加熱パッドの上に置きます。
- ホルダー内の麻酔気流をO2の1 L / minで1%-2%イソフルランに設定することにより、鼻から供給される麻酔を維持します。
- 麻酔下の乾燥を防ぐために、動物の目に獣医軟膏を塗ります。
- 動物をうつ伏せにするか横に置き、アルコール綿棒で尾を掃除します。2つの尾静脈のうちの1つを見つけます。必要に応じて、UVランプで尾を温め、尾静脈をより見やすくします。
- 29 Gインスリン針を静脈と平行に挿入し、針の斜角を上にして挿入します。.gadofosvesetトリナトリウムを含むプレフィルドシリンジの容量を静かに注入します。.針を抜いた後、注射部位に出血がないことを確認してください。.
- gadofosvesetが循環するまで30秒待ってから、マウスをMRIベッドに移します。
2. MRIスキャナーの準備( 図1を参照)
- MRIテーブルを吸収性組織で覆います。
- MRIシングルループレシーバーコイルをMRIベッドに置きます。プラットフォームを使用してレシーバーコイルを持ち上げ、レシーバーコイルとMRIテーブルが直接接触しないようにします。
- サージカルテープを使用してコイルをプラットフォームに固定します。
- 循環式ヒートポンプに接続されたチューブをコイルの周りに配置して固定し、イメージング中に動物の体温を維持するために37°Cに設定します。
- 麻酔送達チューブをMRIスキャナーの穴に挿入し、ノーズコーンが動物の頭が配置されるレシーバーコイルの先端に達するようにテープで留めます。
- インボアカメラの電源を入れて、コンソールルームから動物を監視します。
- MRIコンソールルームで、ソフトウェアインターフェースを使用して、動物(患者)の新しい研究を開始します。
3. MRIスキャナーでの動物の位置決めとモニタリング( 図2を参照)
- 麻酔をかけた動物をスキャナールームに移します。マウスをレシーバーコイルの腹臥位に置き、鼻がノーズコーンに収まるようにして麻酔を維持します。麻酔の気流をO2の1 L / minで1%-1.5%イソフルランに回します。
- 動物をMRIコイルの上に置き、心臓と首の領域をレシーバーコイルの中央に配置してください。
- マウスの鼻をノーズコーン、腹部、およびマウスの尾をプラットフォームにテープで固定します。
- 前足と後足に4つの電極を配置し、つま先の手のひらが完全に開いていることを確認して心電図(ECG)を記録します。ECGパッドを取り付ける前に、マウスの足にECG導電性ゲルを使用して、導電性を向上させます。
- 電極をプラットフォームにしっかりと取り付けるために、テープを使用してください。
- スキャナーのベッドのレーザーを心臓の基部(近位端)に合わせます。鎖骨と前足のラインを目印にしてください。自動MRテーブルを使用して、動物を磁石のアイソセンタに配置します。
4. MRI画像のプランニングと取得
- スカウトスキャンを開始して、MRIシステムの標準キャリブレーションを実行します。
- ECGのR波を検出するように監視装置を設定します。各マウスのしきい値とイメージングセッション内のしきい値を調整して、信頼性の高いトリガーが得られるようにします。
注:深い麻酔下でのマウスの心拍数は通常、毎分400〜600拍(bpm)の範囲です。 - 3Dグラジエントエコースキャン(GRE)を取得して、残りのスキャンを計画するための多平面パイロット画像(スカウト画像)を取得します(MRI取得パラメータについては 表1 を、計画については 図3 を参照)。
- スカウト画像、特に冠状ビューで心臓を特定するのは、そのフローアーティファクトによって最も簡単に識別できます。
注意: 画像がマウスがコイルまたはアイソセンターの中央にうまく配置されていないことを示している場合は、ベッドを引っ込めて配置を繰り返します。 - 心臓の基部から首と頸動脈に向かって伸びる横断面で、8 mmの視野(FOV)で3D造影MR血管造影(MRA)スキャンを計画します(MRI取得パラメータのスキャンについては 表1 、計画については 図3 を参照)。
- 最大強度投影(MIP)画像を使用して、大動脈弓、腕頭動脈、頸動脈を視覚化し、その後の後期ガドリニウム増強(LGE)、T1マッピング、およびシネスキャンを計画します(代表的な画像については 図3 を参照)。
注:イメージングボリュームのレベルが正しくない場合は、スライスを近位または遠位に動かして取得を繰り返します。 - 内皮透過性を測定するためのMRI画像取得。
- 前に取得したMIP画像と横方向MRA画像を使用して、上行大動脈または頸動脈に垂直な単一スライスの2D-Look-Locker(LL)取得を計画します(MRI取得パラメータのスキャンについては 表1 を、代表的な画像については 図3 を参照)。
- シミュレートされたECG信号を使用する場合は心拍数を60 bpmに設定するか、記録されたECG信号を使用する場合は、後続の反転回復パルス間の反転回復パルスが1000ミリ秒になるようにブランキング期間を設定します。
- Look-Lockerの画像を使用して、LGEスキャンに必要な血液信号のヌル化に最適な反転時間(TI)を決定します。
- LGEイメージング:gadofosvesetの注入の20〜30分後、LLスキャンの直後(ステップ4.7.1〜4.7.3で説明)に、反転回復3D高速グラジエントエコーシーケンスを使用してLGEスキャンを取得します(MRI取得パラメータについては 表1 を参照、代表的な画像については 図3 を参照)。
- 上記の MRA と同じジオメトリを使用して、心臓の基部 (大動脈基部の一部を含む)、腕頭動脈 (大動脈基部から鎖骨下分岐部まで)、頸動脈の一部をカバーする横方向 3D 高速グラデーション エコー LGE スキャンを計画します (代表的な画像については 図 3 を参照)。
- シミュレートされたECG信号を使用する場合は、心拍数を60 bpmに設定するか、記録されたECG信号を使用する場合(上記のステップ4.7.2と同様)、LGEスキャンで1000ミリ秒ごとに連続する反転回復パルスが発生するようにブランキング期間を設定します。
注:これは、連続する反転回復パルス間の磁化の一貫した心拍数に依存しない回復にとって重要です。 - Look-Lockerから取得したT1を、 コントラスト>反転遅延の下のLGEシーケンスに挿入します。
- T1マッピングイメージング:3D高速グラジエントエコー取得を使用して、gadofosvesetの注入から45分後に横方向のT1マッピング画像を取得します。上記のLGEスキャンと同じ向きと形状でシーケンスを計画します(MRI取得パラメータについては 表1 を、代表的な画像については 図3 を参照してください)。
- シミュレートされた ECG を使用する場合は心拍数を 120 bpm に設定するか、記録された ECG トレースを使用する場合は、2 つのイメージング トレイン間の反転回復パルスが 500 ミリ秒ごとに発生するようにブランキング期間を設定します。
注:T1マッピングシーケンスは、反転時間が20〜2000ミリ秒の2つの非選択的反転パルスを使用し、その後に8つの個々の画像に対して8つのセグメント化された読み出しが続きます。2 つのイメージング トレイルの組み合わせにより、スライスあたり合計 16 枚の画像が得られ、反転時間も異なります。画像は、3パラメータフィットモデルを使用してスキャナー上で自動的に再構築されます。T1 パラメトリック マップの生成に使用される方程式は次のとおりです。
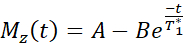
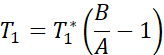
- 内皮機能を測定するためのMRI画像取得
- 生理食塩水に希釈したアセチルコリンの溶液を調製します。29 G 針インスリン注射器に適切な量の溶液をロードして (16.6 mg/kg) を達成します。注入量を50〜150μLに保ちます。
- 横方向MRAと対応するMIP画像を使用して、腕頭動脈を横切って、大動脈基部と鎖骨下分岐部の間に横スライスを配置します(代表的な画像の図3 )。
- レトロスペクティブ ECG ゲーティングを備えた横方向 2D グラディエント エコー (GRE) を使用して、腕頭動脈の時間的に分解されたシネ画像を取得します (MRI 取得パラメーターについては 表 1 を、代表的な画像については 図 3 を参照してください)。
- 各動物の心拍数に合わせて最大心相の数を調整します。
注:通常、14の心臓フェーズで十分な時間分解能が得られます。 - ベースライン画像を取得した後、MRIスキャナー室に入ります。マウスをスキャナーで麻酔している間に、アセチルコリンを腹腔内(IP)に穏やかに注入します。コイル上でマウスを動かさないでください。
- 心拍数が安定するまで6〜10分待ち、取得を繰り返します。
- イメージング手順の最後に、マウスをケージに戻し、ケージを加熱パッドに置いて回復します。
注:マウスは、胸骨の横臥を維持するのに十分な意識を取り戻すと回復します。 - 取得した画像をDICOM(Digital Imaging and Communications in Medicine)形式でエクスポートし、オープンプラットフォームの画像解析ソフトウェアを使用します。
5. MRIのセグメンテーションとデータ解析( 図4参照)
- Dicomファイルをオープンプラットフォームソフトウェアのデータベースにドラッグアンドドロップして、すべての画像をロードします。
- LGE画像を使用して、血管壁のコントラスト取り込みを視覚化し、内皮細胞漏出の代理マーカーとして増強領域を計算します。
- MRA スキャンと反転リカバリー・スキャンの両方を選択します。 Enter キーを押して、これらの画像を並べて読み込みます。スキャン名の横にある小さなアイコンをクリックし、MRA画像をLGE画像にドラッグアンドドロップします。
- [ 再サンプル ] オプションを選択すると、スライスの厚さの違いを考慮するための参照として LGE 画像を使用して MRA 画像を再スライスします。
- スキャン名の横にある小さなアイコンをクリックします。LGE 画像を MRA 画像にドラッグ アンド ドロップします (上記の手順 5.4 を参照)。メニューから [Image Fusion ] を選択して、LGE イメージと MRA イメージをオーバーレイします。
- ツールバーから「 2D Viewer」をクリックし、「 3D Position Panel」を選択します。ボタンを使用して面内シフトを手動で修正し、動物の呼吸による小さな変位の可能性を考慮します。
- ツールバーにある [閉じたポリゴン ]ツールを使用して、船舶の壁の視覚的に強化されたセグメントを手動でセグメント化します。同時登録された MRA 画像と LGE 画像を使用して、セグメンテーションをガイドします。
- 腕頭動脈を囲むすべての LGE 画像をセグメント化します。
注:血管壁の強調が拡散または斑点のある外観をしている場合は、各スライスでそれらを個別にセグメント化します。 - ツールバーの 「プラグイン 」ボタンをクリックして「 ROIツール」を選択し、「 ROIをエクスポート 」を選択して、各関心領域(ROI)のセグメント化された領域(mm2)をスプレッドシートにエクスポートします。
- 各スライスの面積を合計して、スプレッドシートで腕頭動脈の強化の総面積を計算します。
注:エンハンスメントの総面積は、内皮透過性の定量的マーカーとして使用できます。 - MRIスキャナーコンピュータで自動的に生成されるT1マップを使用して、血管壁へのガドホスベセットの取り込み量を反映する血管壁の平均T1値を計算します-これは内皮透過性の別の定量的マーカーです。
- MRAおよびT1マップ画像をロードし、上記と同様のアプローチ(ステップ5.3〜5.9)に従って血管壁をセグメント化し、T1値(ms)を抽出します。
- スプレッドシートで、T1 値を反転し、1000 を掛けて、緩和時間 R1 = 1/T1 を秒単位で計算します。各動物の腕頭動脈を覆うすべてのスライスの平均R1を計算します。
- 位相差血管造影画像と速度マップをロードして、心周期中の血管面積の変化と血流速度をそれぞれ計算します。
- アセチルコリンの注射前と注射後に取得した画像の両方をセグメント化して、内皮 (障害) 機能の代理マーカーである内皮依存性血管活性を計算します。
- [ROI] タブにある半自動の [領域の拡大 ] ツールを使用するか、ツールバーの [閉じたポリゴン ] オプション (手順 5.7 で説明) を使用して、血管造影画像内の腕頭動脈の内腔面積 (mm2) をセグメント化します。
注:半自動ツールは、ピクセルしきい値を使用して、信号強度に基づいて血液プールを取り囲むピクセルをクラスター化します。 - [ポリゴンを閉じる] ツールを使用して、対応する血流速度エンコード マップをセグメント化し、血流速度 (cm/s) を計算します。
- ルーメン面積 (mm2) と血流速度 (cm/s) をスプレッドシート (ステップ 5.9 で説明) にエクスポートし、拡張末期 (最大面積) と収縮期末 (最小面積) の心相に対応するものを特定します。
- 表形式のスプレッドシートを使用して、内皮依存性血管拡張を計算します (アセチルコリンの注射前および注射後の拡張末期 (ED) 内腔面積と血流速度の変化率を計算します)。次の式を使用します。
エリア変更=
フロー変更=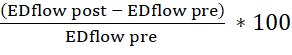
- 各動物について、LGE画像、T1マップ、およびアセチルコリンテストから得られた対応するデータを統計ソフトウェアで表にして分析します。
結果
この報告では、アテローム性動脈硬化性ApoE-/-マウスの腕頭動脈におけるEndoThelial peRmeabIlityおよび(dys)funCtion(qMETRIC)を測定するためのQuantitative MRI法の適用が実証されています。この方法では、内皮損傷の 2 つのマーカー (透過性と (機能障害) の直接的かつ定量化可能なデータが得られ、1 回のイメージングセッションで取得した in vivo 血管壁スキャンから抽出できます。まず、LGEを使用して血管壁増強の面積(mm3)を測定し、T1(またはR1)マップを使用して、透過性の代理マーカーであるガドフォスベセットの投与後の血管壁(s-1)の緩和率を定量化します(代表的な結果については図5を参照)。血管壁R1の緩和率は、高脂肪食の4週間、8週間、12週間で、それぞれ2.42 s-1 ± 0.35 s-1から3.45 s-1 ± 0.54 s-1から3.83 s-1 ± 0.52 s-1の範囲でした。逆に、野生型(R1 = 2.15 ± 0.34 s-1)およびスタチン処理ApoE-/-(R1 = 3.0 ± 0.65 s-1)マウスは、あまり増強されませんでした。ApoE-/-マウスに最大12か月間高脂肪食を与えられた研究では、組織学的分析、Evans Blue色素、および電子顕微鏡法により、アテローム性動脈硬化症の進行中に内皮透過性が増加することが示されています。これは、LGE血管壁容積の増加、血管壁R1弛緩性の増加、およびアセチルコリン注射後の逆説的な血管収縮と一致していました5.逆に、スタチンや他の内皮標的治療は、内皮透過性とプラークサイズを減少させ、これはLGE体積の減少、R1値の低下5,7、および血管拡張の改善に反映されました。機構的には、gadofosvesetは血清アルブミンに可逆的に結合します。.これにより、プローブ29のT1弛緩性が5〜6倍増加し、MRIで高感度で検出可能になります。ここでの研究は、アルブミンに結合したプローブの取り込みは、内皮漏出を定量化する標準的なex vivo法であるエバンの青色色素(図5)の取り込みと相関しているため、内皮漏出を反映していることが示されています5。次に、アセチルコリンに反応した内皮(障害)機能を測定するための簡単なテストが実証されています。対照血管では、アセチルコリンは内皮依存性の血管弛緩を引き起こし、動脈の面積/体積と血流の増加につながります。内皮(機能障害)を測定するために、アセチルコリンの投与前後に取得したECGトリガー血管造影画像を使用しました。この研究では、アセチルコリンの投与前後の血管内腔の拡張末期領域(または体積)の変化を計算します。アセチルコリンに応答して血管を拡張する正常な血管とは異なり、アテローム性動脈硬化性血管は、血管面積(または体積)の変化の減少、または血管の逆説的な血管収縮として現れる内皮依存性血管拡張機能の低下を示すことがわかりました(図5)。興味深いことに、スタチン治療は内皮の血管拡張特性を改善しました13。
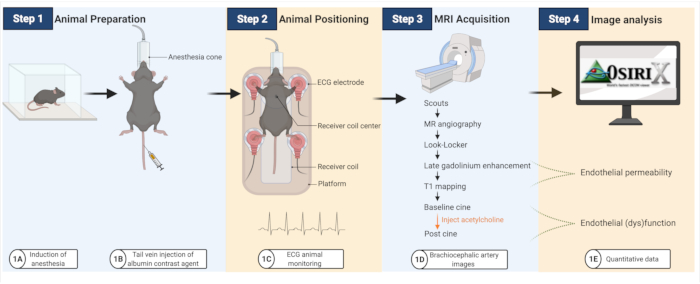
図1:アテローム性動脈硬化性マウスの内皮透過性と(機能障害)を画像化するためのワークフロー。 (A-B)マウスは最初に麻酔をかけられ、次にアルブミン造影剤を注射されます。(C)次に、マウスをMRIコイルに移し、ECGパッドを使用して心臓の活動を監視します。(D-E)MRI画像を取得して、内皮透過性と(機能障害)を定量化し、その後、オープンプラットフォームソフトウェア(BioRender.com で作成)を使用して分析します。この図の拡大版を表示するには、ここをクリックしてください。
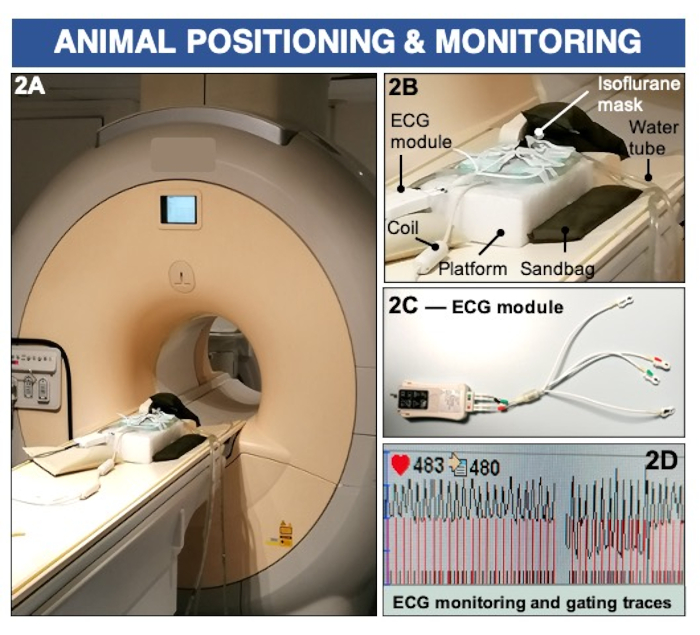
図2:臨床3テスラMRIスキャナーを使用した内皮透過性と(機能障害)を画像化するための動物のポジショニングとECGモニタリング。 (A-B)動物は表面コイル上に腹臥位で配置され、吸入可能なイソフルランを使用して麻酔された状態が維持されます。サンドバッグは、イメージングプラットフォームを安定させるために使用されます。(C-D)ECGパッドは前足に配置され、臨床ECGモジュールに接続して心臓の活動を記録します。この図の拡大版を表示するには、ここをクリックしてください。
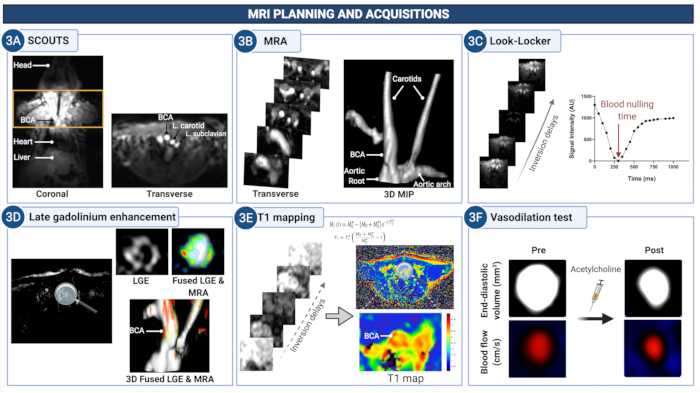
図3:アテローム性動脈硬化性マウスの腕頭動脈の内皮透過性と(機能障害)を定量化するためのMRI計画と画像の取得(A)スカウト画像を取得して、大動脈根と頸動脈の間の解剖学的領域を特定します。(B)MR血管造影は、血管系を視覚化し、その後のスキャンを計画するために使用されます。(C)Look-Locker画像は、腕頭動脈のレベルで取得され、その後のガドリニウム増強画像(LGE)で血液からの信号をゼロにする適切な時間遅延を決定する。(D)LGE画像は、血管壁の強化を視覚的に評価します。(E)T1マッピングは、ガドリニウムの濃度を示す血管壁緩和率を計算するために使用されます。(F)血管壁の内皮依存性血管拡張特性は、アセチルコリンの投与後に定量化されます。この図の拡大版を表示するには、ここをクリックしてください。
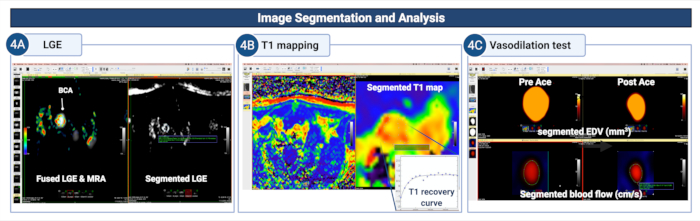
図4:アテローム性動脈硬化マウスの腕頭動脈における内皮透過性と(機能障害)を定量化するための画像セグメンテーションと分析 (A)造影剤の取り込みの面積/体積を定量化するために、LGE画像上で血管壁を手動でセグメント化します。(B)血管壁は、T1マッピング上でセグメント化され、血管壁T1緩和率を計算します。(C)MR血管造影および血流符号化された画像でセグメント化された血管壁は、血管壁の血管拡張特性を研究するために使用されます 最終の変化の変化を計算することにより、血管壁の血管拡張特性 -
アセチルコリン投与後の拡張期内腔面積(または体積)および血流。 この図の拡大版を表示するには、ここをクリックしてください。
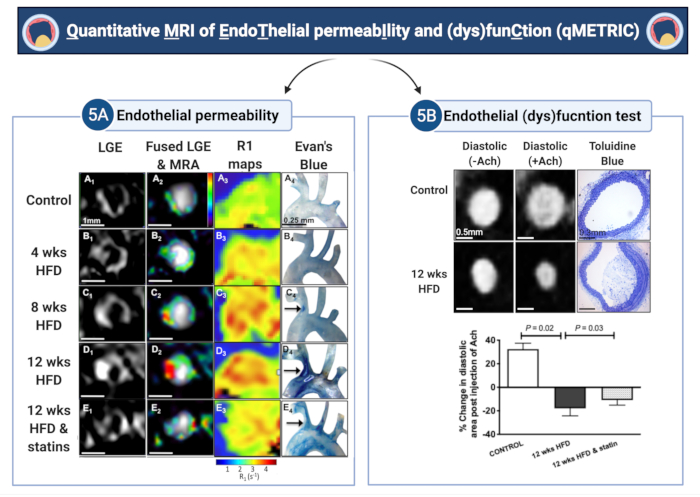
図5:アテローム性動脈硬化性マウスにおける内皮透過性と(機能障害)の定量的イメージング(qMETRIC) (A)LGE画像とR1リラクゼーションマップは、アテローム性動脈硬化症の進行中の血管壁内でのアルブミン結合造影剤の取り込みの増加とスタチン治療後の改善を示しています。イメージングデータは、アルブミン結合色素であるエバンの青色色素の ex vivoの蓄積によって裏付けられています。(B)アセチルコリン投与に応答した血管壁の血管拡張特性の変化により、内皮依存性血管拡張の定量化が可能になります。制御血管は血管拡張しますが、アテローム性動脈硬化性血管はアセチルコリンに応答して血管収縮し、内皮損傷を示唆しています。スタチンによる治療は内皮損傷を改善します。図中の「wks」と「HFD」は、それぞれ「weeks」と「High-fat diet」を表しています。この図は、Phinikaridou, A. et al.5から修正されています。 この図の拡大版を表示するには、ここをクリックしてください。
| スキャン/シーケンス | 取得パラメータ | ||
| スカウト/パイロットスキャン | 3D、高速グラジエントエコー 横方向:FOV = 50 mm x 27 mm x 14 mm、マトリックス = 96 x 52、面内分解能 = 0.5 mm x 0.5 mm、スライス厚さ = 0.5 mm、TR/TE = 15/6.1 ms、フリップ角度 = 30°、平均 = 1 コロナル:FOV = 200 mm x 102 mm x 14 mm、マトリックス= 336 x 173、面内分解能= 0.5 mm x 0.5 mm、スライス厚さ= 0.5 mm、TR / TE = 12/6 ms、フリップ角度= 30°、平均= 1 | ||
| MRAスキャン | 3D高速グラジエントエコー、FOV = 30 mm x 30 mm x 8 mm、マトリックス = 200 x 200、面内分解能 = 0.15 mm x 0.15 mm、スライス厚さ = 0.5 mm、TR/TE = 15/6.1 ms、フリップ角度 = 40°、平均 = 1 | ||
| Look-Lockerスキャン | 2D高速グラジエントエコー、FOV = 30 mm x 30 mm、マトリックス = 80 x 80、面内分解能 = 0.38 mm x 0.38 mm、スライス厚さ = 2 mm、TR/TE = 19/8.6 ms、後続のIRパルス間のTR = 1000 ms、反転角度 = 10°、平均 = 1。 | ||
| LGEスキャン | 3D高速グラジエントエコー、FOV = 30 mm x 30 mm x 8 mm、マトリックス = 304 x 304、面内分解能 = 0.1 mm x 0.1 mm、測定スライス厚さ = 0.5 mm、スライス = 32、TR/TE = 28/8 ms、後続のIRパルス間のTR = 1000 ms、フリップ角度 = 30°、平均 = 1。 | ||
| T1 マッピング・スキャン | 3D高速グラジエントエコー、FOV = 36 mm x 22 mm x 8 mm、マトリックス = 192 x 102、面内分解能 = 0.18 mm x 0.22 mm、測定スライス厚さ = 0.5 mm、スライス = 16、TR/TE = 9.6/4.9 ms、反転角度 = 10°、平均 = 1。 | ||
| 位相差血管造影スキャン | 2D、高速グラジエントエコー、FOV = 40 mm x 23 mm、マトリックス = 132 x 77、面内分解能 = 0.3 mm x 0.3 mm x 1 mm、TR/TE = 9.8/4.9 ms、フリップ角度 = 30°、心相 = 14、平均 = 6、流速 (足頭方向) = 30 cm/s。 | ||
表1:MRI取得パラメータ
ディスカッション
血管内皮の健康状態の判断は、アテローム性動脈硬化症関連リスクの診断や治療効果のモニタリングに使用できる可能性のある魅力的なイメージングバイオマーカーです。ここで概説するqMETRICプロトコルは、包括的で迅速かつ臨床的に適用可能なMRIプロトコルで、内皮の透過性/漏出性および(機能障害)を再現性よく定量化するために使用できます。このようなアプローチは、内皮透過性を定量化するための既存のDCE-MRIプロトコルに代わる、よりシンプルな代替ツールまたは補完的なツールを提供できます。また、冠動脈や頸動脈などの血管床の内皮(機能障害)を直接評価するための非侵襲的なツールを提供することもできます。侵襲的な技術や、疾患の影響が少ない末梢動脈での代理測定を使用する代わりに、この方法を使用して内皮透過性を測定すると、げっ歯類の血管壁の正確なセグメンテーションに不可欠な高い空間分解能(LGE画像で0.1 mm、T1マッピングで0.22 mm)で大動脈、大動脈弓、腕頭動脈と頸動脈をカバーできます。画像の解析は、オープンソースのプラットフォームを使用して行うことができ、複雑な薬物動態モデリングを必要とせずに、血管壁の単純なセグメンテーションのみが必要です。重要なことに、このプロトコルは、多数の異なる市販のスキャナーで使用するように適合させることができ、異なる動物モデルや人間で使用するように拡張することができます。このプロトコルは、臨床スキャナーのセットアップを使用した方法論を説明していますが、MRIプロトコルは、高磁場小動物スキャナーを使用する場合にも実装できます。これらのスキャナーは、多くの場合、反転回復、T1マッピング、および血管造影プロトコルを提供し、スキャナーの製造元と協力して使用またはプログラムできます。
正確で再現性のある結果を得るためには、プロトコールの重要なステップに特に注意を払う必要があります。まず、臨床スキャナーで小動物をイメージングする場合、高画質のために信号対雑音比を最大化するために、適切でカスタムメイドのレシーバーコイルが必要です。また、コイル上での動物の位置決めも重要で、動物とコイルの間の分離や空気で満たされた空間を避けることで、S/N比を向上させます。このため、解剖学的関心領域をコイルの中心に配置し、次に磁石の等心に移動して、磁場に最大限に均一にさらす必要があります。次に、安定した、強力で正確なECG信号は、信頼性の高いイメージングトリガー/ゲーティングにとって最も重要です。これは、特定の時点における磁化の一貫した励起と画像取得ウィンドウのタイミング、および機能テストの拡張末期を含む正確な時間分解画像を取得するために重要です。小動物用パッドベースまたは針ベースの電極は、臨床スキャナーと比較してシールド性が高い高電界強度スキャナーで使用する場合、より適切なオプションです。これらのオプションを臨床フィールドスキャナーで使用する場合、パルスシーケンス中にECG信号を劣化させる可能性のあるMRI Lamour周波数での共振回路の形成を避けるために、ECGケーブルを一緒に反らせる必要があります。あるいは、人間のスキャンに使用されるECGモジュールとパッドを使用して、パッドのサイズをマウスの足のサイズに調整し、テープでパッドをさらに安定させて導電性を向上させることを提案します。第三に、造影剤がまだ血流中を循環しているときにLGE画像を取得する場合、血管壁を描写するために血液プールを効率的に抑制するために、適切なヌル時間を選択することが重要です。Look-lockerシーケンスは、各LGEシーケンスの前に実行する必要があり、それに応じて反転遅延時間を調整する必要があります。第四に、MOLLI(Modified Look-Locker Inversion Recovery)シーケンスを使用した正確かつ精密なT1マッピングのためには、提案された画像取得スキームを実装して、少なくとも20 msから2000 msの範囲の反転遅延をカバーして、短いT1種と長いT1種を捕捉する必要があります。最後に、MRIデータのセグメンテーションは、面積/体積およびT1値の計算における観察者内および/または観察者間のバイアスを回避するために、厳密で厳格な基準を適用する必要があります。
DCE-MRIとは異なり、ここで説明する手順では、血管壁内の造影剤のウォッシュインおよびウォッシュアウトの速度論的データは提供されません。むしろ、アルブミン結合造影剤であるgadofosvesetの注射後の特定の時点での内皮透過性のスナップショットを提供します。しかし、これらの時点から抽出された定量データは、内皮透過性や内皮ギャップ接合幅の増加を測定するためのゴールドスタンダードと考えられているエバンの青色色素など、他のアルブミン色素と高い相関性を示しました。機構的には、ガドホスベセットのアルブミン結合画分と非結合画分の両方が、内皮接合部の切れ目を通過してMRI信号の増強につながるほど小さいです。さらに、非結合画分が血管壁に入った後、プラーク内アルブミンにも結合し、シグナルが増強される可能性があります。ガドホスベセットを臨床用量で注射した場合、血管壁の弛緩性はr1≈17 mmol/L/sであることが観察されました。この値は、アルブミン結合画分(r1≈25 mmol/L/s)について報告された値に近く、遊離画分(r1≈6.6 mmol/L/s)5,29と比較されます。
このイメージング法の将来の応用には、さまざまな動物モデルやその他の動脈セグメントでの基礎科学研究や、既存または新規の医薬品に対する生物学的反応を評価するためのこの方法の使用が含まれます。研究は、横断的または縦断的に実施して、それぞれメカニズムデータと結果データを収集できます。簡単なワークフローにより、このアプローチはアクセスしやすく、人間にも臨床的に適用できます。この方法をヒトの頸動脈および末梢動脈のイメージングに適合させることは、より差し迫ったものであるが、冠状動脈のイメージングにこの方法を適用するには、現在開発中の画像取得、再構成、および運動補正のさらなる進歩が必要である30,31。
開示事項
著者は何も開示していません。
謝辞
(1)ブリティッシュハート財団(APアーリーキャリア開発フェローシップ、プロジェクト助成金-PG / 2019/34897、およびRMBプロジェクトおよびプログラム助成金PG / 10/044/28343、RG / 12/1/29262およびRG / 20/1/34802)への資金提供に感謝します。(2)キングスBHFセンターフォーリサーチエクセレンスRE / 18/2/34213。(3)ウェルカムEPSRC医療工学センター(NS / A000049 / 1)。(4) 国立衛生研究所(NIHR)、心血管医療技術協同組合(HTC)、および包括的な生物医学研究センターを通じて、キングス・カレッジ・ロンドンおよびキングス・カレッジ・ホスピタルNHS財団トラストとの提携により、ガイズ&セントトーマスNHS財団トラストに授与された。(5)チリ研究開発庁(ANID)-ミレニアム科学イニシアチブプログラム-NCN17_129およびFONDECYT 1180525。
資料
| Name | Company | Catalog Number | Comments |
| Acetylcholine | Sigma Aldrich | A6625- 100G, 16.6 mg/kg | |
| Anesthesia equipment | General Anesthetic Services | General Anesthetic Services | |
| Circulating heating pump | ThermoFisher Scientific, USA | BOM: 152510101 | |
| ECG conductive gel (Nuprep) | Waever and Company, USA | 10-30-T | |
| ECG monitoring module | Invivo, USA | REF 0700-1002 | |
| Gadofosveset trisordium (Vasovist/ Ablavar) | Lantheus Medical Imaging Inc, North Billerica, MA, USA | 0.03 mmol/kg | |
| High fat diet | Special Diets Services, Witham, UK | 21% fat from lard, 0.15% (wt/wt) cholesterol | |
| Induction box | Vet Tech Solutions LTD | ||
| Insulin syringes | BD Biosciences | 0.5 mL, 29 G | |
| OsirixX software | OsiriX Foundation, Geneva, Switzerland | Open-source platform | |
| Philips Achieva MRI Scanner (3 Tesla) | Philips Healthcare, Best, The Netherlands | Equipped with a clinical gradient system (30 mT m-1, 200 mT m-1 ms-1) | |
| Single–loop surface microscopy receiver coil | Phillips Hamburg | Diameter = 23 mm | Custom built |
参考文献
- Lloyd-Jones, D. M., et al. Defining and setting national goals for cardiovascular health promotion and disease reduction: The American heart association's strategic impact goal through 2020 and beyond. Circulation. 121 (4), 586-613 (2010).
- Davignon, J., Ganz, P. Role of endothelial dysfunction in atherosclerosis. Circulation. 109 (23), Suppl 1 27-32 (2004).
- Ludmer, P. L., et al. Paradoxical vasoconstriction induced by acetylcholine in atherosclerotic coronary arteries. New England Journal of Medicine. 315 (17), 1046-1051 (1986).
- Crauwels, H. M., Van Hove, C. E., Holvoet, P., Herman, A. G., Bult, H. Plaque-associated endothelial dysfunction in apolipoprotein E-deficient mice on a regular diet. Effect of human apolipoprotein AI. Cardiovascular Research. 59 (1), 189-199 (2003).
- Phinikaridou, A., et al. Non-invasive magnetic resonance imaging evaluation of endothelial permeability in murine atherosclerosis using an albumin-binding contrast agent. Circulation. 126 (6), 707-719 (2012).
- Phinikaridou, A., et al. Increased vascular permeability measured with an albumin-binding magnetic resonance contrast agent is a surrogate marker of rupture-prone atherosclerotic plaque. Circulation; Cardiovascular Imaging. 9 (12), (2016).
- Phinikaridou, A., Andia, M. E., Passacquale, G., Ferro, A., Botnar, R. M. Noninvasive MRI monitoring of the effect of interventions on endothelial permeability in murine atherosclerosis using an albumin-binding contrast agent. Journal of the American Heart Association. 2 (5), 000402(2013).
- Sluimer, J. C., et al. Thin-walled microvessels in human coronary atherosclerotic plaques show incomplete endothelial junctions relevance of compromised structural integrity for intraplaque microvascular leakage. Journal of the American College of Cardiology. 53 (17), 1517-1527 (2009).
- Rubenfire, M., Cao, N., Smith, D. E., Mosca, L. Carotid artery reactivity to isometric hand grip exercise identifies persons at risk and with coronary disease. Atherosclerosis. 160 (1), 241-248 (2002).
- Nguyen, P. K., Meyer, C., Engvall, J., Yang, P., McConnell, M. V. Non-invasive assessment of coronary vasodilation using cardiovascular magnetic resonance in patients at high risk for coronary artery disease. Journal of Cardiovascular Magnetic Resonance. 10, 28(2008).
- Terashima, M., et al. Impaired coronary vasodilation by magnetic resonance angiography is associated with advanced coronary artery calcification. Journal of the American College of Cardiology; Cardiovascular Imaging. 1 (2), 167-173 (2008).
- Hays, A. G., et al. Non-invasive visualization of coronary artery endothelial function in healthy subjects and in patients with coronary artery disease. Journal of the American College of Cardiology. 56 (20), 1657-1665 (2010).
- Hirooka, Y., et al. Effect of L-arginine on acetylcholine-induced endothelium-dependent vasodilation differs between the coronary and forearm vasculatures in humans. Journal of the American College of Cardiology. 24 (4), 948-955 (1994).
- Takase, B., et al. Endothelium-dependent flow-mediated vasodilation in coronary and brachial arteries in suspected coronary artery disease. American Journal of Cardiology. 82 (12), 1535-1539 (1998).
- Al-Badri, A., Kim, J. H., Liu, C., Mehta, P. K., Quyyumi, A. A. Peripheral microvascular function reflects coronary vascular function. Arteriosclerosis Thrombosis and Vascular Biology. 39 (7), 1492-1500 (2019).
- Calcagno, C., et al. Detection of neovessels in atherosclerotic plaques of rabbits using dynamic contrast enhanced MRI and 18F-FDG PET. Arteriosclerosis Thrombosis and Vascular Biology. 28 (7), 1311-1317 (2008).
- Lobbes, M. B., et al. Atherosclerosis: contrast-enhanced MR imaging of vessel wall in rabbit model--comparison of gadofosveset and gadopentetate dimeglumine. Radiology. 250 (3), 682-691 (2009).
- Kerwin, W. S., Oikawa, M., Yuan, C., Jarvik, G. P., Hatsukami, T. S. MR imaging of adventitial vasa vasorum in carotid atherosclerosis. Magnetic Resonance Medicine. 59 (3), 507-514 (2008).
- van Hoof, R. H., et al. Vessel wall and adventitial DCE-MRI parameters demonstrate similar correlations with carotid plaque microvasculature on histology. Journal of Magnetic Resonance Imaging. 46 (4), 1053-1059 (2017).
- Calcagno, C., Mani, V., Ramachandran, S., Fayad, Z. A. Dynamic contrast enhanced (DCE) magnetic resonance imaging (MRI) of atherosclerotic plaque angiogenesis. Angiogenesis. 13 (2), 87-99 (2010).
- van Wijk, D. F., et al. Increasing spatial resolution of 3T MRI scanning improves reproducibility of carotid arterial wall dimension measurements. Magnetic Resonance Materials in Physics, Biology, and Medicine. 27 (3), 219-226 (2014).
- Li, B., et al. Turbo fast three-dimensional carotid artery black-blood MRI by combining three-dimensional MERGE sequence with compressed sensing. Magnetic Resonance Medicine. 70 (5), 1347-1352 (2013).
- Fan, Z., et al. Carotid arterial wall MRI at 3T using 3D variable-flip-angle turbo spin-echo (TSE) with flow-sensitive dephasing (FSD). Journal of Magnetic Resonance Imaging. 31 (3), 645-654 (2010).
- Li, X., Huang, W., Rooney, W. D. Signal-to-noise ratio, contrast-to-noise ratio and pharmacokinetic modeling considerations in dynamic contrast-enhanced magnetic resonance imaging. Magnetic Resonance Imaging. 30 (9), 1313-1322 (2012).
- Heisen, M., et al. The influence of temporal resolution in determining pharmacokinetic parameters from DCE-MRI data. Magnetic Resonance Medicine. 63 (3), 811-816 (2010).
- Chen, H., et al. Scan-rescan reproducibility of quantitative assessment of inflammatory carotid atherosclerotic plaque using dynamic contrast-enhanced 3T CMR in a multi-center study. Journal of Cardiovascular Magnetic Resonance. 16, 51(2014).
- Calcagno, C., Vucic, E., Mani, V., Goldschlager, G., Fayad, Z. A. Reproducibility of black blood dynamic contrast-enhanced magnetic resonance imaging in aortic plaques of atherosclerotic rabbits. Journal of Magnetic Resonance Imaging. 32 (1), 191-198 (2010).
- Engel, L. C., et al. Non-invasive imaging of endothelial damage in patients with different HbA1c levels: A proof-of-concept study. Diabetes. 68 (2), 387-394 (2019).
- Caravan, P., et al. The interaction of MS-325 with human serum albumin and its effect on proton relaxation rates. Journal of the American Chemical Society. 124 (12), 3152-3162 (2002).
- Munoz, C., et al. Motion-corrected 3D whole-heart water-fat high-resolution late gadolinium enhancement cardiovascular magnetic resonance imaging. Journal of Cardiovascular Magnetic Resonance. 22 (1), 53(2020).
- Milotta, G., et al. 3D whole-heart isotropic-resolution motion-compensated joint T1 /T2 mapping and water/fat imaging. Magnetic Resonance Medicine. 84 (6), 3009-3026 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved