Method Article
Количественная МРТ проницаемости и (дис)функции эндотелия при атеросклерозе
В этой статье
Резюме
Мы разработали точный, неинвазивный и простой в использовании метод количественной оценки проницаемости эндотелия и дисфункции в артериях с помощью магнитно-резонансной томографии (МРТ) под названием qMETRIC. Этот метод позволяет оценить повреждение сосудов и сердечно-сосудистый риск, связанный с атеросклерозом, на доклинических моделях и у человека.
Аннотация
Сердечно-сосудистые заболевания являются основными причинами смертности во всем мире. Проницаемый/негерметичный и дисфункциональный эндотелий считается самым ранним маркером повреждения сосудов и считается причиной атеросклероза. Метод выявления этих изменений in vivo был бы желателен в клинике. Инструменты магнитно-резонансной томографии (МРТ) и другие технологии позволили глубоко понять роль эндотелия в развитии сердечно-сосудистых заболеваний и риск in vivo. Тем не менее, существует потребность в воспроизводимых и простых подходах для извлечения количественных данных, отражающих повреждение эндотелия, из одного исследования визуализации. Был разработан неинвазивный, простой в реализации и количественный рабочий процесс МРТ для получения и анализа изображений, которые позволяют количественно оценить два биомаркера визуализации повреждения эндотелия артерий (негерметичность/проницаемость и дисфункция). Здесь в протоколе описано применение этого метода в брахиоцефальной артерии атеросклеротических мышей ApoE-/- с использованием клинического МРТ-сканера. Во-первых, описаны протоколы позднего гадолиниевого усиления (LGE) и модифицированного Look-Locker Inversion Recovery (MOLLI) T1 для количественной оценки утечки эндотелия с использованием альбуминсвязывающего зонда. Во-вторых, описаны анатомические и количественные последовательности кровотока для измерения эндотелиальной дисфункции в ответ на ацетилхолин. Важно отметить, что описанный здесь метод позволяет получать 3D-изображения с высоким пространственным разрешением и большим объемным охватом, что позволяет точно сегментировать структуры стенок сосудов для улучшения меж- и внутринаблюдательной вариабельности, а также для повышения надежности и воспроизводимости. Кроме того, он предоставляет количественные данные без необходимости высокого временного разрешения для сложного кинетического моделирования, что делает его независимым от модели и даже позволяет визуализировать высокоподвижные сосуды (коронарные артерии). Таким образом, такой подход упрощает и ускоряет анализ данных. Наконец, этот метод может быть реализован на различных сканерах, может быть расширен для визуализации различных артериальных русла и клинически применим для использования у людей. Этот метод может быть использован для диагностики и лечения пациентов с атеросклерозом с использованием подхода точной медицины.
Введение
Сердечно-сосудистые заболевания (ССЗ) остаются основной причиной смертности и заболеваемости во всем мире, на их долю приходится почтитреть смертей1, и причиной пожизненной инвалидности, которая наносит высокие финансовые издержки системам здравоохранения1. Среди ССЗ ишемическая болезнь сердца и инсульт в первую очередь вызваны атеросклеротическими бляшками. Атеросклероз является многофакторным заболеванием; Тем не менее, общим признаком является раннее повреждение эндотелиальных клеток сосудов, которое приводит к формированию, прогрессированию и возможным осложнениям атеросклероза. Интактный эндотелий сосудов обладает основными сосудопротекторными свойствами2. Эндотелий регулирует проницаемость сосудов, контролируя транслокацию клеток и молекул между системным кровотоком и стенкой сосуда; контролирует сосудистый тонус, уравновешивая выработку сосудорасширяющих средств (например, оксида азота, простациклина) и сосудосуживающих средств (например, эндотелина-1, ангиотензина II); А также обладает антикоагулянтными свойствами. Тем не менее, как функция, так и проницаемость эндотелиальных клеток могут ухудшаться в присутствии сердечно-сосудистых факторов риска (например, курение, высокий уровень холестерина, диабет, системное воспаление, окислительный стресс) и в результате гемодинамики кровотока. Дисфункциональный эндотелий снижает вазодилатацию в ответ на стрессоры, что приводит к увеличению артериальной жесткости. Кроме того, проницаемый/негерметичный эндотелий имеет расширенные узкие щелевые соединения между соседними клетками 3,4,5,6,7. Такое изменение происходит как на эндотелии просвета, так и на новообразованных микрососудах бляшек, которые кажутся хрупкими, негерметичными и дисморфическими8. Проницаемые эндотелиальные клетки действуют как точки входа для молекул и клеток, переносимых плазмой, что усугубляет риск сердечно-сосудистых заболеваний.
Основываясь на этих знаниях, за последние 15 лет проницаемость и функция эндотелия стали многообещающей визуализирующей и терапевтической мишенью для лучшей диагностики пациентов с риском сердечно-сосудистых заболеваний и оценки эффектов известных или новых лекарств. Однако прямая и количественная визуализация функции эндотелия ограничена 9,10,11,12. В настоящее время большая часть интерпретации функции эндотелия in vivo основана на исследованиях эндотелиально-зависимой дилатации (ящур) в периферических сосудах, функция которых умеренно коррелирует с нагрузкой атеросклероза в сосудистом русле, вызывающей клинические события 13,14,15. Только ограниченное число визуализирующих исследований показало прямую связь между эндотелиальной дисфункцией и бременем атеросклероза in vivo 9,10,11,12. И наоборот, более доступные подходы, основанные на МРТ, позволили более широко визуализировать эндотелиальную проницаемость. Использование показателя процентного усиления сигнала стенки сосуда после введения МРТ препаратов гадолиния позволило получить полуколичественное измерение проницаемости эндотелия16,17. Позже, разработка протоколов динамического контрастирования (DCE) позволила улучшить и количественно измерить проницаемость эндотелия сосудов. Количественные параметры, такие как скорость экстравазации контраста (Ktrans) и микрососудистый объем (Vρ), полученные с помощью кинетического моделирования или площадь под кривой (AUC), восходящий наклон, время до пика и пиковая концентрация, полученные с помощью немоделируемых методов, коррелируют не только с проницаемостью эндотелия, но и с васкуляризацией бляшек 18,19,20. Тем не менее, применение сосудистой ДКЭ остается сложной задачей, несмотря на значительные технические достижения, поскольку: (i) для точного определения границ стенки сосуда требуется как высокое пространственное (0,5-0,7мм2), так и временноеразрешение21. Отбор проб концентрации контрастного вещества в крови для расчета артериальной входной функции также требует кинетического моделирования, что приводит к компромиссу либо ограничение анатомического покрытия22,23 для получения временного разрешения, либо наоборот24,25; (ii) для анализа данных может потребоваться сложное фармакокинетическое моделирование (например, Патлак против Тофтса); (iii) обеспечивает ограниченное качество изображения, плохую воспроизводимость сканирования и повторного сканирования, а также среднюю вариабельность между наблюдателями и внутри наблюдателя26,27. Таким образом, по-прежнему существует потребность в воспроизводимых и простых подходах для извлечения прямых и поддающихся количественной оценке данных о проницаемости и (дис)функции эндотелия из отдельных визуализирующих исследований, которые могли бы иметь большую клиническую полезность.
Здесь мы разработали неинвазивную, простую в реализации количественную МРТ для получения и анализа изображений, которая позволяет проводить прямую количественную оценку двух маркеров повреждения эндотелия артерий (негерметичность/проницаемость и дисфункция) с использованием доклинических моделей атеросклероза за одно сканирование. Метод получил название Quantitative MRI of EndoThelial peRmeabIlity and dysfunCtion (qMETRIC). Он включает в себя приобретение протоколов позднего гадолиниевого усиления (LGE) и модифицированного Look-Locker Inversion Recovery (MOLLI) T1 для количественной оценки утечки эндотелия после введения внутрисосудистого альбуминсвязывающего зонда; и получение анатомических и количественных последовательностей кровотока для измерения эндотелиальной дисфункции в ответ на болюс ацетилхолина. Мы продемонстрировали, что qMETRIC точно определяет: тяжесть атеросклероза и риск осложнений; реакция на лечение; и может быть адаптирован для применения у пациентов 5,6,7. Важно отметить, что описанный здесь метод позволяет получать изображения с высоким пространственным разрешением, что позволяет точно сегментировать стенку сосуда, минимизировать смещение между наблюдателями и повысить надежность и воспроизводимость при большом анатомическом охвате. Наконец, этот метод может быть адаптирован для использования на различных сканерах и может быть расширен для визуализации различных артериальных русел (даже коронарных артерий28). Простой рабочий процесс делает этот подход более доступным для сообщества специалистов по сердечно-сосудистой визуализации.
протокол
Все компоненты этого исследования были проведены в соответствии с Законом Великобритании о животных (научные процедуры) 1986 года и с одобрения Группы этической экспертизы Королевского колледжа Лондона.
Экспериментальный рабочий процесс кратко представлен на рисунке 1.
1. Подготовка животных
- Вызывайте атеросклероз, кормя мышей ApoE-/- диетой с высоким содержанием жиров, содержащей 21% жира из сала и 0,15% (масс./масса) холестерина в среднем в течение 12 недель.
- Загрузите инсулиновый шприц с иглой 29 г с нужным объемом контрастного вещества (гадофосвесет трисордиум) для достижения дозы 0,03 ммоль/кг. Держите объем впрыска в пределах 50-150 μл.
- Поместите клетку на грелку, установленную на 37 °C, чтобы предварительно нагреть животное и поддерживать температуру тела.
- Вызовите анестезию, поместив мышь в индукционную коробку, выстланную абсорбирующими салфетками. Отрегулируйте расходомер на 3%-5% изофлурана при 1 л/минО2 в течение примерно 3-5 минут.
ПРИМЕЧАНИЕ: Обеспечьте правильную глубину анестезии, определив замедляющуюся частоту дыхания, которая должна уменьшиться до менее чем 70 вдохов в минуту (уд/мин). - Подтвердите анестезию методом защемления пальца ноги (т.е. потеря рефлекса отмены до защемления пальца ноги). Переложите животное в держатель и вставьте его нос в носовой конус. Поместите держатель на грелку, чтобы поддерживать температуру тела животного.
- Поддерживайте анестезию, вводимую через нос, установив поток воздуха для анестезии в держателе на 1%-2% изофлурана при 1 л/минO2.
- Нанесите ветеринарную мазь на глаза животного, чтобы предотвратить сухость во время пребывания под анестезией.
- Поместите животное либо лежа, либо на бок и очистите хвост спиртовым тампоном. Найдите одну из двух хвостовых вен. При необходимости прогрейте хвост ультрафиолетовой лампой, чтобы сделать прожилки хвоста более заметными.
- Введите иглу инсулина 29 г параллельно вене скосом иглы вверх. Аккуратно введите объем предварительно заполненного шприца, содержащего гадофосвесет трисотрий. Следите за тем, чтобы в месте инъекции не было кровотечения после извлечения иглы.
- Подождите 30 с, пока гадофосвесет начнет циркулировать, а затем перенесите мышь на ложе для МРТ.
2. Подготовка МРТ-сканера (см. рисунок 1)
- Накройте стол МРТ абсорбирующими салфетками.
- Поместите одноконтурный приемник МРТ на станину для МРТ. Используйте платформу для поднятия приемной катушки и избегайте прямого контакта между приемной катушкой и столом МРТ.
- Закрепите катушку на платформе с помощью хирургической ленты.
- Поместите и закрепите трубку, подключенную к циркуляционному нагревательному насосу, вокруг катушки и установите ее на 37 °C для поддержания температуры тела животного во время визуализации.
- Поместите трубку для подачи анестезии в отверстие МРТ-сканера и заклейте ее скотчем так, чтобы носовой конус достигал кончика катушки-приемника, где будет размещена голова животного.
- Включите встроенную камеру, чтобы наблюдать за животным из консольной комнаты.
- В консольной комнате МРТ используйте интерфейс программного обеспечения, чтобы начать новое исследование животного (пациента).
3. Позиционирование животного в МРТ-сканере и мониторинг (см. рисунок 2)
- Перенесите животное, находящееся под наркозом, в комнату для сканирования. Поместите мышь в положение лежа на катушке приемника и убедитесь, что ее морда входит в носовой конус для поддержания анестезии. Увеличьте поток воздуха для анестезии до 1%-1,5% изофлурана при 1 л/минО2.
- Убедитесь, что животное находится на катушке МРТ так, чтобы его области сердца и шеи располагались в центре приемной катушки.
- Закрепите нос мыши в носовом конусе, брюшную полость и хвост мыши на платформе с помощью скотча.
- Поместите четыре электрода на переднюю и заднюю лапы, убедившись, что ладони пальцев ног полностью открыты для записи электрокардиограммы (ЭКГ). Используйте проводящий гель для ЭКГ на лапах мыши перед прикреплением подушечек ЭКГ для улучшения проводимости.
- Убедитесь, что электроды надежно прикреплены к платформе с помощью ленты.
- Совмещение лазера ложа сканера с основанием (проксимальным концом) сердца; Используйте линию ключицы и передней лапы в качестве ориентира. Расположите животное в изоцентре магнита с помощью автоматического стола МРТ.
4. Планирование и получение изображений МРТ
- Запустите сканирование скаута, чтобы выполнить стандартные калибровки для системы МРТ.
- Настройте оборудование для мониторинга на обнаружение R-зубца ЭКГ. Отрегулируйте пороговые значения для каждой мыши и во время сеансов визуализации, чтобы обеспечить надежное срабатывание.
ПРИМЕЧАНИЕ: Частота сердечных сокращений мыши под глубокой анестезией обычно колеблется в пределах 400-600 ударов в минуту (уд/мин). - Получите 3D-градиентное эхо-сканирование (GRE) для получения мультипланарных пилотных изображений (скаут-изображений) для планирования остальных сканирований (см. Таблицу 1 для параметров получения данных МРТ и Рисунок 3 для планирования).
- Определите сердце на изображениях разведчика, особенно на корональном снимке, проще всего по артефактам потока.
ПРИМЕЧАНИЕ: Если на изображениях видно, что мышь недостаточно хорошо отцентрирована над катушкой или изоцентром, втяните стол и повторите позиционирование. - Запланируйте 3D-сканирование МР-ангиографии (МРА) с контрастированием (см. Таблицу 1 для сканирования для получения данных МРТ и Рисунок 3 для планирования) в поперечной плоскости, проходящей от основания сердца к шее и сонным артериям с полем зрения (FOV) 8 мм.
- Используйте изображения проекции максимальной интенсивности (MIP) для визуализации дуги аорты, брахиоцефальных и сонных артерий и планирования последующего позднего гадолиниевого усиления (LGE), картирования Т1 и сканирования кино (см. Рисунок 3 для репрезентативных изображений).
ПРИМЕЧАНИЕ: Если уровень объема визуализации неправильный, повторите получение, перемещая срезы проксимально или дистально. - Получение изображений МРТ для измерения проницаемости эндотелия.
- Используйте полученные ранее изображения MIP и поперечной МРА, чтобы спланировать сбор данных с помощью одного среза 2D-Look-Locker (LL) перпендикулярно восходящей аорте или сонным артериям (см. Таблицу 1 для сканирования для параметров сбора данных МРТ и Рисунок 3 для репрезентативных изображений).
- Установите частоту сердечных сокращений на 60 уд/мин при использовании имитируемого сигнала ЭКГ или установите период гашения, чтобы гарантировать, что импульс восстановления инверсии между последующими импульсами восстановления инверсии составляет 1000 мс при использовании записанного сигнала ЭКГ.
- Используйте изображения Look-Locker для определения оптимального времени инверсии (TI) для обнуления сигнала крови, необходимого для сканирования LGE.
- Визуализация ЛГЭ: Через 20-30 минут после введения гадофосвесета и сразу после сканирования ЛЛ (описано в шагах 4.7.1-4.7.3) получите сканирование ЛГЭ с использованием 3D быстрой градиентной эхо-последовательности с восстановлением инверсии-восстановления (см. Таблицу 1 для параметров регистрации МРТ и Рисунок 3 для репрезентативных изображений).
- Запланируйте поперечное 3D-сканирование с быстрым градиентным эхо ЛГЭ, чтобы охватить основание сердца (включая часть корня аорты), брахиоцефальную артерию (между корнем аорты и подключичной бифуркацией) и часть сонных артерий с полем зрения 8 мм в направлении стопа-голова с использованием той же геометрии, что и для МРА выше (см. Рисунок 3 для репрезентативных изображений).
- Установите частоту сердечных сокращений на 60 уд/мин при использовании симулированного сигнала ЭКГ или установите период гашения, чтобы гарантировать, что последовательные импульсы восстановления инверсии происходят каждые 1000 мс при сканировании LGE при использовании записанного сигнала ЭКГ (как для шага 4.7.2 выше).
ПРИМЕЧАНИЕ: Это важно для последовательного и независимого от частоты сердечных сокращений восстановления намагниченности между последовательными импульсами восстановления инверсии. - Вставьте T1, полученный из Look-Locker, в последовательность LGE в разделе Контраст > Задержка инверсии.
- Картографирование T1: Используйте быстрое 3D-сканирование градиентного эха для получения изображений поперечного T1 через 45 минут после введения гадофосвесета. Спланируйте последовательность в той же ориентации и геометрии, что и при сканировании LGE выше (см. Таблицу 1 для параметров получения данных МРТ и Рисунок 3 для репрезентативных изображений).
- Установите частоту сердечных сокращений на 120 уд/мин при использовании моделируемой ЭКГ или установите период гашения, чтобы гарантировать, что импульс восстановления инверсии между двумя последовательностями изображений происходит каждые 500 мс при использовании записанной кривой ЭКГ.
ПРИМЕЧАНИЕ: В последовательности картирования T1 используются два неселективных инверсионных импульса с временем инверсии от 20 до 2000 мс, за которыми следуют восемь сегментированных считываний для восьми отдельных изображений. Комбинация двух следов изображения приводит к получению в общей сложности шестнадцати изображений на срез с различным временем инверсии. Изображения автоматически реконструируются на сканере с использованием трехпараметрической модели соответствия. Уравнения, используемые для создания параметрических карт T1:
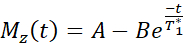
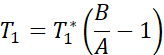
- Получение изображений МРТ для измерения функции эндотелия
- Приготовьте раствор разведенного ацетилхолина в физрастворе. Загрузите в инсулиновый шприц с иглой 29 г нужное для достижения объема раствора (16,6 мг/кг). Держите объем впрыска в пределах 50-150 μл.
- Используя поперечную МРА и соответствующие изображения MIP, поместите поперечный срез поперек брахиоцефальной артерии, между корнем аорты и подключичной бифуркацией (Рисунок 3 для репрезентативных изображений).
- Используйте поперечное 2D градиентное эхо (GRE) с ретроспективным стробированием ЭКГ для получения киноизображений брахиоцефальной артерии с временным разрешением (см. Таблицу 1 для параметров получения данных МРТ , Рисунок 3 для репрезентативных изображений).
- Отрегулируйте количество максимальных сердечных фаз в соответствии с частотой сердечных сокращений каждого животного.
ПРИМЕЧАНИЕ: Как правило, 14 сердечных фаз обеспечивают достаточное временное разрешение. - После получения исходных изображений войдите в комнату МРТ-сканера. Пока мышь находится под наркозом в сканере, аккуратно введите ацетилхолин внутрибрюшинно (IP). Не перемещайте мышь на катушке.
- Подождите 6-10 минут, чтобы частота сердечных сокращений стабилизировалась, и повторите сбор.
- В конце процедуры визуализации верните мышь в клетку и положите клетку на грелку для восстановления.
ПРИМЕЧАНИЕ: Мыши выздоравливают, когда они приходят в сознание, достаточное для поддержания лежачего положения на грудине. - Экспортируйте полученные изображения в формат цифровой визуализации и связи в медицине (DICOM) и используйте программное обеспечение для анализа изображений на открытой платформе.
5. Сегментация МРТ и анализ данных (см. Рисунок 4)
- Перетащите файлы Dicom в базу данных программного обеспечения с открытой платформой, чтобы загрузить все изображения.
- Используйте изображения LGE для визуализации поглощения контраста в стенке сосуда и расчета площади усиления в качестве суррогатного маркера утечки эндотелиальных клеток.
- Выберите сканирование MRA и сканирование для восстановления после инверсии. Нажмите клавишу Enter , чтобы загрузить эти изображения рядом друг с другом. Нажмите на маленький значок рядом с названием сканирования и перетащите изображения MRA на изображения LGE.
- Выберите опцию Повторная выборка , чтобы повторно срезать изображения MRA с использованием изображений LGE в качестве эталона для учета различий в толщине среза.
- Нажмите на маленький значок рядом с названием сканирования. Перетащите изображения LGE на изображения MRA (как в шаге 5.4 выше). В меню выберите «Слияние изображений », чтобы наложить изображения LGE и MRA.
- На панели инструментов нажмите « Просмотрщик 2D», а затем выберите «Панель 3D-положения». Используйте кнопки для ручной коррекции сдвигов в плоскости, чтобы учесть возможные небольшие смещения из-за дыхания животных.
- Используйте инструмент «Замкнутый многоугольник », расположенный на панели инструментов, чтобы вручную сегментировать визуально улучшенный сегмент стенки судна. Используйте совместно зарегистрированные изображения MRA и LGE для сегментации.
- Сегментируйте все изображения ЛГЭ, которые охватывают брахиоцефальную артерию.
ПРИМЕЧАНИЕ: Если усиление стенки сосуда имеет размытый или пятнистый вид, сегментируйте их по отдельности в каждом ломтике. - Нажмите кнопку «Плагины» на панели инструментов и выберите «Инструменты ROI», а затем «Экспорт ROI», чтобы экспортировать сегментированную область (мм2) для каждой области интереса (ROI) в электронной таблице.
- Суммируйте площадь каждого среза, чтобы рассчитать общую площадь увеличения в брахиоцефальной артерии в таблице.
Примечание: Общая площадь усиления может быть использована в качестве количественного маркера проницаемости эндотелия. - Используйте карты Т1, которые автоматически генерируются на компьютере МРТ-сканера, чтобы рассчитать среднее значение Т1 стенки сосуда, которое отражает величину поглощения гадофосвесета в стенке сосуда – это еще один количественный маркер проницаемости эндотелия.
- Загрузите изображения карт MRA и T1 и следуйте описанному выше подходу, аналогичному описанному выше (шаги 5.3-5.9), чтобы сегментировать стенку судна и извлечь значения T1 (мс).
- В таблице инвертируйте значения T1 и умножьте их на 1000, чтобы рассчитать время релаксации R1 = 1/T1 в секундах. Рассчитайте среднее значение R1 для всех срезов, покрывающих брахиоцефальную артерию у каждого животного.
- Загрузите изображения фазово-контрастной ангиографии и карты скоростей для расчета изменения площади сосуда и скорости кровотока, соответственно, в течение сердечного цикла.
- Сегментируйте изображения, полученные до и после инъекции ацетилхолина, чтобы рассчитать эндотелиально-зависимую вазореактивность, суррогатный маркер эндотелиальной (дис)функции.
- Используйте полуавтоматический инструмент «Увеличить область», доступный на вкладке ROI, или используйте опцию «Замкнутый полигон », доступную на панели инструментов (как описано в шаге 5.7), чтобы сегментировать область просвета (мм2) брахиоцефальной артерии на ангиографических изображениях.
ПРИМЕЧАНИЕ: Полуавтоматический инструмент использует пороговое значение пикселей для кластеризации пикселей, охватывающих бассейн крови, на основе интенсивности их сигнала. - Используйте инструмент Замкнутый полигон для сегментации соответствующих закодированных карт скорости кровотока для вычисления скорости кровотока (см/с).
- Экспортируйте площадь просвета (мм2) и скорость кровотока (см/с) в электронную таблицу (как описано в шаге 5.9) и определите те, которые соответствуют конечной диастолической (максимальная площадь) и конечной систолической (минимальная площадь) сердечным фазам.
- Используйте таблицу для расчета эндотелий-зависимой вазодилатации (рассчитайте процентное изменение площади конечного диастолического просвета (ЭД) и скорости кровотока до и после инъекции ацетилхолина). Используйте следующие формулы:
изменение площади=
изменение потока=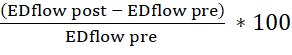
- Для каждого животного сведите в таблицу соответствующие данные, полученные из изображений LGE, карт T1 и теста на ацетилхолин в статистическом программном обеспечении для анализа.
Результаты
В данной работе было продемонстрировано применение метода Quantitative MRI для измерения EndoThelial peRmeabIlity и (dys)funCtion (qMETRIC) в брахиоцефальной артерии атеросклеротических мышей ApoE-/-. Этот метод позволяет получить прямые и количественные данные о двух маркерах повреждения эндотелия - проницаемости и (дис)функции, которые могут быть извлечены из сканирования стенки сосуда in vivo, полученного в течение одного сеанса визуализации. Во-первых, LGE используются для измерения площади увеличения стенки сосуда (mm3), а карты T1 (или R1) используются для количественной оценки скорости релаксации стенки сосуда (s-1) после введения гадофосвесета, оба являются суррогатными маркерами проницаемости (репрезентативные результаты см. на рисунке 5). Скорость релаксации R1 стенки сосуда варьировала от 2,42 с-1 ± 0,35 с-1 до 3,45 с-1 ± 0,54 с-1 до 3,83 с-1 ± 0,52 с-1 при 4 неделях, 8 неделях и 12 неделях диеты с высоким содержанием жиров соответственно. И наоборот, мыши дикого типа (R1 = 2,15 ± 0,34 с-1) и обработанные статинами ApoE-/- (R1 = 3,0 ± 0,65 с-1) показали меньший прогресс. У мышей с высоким содержанием жиров ApoE-/-, которых кормили пищей с высоким содержанием жиров в течение 12 месяцев, исследование показало с помощью гистологического анализа, красителя Evans Blue и электронной микроскопии, что увеличивается проницаемость эндотелия во время прогрессирования атеросклероза, что согласуется с увеличением объема стенки сосуда LGE, повышенным изменением релакситивности R1 стенки сосуда и парадоксальной вазоконстрикцией после инъекции ацетилхолина.. И наоборот, статины и другие препараты, нацеленные на эндотелий, снижали проницаемость эндотелия и размер бляшек, что отражалось в меньшем объеме LGE, более низких значениях R1 5,7 и улучшении вазодилатации. Механически гадофосмесит обратимо связывается с сывороточным альбумином. Это приводит к 5-6-кратному увеличению релаксации Т1 зонда29, что делает его обнаруживаемым с помощью МРТ с высокой чувствительностью. Здесь исследование показывает, что связанное с альбумином поглощение зондом отражает утечку эндотелия, поскольку оно коррелирует с поглощением синего красителя Эвана - золотого стандарта ex vivo метода количественной оценки утечки эндотелия (Рисунок 5) - и более широкими узкими зазорными соединениями5. Во-вторых, продемонстрирован простой тест для измерения эндотелиальной (дис)функции в ответ на ацетилхолин. В контрольных сосудах ацетилхолин вызывает эндотелий-зависимое расслабление сосудов, что приводит к увеличению площади/объема артерий и кровотока. Для измерения эндотелиальной (дис)функции использовали ЭКГ-триггерные ангиографические изображения, полученные до и после введения ацетилхолина. В исследовании рассчитывают изменение конечной диастолической площади (или объема) просвета сосуда до и после введения ацетилхолина. Было обнаружено, что, в отличие от нормальных сосудов, которые вазодилатируются в ответ на ацетилхолин, атеросклеротические сосуды демонстрируют снижение эндотелиально-зависимой вазодилататорной функции, что проявляется либо в уменьшении площади (или объема) сосуда, либо даже в парадоксальном сужении сосудов (рис. 5). Интересно, что лечение статинами улучшило сосудорасширяющие свойства эндотелия13.
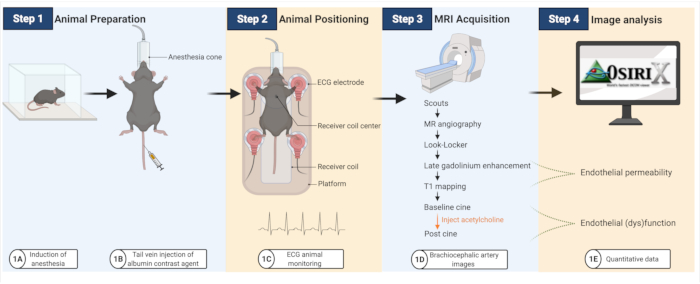
Рисунок 1: Рабочий процесс для визуализации эндотелиальной проницаемости и (дис)функции у атеросклеротических мышей. (А-Б) Мышам сначала делают анестезию, а затем вводят контрастное вещество альбумина. (C) Затем мышей переносят на катушку МРТ, где для мониторинга сердечной деятельности используются прокладки для ЭКГ. (Д-Э) Для количественной оценки проницаемости эндотелия и (дис)функции получаются изображения МРТ, которые затем анализируются с помощью программного обеспечения открытой платформы (созданного совместно с BioRender.com). Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
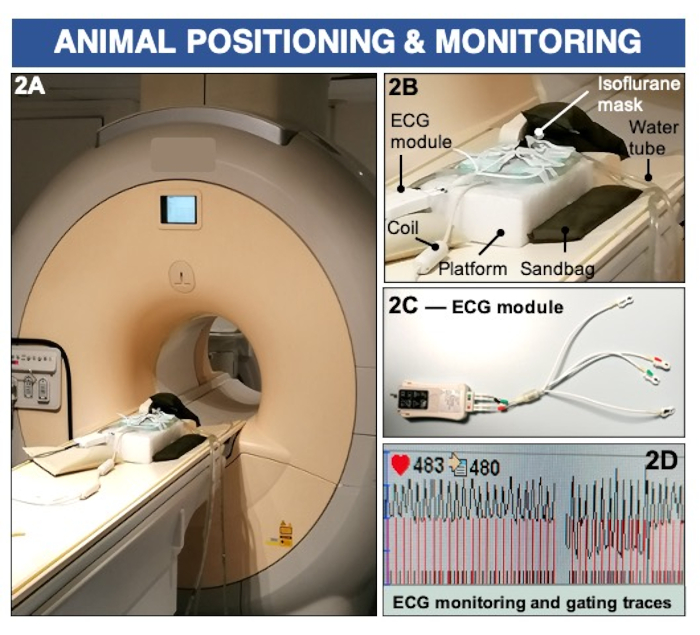
Рисунок 2: Позиционирование животных и мониторинг ЭКГ для визуализации проницаемости эндотелия и (дис)функции с помощью клинического МРТ-сканера мощностью 3 Тесла. (А-Б) Животное располагают лежа на поверхностной катушке и поддерживают под наркозом с помощью ингаляционного изофлурана. Мешки с песком используются для стабилизации платформы визуализации. (К-Д) Подушечки ЭКГ надеваются на лапы и подключаются к клиническому модулю ЭКГ для записи сердечной деятельности. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
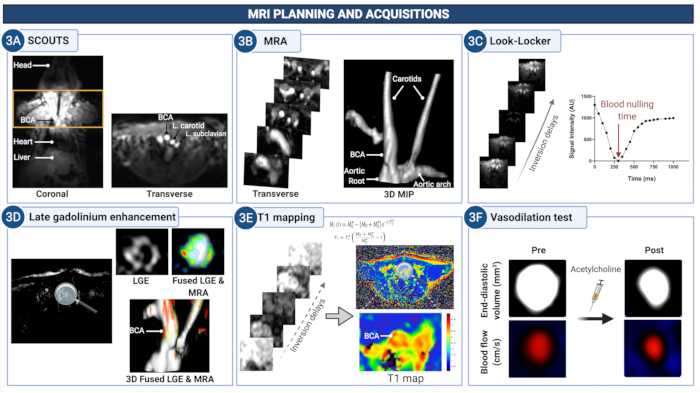
Рисунок 3: Планирование МРТ и получение изображений для количественной оценки проницаемости эндотелия и (дис)функции в брахиоцефальной артерии атеросклеротических мышей. (A) Скаут-изображения получены для идентификации анатомической области между корнем аорты и сонными артериями. (Б) МР-ангиограмма используется для визуализации сосудистой сети и планирования последующих сканирований. (C) Изображения Look-Locker получают на уровне брахиоцефальной артерии для определения подходящей временной задержки для обнуления сигнала из крови на последующих изображениях с усилением гадолиния (LGE). (D) Изображения LGE обеспечивают визуальную оценку улучшения стенок судна. (E) Картирование T1 используется для расчета скорости релаксации стенок сосуда, которая указывает на концентрацию гадолиния. (F) Эндотелий-зависимые сосудорасширяющие свойства стенки сосуда количественно оцениваются после введения ацетилхолина. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
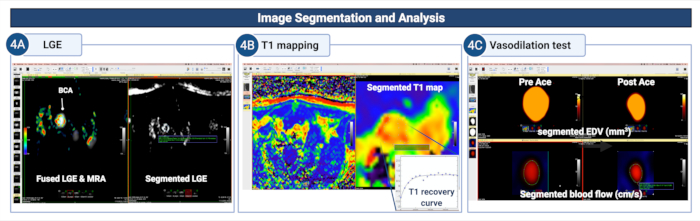
Рисунок 4: Сегментация и анализ изображений для количественной оценки проницаемости эндотелия и (дис)функции в брахиоцефальной артерии атеросклеротических мышей. (A) Стенка сосуда вручную сегментируется на изображениях LGE для количественной оценки площади/объема поглощения контраста. (B) Стенка сосуда сегментируется на карте Т1 для расчета скорости релаксации стенки сосуда Т1. (C) Сегментированная стенка сосуда на МР-ангиограммах и закодированных изображениях кровотока используется для изучения сосудорасширяющих свойств стенки сосуда путем расчета изменений в конечном итоге.
площадь (или объем) диастолического просвета и кровоток после введения ацетилхолина. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
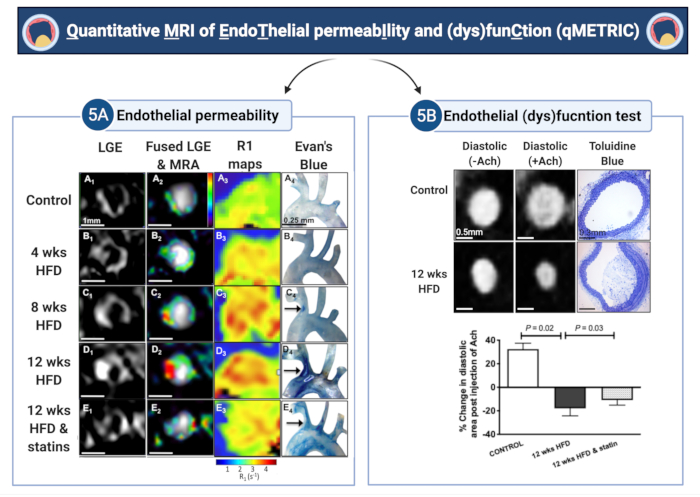
Рисунок 5: Количественная визуализация проницаемости эндотелия и (дис)функции (qMETRIC) у мышей с атеросклеротическим заболеванием. (A) Изображения LGE и карты релаксации R1 показывают повышенное поглощение альбумин-связывающего контрастного вещества в стенке сосуда во время прогрессирования атеросклероза и улучшение после лечения статинами. Данные визуализации подтверждаются накоплением синего красителя Эвана, альбуминсвязывающего красителя, ex vivo. (В) Изменения сосудорасширяющих свойств стенки сосуда в ответ на введение ацетилхолина позволяют количественно оценить эндотелиально-зависимую вазодилатацию. Сосуды контролируют сосуды, в то время как атеросклеротические сосуды сужаются в ответ на ацетилхолин, что указывает на повреждение эндотелия. Лечение статинами улучшает повреждение эндотелия. Термины «wks» и «HFD» на рисунке обозначают «недели» и «диета с высоким содержанием жиров» соответственно. Этот рисунок был изменен из Phinikaridou, A. et al.5. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
| Сканирование / Секвенирование | Параметры сбора данных | ||
| Сканирование разведчика / пилота | 3D, быстрое градиентное эхо Поперечная: поле зрения = 50 мм x 27 мм x 14 мм, матрица = 96 x 52, разрешение в плоскости = 0,5 мм x 0,5 мм, толщина среза = 0,5 мм, TR/TE = 15/6,1 мс, угол поворота = 30°, средние значения = 1 Корональный: поле зрения = 200 мм x 102 мм x 14 мм, матрица = 336 x 173, разрешение в плоскости = 0,5 мм x 0,5 мм, толщина среза = 0,5 мм, TR/TE = 12/6 мс, угол поворота = 30°, средние значения = 1 | ||
| МРТ | 3D быстрое градиентное эхо, поле зрения = 30 мм x 30 мм x 8 мм, матрица = 200 x 200, разрешение в плоскости = 0,15 мм x 0,15 мм, толщина среза = 0,5 мм, TR/TE = 15/6,1 мс, угол поворота = 40°, средние значения = 1 | ||
| Сканирование Look-Locker | 2D быстрое градиентное эхо, поле зрения = 30 мм x 30 мм, матрица = 80 x 80, разрешение в плоскости = 0,38 мм x 0,38 мм, толщина среза = 2 мм, TR/TE = 19/8,6 мс, TR между последующими ИК-импульсами = 1000 мс, угол поворота = 10°, средние значения = 1. | ||
| Сканирование LGE | 3D быстрое градиентное эхо, поле зрения = 30 мм x 30 мм x 8 мм, матрица = 304 x 304, разрешение в плоскости = 0,1 мм x 0,1 мм, измеренная толщина среза = 0,5 мм, срезы = 32, TR/TE = 28/8 мс, TR между последующими ИК-импульсами = 1000 мс, угол поворота = 30°, среднее значение = 1. | ||
| Сканирование картирования T1 | 3D быстрое градиентное эхо, поле зрения = 36 мм x 22 мм x 8 мм, матрица = 192 x 102, разрешение в плоскости = 0,18 мм x 0,22 мм, измеренная толщина среза = 0,5 мм, толщина среза = 16, TR/TE = 9,6/4,9 мс, угол поворота = 10°, средние значения = 1. | ||
| Фазово-контрастная ангиография | 2D, быстрое градиентное эхо, поле зрения = 40 мм x 23 мм, матрица = 132 x 77, разрешение в плоскости = 0,3 мм x 0,3 мм x 1 мм, TR/TE = 9,8/4,9 мс, угол поворота = 30°, сердечные фазы = 14, средние значения = 6, скорость потока (направление стопа-голова) = 30 см/с. | ||
ТАБЛИЦА 1: Параметры регистрации МРТ
Обсуждение
Определение здоровья эндотелия сосудов является привлекательным визуализирующим биомаркером, который потенциально может быть использован для диагностики атеросклеротического риска и мониторинга эффектов лечения. Описанный здесь протокол qMETRIC может быть использован для воспроизводимого количественного определения проницаемости/утечки эндотелия и (дис)функции в комплексном, быстром и клинически применимом протоколе МРТ. Такой подход может стать более простой альтернативой или дополнительным инструментом к существующим протоколам DCE-MRI для количественной оценки проницаемости эндотелия. Он также может стать неинвазивным инструментом для прямой оценки эндотелиальной (дис)функции в сосудистых руслах, таких как коронарные и сонные артерии, вместо использования инвазивных методов или суррогатных измерений в периферических артериях, которые менее серьезно поражены заболеванием. Измерение проницаемости эндотелия с помощью этого метода позволяет охватить аорту, дугу аорты, брахиоцефальную и сонную артерии с высоким пространственным разрешением (0,1 мм для изображений LGE и 0,22 мм для картирования T1), что имеет решающее значение для точной сегментации стенки сосуда у грызунов. Анализ изображений может быть проведен с использованием платформы с открытым исходным кодом и требует только простой сегментации стенки сосуда без необходимости сложного фармакокинетического моделирования. Важно отметить, что этот протокол может быть адаптирован для использования в ряде различных коммерчески доступных сканеров, а также может быть расширен для использования на различных моделях животных, а также на людях. Несмотря на то, что этот протокол описывает методологию с использованием клинического сканера, протоколы МРТ также могут быть реализованы при использовании высокопольных сканеров мелких животных. Эти сканеры часто предлагают протоколы восстановления инверсии, картирования T1 и ангиографии, которые могут быть использованы или запрограммированы в сотрудничестве с производителями сканеров.
Для получения точных и воспроизводимых результатов особое внимание следует уделить некоторым критическим этапам протокола. Во-первых, при визуализации мелких животных в клиническом сканере необходимы подходящие и изготовленные по индивидуальному заказу катушки приемника, чтобы максимизировать соотношение сигнал/шум для обеспечения высокого качества изображения. Расположение животного на катушке также имеет решающее значение, так как позволяет избежать разделения и заполненных воздухом пространств между животным и катушкой, чтобы улучшить соотношение сигнал/шум. По этой причине анатомические области интереса должны быть размещены в центре катушки, а затем перемещены в изоцентр магнита, чтобы подвергнуть их воздействию магнитного поля с максимальной однородностью. Во-вторых, стабильный, сильный и точный сигнал ЭКГ имеет первостепенное значение для надежного запуска визуализации. Это важно для последовательного возбуждения намагниченности и синхронизации окна получения изображения в определенные моменты времени, а также для получения точных изображений с временным разрешением, которые включают конечную диастолическую фазу для функционального испытания. Электроды на основе подушечек для мелких животных или иглы являются более подходящими вариантами при использовании в сканерах с более высокой напряженностью поля, которые лучше защищены по сравнению с клиническими сканерами. Когда эти варианты используются в клинических полевых сканерах, кабели ЭКГ должны быть деформированы вместе, чтобы избежать образования резонансных цепей на частоте МРТ Ламура, которые могут ухудшить сигнал ЭКГ во время последовательности импульсов. В качестве альтернативы мы предлагаем использовать модуль ЭКГ и прокладки, используемые для сканирования человека, с регулировкой размера подушечки в соответствии с размером мышиной лапы и дополнительной стабилизацией подушечек с помощью ленты для улучшения проводимости. В-третьих, при получении изображений ЛГЭ в то время, когда контрастное вещество все еще циркулирует в кровотоке, крайне важно выбрать правильное время обнуления, чтобы эффективно подавить пул крови для оконтуривания стенки сосуда. Последовательность Look-locker должна быть запущена перед каждой последовательностью LGE, и время задержки инверсии должно быть соответствующим образом скорректировано. В-четвертых, для точного и точного картирования Т1 с использованием модифицированной последовательности восстановления инверсии look-locker (MOLLI) предлагаемая схема получения изображений должна быть реализована таким образом, чтобы охватить диапазон задержек инверсии в диапазоне от 20 мс до 2000 мс для захвата коротких и длинных видов Т1. Наконец, сегментация данных МРТ должна быть строгой, и должны применяться строгие критерии, чтобы избежать смещения внутри и/или между наблюдателями при расчете площади/объема и значения Т1.
В отличие от ДКЭ-МРТ, описанная здесь процедура не предоставляет кинетических данных о промывке и вымывании контрастного вещества в стенке сосуда. Скорее, он обеспечивает моментальный снимок проницаемости эндотелия в определенный момент времени после инъекции альбуминсвязывающего контрастного вещества, гадофосвесета. Тем не менее, количественные данные, извлеченные из этих временных точек, сильно коррелировали с другими альбуминовыми красителями, такими как синий краситель Эвана, который считается золотым стандартом для измерения эндотелиальной проницаемости и увеличенной ширины эндотелиального щелевого соединения. С механистической точки зрения, как связанная с альбумином, так и несвязанная фракция гадофосвесет достаточно малы, чтобы проходить через разрывы в эндотелиальных соединениях и приводить к усилению сигнала МРТ. Кроме того, возможно, что несвязанная фракция может также связываться с внутрибляшечным альбумином после того, как он попадает в стенку сосуда и приводит к усилению сигнала. Было замечено, что релактивность стенки сосуда составляетr 1≈17 ммоль/л/с, когда гадофосвесет вводится в клинической дозе. Это значение ближе к значению, указанному для связанной с альбумином фракции (r1≈25 ммоль/л/с) по сравнению со свободной фракцией (r1≈6,6 ммоль/л/с)5,29.
Будущие применения этого метода визуализации включают фундаментальные научные исследования на различных животных моделях и других артериальных сегментах, а также использование этого метода для оценки биологических реакций на существующие или новые фармацевтические агенты. Исследования могут быть выполнены как в поперечном, так и в продольном направлении для сбора механистических данных и данных об исходах соответственно. Простой рабочий процесс делает этот подход доступным и клинически применимым для использования и у людей. Адаптация этого метода для визуализации сонных и периферических артерий человека является более неизбежной, но применение этого метода для визуализации коронарных артерий требует дальнейших достижений в получении изображений, реконструкции и коррекции движения, которые в настоящее время разрабатываются30,31.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Мы благодарны за финансирование: (1) Британскому фонду сердца (стипендия A.P для раннего развития карьеры, грант проекта PG/2019/34897 и гранты на проекты и программы R.M.B. PG/10/044/28343, RG/12/1/29262 И RG/20/1/34802); (2) Королевский центр передового опыта в области научных исследований BHF RE/18/2/34213; (3) Центр медицинской инженерии Wellcome EPSRC (NS/A000049/1); (4) Министерство здравоохранения через Национальный институт исследований в области здравоохранения (NIHR), Технологический кооператив в области сердечно-сосудистого здоровья (HTC) и Комплексный центр биомедицинских исследований, присужденный Guy's & St Thomas' NHS Foundation Trust в партнерстве с Королевским колледжем Лондона и больницей Королевского колледжа NHS Foundation Trust; (5) Чилийское агентство по исследованиям и разработкам (ANID) - Программа Научной инициативы тысячелетия - NCN17_129 и FONDECYT 1180525.
Материалы
| Name | Company | Catalog Number | Comments |
| Acetylcholine | Sigma Aldrich | A6625- 100G, 16.6 mg/kg | |
| Anesthesia equipment | General Anesthetic Services | General Anesthetic Services | |
| Circulating heating pump | ThermoFisher Scientific, USA | BOM: 152510101 | |
| ECG conductive gel (Nuprep) | Waever and Company, USA | 10-30-T | |
| ECG monitoring module | Invivo, USA | REF 0700-1002 | |
| Gadofosveset trisordium (Vasovist/ Ablavar) | Lantheus Medical Imaging Inc, North Billerica, MA, USA | 0.03 mmol/kg | |
| High fat diet | Special Diets Services, Witham, UK | 21% fat from lard, 0.15% (wt/wt) cholesterol | |
| Induction box | Vet Tech Solutions LTD | ||
| Insulin syringes | BD Biosciences | 0.5 mL, 29 G | |
| OsirixX software | OsiriX Foundation, Geneva, Switzerland | Open-source platform | |
| Philips Achieva MRI Scanner (3 Tesla) | Philips Healthcare, Best, The Netherlands | Equipped with a clinical gradient system (30 mT m-1, 200 mT m-1 ms-1) | |
| Single–loop surface microscopy receiver coil | Phillips Hamburg | Diameter = 23 mm | Custom built |
Ссылки
- Lloyd-Jones, D. M., et al. Defining and setting national goals for cardiovascular health promotion and disease reduction: The American heart association's strategic impact goal through 2020 and beyond. Circulation. 121 (4), 586-613 (2010).
- Davignon, J., Ganz, P. Role of endothelial dysfunction in atherosclerosis. Circulation. 109 (23), Suppl 1 27-32 (2004).
- Ludmer, P. L., et al. Paradoxical vasoconstriction induced by acetylcholine in atherosclerotic coronary arteries. New England Journal of Medicine. 315 (17), 1046-1051 (1986).
- Crauwels, H. M., Van Hove, C. E., Holvoet, P., Herman, A. G., Bult, H. Plaque-associated endothelial dysfunction in apolipoprotein E-deficient mice on a regular diet. Effect of human apolipoprotein AI. Cardiovascular Research. 59 (1), 189-199 (2003).
- Phinikaridou, A., et al. Non-invasive magnetic resonance imaging evaluation of endothelial permeability in murine atherosclerosis using an albumin-binding contrast agent. Circulation. 126 (6), 707-719 (2012).
- Phinikaridou, A., et al. Increased vascular permeability measured with an albumin-binding magnetic resonance contrast agent is a surrogate marker of rupture-prone atherosclerotic plaque. Circulation; Cardiovascular Imaging. 9 (12), (2016).
- Phinikaridou, A., Andia, M. E., Passacquale, G., Ferro, A., Botnar, R. M. Noninvasive MRI monitoring of the effect of interventions on endothelial permeability in murine atherosclerosis using an albumin-binding contrast agent. Journal of the American Heart Association. 2 (5), 000402(2013).
- Sluimer, J. C., et al. Thin-walled microvessels in human coronary atherosclerotic plaques show incomplete endothelial junctions relevance of compromised structural integrity for intraplaque microvascular leakage. Journal of the American College of Cardiology. 53 (17), 1517-1527 (2009).
- Rubenfire, M., Cao, N., Smith, D. E., Mosca, L. Carotid artery reactivity to isometric hand grip exercise identifies persons at risk and with coronary disease. Atherosclerosis. 160 (1), 241-248 (2002).
- Nguyen, P. K., Meyer, C., Engvall, J., Yang, P., McConnell, M. V. Non-invasive assessment of coronary vasodilation using cardiovascular magnetic resonance in patients at high risk for coronary artery disease. Journal of Cardiovascular Magnetic Resonance. 10, 28(2008).
- Terashima, M., et al. Impaired coronary vasodilation by magnetic resonance angiography is associated with advanced coronary artery calcification. Journal of the American College of Cardiology; Cardiovascular Imaging. 1 (2), 167-173 (2008).
- Hays, A. G., et al. Non-invasive visualization of coronary artery endothelial function in healthy subjects and in patients with coronary artery disease. Journal of the American College of Cardiology. 56 (20), 1657-1665 (2010).
- Hirooka, Y., et al. Effect of L-arginine on acetylcholine-induced endothelium-dependent vasodilation differs between the coronary and forearm vasculatures in humans. Journal of the American College of Cardiology. 24 (4), 948-955 (1994).
- Takase, B., et al. Endothelium-dependent flow-mediated vasodilation in coronary and brachial arteries in suspected coronary artery disease. American Journal of Cardiology. 82 (12), 1535-1539 (1998).
- Al-Badri, A., Kim, J. H., Liu, C., Mehta, P. K., Quyyumi, A. A. Peripheral microvascular function reflects coronary vascular function. Arteriosclerosis Thrombosis and Vascular Biology. 39 (7), 1492-1500 (2019).
- Calcagno, C., et al. Detection of neovessels in atherosclerotic plaques of rabbits using dynamic contrast enhanced MRI and 18F-FDG PET. Arteriosclerosis Thrombosis and Vascular Biology. 28 (7), 1311-1317 (2008).
- Lobbes, M. B., et al. Atherosclerosis: contrast-enhanced MR imaging of vessel wall in rabbit model--comparison of gadofosveset and gadopentetate dimeglumine. Radiology. 250 (3), 682-691 (2009).
- Kerwin, W. S., Oikawa, M., Yuan, C., Jarvik, G. P., Hatsukami, T. S. MR imaging of adventitial vasa vasorum in carotid atherosclerosis. Magnetic Resonance Medicine. 59 (3), 507-514 (2008).
- van Hoof, R. H., et al. Vessel wall and adventitial DCE-MRI parameters demonstrate similar correlations with carotid plaque microvasculature on histology. Journal of Magnetic Resonance Imaging. 46 (4), 1053-1059 (2017).
- Calcagno, C., Mani, V., Ramachandran, S., Fayad, Z. A. Dynamic contrast enhanced (DCE) magnetic resonance imaging (MRI) of atherosclerotic plaque angiogenesis. Angiogenesis. 13 (2), 87-99 (2010).
- van Wijk, D. F., et al. Increasing spatial resolution of 3T MRI scanning improves reproducibility of carotid arterial wall dimension measurements. Magnetic Resonance Materials in Physics, Biology, and Medicine. 27 (3), 219-226 (2014).
- Li, B., et al. Turbo fast three-dimensional carotid artery black-blood MRI by combining three-dimensional MERGE sequence with compressed sensing. Magnetic Resonance Medicine. 70 (5), 1347-1352 (2013).
- Fan, Z., et al. Carotid arterial wall MRI at 3T using 3D variable-flip-angle turbo spin-echo (TSE) with flow-sensitive dephasing (FSD). Journal of Magnetic Resonance Imaging. 31 (3), 645-654 (2010).
- Li, X., Huang, W., Rooney, W. D. Signal-to-noise ratio, contrast-to-noise ratio and pharmacokinetic modeling considerations in dynamic contrast-enhanced magnetic resonance imaging. Magnetic Resonance Imaging. 30 (9), 1313-1322 (2012).
- Heisen, M., et al. The influence of temporal resolution in determining pharmacokinetic parameters from DCE-MRI data. Magnetic Resonance Medicine. 63 (3), 811-816 (2010).
- Chen, H., et al. Scan-rescan reproducibility of quantitative assessment of inflammatory carotid atherosclerotic plaque using dynamic contrast-enhanced 3T CMR in a multi-center study. Journal of Cardiovascular Magnetic Resonance. 16, 51(2014).
- Calcagno, C., Vucic, E., Mani, V., Goldschlager, G., Fayad, Z. A. Reproducibility of black blood dynamic contrast-enhanced magnetic resonance imaging in aortic plaques of atherosclerotic rabbits. Journal of Magnetic Resonance Imaging. 32 (1), 191-198 (2010).
- Engel, L. C., et al. Non-invasive imaging of endothelial damage in patients with different HbA1c levels: A proof-of-concept study. Diabetes. 68 (2), 387-394 (2019).
- Caravan, P., et al. The interaction of MS-325 with human serum albumin and its effect on proton relaxation rates. Journal of the American Chemical Society. 124 (12), 3152-3162 (2002).
- Munoz, C., et al. Motion-corrected 3D whole-heart water-fat high-resolution late gadolinium enhancement cardiovascular magnetic resonance imaging. Journal of Cardiovascular Magnetic Resonance. 22 (1), 53(2020).
- Milotta, G., et al. 3D whole-heart isotropic-resolution motion-compensated joint T1 /T2 mapping and water/fat imaging. Magnetic Resonance Medicine. 84 (6), 3009-3026 (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены