Method Article
Construcción e implementación de matrices de microelectrodos de fibra de carbono para grabaciones in vivo crónicas y agudas
En este artículo
Resumen
Este protocolo describe un procedimiento para construir matrices de microelectrodos de fibra de carbono para registros electrofisiológicos in vivo crónicos y agudos en ratones(Mus musculus)y hurones(Mustela putorius furo) de múltiples regiones cerebrales. Cada paso, después de la compra de fibras de carbono en bruto para la implantación de matrices de microelectrodos, se describe en detalle, con énfasis en la construcción de matrices de microelectrodos.
Resumen
Las matrices de electrodos multicanal ofrecen información sobre el cerebro en funcionamiento y sirven para dilucidar los procesos neuronales a nivel de una sola célula y circuito. El desarrollo de estas herramientas es crucial para comprender los comportamientos complejos y la cognición y para avanzar en las aplicaciones clínicas. Sin embargo, sigue siendo un desafío registrar densamente de las poblaciones celulares de manera estable y continua durante largos períodos de tiempo. Muchos electrodos populares, como los tetrodos y las matrices de silicio, presentan grandes diámetros cruzados que producen daño al insertarse y provocan respuestas tisulares reactivas crónicas asociadas con la muerte neuronal, lo que dificulta el registro de una actividad neuronal estable y continua. Además, la mayoría de los haces de cables exhiben un amplio espaciado entre canales, lo que impide la grabación simultánea de un gran número de células agrupadas en un área pequeña. Las matrices de microelectrodos de fibra de carbono descritas en este protocolo ofrecen una solución accesible a estas preocupaciones. El estudio proporciona un método detallado para fabricar matrices de microelectrodos de fibra de carbono que se pueden utilizar tanto para registros agudos como crónicos in vivo. Las propiedades físicas de estos electrodos los hacen ideales para grabaciones estables y continuas a largo plazo a altas densidades celulares, lo que permite al investigador realizar grabaciones robustas e inequívocas de unidades individuales a lo largo de meses.
Introducción
Los electrodos y las matrices de electrodos son herramientas valiosas para comprender cómo el cerebro procesa la información a nivel neuronal. Si bien los registros electrofisiológicos han sido alcanzables durante más de dos siglos1, todavía no es posible medir simultáneamente la actividad de circuitos neuronales completos a la resolución espacial y temporal requerida para capturar el pico de neuronas individuales. Aunque los métodos no invasivos, como la electroencefalografía2,la topografía de emisión de positrones3y la resonancia magnética funcional4 permiten mediciones de todo el cerebro, no pueden lograr la resolución espacial y temporal necesaria para resolver la actividad de los circuitos neuronales2,5. Por el contrario, los métodos de imagen como las imágenes ópticas que utilizan colorantes sensibles al voltaje o los indicadores de calcio codificados genéticamente pueden lograr una resolución espacial de una sola unidad, pero plantean problemas como la baja resolución temporal y la mala selectividad3,4,5,6. Las grabaciones eléctricas son una poderosa alternativa a estos métodos. Los electrodos de grabación proporcionan una resolución temporal sin precedentes y permiten al usuario realizar mediciones con precisión de tiempo de pico en cualquier región del cerebro7. Además, las matrices multielectrodos implantadas crónicamente (MEA) permiten registros a gran escala (decenas a cientos de células) de una sola célula en animales que se comportan durante un período de días ameses 8,9. Sin embargo, las sondas de silicio que registran a densidades más altas tienen una gran huella y son altamente invasivas, y las matrices implantadas crónicamente a menudo generan una respuesta de inflamación, encapsulación de tejidos y muerte neuronal10,11,12,13.
Las limitaciones de los electrodos existentes han dado lugar a innovaciones recientes que permiten grabaciones estables, de alta resolución y a largo plazo. Los electrodos típicos consisten en un conductor metálico, como tungsteno o platino-iridio, o son a base de silicio o polímero. Si bien las matrices de microcables a base de metal pueden mantener grabaciones estables a largo plazo, tienen una huella mucho mayor, con un diámetro de un solo cable que oscila entre 10 y 200 μm14. Por el contrario, las matrices de electrodos basadas en silicio producen grabaciones con alta resolución espacial, pero debido a su diseño relativamente rígido, generalmente no pueden mantener la señal y grabar desde las mismas neuronas durante muchosmeses 15. Los desarrollos recientes en matrices basadas en silicio han dado como resultado electrodos que pueden realizar grabaciones crónicas de manera confiable, pero estas matrices no se pueden usar para grabar desde regiones cerebrales profundas en animales más grandes y están destinadas a grabaciones lineales9. Los avances en las matrices de polímeros han dado como resultado una mayor flexibilidad y estabilidad de registro de unidades individuales y ofrecen el potencial de grabaciones de alta densidad en un futuro próximo, pero con una disponibilidad limitada en la actualidad8,16,17. Las fibras de carbono permiten grabaciones de alta densidad con materiales listos para usar que se describen aquí.
Los microelectrodos de grabación de fibra de carbono se han utilizado durante décadas, con los primeros electrodos de fibra de carbono que consisten en una sola fibra de carbono insertada en una micropipeta de vidrio. Estos microelectrodos se utilizaron para grabaciones extracelulares de una sola unidad, y aunque la relación señal-ruido era comparable a los mejores microelectrodos de tungsteno en vidrio, eran ventajosos debido a su flexibilidad, valores de impedancia más bajos y simplicidad para fabricar18,19. Los esfuerzos para desarrollar matrices de electrodos de fibra de carbono se han acelerado recientemente debido a las capacidades de biodetección de las fibras de carbono. Además de su mayor biocompatibilidad y conductividad eléctrica excepcional, cuentan con un conjunto único de propiedades, que incluyen resistencia a altas temperaturas, baja densidad relativa, alta resistencia a la tracción, baja rigidez a la flexión, alta sensibilidad de detección y una pequeña área de sección transversal10,12. Todas estas propiedades han motivado el desarrollo de matrices de microelectrodos de fibra de carbono (CFEA) que facilitan los registros crónicos, estables y de alto rendimiento de neuronas individuales. Tales CFEA ahora se pueden elaborar a mano20, 21(Figura 1),produciendo matrices de microelectrodos que pueden contener neuronas individuales durante meses. Aquí se describe un proceso de construcción accesible para los CFEA que se ha adaptado de dos maneras para registros agudos y crónicos de neuronas individuales en dos especies.
Protocolo
Todos los procedimientos experimentales fueron aprobados por la Universidad de Brandeis o el Comité de Cuidado y Uso de Animales de la Universidad de Washington. Los datos mostrados fueron recolectados de un hurón hembra y un ratón macho.
1. Preparación de fibras de carbono y herramientas
- Preparación de fibras de carbono comerciales
- Corte tiras de 8 cm del haz de fibra del tamaño de epoxi. Coloque las tiras paralelas en un crisol y hornee en un horno a 400 ° C durante 6 h para eliminar el epoxi de las fibras comerciales. Luego, guarde las fibras horneadas en una placa de Petri estándar o en un tubo cónico.
NOTA: Se utilizaron fibras con un diámetro de 7 μm. Otros grupos han utilizado fibras de 4 μm20,21. - Prepare casetes para sostener fibras individuales. Utilice una impresora 3D o un cortador láser para crear los casetes y el soporte de casete asociado (consulte la Figura 2).
- Cargue las fibras en los casetes. Comience colocando un trozo de cinta adhesiva de doble cara en los dos lados largos del cassette, alineando el borde de la cinta con el borde interior del cassette. Separe las fibras individuales del paquete horneado y colóquelas paralelas con el lado corto del cassette, manteniendo 2-3 mm entre las fibras. Asegúrese de colocar 20-30 fibras en cada cassette. Selle las fibras en su lugar colocando cinta transparente sobre la cinta de doble adherencia. Coloque los casetes llenos en el soporte del cassette.
NOTA: Para un constructor experimentado, llenar un casete de fibras tomará ~ 1 h. Para el constructor novato, este proceso probablemente tomará ~ 1.5-3 h. Hay diez casetes en una caja, y dos soportes de casete pueden caber en la cámara de deposición de parileno. - Cubra las fibras individuales con parileno C utilizando una cámara de deposición de vacío comercial. Se necesita una sola tirada para el recubrimiento. Mide 2,3 g de parileno por cada carrera. Dos soportes de casete caben en la cámara a la vez. El procedimiento de recubrimiento dura ~ 2 h por carrera.
NOTA: Una medida de 2,3 g de parileno C proporciona un recubrimiento aproximado de 1 μm. Las fibras recubiertas se pueden almacenar indefinidamente.
- Corte tiras de 8 cm del haz de fibra del tamaño de epoxi. Coloque las tiras paralelas en un crisol y hornee en un horno a 400 ° C durante 6 h para eliminar el epoxi de las fibras comerciales. Luego, guarde las fibras horneadas en una placa de Petri estándar o en un tubo cónico.
- Preparación de la herramienta de manipulación de fibra de carbono
- Envuelva un pequeño trozo de película adhesiva flexible alrededor de una aguja de 30 G, formando un punto afilado pero flexible con la película adhesiva.
NOTA: Envolver la punta de una aguja con parafilm, y estirar la parafilm al hacerlo, crea un efecto adhesivo suave que permite al usuario recoger y maniobrar fibras individuales.
- Envuelva un pequeño trozo de película adhesiva flexible alrededor de una aguja de 30 G, formando un punto afilado pero flexible con la película adhesiva.
2. Diseño y fabricación
- Seleccione el diseño de plantilla apropiado necesario en función de las especificaciones del electrodo que se construirá. Esto se basará en el número de canales necesarios, junto con cualquier adición de diseño.
NOTA: Jig se refiere al bloque impreso en 3D que proporciona un anclaje para electrodos y conexiones eléctricas. - Cree o modifique el diseño específico de la plantilla utilizando un software de diseño asistido por ordenador (CAD).
- Utilice una empresa de impresión 3D o el laboratorio de creación institucional para imprimir las plantillas utilizando una impresora 3D SLA de alta resolución.
3. Montaje de la matriz de microelectrodos de fibra de carbono (CFEA)
NOTA: Este paso toma ~ 2 h para un constructor experimentado y ~ 6 h para un constructor novato. Realice todos los pasos de ensamblaje de CFEA y los pasos de agrupación de fibra bajo un microscopio estéreo 10x. Montaje completo del CFEA en un entorno con un movimiento de aire mínimo, ya que esto puede perturbar el proceso de construcción.
- Elija la plantilla adecuada necesaria para construir el electrodo deseado.
- Usando cortadores de alambre de metal, corte dos piezas de alambre de tungsteno de diámetro 0.003 in (76.2 μm), aproximadamente 7 cm de longitud.
- Alimente cada cable a través del canal apropiado en el extremo del conector de la plantilla (GND y REF). Alimente lo suficiente hasta que los dos extremos tengan la misma longitud, y luego gírelos juntos para asegurarlos en la plantilla.
NOTA: Para el diseño agudo de 16 canales, asegúrese de que el alambre de metal encaje dentro de la cresta en la plantilla.- Aplique cemento dental curado con UV para asegurar el alambre. Asegúrese de no obtener ningún cemento dental dentro del canal abierto a través del cual se alimenta el cable.
NOTA: El usuario debe usar protección ocular con filtro UV durante todos los procedimientos relacionados con los rayos UV para prevenir posibles daños oculares. Muchas varitas de curado UV tienen filtros de visualización incorporados. - Usando la varita de curado UV, cure el cemento dental durante 20 s.
- Asegure la plantilla en la vise de joyería por uno de los brazos de la plantilla. Oriente la plantilla de modo que una de las caras laterales quede paralela al suelo.
- Oriente la plantilla y la visera bajo el microscopio para que el extremo del conector, la cuenca y la punta del embudo sean visibles. Oriente la plantilla de modo que el embudo apunte lejos del usuario y el extremo del conector esté orientado hacia el usuario.
- Reúna las herramientas de fibra de carbono y una aguja de punta afilada de 25 G.
- Coloque un casete con fibras recubiertas de parileno-C sobre una hoja de papel blanca, con cinta adhesiva hacia arriba para que las fibras no estén directamente sobre el papel.
- Use la aguja de 25 G para cortar una sola fibra de carbono del cassette. Haga esto deslizando la punta de la aguja contra el cassette donde emerge la fibra a eliminar.
- Si construye usando medias fibras, corte un extremo de la fibra como se describió anteriormente. Orienta la fibra para que quede recta, y usando la aguja, corta la fibra por la mitad cortando la fibra contra el papel. Para cortar la otra mitad, que todavía está conectada al cassette, sostenga la punta libre de la fibra con la herramienta de fibra de carbono que se hizo anteriormente, y luego use la aguja para cortar la fibra aún conectada al cassette como se describió anteriormente.
- Si construye con fibras completas, corte un extremo de la fibra como se describió anteriormente. Use la herramienta de fibra de carbono hecha previamente y sostenga el extremo libre de la fibra que se acaba de cortar. Con la aguja, corte el otro extremo de la fibra lejos del cassette.
- Recoge la fibra de carbono utilizando la herramienta de fibra de carbono fabricada anteriormente. Recoge la fibra para que un extremo tenga aproximadamente 1 cm de longitud de la herramienta.
- Use la herramienta de fibra de carbono con la fibra unida y alimente el extremo más corto de la fibra a través de la pieza del embudo desde el recipiente medio de la plantilla. Use un microscopio para visualizar.
- Continúe alimentando la fibra a través del embudo de la plantilla hasta que la mayor parte de la longitud de la fibra esté a través (ver Figura 3A).
- Alimente la parte posterior de la fibra a través de un canal disponible utilizando la herramienta de fibra de carbono fabricada anteriormente. Alimente la fibra a través de la parte posterior hasta que unos 5 mm de fibra sobresalgan de la parte posterior. Corte a medida si es necesario (ver Figura 3B).
NOTA: No alimente fibras en canales que contengan los cables metálicos.
- Llene el resto de los canales con fibras en un lado de la plantilla, siguiendo las instrucciones dadas anteriormente.
NOTA: Al alimentar fibras en el embudo, alimente la mitad de las fibras en cada división del embudo, con la mitad derecha de los canales en la división derecha y la mitad izquierda de los canales en la división izquierda. Cuando las fibras están en contacto cercano dentro del embudo, hay una fricción desfavorable entre las fibras que conduce a que las fibras existentes se suelten o se rompan mientras se alimentan nuevas fibras en la plantilla. Esta división en cuatro secciones proporciona cierto alivio, ya que las fibras se mantienen en haces más pequeños hasta un paso posterior. - Use un encendedor de rueda de chispa estándar y pase rápidamente la llama sobre las fibras expuestas en el extremo del conector. Asegúrese de que el aislamiento de todas las fibras se elimina en los extremos (ver Figura 3C).
NOTA: La porción de las fibras que fueron expuestas a la llama debe parecer ligeramente más delgada que el resto de la fibra. - Alimente la fibra flameada a través de la plantilla para que la porción de la fibra expuesta a la llama esté ahora dentro del canal. Asegúrese de que no sobresalgan fibras de la parte posterior de la plantilla (consulte la Figura 3D).
NOTA: Use la herramienta de fibra de carbono para agarrar la fibra desde el interior de la cuenca y alimentar la fibra flameada a través de la plantilla. No toque la porción de las fibras expuestas a la llama, ya que esta porción es más frágil. - Aplique cemento dental curado con UV a las fibras en el recipiente de la plantilla. Llenar toda la cuenca para cubrir las aberturas de los canales y la apertura del embudo (ver Figura 3E).
- Utiliza la luz UV y cura el cemento dental durante 20 s. Cure durante 20 s adicionales si el cemento dental no está completamente curado.
NOTA: Asegúrese de que el cemento dental no viaje dentro de los canales.
- Utiliza la luz UV y cura el cemento dental durante 20 s. Cure durante 20 s adicionales si el cemento dental no está completamente curado.
- Retire la plantilla de la visera, voltéela y asegure la plantilla en la visera como se había asegurado anteriormente. Asegúrese de que el lado que contiene las fibras ahora esté boca abajo.
- Rellene el lado vacío de la plantilla con fibras de carbono exactamente como se describió anteriormente.
- Una vez que todos los canales tengan fibras, y las fibras estén aseguradas con cemento dental, retire la plantilla de la visera y oriente la plantilla para que el embudo apunte hacia abajo. Asegure la plantilla en la visera para que el extremo del conector apunte hacia arriba.
- Reúna una aguja de punta afilada de 25 G, una jeringa de 1 ml, pintura conductora plateada, aplicadores con punta de algodón, diluyente de pintura, toallitas de pañuelos desechables y el conector apropiado para el cabezal.
NOTA: Asegúrese de que la pintura conductora de plata esté bien mezclada y sea una solución homogénea. No deje que la pintura se seque. - Extraiga 0,3 ml de pintura plateada en la jeringa de 1 ml y luego coloque la aguja de 25 G de punta afilada.
- Inserte cuidadosamente la aguja en un canal hasta que el cemento dental la detenga. Presione lentamente la jeringa mientras retira la aguja del canal para llenar el canal con pintura (consulte la Figura 3E).
- Limpie la pintura de la aguja y luego continúe hasta el siguiente canal.
- Llena todos los canales con pintura.
NOTA: Pueden ser necesarias pasadas adicionales a los canales a medida que la pintura se establece en los canales durante los primeros minutos.
- Llena todos los canales con pintura.
- Sumerja un aplicador con punta de algodón en el diluyente de pintura y luego limpie la base de la plantilla de cualquier pintura en la superficie. Unos pocos aplicadores con punta de algodón pueden ser necesarios para esto.
NOTA: Los aplicadores con punta de algodón no sumergidos en diluyente de pintura también pueden ser útiles para limpiar la plantilla. - Inserte el conector del cabezal en la orientación adecuada alineando los pines con los canales. Asegúrese de que el conector del cabezal esté sentado derecho en posición vertical y esté lo más al ras posible de la plantilla (consulte la Figura 3F).
- Deje que la plantilla se cure durante 24 h.
- Asegure el conector del cabezal a la plantilla con cemento dental curado por UV aplicando cemento dental a lo largo del borde donde el conector del cabezal se encuentra con la plantilla. Curado UV usando una luz UV durante 20 s.
- Aplique cemento dental curado con UV para asegurar el alambre. Asegúrese de no obtener ningún cemento dental dentro del canal abierto a través del cual se alimenta el cable.
4. Embalaje de paquete de fibra
NOTA: Se tarda aproximadamente 30 minutos en realizar este paso. Complete este paso para los electrodos utilizados en modelos animales con una capa gruesa de piamadre. Refuerce el haz de fibra para minimizar la flexión. En los procedimientos de ratón, este paso puede no ser necesario.
- Unir el haz de fibras en un solo eje utilizando tensión de agua. Use una pipeta de transferencia para pasar una gota de agua desde la punta del embudo hasta la punta del haz mientras el electrodo está asegurado en posición vertical en una visera.
- Comience con la aplicación de una capa de cemento dental de aproximadamente 1,5 mm de espesor alrededor del haz en la punta del embudo. Curar el cemento dental con 20 s de luz UV.
NOTA: Para las grabaciones corticales, no se necesita más embalaje. Para regiones cerebrales más profundas, asegure un tubo guía alrededor del haz. - Construcción del tubo guía e inserción del haz en el tubo guía
- Mida y corte la longitud deseada de los tubos de poliimida. Asegúrese de que la longitud de los tubos de poliimida deje 2 mm de puntas de fibra de carbono libres. Mide y corta un trozo de tubo metálico de 30 G 2 mm más corto que el tubo de poliimida. Utilice una herramienta rotativa para quitar los bordes afilados del tubo de metal. Inserte el tubo de poliimida dentro del tubo de metal.
- Coloque el electrodo en una visera con el haz de fibra de carbono apuntando hacia arriba. Asegure el tubo ensamblado a un micromanipulador y, con un microscopio, bájelo cuidadosamente sobre el haz de fibra. Asegure el tubo a la base de cemento dental existente utilizando una capa adicional de cemento dental. Curar el cemento dental con 20 s de luz UV.
NOTA: El proceso de construcción se puede pausar aquí.
5. Preparación de la punta del electrodo
NOTA: Se tarda aproximadamente 30 minutos por matriz en realizar este paso.
- Corte los electrodos a la longitud deseada.
- En preparación para cortar la punta del electrodo, apile notas adhesivas para construir una plataforma de aproximadamente 1,5 mm de altura. Mida, desde el borde de la plataforma, la longitud deseada del electrodo y marque esta distancia. La plataforma actuará como guía para el corte.
- Baje el electrodo en un vaso de precipitados de agua desionizada o destilada hasta que la punta del embudo esté completamente sumergida, primero la punta y se mantenga normal a la superficie. Junte las fibras de carbono individuales retirando el electrodo del agua. La tensión superficial unirá el paquete (s). Deje que el electrodo se seque al aire durante 30 min.
- Coloque la hoja de bisturí #10 en el mango. Congele el bisturí y el electrodo colocándolos en un congelador de -18 °C durante al menos 5 min.
- Coloque el electrodo de modo que las fibras queden al ras de la superficie de la guía (preparado en el paso 5.1.1). Corta las fibras a la longitud deseada con el bisturí, usando un movimiento de rodadura. Complete este paso rápidamente para asegurarse de que el electrodo y el bisturí aún estén congelados (consulte la Figura 3G).
- Inyecte corriente positiva para reducir la impedancia de las puntas de los electrodos.
- Conecte el electrodo al probador de impedancia multielectrodo utilizando el adaptador adecuado (consulte la Tabla de materiales). Punta del electrodo inferior ~ 2 mm en un tubo de microcentrífuga de solución salina tamponada con fosfato (PBS) de 0,1 M. Inserte el cable de conexión a tierra en el tubo de la microcentrífuga.
- Inyecte corriente con la amplitud y duración elegidas.
NOTA: Este paso está destinado a reducir los valores de impedancia en la punta del CFEA. En este estudio, se introdujeron los siguientes parámetros en la interfaz gráfica de usuario del software de galvanoplastia: Corriente: 0,100 μA; Duración: 10 s; Pausa: 1 s. Este proceso se puede repetir según sea necesario, por canal, hasta que las impedancias de los electrodos cumplan con los valores deseados (ver Figura 4C). - Una vez que los valores de impedancia sean los deseados, enjuague las fibras en agua desionizada o destilada para limpiar.
- Electroplaca en la solución de chapado en oro.
NOTA: Este paso debe realizarse poco antes de la implantación (el mismo día).
PRECAUCIÓN: Algunos de los productos químicos utilizados en la preparación de las puntas CFEA son corrosivos, incluida la solución de baño de oro. Consulte a la SDS antes de su uso y determine las medidas de precaución adecuadas a tomar para manejar la solución de manera segura.
NOTA: Para proporcionar rigidez al paquete de fibra, el usuario puede crear una solución de baño de oro solubilizando primero PEG8000 en agua desionizada o destilada a 1 mg / ml. Luego, combine la solución de recubrimiento de oro PEG8000 solubilizada de 625 μL y la solución de vórtice durante 10 s para mezclar. El PEG8000 se disolverá después de la inserción de fibras en el cerebro.- Baje la punta del haz de electrodos ~ 2 mm en el tubo de microcentrífuga de la mezcla de chapado. Inserte el cable de conexión a tierra en el tubo de la microcentrífuga.
- Establezca los parámetros apropiados para la galvanoplastia. En este estudio, se introdujeron los siguientes parámetros en la interfaz gráfica de usuario del software de galvanoplastia: Corriente: -0,05 μA; Duración: 30 s; Pausa: 5 s.
- Enjuague bien las fibras con agua desionizada o destilada. En este momento, mida los valores de impedancia nuevamente si lo desea.
6. Inserción en el cerebro: cirugía de supervivencia, ratón (Mus musculus) y cirugía de no supervivencia, hurón (Mustela putorius furo)
NOTA: Los procedimientos quirúrgicos deben seguir el protocolo estándar de conformidad con IACUC. Para obtener información detallada, véase Ma et al.22 para el protocolo de cirugía de supervivencia y Popovic et al.23 para el protocolo de cirugía de no supervivencia. Siga los procedimientos quirúrgicos asépticos según las pautas de ASC para la cirugía de supervivencia en especies de roedores. Estos incluyen el autoclave de todas las herramientas y materiales quirúrgicos a 135 ° C durante 15 min y el tratamiento del aparato estereotáxico y el área quirúrgica con etanol al 70%. Use guantes quirúrgicos estériles, una bata desechable y una máscara facial durante el procedimiento.
- Cirugía de supervivencia, ratón (Mus musculus).
- Anestesiar a los ratones con 2.5% de isoflurano en una caja de inducción durante ~ 1 min, hasta que la frecuencia respiratoria alcance 55-65 respiraciones / min. Luego, administre isoflurano al 2.0% a través de un cono nasal para mantener la anestesia. Aplique ungüento veterinario en ambos ojos para prevenir el daño corneal. Realice un pellizco en el dedo del pie para verificar el grado adecuado de anestesia.
- Después de la verificación, siga los procedimientos de cirugía de supervivencia detallados en Ma et al.22. Controla la frecuencia respiratoria y mantenla a 60 respiraciones/min. Mantenga la temperatura corporal a 37 °C utilizando una almohadilla térmica controlada termostáticamente. Consulte los pasos 6.3-6.5 (detallados a continuación) para obtener instrucciones sobre cómo preparar el cráneo para la craneotomía, la durotomía y la implantación de electrodos.
- Después de la cirugía, devuelva a los ratones a una jaula de recuperación, equipada con una almohadilla térmica de 37 ° C, aislada de otros animales.
- Cubra las heridas quirúrgicas en la pomada antibiótica. Monitoree a los animales hasta que recuperen la conciencia suficiente para mantener la reclinación esternal y permitirles recuperarse durante un período de 2 a 5 días. Alojarlos individualmente y monitorear continuamente para detectar signos de infección o malestar. Administre a los animales una dosis de buprenorfina 72 h de liberación sostenida (0.5-1.0 mg / kg) el día de la cirugía como analgésico.
- Cirugía de no supervivencia, hurón (Mustela putorius furo)
- Anestesiar al hurón inicialmente con ketamina (20 mg/kg, i.m.), y luego ventilar con 1.0%-2.0% de isoflurano en una mezcla 2:1 de óxido nitroso y oxígeno a través de una máscara. Realice un pellizco en el dedo del pie para verificar el grado adecuado de anestesia.
- Después de la verificación, siga los procedimientos quirúrgicos de no supervivencia detallados en Popovic et al.23. Realizar una traqueostomía y ventilar a los animales con 1.0%-2.0% de isoflurano en una mezcla 2:1 de óxido nitroso y oxígeno. Aplique ungüento veterinario en ambos ojos para prevenir el daño corneal.
- Mantenga la temperatura corporal a 37 °C utilizando una almohadilla térmica controlada termostáticamente. Controle la frecuencia cardíaca, los niveles de CO2 al final de la marea y la frecuencia respiratoria. Mantenga la frecuencia respiratoria dentro del rango fisiológico apropiado (3.5% -4.0%). Consulte los pasos 6.3-6.5 (detallados a continuación) para obtener instrucciones sobre cómo preparar el cráneo para la craneotomía, la durotomía y la implantación de electrodos.
- Monitoree continuamente el ECG del animal para garantizar una anestesia adecuada y aumentar el porcentaje de isoflurano si el ECG indica alguna angustia.
- Al finalizar el experimento, administrar 1 ml de solución de pentobarbital sódico y fenitoína sódica al hurón y controlar hasta que la frecuencia cardíaca y el CO2 final de marea midan 0.
- Preparación del cráneo
- Usando una rebaba de taladro de 0,8 mm, perfore una sola craneotomía de 4 mm x 4 mm en el lugar deseado para la implantación. Para el ratón, perfore un orificio de rebaba adicional en un sitio contralateral para la inserción del tornillo de tierra de acero inoxidable.
NOTA: No realice una durotomía hasta que el electrodo esté listo para la implantación. - Establecer un terreno/referencia. En experimentos agudos con hurones, use una aguja de 18 G para perforar la piel y la capa de músculo que rodea el cráneo en el lado de la cabeza del animal opuesto a la craneotomía. Inserte el extremo del alambre del electrodo de referencia Ag/Cl en la punta de la aguja y luego retraiga la aguja del músculo/piel para que el gránulo ahora esté sentado de forma segura entre el músculo y el cráneo. En el mouse, envuelva el cable de tierra plateado alrededor del tornillo de conexión a tierra de acero inoxidable. Asegure con cemento dental curado UV.
- Conecte el electrodo al soporte del electrodo con una tira delgada de cinta de etiquetado y asegure el soporte del electrodo en el micromanipulador. Conecte el cable de tierra a una fuente de conexión a tierra a través de un clip de cocodrilo. Conecte el cable de referencia al electrodo de referencia incrustado en el músculo del animal.
- Usando una rebaba de taladro de 0,8 mm, perfore una sola craneotomía de 4 mm x 4 mm en el lugar deseado para la implantación. Para el ratón, perfore un orificio de rebaba adicional en un sitio contralateral para la inserción del tornillo de tierra de acero inoxidable.
- Durotomía y penetración de pia
- Retire la duramadre de la craneotomía con un pico de duramadre.
- Crea un pequeño agujero en la pia. Para hacer esto, inserte y retire un microelectrodo metálico (recomendado en el hurón). Alternativamente, baje el CFEA ortogonal a la superficie del cerebro para evitar cualquier vasculatura. Una vez que se determina esta ubicación, levante el electrodo y corte suavemente la superficie del cerebro en esa ubicación con una púa de duramadre, tirando hacia arriba con la púa (recomendada en el mouse).
- Implantación de electrodos
- Baje la punta del electrodo a la misma ubicación y, en modo fino, comience a conducir el electrodo hacia el cerebro a una velocidad de ~ 2 μm / s. Use un microscopio para asegurarse de que el electrodo entre suavemente y no se doble.
NOTA: Si el electrodo no está entrando suavemente, sáquelo del cerebro y reajuste el ángulo. Si continúa doblándose sin entrar suavemente, ajuste la ubicación y repita el proceso de cortar la superficie del cerebro para la nueva ubicación de entrada. - Realice la implantación crónica y aguda siguiendo los siguientes pasos.
- Para la implantación crónica: Cementar el electrodo en su lugar utilizando cemento dental curado por UV.
- Cierre la incisión con suturas quirúrgicas 5-0 y construya la tapa de la cabeza.
- Para construir un cubrecabezas, agregue cemento dental adicional alrededor del sitio del implante. Asegúrese de cubrir la nariz de la plantilla.
- Tire de la piel hacia arriba y alrededor de la tapa de la cabeza. Sutura la incisión detrás de la tapa de la cabeza con 5-0 suturas quirúrgicas.
- Aplique la crema de lidocaína y la pomada antibiótica.
- Suspenda el anestésico y siga los procedimientos de recuperación estándar.
- Para la implantación aguda: Después de bajar el electrodo y alcanzar la profundidad deseada, espere al menos 30 minutos antes de comenzar el registro electrofisiológico para permitir que el electrodo se asiente en su lugar.
- Para la implantación crónica: Cementar el electrodo en su lugar utilizando cemento dental curado por UV.
- Baje la punta del electrodo a la misma ubicación y, en modo fino, comience a conducir el electrodo hacia el cerebro a una velocidad de ~ 2 μm / s. Use un microscopio para asegurarse de que el electrodo entre suavemente y no se doble.
Resultados
Con la finalización de este protocolo, será posible realizar grabaciones estables de la actividad de aumento de una sola unidad. Estas matrices de microelectrodos son personalizables en material, recuento de canales y adaptador de cabecera en función de las necesidades del investigador. La galvanoplastia de fibras en oro da como resultado una disminución de las impedancias adecuadas para el registro(Figura 4 y Figura 5). Si el usuario tiene la intención de registrar crónicamente, las mediciones se pueden realizar después de que el animal se haya recuperado del procedimiento quirúrgico. Los procedimientos crónicos han dado como resultado registros estables de una sola unidad durante al menos 120 días. En la Figura 6se muestra un registro representativo que ilustra la actividad electrofisiológica estable de 64 canales en la corteza retroesplenial de un ratón macho adulto que se comporta libremente. Si se pretende una preparación aguda, las grabaciones pueden comenzar poco después de la implantación (~ 30 min). Esto dará tiempo para que el electrodo se asiente en el cerebro. La Figura 7 proporciona un ejemplo representativo de un registro agudo de AECA de 16 canales adquirido de la corteza visual primaria de un hurón hembra adulto. La clasificación de espigas en ratones y hurones se realizó con software de clasificación de espigas (ver Tabla de Materiales).
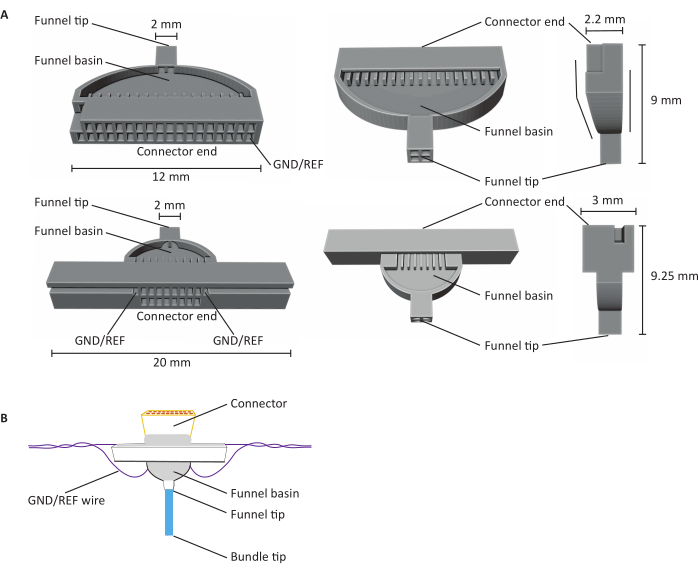
Figura 1: Anatomía de matrices de microelectrodos de fibra de carbono de 16 y 32 canales (CFEA). (A) Esquemas de CFEA de 32 canales (arriba) y 16 canales (abajo) desde tres puntos de vista diferentes. El CFEA de 16 canales presenta un diseño extendido para fines de manipulación. El diseño de 32 canales presenta una cara plana que permite combinar dos plantillas para un CFEA de 64 canales. Ambos diagramas tienen estructuras de identificación etiquetadas con dimensiones. El extremo del conector indica la ubicación de la inserción del conector, y los canales GND/REF indican dónde se inserta el cable de conexión a tierra. La cuenca del embudo se refiere a la ubicación por la que pasan las fibras para ser superpuestas con cemento dental curado con luz UV, y la punta del embudo significa el sitio desde donde las fibras salen de la plantilla. La punta del embudo se divide en cuadrantes para minimizar las fibras que se adhieren entre sí y crean daños. Las fibras se extraen más tarde en un solo haz con el uso del cemento dental. Las plantillas se imprimen en 3D utilizando impresoras de resina SLA. Los diagramas se amplían para mostrar detalles. B)CFEA construido. El diagrama tiene estructuras de identificación etiquetadas. La punta azul del haz representa el segmento de las fibras de carbono que adquieren mediciones de registro. El gris dentro de la cuenca del embudo y que rodea el conector es indicativo de cemento dental curado con luz UV que mantiene las fibras de carbono en su lugar en la cuenca del embudo y asegura el conector a la plantilla. El cable púrpura representa el cable de conexión a tierra. Haga clic aquí para ver una versión más grande de esta figura.
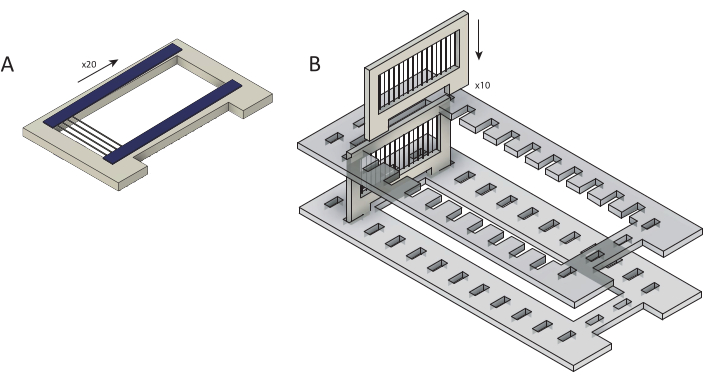
Figura 2: Carga de fibras de carbono en bruto en casetes para el recubrimiento de parileno C. (A) Las fibras de carbono se cargan en cartuchos superpuestos con dos tiras de cinta de doble cara (azul). Cada casete está cargado con ~25 fibras. (B) Los casetes se cargan en un soporte cortado con láser (gris) en preparación para el recubrimiento de parileno C. Cada uno contiene diez casetes. Haga clic aquí para ver una versión más grande de esta figura.
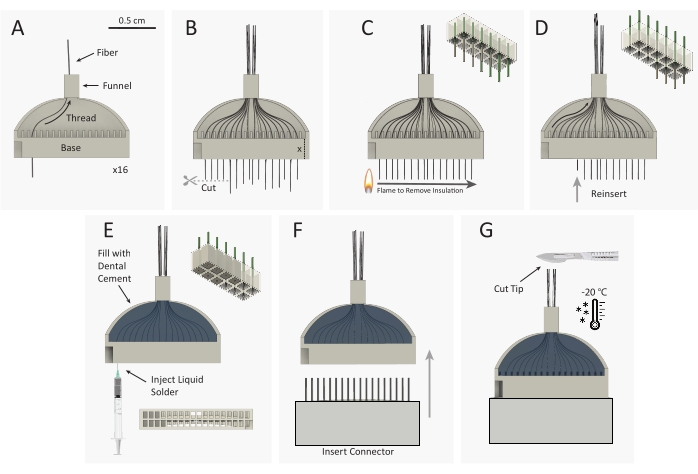
Figura 3: Esquema de construcción de paquetes de matriz de microelectrodos de fibra de carbono (CFEA). (A) 16 fibras de carbono individuales recubiertas (negro) se roscan a través de la plantilla impresa en 3D de 32 canales (gris). (B)Las puntas de fibra de carbono se cortan con micro-tijeras, dejando el exceso de fibra igual a la altura de la base de la plantilla, extendiéndose fuera de la base de la plantilla. (C)Un encendedor de rueda de chispa de plástico estándar se pasa rápidamente sobre el exceso de fibra para eliminar el aislamiento de parileno C. El esquema superior derecho muestra la eliminación de parileno de 9 de las 12 fibras. (D) Las fibras se reinsertan en la plantilla hasta que el extremo de la fibra está al ras de la base. El esquema superior derecho muestra la reinserción de 9 fibras con puntas de fibra sin aislamiento (gris) alojadas dentro de la base de la plantilla. Luego se da la vuelta a la plantilla y se repiten los pasos A-D para enhebrar los 16 canales opuestos. (E) La plantilla se rellena con cemento dental para asegurar las fibras. La impresión de plata se inyecta en cada pozo de la base de la plantilla. (F) El conector macho se inserta en la base de la plantilla. (G) El ACE CFA y el bisturí se congelan en un congelador de -20 °C. La punta de la matriz se corta a la longitud deseada, dejando 32 fibras pares. Haga clic aquí para ver una versión más grande de esta figura.
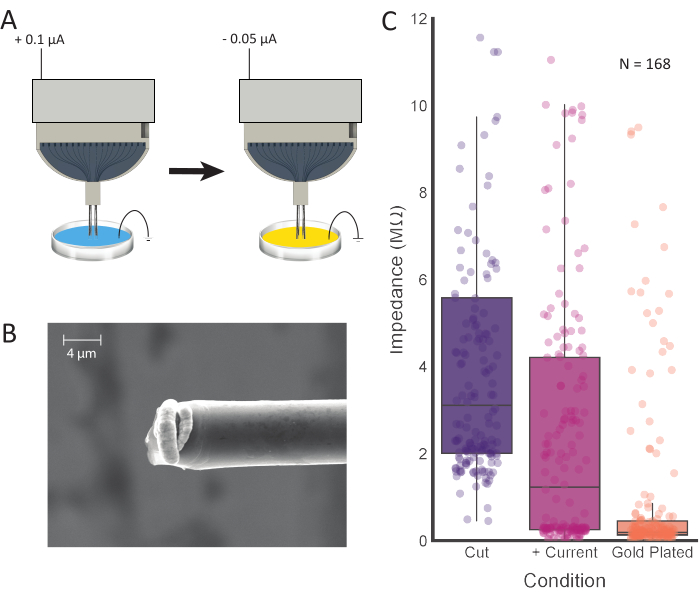
Figura 4: Tratamiento de puntas y galvanoplastia. (A) Las puntas de los electrodos se colocan primero en PBS de 0,1 M, donde la corriente pasa a través de cada electrodo. Las puntas se enjuagan y se transfieren a una solución de baño de oro, donde se galvanizan con la corriente. (B) Las imágenes SEM de fibra de carbono preparada muestran una solución de chapado en oro concentrada en la punta. La barra de escala representa 4 μm. (C) Los valores de impedancia de 168 canales después del corte inicial (púrpura; 3.11 MΩ ± 0.42 MΩ, mediana ± SE, n = 168 fibras), inyección de corriente positiva (rosa; 1.23 MΩ ± 0.36 MΩ, mediana ± SE, n = 168 fibras) y galvanoplastia (naranja; 0.19 MΩ ± 0.15 MΩ, mediana ± SE, n = 168 fibras) muestran valores de impedancia disminuidos después de cada paso de procesamiento. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Lasduraciones moderadas de galvanoplastia de oro producen depósitos pequeños y redondeados en las puntas de los haces de fibra de carbono. Las puntas de fibra de carbono que se muestran son todas de diferentes matrices de microelectrodos, lo que refleja diferentes duraciones de la corriente inyectada para la reducción de la impedancia o el baño de oro. Las imágenes también representan el revestimiento de parileno C, que aísla las fibras de carbono y evita cualquier adquisición de señal de una ubicación que no sea las puntas de las fibras. (A)Imagen de microscopía electrónica de barrido de puntas de fibra de carbono después de congelar y hacer un solo corte con una cuchilla de afeitar. Las barras de escala representan 10 μm. (B) Igual que A pero luego seguidas con inyección de corriente positiva durante 10 s. (C) Igual que B pero luego galvanizado con oro durante 5 s. (D) Igual que B pero luego galvanizado con oro durante 15 s. (E) Igual que B pero luego galvanizado con oro durante 30 s. (F) Igual que B pero luego galvanizado con oro durante 120 s. Encontramos que la galvanoplastia durante 30 s a una corriente de -0,05 μA fue óptima para los registros electrofisiológicos. Haga clic aquí para ver una versión más grande de esta figura.
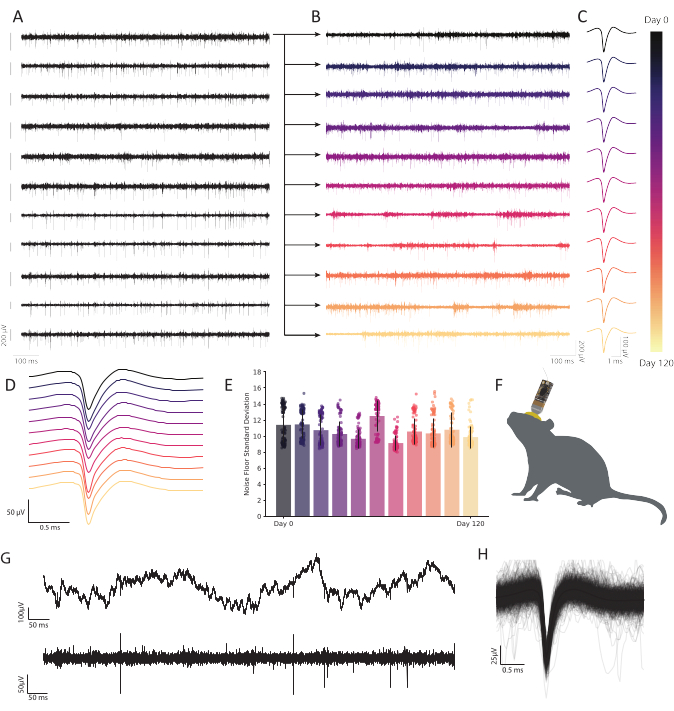
Figura 6: Las grabaciones extracelulares crónicas en la corteza retroesplenial del ratón que se comporta libremente con matrices de microelectrodos de fibra de carbono muestran una actividad neuronal persistente y estable. (A) Se registraron simultáneamente once trazas de voltaje de banda pasada. Las trazas posteriores registradas desde el primer canal (fila superior) se trazan en B para mostrar la durabilidad a través del tiempo. Las diez filas restantes demuestran la consistencia de la calidad de grabación y muestran una actividad robusta en toda la matriz. La barra de escala a la izquierda de cada traza representa un potencial de 200 μV. (B)Datos de banda cruzada de la misma fibra que en la traza superior en A, expandidos para mostrar una actividad robusta a lo largo de una grabación continua de 120 días. (C) La agrupación en clústeres revela una detección robusta de una sola unidad durante meses. Las trazas representan la forma de onda promedio de una unidad única representativa continuamente observable a lo largo de 120 días, extraída de la fibra trazada en B en cada punto de tiempo. (D) Media, formas de onda de pico no normalizadas de C apiladas para demostrar consistencia a lo largo del tiempo. (E) Las grabaciones de fibra de carbono demuestran un suelo de ruido estable durante muchos meses. La desviación estándar del piso de ruido (traza menos actividad de aumento) en B no muestra un cambio progresivo en el ruido. Las barras representan la contaminación media. Las barras de error representan la desviación estándar. (F) Dibujo a escala de un ratón con un CFEA implantado crónicamente y un estadio. (G) La traza de voltaje bruto (arriba) 11 meses después de la implantación muestra LFP robusta. La traza de voltaje por banda (abajo) muestra una actividad neuronal constante. (H) Forma de onda de pico medio de la neurona registrada en la fibra de C, subyacente por las primeras 1.000 incidencias de actividad de aumento. Haga clic aquí para ver una versión más grande de esta figura.

Figura 7:Grabaciones de la matriz de microelectrodos de fibra de carbono (CFEA) de la corteza visual primaria del hurón. (A) Formas de onda de unidades individuales clasificadas por picos registradas a partir de un CFEA de 16 canales. Los potenciales de acción de neuronas individuales a menudo eran evidentes en múltiples canales a amplitudes ligeramente diferentes. (B) Curvas de ajuste de dirección de neuronas seleccionadas. Los colores corresponden a unidades registradas en A. Las flechas indican la dirección del movimiento del estímulo. Las barras de escala indican la tasa de respuesta. Las barras de error indican la respuesta media con error estándar. La línea discontinua horizontal representa la velocidad de disparo espontáneo de la misma celda durante la exposición a una pantalla en blanco. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Este protocolo describe cada paso necesario para construir un ACG funcional tanto para uso agudo como crónico. El proceso descrito es personalizable a las necesidades del investigador, por lo que es una opción accesible y económica para monitorear neuronas individuales durante meses. El protocolo demuestra la viabilidad de registrar tanto la actividad robusta de una sola unidad a los pocos minutos de la implantación en un animal anestesiado, como a lo largo de cuatro meses en un animal despierto y de comportamiento, lo que ilustra el potencial de estos CFEA para estudiar los cambios a corto y largo plazo en las respuestas neuronales.
Los pasos del protocolo descritos han sido probados a fondo y mejorados con el tiempo para producir un procedimiento eficiente que se puede completar rápidamente, a un bajo costo marginal (< $ 100.00), con la capacidad de registrar unidades individuales inequívocas, densa y estable durante meses. Los pasos de construcción se pueden completar en menos de un día y producirán señales electrofisiológicas que son comparables a cualquier matriz comercial líder. Los CFEA también tienen una huella mucho más pequeña (el haz de fibras de 16 canales tiene un diámetro de ~ 26 μm) que las matrices comerciales similares, y su biocompatibilidad las hace adecuadas para el uso a largo plazo13. Es importante destacar que hay varios pasos e instrucciones críticas que deben seguirse para producir un CFEA funcional con un rendimiento comparable.
Debido a la fragilidad de las fibras de carbono, deben manejarse con el máximo cuidado. Manipularlos con pinzas afiladas u otras herramientas puede provocar la rotura de las fibras. Además, es importante construir los CFEA en un espacio con movimiento de aire limitado para que las fibras no se desvanezcan. Al quemar la parte posterior de las fibras, el encendedor solo necesita moverse en un movimiento de ida y vuelta muy brevemente, durante aproximadamente 1 s. Los pasos que siguen a esta eliminación del aislamiento son cruciales para construir un electrodo con canales de trabajo. Las puntas flameadas deben introducirse en la plantilla sin ningún contacto adicional. Luego, al llenar el lavabo con cemento dental, es importante que el cemento se aplique cuidadosamente y llene completamente los canales y el recipiente del embudo, cerrando las aberturas sin llenarlas. El cemento dental debe curarse completamente con luz UV antes de continuar. Una vez que esto se haya completado, se debe inyectar pintura plateada en cada canal hasta que esté completamente lleno, pero sin derramarse. Este es el paso más variable en el proceso. Cualquier llenado excesivo puede producir diafonía entre canales, y un llenado insuficiente puede provocar una falla en la conexión. Si no puede inyectar pintura plateada con una aguja de 25 G, es probable que la solución sea demasiado viscosa y, en este caso, se puede agregar una pequeña cantidad de diluyente de pintura para crear una solución más fluida. Una vez que se llenan todos los canales y se inserta el conector del cabezal, es importante permitir que la matriz se cure durante 24 h antes de asegurar el conector con cemento dental. Descubrimos que el hecho de no hacerlo redujo el número de canales conectados. La aplicación de una cantidad generosa de cemento dental también es importante para que el conector no se desconecte al interactuar con el sistema de adquisición de señal. Si se desprenden, es posible intentar la reconexión con el llenado repetido de canales con pintura plateada, pero el usuario debe probar los valores de impedancia del CFEA para evaluar el número de canales conectados. Permitir que el cemento dental se cure durante la noche también sirve para prevenir posibles desprendimientos.
La medición de la impedancia del electrodo proporcionará una estimación precisa de los canales conectados. Esto se puede hacer después de sumergir los cables de tierra y referencia y las puntas de fibra de carbono en PBS. Hemos observado que una alta impedancia (>15 MΩ) es indicativa de un canal abierto y no conectado. Antes de inyectar corriente y galvanoplastia, un canal conectado puede tener un rango de valores de impedancia que deberían disminuir significativamente con este proceso. El número promedio de canales conectados (impedancia < 4 MΩ después de la inyección de corriente) por electrodo de 16 canales fue de 12,96 ± 2,74 (promedio ± SD; N = 48 electrodos). Se probaron varios tiempos de galvanoplastia, y 30 s produjeron un aislamiento de señal superior entre los sitios de grabación(Figura 5). Si bien se ha establecido bien que PEDOT-pTS12,24,25,26 y PEDOT-TFB21 proporcionan opciones confiables para preparar sitios de grabación de fibra de carbono, encontramos que el chapado con oro, un método probado y confiable para galvanoplastia electrodos para implantación crónica27,28 , aumentó la facilidad de implantación y evitó que las puntas de los electrodos se aglutinaran. Al producir valores de impedancia final de menos de 0,2 MΩ en promedio, este método resulta comparable a los valores alcanzados utilizando PEDOT-TFB21 y PEDOT-pTS26.
Al implantar la matriz de microelectrodos, es importante seguir visualmente la inserción de las puntas de fibra de carbono bajo el microscopio. La inserción exitosa debe ser evidente, sin flexión de las fibras. Si las fibras parecen estar pandeándose, es poco probable que entren con éxito en el cerebro. En este caso, el ángulo de la sonda debe ajustarse para un segundo intento. Este proceso puede continuar hasta que la inserción de la sonda sea exitosa. Una vez que el electrodo está a la profundidad deseada, hemos encontrado que esperar al menos 30 minutos permitirá que la sonda se conforme con la adquisición óptima de la señal (grabaciones agudas).
Los CFEA descritos, además de su pequeña huella y biocompatibilidad, ofrecen una alternativa robusta y personalizable a las matrices comerciales debido a su facilidad de construcción y bajo costo. La mayor limitación a los CFEA detallados en este protocolo es su escalabilidad. Debido a la naturaleza manual de su construcción, escalar a diseños con cientos de sitios de grabación puede no ser práctico. Además, los avances en la fabricación de matrices de microelectrodos utilizando nanotecnología permitirán registros de población a mayor escala que los métodos descritos aquí. Sin embargo, este protocolo ofrece accesibilidad CFEA a los laboratorios interesados en la fabricación de electrodos de fibra de carbono. No observamos pérdida de estabilidad o disminución de la robustez en la amplitud del pico durante la duración de los experimentos crónicos de 120 días, como lo indica un canal único representativo típico de nuestras observaciones en esa escala de tiempo(Figura 6A-E). Además, los CFEA muestran la capacidad de actividad persistente de una sola unidad, ya que cuatro unidades individuales permanecieron discernibles 11 meses después de la implantación enratones (Figura 6G,H). También es posible obtener grabaciones estables de una sola unidad de forma aguda(Figura 7),lo que ofrece una ventaja sobre muchos otros electrodos comerciales para el estudio de neuronas individuales en períodos cortos de tiempo. En el futuro, el desarrollo de estas sondas flexibles y biocompatibles con diámetros mínimos permitirá el estudio de procesos complejos. Estas herramientas proporcionarán una utilidad sustancial en el avance de la tecnología neuronal, incluidas las aplicaciones en interfaces cerebro-máquina (IMC), que requieren estabilidad continua a largo plazo29.
Divulgaciones
Los autores declaran que no hay conflictos de intereses financieros.
Agradecimientos
Nos gustaría agradecer a Greg Guitchounts por su orientación con el diseño y la construcción de electrodos y a Tim Gardner por abrirnos su laboratorio e instalaciones. Nos gustaría agradecer a Christos Michas por su ayuda con el uso de PDS en las instalaciones centrales de Bio-Interface and Technology y a Neil Ritter, Jon Spyreas y David Landesman por su ayuda en el diseño de las primeras versiones de la plantilla de 16 canales. Nos gustaría agradecer a Tim Cavanaugh por su ayuda con las imágenes SEM en el Centro de Sistemas de Nanoescala de Harvard en Harvard.
Materiales
| Name | Company | Catalog Number | Comments |
| #10 scalpel blade | Fisher Scientific | 14-840-15 | Building tool |
| 16-channel CFEA Jig | Realize Inc. | CFMA component | |
| 16-channel Omnetics connector | Omnetics | A79014-001 | CFMA component |
| 25 G needle | Fisher Scientific | 14-840-84 | Building tool - sharp-tipped |
| 30 G needle | Fisher Scientific | 14-841-03 | Building tool |
| 31 G stainless steel 304 hypodermic round tubing | Small Parts Inc | B000FMYN38 | For guide tube |
| 32-channel CFEA jig | Realize Inc. | CFMA component | |
| 32-channel Omnetics connector | Omnetics | A79022-001 | CFMA component |
| 6 in cotton tip applicators | Fisher Scientific | 22-363-156 | Building tool |
| Acetone | Fisher Scientific | A16P4 | Building tool |
| AutoCad 3D printing software | Autodesk | Computer-aided design tool/ 3D modeling software | |
| Autodesk Fusion 360 | Autodesk | Computer-aided design tool/ 3D modeling software | |
| BD disposable syringes | Fisher Scientific | 14-823-30 | 1 mL |
| Carbon fibers | Good Fellow USA | C 005725 | 7 μm epoxy sized |
| Cassettes and cassette holder | For coating fibers | ||
| Clear tape | Scotch | For coating raw fibers | |
| Deionized water | Electroplating component | ||
| Double-sided tape | Scotch | For coating raw fibers | |
| Flowable Dental Composite | Pentron | Flow-It ALC | CFMA component/ UV cured dental cement |
| Gold plating solution | Sifco ASC | 5355 | 10.0-20.0% glycerol, 1.0-5.0% ethylenediamine, 1.0-5.0% acetic acid (ethylenedinitrilo)tetra-, dipotassium salt, 5.0-10.0% butanoic acid, mercapto-monogold(1+) sodium salt, 1.0–5.0% potassium metabisulfite, 55.0-82.0% water |
| Jewelry clamp | Amazon | B00GRABH9K | Building tool |
| JRClust | Ferret spike sorting software | ||
| Lighter | BIC | LCP62DC | Building tool |
| Micromanipulator | Scientifica | PS-7000C | For guide tube |
| Microscissors | Fisher Scientific | 08-953-1B | Building tool |
| MountainSort | Mouse spike sorting software | ||
| NanoZ 16-channel adapter | Multi-channel systems | ADPT-nanoZ-NN-16 | Electroplating component |
| NanoZ 32-channel adapter | White Matter | NZA-OMN-32 rev A | Electroplating component |
| NanoZ multi-electrode impedance tester | White Matter | Electroplating component | |
| Parafilm | Fisher Stockroom | 13-374-10 | Semi-transparent, flexible film with adhesive properties |
| Parylene 'C' Dimer | Specialty Coating Systems | 980130-C-01LBE | For coating raw fibers |
| PEG 8000 | Fisher Scientific | 25322-68-3 | Electroplating component |
| Phosphate-buffered saline | Electroplating component | ||
| Polyimide tubing | MicroLumen | BRAUNI001 | For guide tube |
| Rotary tool | Dremel | 300124 | For guide tube |
| Scalpel handle | Fine Science Tools | 10003-12 | Building tool |
| Silver conductive coating | MG Chemicals | 842AR Super Shield | CFMA component |
| Stereo microscope with range 6.7:1 | Motic | SMZ-168 | Building tool |
| Sticky notes | Post-it | Building tool | |
| Tissue wipes | Kimtech Science | 34155 | Building tool |
| Tungsten wire | A-M Systems | 797550 | CFMA component |
| UV curing wand | Woodpecker | Building tool | |
| Vacuum deposition chamber | Specialty Coating Systems | Labcoter 2 (PDS 2010) |
Referencias
- Galvani, L. De viribus electricitatis in motu musculari commentarius. , Academy of Sciences. Bologna. (1791).
- Buzsaki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nature reviews. Neuroscience. 13 (6), 407-420 (2012).
- Ledochowitsch, P., et al. On the correspondence of electrical and optical physiology in in vivo population-scale two-photon calcium imaging. bioRxiv. , 800102(2019).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Seymour, J. P., Wu, F., Wise, K. D., Yoon, E. State-of-the-art MEMS and microsystem tools for brain research. Microsystems and Nanoengineering. 3 (1), 16066(2017).
- Kerr, J. N., Denk, W. Imaging in vivo: watching the brain in action. Nature reviews. Neuroscience. 9 (3), 195-205 (2008).
- Hong, G., Lieber, C. M. Novel electrode technologies for neural recordings. Nature reviews. Neuroscience. 20 (6), 330-345 (2019).
- Chung, J. E., et al. High-density, long-lasting, and multi-region electrophysiological recordings using polymer electrode arrays. Neuron. 101 (1), 21-31 (2019).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551 (7679), 232-236 (2017).
- Kozai, T. D., Jaquins-Gerstl, A. S., Vazquez, A. L., Michael, A. C., Cui, X. T. Brain tissue responses to neural implants impact signal sensitivity and intervention strategies. ACS Chemical Neuroscience. 6 (1), 48-67 (2015).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Kozai, T. D., et al. Ultrasmall implantable composite microelectrodes with bioactive surfaces for chronic neural interfaces. Nature Materials. 11 (12), 1065-1073 (2012).
- Chen, R., Canales, A., Anikeeva, P. Neural recording and modulation technologies. Nature Reviews Materials. 2 (2), 16093(2017).
- Szostak, K. M., Grand, L., Constandinou, T. G. Neural interfaces for intracortical recording: requirements, fabrication methods, and characteristics. Frontiers in Neuroscience. 11, 665(2017).
- Subbaroyan, J., Martin, D. C., Kipke, D. R. A finite-element model of the mechanical effects of implantable microelectrodes in the cerebral cortex. Journal of Neural Engineering. 2 (4), 103-113 (2005).
- Park, S., et al. One-step optogenetics with multifunctional flexible polymer fibers. Nature Neuroscience. 20 (4), 612-619 (2017).
- Guo, Y., et al. Polymer composite with carbon nanofibers aligned during thermal drawing as a microelectrode for chronic neural interfaces. ACS Nano. 11 (7), 6574-6585 (2017).
- Armstrong-James, M., Millar, J. Carbon fibre microelectrodes. Journal of Neuroscience Methods. 1 (3), 279-287 (1979).
- Garris, P. A., Ciolkowski, E. L., Pastore, P., Wightman, R. M. Efflux of dopamine from the synaptic cleft in the nucleus accumbens of the rat brain. Journal of Neuroscience: The Official Journal of the Society of Neuroscience. 14 (10), 6084-6093 (1994).
- Guitchounts, G., Markowitz, J. E., Liberti, W. A., Gardner, T. J. A carbon-fiber electrode array for long-term neural recording. Journal of Neural Engineering. 10 (4), 046016(2013).
- Guitchounts, G., Cox, D. 64-channel carbon fiber electrode arrays for chronic electrophysiology. Scientific Reports. 10 (1), 3830(2020).
- Ma, Z., Turrigiano, G. G., Wessel, R., Hengen, K. B. Cortical circuit dynamics are homeostatically tuned to criticality in vivo. Neuron. 104 (4), 655-664 (2019).
- Popovic, M., et al. Development of cross-orientation suppression and size tuning and the role of experience. Journal of Neuroscience: The Official Journal of the Society of Neuroscience. 38 (11), 2656-2670 (2018).
- Patel, P. R., et al. Chronic in vivo stability assessment of carbon fiber microelectrode arrays. Journal of Neural Engineering. 13 (6), 066002(2016).
- Welle, E. J., et al. Ultra-small carbon fiber electrode recording site optimization and improved in vivo chronic recording yield. Journal of Neural Engineering. 17 (2), 026037(2020).
- Patel, P. R., et al. Insertion of linear 8.4 µm diameter 16 channel carbon fiber electrode arrays for single unit recordings. Journal of Neural Engineering. 12 (4), 046009(2015).
- Ferguson, J. E., Boldt, C., Redish, A. D. Creating low-impedance tetrodes by electroplating with additives. Sensors and Actuators. A, Physical. 156 (2), 388-393 (2009).
- Vafaiee, M., Vossoughi, M., Mohammadpour, R., Sasanpour, P. Gold-plated electrode with high scratch strength for electrophysiological recordings. Scientific Reports. 9 (1), 2985(2019).
- Lebedev, M. A., Nicolelis, M. A. Brain-machine interfaces: From basic science to neuroprostheses and neurorehabilitation. Physiological Reviews. 97 (2), 767-837 (2017).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados