Method Article
Konstruktion und Implementierung von Kohlefaser-Mikroelektroden-Arrays für chronische und akute In-vivo-Aufnahmen
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Dieses Protokoll beschreibt ein Verfahren zur Konstruktion von Kohlefaser-Mikroelektroden-Arrays für chronische und akute in vivo elektrophysiologische Aufnahmen in Maus (Mus musculus) und Frettchen (Mustela putorius furo) aus mehreren Hirnregionen. Jeder Schritt nach dem Kauf von Rohkohlenstofffasern zur Mikroelektroden-Array-Implantation wird detailliert beschrieben, wobei der Schwerpunkt auf der Konstruktion von Mikroelektroden-Arrays liegt.
Zusammenfassung
Mehrkanal-Elektrodenarrays bieten Einblick in das arbeitende Gehirn und dienen dazu, neuronale Prozesse auf Einzelzell- und Schaltkreisebene aufzuklären. Die Entwicklung dieser Werkzeuge ist entscheidend für das Verständnis komplexer Verhaltensweisen und Kognitionen sowie für die Weiterentwicklung klinischer Anwendungen. Es bleibt jedoch eine Herausforderung, aus Zellpopulationen stabil und kontinuierlich über lange Zeiträume dicht zu erfassen. Viele beliebte Elektroden, wie Tetroden und Silizium-Arrays, weisen große Kreuzdurchmesser auf, die beim Einsetzen Schäden verursachen und chronische reaktive Gewebereaktionen hervorrufen, die mit dem neuronalen Tod verbunden sind, was die Aufzeichnung einer stabilen, kontinuierlichen neuronalen Aktivität behindert. Darüber hinaus weisen die meisten Drahtbündel einen großen Abstand zwischen den Kanälen auf, wodurch die gleichzeitige Aufzeichnung von einer großen Anzahl von Zellen, die auf einer kleinen Fläche gruppiert sind, ausgeschlossen ist. Die in diesem Protokoll beschriebenen Kohlefaser-Mikroelektroden-Arrays bieten eine zugängliche Lösung für diese Bedenken. Die Studie bietet eine detaillierte Methode zur Herstellung von Kohlefaser-Mikroelektroden-Arrays, die sowohl für akute als auch für chronische Aufnahmen in vivoverwendet werden können. Die physikalischen Eigenschaften dieser Elektroden machen sie ideal für stabile und kontinuierliche Langzeitaufnahmen bei hohen Zelldichten, so dass der Forscher robuste, eindeutige Aufnahmen von einzelnen Einheiten über Monate hinweg machen kann.
Einleitung
Elektroden und Elektrodenarrays sind wertvolle Werkzeuge, um zu verstehen, wie das Gehirn Informationen auf neuronaler Ebene verarbeitet. Während elektrophysiologische Aufzeichnungen seit über zwei Jahrhunderten erreichbar sind1, ist es immer noch nicht möglich, die Aktivität ganzer neuronaler Schaltkreise gleichzeitig mit der räumlichen und zeitlichen Auflösung zu messen, die erforderlich ist, um das Spiking einzelner Neuronen zu erfassen. Obwohl nicht-invasive Methoden wie die Elektroenzephalographie2, diePositronenemissionstopographie3und die funktionelle Magnetresonanztomographie4 Messungen des gesamten Gehirns ermöglichen, können sie nicht die räumliche und zeitliche Auflösung erreichen, die für die Auflösung der Aktivität neuronaler Schaltkreise erforderlich ist2,5. Im Gegensatz dazu können bildgebende Verfahren wie die optische Bildgebung mit spannungsempfindlichen Farbstoffen oder genetisch kodierten Kalziumindikatoren eine räumliche Auflösung von einer Einheit erreichen, aber sie werfen Probleme wie eine geringe zeitliche Auflösung und eine schlechte Selektivitätauf 3,4,5,6. Elektrische Aufzeichnungen sind eine leistungsfähige Alternative zu diesen Methoden. Aufzeichnungselektroden bieten eine beispiellose zeitliche Auflösung und ermöglichen es dem Benutzer, Messungen mit Spike-Time-Präzision in jeder Region des Gehirns durchzuführen7. Darüber hinaus ermöglichen chronisch implantierte Multielektroden-Arrays (MEAs) großräumige (Dutzende bis Hunderte von Zellen) Einzelzellaufnahmen bei sich verhaltenden Tieren über einen Zeitraum von Tagen bis Monaten8,9. Siliziumsonden, die mit höheren Dichten aufzeichnen, haben jedoch einen großen Fußabdruck und sind hochinvasiv, und chronisch implantierte Arrays erzeugen oft eine Entzündungsreaktion, Gewebeverkapselung und neuronalen Tod10,11,12,13.
Die Einschränkungen bestehender Elektroden haben zu jüngsten Innovationen geführt, die stabile, hochauflösende Langzeitaufnahmen ermöglichen. Typische Elektroden bestehen aus einem metallischen Leiter, wie Wolfram oder Platin-Iridium, oder sind silizium- oder polymerbasiert. Während metallbasierte Mikrodraht-Arrays langfristige, stabile Aufnahmen aufrechterhalten können, haben sie eine viel größere Grundfläche, mit einem Durchmesser eines einzelnen Drahtes im Bereich von 10-200 μm14. Im Gegensatz dazu liefern siliziumbasierte Elektrodenarrays Aufnahmen mit hoher räumlicher Auflösung, aber aufgrund ihres relativ starren Designs sind sie typischerweise nicht in der Lage, das Signal aufrechtzuerhalten und von denselben Neuronen über viele Monate aufzuzeichnen15. Jüngste Entwicklungen bei siliziumbasierten Arrays haben zu Elektroden geführt, die zuverlässig chronische Aufzeichnungen durchführen können, aber diese Arrays können nicht zur Aufzeichnung aus tiefen Hirnregionen bei größeren Tieren verwendet werden und sind für lineare Aufnahmen vorgesehen9. Fortschritte bei Polymer-Arrays haben zu einer erhöhten Flexibilität und Aufzeichnungsstabilität einzelner Einheiten geführt und bieten das Potenzial für Aufzeichnungen mit hoher Dichte in naherZukunft,jedoch mit begrenzter Verfügbarkeit derzeit8,16,17. Kohlefasern ermöglichen Aufnahmen mit hoher Dichte mit handelsüblichen Materialien, die hier beschrieben werden.
Kohlefaser-Aufnahmemikroelektroden werden seit Jahrzehnten verwendet, wobei die ersten Kohlefaserelektroden aus einer einzigen Kohlefaser bestehen, die in eine Glasmikropipette eingefügt wurde. Diese Mikroelektroden wurden für extrazelluläre Einzelaufnahmen verwendet, und obwohl das Signal-Rausch-Verhältnis mit den besten Wolfram-in-Glas-Mikroelektroden vergleichbar war, waren sie aufgrund ihrer Flexibilität, niedrigeren Impedanzwerte und der Einfachheit der Herstellungvon 18,19von Vorteil. Die Bemühungen zur Entwicklung von Kohlefaser-Elektrodenarrays haben sich in letzter Zeit aufgrund der Biosensorik von Kohlenstofffasern beschleunigt. Zusätzlich zu ihrer erhöhten Biokompatibilität und außergewöhnlichen elektrischen Leitfähigkeit zeichnen sie sich durch eine einzigartige Reihe von Eigenschaften aus, darunter Hochtemperaturbeständigkeit, geringe relative Dichte, hohe Zugfestigkeit, geringe Biegesteifigkeit, hohe Detektionsempfindlichkeit und eine kleine Querschnittsfläche10,12. All diese Eigenschaften haben die Entwicklung von Kohlefaser-Mikroelektroden-Arrays (CFEAs) motiviert, die chronische, stabile und ertragreiche Aufnahmen einzelner Neuronen ermöglichen. Solche CFEAs können nun von Hand20,21 (Abbildung 1) hergestellt werden, wodurch Mikroelektrodenarrays entstehen, die einzelne Neuronen über Monate halten können. Beschrieben wird hier ein zugänglicher Konstruktionsprozess für CFEAs, der auf zwei Arten für akute und chronische Aufnahmen einzelner Neuronen in zwei Spezies angepasst wurde.
Protokoll
Alle experimentellen Verfahren wurden von der Brandeis University oder dem Washington University Animal Care and Use Committee genehmigt. Die gezeigten Daten wurden von einem weiblichen Frettchen und einer männlichen Maus gesammelt.
1. Vorbereitung von Carbonfasern und Werkzeugen
- Herstellung von handelsüblichen Carbonfasern
- Schneiden Sie 8 cm Streifen aus dem epoxidgroßen Faserbündel. Legen Sie die Streifen parallel in einen Tiegel und backen Sie sie in einem Ofen bei 400 ° C für 6 h, um das Epoxidharz von handelsüblichen Fasern zu entfernen. Bewahren Sie dann die gebackenen Fasern in einer Standard-Petrischale oder einem konischen Röhrchen auf.
HINWEIS: Es wurden Fasern mit einem Durchmesser von 7 μm verwendet. Andere Gruppen haben 4 μmFasern 20,21verwendet. - Bereiten Sie Kassetten für die Aufnahme einzelner Fasern vor. Verwenden Sie einen 3D-Drucker oder Laserschneider, um die Kassetten und den zugehörigen Kassettenhalter zu erstellen (siehe Abbildung 2).
- Laden Sie die Fasern auf die Kassetten. Legen Sie zunächst ein Stück doppelseitiges Klebeband auf die beiden Längsseiten der Kassette und richten Sie den Rand des Bandes mit dem inneren Rand der Kassette aus. Trennen Sie die einzelnen Fasern vom gebackenen Bündel und legen Sie sie parallel zur kurzen Seite der Kassette, wobei 2-3 mm zwischen den Fasern bleiben. Stellen Sie sicher, dass 20-30 Fasern auf jede Kassette passen. Versiegeln Sie die Fasern an Ort und Stelle, indem Sie klares Klebeband über das Doppelklebeband legen. Legen Sie die gefüllten Kassetten in den Kassettenhalter.
HINWEIS: Für einen erfahrenen Bauherrn dauert das Füllen einer Kassette mit Fasern ~ 1 h. Für den unerfahrenen Builder wird dieser Vorgang wahrscheinlich ~ 1,5-3 h dauern. Es gibt zehn Kassetten zu einer Box, und zwei Kassettenhalter passen in die Parylen-Abscheidekammer. - Beschichten Sie die einzelnen Fasern mit Parylen C unter Verwendung einer handelsüblichen Vakuumabscheidungskammer. Für die Beschichtung ist ein einziger Lauf erforderlich. Messen Sie 2,3 g Parylen für jeden Lauf aus. Zwei Kassettenhalter passen gleichzeitig in die Kammer. Der Beschichtungsprozess dauert ~2 h pro Durchlauf.
HINWEIS: Eine Messung von 2,3 g Parylen C ergibt eine Beschichtung von etwa 1 μm. Beschichtete Fasern können unbegrenzt gelagert werden.
- Schneiden Sie 8 cm Streifen aus dem epoxidgroßen Faserbündel. Legen Sie die Streifen parallel in einen Tiegel und backen Sie sie in einem Ofen bei 400 ° C für 6 h, um das Epoxidharz von handelsüblichen Fasern zu entfernen. Bewahren Sie dann die gebackenen Fasern in einer Standard-Petrischale oder einem konischen Röhrchen auf.
- Vorbereitung des Kohlefaser-Manipulationswerkzeugs
- Wickeln Sie ein kleines Stück flexibler Klebefolie um eine 30 G-Nadel und bilden Sie mit der Klebefolie eine scharfe, aber flexible Spitze.
HINWEIS: Das Umwickeln einer Nadelspitze mit Parafilm und das Dehnen des Parafilms erzeugt dabei einen milden Klebeeffekt, der es dem Benutzer ermöglicht, einzelne Fasern aufzunehmen und zu manövrieren.
- Wickeln Sie ein kleines Stück flexibler Klebefolie um eine 30 G-Nadel und bilden Sie mit der Klebefolie eine scharfe, aber flexible Spitze.
2. Design und Fertigung
- Wählen Sie das geeignete Vorrichtungsdesign aus, das basierend auf den Spezifikationen der zu bauenden Elektrode erforderlich ist. Dies basiert auf der Anzahl der benötigten Kanäle sowie auf allen Designergänzungen.
HINWEIS: Jig bezieht sich auf den 3D-gedruckten Block, der einen Anker für Elektroden und elektrische Verbindungen bietet. - Erstellen oder ändern Sie die spezifische Konstruktion der Vorrichtung mit cad-Software (Computer-Aided Design).
- Verwenden Sie ein 3D-Druckunternehmen oder das institutionelle Herstellerlabor, um die Vorrichtungen mit einem hochauflösenden SLA-3D-Drucker zu drucken.
3. Montage des Kohlefaser-Mikroelektroden-Arrays (CFEA)
HINWEIS: Dieser Schritt dauert ~ 2 h für einen erfahrenen Builder und ~ 6 h für einen unerfahrenen Builder. Führen Sie alle CFEA-Montageschritte und Faserbündelungsschritte unter einem 10-fachen Stereomikroskop durch. Komplette Montage des CFEA in einer Umgebung mit minimaler Luftbewegung, da dies den Bauprozess stören kann.
- Wählen Sie die geeignete Vorrichtung, die zum Bau der gewünschten Elektrode benötigt wird.
- Schneiden Sie mit Metalldrahtschneidern zwei Stücke Wolframdraht mit einem Durchmesser von 76,2 μm (0,003 Zoll) und einer Länge von etwa 7 cm.
- Führen Sie jeden Draht durch den entsprechenden Kanal am Steckerende der Vorrichtung (GND und REF). Zuführen Sie genug durch, bis die beiden Enden gleich lang sind, und drehen Sie sie dann zusammen, um sie an der Vorrichtung zu befestigen.
HINWEIS: Stellen Sie für das 16-Kanal-Akutdesign sicher, dass der Metalldraht in den Grat in der Vorrichtung passt.- Tragen Sie UV-härtenden Zahnzement auf, um den Draht zu sichern. Stellen Sie sicher, dass sie keinen Zahnzement in den offenen Kanal bekommen, durch den der Draht geführt wird.
HINWEIS: Der Benutzer sollte während aller UV-bezogenen Verfahren einen UV-filternden Augenschutz tragen, um mögliche Augenschäden zu vermeiden. Viele UV-Härtungsstäbe verfügen über integrierte Sichtfilter. - Mit dem UV-Härtungsstab den Zahnzement für 20 s aushärten.
- Befestigen Sie die Vorrichtung im Schmuckschraubstock an einem der Arme der Vorrichtung. Richten Sie die Vorrichtung so aus, dass eine der Seitenflächen parallel zum Boden verläuft.
- Richten Sie die Vorrichtung und den Schraubstock unter dem Mikroskop so aus, dass das Anschlussende, das Becken und die Trichterspitze sichtbar sind. Richten Sie die Vorrichtung so aus, dass der Trichter vom Benutzer weg zeigt und das Steckerende zum Benutzer zeigt.
- Sammeln Sie die Kohlefaserwerkzeuge und eine scharf bestückte 25 G Nadel.
- Legen Sie eine Kassette mit Parylen-C-beschichteten Fasern auf ein weißes Blatt Papier, Klebeband nach oben, so dass die Fasern nicht direkt auf dem Papier sind.
- Verwenden Sie die 25 G Nadel, um eine einzelne Kohlefaser aus der Kassette zu schneiden. Dazu schieben Sie die Nadelspitze gegen die Kassette, aus der die zu entfernende Faser austritt.
- Wenn Sie mit halben Fasern bauen, schneiden Sie ein Ende der Faser wie oben beschrieben. Richten Sie die Faser so aus, dass sie gerade ist, und schneiden Sie die Faser mit der Nadel in zwei Hälften, indem Sie die Faser gegen das Papier schneiden. Um die andere Hälfte zu schneiden, die noch mit der Kassette verbunden ist, halten Sie die freie Spitze der Faser mit dem zuvor hergestellten Kohlefaserwerkzeug fest und schneiden Sie dann mit der Nadel die noch mit der Kassette verbundene Faser wie oben beschrieben ab.
- Wenn Sie mit vollen Fasern bauen, schneiden Sie ein Ende der Faser wie oben beschrieben. Verwenden Sie das zuvor hergestellte Kohlefaserwerkzeug und halten Sie das freie Ende der Faser, die gerade geschnitten wurde. Schneiden Sie mit der Nadel das andere Ende der Faser von der Kassette weg.
- Heben Sie die Kohlefaser mit dem zuvor hergestellten Kohlefaserwerkzeug auf. Nehmen Sie die Faser so auf, dass ein Ende etwa 1 cm Länge vom Werkzeug hat.
- Verwenden Sie das Kohlefaserwerkzeug mit der angebrachten Faser und führen Sie das kürzere Ende der Faser durch das Trichterstück aus dem mittleren Becken der Vorrichtung. Verwenden Sie ein Mikroskop, um zu visualisieren.
- Führen Sie die Faser weiter durch den Vorrichtungstrichter, bis der größte Teil der Länge der Faser durch ist (siehe Abbildung 3A).
- Führen Sie den Rückteil der Faser mit dem zuvor hergestellten Kohlefaserwerkzeug durch einen verfügbaren Kanal ein. Führen Sie die Faser durch den Rücken, bis etwa 5 mm Faser aus der Rückseite herausragen. Bei Bedarf auf Maß zuschneiden (siehe Abbildung 3B).
HINWEIS: Führen Sie keine Fasern in Kanäle ein, die die Metalldrähte enthalten.
- Füllen Sie die restlichen Kanäle mit Fasern auf einer Seite der Vorrichtung und befolgen Sie die oben angegebenen Anweisungen.
HINWEIS: Wenn Sie Fasern in den Trichter einspeisen, führen Sie die Hälfte der Fasern in jede Abteilung des Trichters ein, wobei die rechte Hälfte der Kanäle in der rechten Abteilung und die linke Hälfte der Kanäle in der linken Abteilung liegt. Wenn die Fasern in engem Kontakt innerhalb des Trichters stehen, kommt es zu einer ungünstigen Reibung zwischen den Fasern, die dazu führt, dass vorhandene Fasern entweder losgezogen oder gebrochen werden, während neue Fasern in die Vorrichtung eingebracht werden. Diese Aufteilung in vier Abschnitte sorgt für eine gewisse Erleichterung, da die Fasern bis zu einem späteren Schritt in kleineren Bündeln gehalten werden. - Verwenden Sie ein Standard-Funkenradfeuerzeug und leiten Sie die Flamme schnell über die freiliegenden Fasern am Steckerende. Stellen Sie sicher, dass die Isolierung aller Fasern an den Enden entfernt wird (siehe Abbildung 3C).
HINWEIS: Der Teil der Fasern, der der Flamme ausgesetzt war, sollte etwas dünner erscheinen als der Rest der Faser. - Führen Sie die geflammte Faser durch die Vorrichtung, so dass sich der Teil der Faser, der der Flamme ausgesetzt ist, nun im Kanal befindet. Stellen Sie sicher, dass keine Fasern aus der Rückseite der Vorrichtung herausragen (siehe Abbildung 3D).
HINWEIS: Verwenden Sie das Kohlefaserwerkzeug, um die Faser aus dem Becken zu greifen und die geflammte Faser durch die Vorrichtung zu führen. Berühren Sie nicht den Teil der Fasern, der der Flamme ausgesetzt ist, da dieser Teil zerbrechlicher ist. - Tragen Sie UV-ausgehärteten Zahnzement auf die Fasern im Becken der Vorrichtung auf. Füllen Sie das gesamte Becken aus, um die Öffnungen der Kanäle und die Öffnung des Trichters abzudecken (siehe Abbildung 3E).
- Verwenden Sie das UV-Licht und härten Sie den Zahnzement für 20 s aus. Weitere 20 s aushärten, wenn der Zahnzement nicht vollständig ausgehärtet ist.
HINWEIS: Stellen Sie sicher, dass der Zahnzement nicht innerhalb der Kanäle wandert.
- Verwenden Sie das UV-Licht und härten Sie den Zahnzement für 20 s aus. Weitere 20 s aushärten, wenn der Zahnzement nicht vollständig ausgehärtet ist.
- Entfernen Sie die Vorrichtung vom Schraubstock, drehen Sie sie um und befestigen Sie die Vorrichtung wie zuvor gesichert im Schraubstock. Stellen Sie sicher, dass die Seite, die die Fasern enthält, jetzt mit der Vorderseite nach unten ist.
- Füllen Sie die leere Seite der Vorrichtung genau wie oben beschrieben mit Kohlefasern aus.
- Sobald alle Kanäle Fasern haben und die Fasern mit Zahnzement gesichert sind, entfernen Sie die Vorrichtung vom Schraubstock und richten Sie die Vorrichtung so aus, dass der Trichter nach unten zeigt. Befestigen Sie die Vorrichtung im Schraubstock, so dass das Steckerende nach oben zeigt.
- Sammeln Sie eine 25-G-Nadel mit scharfer Spitze, eine 1-ml-Spritze, eine leitende Silberfarbe, Applikatoren mit Baumwollspitze, Einendünner, Gewebetücher und den entsprechenden Headstage-Verbinder.
HINWEIS: Stellen Sie sicher, dass die silberleitende Farbe gut gemischt ist und eine homogene Lösung darstellt. Lassen Sie die Farbe nicht austrocknen. - Ziehen Sie 0,3 ml Silberfarbe in die 1 ml Spritze und befestigen Sie dann die 25 G-Nadel mit scharfer Spitze.
- Führen Sie die Nadel vorsichtig in einen Kanal ein, bis sie vom Zahnzement gestoppt wird. Drücken Sie langsam auf die Spritze, während Sie die Nadel aus dem Kanal entfernen, um den Kanal mit Farbe zu füllen (siehe Abbildung 3E).
- Wischen Sie jede Farbe von der Nadel ab und fahren Sie dann mit dem nächsten Kanal fort.
- Füllen Sie alle Kanäle mit Farbe.
HINWEIS: Zusätzliche Durchgänge in die Kanäle können erforderlich sein, da die Farbe in den Kanälen für die ersten Minuten aushärtet.
- Füllen Sie alle Kanäle mit Farbe.
- Tauchen Sie einen Applikator mit Baumwollspitze in den Farbverdünner und reinigen Sie dann die Basis der Vorrichtung von einer beliebigen Farbe auf der Oberfläche. Ein paar Applikatoren mit Baumwollspitze können dafür notwendig sein.
HINWEIS: Applikatoren mit Baumwollspitze, die nicht in Farbverdünner getaucht sind, können auch nützlich sein, um die Vorrichtung zu reinigen. - Stecken Sie den Headstage-Stecker in die richtige Ausrichtung, indem Sie die Pins an den Kanälen ausrichten. Stellen Sie sicher, dass der Headstage-Stecker aufrecht sitzt und so bündig wie möglich zur Vorrichtung ist (siehe Abbildung 3F).
- Lassen Sie die Vorrichtung 24 h aushärten.
- Befestigen Sie den Headstage-Stecker mit UV-härtendem Zahnzement an der Vorrichtung, indem Sie Zahnzement entlang der Kante auftragen, an der der Headstage-Verbinder auf die Vorrichtung trifft. UV-Härten mit einem UV-Licht für 20 s.
- Tragen Sie UV-härtenden Zahnzement auf, um den Draht zu sichern. Stellen Sie sicher, dass sie keinen Zahnzement in den offenen Kanal bekommen, durch den der Draht geführt wird.
4. Verpackung von Faserbündeln
HINWEIS: Es dauert ungefähr 30 Minuten, um diesen Schritt auszuführen. Führen Sie diesen Schritt für die in Tiermodellen verwendeten Elektroden mit einer dicken Schicht Pia mater aus. Verstärken Sie das Faserbündel, um Biegungen zu minimieren. Bei Mausprozeduren ist dieser Schritt möglicherweise nicht erforderlich.
- Bringen Sie das Faserbündel unter Wasserspannung in einem einzigen Schacht zusammen. Verwenden Sie eine Transferpipette, um einen Tropfen Wasser von der Trichterspitze zur Bündelspitze zu leiten, während die Elektrode aufrecht in einem Schraubstock befestigt ist.
- Beginnen Sie mit dem Auftragen einer etwa 1,5 mm dicken Schicht Zahnzement um das Bündel an der Trichterspitze. Härten Sie den Zahnzement mit 20 s UV-Licht aus.
HINWEIS: Für kortikale Aufnahmen ist keine weitere Verpackung erforderlich. Für tiefere Hirnregionen befestigen Sie ein Führungsrohr um das Bündel. - Aufbau des Führungsrohres und Einsetzen des Bündels in das Führungsrohr
- Messen und schneiden Sie die gewünschte Länge von Polyimidschläuchen. Stellen Sie sicher, dass die Länge des Polyimidschlauchs 2 mm Kohlefaserspitzen frei lässt. Messen und schneiden Sie ein Stück 30 G Metallrohr, das 2 mm kürzer ist als das Polyimidrohr. Verwenden Sie ein Rotationswerkzeug, um scharfe Kanten am Metallrohr zu entfernen. Setzen Sie den Polyimidschlauch in den Metallschlauch ein.
- Positionieren Sie die Elektrode in einem Schraubstock, wobei das Kohlefaserbündel nach oben zeigt. Befestigen Sie den zusammengebauten Schlauch an einem Mikromanipulator und senken Sie ihn mit einem Mikroskop vorsichtig über das Faserbündel. Befestigen Sie den Schlauch mit einer zusätzlichen Schicht Zahnzement an der vorhandenen Zahnzementbasis. Härten Sie den Zahnzement mit 20 s UV-Licht aus.
HINWEIS: Der Bauprozess kann hier pausiert werden.
5. Vorbereitung der Elektrodenspitze
HINWEIS: Dieser Schritt dauert ca. 30 Minuten pro Array.
- Schneiden Sie die Elektroden auf die gewünschte Länge.
- In Vorbereitung auf das Schneiden der Elektrodenspitze stapeln Sie Haftnotizen, um eine Plattform von etwa 1,5 mm Höhe zu bauen. Messen Sie vom Rand der Plattform aus die gewünschte Elektrodenlänge und markieren Sie diesen Abstand. Die Plattform wird als Leitfaden für das Schneiden dienen.
- Senken Sie die Elektrode in ein Becherglas mit entionisiertem oder destilliertem Wasser, bis die Trichterspitze vollständig eingetaucht ist, zuerst die Spitze und senkrecht an der Oberfläche gehalten wird. Bringen Sie die einzelnen Kohlefasern zusammen, indem Sie die Elektrode aus dem Wasser entfernen. Die Oberflächenspannung bringt die Bündel zusammen. Lassen Sie die Elektrode 30 min an der Luft trocknen.
- Befestigen Sie die #10 Skalpellklinge am Griff. Skalpell und Elektrode einfrieren, indem Sie sie für mindestens 5 min in einen -18 °C Gefrierschrank legen.
- Legen Sie die Elektrode so an, dass die Fasern bündig auf der Oberfläche der Führung liegen (vorbereitet in Schritt 5.1.1). Schneiden Sie die Fasern mit dem Skalpell mit einer Rollbewegung auf die gewünschte Länge. Führen Sie diesen Schritt schnell aus, um sicherzustellen, dass Elektrode und Skalpell noch eingefroren sind (siehe Abbildung 3G).
- Injizieren Sie positiven Strom, um die Impedanz der Elektrodenspitzen zu reduzieren.
- Befestigen Sie die Elektrode mit dem entsprechenden Adapter am Multielektrodenimpedanztester (siehe Materialtabelle). Untere Elektrodenspitze ~2 mm in ein Mikrozentrifugenröhrchen aus 0,1 M phosphatgepufferter Kochsalzlösung (PBS). Führen Sie den Erdungsdraht in das Mikrozentrifugenrohr ein.
- Injizieren Sie Strom mit der gewählten Amplitude und Dauer.
HINWEIS: Mit diesem Schritt sollen die Impedanzwerte an der Spitze des CFEA reduziert werden. In dieser Studie wurden die folgenden Parameter in die grafische Benutzeroberfläche der Galvaniksoftware eingegeben: Strom: 0,100 μA; Dauer: 10 s; Pause: 1 s. Dieser Vorgang kann bei Bedarf pro Kanal wiederholt werden, bis die Elektrodenimpedanzen die gewünschten Werte erreichen (siehe Abbildung 4C). - Sobald die Impedanzwerte wie gewünscht sind, spülen Sie die Fasern in deionisiertem oder destilliertem Wasser ab, um sie zu reinigen.
- Galvanik in der Vergoldungslösung.
HINWEIS: Dieser Schritt sollte kurz vor der Implantation (am selben Tag) durchgeführt werden.
VORSICHT: Einige der Chemikalien, die bei der Herstellung von CFEA-Spitzen verwendet werden, sind korrosiv, einschließlich der Vergoldungslösung. Konsultieren Sie vor der Anwendung das SDB und bestimmen Sie die geeigneten Vorsichtsmaßnahmen, die zu ergreifen sind, um die Lösung sicher zu handhaben.
HINWEIS: Um dem Faserbündel Steifigkeit zu verleihen, kann der Benutzer eine Vergoldungslösung herstellen, indem er PEG8000 zuerst in deionisiertem oder destilliertem Wasser bei 1 mg / ml auflöst. Kombinieren Sie dann 625 μL solubilisierte PEG8000 und 375 μL Vergoldungslösung und Wirbellösung für 10 s zum Mischen. Das PEG8000 löst sich nach dem Einsetzen von Fasern im Gehirn auf.- Senken Sie die Elektrodenbündelspitze ~ 2 mm in das Mikrozentrifugenröhrchen der Beschichtungsmischung. Führen Sie den Erdungsdraht in das Mikrozentrifugenrohr ein.
- Stellen Sie geeignete Parameter für die Galvanik ein. In dieser Studie wurden die folgenden Parameter in die grafische Benutzeroberfläche der Galvaniksoftware eingegeben: Strom: -0,05 μA; Dauer: 30 s; Pause: 5 s.
- Spülen Sie die Fasern gründlich mit entionisiertem oder destilliertem Wasser ab. Messen Sie zu diesem Zeitpunkt die Impedanzwerte auf Wunsch erneut.
6. Insertion im Gehirn: Überlebenschirurgie, Maus (Mus musculus) und Nicht-Überlebenschirurgie, Frettchen (Mustela putorius furo)
HINWEIS: Chirurgische Eingriffe sollten dem Standardprotokoll in Übereinstimmung mit IACUC folgen. Für detaillierte Informationen siehe Ma et al.22 für das Überlebenschirurgieprotokoll und Popovic et al.23 für das Nicht-Überlebenschirurgieprotokoll. Befolgen Sie die aseptischen chirurgischen Verfahren gemäß den ASC-Richtlinien für die Überlebenschirurgie bei Nagetierarten. Dazu gehören das Autoklavieren aller chirurgischen Werkzeuge und Materialien bei 135 °C für 15 min und die Behandlung des stereotaktischen Gerätes und des Operationsbereichs mit 70% Ethanol. Verwenden Sie sterile OP-Handschuhe, ein Einwegkleid und eine Gesichtsmaske während des Eingriffs.
- Überlebenschirurgie, Maus (Mus musculus).
- Betäuben Sie die Mäuse mit 2,5% Isofluran in einer Induktionsbox für ~ 1 min, bis die Atemfrequenz 55-65 Atemzüge / min erreicht. Dann verabreichen Sie 2,0% Isofluran durch einen Nasenzapfen, um die Anästhesie aufrechtzuerhalten. Tragen Sie Tiersalbe auf beide Augen auf, um Hornhautschäden zu vermeiden. Führen Sie eine Zehenzange durch, um den richtigen Grad der Anästhesie zu überprüfen.
- Befolgen Sie nach der Überprüfung die in Ma et al.22beschriebenen Verfahren der Überlebenschirurgie. Überwachen Sie die Atemfrequenz und halten Sie sie bei 60 Atemzügen / min. Halten Sie die Körpertemperatur mit einem thermostatisch gesteuerten Heizkissen bei 37 °C. In den Schritten 6.3-6.5 (siehe unten) finden Sie Anweisungen zur Vorbereitung des Schädels auf die Kraniotomie, Durotomie und Elektrodenimplantation.
- Nach der Operation bringen Sie die Mäuse in einen Erholungskäfig zurück, der mit einem 37 °C heißen Heizkissen ausgestattet ist, das von anderen Tieren isoliert ist.
- Bedecken Sie die Operationswunden mit der antibiotischen Salbe. Überwachen Sie die Tiere, bis sie wieder genug Bewusstsein erlangen, um das Brustlagendrückstand aufrechtzuerhalten und ihnen zu ermöglichen, sich für einen Zeitraum von 2-5 Tagen zu erholen. Beherbergen Sie sie einzeln und überwachen Sie kontinuierlich auf Anzeichen von Infektionen oder Beschwerden. Geben Sie den Tieren am Tag der Operation eine Dosis Buprenorphin 72 h mit verzögerter Freisetzung (0,5-1,0 mg/kg) als Analgetikum.
- Nicht-Überlebenschirurgie, Frettchen (Mustela putorius furo)
- Das Frettchen zunächst mit Ketamin (20 mg/kg, i.m.) betäuben und dann mit 1,0%-2,0% Isofluran in einem 2:1-Gemisch aus Lachgas und Sauerstoff durch eine Maske lüften. Führen Sie eine Zehenzange durch, um den richtigen Grad der Anästhesie zu überprüfen.
- Befolgen Sie nach der Überprüfung nicht überlebensbedingte chirurgische Verfahren, die in Popovic et al.23 beschriebensind. Führen Sie eine Tracheostomie durch und beatmen Sie die Tiere mit 1,0% -2,0% Isofluran in einer 2: 1-Mischung aus Lachgas und Sauerstoff. Tragen Sie Tiersalbe auf beide Augen auf, um Hornhautschäden zu vermeiden.
- Halten Sie die Körpertemperatur mit einem thermostatisch gesteuerten Heizkissen bei 37 °C. Überwachen Sie die Herzfrequenz, den CO2-Gehalt an den Gezeiten und die Atemfrequenz. Halten Sie die Atemfrequenz im geeigneten physiologischen Bereich (3,5% -4,0%). In den Schritten 6.3-6.5 (siehe unten) finden Sie Anweisungen zur Vorbereitung des Schädels auf die Kraniotomie, Durotomie und Elektrodenimplantation.
- Überwachen Sie kontinuierlich das EKG des Tieres, um eine ausreichende Anästhesie sicherzustellen und den Isoflurananteil zu erhöhen, wenn das EKG auf Eine Belastung hinweist.
- Nach Abschluss des Experiments werden dem Frettchen 1 ml Pentobarbital-Natrium- und Phenytoin-Natriumlösung verabreicht und überwacht, bis die Herzfrequenz und das CO2 der Endtidalen 0 messen.
- Vorbereitung des Schädels
- Bohren Sie mit einem 0,8 mm Bohrgrat eine einzelne 4 mm x 4 mm Kraniotomie an der gewünschten Stelle für die Implantation. Bohren Sie bei der Maus ein zusätzliches Gratloch an einer kontralateralen Stelle für das Einsetzen der Bodenschraube aus Edelstahl.
HINWEIS: Führen Sie keine Durotomie durch, bis die Elektrode zur Implantation bereit ist. - Legen Sie einen Boden/eine Referenz fest. Verwenden Sie in akuten Frettchenexperimenten eine 18 G-Nadel, um die Haut und die Muskelschicht, die den Schädel umgibt, auf der Seite des Kopfes des Tieres gegenüber der Kraniotomie zu durchbohren. Führen Sie das Drahtende der Ag/Cl-Referenzelektrode in die Nadelspitze ein und ziehen Sie dann die Nadel vom Muskel/der Haut zurück, so dass das Pellet nun sicher zwischen Muskel und Schädel sitzt. Wickeln Sie in der Maus den silbernen Erdungsdraht um die Edelstahl-Erdungsschraube. Sicher mit UV-härtendem Zahnzement.
- Befestigen Sie die Elektrode mit einem dünnen Streifen Etikettierband am Elektrodenhalter und befestigen Sie den Elektrodenhalter im Mikromanipulator. Befestigen Sie den Erdungsdraht über einen Krokodilclip an einer Erdungsquelle. Befestigen Sie den Referenzdraht an der Referenzelektrode, die in den Muskel des Tieres eingebettet ist.
- Bohren Sie mit einem 0,8 mm Bohrgrat eine einzelne 4 mm x 4 mm Kraniotomie an der gewünschten Stelle für die Implantation. Bohren Sie bei der Maus ein zusätzliches Gratloch an einer kontralateralen Stelle für das Einsetzen der Bodenschraube aus Edelstahl.
- Durotomie und Pia-Penetration
- Entfernen Sie die Dura aus der Kraniotomie mit einem Dura-Pick.
- Erstellen Sie ein kleines Loch in der Pia. Setzen Sie dazu eine Metallmikroelektrode (im Frettchen empfohlen) ein und ziehen Sie sie zurück. Alternativ können Sie die CFEA orthogonal auf die Oberfläche des Gehirns absenken, um ein Gefäßsystem zu vermeiden. Sobald dieser Ort bestimmt ist, heben Sie die Elektrode an und nicken Sie vorsichtig die Oberfläche des Gehirns an dieser Stelle mit einem Dura-Pick ein und ziehen Sie mit dem Pick nach oben (empfohlen bei der Maus).
- Elektrodenimplantation
- Senken Sie die Elektrodenspitze an die gleiche Stelle und beginnen Sie im Feinmodus, die Elektrode mit einer Geschwindigkeit von ~ 2 μm / s in das Gehirn zu treiben. Verwenden Sie ein Mikroskop, um sicherzustellen, dass die Elektrode sanft eindringt und sich nicht verbiegt.
HINWEIS: Wenn die Elektrode nicht sanft eindringt, heben Sie sie aus dem Gehirn und stellen Sie den Winkel neu ein. Wenn es sich weiter biegt, ohne sanft einzutreten, passen Sie die Position an und wiederholen Sie den Prozess des Nickens der Oberfläche des Gehirns für die neue Eintrittsstelle. - Führen Sie die chronische und akute Implantation mit den folgenden Schritten durch.
- Bei chronischer Implantation: Zementieren Sie die Elektrode mit UV-härtendem Zahnzement an Ort und Stelle.
- Schließen Sie den Schnitt mit 5-0 chirurgischen Nähten und bauen Sie die Kopfkappe.
- Um eine Kopfkappe aufzubauen, fügen Sie zusätzlichen Zahnzement um die Implantationsstelle hinzu. Stellen Sie sicher, dass Sie die Nase der Vorrichtung bedecken.
- Ziehen Sie die Haut nach oben und um die Kopfkappe. Nähen Sie den Schnitt hinter der Kopfkappe mit 5-0 chirurgischen Nähten.
- Lidocain-Creme und antibiotische Salbe auftragen.
- Stoppen Sie das Anästhetikum und befolgen Sie die Üblichen Wiederherstellungsverfahren.
- Bei akuter Implantation: Nachdem Sie die Elektrode abgesenkt und die gewünschte Tiefe erreicht haben, warten Sie mindestens 30 Minuten, bevor Sie mit der elektrophysiologischen Aufzeichnung beginnen, damit sich die Elektrode an Ort und Stelle setzen kann.
- Bei chronischer Implantation: Zementieren Sie die Elektrode mit UV-härtendem Zahnzement an Ort und Stelle.
- Senken Sie die Elektrodenspitze an die gleiche Stelle und beginnen Sie im Feinmodus, die Elektrode mit einer Geschwindigkeit von ~ 2 μm / s in das Gehirn zu treiben. Verwenden Sie ein Mikroskop, um sicherzustellen, dass die Elektrode sanft eindringt und sich nicht verbiegt.
Ergebnisse
Mit dem Abschluss dieses Protokolls werden stabile Aufzeichnungen der Spiking-Aktivität einzelner Einheiten möglich sein. Diese Mikroelektroden-Arrays sind in Material, Kanalanzahl und Headstage-Adapter an die Bedürfnisse des Forschers anpassbar. Die Galvanisierung von Fasern in Gold führt zu verminderten Impedanzen, die für die Aufzeichnung geeignet sind (Abbildung 4 und Abbildung 5). Beabsichtigt der Anwender, chronisch aufzuzeichnen, können Messungen durchgeführt werden, nachdem sich das Tier von dem chirurgischen Eingriff erholt hat. Chronische Eingriffe haben zu stabilen Einzelaufnahmen für mindestens 120 Tage geführt. Eine repräsentative Aufzeichnung ist in Abbildung 6dargestellt, die die stabile elektrophysiologische Aktivität mit 64 Kanälen im retrosplenialen Kortex einer sich frei verhaltenden, erwachsenen männlichen Maus veranschaulicht. Ist ein akutes Präparat vorgesehen, können die Aufnahmen bereits kurz nach der Implantation (~30 min) beginnen. Dies gibt der Elektrode Zeit, sich im Gehirn niederzulassen. Abbildung 7 zeigt ein repräsentatives Beispiel für eine akute 16-Kanal-CFEA-Aufzeichnung, die vom primären visuellen Kortex eines erwachsenen weiblichen Frettchens aufgenommen wurde. Die Spike-Sortierung in Maus und Frettchen wurde mit Spike-Sortiersoftware durchgeführt (siehe Materialtabelle).
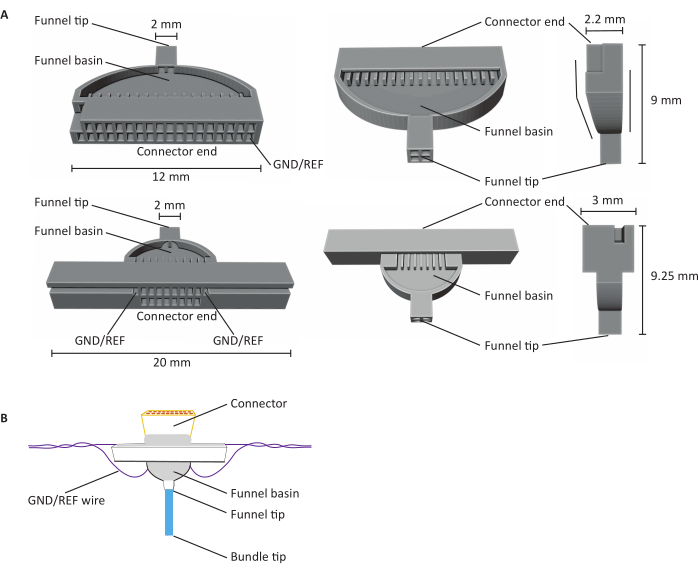
Abbildung 1: Anatomie von 16- und 32-Kanal-Kohlefaser-Mikroelektroden-Arrays (CFEAs). (A) Schematische von 32-Kanal (oben) und 16-Kanal (unten) CFEA aus drei verschiedenen Ansichten. Der 16-Kanal-CFEA verfügt über ein erweitertes Design für Handhabungszwecke. Das 32-Kanal-Design verfügt über eine flache Oberfläche, die es ermöglicht, zwei Vorrichtungen für ein 64-Kanal-CFEA zu kombinieren. Beide Diagramme haben identifizierende Strukturen, die mit Dimensionen gekennzeichnet sind. Das Steckerende zeigt die Position der Steckverbindereinführung an, und GND/REF-Kanäle zeigen an, wo der Erdungsdraht eingesteckt ist. Das Trichterbecken bezieht sich auf die Stelle, durch die die Fasern gehen, um mit UV-Licht ausgehärtetem Zahnzement überlagert zu werden, und die Trichterspitze bezeichnet die Stelle, von der aus die Fasern die Vorrichtung verlassen. Die Trichterspitze ist in Quadranten unterteilt, um zu minimieren, dass Fasern aneinander haften und Schäden verursachen. Die Fasern werden später unter Verwendung des Zahnzements zu einem einzigen Bündel gezogen. Vorrichtungen werden mit SLA-Harzdruckern in 3D gedruckt. Diagramme werden vergrößert, um Details anzuzeigen. (B) Konstruiertes CFEA. Das Diagramm hat identifizierende Strukturen beschriftet. Die blaue Bündelspitze stellt das Segment der Kohlefasern dar, die Aufzeichnungsmessungen erfassen. Das Grau im Trichterbecken und um den Verbinder herum weist auf UV-lichtvernetzten Zahnzement hin, der Kohlefasern im Trichterbecken hält und den Verbinder an der Vorrichtung befestigt. Der violette Draht stellt den Erdungsdraht dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
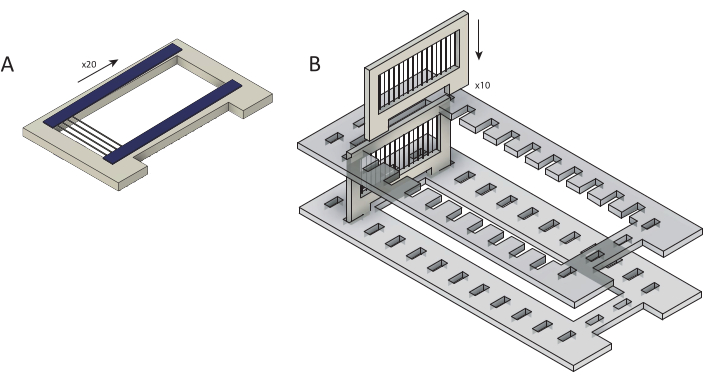
Abbildung 2: Laden von Rohkohlenstofffasern in Kassetten für die Parylen-C-Beschichtung. (A) Kohlefasern werden auf Patronen geladen, die mit zwei Streifen doppelseitigem Klebeband (blau) überlagert sind. Jede Kassette ist mit ~25 Fasern beladen. (B) Kassetten werden in Vorbereitung auf die Parylen-C-Beschichtung in einen lasergeschnittenen Halter (grau) geladen. Jede fasst zehn Kassetten. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
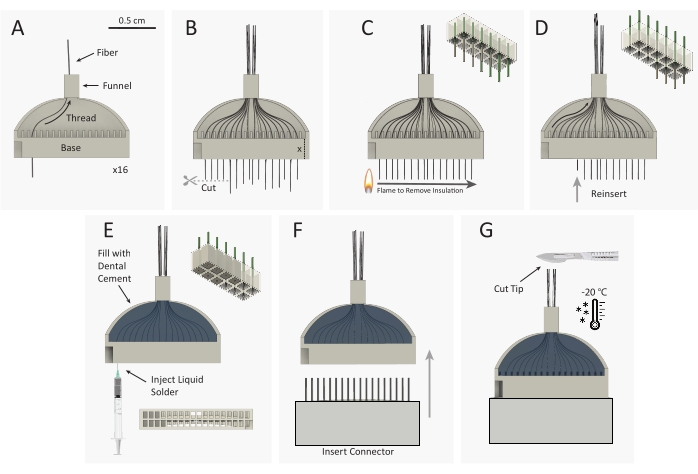
Abbildung 3: Schematische Konstruktion desKohlefaser-Mikroelektrodenarrays (CFEA) -Bündels. (A) 16 einzelne, beschichtete Kohlefasern (schwarz) werden durch die 32-Kanal-3D-gedruckte Vorrichtung (grau) gefädelt. (B) Kohlefaserspitzen werden mit einer Mikroschere geschnitten, wobei überschüssige Fasern gleich der Höhe der Vorrichtungsbasis verbleiben und sich aus der Vorrichtungsbasis erstrecken. (C) Ein Standard-Kunststoff-Funkenradfeuerzeug wird schnell über die überschüssige Faser geleitet, um die Parylen-C-Isolierung zu entfernen. Das obere rechte Schema zeigt die Entfernung von Parylen aus 9 der 12 Fasern. (D) Fasern werden wieder in die Vorrichtung eingeführt, bis das Faserende bündig mit der Basis ist. Der obere rechte Schaltplan zeigt das Wiedereinfügen von 9 Fasern mit ungedämmten (grauen) Faserspitzen, die in der Vorrichtungsbasis untergebracht sind. Die Vorrichtung wird dann umgedreht und die Schritte A-D werden wiederholt, um die gegenüberliegenden 16 Kanäle einzufädeln. (E) Die Vorrichtung ist mit Zahnzement gefüllt, um die Fasern zu sichern. Silberdruck wird in jede Vertiefung der Vorrichtungsbasis injiziert. (F) Der Stecker wird in den Vorrichtungssockel eingesetzt. (G) CFEA und Skalpell werden in einem -20 °C Gefrierschrank eingefroren. Die Array-Spitze wird auf die gewünschte Länge geschnitten, so dass 32 gleichmäßige Fasern übrig bleiben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
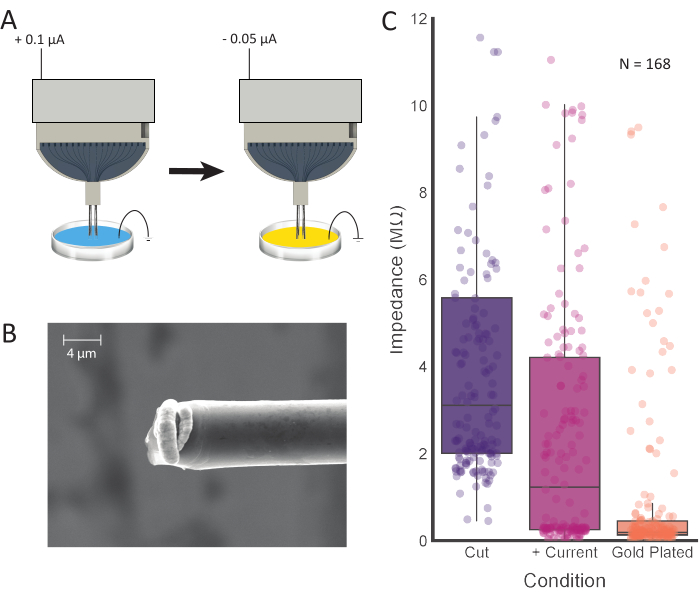
Abbildung 4:Spitzenbehandlung und Galvanisieren. (A) Die Elektrodenspitzen werden zuerst in 0,1 M PBS platziert, wobei Strom durch jede Elektrode geleitet wird. Die Spitzen werden dann gespült und in eine Vergoldungslösung überführt, wo sie mit dem Strom galvanisiert werden. (B) REM-Bilder von präparierter Kohlefaser zeigen eine an der Spitze konzentrierte Vergoldungslösung. Der Maßstabsbalken entspricht 4 μm. (C) Impedanzwerte von 168 Kanälen nach dem ersten Schneiden (violett; 3,11 MΩ ± 0,42 MΩ, median ± SE, n = 168 Fasern), positiver Strominjektion (rosa; 1,23 MΩ ± 0,36 MΩ, Median ± SE, n = 168 Fasern) und Galvanisierung (orange; 0,19 MΩ ± 0,15 MΩ, Median ± SE, n = 168 Fasern) zeigen nach jedem Verarbeitungsschritt verringerte Impedanzwerte. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5:Moderate Goldgalvanikdauern erzeugen kleine, abgerundete Ablagerungen auf Kohlefaserbündelspitzen. Die abgebildeten Kohlefaserspitzen stammen alle aus verschiedenen Mikroelektrodenarrays, die unterschiedliche Dauer des injizierten Stroms zur Impedanzreduzierung oder Vergoldung widerspiegeln. Die Bilder zeigen zusätzlich die Parylen-C-Beschichtung, die die Kohlefasern isoliert und jede Signalerfassung von einem anderen Ort als den Spitzen der Fasern verhindert. (A) Rasterelektronenmikroskopische Aufnahme von Kohlefaserspitzen nach dem Einfrieren und einem einzigen Schnitt mit einer Rasierklinge. Maßstabsbalken repräsentieren 10 μm. (B) Wie A, aber dann gefolgt von der Injektion von positivem Strom für 10 s. (C) Wie B, aber dann mit Gold für 5 s galvanisiert. (D) Wie B, aber dann mit Gold für 15 s galvanisiert. (E) Wie B, aber dann mit Gold für 30 s galvanisiert. (F) Wie B, aber dann mit Gold für 120 s galvanisiert. Wir fanden heraus, dass die Galvanisierung für 30 s bei einem Strom von -0,05 μA für elektrophysiologische Aufnahmen optimal war. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
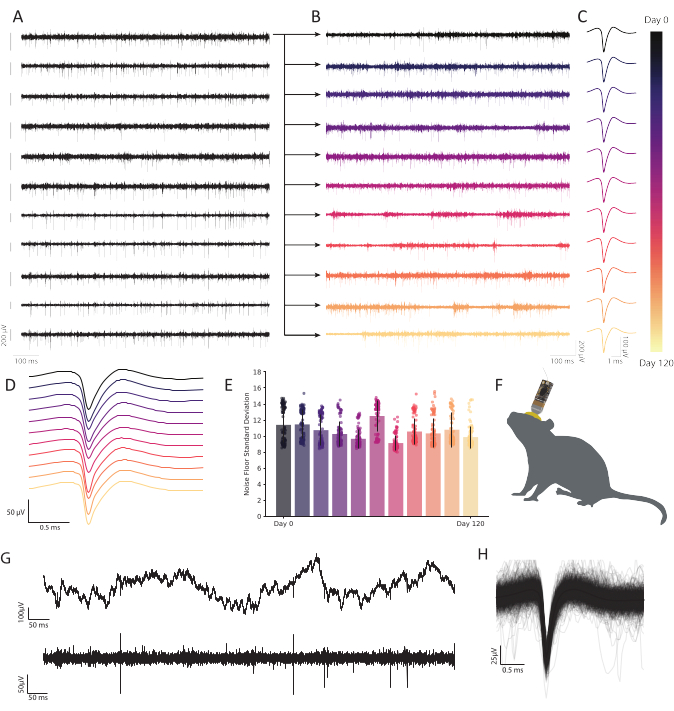
Abbildung 6: Chronische extrazelluläre Aufnahmen im sich frei verhaltenden retrosplenialen Kortex der Maus mit Kohlefaser-Mikroelektroden-Arrays zeigen eine anhaltende, stabile neuronale Aktivität. (A) Elf bandpassierte Spannungsspuren wurden gleichzeitig aufgezeichnet. Nachfolgende Leiterbahnen, die vom ersten Kanal (obere Reihe) aufgezeichnet wurden, werden in B dargestellt, um die Haltbarkeit im Laufe der Zeit zu zeigen. Die verbleibenden zehn Zeilen veranschaulichen die Konsistenz der Aufzeichnungsqualität und zeigen robuste Aktivitäten im gesamten Array. Der Skalierungsbalken links von jeder Spur stellt ein Potential von 200 μV dar. (B) Bandpassed Daten von der gleichen Faser wie in der oberen Spur in A, erweitert, um robuste Aktivität über eine 120-tägige kontinuierliche Aufzeichnung zu zeigen. (C) Clustering zeigt eine robuste Einzeleinheitserkennung über Monate. Traces stellen die durchschnittliche Wellenform einer kontinuierlich beobachtbaren repräsentativen Einzeleinheit über 120 Tage dar, extrahiert aus der Faser, die zu jedem Zeitpunkt in B aufgetragen wird. (D) Mittlere, nicht normalisierte Spike-Wellenformen von C gestapelt, um Konsistenz über die Zeit zu demonstrieren. (E) Kohlefaseraufnahmen zeigen einen stabilen Grundrausch über viele Monate. Die Standardabweichung des Grundrauschens (Spur minus Spiking-Aktivität) in B zeigt keine progressive Änderung des Rauschens. Balken stellen die mittlere Kontamination dar. Fehlerindikatoren stellen die Standardabweichung dar. (F) Maßstabszeichnung einer Maus mit chronisch implantierter CFEA und Kopfunterlage. (G) Die Rohspannungsspur (oben) zeigt 11 Monate nach der Implantation ein robustes LFP. Bandpassed Voltage Trace (unten) zeigt stetige neuronale Aktivität. (H) Mittlere Spikewellenform des Neurons, aufgezeichnet auf der Faser von C, unterlegt durch die ersten 1.000 Inzidenzen von Spiking-Aktivität. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 7: CfEA-Aufnahmen (Carbon Fiber Microelectrode Array) aus dem primären visuellen Kortex des Frettchens. (A) Wellenformen von spikesortierten Einzeleinheiten, die von einem 16-Kanal-CFEA aufgezeichnet wurden. Aktionspotentiale einzelner Neuronen waren oft auf mehreren Kanälen bei leicht unterschiedlichen Amplituden sichtbar. (B) Richtungsabstimmungskurven von ausgewählten Neuronen. Farben entsprechen den aufgezeichneten Einheiten in A. Pfeile zeigen die Richtung der Reizbewegung an. Skalierungsbalken zeigen die Antwortrate an. Fehlerindikatoren zeigen die mittlere Antwort mit Standardfehler an. Die horizontal gestrichelte Linie stellt die spontane Feuerrate derselben Zelle während der Exposition gegenüber einem leeren Bildschirm dar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Dieses Protokoll beschreibt jeden Schritt, der für die Konstruktion einer funktionellen CFEA sowohl für den akuten als auch für den chronischen Gebrauch erforderlich ist. Der beschriebene Prozess ist an die Bedürfnisse des Forschers anpassbar, was ihn zu einer zugänglichen und kostengünstigen Option für die Überwachung einzelner Neuronen über Monate macht. Das Protokoll demonstriert die Machbarkeit der Aufzeichnung sowohl der robusten Einzelaktivität innerhalb von Minuten nach der Implantation in einem anästhesierten Tier als auch über vier Monate in einem wachen, sich verhaltenden Tier, was das Potenzial dieser CFEAs zur Untersuchung kurz- und langfristiger Veränderungen der neuronalen Reaktionen veranschaulicht.
Die beschriebenen Schritte des Protokolls wurden gründlich getestet und im Laufe der Zeit verbessert, um ein effizientes Verfahren zu erhalten, das schnell zu niedrigen Grenzkosten (<$ 100,00) abgeschlossen werden kann, mit der Fähigkeit, eindeutige einzelne Einheiten dicht und stabil über Monate hinweg aufzuzeichnen. Die Bauschritte können in weniger als einem Tag abgeschlossen werden und erzeugen elektrophysiologische Signale, die mit jedem führenden kommerziellen Array vergleichbar sind. Die CFEAs haben auch eine viel kleinere Stellfläche (16-Kanal-Faserbündel hat einen Durchmesser von ~ 26 μm) als ähnliche kommerzielle Arrays, und ihre Biokompatibilität macht sie für den Langzeiteinsatz geeignet13. Wichtig ist, dass es mehrere kritische Schritte und Anweisungen gibt, die befolgt werden müssen, um eine funktionierende CFEA mit vergleichbarer Leistung zu erzeugen.
Aufgrund der Zerbrechlichkeit der Carbonfasern müssen diese mit größter Sorgfalt behandelt werden. Die Handhabung mit einer scharfen Pinzette oder anderen Werkzeugen kann zu einem Bruch der Fasern führen. Darüber hinaus ist es wichtig, die CFEAs in einem Raum mit begrenzter Luftbewegung zu konstruieren, damit die Fasern nicht wegblasen. Beim Anzünden des hinteren Teils der Fasern muss das Feuerzeug nur sehr kurz, für ca. 1 s, in einer Hin- und Herbewegung bewegt werden. Die Schritte nach dieser Entfernung der Isolierung sind entscheidend für den Bau einer Elektrode mit Arbeitskanälen. Die geflammten Spitzen sollten ohne zusätzlichen Kontakt in die Vorrichtung eingezogen werden. Dann, wenn Sie das Becken mit Zahnzement füllen, ist es wichtig, dass der Zement sorgfältig aufgetragen wird und die Kanäle und das Trichterbecken vollständig ausfüllt und die Öffnungen verschließt, ohne sie zu füllen. Der Zahnzement sollte dann vollständig mit UV-Licht ausgehärtet werden, bevor es weitergeht. Sobald dies abgeschlossen ist, sollte Silberfarbe in jeden Kanal injiziert werden, bis sie vollständig gefüllt ist, aber nicht ausläuft. Dies ist der variabelste Schritt im Prozess. Jede Überfüllung kann zu Übersprechen zwischen den Kanälen führen, und eine unzureichende Füllung kann zu einem Verbindungsfehler führen. Wenn sie nicht in der Lage sind, Silberfarbe mit einer 25 G-Nadel zu injizieren, ist es wahrscheinlich, dass die Lösung zu viskos ist und in diesem Fall eine kleine Menge Farbverdünner hinzugefügt werden kann, um eine flüssigere Lösung zu erzeugen. Sobald alle Kanäle gefüllt sind und der Headstage-Stecker eingesetzt ist, ist es wichtig, das Array 24 Stunden lang aushärten zu lassen, bevor der Steckverbinder mit Zahnzement gesichert wird. Wir haben festgestellt, dass dies die Anzahl der angeschlossenen Kanäle verringert hat. Das Auftragen einer großzügigen Menge Zahnzement ist ebenfalls wichtig, damit sich der Stecker bei der Verbindung mit dem Signalerfassungssystem nicht trennt. Wenn sie sich lösen, ist es möglich, die Wiederverbindung mit dem wiederholten Füllen von Kanälen mit Silberfarbe zu versuchen, aber der Benutzer sollte die Impedanzwerte des CFEA testen, um die Anzahl der angeschlossenen Kanäle zu bewerten. Das Aushärten des Zahnzements über Nacht dient auch dazu, eine mögliche Ablösung zu verhindern.
Die Messung der Impedanz der Elektrode liefert eine genaue Schätzung der angeschlossenen Kanäle. Dies kann nach dem Eintauchen der Erdungs- und Referenzdrähte und der Kohlefaserspitzen in PBS erfolgen. Wir haben beobachtet, dass eine hohe Impedanz (>15 MΩ) auf einen offenen, unverbundenen Kanal hinweist. Vor dem Einspritzen von Strom und der Galvanisierung kann ein angeschlossener Kanal einen Bereich von Impedanzwerten aufweisen, die bei diesem Prozess deutlich abnehmen sollten. Die durchschnittliche Anzahl der angeschlossenen Kanäle (Impedanz < 4 MΩ nach Strominjektion) pro 16-Kanal-Elektrode betrug 12,96 ± 2,74 (mittlere ± SD; N = 48 Elektroden). Eine Reihe von Galvanikzeiten wurde getestet, und 30 s erzeugten eine überlegene Signalisolierung zwischen den Aufzeichnungsstellen (Abbildung 5). Während es gut etabliert ist, dass PEDOT-pTS12,24,25,26 und PEDOT-TFB21 zuverlässige Optionen für die Vorbereitung von Kohlefaser-Aufnahmestellen bieten, fanden wir heraus, dass die Beschichtung mit Gold, eine bewährte und zuverlässige Methode zur Galvanisierung von Elektroden für die chronische Implantation27,28 , erhöhte die Leichtigkeit der Implantation und verhinderte, dass die Elektrodenspitzen zusammenklumpten. Bei der Herstellung von Endimpedanzwerten von durchschnittlich weniger als 0,2 MΩ erweist sich diese Methode als vergleichbar mit Werten, die mit PEDOT-TFB21 und PEDOT-pTS26erreicht wurden.
Bei der Implantation des Mikroelektrodenarrays ist es wichtig, das Einsetzen der Kohlefaserspitzen unter dem Mikroskop visuell zu verfolgen. Eine erfolgreiche Einführung sollte offensichtlich sein, ohne dass die Fasern verbogen werden. Wenn die Fasern zu knicken scheinen, ist es unwahrscheinlich, dass sie erfolgreich in das Gehirn gelangen. In diesem Fall sollte der Winkel der Sonde für einen zweiten Versuch eingestellt werden. Dieser Vorgang kann fortgesetzt werden, bis das Einsetzen der Sonde erfolgreich ist. Sobald sich die Elektrode in der gewünschten Tiefe befindet, haben wir festgestellt, dass das Warten auf mindestens 30 Minuten es der Sonde ermöglicht, sich mit einer optimalen Signalerfassung (akute Aufzeichnungen) zufrieden zu geben.
Die beschriebenen CFEAs bieten neben ihrer geringen Stellfläche und Biokompatibilität aufgrund ihrer einfachen Konstruktion und niedrigen Kosten eine robuste, anpassbare Alternative zu kommerziellen Arrays. Die größte Einschränkung der in diesem Protokoll beschriebenen CFEAs ist ihre Skalierbarkeit. Aufgrund der manuellen Natur ihrer Konstruktion ist die Skalierung auf Designs mit Hunderten von Aufzeichnungsseiten möglicherweise nicht praktikabel. Darüber hinaus werden Fortschritte bei der Herstellung von Mikroelektroden-Arrays unter Verwendung der Nanotechnologie Bevölkerungsaufnahmen in größerem Maßstab ermöglichen als die hier beschriebenen Methoden. Dieses Protokoll bietet jedoch CFEA-Zugänglichkeit für Labore, die an der Tischfertigung von Kohlefaserelektroden interessiert sind. Wir beobachteten keinen Verlust der Stabilität oder verminderte Robustheit in der Spike-Amplitude über die Dauer der 120-tägigen chronischen Experimente, wie ein repräsentativer einzelner Kanal zeigt, der für unsere Beobachtungen auf dieser Zeitskala typisch ist (Abbildung 6A-E). Darüber hinaus zeigen die CFEAs die Kapazität für eine anhaltende Einzeleinheitsaktivität, da vier Einzeleinheiten 11 Monate nach der Implantation in die Maus erkennbar blieben (Abbildung 6G,H). Es ist auch möglich, stabile Einzelgeräteaufnahmen akut zu erhalten (Abbildung 7), was einen Vorteil gegenüber vielen anderen kommerziellen Elektroden für die Untersuchung einzelner Neuronen über kurze Zeiträume bietet. Die Entwicklung solcher flexiblen, biokompatiblen Sonden mit minimalen Durchmessern wird es in Zukunft ermöglichen, komplexe Prozesse zu untersuchen. Diese Werkzeuge werden einen erheblichen Nutzen bei der Weiterentwicklung der neuronalen Technologie bieten, einschließlich Anwendungen in Gehirn-Maschine-Schnittstellen (BMIs), die eine kontinuierliche Langzeitstabilität erfordern29.
Offenlegungen
Die Autoren erklären keine finanziellen Interessenkonflikte.
Danksagungen
Wir möchten Greg Guitchounts für die Anleitung bei der Elektrodenkonstruktion und -konstruktion und Tim Gardner für die Öffnung seines Labors und seiner Einrichtungen für uns danken. Wir danken Christos Michas für seine Unterstützung bei der PDS-Nutzung in der Bio-Interface and Technology Core Facility und Neil Ritter, Jon Spyreas und David Landesman für ihre Hilfe bei der Entwicklung früher Versionen der 16-Kanal-Vorrichtung. Wir danken Tim Cavanaugh für seine Unterstützung bei der SEM-Bildgebung am Center for Harvard Nanoscale Systems in Harvard.
Materialien
| Name | Company | Catalog Number | Comments |
| #10 scalpel blade | Fisher Scientific | 14-840-15 | Building tool |
| 16-channel CFEA Jig | Realize Inc. | CFMA component | |
| 16-channel Omnetics connector | Omnetics | A79014-001 | CFMA component |
| 25 G needle | Fisher Scientific | 14-840-84 | Building tool - sharp-tipped |
| 30 G needle | Fisher Scientific | 14-841-03 | Building tool |
| 31 G stainless steel 304 hypodermic round tubing | Small Parts Inc | B000FMYN38 | For guide tube |
| 32-channel CFEA jig | Realize Inc. | CFMA component | |
| 32-channel Omnetics connector | Omnetics | A79022-001 | CFMA component |
| 6 in cotton tip applicators | Fisher Scientific | 22-363-156 | Building tool |
| Acetone | Fisher Scientific | A16P4 | Building tool |
| AutoCad 3D printing software | Autodesk | Computer-aided design tool/ 3D modeling software | |
| Autodesk Fusion 360 | Autodesk | Computer-aided design tool/ 3D modeling software | |
| BD disposable syringes | Fisher Scientific | 14-823-30 | 1 mL |
| Carbon fibers | Good Fellow USA | C 005725 | 7 μm epoxy sized |
| Cassettes and cassette holder | For coating fibers | ||
| Clear tape | Scotch | For coating raw fibers | |
| Deionized water | Electroplating component | ||
| Double-sided tape | Scotch | For coating raw fibers | |
| Flowable Dental Composite | Pentron | Flow-It ALC | CFMA component/ UV cured dental cement |
| Gold plating solution | Sifco ASC | 5355 | 10.0-20.0% glycerol, 1.0-5.0% ethylenediamine, 1.0-5.0% acetic acid (ethylenedinitrilo)tetra-, dipotassium salt, 5.0-10.0% butanoic acid, mercapto-monogold(1+) sodium salt, 1.0–5.0% potassium metabisulfite, 55.0-82.0% water |
| Jewelry clamp | Amazon | B00GRABH9K | Building tool |
| JRClust | Ferret spike sorting software | ||
| Lighter | BIC | LCP62DC | Building tool |
| Micromanipulator | Scientifica | PS-7000C | For guide tube |
| Microscissors | Fisher Scientific | 08-953-1B | Building tool |
| MountainSort | Mouse spike sorting software | ||
| NanoZ 16-channel adapter | Multi-channel systems | ADPT-nanoZ-NN-16 | Electroplating component |
| NanoZ 32-channel adapter | White Matter | NZA-OMN-32 rev A | Electroplating component |
| NanoZ multi-electrode impedance tester | White Matter | Electroplating component | |
| Parafilm | Fisher Stockroom | 13-374-10 | Semi-transparent, flexible film with adhesive properties |
| Parylene 'C' Dimer | Specialty Coating Systems | 980130-C-01LBE | For coating raw fibers |
| PEG 8000 | Fisher Scientific | 25322-68-3 | Electroplating component |
| Phosphate-buffered saline | Electroplating component | ||
| Polyimide tubing | MicroLumen | BRAUNI001 | For guide tube |
| Rotary tool | Dremel | 300124 | For guide tube |
| Scalpel handle | Fine Science Tools | 10003-12 | Building tool |
| Silver conductive coating | MG Chemicals | 842AR Super Shield | CFMA component |
| Stereo microscope with range 6.7:1 | Motic | SMZ-168 | Building tool |
| Sticky notes | Post-it | Building tool | |
| Tissue wipes | Kimtech Science | 34155 | Building tool |
| Tungsten wire | A-M Systems | 797550 | CFMA component |
| UV curing wand | Woodpecker | Building tool | |
| Vacuum deposition chamber | Specialty Coating Systems | Labcoter 2 (PDS 2010) |
Referenzen
- Galvani, L. De viribus electricitatis in motu musculari commentarius. , Academy of Sciences. Bologna. (1791).
- Buzsaki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nature reviews. Neuroscience. 13 (6), 407-420 (2012).
- Ledochowitsch, P., et al. On the correspondence of electrical and optical physiology in in vivo population-scale two-photon calcium imaging. bioRxiv. , 800102(2019).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Seymour, J. P., Wu, F., Wise, K. D., Yoon, E. State-of-the-art MEMS and microsystem tools for brain research. Microsystems and Nanoengineering. 3 (1), 16066(2017).
- Kerr, J. N., Denk, W. Imaging in vivo: watching the brain in action. Nature reviews. Neuroscience. 9 (3), 195-205 (2008).
- Hong, G., Lieber, C. M. Novel electrode technologies for neural recordings. Nature reviews. Neuroscience. 20 (6), 330-345 (2019).
- Chung, J. E., et al. High-density, long-lasting, and multi-region electrophysiological recordings using polymer electrode arrays. Neuron. 101 (1), 21-31 (2019).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551 (7679), 232-236 (2017).
- Kozai, T. D., Jaquins-Gerstl, A. S., Vazquez, A. L., Michael, A. C., Cui, X. T. Brain tissue responses to neural implants impact signal sensitivity and intervention strategies. ACS Chemical Neuroscience. 6 (1), 48-67 (2015).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Kozai, T. D., et al. Ultrasmall implantable composite microelectrodes with bioactive surfaces for chronic neural interfaces. Nature Materials. 11 (12), 1065-1073 (2012).
- Chen, R., Canales, A., Anikeeva, P. Neural recording and modulation technologies. Nature Reviews Materials. 2 (2), 16093(2017).
- Szostak, K. M., Grand, L., Constandinou, T. G. Neural interfaces for intracortical recording: requirements, fabrication methods, and characteristics. Frontiers in Neuroscience. 11, 665(2017).
- Subbaroyan, J., Martin, D. C., Kipke, D. R. A finite-element model of the mechanical effects of implantable microelectrodes in the cerebral cortex. Journal of Neural Engineering. 2 (4), 103-113 (2005).
- Park, S., et al. One-step optogenetics with multifunctional flexible polymer fibers. Nature Neuroscience. 20 (4), 612-619 (2017).
- Guo, Y., et al. Polymer composite with carbon nanofibers aligned during thermal drawing as a microelectrode for chronic neural interfaces. ACS Nano. 11 (7), 6574-6585 (2017).
- Armstrong-James, M., Millar, J. Carbon fibre microelectrodes. Journal of Neuroscience Methods. 1 (3), 279-287 (1979).
- Garris, P. A., Ciolkowski, E. L., Pastore, P., Wightman, R. M. Efflux of dopamine from the synaptic cleft in the nucleus accumbens of the rat brain. Journal of Neuroscience: The Official Journal of the Society of Neuroscience. 14 (10), 6084-6093 (1994).
- Guitchounts, G., Markowitz, J. E., Liberti, W. A., Gardner, T. J. A carbon-fiber electrode array for long-term neural recording. Journal of Neural Engineering. 10 (4), 046016(2013).
- Guitchounts, G., Cox, D. 64-channel carbon fiber electrode arrays for chronic electrophysiology. Scientific Reports. 10 (1), 3830(2020).
- Ma, Z., Turrigiano, G. G., Wessel, R., Hengen, K. B. Cortical circuit dynamics are homeostatically tuned to criticality in vivo. Neuron. 104 (4), 655-664 (2019).
- Popovic, M., et al. Development of cross-orientation suppression and size tuning and the role of experience. Journal of Neuroscience: The Official Journal of the Society of Neuroscience. 38 (11), 2656-2670 (2018).
- Patel, P. R., et al. Chronic in vivo stability assessment of carbon fiber microelectrode arrays. Journal of Neural Engineering. 13 (6), 066002(2016).
- Welle, E. J., et al. Ultra-small carbon fiber electrode recording site optimization and improved in vivo chronic recording yield. Journal of Neural Engineering. 17 (2), 026037(2020).
- Patel, P. R., et al. Insertion of linear 8.4 µm diameter 16 channel carbon fiber electrode arrays for single unit recordings. Journal of Neural Engineering. 12 (4), 046009(2015).
- Ferguson, J. E., Boldt, C., Redish, A. D. Creating low-impedance tetrodes by electroplating with additives. Sensors and Actuators. A, Physical. 156 (2), 388-393 (2009).
- Vafaiee, M., Vossoughi, M., Mohammadpour, R., Sasanpour, P. Gold-plated electrode with high scratch strength for electrophysiological recordings. Scientific Reports. 9 (1), 2985(2019).
- Lebedev, M. A., Nicolelis, M. A. Brain-machine interfaces: From basic science to neuroprostheses and neurorehabilitation. Physiological Reviews. 97 (2), 767-837 (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten