Method Article
Construção e Implementação de Matrizes de Microeletrodos de Fibra de Carbono para Gravações In Vivo Crônicas e Agudas
Neste Artigo
Resumo
Este protocolo descreve um procedimento para a construção de matrizes de microeletrodos de fibra de carbono para gravações eletrofisiológicas in vivo crônicas e agudas em camundongos (Mus musculus) e furão(Mustela putorius furo) de múltiplas regiões cerebrais. Cada passo, após a compra de fibras de carbono bruto para implantação de matriz de microeletrodos, é descrito em detalhes, com ênfase na construção de matriz de microeletrodos.
Resumo
As matrizes de eletrodos multicanais oferecem uma visão do cérebro em funcionamento e servem para elucidar processos neurais nos níveis unicelulares e circuitos. O desenvolvimento dessas ferramentas é crucial para a compreensão de comportamentos complexos e cognição e para o avanço das aplicações clínicas. No entanto, continua a ser um desafio registrar densamente das populações celulares de forma estável e contínua durante longos períodos de tempo. Muitos eletrodos populares, como tetrodes e matrizes de silício, apresentam grandes diâmetros cruzados que produzem danos após a inserção e provocam respostas crônicas de tecido reativo associadas à morte neuronal, dificultando o registro de atividade neural estável e contínua. Além disso, a maioria dos feixes de fios exibem amplo espaçamento entre os canais, impedindo a gravação simultânea de um grande número de células agrupadas em uma pequena área. As matrizes de microeletrodos de fibra de carbono descritas neste protocolo oferecem uma solução acessível a essas preocupações. O estudo fornece um método detalhado para a fabricação de matrizes de microeletrodos de fibra de carbono que podem ser usados para gravações agudas e crônicas in vivo. As propriedades físicas desses eletrodos as tornam ideais para gravações de longo prazo estáveis e contínuas em altas densidades celulares, permitindo ao pesquisador fazer gravações robustas e inequívocas de unidades únicas ao longo dos meses.
Introdução
Eletrodos e matrizes de eletrodos são ferramentas valiosas para entender como o cérebro processa informações no nível neuronal. Embora as gravações eletrofisiológicas tenham sido alcançáveis por mais de dois séculos1,ainda não é possível medir simultaneamente a atividade de circuitos neurais inteiros na resolução espacial e temporal necessária para capturar o espigão de neurônios individuais. Embora métodos não invasivos, como a eletroencefalografia2,topografia de emissão de pósitrons3, e ressonância magnética funcional4 permitam medições cerebrais integrais, não conseguem alcançar a resolução espacial e temporal necessária para resolver a atividade dos circuitos neurais2,5. Em contraste, métodos de imagem como imagens ópticas usando corantes sensíveis à tensão ou indicadores de cálcio geneticamente codificados podem alcançar resolução espacial uni unitária, mas apresentam problemas como baixa resolução temporal e pouca seletividade3,4,5,6. Gravações elétricas são uma alternativa poderosa a esses métodos. Os eletrodos de gravação fornecem resolução temporal incomparável e permitem ao usuário fazer medições com precisão de tempo de pico em qualquer região do cérebro7. Além disso, matrizes multielerodas cronicamente implantadas (MEAs) permitem em larga escala (dezenas a centenas de células), gravações unicelulares em animais comportados durante um período de dias atémeses 8,9. No entanto, sondas de silício que registram em densidades mais altas têm uma grande pegada e são altamente invasivas, e matrizes cronicamente implantadas muitas vezes geram uma resposta de inflamação, encapsulamento tecidual e morte neuronal10,11,12,13.
As limitações dos eletrodos existentes resultaram em inovações recentes que permitem gravações estáveis, de alta resolução e de longo prazo. Eletrodos típicos consistem em um condutor metálico, como tungstênio ou iídio de platina, ou são à base de silício ou polímero. Embora as matrizes de microfios baseadas em metal possam manter gravações estáveis a longo prazo, elas têm uma pegada muito maior, com um único fio de diâmetro variando de 10-200 μm14. Em contraste, as matrizes de eletrodos à base de silício produzem gravações com alta resolução espacial, mas devido ao seu design relativamente rígido, eles são tipicamente incapazes de manter o sinal e o registro dos mesmos neurônios ao longo de muitosmeses 15. Desenvolvimentos recentes em matrizes baseadas em silício resultaram em eletrodos que podem realizar gravações crônicas de forma confiável, mas essas matrizes não podem ser usadas para gravar de regiões cerebrais profundas em animais maiores e são destinadas a gravações lineares9. Os avanços nos conjuntos de polímeros resultaram em maior flexibilidade e estabilidade de registro de unidades únicas e oferecem o potencial para gravações de alta densidade em um futuro próximo, mas com disponibilidade limitada atualmente8,16,17. As fibras de carbono permitem gravações de alta densidade com materiais fora da prateleira que são descritos aqui.
Microeletrodos de gravação de fibra de carbono são usados há décadas, com os primeiros eletrodos de fibra de carbono consistindo de uma única fibra de carbono inserida em uma micropipette de vidro. Estes microelerodes foram usados para gravações extracelulares uni unitárias, e embora a relação sinal-ruído fosse comparável às melhores microeletrodos de tungstênio em vidro, eram vantajosas devido à sua flexibilidade, valores de impedância mais baixos e simplicidade para fabricar18,19. Os esforços para desenvolver matrizes de eletrodos de fibra de carbono aceleraram recentemente devido às capacidades de biosensação das fibras de carbono. Além do aumento da biocompatibilidade e da condutividade elétrica excepcional, eles apresentam um conjunto único de propriedades, incluindo resistência à alta temperatura, baixa densidade relativa, alta resistência à tração, baixa rigidez de dobra, sensibilidade de alta detecção e uma pequena área transversal10,12. Todas essas propriedades motivaram o desenvolvimento de matrizes de microeletrodos de fibra de carbono (CFEAs) que facilitam registros crônicos, estáveis e de alto rendimento de neurônios únicos. Esses CFEAs agora podem ser criados manualmente20,21 ( Figura1), produzindo matrizes de microeletrídrica que podem conter neurônios únicos ao longo de meses. Descrito aqui é um processo de construção acessível para CFEAs que foi adaptado de duas maneiras para registros agudos e crônicos de neurônios individuais em duas espécies.
Protocolo
Todos os procedimentos experimentais foram aprovados pela Brandeis University ou pelo Comitê de Uso e Cuidados e Uso de Animais da Universidade de Washington. Os dados foram coletados de um furão fêmea e um rato macho.
1. Preparação de fibras e ferramentas de carbono
- Preparação de fibras comerciais de carbono
- Corte tiras de 8 cm do feixe de fibras do tamanho da epóxi. Coloque as tiras paralelas em um cadinho e asse em um forno a 400 °C por 6h para remover o epóxi das fibras comerciais. Em seguida, armazene as fibras assadas em uma placa de Petri padrão ou em um tubo cônico.
NOTA: Foram utilizadas fibras com diâmetro de 7 μm. Outros grupos utilizaram fibras de 4 μm20,21. - Prepare fitas para segurar fibras individuais. Use uma impressora 3D ou cortador a laser para criar as fitas e o porta-fitas associada (ver Figura 2).
- Coloque as fibras nas fitas. Comece colocando um pedaço de fita dupla face nos dois lados longos do, alinhando a borda da fita com a borda interna do. Separe as fibras individuais do pacote assado e coloque-as paralelamente ao lado curto do, mantendo 2-3 mm entre as fibras. Certifique-se de caber 20-30 fibras em cada. Sele as fibras no lugar colocando fita clara sobre a fita de dois bastões. Coloque as fitas cheias no porta-fitas.
NOTA: Para um construtor experiente, encher um de fibras levará ~1 h. Para o construtor iniciante, este processo provavelmente levará ~1,5-3 h. Há dez em uma caixa, e dois porta-fitas podem caber na câmara de depoimento parileno. - Cubra as fibras individuais com parileno C usando uma câmara de deposição de vácuo comercial. Uma única corrida é necessária para o revestimento. Meça 2,3 g de parileno para cada corrida. Dois porta-fitas cabem na câmara de cada vez. O procedimento de revestimento leva ~2 h por corrida.
NOTA: Uma medição de 2,3 g de parileno C fornece aproximadamente 1 μm de revestimento. As fibras revestidas podem ser armazenadas indefinidamente.
- Corte tiras de 8 cm do feixe de fibras do tamanho da epóxi. Coloque as tiras paralelas em um cadinho e asse em um forno a 400 °C por 6h para remover o epóxi das fibras comerciais. Em seguida, armazene as fibras assadas em uma placa de Petri padrão ou em um tubo cônico.
- Preparação da ferramenta de manipulação de fibra de carbono
- Enrole um pequeno pedaço de filme adesivo flexível em torno de uma agulha de 30 G, formando um ponto afiado, mas flexível com o filme adesivo.
NOTA: Embrulhar uma ponta de agulha com parafilme e esticar o parafilme ao fazê-lo, cria um leve efeito adesivo que permite ao usuário pegar e manobrar fibras individuais.
- Enrole um pequeno pedaço de filme adesivo flexível em torno de uma agulha de 30 G, formando um ponto afiado, mas flexível com o filme adesivo.
2. Design e fabricação
- Selecione o design de gabarito apropriado necessário com base nas especificações do eletrodo a ser construído. Isso será baseado no número de canais necessários, juntamente com quaisquer adições de design.
NOTA: Jig refere-se ao bloco impresso em 3D que fornece uma âncora para eletrodos e conexões elétricas. - Crie ou altere o design específico do gabarito usando o software CAD (Computer-Aided Design, design auxiliado por computador).
- Use uma empresa de impressão 3D ou o laboratório de fabricantes institucionais para imprimir os gabaritos usando uma impressora 3D SLA de alta resolução.
3. Montagem do conjunto de microeletrodos de fibra de carbono (CFEA)
NOTA: Este passo leva ~2 h para um construtor experiente e ~6 h para um construtor novato. Execute todas as etapas de montagem do CFEA e passos de agrupamento de fibras sob um microscópio estéreo de 10x. Montagem completa do CFEA em um ambiente com movimento mínimo do ar, pois isso pode perturbar o processo de construção.
- Escolha o gabarito apropriado necessário para construir o eletrodo desejado.
- Utilizando cortadores de arame metálico, corte dois pedaços de fio de tungstênio de diâmetro 0,003 em (76,2 μm), cerca de 7 cm de comprimento.
- Alimente cada fio através do canal apropriado na extremidade do conector do gabarito (GND e REF). Alimente o suficiente até que as duas extremidades sejam iguais em comprimento, e depois torça-as juntas para fixá-las no gabarito.
NOTA: Para o design agudo de 16 canais, certifique-se de que o fio metálico se encaixe dentro do cume no gabarito.- Aplique cimento dental curado por UV para fixar o fio. Certifique-se de não obter qualquer cimento dental dentro do canal aberto pelo que o fio é alimentado.
NOTA: O usuário deve usar proteção ocular filtrante UV durante todos os procedimentos relacionados com UV para evitar possíveis danos oculares. Muitas varinhas de cura UV têm filtros de visualização embutidos. - Usando a varinha de cura UV, cure o cimento dental por 20 s.
- Segure o gabarito na vise das joias por um dos braços do gabarito. Oriente o gabarito para que um dos lados seja paralelo ao chão.
- Oriente o gabarito e o vise sob o microscópio para que o conector final, a bacia e a ponta do funil sejam visíveis. Oriente o gabarito para que o funil esteja apontando para longe do usuário e a extremidade do conector esteja voltada para o usuário.
- Reúna as ferramentas de fibra de carbono e uma agulha de 25 G de ponta afiada.
- Coloque um com fibras revestidas de parileno-C em uma folha branca de papel, coloque o lado para cima para que as fibras não estejam diretamente no papel.
- Use a agulha de 25 G para cortar uma única fibra de carbono do. Faça isso deslizando a ponta da agulha contra o de onde a fibra a ser removida emerge.
- Se construir usando meias fibras, corte uma extremidade da fibra como descrito acima. Oriente a fibra para que ela fique reta, e usando a agulha, corte a fibra ao meio cortando a fibra contra o papel. Para cortar a outra metade, que ainda está conectada ao, segure a ponta livre da fibra com a ferramenta de fibra de carbono que foi feita anteriormente, e depois use a agulha para cortar a fibra ainda conectada ao como descrito acima.
- Se construir usando fibras completas, corte uma extremidade da fibra como descrito acima. Use a ferramenta de fibra de carbono previamente feita e segure a extremidade livre da fibra que acabou de cortar. Usando a agulha, corte a outra extremidade da fibra longe do.
- Pegue a fibra de carbono usando a ferramenta de fibra de carbono feita anteriormente. Pegue a fibra para que uma extremidade tenha cerca de 1 cm de comprimento da ferramenta.
- Use a ferramenta de fibra de carbono com a fibra presa e alimente a extremidade mais curta da fibra através da peça do funil a partir da bacia média do gabarito. Use um microscópio para visualizar.
- Continue alimentando a fibra através do funil de gabarito até que a maior parte do comprimento da fibra esteja passando (ver Figura 3A).
- Alimente a porção traseira da fibra através de um canal disponível usando a ferramenta de fibra de carbono anteriormente feita. Alimente a fibra pela parte de trás até que cerca de 5 mm de fibra esteja saindo pela parte de trás. Corte para tamanho, se necessário (ver Figura 3B).
NOTA: Não alimente fibras em canais que contenham os fios metálicos.
- Encha o restante dos canais com fibras de um lado do gabarito, seguindo as instruções dadas acima.
NOTA: Ao alimentar fibras no funil, alimente metade das fibras em cada divisão do funil, com a metade direita dos canais na divisão direita e a metade esquerda dos canais na divisão esquerda. Quando as fibras estão em contato próximo dentro do funil, há atrito desfavorável entre as fibras que leva às fibras existentes soltas ou quebradas enquanto alimentam novas fibras no gabarito. Esta divisão em quatro seções fornece algum alívio, pois as fibras são mantidas em feixes menores até um passo posterior. - Use uma roda de centelha padrão mais leve e passe rapidamente a chama sobre as fibras expostas na extremidade do conector. Certifique-se de que o isolamento de todas as fibras seja removido nas extremidades (ver Figura 3C).
NOTA: A porção das fibras expostas à chama deve parecer um pouco mais fina que o resto da fibra. - Alimente a fibra inflamada através do gabarito para que a porção da fibra exposta à chama esteja agora dentro do canal. Certifique-se de que nenhuma fibra está saindo da parte de trás do gabarito (ver Figura 3D).
NOTA: Use a ferramenta de fibra de carbono para agarrar a fibra de dentro da bacia e alimentar a fibra flameada através do gabarito. Não toque na porção das fibras expostas à chama, pois esta porção é mais frágil. - Aplique cimento dental curado por UV nas fibras da bacia do gabarito. Encha toda a bacia para cobrir as aberturas dos canais e a abertura do funil (ver Figura 3E).
- Use a luz UV e cure o cimento dental para 20 s. Cura para mais 20 s se o cimento dental não estiver completamente curado.
NOTA: Certifique-se de que o cimento dental não viaja dentro dos canais.
- Use a luz UV e cure o cimento dental para 20 s. Cura para mais 20 s se o cimento dental não estiver completamente curado.
- Retire o gabarito do torno, vire-o e fixe o gabarito no torno como previamente fixado. Certifique-se de que o lado que contém as fibras está agora de cara para baixo.
- Preencha o lado vazio do gabarito com fibras de carbono exatamente como descrito acima.
- Uma vez que todos os canais tenham fibras, e as fibras sejam fixadas com cimento dental, retire o gabarito do torno e oriente o gabarito para que o funil esteja apontando para baixo. Fixar o gabarito na víse para que a extremidade do conector esteja apontando para cima.
- Reúna uma agulha de 25 G de ponta afiada, uma seringa de 1 mL, tinta condutora prateada, aplicadores com ponta de algodão, diluente de tinta, lenços de tecido e o conector de headstage apropriado.
NOTA: Certifique-se de que a tinta condutora prateada está bem misturada e é uma solução homogênea. Não deixe a tinta secar. - Desenhe 0,3 mL de tinta prateada na seringa de 1 mL e, em seguida, conecte a agulha de 25 G de ponta afiada.
- Insira cuidadosamente a agulha em um canal até parar pelo cimento dentário. Deprimir lentamente a seringa enquanto remove a agulha do canal para encher o canal com tinta (ver Figura 3E).
- Limpe qualquer tinta da agulha, e depois continue para o próximo canal.
- Encha todos os canais com tinta.
NOTA: Podem ser necessárias passagens adicionais nos canais, pois a pintura se instala nos canais durante os primeiros minutos.
- Encha todos os canais com tinta.
- Mergulhe um aplicador de ponta de algodão no diluente de tinta e, em seguida, limpe a base do gabarito de qualquer tinta na superfície. Alguns aplicadores com ponta de algodão podem ser necessários para isso.
NOTA: Aplicadores com ponta de algodão não mergulhados em diluentes de tinta também podem ser úteis para limpar o gabarito. - Insira o conector do headstage na orientação adequada alinhando os pinos com os canais. Certifique-se de que o conector do headstage está sentado em linha reta e está o mais alinhado possível ao gabarito (ver Figura 3F).
- Deixe o gabarito curar por 24 h.
- Fixar o conector do headstage ao gabarito usando cimento dental curado UV, aplicando cimento dental ao longo da borda onde o conector do headstage encontra o gabarito. Cura UV usando uma luz UV para 20 s.
- Aplique cimento dental curado por UV para fixar o fio. Certifique-se de não obter qualquer cimento dental dentro do canal aberto pelo que o fio é alimentado.
4. Embalagem de pacote de fibra
NOTA: Leva aproximadamente 30 min para realizar esta etapa. Complete esta etapa para os eletrodos usados em modelos animais com uma camada grossa de pia mater. Reforce o feixe de fibras para minimizar a dobra. Nos procedimentos do mouse, esta etapa pode não ser necessária.
- Junte o feixe de fibras em um único eixo usando a tensão da água. Use uma pipeta de transferência para executar uma gota de água da ponta do funil até a ponta do feixe enquanto o eletrodo é fixado em pé em um torno.
- Comece com a aplicação de uma camada de cimento dental de cerca de 1,5 mm de espessura ao redor do feixe na ponta do funil. Cure o cimento dentário com 20 s de luz UV.
NOTA: Para gravações corticais, não é necessária mais embalagem. Para regiões cerebrais mais profundas, proteja um tubo-guia ao redor do feixe. - Construção do tubo-guia e inserção do feixe no tubo-guia
- Meça e corte o comprimento desejado da tubulação de poliimida. Certifique-se de que o comprimento do tubo de poliimida deixa 2 mm de pontas de fibra de carbono livres. Meça e corte um pedaço de tubo de metal de 30 G 2 mm mais curto que o tubo de poliimida. Use uma ferramenta rotativa para remover quaisquer bordas afiadas na tubulação metálica. Insira a tubulação de poliimida dentro do tubo metálico.
- Posicione o eletrodo em um torno com o feixe de fibra de carbono apontando para cima. Fixar a tubulação montada a um micromanípulo e, usando um microscópio, abaixe-a cuidadosamente sobre o feixe de fibras. Fixar a tubulação na base de cimento dental existente usando uma camada adicional de cimento dental. Cure o cimento dentário com 20 s de luz UV.
NOTA: O processo de construção pode ser pausado aqui.
5. Preparação da ponta do eletrodo
NOTA: Leva aproximadamente 30 minutos por matriz para executar esta etapa.
- Corte os eletrodos ao comprimento desejado.
- Na preparação para cortar a ponta do eletrodo, empilhe notas pegajosas para construir uma plataforma de aproximadamente 1,5 mm de altura. Meça, a partir da borda da plataforma, o comprimento do eletrodo desejado e marque essa distância. A plataforma atuará como um guia para o corte.
- Abaixe o eletrodo em um béquer de água desionizada ou destilada até que a ponta do funil esteja totalmente submersa, incline-se primeiro e segure normalmente à superfície. Unindo as fibras de carbono individuais removendo o eletrodo da água. A tensão superficial unirá o feixe. Deixe o eletrodo secar por 30 minutos.
- Coloque a lâmina de bisturi nº 10 na alça. Congele o bisturi e o eletrodo colocando-os em um congelador de -18 °C por pelo menos 5 min.
- Coloque o eletrodo para que as fibras coloquem descarga na superfície do guia (preparado na etapa 5.1.1). Corte as fibras ao comprimento desejado com o bisturi, usando um movimento de rolamento. Complete esta etapa rapidamente para garantir que o eletrodo e o bisturi ainda estejam congelados (ver Figura 3G).
- Injete corrente positiva para reduzir a impedância de pontas de eletrodos.
- Conecte o eletrodo ao testador de impedância multieletrísora usando o adaptador apropriado (ver Tabela de Materiais). Ponta de eletrodo inferior ~2 mm em um tubo de microcentrifuge de 0,1 M de soro fisáfero tamponado com fosfato (PBS). Insira o fio de aterramento no tubo de microcentrifuuagem.
- Injete corrente com a amplitude e duração escolhidas.
NOTA: Esta etapa destina-se a reduzir os valores de impedância na ponta do CFEA. Neste estudo, foram inseridos os seguintes parâmetros na interface gráfica do usuário do software de eletroplacar: Corrente: 0,100 μA; Duração: 10 s; Pausa: 1 s. Esse processo pode ser repetido conforme necessário, por canal, até que as impedâncias eletrodos atendam aos valores desejados (ver Figura 4C). - Uma vez que os valores de impedância são como desejado, enxágue as fibras em água desionizada ou destilada para limpar.
- Eletroplaca na solução de revestimento de ouro.
NOTA: Esta etapa deve ser feita pouco antes da implantação (mesmo dia).
ATENÇÃO: Alguns dos produtos químicos utilizados na preparação das pontas cfea são corrosivos, incluindo a solução de revestimento de ouro. Consulte o CET previamente à contratação do financiamento.
NOTA: Para fornecer rigidez ao feixe de fibras, o usuário pode criar uma solução de revestimento de ouro, solubilizando peg8000 em água desionizada ou destilada a 1 mg/mL. Em seguida, combine 625 μL solubilizado PEG8000 e 375 μL solução de revestimento de ouro e solução de vórtice para 10 s para misturar. O PEG8000 se dissolverá após a inserção de fibras no cérebro.- Abaixe a ponta do feixe de eletrodos ~2 mm no tubo de microcentrifuuagem da mistura de revestimento. Insira o fio de aterramento no tubo de microcentrifuuagem.
- Defina parâmetros apropriados para eletroplacar. Neste estudo, foram inseridos os seguintes parâmetros na interface gráfica do usuário do software de eletroplacar: Corrente: -0,05 μA; Duração: 30 s; Pausa: 5 s.
- Enxágüe bem as fibras com água desionizada ou destilada. Neste momento, meça novamente os valores de impedância, se desejar.
6. Inserção no cérebro: Cirurgia de sobrevivência, camundongo(Mus musculus) e cirurgia de não sobrevivência, furão(Mustela putorius furo)
NOTA: Os procedimentos cirúrgicos devem seguir o protocolo padrão em conformidade com o IACUC. Para informações detalhadas, consulte Ma et al.22 para o protocolo de cirurgia de sobrevivência e Popovic et al.23 para protocolo de cirurgia de não sobrevivência. Siga os procedimentos cirúrgicos assépticos pelas diretrizes do ASC para cirurgia de sobrevivência em espécies de roedores. Estes incluem autoclaving todas as ferramentas cirúrgicas e materiais a 135 °C por 15 min e tratamento do aparelho estereotax e área cirúrgica com 70% de etanol. Use luvas cirúrgicas estéreis, um vestido descartável e máscara facial durante o procedimento.
- Cirurgia de sobrevivência, rato(Mus musculus).
- Anestesiar os camundongos com isoflurane de 2,5% em uma caixa de indução por ~1 min, até que a taxa de respiração atinja 55-65 respirações/min. Em seguida, administre 2,0% de isoflurane através de um cone de nariz para manter a anestesia. Aplique pomada veterinária em ambos os olhos para evitar danos na córnea. Faça uma beliscação no dedo do dedo do dedo para verificar o grau adequado de anestesia.
- Após a verificação, siga os procedimentos de cirurgia de sobrevivência detalhados em Ma et al.22. Monitore a taxa respiratória e mantenha-a a 60 respirações/min. Mantenha a temperatura do corpo a 37 °C usando uma almofada de aquecimento controlada termostaticamente. Consulte as etapas 6.3-6.5 (detalhadas abaixo) para obter instruções sobre como preparar o crânio para a craniotomia, a duratomia e a implantação de eletrodos.
- Após a cirurgia, devolva os camundongos a uma gaiola de recuperação, equipada com uma almofada de aquecimento de 37 °C, isolada de outros animais.
- Cubra as feridas cirúrgicas na pomada antibiótica. Monitore os animais até que recuperem a consciência suficiente para manter a recumbência severa e permitam que eles se recuperem por um período de 2-5 dias. Abriga-os de forma singly e monitora continuamente para sinais de infecção ou desconforto. Dê aos animais uma dose de buprenorfina 72 h de liberação sustentada (0,5-1,0 mg/kg) no dia da cirurgia como analgésico.
- Cirurgia de não sobrevivência, furão (Mustela putorius furo)
- Anestesiar o furão inicialmente com cetamina (20 mg/kg, i.m.), e depois ventilar com 1,0%-2,0% isoflurane em uma mistura de 2:1 de óxido nitroso e oxigênio através de uma máscara. Faça uma beliscação no dedo do dedo do dedo para verificar o grau adequado de anestesia.
- Após a verificação, siga os procedimentos de cirurgia de não sobrevivência detalhados em Popovic et al.23. Realize uma traqueostomia e ventile os animais com 1,0%-2,0% de isoflurane em uma mistura 2:1 de óxido nitroso e oxigênio. Aplique pomada veterinária em ambos os olhos para evitar danos na córnea.
- Mantenha a temperatura do corpo a 37 °C usando uma almofada de aquecimento controlada termostaticamente. Monitore a frequência cardíaca,os níveis finais de CO 2 e a taxa de respiração. Mantenha a taxa de respiração dentro da faixa fisiológica apropriada (3,5%-4,0%). Consulte as etapas 6.3-6.5 (detalhadas abaixo) para obter instruções sobre como preparar o crânio para a craniotomia, a duratomia e a implantação de eletrodos.
- Monitore continuamente o ECG do animal para garantir anestesia adequada e aumentar a porcentagem de isoflurane se o ECG indicar qualquer aflição.
- Ao final do experimento, administre 1 mL de solução de sódio pentobarbital e fenitoína ao furão e monitore até que a frequência cardíaca e o CO 2 final de marémedem 0.
- Preparação do crânio
- Utilizando uma rebarba de perfuração de 0,8 mm, perfurar uma única craniotomia de 4 mm x 4 mm no local desejado para implantação. Para o mouse, faça um orifício adicional de rebarba em um local contralateral para inserção do parafuso moído de aço inoxidável.
NOTA: Não faça uma duratomia até que o eletrodo esteja pronto para implantação. - Estabeleça um solo/referência. Em experimentos agudos de furão, use uma agulha de 18 G para perfurar a pele e a camada de músculo ao redor do crânio na lateral da cabeça do animal em frente à craniotomia. Insira a extremidade do fio do eletrodo de referência Ag/Cl na ponta da agulha e, em seguida, retire a agulha do músculo/pele para que a pelota esteja agora sentada firmemente entre o músculo e o crânio. No mouse, enrole o fio de prata em torno do parafuso de aterramento de aço inoxidável. Seguro com cimento dental curado UV.
- Conecte o eletrodo ao suporte do eletrodo usando uma fina tira de fita de rotulagem e fixe o suporte de eletrodo no micromanipulador. Conecte o fio do solo a uma fonte de aterramento através de um clipe de jacaré. Conecte o fio de referência ao eletrodo de referência embutido no músculo do animal.
- Utilizando uma rebarba de perfuração de 0,8 mm, perfurar uma única craniotomia de 4 mm x 4 mm no local desejado para implantação. Para o mouse, faça um orifício adicional de rebarba em um local contralateral para inserção do parafuso moído de aço inoxidável.
- Duratomia e penetração pia
- Remova a dura dura da craniotomia usando uma pega dura.
- Crie um pequeno buraco na pia. Para isso, insira e retire um microeletrodo metálico (recomendado no furão). Alternativamente, abaixe a ortogonal cfea à superfície do cérebro para evitar qualquer vasculatura. Uma vez que este local é determinado, levante o eletrodo e corte suavemente a superfície do cérebro naquele local com uma pegatura dura, puxando para cima com a picareta (recomendada no mouse).
- Implantação de eletrodos
- Abaixe a ponta do eletrodo para o mesmo local e, no modo fino, comece a conduzir o eletrodo para dentro do cérebro a uma taxa de ~2 μm/s. Use um microscópio para garantir que o eletrodo esteja entrando suavemente e não dobrando.
NOTA: Se o eletrodo não estiver entrando sem problemas, levante-o do cérebro e reajuste o ângulo. Se continuar a dobrar sem entrar sem entrar sem problemas, ajuste a localização e repita o processo de cortar a superfície do cérebro para o novo local de entrada. - Realize a implantação crônica e aguda utilizando as seguintes etapas.
- Para implantação crônica: Cimentar o eletrodo no lugar usando cimento dentário curado UV.
- Feche a incisão usando suturas cirúrgicas 5-0 e construa a tampa da cabeça.
- Para construir uma tampa da cabeça adicione cimento dental adicional ao redor do local do implante. Certifique-se de cobrir o nariz do gabarito.
- Puxe a pele para cima e ao redor da tampa da cabeça. Suturar a incisão atrás da tampa da cabeça com suturas cirúrgicas 5-0.
- Aplique creme de lidocaína e pomada antibiótica.
- Pare o anestésico e siga os procedimentos padrão de recuperação.
- Para implantação aguda: Depois de baixar o eletrodo e atingir a profundidade desejada, espere pelo menos 30 minutos antes de iniciar a gravação eletrofisiológica para permitir que o eletrodo se instale no local.
- Para implantação crônica: Cimentar o eletrodo no lugar usando cimento dentário curado UV.
- Abaixe a ponta do eletrodo para o mesmo local e, no modo fino, comece a conduzir o eletrodo para dentro do cérebro a uma taxa de ~2 μm/s. Use um microscópio para garantir que o eletrodo esteja entrando suavemente e não dobrando.
Resultados
Com a conclusão deste protocolo, serão possíveis gravações estáveis de atividade de espetamento de unidade única. Essas matrizes de microeletrodo são personalizáveis em material, contagem de canais e adaptador de headstage com base nas necessidades do pesquisador. As fibras de eletroplacar em ouro resultam em diminuição das impedâncias adequadas para o registro (Figura 4 e Figura 5). Se o usuário pretende registrar cronicamente, as medições podem ser feitas após a recuperação do animal do procedimento cirúrgico. Os procedimentos crônicos resultaram em gravações estáveis e uni unitárias por pelo menos 120 dias. Uma gravação representativa é mostrada na Figura 6, ilustrando atividade eletrofisiológica estável de 64 canais no córtex retrosplenial de um rato macho adulto livremente comportado. Se uma preparação aguda for planejada, as gravações podem começar logo após a implantação (~30 min). Isso permitirá tempo para o eletrodo se estabelecer no cérebro. A Figura 7 fornece um exemplo representativo de uma gravação aguda de CFEA de 16 canais adquirida do córtex visual primário de um furão feminino adulto. A triagem de espetos no mouse e no furão foi realizada com software de classificação de picos (ver Tabela de Materiais).
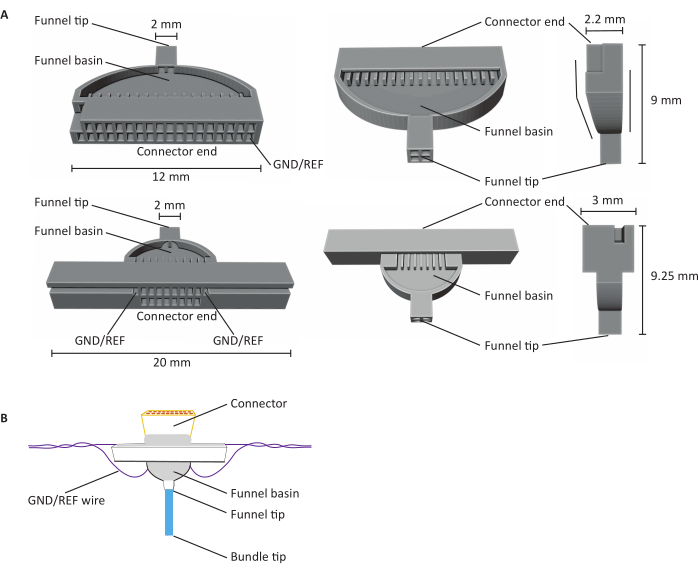
Figura 1: Anatomia de matrizes de microeletrodos de fibra de carbono de 16 e 32 canais (CFEAs). O CFEA de 16 canais possui um design estendido para fins de manuseio. O design de 32 canais possui uma face plana que permite que dois gabaritos sejam combinados para um CFEA de 64 canais. Ambos os diagramas têm estruturas de identificação rotuladas com dimensões. A extremidade do conector indica a localização da inserção do conector e os canais GND/REF indicam onde o fio de aterramento está inserido. A bacia do funil refere-se ao local pelo qual as fibras passam para serem sobrepostas com cimento dental curado à luz UV, e a ponta do funil significa o local de onde as fibras saem do gabarito. A ponta do funil é dividida em quadrantes para minimizar as fibras que se agarram e criam danos. As fibras são posteriormente puxadas para um único pacote com o uso do cimento dentário. Os gabaritos são impressos em 3D usando impressoras de resina SLA. Os diagramas são ampliados para mostrar detalhes. (B) CFEA construída. O diagrama identificou estruturas rotuladas. A ponta do feixe azul representa o segmento das fibras de carbono que adquirem medidas de gravação. O cinza dentro da bacia do funil e ao redor do conector é indicativo de cimento dental curado à luz UV que mantém fibras de carbono no lugar na bacia do funil e protege o conector ao gabarito. O fio roxo representa o fio de aterramento. Clique aqui para ver uma versão maior desta figura.
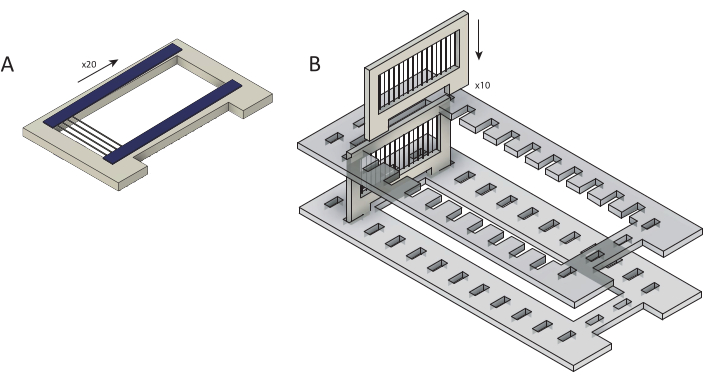
Figura 2: Carregamento de fibras de carbono bruto em para revestimento de parileno C. (A) As fibras de carbono são carregadas em cartuchos sobrepostos com duas tiras de fita dupla face (azul). Cada é carregado com ~25 fibras. (B) As fitas são carregadas em um suporte de corte a laser (cinza) em preparação para o revestimento de parileno C. Cada um tem dez. Clique aqui para ver uma versão maior desta figura.
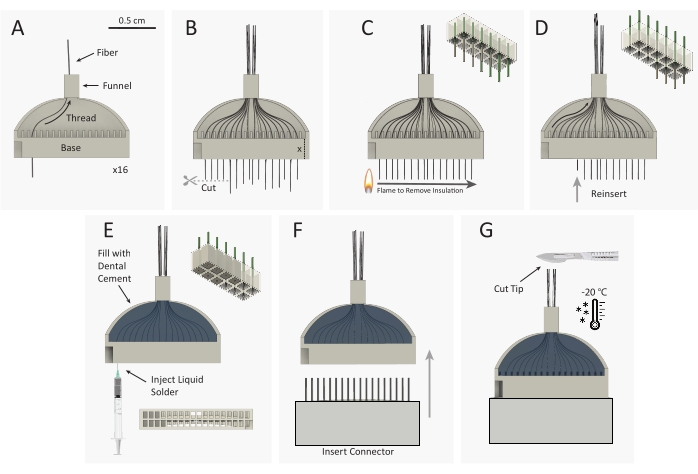
Figura 3: O esquema de construção do pacote de microeletrônico de fibra de carbono (CFEA) (A) 16 fibras de carbono revestidas individuais (pretas) são roscadas através do gabarito impresso em 3D de 32 canais (cinza). (B) As pontas de fibra de carbono são cortadas com micro-tesoura, deixando o excesso de fibra igual à altura da base do gabarito, estendendo-se para fora da base do gabarito. (C) Um isqueiro de roda de lha de plástico padrão é rapidamente passado sobre o excesso de fibra para remover o isolamento do parileno C. O esquema superior direito mostra a remoção do parileno de 9 das 12 fibras. (D) As fibras são reinseridas no gabarito até que a extremidade da fibra esteja alinhada com a base. O esquema superior direito mostra a reinserção de 9 fibras com pontas de fibra uninsuladas (cinza) alojadas dentro da base do gabarito. O gabarito é então virado e os passos A-D são repetidos para roscar os 16 canais opostos. (E) O gabarito é preenchido com cimento dental para fixar as fibras. A impressão prateada é injetada em cada poço da base do gabarito. (F) O conector masculino é inserido na base do gabarito. (G) CFEA e bisturi estão congelados em um congelador de -20 °C. A ponta do array é cortada ao comprimento desejado, deixando 32 fibras uniformes. Clique aqui para ver uma versão maior desta figura.
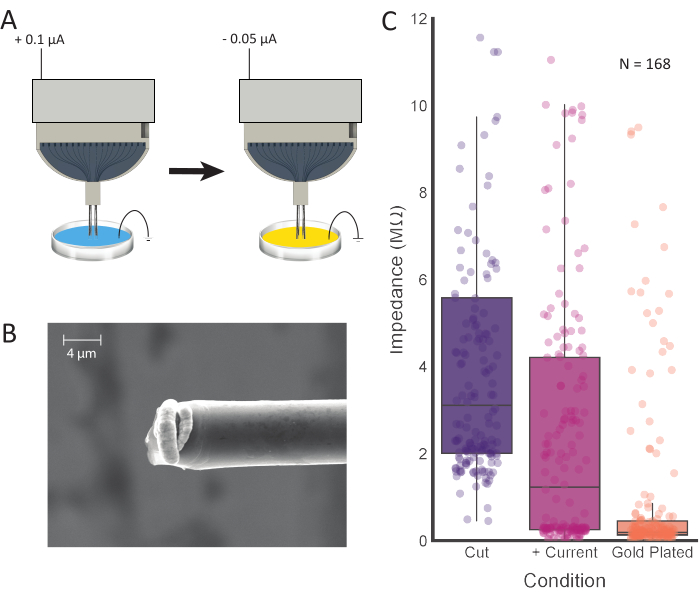
Figura 4: Tratamento de ponta e eletroplato. (A) As pontas do eletrodo são primeiramente colocadas em 0,1 M PBS, onde a corrente é passada através de cada eletrodo. As pontas são então enxaguadas e transferidas para uma solução de revestimento de ouro, onde são eletropladas com a correnteza. (B) Imagens SEM de fibra de carbono preparada mostram solução de revestimento de ouro concentrada na ponta. Barra de escala representa 4 μm. (C) Valores de impedância de 168 canais após corte inicial (roxo; 3,11 MΩ ± 0,42 MΩ, mediana ± SE, n = 168 fibras), injeção de corrente positiva (rosa; 1,23 MΩ ± 0,36 MΩ, mediana ± SE, n = 168 fibras) e eletroplacamento (laranja; 0,19 MΩ ± 0,15 MΩ, mediana ± SE, n = 168 fibras) apresentam valores de impedância reduzidos após cada etapa de processamento. Clique aqui para ver uma versão maior desta figura.

Figura 5: Durações moderadas de eletroplacar de ouro produzem pequenos depósitos arredondados em pontas de feixe de fibra de carbono. As pontas de fibra de carbono retratadas são todas de diferentes matrizes de microeletrodos, refletindo diferentes durações da corrente injetada para redução de impedância ou revestimento de ouro. Além disso, as imagens retratam o revestimento parileno C, que isola as fibras de carbono e impede qualquer aquisição de sinal de um local diferente das pontas das fibras. (A) Escaneando a imagem da microscopia eletrônica das pontas de fibra de carbono após congelar e fazer um único corte com uma lâmina de barbear. As barras de escala representam 10 μm. (B) Mesmo que A, mas depois seguidas com injeção de correntepositiva para 10 s. (C) Mesmo que B, mas depois eletroplada com ouro por 15 s. (E) Mesmo que B, mas depois eletroplada com ouro para 120 s. Descobrimos que a eletroplacar para 30 s a uma corrente de -0,05 μA foi ótima para gravações eletrofisiológicas. Clique aqui para ver uma versão maior desta figura.
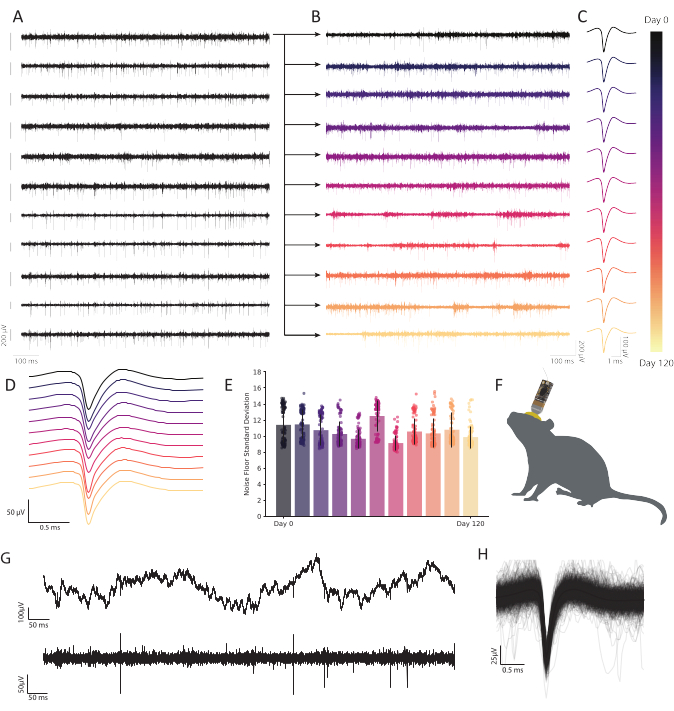
Figura 6: Gravações extracelulares crônicas em córtex retrosplenial de camundongos com matrizes de microeletrodos de fibra de carbono mostram atividade neural persistente e estável. (A) Foram registrados traços de tensão de onze faixas foram gravados simultaneamente. Os traços subsequentes gravados do primeiro canal (linha superior) são plotados em B para mostrar durabilidade ao longo do tempo. As dez linhas restantes demonstram a consistência da qualidade de gravação e mostram atividade robusta em toda a matriz. A barra de escala à esquerda de cada traço representa um potencial de 200 μV. (B) Dados de bandpassed da mesma fibra que no traço superior em A, expandidos para mostrar atividade robusta em uma gravação contínua de 120 dias. (C) O cluster revela uma detecção robusta de unidade única ao longo de meses. Os traços representam a forma média de onda de uma unidade única representativa continuamente observável ao longo de 120 dias, extraída da fibra plotada em B em cada ponto de tempo. (D) Formas de onda de pico não normalizadas de C empilhadas para demonstrar consistência ao longo do tempo. (E) As gravações de fibra de carbono demonstram um piso de ruído estável ao longo de muitos meses. O desvio padrão do piso de ruído (traço menos atividade de espetamento) em B não mostra nenhuma mudança progressiva no ruído. As barras representam contaminação média. As barras de erro representam desvio padrão. (F) Desenho em escala de um rato com um CFEA cronicamente implantado e headstage. (G) Traço de tensão bruta (topo) 11 meses após a implantação mostra LFP robusto. Traço de tensão com faixa (inferior) mostra atividade neural constante. (H) Forma média de onda de pico do neurônio registrada na fibra de C, subposta pelas primeiras 1.000 incidências de atividade de espetamento. Clique aqui para ver uma versão maior desta figura.

Figura 7: Gravações de microeletrodos de fibra de carbono (CFEA) do córtex visual primário do furão. (A) Formas de onda de unidades únicas classificadas de picos registrados a partir de um CFEA de 16 canais. Os potenciais de ação de neurônios únicos eram frequentemente evidentes em múltiplos canais em amplitudes ligeiramente diferentes. (B) Curvas de ajuste de direção a partir de neurônios selecionados. As cores correspondem às unidades registradas em A. Setas indicam a direção do movimento de estímulo. Barras de escala indicam a taxa de resposta. As barras de erro indicam a resposta média com erro padrão. A linha horizontal tracejada representa a taxa de disparo espontânea da mesma célula durante a exposição a uma tela em branco. Clique aqui para ver uma versão maior desta figura.
Discussão
Este protocolo descreve cada passo necessário para a construção de um CFEA funcional para uso agudo e crônico. O processo descrito é personalizável às necessidades do pesquisador, tornando-o uma opção acessível e barata para monitorar neurônios únicos ao longo dos meses. O protocolo demonstra a viabilidade de registrar tanto atividade robusta uni unitária em poucos minutos de implantação em um animal anestesiado, quanto ao longo de quatro meses em um animal acordado, comportando-se animal, ilustrando o potencial desses CFEAs para estudar mudanças de curto e longo prazo nas respostas neurais.
As etapas do protocolo descrito foram minuciosamente testadas e aprimoradas ao longo do tempo para produzir um procedimento eficiente que pode ser concluído rapidamente, a um baixo custo marginal (<$100,00), com a capacidade de registrar unidades únicas inequívocas, densamente e compuntura ao longo de meses. As etapas de construção podem ser concluídas em menos de um dia e produzirão sinais eletrofisiológicos comparáveis a qualquer matriz comercial líder. Os CFEAs também têm uma pegada muito menor (pacote de fibras de 16 canais tem um diâmetro de ~26 μm) do que matrizes comerciais similares, e sua biocompatibilidade as torna adequadas para uso a longo prazo13. É importante ressaltar que existem várias etapas e instruções críticas que devem ser seguidas para produzir um CFEA funcional com desempenho comparável.
Devido à fragilidade das fibras de carbono, elas devem ser tratadas com o maior cuidado. Manuseá-los com fórceps afiados ou outras ferramentas pode resultar em quebra das fibras. Além disso, é importante construir os CFEAs em um espaço com movimento de ar limitado para que as fibras não esvaam. Ao queimar a porção traseira das fibras, o isqueiro só precisa ser movido em um movimento de ida e volta muito brevemente, por aproximadamente 1 s. As etapas após essa remoção do isolamento são cruciais para a construção de um eletrodo com canais de trabalho. As pontas flamedas devem ser alimentadas no gabarito sem qualquer contato adicional. Então, ao encher a bacia com cimento dentário, é importante que o cimento seja cuidadosamente aplicado e preencha completamente os canais e a bacia do funil, fechando as aberturas sem preenchê-las. O cimento dental deve então ser completamente curado com luz UV antes de prosseguir. Uma vez que isso esteja completo, a tinta prateada deve ser injetada em cada canal até que esteja completamente preenchida, mas não derramando. Esta é a etapa mais variável do processo. Qualquer excesso de preenchimento pode produzir crosstalk entre canais, e o preenchimento insuficiente pode resultar em uma falha de conexão. Se não conseguir injetar tinta prateada usando uma agulha de 25 G, é provável que a solução seja muito viscosa e, neste caso, uma pequena quantidade de diluente de tinta possa ser adicionada para criar uma solução mais fluida. Uma vez preenchidos todos os canais e o conector do headstage inserido, é importante permitir que a matriz cure por 24 horas antes de fixar o conector com cimento dental. Descobrimos que a falha em fazê-lo reduziu o número de canais conectados. Aplicar uma quantidade generosa de cimento dental também é importante para que o conector não se desconecte ao interagir com o sistema de aquisição de sinal. Se eles se desvincularem, é possível tentar a reconexão com o preenchimento repetido de canais com tinta prateada, mas o usuário deve testar os valores de impedância do CFEA para avaliar o número de canais conectados. Permitir que o cimento dental cure durante a noite também serve para evitar um possível descolamento.
Medir a impedância do eletrodo fornecerá uma estimativa precisa dos canais conectados. Isso pode ser feito depois de submergir o solo e os fios de referência e as pontas de fibra de carbono na PBS. Observamos que uma alta impedância (>15 MΩ) é indicativa de um canal aberto e desconectado. Antes de injetar corrente e eletroplacamento, um canal conectado pode ter uma gama de valores de impedância que devem diminuir significativamente com esse processo. O número médio de canais conectados (impedância < 4 MΩ após a injeção atual) por eletrodo de 16 canais foi de 12,96 ± 2,74 (média ± SD; N = 48 eletrodos). Foram testados vários tempos de eletroplacar, e 30 s produziram isolamento de sinal superior entre os locais de gravação(Figura 5). Embora tenha sido bem estabelecido que pEDOT-pTS12,24,25,26 e PEDOT-TFB21 fornecem opções confiáveis para a preparação de locais de gravação de fibra de carbono, descobrimos que o revestimento com ouro, um método comprovado e confiável para eletrodos eletroplatados para implantação crônica27,28 , aumentou a facilidade de implantação e impediu que as pontas do eletrodo se agrupassem. Na produção de valores de impedância final inferiores a 0,2 MΩ em média, este método se mostra comparável aos valores alcançados utilizando PEDOT-TFB21 e PEDOT-pTS26.
Ao implantar a matriz de microeletrodes, é importante acompanhar visualmente a inserção das pontas de fibra de carbono sob o microscópio. A inserção bem sucedida deve ser aparente, sem dobra das fibras. Se as fibras parecem estar se curvando, é improvável que elas entrem com sucesso no cérebro. Neste caso, o ângulo da sonda deve ser ajustado para uma segunda tentativa. Este processo pode continuar até que a inserção da sonda seja bem sucedida. Uma vez que o eletrodo esteja na profundidade desejada, descobrimos que esperar pelo menos 30 min permitirá que a sonda se contente com a aquisição ideal de sinal (gravações agudas).
Os CFEAs descreveram, além de sua pequena pegada e biocompatibilidade, oferecer uma alternativa robusta e personalizável aos arrays comerciais devido à sua facilidade de construção e baixo custo. A maior limitação para os CFEAs detalhados neste protocolo é sua escalabilidade. Devido à natureza manual de sua construção, escalar até projetos com centenas de locais de gravação pode não ser prático. Além disso, os avanços na fabricação de matrizes de microeletrodos usando nanotecnologia permitirão registros populacionais de maior escala do que os métodos descritos aqui. No entanto, este protocolo oferece acessibilidade cfea a laboratórios interessados na fabricação de bancada de eletrodos de fibra de carbono. Não observada perda de estabilidade ou diminuição da robustez na amplitude do pico ao longo da duração dos experimentos crônicos de 120 dias, como indicado por um único canal representativo típico de nossas observações nessa escala de tempo(Figura 6A-E). Além disso, os CFEAs mostram a capacidade de atividade uni unitária persistente, uma vez que quatro unidades únicas permaneceram perceptíveis 11 meses após a implantação no camundongo (Figura 6G,H). Também é possível obter gravações estáveis, uni unitárias agudamente(Figura 7),o que oferece uma vantagem sobre muitos outros eletrodos comerciais para o estudo de neurônios únicos em períodos curtos. No futuro, o desenvolvimento de sondas tão flexíveis e biocompatíveis com diâmetros mínimos permitirá o estudo de processos complexos. Essas ferramentas fornecerão utilidade substancial no avanço da tecnologia neural, incluindo aplicações em interfaces cérebro-máquina (IMC), que requerem estabilidade contínua e de longo prazo29.
Divulgações
Os autores não declaram conflitos financeiros de interesse.
Agradecimentos
Gostaríamos de agradecer a Greg Guitchounts por orientação com projeto e construção de eletrodos e Tim Gardner por abrir seu laboratório e instalações para nós. Gostaríamos de agradecer a Christos Michas por sua ajuda com o uso do PDS na instalação principal de Bio-Interface e Tecnologia e Neil Ritter, Jon Spyreas e David Landesman por sua ajuda no projeto das primeiras versões do gabarito de 16 canais. Gostaríamos de agradecer a Tim Cavanaugh por sua ajuda com a SEM imaging no Center for Harvard Nanoscale Systems em Harvard.
Materiais
| Name | Company | Catalog Number | Comments |
| #10 scalpel blade | Fisher Scientific | 14-840-15 | Building tool |
| 16-channel CFEA Jig | Realize Inc. | CFMA component | |
| 16-channel Omnetics connector | Omnetics | A79014-001 | CFMA component |
| 25 G needle | Fisher Scientific | 14-840-84 | Building tool - sharp-tipped |
| 30 G needle | Fisher Scientific | 14-841-03 | Building tool |
| 31 G stainless steel 304 hypodermic round tubing | Small Parts Inc | B000FMYN38 | For guide tube |
| 32-channel CFEA jig | Realize Inc. | CFMA component | |
| 32-channel Omnetics connector | Omnetics | A79022-001 | CFMA component |
| 6 in cotton tip applicators | Fisher Scientific | 22-363-156 | Building tool |
| Acetone | Fisher Scientific | A16P4 | Building tool |
| AutoCad 3D printing software | Autodesk | Computer-aided design tool/ 3D modeling software | |
| Autodesk Fusion 360 | Autodesk | Computer-aided design tool/ 3D modeling software | |
| BD disposable syringes | Fisher Scientific | 14-823-30 | 1 mL |
| Carbon fibers | Good Fellow USA | C 005725 | 7 μm epoxy sized |
| Cassettes and cassette holder | For coating fibers | ||
| Clear tape | Scotch | For coating raw fibers | |
| Deionized water | Electroplating component | ||
| Double-sided tape | Scotch | For coating raw fibers | |
| Flowable Dental Composite | Pentron | Flow-It ALC | CFMA component/ UV cured dental cement |
| Gold plating solution | Sifco ASC | 5355 | 10.0-20.0% glycerol, 1.0-5.0% ethylenediamine, 1.0-5.0% acetic acid (ethylenedinitrilo)tetra-, dipotassium salt, 5.0-10.0% butanoic acid, mercapto-monogold(1+) sodium salt, 1.0–5.0% potassium metabisulfite, 55.0-82.0% water |
| Jewelry clamp | Amazon | B00GRABH9K | Building tool |
| JRClust | Ferret spike sorting software | ||
| Lighter | BIC | LCP62DC | Building tool |
| Micromanipulator | Scientifica | PS-7000C | For guide tube |
| Microscissors | Fisher Scientific | 08-953-1B | Building tool |
| MountainSort | Mouse spike sorting software | ||
| NanoZ 16-channel adapter | Multi-channel systems | ADPT-nanoZ-NN-16 | Electroplating component |
| NanoZ 32-channel adapter | White Matter | NZA-OMN-32 rev A | Electroplating component |
| NanoZ multi-electrode impedance tester | White Matter | Electroplating component | |
| Parafilm | Fisher Stockroom | 13-374-10 | Semi-transparent, flexible film with adhesive properties |
| Parylene 'C' Dimer | Specialty Coating Systems | 980130-C-01LBE | For coating raw fibers |
| PEG 8000 | Fisher Scientific | 25322-68-3 | Electroplating component |
| Phosphate-buffered saline | Electroplating component | ||
| Polyimide tubing | MicroLumen | BRAUNI001 | For guide tube |
| Rotary tool | Dremel | 300124 | For guide tube |
| Scalpel handle | Fine Science Tools | 10003-12 | Building tool |
| Silver conductive coating | MG Chemicals | 842AR Super Shield | CFMA component |
| Stereo microscope with range 6.7:1 | Motic | SMZ-168 | Building tool |
| Sticky notes | Post-it | Building tool | |
| Tissue wipes | Kimtech Science | 34155 | Building tool |
| Tungsten wire | A-M Systems | 797550 | CFMA component |
| UV curing wand | Woodpecker | Building tool | |
| Vacuum deposition chamber | Specialty Coating Systems | Labcoter 2 (PDS 2010) |
Referências
- Galvani, L. De viribus electricitatis in motu musculari commentarius. , Academy of Sciences. Bologna. (1791).
- Buzsaki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents--EEG, ECoG, LFP and spikes. Nature reviews. Neuroscience. 13 (6), 407-420 (2012).
- Ledochowitsch, P., et al. On the correspondence of electrical and optical physiology in in vivo population-scale two-photon calcium imaging. bioRxiv. , 800102(2019).
- Lin, M. Z., Schnitzer, M. J. Genetically encoded indicators of neuronal activity. Nature Neuroscience. 19 (9), 1142-1153 (2016).
- Seymour, J. P., Wu, F., Wise, K. D., Yoon, E. State-of-the-art MEMS and microsystem tools for brain research. Microsystems and Nanoengineering. 3 (1), 16066(2017).
- Kerr, J. N., Denk, W. Imaging in vivo: watching the brain in action. Nature reviews. Neuroscience. 9 (3), 195-205 (2008).
- Hong, G., Lieber, C. M. Novel electrode technologies for neural recordings. Nature reviews. Neuroscience. 20 (6), 330-345 (2019).
- Chung, J. E., et al. High-density, long-lasting, and multi-region electrophysiological recordings using polymer electrode arrays. Neuron. 101 (1), 21-31 (2019).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551 (7679), 232-236 (2017).
- Kozai, T. D., Jaquins-Gerstl, A. S., Vazquez, A. L., Michael, A. C., Cui, X. T. Brain tissue responses to neural implants impact signal sensitivity and intervention strategies. ACS Chemical Neuroscience. 6 (1), 48-67 (2015).
- Polikov, V. S., Tresco, P. A., Reichert, W. M. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148 (1), 1-18 (2005).
- Kozai, T. D., et al. Ultrasmall implantable composite microelectrodes with bioactive surfaces for chronic neural interfaces. Nature Materials. 11 (12), 1065-1073 (2012).
- Chen, R., Canales, A., Anikeeva, P. Neural recording and modulation technologies. Nature Reviews Materials. 2 (2), 16093(2017).
- Szostak, K. M., Grand, L., Constandinou, T. G. Neural interfaces for intracortical recording: requirements, fabrication methods, and characteristics. Frontiers in Neuroscience. 11, 665(2017).
- Subbaroyan, J., Martin, D. C., Kipke, D. R. A finite-element model of the mechanical effects of implantable microelectrodes in the cerebral cortex. Journal of Neural Engineering. 2 (4), 103-113 (2005).
- Park, S., et al. One-step optogenetics with multifunctional flexible polymer fibers. Nature Neuroscience. 20 (4), 612-619 (2017).
- Guo, Y., et al. Polymer composite with carbon nanofibers aligned during thermal drawing as a microelectrode for chronic neural interfaces. ACS Nano. 11 (7), 6574-6585 (2017).
- Armstrong-James, M., Millar, J. Carbon fibre microelectrodes. Journal of Neuroscience Methods. 1 (3), 279-287 (1979).
- Garris, P. A., Ciolkowski, E. L., Pastore, P., Wightman, R. M. Efflux of dopamine from the synaptic cleft in the nucleus accumbens of the rat brain. Journal of Neuroscience: The Official Journal of the Society of Neuroscience. 14 (10), 6084-6093 (1994).
- Guitchounts, G., Markowitz, J. E., Liberti, W. A., Gardner, T. J. A carbon-fiber electrode array for long-term neural recording. Journal of Neural Engineering. 10 (4), 046016(2013).
- Guitchounts, G., Cox, D. 64-channel carbon fiber electrode arrays for chronic electrophysiology. Scientific Reports. 10 (1), 3830(2020).
- Ma, Z., Turrigiano, G. G., Wessel, R., Hengen, K. B. Cortical circuit dynamics are homeostatically tuned to criticality in vivo. Neuron. 104 (4), 655-664 (2019).
- Popovic, M., et al. Development of cross-orientation suppression and size tuning and the role of experience. Journal of Neuroscience: The Official Journal of the Society of Neuroscience. 38 (11), 2656-2670 (2018).
- Patel, P. R., et al. Chronic in vivo stability assessment of carbon fiber microelectrode arrays. Journal of Neural Engineering. 13 (6), 066002(2016).
- Welle, E. J., et al. Ultra-small carbon fiber electrode recording site optimization and improved in vivo chronic recording yield. Journal of Neural Engineering. 17 (2), 026037(2020).
- Patel, P. R., et al. Insertion of linear 8.4 µm diameter 16 channel carbon fiber electrode arrays for single unit recordings. Journal of Neural Engineering. 12 (4), 046009(2015).
- Ferguson, J. E., Boldt, C., Redish, A. D. Creating low-impedance tetrodes by electroplating with additives. Sensors and Actuators. A, Physical. 156 (2), 388-393 (2009).
- Vafaiee, M., Vossoughi, M., Mohammadpour, R., Sasanpour, P. Gold-plated electrode with high scratch strength for electrophysiological recordings. Scientific Reports. 9 (1), 2985(2019).
- Lebedev, M. A., Nicolelis, M. A. Brain-machine interfaces: From basic science to neuroprostheses and neurorehabilitation. Physiological Reviews. 97 (2), 767-837 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados