Method Article
In vitro Análisis celular multiparamétrico mediante matrices de transistores de efecto de campo moduladas por carga micro orgánica
En este artículo
Resumen
Aquí, presentamos el protocolo de fabricación de un dispositivo basado en transistor de efecto de campo modulado por carga orgánica (OCMFET) para la interfaz celular in vitro . El dispositivo, llamado matriz micro OCMFET, es un dispositivo flexible, de bajo costo y sin referencias, que permitirá el monitoreo de las actividades eléctricas y metabólicas de los cultivos celulares electroactivos.
Resumen
La electrofisiología moderna ha sido constantemente alimentada por el desarrollo paralelo de herramientas y materiales cada vez más sofisticados. A su vez, los descubrimientos en este campo han impulsado el progreso tecnológico en un proceso de ida y vuelta que finalmente determinó los impresionantes logros de los últimos 50 años. Sin embargo, los dispositivos más empleados utilizados para la interfaz celular (a saber, las matrices de microelectrodos y los dispositivos microelectrónicos basados en transistores) todavía presentan varias limitaciones, como el alto costo, la rigidez de los materiales y la presencia de un electrodo de referencia externo. Para superar parcialmente estos problemas, ha habido desarrollos en un nuevo campo científico llamado bioelectrónica orgánica, lo que resulta en ventajas como menor costo, materiales más convenientes y técnicas de fabricación innovadoras.
Durante la última década se han propuesto varios dispositivos orgánicos nuevos e interesantes para interactuar convenientemente con cultivos celulares. Este artículo presenta el protocolo para la fabricación de dispositivos para la interfaz celular basados en el transistor de efecto de campo modulado por carga orgánica (OCMFET). Estos dispositivos, llamados micro OCMFET arrays (MOAs), combinan las ventajas de la electrónica orgánica y las características peculiares del OCMFET para preparar herramientas transparentes, flexibles y sin referencia con las que es posible monitorear las actividades eléctricas y metabólicas de cardiomiocitos y neuronas in vitro, permitiendo así una evaluación multiparamétrica de modelos celulares electrogénicos.
Introducción
El monitoreo in vivo de células electroactivas, como neuronas y cardiomiocitos, representa un enfoque válido y poderoso en aplicaciones de investigación fundamental para el cerebro humano, estudios de conectividad funcional, farmacología y toxicología. Las herramientas empleadas habitualmente para este tipo de estudios se basan principalmente en matrices de microelectrodos (AMUMA)1,2,3,4,5 y dispositivos de efecto de campo (FEDs) cada vez más eficientes y potentes6,7,8,9,10,11,12 . Estas dos familias de dispositivos permiten la monitorización y estimulación en tiempo real de la actividad eléctrica de neuronas y cardiomiocitos y suelen caracterizarse por su robustez, facilidad de uso y fiabilidad. Estas características hacen que los AMUMA y los FED sean el estándar de oro para aplicaciones electrofisiológicas, ya que actualmente se emplean para interactuar con cultivos celulares estándar, cortes cerebrales organotípicos y organoides tridimensionales13,14,15,16. A pesar de su uso generalizado y sus impresionantes características, los AMUMA y LOS FEDs presentan algunas limitaciones como el alto costo, la rigidez de los materiales y la presencia de un electrodo de referencia generalmente voluminoso, que debe colocarse en el entorno líquido de medición y es necesario para el correcto funcionamiento de los dispositivos.
Para explorar soluciones alternativas para la interfaz celular, se ha invertido mucho esfuerzo en la última década en el estudio de dispositivos electrónicos basados en materiales orgánicos y técnicas de fabricación innovadoras17. Entre los diversos dispositivos orgánicos estudiados para abordar las limitaciones antes mencionadas, recientemente se ha propuesto un transistor orgánico peculiar llamado OCMFET como una alternativa válida a los AMUMA y FEDs18. Además de las características estándar que ofrece la tecnología de electrónica orgánica, como materiales y técnicas de fabricación de bajo costo, propiedades mecánicas y químicas óptimas, transparencia óptica y biocompatibilidad, el OCMFET también ofrece una sensibilidad de carga ultra alta (debido a su estructura de doble puerta) sin la necesidad de un electrodo de referencia externo. Además, este sensor orgánico tiene la notable capacidad de detectar diferentes parámetros físicos/analitos, dependiendo de la funcionalización específica de su área de detección, que está separada del área del transistor19,20. Todas estas características pueden ser convenientemente explotadas para la adquisición de diferentes parámetros dentro de un cultivo celular. En particular, además de poder detectar la actividad eléctrica neuronal/cardíaca, también es posible explotar la sensibilidad de pH ultra alta que ofrece la peculiar estructura de doble puerta del OCMFET mediante el uso de una simple funcionalización física21 para monitorizar de forma fiable las ligeras variaciones locales de pH causadas por la actividad metabólica celular.
En la biodetección celular in vitro, el monitoreo de la actividad metabólica celular es un poderoso indicador del estado del cultivo y puede ser utilizado para evaluar la respuesta celular a diversos estímulos, como la administración de fármacos y la estimulación eléctrica22,23. Además, en el caso específico de las aplicaciones neuronales, el seguimiento tanto de las actividades eléctricas como metabólicas es de gran interés, particularmente en farmacología y toxicología24. Con la intención de abordar convenientemente los requisitos de la electrofisiología in vitro moderna y, al mismo tiempo, ofrecer todas las ventajas del OCMFET, recientemente se ha introducido un dispositivo llamado Micro OCMFET Array (MOA). El MOA es una matriz basada en OCMFET con áreas de detección especializadas diseñadas específicamente para la interfaz celular in vitro, lo que permite el análisis multiparamétrico de cultivos de células electrogénicas. En particular, dos canales MOA tienen áreas de detección más grandes para maximizar su sensibilidad y pueden funcionalizarse selectivamente para monitorear parámetros específicos de interés, como las variaciones de pH del medio de cultivo. Los otros OCMFET en la estructura actúan como sensores de actividad eléctrica extracelular. La Figura 1 muestra la estructura de un MOA de 16 canales. Esta capacidad, combinada con la ausencia de un electrodo de referencia externo, hace que el MOA sea una herramienta muy interesante para aplicaciones in vitro. Este trabajo presenta el protocolo de fabricación paso a paso de un MOA multidetección para la detección in vitro de las actividades eléctricas y metabólicas de neuronas y cardiomiocitos. La Figura 2 muestra los principales pasos de fabricación, los materiales utilizados y la estructura del dispositivo.
Protocolo
Se siguieron todas las pautas internacionales, nacionales y/o institucionales aplicables para el cuidado y uso de los animales. Se hicieron todos los esfuerzos para reducir el número de animales para el proyecto y minimizar su sufrimiento.
1. Preparación de la solución en desarrollo, las soluciones de grabado, la solución semiconductora orgánica y las máscaras fotolitográficas
- Prepare la solución en desarrollo diluyendo los gránulos de NaOH en agua desionizada a una concentración de 175 mM.
NOTA: Esta es una reacción exotérmica. Si se utiliza un recipiente de plástico, siga agitando el recipiente hasta que todos los gránulos se disuelvan por completo. - Prepare la solución de grabado de titanio diluyendo ácido fluorhídrico (HF) en agua desionizada (1 parte de 48% de HF concentrado, 49 partes de agua desionizada).
PRECAUCIÓN: El ácido fluorhídrico puede penetrar fácilmente en la piel, causando daños graves a las capas de tejido profundo. La neutralización rápida de la IC es necesaria para prevenir la destrucción de tejidos, que puede continuar durante días y provocar lesiones graves o incluso la muerte. Los riesgos asociados con la IC dependen de la concentración y la duración del contacto con el ácido. Use solo debajo de una campana de humos usando un protector facial. También se recomienda encarecidamente el doble guante. - Prepare la solución de grabado de oro mezclando yodo, yoduro de potasio y agua desionizada (para 250 g de solución, use 200 ml de agua desionizada, 20 g de KI, 5 g de I2). Revuelva la solución a temperatura ambiente durante 1 h y déjela reposar durante la noche antes de usarla.
- Preparar la solución semiconductora disolviendo el pentaceno 6,13-bis(triisopropilsilsililetil))(TIPS Pentaceno) en anísole (1% de peso) y revolviendo suavemente durante 2 h en una placa caliente a 80 °C.
NOTA: Siga agitando esta solución. Utilice viales de vidrio ámbar y/o guárdelos en condiciones de poca luz. - Prepare el conjunto de máscaras fotolitográficas deseadas con un software de gráficos vectoriales. Prepare 5 máscaras para todo el proceso: la máscara para el modelado de las puertas flotantes (FG); la máscara para la apertura de las vías y las áreas de detección para los registros electrofisiológicos; la máscara para el proceso de autoalineación; la máscara para el modelado de la fuente, el drenaje y el contacto superior de la puerta de control; y la máscara para la activación plasmática de los canales de pH.
NOTA: Dependiendo de la resolución necesaria y la configuración fotolitográfica específica, se pueden usar diferentes tipos de máscaras. En el caso de los dispositivos propuestos (que tienen una resolución lateral máxima de 40 μm), se han comprado máscaras flexibles de plástico simples en una tienda de fotocopias local.
2. Selección y preparación del sustrato
- Corte un cuadrado de 6 x 6 cm2 de tereftalato de polietileno (PET) de 250 μm de una lámina de PET prístina.
NOTA: Comience con un sustrato ligeramente más grande que el dispositivo final para tener márgenes lo suficientemente amplios como para permitir la manipulación con pinzas de laboratorio estándar sin dañarlo. - Inspeccione el sustrato con un microscopio óptico para excluir la presencia de surcos profundos y arañazos. Seleccione cuidadosamente los sustratos menos rayados, ya que las imperfecciones más grandes pueden provocar la falla del dispositivo final.
- Enjuague los sustratos de PET con acetona, alcohol isopropílico y agua desionizada (en este orden) y séquelos con corrientes de nitrógeno. Guarde los sustratos en placas/recipientes de Petri de plástico limpio.
3. FG: deposición de titanio
- Limpie previamente los sustratos con oxígeno plasmático (30 s a 100 W) y colóquelos en el soporte del sustrato dentro de la cámara de vacío del evaporador térmico.
- Coloque 60 mg de titanio en el crisol, cierre el obturador y bombee por la cámara de evaporación hasta que alcance un nivel de vacío inferior a 10-6 Torr. Aumente la potencia del evaporador hasta que el crisol brille en rojo y espere 30 s. Abra el obturador, aumente la potencia al 60% (o hasta que el crisol brille en blanco brillante) y espere 60 s. Cierra el obturador y baja la alimentación.
- Retire los sustratos del evaporador; límpielos con acetona, alcohol isopropílico y agua desionizada; y secarlos con corrientes de nitrógeno. Realizar un segundo tratamiento con plasma de oxígeno (60 s a 200 W) para oxidar ligeramente la superficie de titanio.
4. Modelado FG
- Coloque un sustrato a la vez en el revestimiento de centrifugado colocado dentro de una campana de humos. Deposite 4 mL de fotorresistencia sobre el sustrato utilizando una pipeta de plástico desechable. Utilice los siguientes parámetros de recubrimiento de espín para obtener una capa fotorresistente de 2 μm de espesor: velocidad de centrifugado: 3000 rpm; tiempo de centrifugado: 45 s; tiempo de aceleración: 0.5 s; tiempo de desaceleración: 0.5 s.
- Hornea suavemente la fotorresistente colocando el sustrato sobre una placa caliente (70 °C durante 5 min). Guarde el sustrato dentro de un recipiente de petri/plástico envuelto en papel de aluminio para evitar la exposición directa a la luz.
NOTA: Evite la temperatura de horneado sugerida (100 °C durante 50 s) para evitar la deformación del sustrato. Sin embargo, hornear a una temperatura más baja durante más tiempo garantiza buenos resultados. - Coloque el dispositivo en un bromógrafo y coloque la máscara fotolitográfica de plástico con el diseño FG deseado sobre el sustrato. Exponer a la luz ultravioleta (UV) de la parte superior durante 1 min, y retirar con cuidado la mascarilla, teniendo cuidado de minimizar los movimientos laterales de la mascarilla sobre el sustrato para evitar rascarla.
- Sumerja el sustrato durante 5 s en un recipiente de vidrio lleno de la solución en desarrollo (paso 1.1). Enjuáguelo rápidamente en agua desionizada y séquelo con nitrógeno. Use un microscopio óptico para buscar manchas subdesarrolladas / sobredesarrolladas en el sustrato. Repetir la inmersión del sustrato en solución en desarrollo en caso de subdesarrollo.
- Graba el titanio expuesto sumergiéndolo en la solución de grabado de titanio (paso 1.2) durante 15 s, enjuágalo con agua desionizada y sécalo con nitrógeno. Inspeccione ópticamente el sustrato y retire la fotorresistente con acetona. Enjuague el sustrato con alcohol isopropílico y agua desionizada, y séquelo con nitrógeno.
5. Deposición dieléctrica de compuerta
- Prepare la cámara de deposición del recubridor de parileno distribuyendo 2 ml del promotor de adhesión (silano - 3-(trimetoxisilil)metacrilato de propil) en las paredes de la cámara de deposición utilizando una toallita de laboratorio. Coloque 300 mg de dímero Parylene C (correspondiente a un espesor final de 150 nm) en el recubridor de Parylene. Establezca el valor de presión más bajo en 7 mbar y el valor de presión más alto en 10 mbar. Después de la deposición, limpie los sustratos con acetona, alcohol isopropílico y agua desionizada, y séquelos con nitrógeno.
6. Apertura de las áreas de detección del OCMFET para el registro de la actividad eléctrica y la formación de las vías para acceder a la parte posterior de los FG
- Deposite la fotorresistencia sobre los sustratos utilizando los mismos parámetros de los pasos 4.1 y 4.2.
- Coloque el dispositivo en un bromógrafo y coloque la máscara fotolitográfica de plástico sobre el sustrato de las vías (aberturas circulares con un diámetro de 50 μm sobre las áreas de detección y aberturas de 100 x 100 μm2 sobre las FG lejos de las áreas de detección (denominadas contacto posterior de las CG en la Figura 1 y figura 2)) bajo un microscopio estereoscópico para mejorar la precisión de alineación. Exponer a la luz UV de la parte superior durante 1 min, y retirar con cuidado la mascarilla, teniendo cuidado de minimizar los movimientos laterales de la mascarilla sobre el sustrato para evitar rascarla.
NOTA: Las vías en el lado de los FG lejos del área de detección (que se muestran como contacto posterior de los FG en la Figura 1 y la Figura 2) son necesarias para el contacto durante la caracterización del transistor. Además, tener acceso eléctrico a los FG puede ser muy útil para diferentes tipos de funcionalización (por ejemplo, electrodeposición). - Desarrolle la fotorresistencia como se describió anteriormente en el paso 4.4. Exponga el sustrato con el fotorresistente estampado (que actúa como una máscara aquí) al plasma de oxígeno (180 s a 200 W) para eliminar el Parylene C de las áreas de detección.
NOTA: La velocidad de grabado de Parylene C en un limpiador de plasma isotrópico a 200 W es de aproximadamente 90 nm / min. Se realiza un ligero sobregrabado para limpiar aún más las áreas de detección. La fotorresistente también se graba durante el proceso. Sin embargo, su espesor (2 μm) es muy superior al del Parileno C. - Coloque los sustratos en un recipiente de vidrio lleno de acetona dentro del baño ultrasónico durante 10 s para eliminar la fotorresistente por completo. Enjuague los sustratos con acetona, alcohol isopropílico y agua y séquelos con nitrógeno.
NOTA: El uso de sonicación en lugar de simplemente enjuagar los sustratos con acetona es crucial para evitar el plegamiento no deseado y la redeposición de fragmentos de parileno C en la superficie de las áreas de detección.
7. Autoalineación de fuente y drenaje con el FG
- Deposite la fotorresistencia sobre los sustratos utilizando los mismos parámetros de los pasos 4.1 y 4.2. Coloque el dispositivo en un bromógrafo y coloque sobre el sustrato una máscara fotolitográfica de plástico con rectángulos negros simples que cubran completamente las áreas del transistor. Exponer a la luz UV durante 1 min tanto desde la parte superior como inferior, y retirar con cuidado la mascarilla, teniendo cuidado de minimizar los movimientos laterales de la mascarilla sobre el sustrato para evitar rayarla.
NOTA: Con la exposición de doble cara, los FG actúan como máscaras fotolitográficas con respecto a la exposición inferior, mientras que la presencia de la máscara superior garantiza que solo la fotorresistencia presente en el canal de los transistores permanezca sin exponer. - Desarrolle la fotorresistencia como se describió anteriormente en el paso 4.4.
8. Deposición de oro, formación de canales y modelado de las fuentes, drenajes y puertas de control
- Limpie los sustratos con un suave tratamiento por plasma (30 s a 30 W) para promover la adhesión del metal sobre el Parylene C y colóquelos en el soporte del sustrato dentro de la cámara de vacío del evaporador térmico.
- Coloque 30 mg de oro en el crisol, cierre el obturador y bombee por la cámara de evaporación hasta que alcance 10-5 Torr. Aumente la potencia del evaporador hasta que el crisol brille en rojo y espere 30 s. Abra el obturador, aumente la potencia al 40% (o hasta que el crisol brille en blanco brillante), espere 60 s, cierre el obturador y baje la alimentación.
- Coloque los sustratos en un recipiente de acetona dentro del baño ultrasónico durante 10 s para despegar la fotorresistencia, eliminando así el oro del canal de los transistores. Enjuague los sustratos con acetona, alcohol isopropílico y agua y séquelos con nitrógeno. Deposite la fotorresistencia sobre los sustratos utilizando los mismos parámetros de los pasos 4.1 y 4.2.
- Coloque el dispositivo en un bromógrafo y coloque sobre el sustrato una máscara fotolitográfica de plástico con las fuentes, los desagües y el diseño de la puerta de control deseados. Exponer a la luz UV durante 1 min desde la parte superior, y retirar con cuidado la mascarilla, teniendo cuidado de minimizar los movimientos laterales de la mascarilla sobre el sustrato para evitar rascarla.
- Desarrolle la fotorresistente como se describe en el paso 4.4. Graba el oro expuesto sumergiéndolo en la solución de grabado de oro (paso 1.3) durante 10 s, enjuágalo con agua desionizada y sécalo con nitrógeno. Inspeccione ópticamente el sustrato y retire la fotorresistente con acetona. Enjuague con alcohol isopropílico y agua desionizada y séquelo con nitrógeno.
9. Deposición y activación del parileno C para la detección de pH
- Deposite la fotorresistencia sobre los sustratos utilizando los mismos parámetros de los pasos 4.1 y 4.2.
- Coloque el dispositivo en un bromógrafo y coloque sobre el sustrato una máscara fotolitográfica de plástico con aberturas correspondientes a las áreas de detección de pH de los OCMFET. Exponer a la luz UV durante 1 min desde la parte superior, y retirar con cuidado la mascarilla, teniendo cuidado de minimizar los movimientos laterales de la mascarilla sobre el sustrato para evitar rascarla.
- Desarrolle la fotorresistente como se describe en el paso 4.4. Proteja todo el dispositivo, excepto las áreas de detección de pH, con cinta aislante de poliimida (consulte la Tabla de materiales). Depositar una capa de 500 nm de parileno C (correspondiente a 1 g de dímero parileno C) sobre el sustrato utilizando los mismos parámetros descritos en el paso 5.1.
NOTA: El espesor total de parileno C en las áreas de detección de pH es de 650 nm. No se requiere silano para esta deposición. - Retire con cuidado la cinta aislante de poliimida. Exponga el sustrato al plasma de oxígeno (5 min y 30 s a 200 W) para activar el Parileno C en las áreas de detección de pH de los OCMFET.
NOTA: La cinta aislante de poliimida es necesaria aquí para limitar la deposición de Parylene C. De hecho, un simple despegue utilizando la fotorresistente no da resultados positivos debido a la naturaleza casi libre de agujeros de ester del recubrimiento conformado obtenido con Parylene C. - Coloque los sustratos en un recipiente de acetona dentro del baño ultrasónico durante 10 s para eliminar completamente la fotorresistente. Enjuague los sustratos con acetona y alcohol isopropílico (sin agua) y séquelos con nitrógeno.
10. Deposición de semiconductores, colocación de la cámara de cultivo y corte final del dispositivo a partir del PET
- Coloque los sustratos sobre una placa caliente a 50 °C. Vierta una gota (1 μL) de solución semiconductora (paso 1.4) en cada área del canal, cubra todo el sustrato con una tapa y déjelo secar debajo de una campana química durante 30 min.
- Prepare la cámara de cultivo imprimiendo un anillo de acrilonitrilo butadieno estireno con un radio interno de 15 mm, un grosor de 1 mm y una altura de 7 mm con una impresora 3D. Pegue la cámara de cultivo en la parte central del sustrato con polidimetilsiloxano (proporción del agente de curado: 15% en peso). Recorte el dispositivo del PET manualmente o con un cortador láser.
11. Caracterización eléctrica de transistores
- Caracterizar cada transistor utilizando un medidor de fuente18,19,20,21 (ver la Tabla de Materiales).
NOTA: Tanto la salida como las características de entrada deben medirse para extrapolar los parámetros de los transistores (principalmente la movilidad de los portadores, el voltaje umbral, la relación ION/IOFF y la pendiente subumbral).
Resultados
El potencial del MOA se ha validado aquí tanto para los registros de actividad eléctrica como para el monitoreo de la actividad metabólica. La estimación precisa de las capacidades del dispositivo para detectar potenciales de acción extracelular se basó en una caracterización exhaustiva con cultivos de cardiomiocitos de rata (particularmente en cardiomiocitos primarios de rata medidos a los 8 días in vitro [DIV])18. La Figura 3A muestra un MOA completo con 16 OCMFET. El recuadro superior muestra un ejemplo de un cultivo de cardiomiocitos de rata confluente que se adhiere a la superficie del MOA. Para resaltar su salud, las células han sido inmunoteñidas para la proteína sarcomérica, tropomiosina, después de la sesión de grabación. El recuadro inferior muestra una sola señal de cardiomiocitos medida con un OCMFET.
Curiosamente, el dispositivo podría detectar la actividad eléctrica espontánea y la actividad inducida por la administración de diferentes productos químicos, como se muestra en la Figura 3B. Esta validación fue crucial para demostrar la viabilidad de utilizar este enfoque para la interfaz de células electrogénicas. Debido a la configuración de la matriz, el MOA también permitió la reconstrucción de la velocidad de propagación de la señal cardíaca, demostrando así la idoneidad del sistema para el estudio de las redes celulares (Figura 3C). Para una mayor validación para determinar el límite de detección real del dispositivo, el MOA también se probó con neuronas estriatales (21 DIV)18, con resultados interesantes en términos de amplitud de señal y la fiabilidad de las grabaciones. Como se ve en la Figura 3D, el OCMFET podría amplificar los potenciales del campo neuronal con una estabilidad notable, mostrando relaciones señal-ruido (SNRS) de hasta 3,2 (en el mismo rango que el de los SNR obtenidos con MEAs estándar25). La configuración de grabación consistió en electrónica multicanal personalizada para el sesgo del transistor y la lectura y acondicionamiento de la señal. Cada canal para la grabación eléctrica tiene una primera etapa que consiste en un convertidor de I / V con una resistencia de retroalimentación de 1 MΩ y un filtro de paso de banda de 150 Hz-1.3 kHz con una ganancia de voltaje de 110. Para todas las mediciones presentadas, los transistores estaban sesgados con VDS = VGS = -1 V. La conversión A/D y la visualización y almacenamiento de datos se realizaron utilizando un tablero de adquisición de datos (ver la Tabla de Materiales). Todas las sesiones de medición se llevaron a cabo dentro de una jaula de Faraday para minimizar el ruido eléctrico y ambiental en el sistema.
Como se mencionó anteriormente, al explotar la funcionalización física simple presentada en el protocolo, fue posible preparar sensores de pH altamente sensibles con una respuesta supernernstiana. Debido al enfoque de fabricación presentado, estos dispositivos de pH podrían integrarse en un MOA y utilizarse para monitorizar las ligeras variaciones de pH inducidas por la actividad metabólica de las neuronas primarias de ratas del hipocampo26. En particular, como se muestra en la Figura 4, sólo uno de los dos OCMFET dedicados a la detección de baja frecuencia se funcionalizó selectivamente para demostrar la viabilidad del enfoque. Esta funcionalización selectiva permitió evaluar la respuesta de los dos OCMFET a las variaciones metabólicas inducidas químicamente: en particular, se puede obtener un estado metabólico alto utilizando bicucullina (BIC), un inhibidor de los receptores GABA A27, mientras que un estado metabólico bajo puede ser inducido por la adición de tetrodotoxina (TTX), que eventualmente causa la muerte celular28 . La configuración de grabación consistió en la misma electrónica multicanal personalizada utilizada para las mediciones electrónicas de actividad.
A diferencia del caso anterior, se utilizaron dos canales dedicados para registrar las variaciones lentas inducidas por la actividad metabólica celular. Cada canal consistía en un circuito simple compuesto por dos bloques principales: un convertidor de I / V con una resistencia de retroalimentación de 1 MΩ y un filtro de paso bajo con una frecuencia de corte de 10 Hz. Los transistores estaban sesgados con VDS = VGS = -1 V, y todas las mediciones se llevaron a cabo dentro de una jaula de Faraday para minimizar el impacto del ruido externo en las grabaciones (este es un aspecto particularmente importante teniendo en cuenta las bajas fluctuaciones de corriente inducidas por la actividad metabólica celular). Durante los experimentos, los cultivos se mantuvieron en un medio de cultivo de bajo amortiguamiento, y todo el sistema se colocó en un ambiente controlado (37 ° C y un flujo continuo de CO2 / aire). Como era de esperar, solo la corriente del OCMFET sensible al pH podría modularse mediante la adición de 25 μM BIC. Esto se confirmó aún más por la inducción de la variación actual por la variación correspondiente de la actividad metabólica celular.
El mismo experimento se repitió después de la adición de 10 μM TTX, lo que resultó en una desaceleración gradual del metabolismo celular. Después de la adición del TTX, ni el OCMFET sensible al pH ni el insensible al pH mostraron respuesta alguna, lo que demuestra la eficacia del enfoque. Estos resultados demuestran la efectividad de la funcionalización propuesta y su relativa estabilidad hasta por 2 semanas. Una conclusión importante que se puede extraer de los experimentos propuestos (tanto la actividad eléctrica como la actividad metabólica) es que es posible preparar diferentes tipos de sensores mediante la funcionalización selectiva de diferentes OCMFET dentro de la misma área de cultivo. Este aspecto representa un logro no trivial en biodetección para aplicaciones celulares porque poder monitorear diferentes parámetros dentro de un mismo cultivo celular es crucial para una mejor caracterización de la complejidad de esos sistemas biológicos.

Figura 1: Vista superior de un MOA de 16 canales para el monitoreo metabólico y eléctrico de células electroactivas. Barra de escala = 1 cm. Abreviaturas: OCMFETs = transistores orgánicos de efecto de campo modulado por carga; FG = puerta flotante; S/D = fuente/drenaje; MOA = matriz micro OCMFET. Haga clic aquí para ver una versión más grande de esta figura.
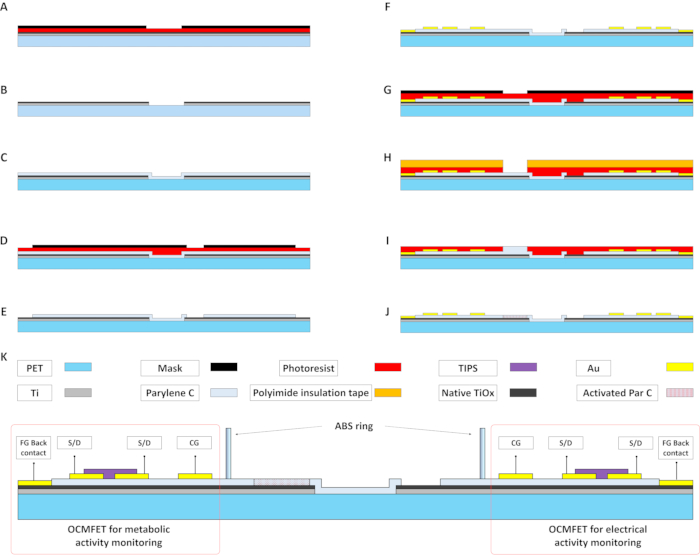
Figura 2: Principales pasos de fabricación de un MOA para el monitoreo metabólico y eléctrico de células electroactivas. (A y B) La película de Ti evaporada se modela utilizando un proceso fotolitográfico estándar para preparar la compuerta flotante de los OCMFET. (C) Deposición de 15 nm de Parylene C. Esta capa, junto con el óxido de Ti nativo, actúa como el dieléctrico de compuerta de los transistores. (D y E) La capa de parileno C se modela mediante tratamiento con oxígeno por plasma. Se utiliza una capa fotorresistente estampada para exponer selectivamente las áreas de detección para las grabaciones eléctricas y los contactos posteriores de la puerta flotante. (F) Modelado de los contactos superiores Au, es decir, la fuente, el drenaje, la puerta de control y el contacto posterior de la puerta flotante. Se utiliza una técnica de autoalineación para mejorar el rendimiento eléctrico del dispositivo. (G-I) Deposición de la segunda capa de parileno C en el área de detección de los OCMFET para el monitoreo de la actividad metabólica. Después de la exposición al plasma de oxígeno, esta capa actuará como la membrana sensible al pH (J). (K) Sección transversal de un MOA completo (con materiales) después de la deposición del semiconductor orgánico (PENTACENO TIPS) y el posicionamiento de la cámara de cultivo. Abreviaturas: OCMFETs = transistores orgánicos de efecto de campo modulado por carga; FG = puerta flotante; S/D = fuente/drenaje; MOA = matriz micro OCMFET; CG = puerta de control; PET = tereftalato de polietileno; Par C = Parileno C; TIPS = 6,13-bis(triisopropilsililetil) pentaceno; ABS = acrilonitrilo butadieno estireno. Haga clic aquí para ver una versión más grande de esta figura.
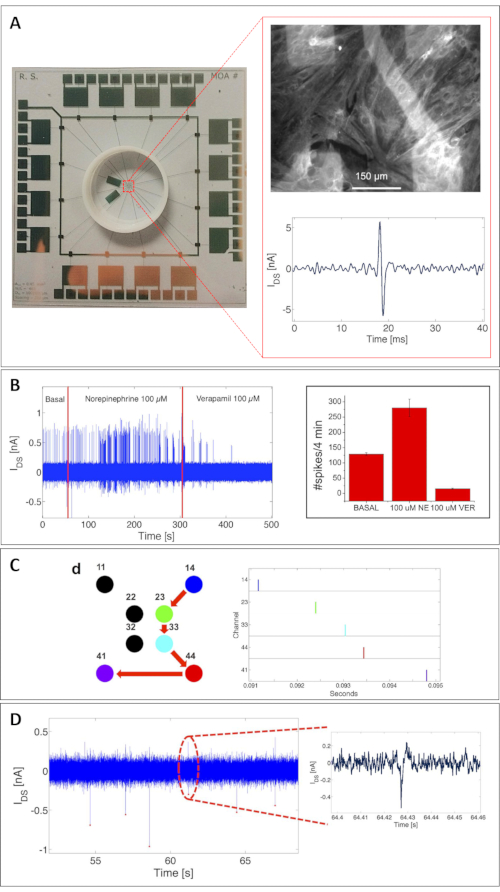
Figura 3: Registros de actividad eléctrica celular con un MOA. (A) Un cultivo confluente de cardiomiocitos de rata (8 DIV) adheridos a la superficie de un MOA, fijados después de una sesión de registro e inmunoteñidos para la proteína sarcomérica, tropomiosina (recuadro superior). Recuadro inferior: ejemplo de una sola señal de cardiomiocitos medida con un OCMFET. Barra de escala = 150 μm. (B) Ajuste químico de la actividad eléctrica de un cultivo de cardiomiocitos. La aceleración de la actividad resultó de la adición de 100 mM de norepinefrina, mientras que la supresión resultó de la adición de 100 mM de verapamilo. Izquierda: modulación de frecuencia de latido; derecha: estadísticas sobre 5 OCMFETs-media y desviación estándar: recuento de picos en 4 min de actividad basal (129 ± 4.6), mediada por norepinefrina (280 ± 28.6) y mediada por verapamilo (15 ± 1.9). (C) Reconstrucción de la propagación de una señal cardíaca. Derecha: gráfico ráster de la actividad espontánea del cultivo que indica la propagación de la señal desde el sitio 14 hasta el sitio 41 (derecha). (D) Potenciales de acción de células estriatales de embrión de rata (21 DIV). Esta cifra ha sido modificada de 18. Abreviaturas: OCMFET = transistor de efecto de campo modulado por carga orgánica; MOA = matriz micro OCMFET; NE = norepinefrina; VER = verapamilo; DIV = días in vitro. Haga clic aquí para ver una versión más grande de esta figura.
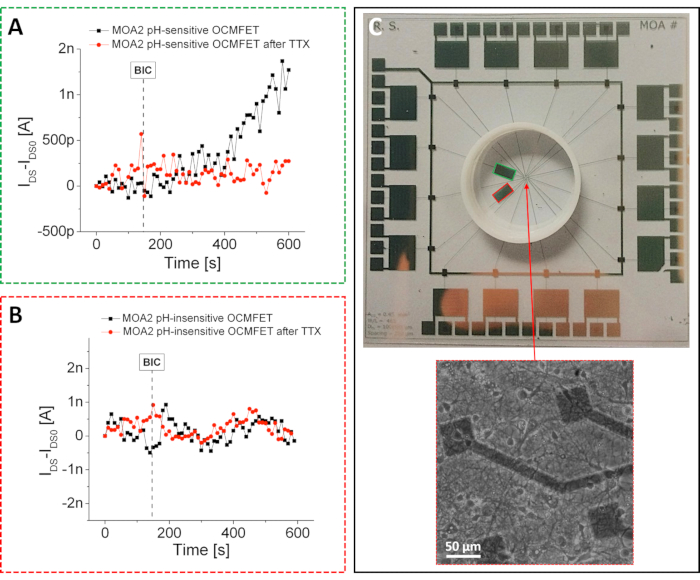
Figura 4: Registros de actividad metabólica con un MOA. Respuesta de los canales (A) sensibles al pH y (B) insensibles al pH de un MOA a la adición de 25 μM BIC antes y después de la adición de 10 μM de TTX. Después de la adición de TTX, el comportamiento del canal sensible al pH se vuelve similar al del canal insensible al pH. En particular, no se puede observar ninguna variación de corriente después de la adición de BIC debido a la muerte celular inducida por TTX. (C) MOA para registros de actividad metabólica. Los OCMFET sensibles al pH y los INSENSIBLES al pH se delinean en verde y rojo, respectivamente. Recuadro: neuronas sanas del hipocampo cultivadas en el dispositivo después de 15 DIV. Barra de escala = 50 μm. Esta cifra ha sido modificada de 26. Abreviaturas: OCMFET = transistor de efecto de campo modulado por carga orgánica; MOA = matriz micro OCMFET; BIC = bicucullina; TTX = tetrodotoxina; DIV = días in vitro. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
A diferencia de los métodos anteriores para la fabricación de OCMFET para aplicaciones celulares18,29, el método propuesto está diseñado específicamente para preparar MOA que puedan detectar simultáneamente la actividad celular eléctrica y metabólica. Además, este enfoque para lograr la sensibilidad del pH tiene la ventaja de ser compatible con los protocolos de fabricación estándar y no implica ninguna modificación química del área de detección (este aspecto garantiza la biocompatibilidad de todo el dispositivo). La sensibilidad al pH se logra utilizando el mismo material utilizado como dieléctrico de compuerta (es decir, el biocompatible Parylene C), lo que hace que este enfoque sea rápido y reproducible.
El resultado final de este enfoque es una herramienta orgánica flexible, transparente, de bajo costo y multidetección para aplicaciones celulares in vitro . El hecho de que esto se pueda obtener utilizando una sola estructura de transistor y una simple modificación física del área de detección se suma a las ventajas que ofrece el uso de materiales y métodos electrónicos orgánicos. Además, debido a que el principio de transducción del OCMFET no depende estrictamente del semiconductor específico o del material FG, todo el proceso puede modificarse y ampliarse según la aplicación específica.
Un aspecto crítico de la técnica propuesta está relacionado con la reproducibilidad de la técnica de activación por plasma. Para obtener resultados consistentes, tanto el espesor del parileno C como su velocidad de grabado deben ser controlados. La calibración frecuente del proceso de deposición de Parylene C y el limpiador de plasma son absolutamente necesarios. Otros aspectos críticos, que también contribuyen a la reproducibilidad del proceso, son el manejo cuidadoso del dispositivo y la deposición del semiconductor orgánico. Aquí se utilizó una técnica simple de lanzamiento de gotas, que intrínsecamente plantea limitaciones de reproducibilidad. Para minimizar esos problemas, como se describe en el paso 10.1 del protocolo, se debe usar la misma cantidad de solución semiconductora cada vez, y la evaporación del solvente debe estandarizarse tanto como sea posible. Mantener una temperatura constante usando una placa caliente y cubriendo el sustrato después de cada deposición de gotas ayudará a ralentizar el proceso de evaporación. Para minimizar aún más este problema, se podría cambiar la técnica de deposición (por ejemplo, utilizando un método de impresión de inyección de tinta)30.
Una limitación del protocolo propuesto se deriva de la naturaleza de la funcionalización del OCMFET para la detección del pH. La estabilidad de los sensores de pH se limita a unas pocas semanas26. Sin embargo, la ventana de estabilidad del enfoque propuesto es lo suficientemente grande como para cubrir los tiempos de incubación estándar necesarios para el crecimiento del cultivo neuronal (2-3 semanas). Se deben considerar otros tipos de funcionalización del área de detección para experimentos más largos. El protocolo de fabricación utiliza un contacto posterior dedicado, lo que permite el acceso eléctrico a los FG. Este contacto, que se deja flotando durante el funcionamiento normal del dispositivo, puede ser explotado para la caracterización eléctrica del dispositivo y la funcionalización de las áreas de detección utilizando diferentes técnicas (por ejemplo, electrodeposición).
Este procedimiento representa una forma conveniente de preparar un dispositivo de detección múltiple para aplicaciones celulares sin la necesidad de materiales expansivos o instalaciones de sala limpia. A pesar de las limitaciones de rendimiento y estabilidad debido al empleo de un semiconductor orgánico y la funcionalización física (no química) del área de detección, se podrían utilizar enfoques similares para preparar sensores y biosensores de bajo costo (y potencialmente desechables), mecánicamente flexibles y ópticamente transparentes, que pueden proporcionar a los investigadores en biología celular, ingeniería de tejidos y neurociencia nuevas herramientas especializadas para estudiar sistemas celulares in vitro.
Divulgaciones
Los autores no tienen conflictos de intereses que declarar.
Agradecimientos
Los autores reconocen la financiación del programa de investigación e innovación Horizonte 2020 de la Unión Europea en virtud del acuerdo de subvención n.º 882897-Search&Rescue y el proyecto PON "TEX-STYLE" ARS01_00996, PNR 2015-2020.
Materiales
| Name | Company | Catalog Number | Comments |
| 3-(Trimethoxysilyl)propyl methacrylate | Sigma Aldrich | 440159 | |
| 3D printer Makerbot Replicator 2x | Makerbot | https://www.makerbot.gr/. Estimated price: 2k-3k euros. | |
| ABS filament | |||
| Anisole | Sigma Aldrich | 296295 | |
| Bromograph model Hellas | Bungard | https://www.bungard.de/. Estimated price: 1k-2k euros. | |
| Gold | Local seller | ||
| Hydrofluoric acid | Sigma Aldrich | 695068 | |
| Iodine | Sigma Aldrich | 207772 | |
| Kapton tape | polyimide insulation tape | ||
| Laser cutter VLS2.30 | Universal Laser Systems | https://www.ulsinc.com/it. Estimated price: 20k euros. | |
| Multichannel Systems acquisition board | www.multichannelsystems.com | ||
| NaOH pellets | Sigma Aldrich | 567530 | |
| Parylene C dimer | SCS special coating systems coating | ||
| PDMS Silgard 184 | Sigma Aldrich | 761036 | |
| PDS 2010 LABCOATER 2 Parylene Deposition System | SCS special coating systems | https://scscoatings.com/. Estimated price: 50k euros | |
| PET film biaxially oriented (thickness 0.25 mm) | Goodfellow | ES301450 | |
| Petri dishes | |||
| Plasma cleaner Gambetti "Tucano" | Gambetti | https://www.gambetti.it/. Estimated price: 20k euros. | |
| Positive photoresist AZ1518 | MicroChemicals | ||
| Potassium iodide KI | Sigma Aldrich | 221945 | |
| Source Meter 2636 | Keithley | https://it.farnell.com/. Estimated price: 18k euros | |
| Spin coater unit | Ossila | https://www.ossila.com/. Estimated price: 2.5k euros. | |
| Stereoscopic microscope SMZ745T | Nikon | https://www.microscope.healthcare.nikon. com/. Estimated price: 2k-3k euros. | |
| Thermal evaporator unit | |||
| TIPS pentacene (6,13-Bis(triisopropylsilylethynyl)-pentacene) | Sigma Aldrich | 716006 | |
| Titanium wire | Goodfellow | TI005129 | |
| Ultrasonic bath | Falc Instruments | https://www.falcinstruments.it/. Estimated price: 1k euro. |
Referencias
- Hubel, D. H. Tungsten microelectrode for recording from single units. Science. 125 (3247), 549-550 (1957).
- Verzeano, M., Negishi, K., Angeles, L. Neuronal activity in cortical and thalamic networks. A study with multiple microelectrodes. Journal of General Physiology. 43 (6), 177-195 (1960).
- Thomas, C. A., Springer, P. A., Loeb, G. E., Berwald-Netter, Y., Okun, L. M. A miniature microelectrode array to monitor the bioelectric activity of cultured cells. Experimental Cell Research. 74 (1), 61-66 (1972).
- Grattarola, M., Martinoia, S. Modeling the neuron-microtransducer junction: from extracellular to patch recording. IEEE Transactions on Biomedical Engineering. 40 (1), 35-41 (1993).
- Wallace, K., Strickland, J. D., Valdivia, P., Mundy, W. R., Shafer, T. J. A multiplexed assay for determination of neurotoxicant effects on spontaneous network activity and viability from microelectrode arrays. NeuroToxicology. 49, 79-85 (2015).
- Bergveld, P. Development, operation, and application of the tool for electrophysiology. IEEE Transactions on Biomedical Engineering. 19 (5), 342-351 (1972).
- Bergveld, P., Wiersma, J., Meertens, H. Extracellular potential recordings by means of a field effect transistor without gate metal, called OSFET. IEEE Transactions on Biomedical Engineering. 23 (2), 136-144 (1976).
- Fromherz, P., Offenhausser, A., Vetter, T., Weis, J. A neuron-silicon junction: a Retzius cell of the leech on an insulated-gate field-effect transistor. Science. 252 (5010), 1290-1293 (1991).
- Martinoia, S., et al. Development of ISFET array-based microsystems for bioelectrochemical measurements of cell populations. Biosensors and Bioelectronics. 16 (9-12), 1043-1050 (2001).
- Heer, F., et al. CMOS microelectrode array for the monitoring of electrogenic cells. Biosensors and Bioelectronics. 20 (2), 358-366 (2004).
- Berdondini, L., et al. Active pixel sensor array for high spatio-temporal resolution electrophysiological recordings from single cell to large scale neuronal networks. Lab on a Chip. 9 (18), 2644-2651 (2009).
- Maccione, A., et al. Multiscale functional connectivity estimation on low-density neuronal cultures recorded by high-density CMOS micro electrode arrays. Journal of Neuroscience Methods. 207 (2), 161-171 (2012).
- Kibler, A. B., Jamieson, B. G., Durand, D. M. A high aspect ratio microelectrode array for mapping neural activity in vitro. Journal of Neuroscience Methods. 204 (2), 296-305 (2012).
- Frega, M., Tedesco, M., Massobrio, P., Pesce, M., Martinoia, S. Network dynamics of 3D engineered neuronal cultures: a new experimental model for in-vitro electrophysiology. Scientific Reports. 4, 5489 (2014).
- Zuo, L., Yu, S., Briggs, C. A., Kantor, S., Pan, J. Y. Design and fabrication of a three-dimensional multi-electrode array for neuron electrophysiology. Journal of Biomechanical Engineering. 139 (12), (2017).
- Spanu, A., et al. A three-dimensional micro-electrode array for in-vitro neuronal interfacing. Journal of Neural Engineering. 17 (3), 036033 (2020).
- Spanu, A., Martines, L., Bonfiglio, A. Interfacing cells with organic transistors: a review of in vitro and in vivo applications. Lab on a Chip. 21 (5), 795-820 (2021).
- Spanu, A., et al. An organic transistor-based system for reference-less electrophysiological monitoring of excitable cells. Scientific Reports. 5, 8807 (2015).
- Viola, F. A., Spanu, A., Ricci, P. C., Bonfiglio, A., Cosseddu, P. Ultrathin, flexible and multimodal tactile sensors based on organic field-effect transistors. Scientific Reports. 8, 8073 (2018).
- Napoli, C., et al. Electronic detection of DNA hybridization by coupling organic field-effect transistor-based sensors and hairpin-shaped probes. Sensors. 18 (4), 990 (2018).
- Spanu, A., et al. A reference-less pH sensor based on an organic field effect transistor with tunable sensitivity. Organic Electronics. 48, 188-193 (2017).
- Lundgaard, I., et al. Direct neuronal glucose uptake heralds activity-dependent increases in cerebral metabolism. Nature Communications. 6, 6807 (2015).
- Zhang, Y. S., et al. Multisensor-integrated organs-on-chips platform for automated and continual in situ monitoring of organoid behaviors. Proceedings of the National Academy of Sciences of the United States of America. 114 (12), 2293-2302 (2017).
- Yu, H., et al. A novel design of multifunctional integrated cell-based biosensors for simultaneously detecting cell acidification and extracellular potential. Biosensors and Bioelectronics. 24 (5), 1462-1468 (2009).
- Maccione, A., et al. A novel algorithm for precise identification of spikes in extracellularly recorded neuronal signals. Journal of Neuroscience Methods. 177 (1), 241-249 (2009).
- Spanu, A., Tedesco, M. T., Martines, L., Martinoia, S., Bonfiglio, A. An organic neurophysiological tool for neuronal metabolic activity monitoring. APL Bioengineering. 2 (4), 046105 (2018).
- Díaz-García, C. M., et al. Neuronal stimulation triggers neuronal glycolysis and not lactate uptake. Cell Metabolism. 26 (2), 361-374 (2017).
- Xie, Y., Dengler, K., Zacharias, E., Wilffert, B., Tegtmeier, F. Effects of the sodium channel blocker tetrodotoxin (TTX) on cellular ion homeostasis in rat brain subjected to complete ischemia. Brain Research. 652 (2), 216-224 (1994).
- Caboni, A., Orgiu, E., Barbaro, M., Bonfiglio, A. Flexible organic thin-film transistors for pH monitoring. IEEE Sensors Journal. 9 (12), 1963-1970 (2009).
- Fraboni, B., Bonfiglio, A., Basiricò, L. Inkjet printing of transparent, flexible, organic transistors. Thin Solid Films. 520, 1291-1294 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados