Method Article
In vitro Multiparametrische Zellanalyse durch mikroorganisch ladungsmodulierte Feldeffekt-Transistorarrays
In diesem Artikel
Zusammenfassung
Hier stellen wir das Herstellungsprotokoll eines OCMFET-basierten (Organic Charge-Modulated Field-Effect Transistor) Geräts für die in vitro zelluläre Schnittstelle vor. Das Gerät, das als Mikro-OCMFET-Array bezeichnet wird, ist ein flexibles, kostengünstiges und referenzloses Gerät, das die Überwachung der elektrischen und metabolischen Aktivitäten elektroaktiver Zellkulturen ermöglicht.
Zusammenfassung
Die moderne Elektrophysiologie wurde ständig durch die parallele Entwicklung immer ausgefeilterer Werkzeuge und Materialien angetrieben. Entdeckungen auf diesem Gebiet wiederum haben den technologischen Fortschritt in einem Hin- und Her-Prozess vorangetrieben, der letztendlich die beeindruckenden Errungenschaften der letzten 50 Jahre bestimmte. Die am häufigsten verwendeten Geräte, die für die zellulare Schnittstelle verwendet werden (nämlich die Mikroelektrodenarrays und mikroelektronischen Bauelemente, die auf Transistoren basieren), weisen jedoch immer noch einige Einschränkungen auf, wie z. B. hohe Kosten, die Steifigkeit der Materialien und das Vorhandensein einer externen Referenzelektrode. Um diese Probleme teilweise zu überwinden, gab es Entwicklungen in einem neuen wissenschaftlichen Bereich namens organische Bioelektronik, was zu Vorteilen wie niedrigeren Kosten, bequemeren Materialien und innovativen Fertigungstechniken führte.
In den letzten zehn Jahren wurden mehrere interessante neue organische Geräte vorgeschlagen, um bequem mit Zellkulturen zu kommunizieren. Dieses Papier stellt das Protokoll für die Herstellung von Geräten für die zelluläre Schnittstelle auf der Grundlage des organischen ladungsmodulierten Feldeffekttransistors (OCMFET) vor. Diese Geräte, sogenannte Micro OCMFET Arrays (MOAs), vereinen die Vorteile der organischen Elektronik und die Besonderheiten des OCMFET zu transparenten, flexiblen und referenzlosen Werkzeugen, mit denen es möglich ist, sowohl die elektrischen als auch die metabolischen Aktivitäten von Kardiomyozyten und Neuronen in vitro zu überwachen und so eine multiparametrische Auswertung von elektrogenen Zellmodellen zu ermöglichen.
Einleitung
Das In-vivo-Monitoring von elektroaktiven Zellen wie Neuronen und Kardiomyozyten stellt einen gültigen und leistungsfähigen Ansatz in der Grundlagenforschung für das menschliche Gehirn, funktionelle Konnektivitätsstudien, Pharmakologie und Toxikologie dar. Die werkzeuge, die normalerweise für solche Studien verwendet werden, basieren hauptsächlich auf Mikroelektrodenarrays (MEAs)1,2,3,4,5 und immer effizienteren und leistungsfähigeren Feldeffektgeräten (FEDs)6,7,8,9,10,11,12 . Diese beiden Gerätefamilien ermöglichen die Echtzeitüberwachung und -stimulation der elektrischen Aktivität von Neuronen und Kardiomyozyten und zeichnen sich in der Regel durch Robustheit, Benutzerfreundlichkeit und Zuverlässigkeit aus. Diese Eigenschaften machen MEAs und FEDs zum Goldstandard für elektrophysiologische Anwendungen, die derzeit als Schnittstelle zu Standardzellkulturen, organotypischen Hirnschnitten und dreidimensionalen Organoiden eingesetzt werden13,14,15,16. Trotz ihrer weit verbreiteten Verwendung und ihrer beeindruckenden Eigenschaften weisen MEAs und FEDs einige Einschränkungen auf, wie z. B. hohe Kosten, die Steifigkeit der Materialien und das Vorhandensein einer normalerweise sperrigen Referenzelektrode, die in der Umgebung der Messflüssigkeit platziert werden muss und für den ordnungsgemäßen Betrieb der Geräte erforderlich ist.
Um alternative Lösungen für die Zellverbindung zu erforschen, wurden in den letzten zehn Jahren große Anstrengungen in die Untersuchung elektronischer Geräte auf der Basis organischer Materialien und innovativer Fertigungstechniken investiert17. Unter den verschiedenen organischen Bauelementen, die untersucht wurden, um die oben genannten Einschränkungen zu beheben, wurde kürzlich ein eigenartiger organischer Transistor namens OCMFET als gültige Alternative zu MEAs und FEDs18 vorgeschlagen. Neben den Standardmerkmalen der organischen Elektroniktechnologie, wie kostengünstige Materialien und Fertigungstechniken, optimale mechanische und chemische Eigenschaften, optische Transparenz und Biokompatibilität, bietet der OCMFET auch eine extrem hohe Ladungsempfindlichkeit (aufgrund seiner doppelseitigen Struktur), ohne dass eine externe Referenzelektrode erforderlich ist. Darüber hinaus hat dieser organische Sensor die bemerkenswerte Fähigkeit, verschiedene analytische /physikalische Parameter zu erfassen, abhängig von der spezifischen Funktionalisierung seines Erfassungsbereichs, der vom Transistorbereich getrennt ist19,20. All diese Eigenschaften können bequem für die Erfassung verschiedener Parameter innerhalb einer Zellkultur genutzt werden. Neben der Erfassung der neuronalen/kardialen elektrischen Aktivität ist es insbesondere auch möglich, die ultrahohe pH-Sensitivität, die die eigentümliche Double-Gated-Struktur des OCMFET bietet, durch eine einfache physikalische Funktionalisierung21 zu nutzen, um die leichten lokalen pH-Schwankungen, die durch zelluläre Stoffwechselaktivität verursacht werden, zuverlässig zu überwachen.
Bei der In-vitro-Zell-Biosensorik ist die Überwachung der zellulären Stoffwechselaktivität ein starker Indikator für den Zustand der Kultur und kann verwendet werden, um die zelluläre Reaktion auf verschiedene Reize wie Arzneimittelverabreichung und elektrische Stimulation zu beurteilen22,23. Darüber hinaus ist im speziellen Fall neuronaler Anwendungen die Überwachung sowohl der elektrischen als auch der metabolischen Aktivitäten von großem Interesse, insbesondere in der Pharmakologie und Toxikologie24. Mit der Absicht, die Anforderungen der modernen In-vitro-Elektrophysiologie komfortabel zu erfüllen und gleichzeitig alle Vorteile des OCMFET zu bieten, wurde kürzlich ein Gerät namens Micro OCMFET Array (MOA) vorgestellt. Das MOA ist ein OCMFET-basiertes Array mit spezialisierten Sensorbereichen, die speziell für die in vitro zelluläre Schnittstelle entwickelt wurden und die multiparametrische Analyse von elektrogenen Zellkulturen ermöglichen. Insbesondere haben zwei MOA-Kanäle größere Erfassungsbereiche, um ihre Empfindlichkeit zu maximieren, und können selektiv funktionalisiert werden, um bestimmte Parameter von Interesse zu überwachen, wie z. B. die pH-Variationen des Kulturmediums. Die anderen OCMFETs in der Struktur fungieren als extrazelluläre elektrische Aktivitätssensoren. Abbildung 1 zeigt die Struktur eines 16-Kanal-MOA. Diese Fähigkeit, kombiniert mit dem Fehlen einer externen Referenzelektrode, macht das MOA zu einem sehr interessanten Werkzeug für In-vitro-Anwendungen. Diese Arbeit stellt das schrittweise Herstellungsprotokoll eines Multisensing-MOA für den In-vitro-Nachweis der elektrischen und metabolischen Aktivitäten von Neuronen und Kardiomyozyten vor. Abbildung 2 zeigt die wichtigsten Fertigungsschritte, die verwendeten Materialien und die Gerätestruktur.
Protokoll
Alle anwendbaren internationalen, nationalen und/oder institutionellen Richtlinien für die Pflege und Verwendung von Tieren wurden befolgt. Es wurden alle Anstrengungen unternommen, um die Anzahl der Tiere für das Projekt zu reduzieren und ihr Leiden zu minimieren.
1. Herstellung der Entwicklungslösung, der Ätzlösungen, der organischen Halbleiterlösung und der photolithographischen Masken
- Bereiten Sie die Entwicklungslösung vor, indem Sie NaOH-Pellets in deionisiertem Wasser in einer Konzentration von 175 mM verdünnen.
HINWEIS: Dies ist eine exotherme Reaktion. Wenn ein Kunststoffbehälter verwendet wird, rühren Sie den Behälter weiter, bis sich alle Pellets vollständig aufgelöst haben. - Bereiten Sie die Titanätzlösung vor, indem Sie Flusssäure (HF) in deionisiertem Wasser (1 Teil konzentriertes 48% HF, 49 Teile deionisiertes Wasser) verdünnen.
VORSICHT: Flusssäure kann leicht in die Haut eindringen und tiefe Gewebeschichten stark schädigen. Eine schnelle Neutralisation von HF ist notwendig, um eine Gewebezerstörung zu verhindern, die tagelang andauern und zu schweren Verletzungen oder sogar zum Tod führen kann. Die mit HF verbundenen Risiken sind abhängig von der Konzentration und der Dauer des Kontakts mit der Säure. Nur unter einem Abzug mit einem Gesichtsschutz verwenden. Doppeltes Gloving wird ebenfalls dringend empfohlen. - Bereiten Sie die Goldätzlösung vor, indem Sie Jod, Kaliumiodid und deionisiertes Wasser mischen (für 250 g Lösung verwenden Sie 200 ml entionisiertes Wasser, 20 g KI, 5 g I2). Rühren Sie die Lösung bei Raumtemperatur für 1 h um und lassen Sie sie vor Gebrauch über Nacht ruhen.
- Die Halbleiterlösung wird durch Lösen von 6,13-Bis(triisopropylsilylethynyl)pentacen (TIPS Pentacene) in Anisol (1 Gew.-%) und vorsichtig 2 h auf einer Heizplatte bei 80 °C gerührt.
HINWEIS: Rühren Sie diese Lösung weiter. Verwenden Sie Durchstechflaschen aus bernsteinfarbenem Glas und/oder lagern Sie sie bei schlechten Lichtverhältnissen. - Bereiten Sie das gewünschte photolithographische Maskenset mit einer Vektorgrafik-Software vor. Bereiten Sie 5 Masken für den gesamten Prozess vor: die Maske für die Musterung der floating gates (FGs); die Maske für das Öffnen der Vias und die Erfassungsbereiche für die elektrophysiologischen Aufnahmen; die Maske für den Selbstausrichtungsprozess; die Maske für die Strukturierung des Quell-, Abfluss- und Kontrolltor-Top-Kontakts; und die Maske für die Plasmaaktivierung der pH-Kanäle.
HINWEIS: Abhängig von der erforderlichen Auflösung und dem spezifischen photolithographischen Setup können verschiedene Arten von Masken verwendet werden. Im Falle der vorgeschlagenen Geräte (die eine maximale laterale Auflösung von 40 μm haben) wurden einfache flexible Kunststoffmasken in einem lokalen Kopiergeschäft gekauft.
2. Substratauswahl und -aufbereitung
- Schneiden Sie ein 6 x 6 cm2 großes Quadrat aus 250 μm Polyethylenterephthalat (PET) aus einer makellosen PET-Platte.
HINWEIS: Beginnen Sie mit einem etwas größeren Substrat als das endgültige Gerät, um genügend Ränder zu haben, um eine Manipulation mit einer Standard-Laborpinzette zu ermöglichen, ohne sie zu beschädigen. - Untersuchen Sie das Substrat mit einem optischen Mikroskop, um das Vorhandensein von tiefen Rillen und Kratzern auszuschließen. Wählen Sie die weniger zerkratzten Substrate sorgfältig aus, da größere Unvollkommenheiten zum Ausfall der endgültigen Vorrichtung führen können.
- Spülen Sie die PET-Substrate mit Aceton, Isopropylalkohol und deionisiertem Wasser (in dieser Reihenfolge) und trocknen Sie sie mit Stickstoffströmen. Lagern Sie die Substrate in sauberen Kunststoff-Petrischalen/-behältern.
3. FG: Titanabscheidung
- Reinigen Sie die Substrate mit Plasmasauerstoff (30 s bei 100 W) und legen Sie sie auf den Substrathalter in der Vakuumkammer des thermischen Verdampfers.
- Geben Sie 60 mg Titan in den Tiegel, schließen Sie den Verschluss und pumpen Sie die Verdampfungskammer hinunter, bis sie ein Vakuumniveau von weniger als 10-6 Torr erreicht. Erhöhen Sie die Leistung des Verdampfers, bis der Tiegel rot leuchtet, und warten Sie 30 s. Öffnen Sie den Verschluss, erhöhen Sie die Leistung auf 60% (oder bis der Tiegel hellweiß leuchtet) und warten Sie 60 s. Schließen Sie den Verschluss und schalten Sie die Stromversorgung aus.
- Entfernen Sie die Substrate aus dem Verdampfer; reinigen Sie sie mit Aceton, Isopropylalkohol und deionisiertem Wasser; und trocknen Sie sie mit Stickstoffströmen. Führen Sie eine zweite Sauerstoffplasmabehandlung (60 s bei 200 W) durch, um die Titanoberfläche leicht zu oxidieren.
4. FG-Musterung
- Legen Sie jeweils ein Substrat auf den Spin Coater, der sich in einem Abzug befindet. Geben Sie 4 ml Fotolack mit einer Einweg-Kunststoffpipette auf das Substrat auf. Verwenden Sie die folgenden Spinbeschichtungsparameter, um eine 2 μm dicke Fotolackschicht zu erhalten: Spingeschwindigkeit: 3000 U/ min; Schleuderzeit: 45 s; Beschleunigungszeit: 0,5 s; Verzögerungszeit: 0,5 s.
- Backen Sie den Fotolack weich, indem Sie das Substrat auf eine Heizplatte legen (70 °C für 5 min). Lagern Sie das Substrat in einer mit Aluminiumfolie umwickelten Petrischale / Kunststoffbehälter, um direkte Lichteinwirkung zu vermeiden.
HINWEIS: Vermeiden Sie die empfohlene Backtemperatur (100 °C für 50 s), um eine Verformung des Substrats zu verhindern. Das Backen bei einer niedrigeren Temperatur für eine längere Zeit sorgt jedoch für gute Ergebnisse. - Legen Sie das Gerät in einen Bromographen und positionieren Sie die photolithographische Kunststoffmaske mit dem gewünschten FG-Layout auf dem Substrat. 1 Minute lang ultraviolettem (UV) Licht von oben aussetzen und die Maske vorsichtig entfernen, wobei darauf zu achten ist, die seitlichen Bewegungen der Maske über das Substrat zu minimieren, um ein Kratzen zu vermeiden.
- Tauchen Sie das Substrat für 5 s in einen mit der Entwicklungslösung gefüllten Glasbehälter (Schritt 1.1). Spülen Sie es schnell in entionisiertem Wasser und trocknen Sie es unter Stickstoff. Verwenden Sie ein optisches Mikroskop, um nach unterentwickelten / überentwickelten Stellen im Substrat zu suchen. Wiederholen Sie das Eintauchen des Substrats in die Entwicklungslösung im Falle einer Unterentwicklung.
- Ätzen Sie das freiliegende Titan, indem Sie es 15 s lang in die Titanätzlösung (Schritt 1.2) tauchen, spülen Sie es mit deionisiertem Wasser ab und trocknen Sie es mit Stickstoff. Untersuchen Sie das Substrat optisch und entfernen Sie den Fotolack mit Aceton. Spülen Sie das Substrat mit Isopropylalkohol und entionisiertem Wasser ab und trocknen Sie es mit Stickstoff.
5. Dielektrische Gate-Abscheidung
- Bereiten Sie die Abscheidekammer des Parylene-Beschichters vor, indem Sie 2 ml des Haftvermittlers (Silan - 3-(Trimethoxysilyl)propylmethacrylat) mit einem Laborwisch auf die Wände der Abscheidekammer verteilen. 300 mg Parylene C Dimer (entsprechend einer Enddicke von 150 nm) auf den Parylene Coater geben. Stellen Sie den unteren Druckwert auf 7 mbar und den höheren Druckwert auf 10 mbar ein. Reinigen Sie die Substrate nach der Ablagerung mit Aceton, Isopropylalkohol und deionisiertem Wasser und trocknen Sie sie mit Stickstoff.
6. Öffnung der Erfassungsbereiche des OCMFET für die Erfassung elektrischer Aktivitäten und Bildung der Vias, um auf die Rückseite der FGs zuzugreifen
- Legen Sie den Fotolack mit den gleichen Parametern wie in den Schritten 4.1 und 4.2 auf den Substraten ab.
- Platzieren Sie das Gerät in einem Bromographen und positionieren Sie die photolithographische Plastikmaske auf dem Substrat für die Vias (kreisförmige Öffnungen mit einem Durchmesser von 50 μm über den Erfassungsbereichen und 100 x 100 μm2 Öffnungen über den FGs weg von den Sensorbereichen (in Abbildung 1 und Abbildung 2 als Rückkontakt der FGs bezeichnet) unter einem stereoskopischen Mikroskop, um die Ausrichtungspräzision zu verbessern. 1 Minute lang UV-Licht von oben aussetzen und die Maske vorsichtig entfernen, wobei darauf zu achten ist, die seitlichen Bewegungen der Maske über dem Substrat zu minimieren, um ein Kratzen zu vermeiden.
HINWEIS: Die Vias auf der Seite der FGs weg vom Erfassungsbereich (dargestellt als Rückkontakt von FGs in Abbildung 1 und Abbildung 2) sind für den Kontakt während der Charakterisierung des Transistors notwendig. Darüber hinaus kann ein elektrischer Zugang zu den FGs für verschiedene Arten der Funktionalisierung (z. B. Galvanoposition) sehr nützlich sein. - Entwickeln Sie den Fotolack wie zuvor in Schritt 4.4 beschrieben. Setzen Sie das Substrat mit dem gemusterten Fotolack (der hier als Maske dient) Sauerstoffplasma (180 s bei 200 W) aus, um das Parylene C aus den Sensorbereichen zu entfernen.
HINWEIS: Die Ätzrate von Parylen C in einem isotropen Plasmareiniger bei 200 W beträgt ca. 90 nm/min. Eine leichte Überätzung wird durchgeführt, um die Erfassungsbereiche weiter zu reinigen. Der Fotolack wird während des Prozesses ebenfalls geätzt. Seine Dicke (2 μm) ist jedoch viel höher als die des Parylen c. - Legen Sie die Substrate für 10 s in einen mit Aceton gefüllten Glasbehälter in das Ultraschallbad, um den Fotolack vollständig zu entfernen. Spülen Sie die Substrate mit Aceton, Isopropylalkohol und Wasser ab und trocknen Sie sie mit Stickstoff.
HINWEIS: Die Verwendung von Beschallung anstelle des einfachen Spülens der Substrate mit Aceton ist entscheidend, um ein unerwünschtes Falten und erneutes Abscheiden von Parylene C-Fragmenten auf der Oberfläche der Sensorbereiche zu verhindern.
7. Selbstausrichtung von Quelle und Abfluss mit dem REA
- Legen Sie den Fotolack mit den gleichen Parametern wie in den Schritten 4.1 und 4.2 auf den Substraten ab. Legen Sie das Gerät in einen Bromographen und positionieren Sie auf dem Substrat eine photolithographische Plastikmaske mit einfachen schwarzen Rechtecken, die die Bereiche des Transistors vollständig bedecken. 1 minute lang UV-Licht von oben und unten aussetzen und die Maske vorsichtig entfernen, wobei darauf zu achten ist, die seitlichen Bewegungen der Maske über das Substrat zu minimieren, um ein Kratzen zu vermeiden.
HINWEIS: Bei der doppelseitigen Belichtung fungieren die FGs als photolithographische Masken in Bezug auf die untere Belichtung, während das Vorhandensein der oberen Maske sicherstellt, dass nur der auf dem Kanal der Transistoren vorhandene Fotolack unbelichtet bleibt. - Entwickeln Sie den Fotolack wie zuvor in Schritt 4.4 beschrieben.
8. Goldablagerung, Kanalbildung und Strukturierung der Quellen, Abflüsse und Kontrolltore
- Reinigen Sie die Substrate mit einer schonenden Plasmabehandlung (30 s bei 30 W), um die Haftung des Metalls auf dem Parylen c zu fördern, und legen Sie sie auf den Substrathalter in der Vakuumkammer des Thermischen Verdampfers.
- Geben Sie 30 mg Gold in den Tiegel, schließen Sie den Verschluss und pumpen Sie die Verdampfungskammer hinunter, bis sie 10-5 Torr erreicht. Erhöhen Sie die Leistung des Verdampfers, bis der Tiegel rot leuchtet, und warten Sie 30 s. Öffnen Sie den Verschluss, erhöhen Sie die Leistung auf 40% (oder bis der Tiegel hellweiß leuchtet), warten Sie 60 Sekunden, schließen Sie den Verschluss und schalten Sie die Stromversorgung herunter.
- Legen Sie die Substrate für 10 s in einen Acetonbehälter im Ultraschallbad, um den Fotolack abzuheben und so das Gold aus dem Kanal der Transistoren zu entfernen. Spülen Sie die Substrate mit Aceton, Isopropylalkohol und Wasser ab und trocknen Sie sie mit Stickstoff. Legen Sie den Fotolack mit den gleichen Parametern wie in den Schritten 4.1 und 4.2 auf den Substraten ab.
- Legen Sie das Gerät in einen Bromographen und positionieren Sie auf dem Substrat eine photolithographische Plastikmaske mit den gewünschten Quellen, Abflüssen und dem Anordnungslayout des Steuertors. 1 minute von oben UV-Licht aussetzen und die Maske vorsichtig entfernen, wobei darauf zu achten ist, die seitlichen Bewegungen der Maske über das Substrat zu minimieren, um ein Kratzen zu vermeiden.
- Entwickeln Sie den Fotolack wie in Schritt 4.4 beschrieben. Ätzen Sie das freiliegende Gold, indem Sie es 10 s lang in die Goldätzlösung (Schritt 1.3) tauchen, mit entionisiertem Wasser abspülen und mit Stickstoff trocknen. Untersuchen Sie das Substrat optisch und entfernen Sie den Fotolack mit Aceton. Mit Isopropylalkohol und entionisiertem Wasser abspülen und mit Stickstoff trocknen.
9. Abscheidung und Aktivierung des Parylene C zur pH-Messung
- Legen Sie den Fotolack mit den gleichen Parametern wie in den Schritten 4.1 und 4.2 auf den Substraten ab.
- Legen Sie das Gerät in einen Bromographen und positionieren Sie auf dem Substrat eine photolithographische Plastikmaske mit Öffnungen, die den pH-Messbereichen der OCMFETs entsprechen. 1 minute von oben UV-Licht aussetzen und die Maske vorsichtig entfernen, wobei darauf zu achten ist, die seitlichen Bewegungen der Maske über das Substrat zu minimieren, um ein Kratzen zu vermeiden.
- Entwickeln Sie den Fotolack wie in Schritt 4.4 beschrieben. Schützen Sie das gesamte Gerät, mit Ausnahme der pH-Messbereiche, mit Polyimid-Isolierband (siehe Materialtabelle). Eine Schicht von 500 nm Parylen C (entsprechend 1 g Parylenc-Dimer) wird unter Verwendung der in Schritt 5.1 beschriebenen Parameter auf dem Substrat abgeschieden.
HINWEIS: Die Gesamtdicke von Parylen C in den pH-Messbereichen beträgt 650 nm. Für diese Ablagerung wird kein Silan benötigt. - Entfernen Sie vorsichtig das Polyimid-Isolierband. Das Substrat sauerstoffplasma (5 min und 30 s bei 200 W) aussetzen, um das Parylen C auf den pH-Messbereichen der OCMFETs zu aktivieren.
HINWEIS: Das Polyimid-Isolierband ist hier notwendig, um die Parylene C-Ablagerung zu begrenzen. Tatsächlich führt ein einfaches Abheben mit dem Fotolack aufgrund der nahezu lochfreien Beschaffenheit der mit Parylene C erhaltenen Schutzbeschichtung nicht zu positiven Ergebnissen. - Legen Sie die Substrate für 10 s in einen Acetonbehälter im Ultraschallbad, um den Fotolack vollständig zu entfernen. Spülen Sie die Substrate mit Aceton und Isopropylalkohol (ohne Wasser) ab und trocknen Sie sie mit Stickstoff.
10. Halbleiterabscheidung, Kultivierungskammerplatzierung und endgültiger Ausschnitt des Geräts aus dem PET
- Legen Sie die Substrate bei 50 °C auf eine Heizplatte. Gießen Sie ein Tröpfchen (1 μL) Halbleiterlösung (Schritt 1.4) auf jede Kanalfläche, bedecken Sie das gesamte Substrat mit einem Deckel und lassen Sie es 30 Minuten unter einer chemischen Haube austrocknen.
- Bereiten Sie die Kulturkammer vor, indem Sie einen Acrylnitril-Butadien-Styrolring mit einem Innenradius von 15 mm, einer Dicke von 1 mm und einer Höhe von 7 mm mit einem 3D-Drucker drucken. Kleben Sie die Kulturkammer mit Polydimethylsiloxan auf den zentralen Teil des Substrats (Verhältnis des Härters: 15 Gew.-%). Schneiden Sie das Gerät entweder manuell oder mit einem Laserschneider aus dem PET aus.
11. Elektrische Charakterisierung von Transistoren
- Charakterisieren Sie jeden Transistor mit einem Sourcemeter18,19,20,21 (siehe Tabelle der Materialien).
HINWEIS: Sowohl die Ausgangs- als auch die Eingangseigenschaften sollten gemessen werden, um die Parameter der Transistoren zu extrapolieren (hauptsächlich die Mobilität der Träger, die Schwellenwertspannung, das ION/IOFF-Verhältnis und die Steigung unterhalb der Schwelle).
Ergebnisse
Das Potenzial des MOA wurde hier sowohl für elektrische Aktivitätsaufzeichnungen als auch für die Überwachung der Stoffwechselaktivität validiert. Die genaue Abschätzung der Fähigkeiten des Geräts zum Nachweis extrazellulärer Aktionspotentiale basierte auf einer gründlichen Charakterisierung mit Rattenkardiomyozytenkulturen (insbesondere in primären Rattenkardiomyozyten, gemessen nach 8 Tagen in vitro [DIV])18. Abbildung 3A zeigt einen kompletten MOA mit 16 OCMFETs. Der obere Einschub zeigt ein Beispiel für eine konfluente Rattenkardiomyozytenkultur, die an der Oberfläche des MOA haftet. Um ihre Gesundheit hervorzuheben, wurden die Zellen nach der Aufnahmesitzung für das sarkomerische Protein Tropomyosin immungefärbt. Der untere Einschub zeigt ein einzelnes Kardiomyozytensignal, das mit einem OCMFET gemessen wurde.
Interessanterweise konnte das Gerät spontane elektrische Aktivität und die Aktivität, die bei der Verabreichung verschiedener Chemikalien induziert wird, erkennen, wie in Abbildung 3B gezeigt. Diese Validierung war entscheidend, um die Machbarkeit der Verwendung dieses Ansatzes für die elektrogene Zellschnittstelle zu demonstrieren. Aufgrund der Array-Konfiguration ermöglichte das MOA auch die Rekonstruktion der Ausbreitungsgeschwindigkeit des Herzsignals und demonstrierte damit die Eignung des Systems für die Untersuchung zellulärer Netzwerke (Abbildung 3C). Zur weiteren Validierung zur Bestimmung der tatsächlichen Nachweisgrenze des Gerätes wurde das MOA auch mit striatalen Neuronen (21 DIV)18 getestet, mit interessanten Ergebnissen in Bezug auf die Signalamplitude und die Zuverlässigkeit der Aufnahmen. Wie in Abbildung 3D zu sehen ist, konnte der OCMFET neuronale Feldpotentiale mit bemerkenswerter Stabilität verstärken und zeigte Signal-Rausch-Verhältnisse (SNRS) von bis zu 3,2 (im gleichen Bereich wie die mit Standard-MEAs25 erhaltenen SNRs). Das Aufnahme-Setup bestand aus einer benutzerdefinierten Mehrkanalelektronik für die Transistorvorspannung und die Signalauslesung und -konditionierung. Jeder Kanal für die elektrische Aufzeichnung verfügt über eine erste Stufe, bestehend aus einem I/V-Wandler mit einem 1 MΩ Rückkopplungswiderstand und einem 150 Hz-1,3 kHz Bandpassfilter mit einer Spannungsverstärkung von 110. Für alle vorgestellten Messungen waren die Transistoren mit VDS = VGS = -1 V vorgespannt. Die A/D-Konvertierung sowie die Visualisierung und Speicherung der Daten erfolgten über ein Datenerfassungsboard (siehe Materialtabelle). Alle Messsitzungen wurden in einem Faradayschen Käfig durchgeführt, um das elektrische Umgebungsgeräusch auf dem System zu minimieren.
Wie bereits erwähnt, war es durch die Nutzung der im Protokoll dargestellten einfachen physikalischen Funktionalisierung möglich, hochempfindliche pH-Sensoren mit einer supernernstianischen Reaktion herzustellen. Aufgrund des vorgestellten Herstellungsansatzes könnten diese pH-Geräte in ein MOA integriert und zur Überwachung der leichten pH-Variationen verwendet werden, die durch die metabolische Aktivität primärer Hippocampus-Rattenneuronen induziert werden26. Insbesondere, wie in Abbildung 4 gezeigt, wurde nur einer der beiden OCMFETs, die der Niederfrequenzerfassung gewidmet sind, selektiv funktionalisiert, um die Machbarkeit des Ansatzes zu demonstrieren. Diese selektive Funktionalisierung ermöglichte die Bewertung der Reaktion der beiden OCMFETs auf chemisch induzierte Stoffwechselschwankungen: Insbesondere kann mit Bicuculline (BIC), einem Inhibitor von GABA-A-Rezeptoren27, ein hoher Stoffwechselzustand erreicht werden, während durch die Zugabe von Tetrodotoxin (TTX) ein niedriger Stoffwechselzustand induziert werden kann, der schließlich zum Zelltod führt28 . Das Aufnahme-Setup bestand aus der gleichen benutzerdefinierten Mehrkanalelektronik, die für die elektronischen Aktivitätsmessungen verwendet wurde.
Im Gegensatz zum vorherigen Fall wurden zwei dedizierte Kanäle verwendet, um die langsamen Variationen aufzuzeichnen, die durch die zelluläre Stoffwechselaktivität induziert werden. Jeder Kanal bestand aus einer einfachen Schaltung, die aus zwei Hauptblöcken bestand: einem I/V-Wandler mit einem 1 MΩ Rückkopplungswiderstand und einem Tiefpassfilter mit einer Grenzfrequenz von 10 Hz. Die Transistoren waren mit VDS = VGS = -1 V vorgespannt, und alle Messungen wurden in einem Faradayschen Käfig durchgeführt, um die Auswirkungen von Außengeräuschen auf die Aufnahmen zu minimieren (dies ist ein besonders wichtiger Aspekt angesichts der geringen Stromschwankungen, die durch die zelluläre Stoffwechselaktivität induziert werden). Während der Experimente wurden die Kulturen in einem niedrig gepufferten Kulturmedium gehalten und das gesamte System in einer kontrollierten Umgebung (37 °C und ein kontinuierlicher CO2/Luft-Fluss) platziert. Erwartungsgemäß konnte nur der Strom des pH-sensitiven OCMFET durch Zugabe von 25 μM BIC moduliert werden. Dies wurde weiter durch die Induktion der Stromvariation durch die entsprechende Variation der zellulären Stoffwechselaktivität bestätigt.
Das gleiche Experiment wurde nach der Zugabe von 10 μM TTX wiederholt, was zu einer allmählichen Verlangsamung des Zellstoffwechsels führte. Nach der Zugabe des TTX zeigten weder das pH-sensitive OCMFET noch das pH-insensitive ein Ansprechen, was die Wirksamkeit des Ansatzes belegt. Diese Ergebnisse zeigen die Wirksamkeit der vorgeschlagenen Funktionalisierung und ihre relative Stabilität für bis zu 2 Wochen. Eine wichtige Schlussfolgerung, die aus den vorgeschlagenen Experimenten (sowohl der elektrischen Aktivität als auch der metabolischen Aktivität) gezogen werden kann, ist, dass es möglich ist, verschiedene Arten von Sensoren vorzubereiten, indem verschiedene OCMFETs innerhalb desselben Kulturbereichs selektiv funktionalisiert werden. Dieser Aspekt stellt eine nicht triviale Errungenschaft in der Biosensorik für zelluläre Anwendungen dar, da die Möglichkeit, verschiedene Parameter innerhalb derselben Zellkultur zu überwachen, entscheidend für eine bessere Charakterisierung der Komplexität dieser biologischen Systeme ist.

Abbildung 1: Draufsicht eines 16-Kanal-MOA zur metabolischen und elektrischen Überwachung elektroaktiver Zellen. Maßstabsleiste = 1 cm. Abkürzungen: OCMFETs = organische ladungsmodulierte Feldeffekttransistoren; FG = Floating Gate; S/D = Quelle/Abfluss; MOA = Mikro-OCMFET-Array. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
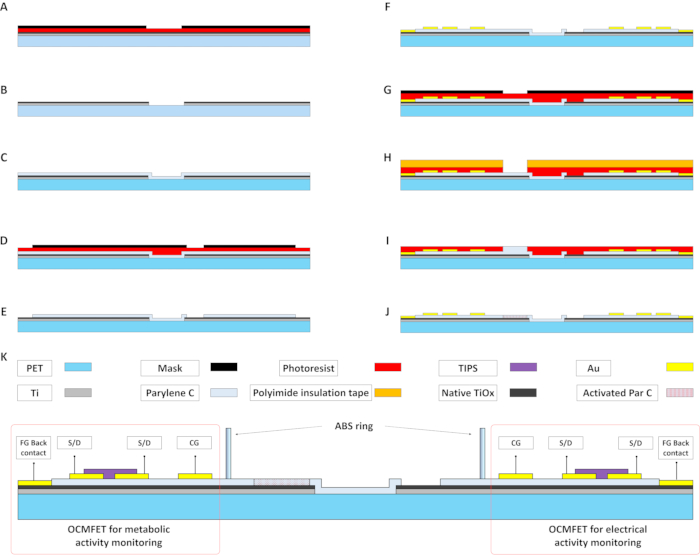
Abbildung 2: Hauptfertigungsschritte eines MOA zur metabolischen und elektrischen Überwachung elektroaktiver Zellen. (A und B) Der verdampfte Ti-Film wird mit einem photolithographischen Standardverfahren gemustert, um das Floating Gate der OCMFETs vorzubereiten. (C) Abscheidung von 15 nm Parylen C. Diese Schicht fungiert zusammen mit dem nativen Ti-Oxid als Gate-Dielektrikum der Transistoren. (D und E) Die Parylen-C-Schicht wird mit Hilfe einer Plasma-Sauerstoffbehandlung strukturiert. Eine gemusterte Fotolackschicht wird verwendet, um die Erfassungsbereiche für die elektrischen Aufzeichnungen und die Floating-Gate-Backkontakte selektiv freizulegen. (F) Strukturierung der Au-Top-Kontakte, d. h. der Quelle, des Abflusses, des Steuergates und des Floating-Gate-Rückkontakts. Eine Self-Alignment-Technik wird verwendet, um die elektrische Leistung des Geräts zu verbessern. (G-I) Abscheidung der zweiten Schicht parylen c auf dem Sensorbereich der OCMFETs zur Überwachung der Stoffwechselaktivität. Nach der Sauerstoffplasma-Exposition fungiert diese Schicht als pH-empfindliche Membran (J). (K) Querschnitt eines kompletten MOA (mit Materialien) nach der Abscheidung des organischen Halbleiters (TIPS Pentacene) und der Positionierung der Kulturkammer. Abkürzungen: OCMFETs = organische ladungsmodulierte Feldeffekttransistoren; FG = Floating Gate; S/D = Quelle/Abfluss; MOA = Mikro-OCMFET-Array; CG = Steuertor; PET = Polyethylenterephthalat; Par C = Parylen C; TIPS = 6,13-Bis(triisopropylsilylethynyl)pentacen; ABS = Acrylnitril-Butadien-Styrol. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
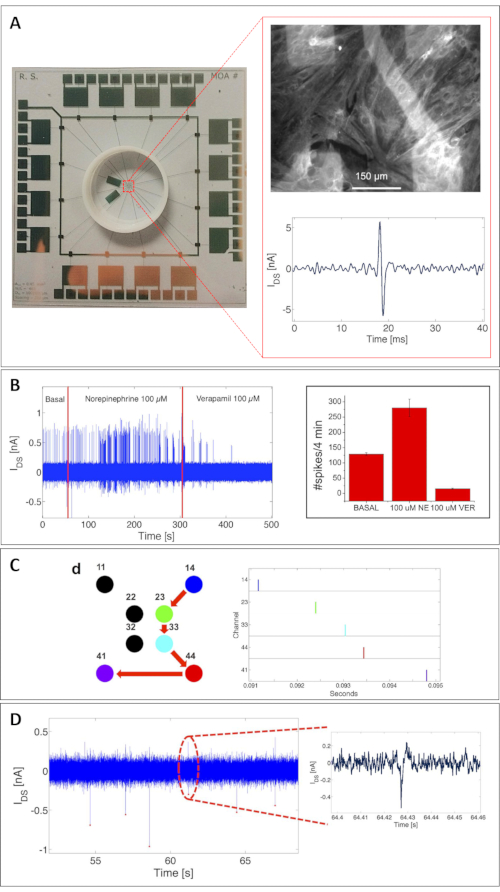
Abbildung 3: Zelluläre elektrische Aktivitätsaufzeichnungen mit einem MOA. (A) Eine konfluente Kultur von Rattenkardiomyozyten (8 DIV), die an der Oberfläche eines MOA haftet, nach einer Aufzeichnungssitzung fixiert und für das sarkomerische Protein Tropomyosin immungefärbt wird (oberer Einschub). Unterer Einschub: Beispiel für ein einzelnes Kardiomyozytensignal, gemessen mit einem OCMFET. Maßstabsbalken = 150 μm. (B) Chemische Abstimmung der elektrischen Aktivität einer Kardiomyozytenkultur. Die Aktivitätsbeschleunigung resultierte aus der Zugabe von 100 mM Noradrenalin, während die Unterdrückung aus der Zugabe von 100 mM Verapamil resultierte. Links: Schlagfrequenzmodulation; rechts: Statistik zu 5 OCMFETs-Durchschnitt und Standardabweichung: Spike-Anzahl bei 4 min basaler (129 ± 4,6), Noradrenalin-vermittelter (280 ± 28,6) und Verapamil-vermittelter Aktivität (15 ± 1,9). (C) Rekonstruktion der Ausbreitung eines Herzsignals. Rechts: Rasterdiagramm der spontanen Aktivität der Kultur, das die Ausbreitung des Signals von Standort 14 nach Standort 41 anzeigt (rechts). (D) Aktionspotentiale von Striatalzellen aus Rattenembryonen (21 DIV). Diese Zahl wurde von 18 geändert. Abkürzungen: OCMFET = organic charge-modulated field-effect transistor; MOA = Mikro-OCMFET-Array; NE = Noradrenalin; VER = Verapamil; DIV = Tage in vitro. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
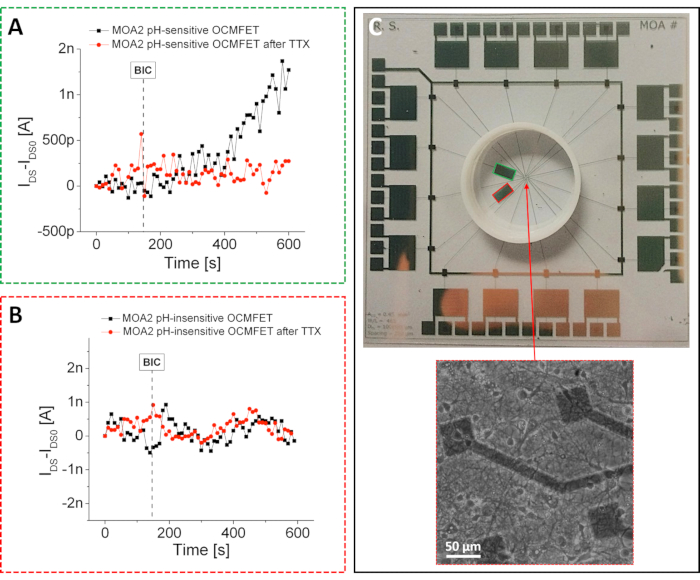
Abbildung 4: Aufzeichnungen der Stoffwechselaktivität mit einem MOA. Reaktion der (A) pH-empfindlichen und (B) pH-unempfindlichen Kanäle eines MOA auf die Zugabe von 25 μM BIC vor und nach der Zugabe von 10 μM TTX. Nach der TTX-Zugabe ähnelt das Verhalten des pH-sensitiven Kanals dem des pH-unempfindlichen. Insbesondere kann nach der BIC-Zugabe aufgrund des TTX-induzierten Zelltodes keine Stromvariation beobachtet werden. (C) MOA für Aufzeichnungen der Stoffwechselaktivität. Die pH-sensitiven und die pH-insensitiven OCMFETs sind grün bzw. rot umrandet. Einschub: gesunde Hippocampus-Neuronen, die nach 15 DIV auf dem Gerät kultiviert wurden. Skalenbalken = 50 μm. Diese Zahl wurde von 26 geändert. Abkürzungen: OCMFET = organic charge-modulated field-effect transistor; MOA = Mikro-OCMFET-Array; BIC = Bikukulin; TTX = Tetrodotoxin; DIV = Tage in vitro. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Im Gegensatz zu früheren Methoden zur Herstellung von OCMFETs für zelluläre Anwendungen18,29 ist die vorgeschlagene Methode speziell für die Herstellung von MOAs konzipiert, die gleichzeitig elektrische und metabolische Zellaktivität nachweisen können. Darüber hinaus hat dieser Ansatz zur Erreichung der pH-Empfindlichkeit den Vorteil, dass er mit Standardherstellungsprotokollen kompatibel ist und keine chemische Modifikation des Erfassungsbereichs beinhaltet (dieser Aspekt gewährleistet die Biokompatibilität des gesamten Geräts). Die pH-Empfindlichkeit wird mit dem gleichen Material erreicht, das als Gate-Dielektrikum verwendet wird (d. H. Das biokompatible Parylen C), was diesen Ansatz schnell und reproduzierbar macht.
Das Endergebnis dieses Ansatzes ist ein flexibles, transparentes, kostengünstiges und multisensierendes organisches Werkzeug für in vitro zelluläre Anwendungen. Die Tatsache, dass dies mit einer einzigen Transistorstruktur und einer einfachen physikalischen Modifikation des Erfassungsbereichs erreicht werden kann, trägt zu den Vorteilen bei, die die Verwendung organischer elektronischer Materialien und Methoden bietet. Da das Transduktionsprinzip des OCMFET nicht streng vom spezifischen Halbleiter oder FG-Material abhängt, kann der gesamte Prozess je nach Anwendung modifiziert und hochskaliert werden.
Ein kritischer Aspekt der vorgeschlagenen Technik bezieht sich auf die Reproduzierbarkeit der Plasmaaktivierungstechnik. Um konsistente Ergebnisse zu erhalten, müssen sowohl die Parylen-C-Dicke als auch seine Ätzrate kontrolliert werden. Eine häufige Kalibrierung des Parylene C-Abscheidungsprozesses und des Plasmareinigers ist unbedingt erforderlich. Weitere kritische Aspekte, die ebenfalls zur Reproduzierbarkeit des Prozesses beitragen, sind der schonende Umgang mit dem Bauelement und die Abscheidung des organischen Halbleiters. Hier wurde eine einfache Drop-Casting-Technik verwendet, die an sich Reproduzierbarkeitseinschränkungen aufweist. Um diese Probleme zu minimieren, sollte, wie in Protokollschritt 10.1 beschrieben, jedes Mal die gleiche Menge Halbleiterlösung verwendet werden, und die Lösungsmittelverdampfung sollte so weit wie möglich standardisiert werden. Die Konstante Temperatur mit einer Heizplatte und das Abdecken des Substrats nach jeder Tröpfchenabscheidung trägt dazu bei, den Verdampfungsprozess zu verlangsamen. Um dieses Problem weiter zu minimieren, könnte die Abscheidetechnik (z. B. mit einem Tintenstrahldruckverfahren) umgestellt werden30.
Eine Einschränkung des vorgeschlagenen Protokolls ergibt sich aus der Art der Funktionalisierung des OCMFET für die pH-Messung. Die Stabilität der pH-Sensoren ist auf wenige Wochen beschränkt26. Das Stabilitätsfenster des vorgeschlagenen Ansatzes ist jedoch groß genug, um die für das Wachstum der neuronalen Kultur erforderlichen Standardinkubationszeiten (2-3 Wochen) abzudecken. Andere Arten der Funktionalisierung des Erfassungsbereichs sollten für längere Experimente in Betracht gezogen werden. Das Fertigungsprotokoll verwendet einen dedizierten Rückkontakt, der den elektrischen Zugriff auf die FGs ermöglicht. Dieser Kontakt, der während des normalen Betriebs des Geräts schweben gelassen wird, kann für die elektrische Charakterisierung des Geräts und die Funktionalisierung der Sensorbereiche mit verschiedenen Techniken (z. B. Elektrodeposition) genutzt werden.
Dieses Verfahren stellt eine bequeme Möglichkeit dar, ein Multi-Sensing-Gerät für zelluläre Anwendungen vorzubereiten, ohne dass umfangreiche Materialien oder Reinraumeinrichtungen erforderlich sind. Trotz der Leistungs- und Stabilitätsbeschränkungen aufgrund des Einsatzes eines organischen Halbleiters und der physikalischen (nicht chemischen) Funktionalisierung des Sensorbereichs könnten ähnliche Ansätze verwendet werden, um kostengünstige (und potenziell einwegfähige), mechanisch flexible und optisch transparente Sensoren und Biosensoren herzustellen, die Forschern in der Zellbiologie, gewebetechnischen und neurowissenschaftlichen Forschung neuartige Spezialwerkzeuge für die Untersuchung zellulärer Systeme in vitro zur Verfügung stellen können.
Offenlegungen
Die Autoren haben keine Interessenkonflikte zu erklären.
Danksagungen
Die Autoren würdigen die Förderung aus dem Forschungs- und Innovationsprogramm Horizon 2020 der Europäischen Union im Rahmen der Finanzhilfevereinbarung Nr. 882897-Search&Rescue-Projekt und dem PON-Projekt "TEX-STYLE" ARS01_00996, PNR 2015-2020.
Materialien
| Name | Company | Catalog Number | Comments |
| 3-(Trimethoxysilyl)propyl methacrylate | Sigma Aldrich | 440159 | |
| 3D printer Makerbot Replicator 2x | Makerbot | https://www.makerbot.gr/. Estimated price: 2k-3k euros. | |
| ABS filament | |||
| Anisole | Sigma Aldrich | 296295 | |
| Bromograph model Hellas | Bungard | https://www.bungard.de/. Estimated price: 1k-2k euros. | |
| Gold | Local seller | ||
| Hydrofluoric acid | Sigma Aldrich | 695068 | |
| Iodine | Sigma Aldrich | 207772 | |
| Kapton tape | polyimide insulation tape | ||
| Laser cutter VLS2.30 | Universal Laser Systems | https://www.ulsinc.com/it. Estimated price: 20k euros. | |
| Multichannel Systems acquisition board | www.multichannelsystems.com | ||
| NaOH pellets | Sigma Aldrich | 567530 | |
| Parylene C dimer | SCS special coating systems coating | ||
| PDMS Silgard 184 | Sigma Aldrich | 761036 | |
| PDS 2010 LABCOATER 2 Parylene Deposition System | SCS special coating systems | https://scscoatings.com/. Estimated price: 50k euros | |
| PET film biaxially oriented (thickness 0.25 mm) | Goodfellow | ES301450 | |
| Petri dishes | |||
| Plasma cleaner Gambetti "Tucano" | Gambetti | https://www.gambetti.it/. Estimated price: 20k euros. | |
| Positive photoresist AZ1518 | MicroChemicals | ||
| Potassium iodide KI | Sigma Aldrich | 221945 | |
| Source Meter 2636 | Keithley | https://it.farnell.com/. Estimated price: 18k euros | |
| Spin coater unit | Ossila | https://www.ossila.com/. Estimated price: 2.5k euros. | |
| Stereoscopic microscope SMZ745T | Nikon | https://www.microscope.healthcare.nikon. com/. Estimated price: 2k-3k euros. | |
| Thermal evaporator unit | |||
| TIPS pentacene (6,13-Bis(triisopropylsilylethynyl)-pentacene) | Sigma Aldrich | 716006 | |
| Titanium wire | Goodfellow | TI005129 | |
| Ultrasonic bath | Falc Instruments | https://www.falcinstruments.it/. Estimated price: 1k euro. |
Referenzen
- Hubel, D. H. Tungsten microelectrode for recording from single units. Science. 125 (3247), 549-550 (1957).
- Verzeano, M., Negishi, K., Angeles, L. Neuronal activity in cortical and thalamic networks. A study with multiple microelectrodes. Journal of General Physiology. 43 (6), 177-195 (1960).
- Thomas, C. A., Springer, P. A., Loeb, G. E., Berwald-Netter, Y., Okun, L. M. A miniature microelectrode array to monitor the bioelectric activity of cultured cells. Experimental Cell Research. 74 (1), 61-66 (1972).
- Grattarola, M., Martinoia, S. Modeling the neuron-microtransducer junction: from extracellular to patch recording. IEEE Transactions on Biomedical Engineering. 40 (1), 35-41 (1993).
- Wallace, K., Strickland, J. D., Valdivia, P., Mundy, W. R., Shafer, T. J. A multiplexed assay for determination of neurotoxicant effects on spontaneous network activity and viability from microelectrode arrays. NeuroToxicology. 49, 79-85 (2015).
- Bergveld, P. Development, operation, and application of the tool for electrophysiology. IEEE Transactions on Biomedical Engineering. 19 (5), 342-351 (1972).
- Bergveld, P., Wiersma, J., Meertens, H. Extracellular potential recordings by means of a field effect transistor without gate metal, called OSFET. IEEE Transactions on Biomedical Engineering. 23 (2), 136-144 (1976).
- Fromherz, P., Offenhausser, A., Vetter, T., Weis, J. A neuron-silicon junction: a Retzius cell of the leech on an insulated-gate field-effect transistor. Science. 252 (5010), 1290-1293 (1991).
- Martinoia, S., et al. Development of ISFET array-based microsystems for bioelectrochemical measurements of cell populations. Biosensors and Bioelectronics. 16 (9-12), 1043-1050 (2001).
- Heer, F., et al. CMOS microelectrode array for the monitoring of electrogenic cells. Biosensors and Bioelectronics. 20 (2), 358-366 (2004).
- Berdondini, L., et al. Active pixel sensor array for high spatio-temporal resolution electrophysiological recordings from single cell to large scale neuronal networks. Lab on a Chip. 9 (18), 2644-2651 (2009).
- Maccione, A., et al. Multiscale functional connectivity estimation on low-density neuronal cultures recorded by high-density CMOS micro electrode arrays. Journal of Neuroscience Methods. 207 (2), 161-171 (2012).
- Kibler, A. B., Jamieson, B. G., Durand, D. M. A high aspect ratio microelectrode array for mapping neural activity in vitro. Journal of Neuroscience Methods. 204 (2), 296-305 (2012).
- Frega, M., Tedesco, M., Massobrio, P., Pesce, M., Martinoia, S. Network dynamics of 3D engineered neuronal cultures: a new experimental model for in-vitro electrophysiology. Scientific Reports. 4, 5489 (2014).
- Zuo, L., Yu, S., Briggs, C. A., Kantor, S., Pan, J. Y. Design and fabrication of a three-dimensional multi-electrode array for neuron electrophysiology. Journal of Biomechanical Engineering. 139 (12), (2017).
- Spanu, A., et al. A three-dimensional micro-electrode array for in-vitro neuronal interfacing. Journal of Neural Engineering. 17 (3), 036033 (2020).
- Spanu, A., Martines, L., Bonfiglio, A. Interfacing cells with organic transistors: a review of in vitro and in vivo applications. Lab on a Chip. 21 (5), 795-820 (2021).
- Spanu, A., et al. An organic transistor-based system for reference-less electrophysiological monitoring of excitable cells. Scientific Reports. 5, 8807 (2015).
- Viola, F. A., Spanu, A., Ricci, P. C., Bonfiglio, A., Cosseddu, P. Ultrathin, flexible and multimodal tactile sensors based on organic field-effect transistors. Scientific Reports. 8, 8073 (2018).
- Napoli, C., et al. Electronic detection of DNA hybridization by coupling organic field-effect transistor-based sensors and hairpin-shaped probes. Sensors. 18 (4), 990 (2018).
- Spanu, A., et al. A reference-less pH sensor based on an organic field effect transistor with tunable sensitivity. Organic Electronics. 48, 188-193 (2017).
- Lundgaard, I., et al. Direct neuronal glucose uptake heralds activity-dependent increases in cerebral metabolism. Nature Communications. 6, 6807 (2015).
- Zhang, Y. S., et al. Multisensor-integrated organs-on-chips platform for automated and continual in situ monitoring of organoid behaviors. Proceedings of the National Academy of Sciences of the United States of America. 114 (12), 2293-2302 (2017).
- Yu, H., et al. A novel design of multifunctional integrated cell-based biosensors for simultaneously detecting cell acidification and extracellular potential. Biosensors and Bioelectronics. 24 (5), 1462-1468 (2009).
- Maccione, A., et al. A novel algorithm for precise identification of spikes in extracellularly recorded neuronal signals. Journal of Neuroscience Methods. 177 (1), 241-249 (2009).
- Spanu, A., Tedesco, M. T., Martines, L., Martinoia, S., Bonfiglio, A. An organic neurophysiological tool for neuronal metabolic activity monitoring. APL Bioengineering. 2 (4), 046105 (2018).
- Díaz-García, C. M., et al. Neuronal stimulation triggers neuronal glycolysis and not lactate uptake. Cell Metabolism. 26 (2), 361-374 (2017).
- Xie, Y., Dengler, K., Zacharias, E., Wilffert, B., Tegtmeier, F. Effects of the sodium channel blocker tetrodotoxin (TTX) on cellular ion homeostasis in rat brain subjected to complete ischemia. Brain Research. 652 (2), 216-224 (1994).
- Caboni, A., Orgiu, E., Barbaro, M., Bonfiglio, A. Flexible organic thin-film transistors for pH monitoring. IEEE Sensors Journal. 9 (12), 1963-1970 (2009).
- Fraboni, B., Bonfiglio, A., Basiricò, L. Inkjet printing of transparent, flexible, organic transistors. Thin Solid Films. 520, 1291-1294 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten