Method Article
Control de la adhesión celular mediante técnicas de patrón de hidrogel para aplicaciones en microscopía de fuerza de tracción
En este artículo
Resumen
La litografía UV cercana y la microscopía de fuerza de tracción se combinan para medir las fuerzas celulares en hidrogeles con micropatrones. La liberación dirigida inducida por la luz de células individuales permite un alto número de mediciones en la misma muestra.
Resumen
La microscopía de fuerza de tracción (TFM) es el principal método utilizado en mecanobiología para medir las fuerzas celulares. Comúnmente, esto se usa para células que se adhieren a sustratos blandos planos que se deforman bajo la tracción celular (2D-TFM). TFM se basa en el uso de materiales elásticos lineales, como el polidimetilsiloxano (PDMS) o la poliacrilamida (PA). Para 2D-TFM en PA, la dificultad para lograr un alto rendimiento resulta principalmente de la gran variabilidad de las formas y tracciones de las células, lo que requiere estandarización. Presentamos un protocolo para fabricar rápida y eficientemente hidrogeles de PA con micropatrones para estudios 2D-TFM. Los micropatrones se crean primero mediante fotolitografía sin máscara utilizando luz UV cercana donde las proteínas de la matriz extracelular se unen solo a las regiones micromodeladas, mientras que el resto de la superficie permanece no adhesiva para las células. El micropatronaje de las proteínas de la matriz extracelular se debe a la presencia de grupos aldehídos activos, lo que resulta en regiones adhesivas de diferentes formas para acomodar células individuales o grupos de células. Para las mediciones de TFM, utilizamos hidrogeles de PA de diferente elasticidad variando las cantidades de acrilamida y bis-acrilamida y rastreando el desplazamiento de perlas fluorescentes incrustadas para reconstruir campos de tracción celular con citometría de tracción por transformada de Fourier regularizada (FTTC).
Para lograr aún más un registro preciso de las fuerzas celulares, describimos el uso de una dosis controlada de luz modelada para liberar tracciones celulares en regiones definidas para células individuales o grupos de células. Llamamos a este método microscopía de fuerza de tracción de iluminación UV local (LUVI-TFM). Con el tratamiento enzimático, todas las células se separan de la muestra simultáneamente, mientras que con LUVI-TFM las fuerzas de tracción de las células en diferentes regiones de la muestra se pueden registrar en secuencia. Demostramos la aplicabilidad de este protocolo (i) para estudiar las fuerzas de tracción celular en función de la adhesión controlada al sustrato, y (ii) para lograr un mayor número de observaciones experimentales a partir de la misma muestra.
Introducción
Al interactuar con su entorno extracelular, las células adherentes ejercen fuerzas que están mediadas principalmente por adherencias focales basadas en integrinas que conectan la matriz extracelular (ECM) con el citoesqueleto de actina. Las adherencias focales son ensamblajes de múltiples proteínas que se centran en la unión de integrinas a proteínas ECM como la fibronectina y el colágeno. La agrupación de integrinas y el crecimiento de adherencias focales es crucial no solo para el establecimiento de una conexión mecánicamente estable, sino también para el reclutamiento de otras proteínas de adhesión focal, incluidas las que activan la vía RhoA para la regulación de la contractilidad celular1. La contractilidad dependiente de RhoA del citoesqueleto de actina permite que las células se propaguen y migren sobre la ECM subyacente, y también perciban su rigidez2. La distribución de las fuerzas de tracción depende en gran medida del área de propagación y la forma de las células, las cuales dependen de las propiedades de la matriz y, por lo tanto, afectan la organización citoesquelética, formando finalmente un circuito de retroalimentación cerrado entre la mecánica de la matriz y la organización citoesquelética3,4.
Las técnicas de micropatronaje de superficie permiten un control definido de la forma celular mediante la creación de regiones de tamaño micrométrico que presentan proteínas adhesivas ECM; según el tamaño de estas regiones, células individuales, o grupos de células que se adhieren al micropatrón5. Las proteínas ECM se pueden modelar en sustratos de vidrio mediante diferentes enfoques, como la impresión de microcontactos, el fotopatronaje o el patrón láser6. El uso de luz UV (λ = 185 o 375 nm) combinado con estrategias antiincrustantes superficiales ofrece la flexibilidad para diseñar diferentes formas y tamaños e inmovilización de múltiples tipos de proteínas con una alta precisión cerca de los bordes de la superficie7,8. Las regiones recubiertas con productos químicos repelentes de proteínas como el polietilenglicol (PEG) están protegidas con una fotomáscara de cromo o un sistema de litografía sin máscara basado en un dispositivo de espejo digital (DMD). Los patrones en las máscaras permiten la exposición a la luz UV de regiones que luego serán modeladas con proteínas ECM. El patrón de superficies de hidrogel con proteínas ECM requiere un paso de transferencia para eliminar las proteínas de la superficie del vidrio y reticularlas a los patrones. Alternativamente, el modelado en materiales blandos se puede lograr recubriendo primero la fotomáscara con una proteína repelente, seguido de quemar las regiones desenmascaradas utilizando iluminación UV profunda. Dado que los rayos UV profundos generan ozono y hacen que la superficie sea reactiva para la unión a proteínas, las regiones desenmascaradas se recubren con proteínas ECM y, finalmente, el gel se polimeriza directamente sobre las regiones no enmascaradas9,10.
Los hidrogeles modelados se pueden utilizar para realizar TFM, una técnica que mide las fuerzas celulares en la interfaz célula-material11. En 2D-TFM, se utiliza la superficie plana de una película de polímero grueso, en la que se han incrustado perlas de marcador para rastrear deformaciones12,13,14,15. Para extraer vectores de desplazamiento, es esencial combinar dos imágenes, una del estado deformado y una imagen de referencia sin deformaciones. Las dos imágenes se asignan entre sí con el procesamiento de imágenes. A alta densidad de marcadores, esto generalmente se hace con la Velocimetría de Imagen de Partículas (PIV), que es un método bien establecido para reconstruir el flujo hidrodinámico. A baja densidad de marcadores y en 3D-TFM, esto generalmente se hace con la Velocimetría de Seguimiento de Partículas (PTV), que incluye características específicas del conjunto de datos experimentales. Un ejemplo de una alternativa computacionalmente más barata es el flujo óptico, como el algoritmo Kanade-Lucas-Tomasi (KLT)16. En el caso de los sustratos de hidrogel, las perlas fluorescentes generalmente se incrustan a alta densidad durante la polimerización del material, y las imágenes se registran antes y después de la liberación celular tras el desprendimiento enzimático. El desprendimiento enzimático de las células adherentes, por ejemplo, por tripsinización, conduce a la liberación simultánea de tracciones celulares de todas las células en los hidrogeles, lo que dificulta la obtención de un análisis detallado de un gran número de células.
Aquí presentamos un protocolo para preparar hidrogeles con micropatrones para controlar la forma y localización celular y un método para medir eficientemente las fuerzas de tracción en secuencia utilizando UV para separar células individuales del sustrato. Para las mediciones de la fuerza de tracción, presentamos una técnica para producir hidrogeles de PA de doble capa, donde las perlas fluorescentes se incrustan solo en la capa superior, lo que aumenta su densidad y reduce su propagación vertical. La combinación de la liberación mediada por UV de las fuerzas de tracción celular con el micropatronaje permite obtener un control espacial sobre el desprendimiento celular (por ejemplo, de células individuales sin afectar la adhesión de otras células en la región de interés), siempre que haya una distancia suficiente entre las células modeladas. La tracción celular se reconstruye utilizando el método más eficiente y fiable para 2D-TFM, a saber, la citometría de tracción por transformada de Fourier (FTTC) con regularización17,18.
Protocolo
1. Preparación de fundas metacriladas
NOTA: Las cubiertas de vidrio se methacrylated para unir covalentemente los hidrogeles de PA y, por lo tanto, evitar su desprendimiento durante la incubación con las células. Las cubiertas de vidrio del microscopio se utilizan para lograr una alta calidad de imagen.
- Para preparar una solución de 300 ml, tome un vaso de precipitados de vidrio limpio de 400 ml y colóquelo dentro de una campana de humos.
- Añadir 10 ml de agua destilada doble (ddH2O) en el vaso de precipitados. Agregue 18.75 mL de ácido acético (≥99.8% pro análisis, p.a.), 18.75 mL de metacrilato de 3-(Trimethoxysilyl)propyl y 252.5 mL de etanol (≥99.8% p.a.) usando una pipeta serológica. Vierta la solución en un plato cristalizante.
- Limpie las cubiertas redondas de vidrio de 24 mm con toallitas de precisión. Coloque las fundas en un estante de politetrafluoretileno hecho a medida.
- Sumerja el bastidor en la solución e incube durante 15 minutos a temperatura ambiente (RT).
- Tome la rejilla y enjuague todas las fundas con etanol (99.8% anual). Seque las cubiertas bajo el flujo de aire.
NOTA: Las fundas metracriladas se pueden almacenar hasta por 1 mes en RT.
2. Micropatronaje de proteínas de la matriz extracelular en hojas de vidrio
NOTA: Las cubiertas de vidrio se recubren primero con una capa de moléculas, que comprende proteínas y repelente celular. Esta capa se elimina mediante una técnica de fotopatronaje, para permitir la posterior deposición de proteínas de la matriz extracelular en regiones micromodeladas.
- Tome una funda de vidrio redonda de 15 mm y colóquela en una placa de Petri. Use un bolígrafo de diamante para marcar la parte superior del cubrehojas. Luego, proceda a la limpieza mediante tratamiento con plasma de oxígeno a 0.4 mbar y 200 W durante 2 min.
- Pipeta 100 μL de solución de poli-L-lisina al 0,01% en la superficie de cada funda. Incubar durante 30 min en RT. Lavar las fundas con 10 mM de ácido 4-(2-hidroxietil)-1-piperazinatanosulfónico (HEPES) pH 8.5. Retire el exceso de líquido, pero mantenga la superficie húmeda.
- Pipeta 100 μL de 50 mg/mL de ácido valerico poli(etilenglicol) metil éter succinimidil valerico (mPEG-SVA) en 10 mM HEPES pH 8.5 en la superficie de cada funda. Incubar durante 1 h en RT. Enjuagar las fundas con 10 mM HEPES pH 8.5 y secar bajo el flujo de aire.
- Agregue 2 μL de fotoiniciador sensible a los rayos UV (por ejemplo, PLPP-gel) seguido de 40 μL de etanol (≥99,8% anual) en la superficie. Para obtener una distribución homogénea del gel y el etanol en la superficie, incline suavemente la placa de Petri hacia adelante y hacia atrás. Espere 5 minutos para que la solución se polimerice.
- Coloque un solo cubrebocas dentro de una placa de Petri de 35 mm con un orificio de 20 mm en la parte inferior. Esto permite que el rayo láser que viene de debajo llegue directamente a la superficie del vidrio.
- Encienda el microscopio y un módulo de modelado de luz (solo se permite trabajar con este dispositivo después de una introducción de seguridad de los oficiales de seguridad láser). Calibra el láser UV-A en el objetivo de aire 20x. Coloque la muestra con el fotoiniciador en el escenario. Ajuste el enfoque en la superficie del vidrio y active el control de enfoque. Cargue y bloquee el patrón prediseñado.
- Prepare el patrón utilizando un software de gráficos como Inkscape. Asegúrese de que el archivo de patrón no exceda las dimensiones DMD (1824 x 1140 px, que corresponde a 552 x 325 μm en lentes de 20 x (0,28 μm/px)).
NOTA: Se recomienda utilizar el tamaño DMD (1824 x 1140 píxeles) como tamaño de archivo de patrón, ya que esto garantizará que no haya errores durante el patrón. Por ejemplo, no produzca un archivo de patrón con una dimensión de 1830 x 1130 píxeles. - Para el propósito de la transferencia de patrones a poliacrilamida, asegúrese de que el patrón se realice solo hasta el 60% -70% del radio desde el centro del vidrio hasta el borde.
- Para modelar una sola celda, use un diámetro de 50-100 μm con la distancia de 100 μm entre patrones y un diámetro de 150-300 μm para un grupo celular. El tamaño apropiado del patrón depende en gran medida del tamaño típico de la célula, y tiene que ser lo suficientemente grande como para permitir que las células se adhieran.
- Prepare el patrón utilizando un software de gráficos como Inkscape. Asegúrese de que el archivo de patrón no exceda las dimensiones DMD (1824 x 1140 px, que corresponde a 552 x 325 μm en lentes de 20 x (0,28 μm/px)).
- Comience el modelado por dosis UV de 30 mJ/mm2. La duración del patrón depende del número de patrones. Hacer un solo patrón toma aproximadamente 1 s.
- Después de completar el paso de modelado, enjuague la superficie con solución salina tamponada con fosfato (PBS) tres veces. Incubar la muestra con 100 μL de 25 μg/mL de fibronectina disuelta en 1x PBS y 25 μg/mL de fibrinógeno Alexa488 conjugado en PBS durante 1 h a RT. Para otras proteínas ECM, encuentre las concentraciones óptimas que cubran completamente las regiones modeladas.
- Enjuague la superficie con 1x PBS tres veces. Asegúrese de que el vidrio estampado se utilice inmediatamente para la transferencia de vidrio-PA. Guarde el vidrio estampado en PBS en RT durante la preparación del hidrogel.
3. Fabricación de hidrogeles de poliacrilamida estampados
NOTA: Se preparan hidrogeles de poliacrilamida, incluyendo N-hidroxietil acrilamida (HEA) oxidada para presentar grupos aldehídos reactivos para la unión covalente de proteínas de la matriz en la superficie. Además, se utiliza un enfoque de doble capa para incrustar perlas fluorescentes solo en la capa superior del hidrogel para mejorar el registro del desplazamiento de perlas durante los experimentos de microscopía de fuerza de tracción.
- Coloque las fundas de vidrio metacriladas en una placa de Petri.
- Para preparar una solución fresca de HEA oxidada, agregue 9,55 ml de agua de doble destilación en un tubo de centrífuga de 15 ml. Luego, agregue 0.5 ml de HEA y 42 mg de sodio (meta) periodato para obtener 10 ml de la solución. Revuelva continuamente la solución en la oscuridad durante 4 h.
- Mezcle acrilamida, bis-acrilamida y agua de doble destilación de acuerdo con la Tabla 1, para obtener 10 ml de hidrogel de solución madre (hágalo debajo de la campana de humos, los monómeros son neurotóxicos). Desgasificar y cerrar la tapa a un sello hermético.
NOTA: La solución madre se puede mantener en alícuotas hasta 1 año a 4 °C. Siempre caracterice el módulo de Young del hidrogel antes de su uso. - Prepare un hidrogel pa de doble capa (hágalo debajo de la campana de humos, los monómeros son neurotóxicos).
- Comience con la capa inferior mezclando suavemente 99,3 μL de solución madre, 0,5 μL de persulfato de amonio al 1% (APS) y 0,2 μL de tetrametilendiamina (TEMED) en un tubo de 1,5 ml. Tome 10 μL de la solución y pipetearlo gota a gota en el centro de la cubierta metacrilada.
- Coloque con cuidado una cubierta redonda de 15 mm en la gota y espere 45 minutos para la polimerización. Separe suavemente el cobertor superior con un bisturí.
- Para la capa superior, mezcle suavemente 93,3 μLof solución madre con 1 μL de solución HEA oxidada fresca, 5 μL de perlas fluorescentes (correspondientes a tres perlas por micra cuadrada para perlas de tamaño 200 nm), 0,5 μL de APS al 1% y 0,2 μL de TEMED en un tubo de 1,5 ml. Tome 5 μL de la solución y pipetearlo en sentido de gota en el centro de la capa inferior ya polimerizada.
- Coloque suavemente la cubierta con micropatrones sobre la gota. Espere 45 minutos en RT para que la gota se polimerice. Asegúrese de que el lado estampado toque la gota. Separe suavemente el cubrehojas con un bisturí.
- Pegue los trozos de cubierta de 24 mm en la parte inferior de las placas de 6 pocillos perforadas a medida con pegamento de silicona de dos componentes. Después de 5 min, agregue PBS a los pozos.
- Caracterizar el módulo de Young de las muestras de hidrogel de poliacrilamida mediante microscopía de fuerza atómica (AFM).
- Monte un voladizo de punta esférica en el soporte AFM.
- Calibrar cada voladizo adquiriendo una curva fuerza-distancia (punto de consigna de 3-4 V) sobre un sustrato duro (por ejemplo, vidrio o mica), extrapolar la sensibilidad en voladizo, retraerse de la superficie y realizar una sintonía térmica para obtener su constante de resorte.
- Coloque los voladizos calibrados sobre la muestra de hidrogel y adquiera curvas de fuerza en tampón PBS, utilizando los siguientes parámetros: punto de consigna de fuerza de 20-30 nN, velocidad de aproximación y retracción de 5 o 10 μm / s, tamaño de rampa de 5 μm.
NOTA: Se utilizó un microscopio óptico invertido, equipado con un objetivo de aire 40x y un filtro de proteína fluorescente verde (GFP) para visualizar y apuntar a áreas con micropatrones ECM dentro de las muestras de hidrogel PA. - Traza las curvas de fuerza adquirida frente a las curvas de distancia con el software de análisis AFM.
- Encuentre el punto de contacto y convierta las curvas de fuerza versus distancia en curvas de fuerza versus curvas de sangría.
- Ajuste la parte de sangría de la curva con el modelo de Hertz (o un modelo mecánico adecuado en función de la geometría de la punta), utilizando una relación de Poisson entre 0.2 y 0.5.
4. Liberación local de las fuerzas de tracción celular mediante iluminación láser UV-A (LUVI-TFM)
NOTA: El láser UV-A se aplica para liberar fuerzas de tracción en células localizadas en regiones definidas de los hidrogeles. El láser UV-A (es decir, λ = láser de estado sólido de 375 nm, <15 mW) es un láser de clase 3B. El rayo láser no blindado es peligroso para los ojos y, a menudo, para la piel. La luz y la radiación reflejadas y dispersadas pueden ser peligrosas. Además, la radiación UV puede causar cáncer de piel. El trabajo con dispositivos solo está permitido después de la introducción de seguridad de los oficiales de seguridad láser.
- Aspirar el PBS de los pozos.
- Sembrar 3 x 106 células por placa de 6 pocillos en medio de crecimiento. Para los fibroblastos, use el Medio Águila Modificada (DMEM) de Dulbecco con alto contenido de glucosa que contiene L-glutamina y se complementa con 10% de suero bovino fetal (FBS) y 1% de penicilina / estreptomicina. Incubar las células durante la noche a 37 °C/5% de CO2. Lave las muestras para eliminar las células flotantes antes de comenzar la microscopía.
- Encienda la cámara de incubación del microscopio y el suministro de gas para obtener una temperatura de 37 °C y una atmósfera de CO2 del 5%.
- Encienda el microscopio y el módulo de modelado láser. Si es necesario, recalibre el láser UV-A en el objetivo de aire 20x utilizando el software Leonardo. Coloque la placa de 6 pocillos hecha a medida con las muestras en el escenario. Ajuste el enfoque en la superficie de la apósito.
- Configure el patrón de iluminación y marque las celdas de interés. Vuelva a enfocar en la superficie del hidrogel. Adquirir la imagen de las células en el canal de campo brillante. Cambie al canal Cy5 (filtro rojo lejano, excitación de 650 nm, emisión de 670 nm) y tome una imagen de las cuentas en estado deformado.
- Cambie al canal láser. Encienda el láser durante 3 minutos. En nuestra configuración particular, esto correspondía a una dosis ligera de 6.000 mJ/mm2.
- Cambie al canal Cy5 y adquiera una imagen de las cuentas en estado no deformado.
NOTA: Para experimentos con fibroblastos embrionarios de ratón, espere 15 minutos después de la exposición para registrar la imagen de referencia/no deformada (consulte la sección Resultados representativos ). Puede ser diferente para otro tipo de células. Repita los pasos 4.5-4.7 de nuevo para otra(s) celda(s) de interés. - Para medir el estrés oxidativo elevado después de la iluminación UV-A, utilice el reactivo disponible comercialmente (CellRox). CellRox no es fluorescente en estado reducido y, cuando se oxida por especies reactivas de oxígeno, emite fluorescencia con un máximo de emisión de ~665 nm.
- De acuerdo con el protocolo proporcionado, agregue un reactivo de 5 μM en el medio de imagen e incube durante 30 min a 37 ° C / 5% de CO2. Luego, lave las células 3x con PBS caliente 1x y reemplace el medio de imagen. Registre la señal Cy5 mediante imágenes de fluorescencia antes y después de la iluminación UV-A utilizando una exposición a la luz similar.
5. Procesamiento de imágenes, velocimetría de imágenes de partículas y cálculo de fuerzas de tracción
NOTA: Las fuerzas de tracción celular se registran analizando el desplazamiento de las perlas fluorescentes y se calculan utilizando herramientas de análisis de imágenes basadas en la velocimetría de imágenes de partículas.
- Imágenes de perlas fluorescentes abiertas, antes (es decir, deformadas) y después del láser (es decir, sin deformar) utilizando Fiji. Combinar dos imágenes como una pila (Imagen | Pilas | Imágenes para apilar).
- Corrija la deriva lateral entre las dos imágenes utilizando el complemento StackReg (P. Thévenaz, Instituto Federal Suizo de Tecnología de Lausana). Cambiar imágenes a 8 bits (imagen | Tipo | 8 bits) y volver a escalar a 1024 x 1024 pix (Imagen | Escala). Guardar como secuencia de imágenes (formato TIFF) con la imagen de referencia siempre al principio.
- Adquirir el campo vectorial de desplazamiento mediante una técnica de correlación cruzada19 a partir del campo PIV tal como se implementó en el proyecto OpenPIV.
- Asegúrese de que la imagen relajada (sin deformar) y la imagen deformada estén cubiertas con ventanas de búsqueda de tamaño wR y wD en píxeles. Para cada ventana de búsqueda, defina una función de correlación cruzada mediante la siguiente fórmula:
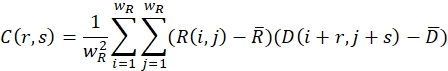
Aquí, R(i,j) y D(i,j) describen los campos de intensidad de las dos imágenes truncadas a la ventana de búsqueda seleccionada y posteriormente reflejadas.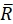 y
y 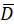 describir su valor medio. Los tamaños de ventana se eligen para ser wR = 32 y wD = 32 y se utiliza una superposición del 70% entre las ventanas de búsqueda vecinas.
describir su valor medio. Los tamaños de ventana se eligen para ser wR = 32 y wD = 32 y se utiliza una superposición del 70% entre las ventanas de búsqueda vecinas. - Para cada ventana de búsqueda, determine un vector de
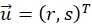 desplazamiento que optimice la función de correlación cruzada y asígnela a la posición central de la ventana de búsqueda. La precisión de los subpíxeles se obtiene utilizando un ajuste gaussiano alrededor de la región máxima como se describe20.
desplazamiento que optimice la función de correlación cruzada y asígnela a la posición central de la ventana de búsqueda. La precisión de los subpíxeles se obtiene utilizando un ajuste gaussiano alrededor de la región máxima como se describe20. - Buscar y eliminar vectores de desplazamiento ambiguos. Vectores de desplazamiento correspondientes a ventanas de búsqueda donde la relación entre dos máximos locales más altos de la función de correlación cruzada por debajo de un umbral de 1,5 se considera ambigua21.
- Descarte los vectores de desplazamiento que no superen la prueba de mediana normalizada para un umbral residual de 1,522.
- (Opcional) Corrija la deriva lateral restante restando un vector
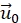 fijo de todos los desplazamientos. Esto se hace porque el desplazamiento en un área seleccionada lejos de la célula desaparece.
fijo de todos los desplazamientos. Esto se hace porque el desplazamiento en un área seleccionada lejos de la célula desaparece. - Interpole el campo vectorial de desplazamiento resultante a una cuadrícula regular con un espaciado de 4 px de las imágenes de entrada utilizando una interpolación polinómica cúbica. Los puntos de datos que faltan se rellenan mediante una extrapolación de spline bivariada suave. Un vector de desplazamiento en píxeles está relacionado con una deformación local por la relación de píxeles de la imagen (0,33 μm/px para lentes de aire 20x).
- (Opcional) El espejo rellena la imagen para reducir los artefactos de timbre en el análisis posterior.
- Multiplica el campo de deformación por una función de ventana Tukey para eliminar el efecto de borde debido a la corrección de deriva, con un parámetro de 0.2-0.3. En este experimento, el área micromodelada que se encuentra en el centro del FOV es de interés.
- Asegúrese de que la imagen relajada (sin deformar) y la imagen deformada estén cubiertas con ventanas de búsqueda de tamaño wR y wD en píxeles. Para cada ventana de búsqueda, defina una función de correlación cruzada mediante la siguiente fórmula:
- Reconstruir la tracción mediante citometría de tracción por transformada de Fourier regularizada (FTTC)18. Como regularización utilizamos la opción razonable más simple, a saber, la regularización tikhonov (L2) de 0º orden23,24,25. Se elige un parámetro de regularización óptimo λ tal que minimice la función de Validación Cruzada Generalizada (GCV) definida por26:
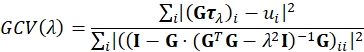
Aquí τλ es un vector apilado que contiene las componentes x e y del campo de tracción reconstruido para el valor dado de λ para todos los modos de muestreo de Fourier y G es el operador lineal que asigna los campos de tracción a su campo de desplazamiento correspondiente, como se define para FTTC. La suma se ejecuta sobre componentes vectoriales. ui son los componentes x e y del campo de desplazamiento para todos los modos de muestreo de Fourier. GCV es ampliamente utilizado en el campo de los problemas inversos mal planteados y es una buena alternativa al criterio de la curva L a menudo utilizado en TFM. Un filtro Lanzcos se utiliza para reducir las introducciones de artefactos debido al espacio de frecuencia limitado y el muestreo ascendente del campo de desplazamiento. El cálculo de la tracción depende del módulo de Young del PA (por ejemplo, 11,3 kPa) y de la relación de Poisson (por ejemplo, para el PA en el rango entre 0,2 y 0,5 dependiendo de la concentración de reticulante).
Resultados
Los hidrogeles de PA fueron polimerizados en cubiertas de vidrio metacriladas, que presentan grupos reactivos para el enlace covalente de la PA. De esta manera, al colocar los hidrogeles en una solución acuosa, se evitó su desprendimiento del sustrato (Figura 1A-D). Para obtener una alta densidad de marcadores fiduciarios cerca de la superficie del hidrogel, desarrollamos la preparación de un hidrogel PA de doble capa. La capa inferior, sin perlas fluorescentes, se polimerizó en la cubierta metacrilada. Posteriormente, otra capa que contenía perlas se polimerizó en la parte superior de la capa inferior (Figura 1E-H), reemplazando la necesidad de sedimentación, que a menudo se utiliza para lograr la distribución de cuentas en un solo plano focal y aumentar la densidad de cuentas. Para lograr el control sobre la forma de la célula durante las mediciones de TFM, producimos hidrogeles de PA con micropatrones a través de la transferencia directa de microestructuras con patrón de fibronectina desde una cubierta de vidrio al PA prepolimerizado (Figura 1F-F'). La adición de un 1% de reticulador no convencional (HEA oxidado) en la solución de capa de hidrogel superior proporciona grupos aldehído que se unen covalentemente a los grupos amina de fibronectina.
Preparamos hidrogeles de PA, que tienen aproximadamente 60 μm de espesor y perlas fluorescentes confinadas en la capa superior cerca de la superficie del hidrogel. Este tipo de hidrogel es un sustrato adecuado para la obtención de imágenes de tracciones celulares con microscopios invertidos y lo suficientemente grueso (se ha informado que el espesor mínimo para realizar TFM es de 20-30 μm)18 para evitar cualquier impacto del sustrato de vidrio. La localización de las perlas fluorescentes se obtuvo mediante microscopía confocal (Figura 1I). Para visualizar la transferencia de proteínas en el hidrogel, utilizamos proteínas ECM marcadas fluorescentemente y las fotografiamos mediante microscopía de epifluorescencia (Figura 1J). Preparamos círculos micromodelados de fibronectina con un diámetro de 100 μm (lado izquierdo) y 50 μm (lado derecho) para permitir la adhesión de grupos de células o células individuales, como se muestra en la superposición de imágenes de campo brillante de células adherentes, y cuentas fiduciales marcadas fluorescentemente y micropatrones de fibronectina. En una muestra diferente, la respuesta de adhesión de células individuales a la fibronectina micromodelada se validó mediante microscopía de inmunofluorescencia indirecta para obtener imágenes de la localización de proteínas de adhesión focal como la paxillin (Figura 1K).
Tanto el recubrimiento proteico ECM como la rigidez del hidrogel son parámetros cruciales para la adhesión celular26. Para caracterizar las propiedades mecánicas de nuestros hidrogeles de PA, realizamos experimentos de nanoindentación por AFM27, junto con un microscopio de epifluorescencia. Los sustratos de hidrogel de tres rigideces diferentes se prepararon y probaron con nuestra configuración (Figura 2 y Tabla 1). Los voladizos AFM en forma de esfera se abordaron cíclicamente y se retrajeron desde hidrogeles de PA sin patrón y fibrinógeno conjugados a áreas con micropatrones Alexa488, mientras registraban curvas de fuerza-distancia. Posteriormente, la evaluación del punto de contacto y la aplicación del modelo de Hertz nos permitió estimar el módulo de Young (E) de cada muestra. El micromodelado ECM no alteró el módulo de Young, que permaneció comparable a cada uno de los hidrogeles de PA sin patrón.
Para medir las fuerzas de tracción ejercidas por las células adherentes sobre el sustrato, desarrollamos una configuración experimental para TFM basada en referencia llevada a cabo en un microscopio de epifluorescencia de campo amplio equipado con un módulo láser UV cercano (UV-A 6000 mJ / mm2) para liberar tracciones celulares (Figura 3A). Como la iluminación del rayo láser se puede controlar espacio-temporalmente, no solo es posible exponer selectivamente una sola célula o un grupo celular con una dosis alta de láser, sino que también, y lo que es más importante, el paso intermedio disruptivo de la eliminación celular de toda la muestra utilizando una enzima digestiva como la tripsina ya no es necesario. La iluminación de las células con una dosis de láser tan alta indujo un estrés oxidativo elevado que conduce a la muerte celular (Figura 3B). La muerte celular produjo la liberación de tracciones del sustrato, como lo indica el desplazamiento de la perla (ilustrado en la Figura 3A). Combinamos la iluminación UV-A con un módulo de modelado de luz para iluminar selectivamente regiones del tamaño de micras de los hidrogeles de PA (Figura 3B-C). De esta manera es posible liberar las tracciones de grupos celulares micropatronados (Figura 3C,F) o células individuales (Figura 3B). Es importante destacar que, en nuestras escalas de tiempo, las propiedades mecánicas de los hidrogeles con patrón ECM no se vieron afectadas significativamente por la exposición a los rayos UV (Figura 2C). El aumento del estrés oxidativo se muestra en la Figura 3D,E. Las fuerzas de tracción se reconstruyeron mediante el uso de FTTC regularizado con un parámetro de regularización elegido por Validación Cruzada Generalizada (Figura 3B, F). La liberación de fuerzas para células individuales ocurrió durante un período de 15 min, y el resultado del LUVI-TFM es comparable al TFM basado en tripsina (Figura 3G-H).
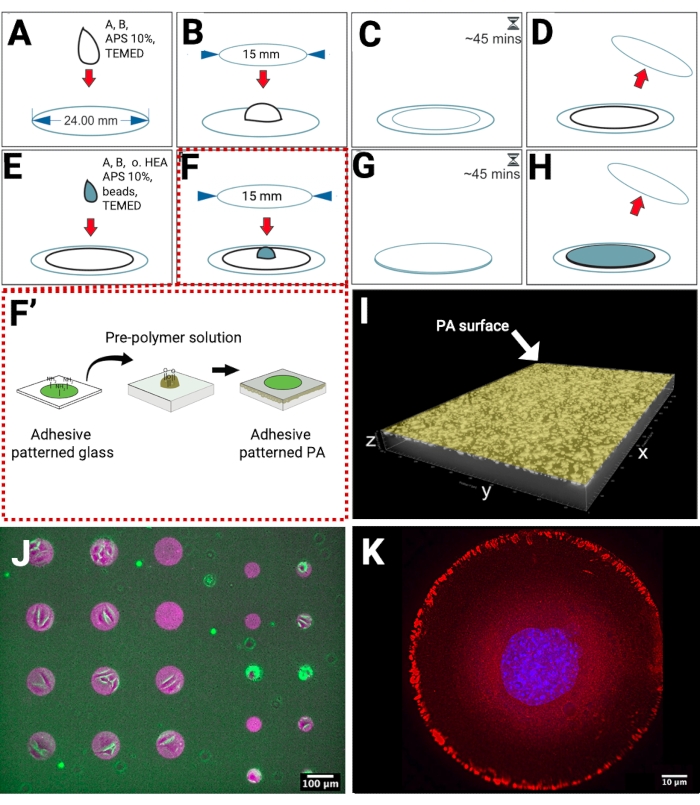
Figura 1: Esquema de preparación patrón de fibronectina-sustrato para TFM. (A) La solución para la capa inferior se pipetea sobre una superficie metacrilada. (B) Se coloca cuidadosamente una funda limpia más pequeña en la gota. (C) El tiempo de gelificación es de 45 min. (D) La cubierta superior está separada. La capa inferior está lista. (E) La solución para la capa superior se pipetea en el hidrogel. (F) La cubierta estampada se coloca cuidadosamente en la gota. (F') El micropatronaje de proteínas adhesivas en el vidrio se produce mediante litografía UV cercana sin máscara, y luego se transfiere del vidrio al hidrogel PA. Los grupos de aminas libres de las proteínas adhesivas, por ejemplo, la fibronectina, se unen covalentemente a los grupos aldehído en la superficie de PA. (G) El tiempo de gelificación es de 45 min. (H) El capó superior está desprendido. El hidrogel PA estampado está listo. (I) Una representación 3D de una micrografía xyz confocal que muestra una alta densidad de cuentas fiduciales cerca de la superficie. (J) Una micrografía de fibronectina marcada fluorescentemente (magenta) en la superficie de PA con perlas fluorescentes incrustadas (verde), superpuestas con una imagen de campo brillante de las células. (K) Imágenes de microscopía de inmunofluorescencia indirecta de una sola célula adherida a un micropatrón de fibronectina en forma de círculo (100 μm). Núcleo (azul), paxillina (rojo). Haga clic aquí para ver una versión más grande de esta figura.
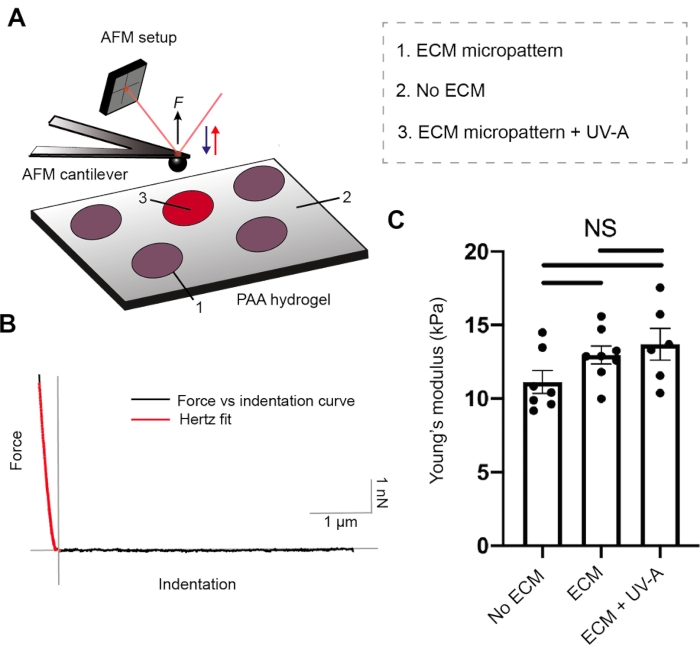
Figura 2: Caracterización de las propiedades mecánicas de la muestra por AFM. (A) Configuración experimental de nanoindentación AFM. Se utiliza un voladizo en forma de esfera para sondear los micropatrones ECM antes o después del tratamiento UV, y las regiones sin patrón de las áreas de PA de doble capa (5% acrilamida, 0,3% bis-acrilamida). (B) Fuerza representativa versus curva de indentación para micropatrones ECM (negro). El ajuste de hercios (rojo) se utiliza para calcular el módulo de Young (E) de la muestra. (C) Mediciones mecánicas para áreas de PA de doble capa sin patrón (sin ECM), micropatrones ECM y micropatrones ECM después de la exposición a UV-A. Las barras muestran ± S.E.M. (prueba ANOVA de Brown-Forsythe y Welch). Haga clic aquí para ver una versión más grande de esta figura.

Figura 3. La iluminación UV-A local TFM (LUVI-TFM) permite mediciones de la fuerza de tracción local dentro de un gran campo de visión. (A) Esquema de iluminación UV-A local TFM. Las células se tratan con una dosis alta de láser UV-A para obtener la imagen no deformada (referencia). (B) La imagen de campo brillante de una sola célula antes de la iluminación láser UV-A. Medio: La imagen de campo brillante de una sola célula después de la iluminación láser UV-A. Derecha: Fuerza de tracción de un solo MEF adherido a un hidrogel PA recubierto de fibronectina (E = 5,74 kPa) iluminado con un haz de luz UV de 50 μm de diámetro (línea discontinua roja). (C) Izquierda: Registro de las fuerzas de tracción de un grupo de fibroblastos embrionarios de ratón (MEF) adheridos a la fibronectina micromodelada (círculo, 100 μm de diámetro). El cúmulo se iluminó con un haz de luz UV de 200 μm de diámetro (línea discontinua roja). Derecha: Registro de las fuerzas de tracción de un grupo de fibroblastos embrionarios de ratón (MEF) adheridos a la fibronectina micromodelada (círculo, 300 μm de diámetro). El cúmulo se iluminó con un haz de luz UV de 300 μm de diámetro (línea discontinua roja). Barra de escala = 200 μm. (D,E) Un aumento en el estrés oxidativo en las células indicado por el aumento de la intensidad de la señal Cy5 después de una dosis alta de láser UV-A se detecta por microscopía de fluorescencia. El estrés oxidativo conduce a la muerte celular. Barra de escala = 200 μm. (F) Izquierda: Mapa de calor de estrés de un grupo de fibroblastos embrionarios de ratón (MEF) adheridos a fibronectina micromodelada (círculo, diámetro de 100 μm). Derecha: El mapa de calor de estrés de un grupo de fibroblastos embrionarios de ratón (MEF) que se adhieren a la fibronectina micropatronada (círculo, 300 μm de diámetro). (G) Las células MEF que se adhieren a micropatrones de fibronectina de 100 μm liberan lentamente sus tracciones después de la exposición a los rayos UV-A. La liberación completa se logra después de 15 minutos (la imagen de referencia se tomó 15 minutos después de la exposición). (H) Una comparación con el TFM convencional basado en tripsina para células MEF que se adhieren a la fibronectina patrón de 300 μm de diámetro. El resultado de la iluminación UV-A (6.000 mJ/mm2) seguida de 15 min de espera no es significativamente diferente del tratamiento convencional con tripsina (es decir, 0,05% durante 20 min). Las barras muestran la media S.E.M. (prueba t de Student de dos colas, ****P < 0.0001, * P < 0.05, ns P ≤0.5). Haga clic aquí para ver una versión más grande de esta figura.
| Acrilamida (%) | Bis-acrilamida (%) | Acrilamida a partir de solución madre al 40 % (ml) | Bis-acrilamida a partir de solución madre al 2 % (ml) | Agua (ml) | Módulo de Young (kPa) |
| 4 | 0.1 | 1 | 0.5 | 8.5 | 5,74 ± 0,53 |
| 5 | 0.15 | 1.25 | 0.75 | 8 | 9,69 ± 0,68 |
| 5 | 0.3 | 1.25 | 1.5 | 7.25 | 11,33 ± 1,06 |
Tabla 1: Mezclas de solución madre de hidrogel y elasticidad resultante
Todos los datos se depositan en el Repositorio de Datos de Acceso Abierto de The Max Planck Society (Edmond) y se puede acceder a ellos a través de la siguiente dirección: https://edmond.mpdl.mpg.de/imeji/collection/JTu8PlWqpbymN9Qf
Discusión
En este protocolo, describimos la preparación de hidrogeles de PA con micropatrones que contienen perlas fluorescentes, que se utilizan como marcadores fiduciarios para estudios de TFM. Nuestro enfoque se basa en tres pasos: 1) preparación de hidrogeles de PA de doble capa; 2) micropatronaje de proteínas ECM y su transferencia a la superficie del hidrogel; 3) uso de luz UV cercana estampada para TFM. La configuración experimental para analizar las tracciones celulares al sustrato requiere el uso de materiales elásticos lineales con valores de rigidez conocidos para calcular las fuerzas relacionadas con el desplazamiento de las perlas fluorescentes26. Los hidrogeles de PA son fáciles de preparar, la rigidez se puede ajustar fácilmente y se utilizan comúnmente para la detección de rigidez y TFM18,28. Sin embargo, para obtener tiempos de polimerización reproducibles y una polimerización homogénea de todo el hidrogel, se debe prestar atención a las condiciones de almacenamiento y el tiempo para los reactivos, por ejemplo, APS debe mantenerse en un desecador para evitar perder su actividad; TEMED debe protegerse de la luz directa. El uso de HEA oxidado permite la unión covalente de proteínas de la matriz en la superficie del hidrogel, lo que podría ser ventajoso para lograr la formación de una capa de proteína completa y estable. La solución de HEA oxidada debe prepararse fresca cada vez que se fabriquen hidrogeles de PA. El hidrogel de PA de doble capa ofrece tres ventajas principales: 1) proporciona una forma alternativa de obtener reproduciblemente una distribución homogénea de las perlas fiduciales cerca de la superficie del hidrogel, sin la necesidad de hacer que el gel sea extremadamente delgado (es decir, <20 μm). El control sobre el espesor del hidrogel es crucial para obtener mediciones precisas con TFM. Cuando el sustrato elástico es demasiado delgado, las células adherentes fuertes, como los fibroblastos, pueden detectar y responder mecánicamente al sustrato de vidrio rígido subyacente29,30. Los hidrogeles gruesos hacen que la adquisición de imágenes para la reconstrucción de la fuerza sea más desafiante. Además, muchos microscopios no tendrán suficiente espacio para acomodarlos, teniendo en cuenta el grosor adicional del sustrato de vidrio utilizado para unir el hidrogel, a menos que se utilicen portaobjetos de microscopía ultradelgados. 2) En el hidrogel de PA de doble capa, la distribución homogénea de las perlas fiduciales cerca de la superficie del hidrogel de PA se logra sin usar una centrífuga, sino más bien con una simple incubación de cantidades precisas de soluciones de hidrogel y perlas fluorescentes. La alta densidad de perlas es una ventaja significativa al realizar el análisis PIV porque aumenta la resolución de las fuerzas de tracción y la relación señal-ruido sin la necesidad de microscopía confocal. 3) El confinamiento de las perlas en una capa delgada cerca de la interfaz célula-material permite obtener imágenes de las fuerzas de tracción con microscopios de epifluorescencia, así como microscopios confocales. Al preparar el hidrogel, el usuario debe asegurarse de que se adhiera firmemente al vidrio inferior antes de continuar con los pasos posteriores del protocolo. Recomendamos seguir el tiempo de incubación indicado para la polimerización de las capas de hidrogel, ya que puede ser difícil quitar el vidrio en la parte superior de la superficie sin dañar la superficie del hidrogel.
Las técnicas más conocidas para medir las propiedades elásticas son la AFM, la nanoindentación, las pruebas de tracción y la reometría. Sin embargo, la nanoindentación induce tensiones muy altas en los materiales que pueden afectar la determinación de las propiedades elásticas. Las pruebas de tracción y la reometría, por otro lado, son técnicas de medición macroscópica, mientras que las células interactúan a escala microscópica31,32. AFM permite mediciones a microescala con cepas reducidas en condiciones fisiológicas. La fiabilidad de las mediciones de AFM puede verse afectada negativamente si faltan detalles experimentales (por ejemplo, fuerza y velocidad de indentación) o si no se registran datos suficientes27. Huth et al. describen un algoritmo para extraer los módulos de Young de los datos de AFM, que enfatiza mantener constantes los detalles de medición27. Este algoritmo ofrece una determinación precisa y confiable de los módulos de Young y se utilizó para nuestros experimentos. Además, medimos muchas curvas en muestras fabricadas en diferentes días y obtuvimos resultados muy similares (variación de los valores medios de aprox. 1-2 kPa). Esto demuestra que la rigidez de nuestros geles se puede predecir de manera confiable.
En este protocolo, utilizamos un módulo de fotopatronaje para crear regiones micromodeladas en vidrio, que luego se transfieren a las superficies de hidrogel. El micropatronaje que se muestra en este protocolo se basa en la litografía casi UV sin máscara basada en DMD (dispositivo de microespejo digital) (λ = 375 nm)7. Un DMD consiste en una gran cantidad de microespejos en un chip. Un solo píxel corresponde a un solo microespejo. El archivo de imagen de patrón pixelado de una computadora se proyecta a través de DMD y se enfoca en la superficie utilizando una lente de objetivo. Para el micropatronaje de proteínas, la luz láser enfocada se utiliza para escindir cepillos de polímero repelente con la ayuda de un fotoiniciador. Posteriormente, las regiones expuestas se llenan de proteínas ECM. Este método de ablación sin máscara ofrece una gran flexibilidad en el diseño de nuevos patrones, ya que no depende del uso de una fotomáscara. Diseñar y aplicar un patrón es muy fácil, ya que solo lleva varios minutos usar un software gratuito como Inkscape. Sin embargo, el número de patrones y muestras producidos en un corto período de tiempo es un inconveniente importante, ya que este método solo se puede usar para modelar un solo sustrato cada vez. El módulo de fotopatronaje utiliza una fuente láser de estado sólido UV cercana que emite varios milivatios. El rayo láser sin blindaje es peligroso para los ojos y la piel. La luz y la radiación reflejadas y dispersadas también pueden ser peligrosas. La manipulación debe ir acompañada de una instrucción de seguridad de los oficiales de láser. El paso más crítico en el protocolo cuando se utiliza un módulo de fotopatronaje es asegurarse de que durante el micropatronaje y la ablación el láser se enfoque correctamente en la superficie. Una dosis de iluminación constante (intensidad multiplicada por el tiempo) de luz UV durante el patrón depende de cómo se enfoca el láser en la superficie. Una intensidad débil en la superficie debido a un enfoque deficiente puede resultar en la falla de la transferencia de ECM a la superficie del hidrogel, lo que resulta en que no haya células que se adhieran al hidrogel.
En los experimentos de TFM, después de la imagen inicial de las células adherentes y los marcadores fiduciarios, las células se liberan del hidrogel pa mediante el tratamiento con tripsina para registrar su estado relajado. Un inconveniente en la realización de este paso es el manejo de la muestra en la etapa de microscopía. Sin una cámara de perfusión, abrir la tapa del plato, aspirar el medio, enjuagar y pipetear la solución de tripsina representa un desafío para los principiantes y los usuarios experimentados. De hecho, estos procedimientos son una fuente importante de la deriva en los ejes xyz , lo que resulta en la pérdida de posición y enfoque. Nuestro protocolo de iluminación UV local hace que TFM sea una técnica más accesible para principiantes. Cabe señalar que utilizamos un módulo de fotomodelado sin máscara basado en microscopía disponible comercialmente, pero en principio se podría usar cualquier sistema de iluminación UV-A, eventualmente en combinación con una máscara para proteger regiones de los sustratos, donde las fuerzas de tracción celular no deben registrarse. Exponer las células con una dosis significativa de luz visible de baja longitud de onda (por ejemplo, la luz violeta que excita la emisión de DAPI) conducirá a un aumento del estrés oxidativo, lo que puede resultar en fototoxicidad y muerte celular. Por lo tanto, esta técnica se puede aplicar incluso en un microscopio de epifluorescencia sin un módulo láser UV. Sin embargo, como la intensidad es mucho más débil, será mucho más fácil lograr TFM con el tratamiento enzimático en este caso.
Con LUVI-TFM es posible utilizar la misma muestra para varias mediciones debido al desprendimiento local de células individuales o pequeños grupos de células. Sin embargo, se debe prestar atención a la selección de células para separar, para evitar el registro de fuerzas de las células vecinas. Por lo tanto, para las mediciones de una sola célula en ausencia de micropatrones, se deben evitar las regiones abarrotadas; para las mediciones en celdas de micropatrones individuales, los patrones deben diseñarse de tal manera que la distancia entre estructuras individuales sea al menos el doble del diámetro del área modelada. También recomendamos no usar células de patrones adyacentes en secuencia, sino muestrearlas de regiones distantes en el sustrato. Nuestra medición se realiza bien en un microscopio de epifluorescencia equipado con una función de control de enfoque y una lente de 40 x aire NA = 0.9, donde la distancia de trabajo de la lente es lo suficientemente larga y el movimiento rápido de un pozo a otro es altamente ajustable. El desprendimiento dirigido de células para aplicaciones de TFM es eficaz para medir la fuerza celular de una sola célula o de todo un grupo de células pequeñas (por ejemplo, hasta 300 μm de diámetro). Usando nuestra configuración, observamos el redondeo y desprendimiento celular para el tratamiento UV de células individuales (Figura 3A), mientras que el desprendimiento rara vez ocurrió para grupos de células pequeñas. Esto podría llevar a una subestimación de las fuerzas de tracción celular. Para grupos celulares más grandes, se recomienda el desprendimiento enzimático, ya que los usuarios deben usar un objetivo de aire 20x para obtener imágenes de todo el clúster y se necesita una función de control de enfoque. Como la profundidad de enfoque de la lente de aire 20x es mucho más larga, el manejo no será tan crítico como el objetivo de mayor aumento. El usuario debe asegurarse de que el enfoque esté configurado correctamente para la ablación de células, ya que la dosis de iluminación depende del enfoque láser en la superficie. Si bien somos conscientes de las posibles limitaciones en el uso de LUVI-TFM en colectivos celulares debido a posibles interacciones mecánicas con células vecinas no tratadas, este aspecto podría resultar útil para estudios sobre la mecánica de la extrusión celular dirigida, por ejemplo, a partir de monocapas epiteliales.
En conclusión, con nuestro enfoque TFM combinado con la liberación inducida por la luz de células micropatronadas, proporcionamos un protocolo robusto y de alto rendimiento para medir las fuerzas de adhesión celular. La versatilidad de este método podría explotarse aún más utilizando la microscopía y la configuración de imágenes destinadas a mejorar la resolución y la sensibilidad.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a la Sra. Rebecca Alvarado por el apoyo en la producción del video del protocolo y al Sr. Stephen Casale por la crítica constructiva sobre el manuscrito. Agradecemos a los colegas del Departamento de Biofísica Celular del Instituto Max Planck de Investigación Médica por las útiles discusiones. El apoyo financiero de la Max-Planck-Gesellschaft a E.A.C.-A. y la Deutsche Forschungsgemeinschaft (DFG SFB1129, Projektnummer 240245660, P15 a E.A.C.-A. y P4 a U.S.S.; DFG EXC 2082/1-390761711 a EE.UU.) también es muy reconocido. J.B. agradece a la Fundación Carl Zeiss por su apoyo financiero. E.A.C.-A., C.S. y U.S.S. reconocen la financiación a través de Max Planck School Matter to Life con el apoyo del Ministerio Federal Alemán de Educación e Investigación (BMBF). C.S. cuenta con el apoyo del Consejo Europeo de Investigación (Consolidator Grant PHOTOMECH, no.101001797).
Materiales
| Name | Company | Catalog Number | Comments |
| 3-(Trimethoxysilyl)propyl methacrylate | #440159 | Sigma Aldrich | |
| Acetic acid | #33209 | Honeywell | |
| Acrylamide 40 % | #1610140 | Bio-Rad | CAUTION : toxic, work under a fume hood |
| AFM cantilever | #CP-CONT-BSG-A-G | NanoAndMore | 5 μm spherical tip |
| AFM system | #NanoWizard3 | JPK | Coupled to optical microscope equipped with 40x air objective and GFP filter |
| Ammonium persulfate | #A3678 | Sigma | |
| Bis-acrylamide 2 % | #1610142 | Bio-Rad | CAUTION : toxic, work under a fume hood |
| Camera sCMOS | #C11440-42U30 | Hamamatsu | |
| Camera sCMOS | #ANDORZYLA4.2 | Oxford Instrument | |
| CellRox | #C10422 | Thermo Fisher | |
| Custom incubator chamber | EMBLEM | ||
| Dental glue | #1300 100 | Picodent | |
| DMEM | #41965 | Thermo Fisher | |
| Epifluorescence microscope | #Eclipse Ti2E | Nikon | |
| Epifluorescence microscope | #Axiovert200 | Zeiss | |
| Ethanol | #9065.3 | Carl Roth | |
| FBS South America | #S181T | Thermo Fisher | |
| Fibrinogen | #F13191 | Invitrogen | Alexa488 conjugate |
| Fibronectin | #F1141 | Sigma | |
| Fluorescent beads 200 nm | #F8805 | Invitrogen | Carboxylated (365/415) |
| Fluorescent beads 200 nm | #F8848 | Invitrogen | Carboxylated (505/515) |
| Fluorescent beads 200 nm | #F8810 | Invitrogen | Carboxylated (580/605) |
| Fluorescent beads 200 nm | #F8807 | Invitrogen | Carboxylated (660/680) |
| Glass coverslip 15 mm round | #41001115 | Assistent | |
| Glass coverslip 24 mm round | #41001124 | Assistent | |
| Microscope Objective | #MRH08230 | Nikon | 20x air NA 0.45 |
| Mouse Embryonic Fibroblasts | #CRL-2991 | ATCC | |
| mPEG-SVA | #MPEG-SVA-5000 | Laysan Bio | |
| N-Hydroxyethyl acrylamide | #697931 | Aldrich | |
| Plasma cleaner | #100-E | TePla | |
| PLPP gel | #PLPPgel | Alveole | |
| Poly-L-lysine | #P4823 | Sigma Aldrich | |
| Poly(L-lysine)-graft-poly(ethylene glycol) | #PLL(20-g[3.5]-PEG(2) | SuSoS | |
| Sodium(meta) periodate | #S1878 | Sigma Aldrich | |
| TEMED | #17919 | Thermo Scientific | |
| UV Patterning module | #PRIMO | Alveole | |
| UVO cleaner | #342-220 | Jelight |
Referencias
- Geiger, B., Bershadsky, A. Exploring the neighborhood: adhesion-coupled cell mechanosensors. Cell. 110 (2), 139-142 (2002).
- Beningo, K. A., Hamao, K., Dembo, M., Wang, Y. -l, Hosoya, H. Traction forces of fibroblasts are regulated by the Rho-dependent kinase but not by the myosin light chain kinase. Archives of Biochemistry and Biophysics. 456 (2), 7(2006).
- Rape, A. D., Guo, W. H., Wang, Y. L. The regulation of traction force in relation to cell shape and focal adhesions. Biomaterials. 32 (8), 2043-2051 (2011).
- Kumar, R., Saha, S., Sinha, B. Cell spread area and traction forces determine myosin-II-based cortex thickness regulation. Biochimica Biophysica Acta. Molecular Cell Research. 1866 (12), 118516(2019).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Thery, M. Micropatterning as a tool to decipher cell morphogenesis and functions. Journal of Cell Science. 123, 4201-4213 (2010).
- Strale, P. O., et al. Multiprotein printing by light-induced molecular adsorption. Advanced Materials. 28 (10), 2024-2029 (2016).
- Azioune, A., Carpi, N., Tseng, Q., Théry, M., Piel, M. Microtubules: in vivo Methods in Cell Biology. , 133-146 (2010).
- Tseng, Q., et al. A new micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab on a Chip. 11 (13), 2231-2240 (2011).
- Vignaud, T., Ennomani, H., Thery, M. Polyacrylamide hydrogel micropatterning. Methods Cell Biology. 120, 93-116 (2014).
- Munevar, S., Wang, Y., Dembo, M. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophysical Journal. 80 (4), 1744-1757 (2001).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Polacheck, W. J., Chen, C. S. Measuring cell-generated forces: a guide to the available tools. Nature Methods. 13 (5), 415-423 (2016).
- Schwarz, U. S., Soine, J. R. Traction force microscopy on soft elastic substrates: A guide to recent computational advances. Biochimica Biophysica Acta. 1853, 3095-3104 (2015).
- Roca-Cusachs, P., Conte, V., Trepat, X. Quantifying forces in cell biology. Nature Cell Biology. 19 (7), 742-751 (2017).
- Hanke, J., Probst, D., Zemel, A., Schwarz, U. S., Koster, S. Dynamics of force generation by spreading platelets. Soft Matter. 14 (31), 6571-6581 (2018).
- Butler, J. P., Tolic-Norrelykke, I. M., Fabry, B., Fredberg, J. J. Traction fields, moments, and strain energy that cells exert on their surroundings. American Journal of Physiology. Cell Physiology. 282 (3), 595-605 (2002).
- Sabass, B., Gardel, M. L., Waterman, C. M., Schwarz, U. S. High resolution traction force microscopy based on experimental and computational advances. Biophysical Journal. 94 (1), 207-220 (2008).
- Willert, C. E., Gharib, M. Digital particle image velocimetry. Experiments in Fluids. 10, 181-193 (1991).
- Lourenco, L., Krothapalli, A. On the accuracy of velocity and corticity measurements with PIV. Experiments in Fluids. 18, 421-428 (1995).
- Adrian, R. J., Westerweel, J. Particle Image Velocimetry. , Cambridge University Press. (2011).
- Westerweel, J., Scarano, F. Universal outlier detection for PIV data. Experiments in Fluids. 39 (6), 1096-1100 (2005).
- Dembo, M., Wang, Y. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophysical Journal. 76 (4), 2307-2316 (1999).
- Schwarz, U. S., et al. Calculation of forces at focal adhesions from elastic substrate data: the effect of localized force and the need for regularization. Biophysical Journal. 83 (3), 1380-1394 (2002).
- Huang, Y., Gompper, G., Sabass, B. A Bayesian traction force microscopy method with automated denoising in a user-friendly software package. Computer Physics Communications. 256, 107313(2020).
- Vedadghavami, A., et al. Manufacturing of hydrogel biomaterials with controlled mechanical properties for tissue engineering applications. Acta Biomaterialia. 62, 42-63 (2017).
- Huth, S., Sindt, S., Selhuber-Unkel, C. Automated analysis of soft hydrogel microindentation: Impact of various indentation parameters on the measurement of Young's modulus. PLoS One. 14 (8), 0220281(2019).
- Oria, R., et al. Force loading explains spatial sensing of ligands by cells. Nature. 552 (7684), 219-224 (2017).
- Buxboim, A., Rajagopal, K., Brown, A. E., Discher, D. E. How deeply cells feel: methods for thin gels. Journal of Physics. Condensed Matter. 22 (19), 194116(2010).
- Sen, S., Engler, A. J., Discher, D. E. Matrix strains induced by cells: Computing how far cells can feel. Cell and Molecular Bioengineering. 2 (1), 39-48 (2009).
- Arnold, M., et al. Induction of cell polarization and migration by a gradient of nanoscale variations in adhesive ligand spacing. Nano Letters. 8 (7), 2063-2069 (2008).
- Galluzzi, M., et al. Atomic force microscopy methodology and AFMech Suite software for nanomechanics on heterogeneous soft materials. Nat Communications. 9 (1), 3584(2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados