Method Article
Kontrolle der Zelladhäsion mit Hydrogel-Patterning-Techniken für Anwendungen in der Zugkraftmikroskopie
In diesem Artikel
Zusammenfassung
Nah-UV-Lithographie und Zugkraftmikroskopie werden kombiniert, um zelluläre Kräfte auf mikrostrukturierte Hydrogele zu messen. Die gezielte lichtinduzierte Freisetzung einzelner Zellen ermöglicht eine hohe Anzahl von Messungen an derselben Probe.
Zusammenfassung
Die Zugkraftmikroskopie (TFM) ist die Hauptmethode in der Mechanobiologie zur Messung von Zellkräften. Üblicherweise wird dies für Zellen verwendet, die an flachen weichen Substraten haften, die sich unter der Zelltraktion (2D-TFM) verformen. TFM setzt auf lineare elastische Materialien wie Polydimethylsiloxan (PDMS) oder Polyacrylamid (PA). Für 2D-TFM auf PA resultiert die Schwierigkeit, einen hohen Durchsatz zu erreichen, hauptsächlich aus der großen Variabilität der Zellformen und -traktionen, die eine Standardisierung erfordert. Wir stellen ein Protokoll zur schnellen und effizienten Herstellung von mikrostrukturierten PA-Hydrogelen für 2D-TFM-Studien vor. Die Mikromuster werden zunächst durch maskenlose Photolithographie mit nahezu UV-Licht erzeugt, bei der extrazelluläre Matrixproteine nur an die mikrostrukturierten Regionen binden, während der Rest der Oberfläche für Zellen nicht adhäsiv bleibt. Die Mikrostrukturierung von extrazellulären Matrixproteinen ist auf das Vorhandensein von aktiven Aldehydgruppen zurückzuführen, was zu adhäsiven Regionen unterschiedlicher Form führt, die entweder einzelne Zellen oder Zellgruppen aufnehmen. Für TFM-Messungen verwenden wir PA-Hydrogele unterschiedlicher Elastizität, indem wir die Mengen an Acrylamid und Bis-Acrylamid variieren und die Verschiebung eingebetteter Fluoreszenzperlen verfolgen, um Zelltraktionsfelder mit der regularisierten Fourier-Transformations-Traktionszytometrie (FTTC) zu rekonstruieren.
Um eine weitere präzise Erfassung der Zellkräfte zu erreichen, beschreiben wir die Verwendung einer kontrollierten Dosis von gemustertem Licht, um Zelltraktionen in definierten Regionen für einzelne Zellen oder Zellgruppen freizusetzen. Wir nennen diese Methode lokale UV-Beleuchtung Zugkraftmikroskopie (LUVI-TFM). Bei der enzymatischen Behandlung werden alle Zellen gleichzeitig von der Probe getrennt, während mit LUVI-TFM Zugkräfte von Zellen in verschiedenen Bereichen der Probe nacheinander aufgezeichnet werden können. Wir demonstrieren die Anwendbarkeit dieses Protokolls (i) zur Untersuchung der Zelltraktionskräfte als Funktion der kontrollierten Haftung am Substrat und (ii) zur Erzielung einer größeren Anzahl experimenteller Beobachtungen aus derselben Probe.
Einleitung
Bei der Interaktion mit ihrer extrazellulären Umgebung üben adhärente Zellen Kräfte aus, die hauptsächlich durch Integrin-basierte fokale Adhäsionen vermittelt werden, die die extrazelluläre Matrix (ECM) mit dem Aktinzytoskelett verbinden. Fokale Adhäsionen sind Multiproteinanordnungen, die sich um die Bindung von Integrinen an ECM-Proteine wie Fibronektin und Kollagen drehen. Integrin-Clustering und Wachstum von fokalen Adhäsionen ist nicht nur für den Aufbau einer mechanisch stabilen Verbindung von entscheidender Bedeutung, sondern auch für die Rekrutierung anderer fokaler Adhäsionsproteine, einschließlich solcher, die den RhoA-Signalweg für die Regulation der zellulären Kontraktilität aktivieren1. Die RhoA-abhängige Kontraktilität des Aktin-Zytoskeletts ermöglicht es zellen, sich auf dem zugrunde liegenden ECM auszubreiten und zu migrieren und auch seine Steifigkeit zu spüren2. Die Verteilung der Zugkräfte hängt stark von der Ausbreitungsfläche und -form der Zellen ab, die beide auf Matrixeigenschaften beruhen und daher die Zytoskelettorganisation beeinflussen und schließlich eine geschlossene Rückkopplungsschleife zwischen Matrixmechanik und Zytoskelettorganisation bilden3,4.
Oberflächen-Mikrostrukturierungstechniken ermöglichen eine definierte Kontrolle der Zellform, indem mikrometergroße Regionen mit ECM-Klebstoffproteinen erzeugt werden. je nach Größe dieser Regionen einzelne Zellen oder Gruppen von Zellen, die am Mikromuster haften5. ECM-Proteine können durch verschiedene Ansätze wie Mikrokontaktdruck, Fotomusterung oder Lasermusterung auf Glassubstraten strukturiert werden6. Die Verwendung von UV-Licht (λ = 185 oder 375 nm) in Kombination mit Oberflächen-Antifouling-Strategien bietet die Flexibilität für die Gestaltung verschiedener Formen und Größen und die Immobilisierung mehrerer Proteintypen mit einer hohen Präzision in der Nähe von Oberflächenkanten7,8. Die regionen, die mit proteinabweisenden Chemikalien wie Polyethylenglykol (PEG) beschichtet sind, sind entweder mit einer Chrom-Photomaske oder einem auf einem digitalen Spiegelgerät (DMD) basierenden masklosen Lithographiesystem geschützt. Die Muster in den Masken ermöglichen die Exposition gegenüber UV-Licht von Regionen, die dann mit ECM-Proteinen strukturiert werden. Die Strukturierung von Hydrogeloberflächen mit ECM-Proteinen erfordert einen Transferschritt, um Proteine von der Glasoberfläche zu entfernen und mit den Mustern zu vernetzen. Alternativ kann die Musterung auf weichen Materialien erreicht werden, indem zuerst die Fotomaske mit einem abweisenden Protein beschichtet und anschließend die unmaskierten Bereiche mit tiefer UV-Beleuchtung verbrannt werden. Da tiefes UV Ozon erzeugt und die Oberfläche für die Proteinbindung reaktiv macht, werden die unmaskierten Bereiche mit ECM-Proteinen beschichtet und schließlich wird das Gel direkt auf den unmaskierten Regionen polymerisiert9,10.
Die gemusterten Hydrogele können verwendet werden, um TFM durchzuführen, eine Technik, die Zellkräfte an der Zell-Material-Grenzfläche misst11. In 2D-TFM verwendet man die flache Oberfläche eines dicken Polymerfilms, in den Markerperlen eingebettet wurden, um Verformungen zu verfolgen12,13,14,15. Um Verschiebungsvektoren zu extrahieren, ist es wichtig, zwei Bilder zu kombinieren, eines des verformten Zustands und ein Referenzbild ohne Verformungen. Die beiden Bilder werden dann mit Bildverarbeitung aufeinander abgebildet. Bei hoher Markerdichte geschieht dies in der Regel mit der Particle Image Velocimetry (PIV), einer etablierten Methode zur Rekonstruktion der hydrodynamischen Strömung. Bei niedriger Markerdichte und in 3D-TFM geschieht dies in der Regel mit der Particle Tracking Velocimetry (PTV), die spezifische Merkmale des experimentellen Datensatzes beinhaltet. Ein Beispiel für eine rechnerisch billigere Alternative ist der optische Fluss, wie der Kanade-Lucas-Tomasi (KLT)-Algorithmus16. Im Falle von Hydrogelsubstraten werden fluoreszierende Kügelchen normalerweise während der Materialpolymerisation mit hoher Dichte eingebettet, und Bilder werden vor und nach der Zellfreisetzung bei enzymatischer Ablösung aufgezeichnet. Die enzymatische Ablösung adhärenter Zellen, z.B. durch Trypsinisierung, führt zur gleichzeitigen Freisetzung zellulärer Traktionen aus allen Zellen auf den Hydrogelen, was es schwierig macht, eine detaillierte Analyse aus einer großen Anzahl von Zellen zu erhalten.
Hier präsentieren wir ein Protokoll zur Herstellung von mikrostrukturierten Hydrogelen zur Kontrolle der Zellform und -lokalisierung und eine Methode zur effizienten Messung der Zugkräfte nacheinander unter Verwendung von UV, um einzelne Zellen vom Substrat zu lösen. Für Zugkraftmessungen stellen wir eine Technik zur Herstellung von zweischichtigen PA-Hydrogelen vor, bei denen fluoreszierende Kügelchen nur in die oberste Schicht eingebettet sind, was ihre Dichte erhöht und ihre vertikale Ausbreitung reduziert. Die Kombination von UV-vermittelter Freisetzung zellulärer Zugkräfte mit Mikrostrukturierung ermöglicht es, eine räumliche Kontrolle über die Zellablösung (z. B. einzelner Zellen) zu erhalten, ohne die Adhäsion anderer Zellen in der interessierenden Region zu beeinträchtigen), vorausgesetzt, es besteht ein ausreichender Abstand zwischen den strukturierten Zellen. Die zelluläre Traktion wird dann mit der effizientesten und zuverlässigsten Methode für 2D-TFM rekonstruiert, nämlich der Fourier-Transformations-Traktionszytometrie (FTTC) mit Regularisierung17,18.
Protokoll
1. Herstellung von methacrylierten Deckgläsern
HINWEIS: Glasdeckgläser sind methacryliert, um PA-Hydrogele kovalent zu verknüpfen und somit deren Ablösung während der Inkubation mit Zellen zu verhindern. Mikroskopglas-Deckgläser werden verwendet, um eine hohe Bildqualität zu erreichen.
- Um eine 300-ml-Lösung herzustellen, nehmen Sie ein sauberes 400-ml-Glasbecherglas und legen Sie es in einen Abzug.
- 10 ml doppelt destilliertes Wasser (ddH2O) in das Becherglas geben. 18,75 ml Essigsäure (≥99,8 % Pro-Analyse, p.a.), 18,75 ml 3-(Trimethoxysilyl)propylmethacrylat und 252,5 ml Ethanol (≥99,8 % p.a.) mit einer serologischen Pipette zugeben. Gießen Sie die Lösung in eine kristallisierende Schale.
- Reinigen Sie 24 mm runde Glasdeckgläser mit Präzisionstüchern. Legen Sie die Deckgläser in ein speziell angefertigtes Polytetrafluorethylen-Rack.
- Tauchen Sie das Rack in die Lösung ein und inkubieren Sie es für 15 minuten bei Raumtemperatur (RT).
- Nehmen Sie das Gestell und spülen Sie alle Deckgläser mit Ethanol (99,8% p.a.) ab. Trocknen Sie die Deckgläser unter Luftstrom.
HINWEIS: Methacrylierte Deckgläser können bis zu 1 Monat bei RT aufbewahrt werden.
2. Mikrostrukturierung extrazellulärer Matrixproteine auf Glasdeckgläsern
HINWEIS: Glasdeckgläser werden zunächst mit einer Schicht von Molekülen beschichtet, die aus Protein und zellabweisendem Mittel besteht. Diese Schicht wird dann mit einer Photostrukturierungstechnik entfernt, um die anschließende Abscheidung von extrazellulären Matrixproteinen in mikrostrukturierten Regionen zu ermöglichen.
- Nehmen Sie einen 15 mm langen runden Glasdecker und legen Sie ihn auf eine Petrischale. Verwenden Sie einen Diamantstift, um die Oberseite des Deckglases zu markieren. Fahren Sie dann mit der Reinigung durch Sauerstoffplasmabehandlung bei 0,4 mbar und 200 W für 2 min fort.
- 100 μL 0,01%ige Poly-L-Lysin-Lösung auf die Oberfläche jedes Deckglases pipettieren. 30 min bei RT inkubieren. Die Deckgläser werden mit 10 mM 4-(2-hydroxyethyl)-1-piperazinethanesulfonsäure (HEPES) pH 8,5 gewaschen. Entfernen Sie überschüssige Flüssigkeit, aber halten Sie die Oberfläche nass.
- 100 μL 50 mg/ml Poly(ethylenglykol)methylether succinimidyl valeric acid (mPEG-SVA) in 10 mM HEPES pH 8,5 auf der Oberfläche jedes Deckglases pipettieren. 1 h bei RT inkubieren. Die Deckgläser mit 10 mM HEPES pH 8,5 abspülen und unter Luftstrom abtrocknen.
- 2 μL UV-sensitiver Photoinitiator (z.B. PLPP-Gel) gefolgt von 40 μL Ethanol (≥99,8% p.a.) auf die Oberfläche geben. Um eine homogene Verteilung des Gels und des Ethanols auf der Oberfläche zu erhalten, kippen Sie die Petrischale vorsichtig hin und her. Warten Sie 5 Minuten, bis die Lösung polymerisiert ist.
- Legen Sie einen einzelnen Deckglas in eine 35-mm-Petrischale mit einem 20-mm-Loch an der Unterseite. Dadurch kann der von unten kommende Laserstrahl direkt auf die Glasoberfläche gelangen.
- Schalten Sie das Mikroskop und ein Lichtstrukturierungsmodul ein (das Arbeiten mit diesem Gerät ist erst nach einer Sicherheitseinführung durch die Laserschutzbeauftragten erlaubt). Kalibrieren Sie den UV-A-Laser auf dem 20-fachen Luftobjektiv. Legen Sie die Probe mit dem Photoinitiator auf die Bühne. Stellen Sie den Fokus auf der Glasoberfläche ein und aktivieren Sie die Fokussteuerung. Laden und sperren Sie das vorgezeichnete Muster.
- Bereiten Sie das Muster mit einer Grafiksoftware wie Inkscape vor. Stellen Sie sicher, dass die Musterdatei die DMD-Abmessungen (1824 x 1140 px, was 552 x 325 μm auf 20 x Objektiv (0,28 μm/px)) entspricht) nicht überschreitet.
HINWEIS: Es wird empfohlen, die DMD-Größe (1824 x 1140 Pixel) als Musterdateigröße zu verwenden, da dies sicherstellt, dass während der Musterung kein Fehler auftritt. Erzeugen Sie beispielsweise keine Musterdatei mit einer Abmessung von 1830 x 1130 Pixeln. - Stellen Sie zum Zwecke der Musterübertragung auf Polyacrylamid sicher, dass die Musterung nur bis zu 60% -70% des Radius von der Mitte des Glases bis zum Rand erfolgt.
- Verwenden Sie für die Strukturierung einer einzelnen Zelle einen Durchmesser von 50-100 μm mit einem Abstand von 100 μm zwischen mustern und einem Durchmesser von 150-300 μm für eine Zellgruppe. Die geeignete Mustergröße hängt stark von der typischen Zellgröße ab und muss ausreichend groß sein, damit die Zellen haften bleiben können.
- Bereiten Sie das Muster mit einer Grafiksoftware wie Inkscape vor. Stellen Sie sicher, dass die Musterdatei die DMD-Abmessungen (1824 x 1140 px, was 552 x 325 μm auf 20 x Objektiv (0,28 μm/px)) entspricht) nicht überschreitet.
- Beginnen Sie die Strukturierung mit einer UV-Dosis von 30 mJ/mm2. Die Musterdauer hängt von der Anzahl der Muster ab. Die Herstellung eines einzelnen Musters dauert ungefähr 1 s.
- Nach Abschluss des Strukturierungsschritts spülen Sie die Oberfläche dreimal mit phosphatgepufferter Kochsalzlösung (PBS) ab. Inkubieren Sie die Probe mit 100 μL 25 μg/mL Fibronektin gelöst in 1x PBS und 25 μg/ml Fibrinogen Alexa488 Konjugat in PBS für 1 h bei RT. Finden Sie für andere ECM-Proteine die optimalen Konzentrationen, die die strukturierten Regionen vollständig abdecken.
- Spülen Sie die Oberfläche dreimal mit 1x PBS ab. Stellen Sie sicher, dass das gemusterte Glas sofort für den Glas-PA-Transfer verwendet wird. Lagern Sie das gemusterte Glas in PBS bei RT während der Hydrogelpräparation.
3. Herstellung von gemusterten Polyacrylamid-Hydrogelen
ANMERKUNG: Polyacrylamid-Hydrogele werden hergestellt, einschließlich oxidiertem N-Hydroxyethylacrylamid (HEA), um reaktive Aldehydgruppen für die kovalente Bindung von Matrixproteinen auf der Oberfläche darzustellen. Darüber hinaus wird ein zweischichtiger Ansatz verwendet, um fluoreszierende Kügelchen nur in die oberste Schicht des Hydrogels einzubetten, um die Aufzeichnung der Perlenverschiebung während der Traktionskraftmikroskopie-Experimente zu verbessern.
- Die Methacrylglas-Deckgläser in eine Petrischale geben.
- Um frische oxidierte HEA-Lösung herzustellen, geben Sie 9,55 ml doppelt destilliertes Wasser in ein 15-ml-Zentrifugenröhrchen. Dann fügen Sie 0,5 ml HEA und 42 mg Natrium (meta) periodat hinzu, um 10 ml der Lösung zu erhalten. Rühren Sie die Lösung 4 h lang kontinuierlich im Dunkeln um.
- Mischen Sie Acrylamid, Bisacrylamid und doppelt destilliertes Wasser gemäß Tabelle 1, um 10 ml Stammlösungshydrogel zu erhalten (tun Sie dies unter dem Abzug, Monomere sind neurotoxisch). Entgasen und den Deckel luftdicht verschließen.
HINWEIS: Die Stammlösung kann bis zu 1 Jahr bei 4 °C in Aliquots aufbewahrt werden. Charakterisieren Sie immer den Elastizitätsmodul des Hydrogels vor der Verwendung. - Bereiten Sie ein zweischichtiges PA-Hydrogel vor (tun Sie es unter dem Abzug, Monomere sind neurotoxisch).
- Beginnen Sie mit der unteren Schicht, indem Sie vorsichtig 99,3 μL Stammlösung, 0,5 μL 1% Ammoniumpersulfat (APS) und 0,2 μL Tetramethylethylendiamin (TEMED) in einem 1,5-ml-Röhrchen mischen. Nehmen Sie 10 μL aus der Lösung und pipettieren Sie sie tropfenweise auf die Mitte des methacrylierten Deckglases.
- Legen Sie vorsichtig einen 15 mm langen runden Deckschutz auf das Tröpfchen und warten Sie 45 min auf die Polymerisation. Den oberen Deckmantel vorsichtig mit einem Skalpell lösen.
- Mischen Sie für die oberste Schicht vorsichtig 93,3 μLof-Stammlösung mit 1 μL frisch oxidierter HEA-Lösung, 5 μL fluoreszierenden Kügelchen (entsprechend drei Perlen pro Quadratmikrometer für Perlen mit einer Größe von 200 nm), 0,5 μL 1% APS und 0,2 μL TEMED in einem 1,5-ml-Röhrchen. Nehmen Sie 5 μL aus der Lösung und pipettieren Sie sie tropfenweise auf die Mitte der bereits polymerisierten unteren Schicht.
- Legen Sie den mikrogemusterten Deckglas vorsichtig auf das Tröpfchen. Warten Sie bei RT 45 min, bis das Tröpfchen polymerisiert ist. Stellen Sie sicher, dass die gemusterte Seite das Tröpfchen berührt. Den Deckmantel vorsichtig mit einem Skalpell lösen.
- Kleben Sie die 24 mm Deckgläser mit Zweikomponenten-Silikonkleber auf den Boden der speziell gebohrten 6-Well-Platten. Nach 5 Minuten PBS zu den Bohrlöchern hinzufügen.
- Charakterisieren Sie den Elastizitätsmodul der Polyacrylamid-Hydrogel-Proben durch Rasterkraftmikroskopie (AFM).
- Montieren Sie einen kugelförmigen Spitzenausleger am AFM-Halter.
- Kalibrieren Sie jeden Cantilever, indem Sie eine Kraft-Weg-Kurve (3-4 V-Sollwert) auf einem harten Substrat (z. B. Glas oder Glimmer) erfassen, extrapolieren Sie die Cantilever-Empfindlichkeit, ziehen Sie sich von der Oberfläche zurück und führen Sie eine thermische Melodie durch, um ihre Federkonstante zu erhalten.
- Platzieren Sie die kalibrierten Cantilever über der Hydrogelprobe und erfassen Sie Kraftkurven im PBS-Puffer mit den folgenden Parametern: 20-30 nN Kraftsollwert, 5 oder 10 μm/s Annäherung und Rückzugsgeschwindigkeit, 5 μm Rampengröße.
HINWEIS: Ein inverses optisches Mikroskop, ausgestattet mit einem Luft-40-fachen Objektiv und einem grün fluoreszierenden Proteinfilter (GFP), wurde verwendet, um ECM-mikrogemusterte Bereiche innerhalb der PA-Hydrogelproben zu visualisieren und gezielt anzusprechen. - Zeichnen Sie die erfassten Kraft- und Abstandskurven mit der AFM-Analysesoftware auf.
- Ermitteln Sie den Kontaktpunkt und konvertieren Sie Kraft-Entfernungs-Kurven in Kraft- und Eindringkurven.
- Passen Sie den Eindringteil der Kurve mit dem Hertz-Modell (oder einem geeigneten mechanischen Modell in Abhängigkeit von der Spitzengeometrie) unter Verwendung eines Poisson-Verhältnisses zwischen 0,2 und 0,5 an.
4. Lokale Freisetzung von Zellzugkräften durch UV-A Laserbeleuchtung (LUVI-TFM)
HINWEIS: Der UV-A-Laser wird angewendet, um Zugkräfte in Zellen freizusetzen, die in definierten Bereichen der Hydrogele lokalisiert sind. Der UV-A-Laser (d.h. λ = 375 nm Festkörperlaser, <15 mW) ist ein Laser der Klasse 3B. Der ungeschirmte Laserstrahl ist gefährlich für die Augen und oft auch für die Haut. Reflektiertes und gestreutes Licht und Strahlung können gefährlich sein. Darüber hinaus kann UV-Strahlung Hautkrebs verursachen. Das Arbeiten mit Geräten ist erst nach Sicherheitseinführung durch die Laserschutzbeauftragten erlaubt.
- Aspirieren Sie das PBS aus den Bohrlöchern.
- Säen Sie 3 x 106 Zellen pro 6-Well-Platte in Wachstumsmedium. Verwenden Sie für Fibroblasten dulbeccos modifiziertes Eagle Medium (DMEM) mit hohem Glukosegehalt, das L-Glutamin enthält und mit 10% fötalem Rinderserum (FBS) und 1% Penicillin / Streptomycin ergänzt wird. Inkubieren Sie die Zellen über Nacht bei 37 °C/5% CO2. Waschen Sie Proben, um schwimmende Zellen zu entfernen, bevor Sie mit der Mikroskopie beginnen.
- Schalten Sie die Inkubationskammer und die Gasversorgung des Mikroskops ein, um eine Temperatur von 37 °C und 5% CO2-Atmosphäre zu erhalten.
- Schalten Sie das Mikroskop und das Laserstrukturierungsmodul ein. Kalibrieren Sie bei Bedarf den UV-A-Laser auf dem 20-fachen Luftobjektiv mit der Leonardo-Software neu. Stellen Sie die maßgefertigte 6-Well-Platte mit den Proben auf die Bühne. Passen Sie den Fokus auf der Oberfläche der PA an.
- Richten Sie das Beleuchtungsmuster ein und markieren Sie die gewünschten Zellen. Konzentrieren Sie sich wieder auf die Oberfläche des Hydrogels. Erfassen Sie das Bild der Zellen im Hellfeldkanal. Wechseln Sie zum Cy5-Kanal (Fernrotfilter, 650 nm Anregung, 670 nm Emission) und machen Sie ein Bild von Kügelchen im verformten Zustand.
- Wechseln Sie zum Laserkanal. Schalten Sie den Laser für 3 Minuten ein. In unserem speziellen Setup entsprach dies einer Lichtdosis von 6.000 mJ/mm2.
- Wechseln Sie zum Cy5-Kanal und nehmen Sie ein Bild der Perlen im unverformten Zustand auf.
HINWEIS: Warten Sie bei Experimenten mit embryonalen Fibroblasten der Maus 15 Minuten nach der Exposition, um das Referenz-/unverformte Bild aufzuzeichnen (siehe Abschnitt Repräsentative Ergebnisse ). Es kann für andere Arten von Zellen anders sein. Wiederholen Sie die Schritte 4.5-4.7 erneut für andere Zellen von Interesse. - Um den erhöhten oxidativen Stress nach UV-A-Beleuchtung zu messen, verwenden Sie das handelsübliche Reagenz (CellRox). CellRox ist im reduzierten Zustand nicht fluoreszierend und fluoresziert bei Oxidation durch reaktive Sauerstoffspezies mit einem Emissionsmaximum von ~665 nm.
- Gemäß dem mitgelieferten Protokoll 5 μM Reagenz in das Bildmedium geben und 30 min bei 37 °C/5% CO2 inkubieren. Dann waschen Sie die Zellen 3x mit warmen 1x PBS und ersetzen Sie die Bildmedien. Zeichnen Sie das Cy5-Signal durch Fluoreszenzbildgebung vor und nach der UV-A-Beleuchtung mit einer ähnlichen Lichtbelichtung auf.
5. Bildverarbeitung, Partikelbild-Velocimetrie und Berechnung von Zugkräften
HINWEIS: Die Zellzugkräfte werden durch die Analyse der Verschiebung von Fluoreszenzperlen aufgezeichnet und mit Bildanalysewerkzeugen berechnet, die auf der Partikelbild-Velocimetrie basieren.
- Öffnen Sie fluoreszierende Perlenbilder, vor (d. H. Verformt) und nach dem Laser (d. H. Unverformten) mit Fidschi. Führen Sie zwei Bilder zu einem Stapel zusammen (Bild | Stapel | Zu stapelnde Bilder).
- Korrigieren Sie die seitliche Drift zwischen den beiden Bildern mit dem StackReg-Plugin (P. Thévenaz, Eidgenössische Technische Hochschule Lausanne). Ändern Sie Bilder in 8 Bit (Bild | Typ | 8 Bit) und skalieren Sie auf 1024 x 1024 Pix (Bild | Maßstab). Speichern sie als Bildsequenz (TIFF-Format) mit dem Referenzbild immer am Anfang.
- Erfassen Sie das Verschiebungsvektorfeld mit einer Kreuzkorrelationstechnik19 aus dem PIV-Feld, wie es im OpenPIV-Projekt implementiert wurde.
- Stellen Sie sicher, dass das entspannte (unverformte) Bild und das verformte Bild mit Suchfenstern der Größe wR und wD in Pixeln bedeckt sind. Definieren Sie für jedes Suchfenster eine Kreuzkorrelationsfunktion mit der folgenden Formel:
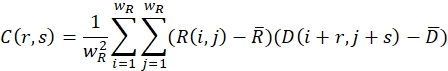
Hier beschreiben R(i,j) und D(i,j) die Intensitätsfelder der beiden Bilder, die auf das ausgewählte Suchfenster gekürzt und anschließend gespiegelt werden.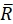 und
und 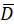 beschreiben ihren Mittelwert. Die Fenstergrößen werden als wR = 32 und wD = 32 gewählt und zwischen den benachbarten Suchfenstern wird eine Überlappung von 70% verwendet.
beschreiben ihren Mittelwert. Die Fenstergrößen werden als wR = 32 und wD = 32 gewählt und zwischen den benachbarten Suchfenstern wird eine Überlappung von 70% verwendet. - Bestimmen Sie für jedes Suchfenster einen Verschiebungsvektor
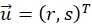 , der die Kreuzkorrelationsfunktion optimiert und der Mittleren Position des Suchfensters zuordnet. Die Subpixelgenauigkeit wird unter Verwendung einer Gaußschen Anpassung um den Maximabereich wie beschrieben20 erhalten.
, der die Kreuzkorrelationsfunktion optimiert und der Mittleren Position des Suchfensters zuordnet. Die Subpixelgenauigkeit wird unter Verwendung einer Gaußschen Anpassung um den Maximabereich wie beschrieben20 erhalten. - Suchen und entfernen Sie mehrdeutige Verschiebungsvektoren. Verschiebungsvektoren, die Suchfenstern entsprechen, in denen das Verhältnis zwischen zwei höchsten lokalen Maxima der Kreuzkorrelationsfunktion unterhalb eines Schwellenwerts von 1,5 als mehrdeutig angesehen wird21.
- Verwerfen Sie Verschiebungsvektoren, die den normalisierten Mediantest für einen Restschwellenwert von 1,522 nicht bestehen.
- (Optional) Korrigieren Sie die verbleibende laterale Drift, indem Sie einen festen Vektor
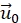 von allen Verschiebungen subtrahieren. Dies geschieht, weil die Verschiebung in einem ausgewählten Bereich weit weg von der Zelle verschwindet.
von allen Verschiebungen subtrahieren. Dies geschieht, weil die Verschiebung in einem ausgewählten Bereich weit weg von der Zelle verschwindet. - Interpolieren Sie das resultierende Verschiebungsvektorfeld zu einem regelmäßigen Raster mit einem Abstand von 4 px der Eingabebilder mit einer kubischen Polynominterpolation. Fehlende Datenpunkte werden mit einer glatten bivariaten Spline-Extrapolation gefüllt. Ein Verschiebungsvektor in Pixeln hängt mit einer lokalen Verformung durch das Pixelverhältnis des Bildes (0,33 μm/px für 20x Luftobjektiv) zusammen.
- (Optional) Spiegeln Sie das Bild auf, um Klingelartefakte in der anschließenden Analyse zu reduzieren.
- Multiplizieren Sie das Verformungsfeld mit einer Tukey-Fensterfunktion, um den Kanteneffekt aufgrund der Driftkorrektur mit einem Parameter von 0,2-0,3 zu eliminieren. In diesem Experiment ist der mikrostrukturierte Bereich, der sich im Zentrum des Sichtfelds befindet, von Interesse.
- Stellen Sie sicher, dass das entspannte (unverformte) Bild und das verformte Bild mit Suchfenstern der Größe wR und wD in Pixeln bedeckt sind. Definieren Sie für jedes Suchfenster eine Kreuzkorrelationsfunktion mit der folgenden Formel:
- Rekonstruieren Sie die Traktion mit der regularisierten Fourier-Transformations-Traktionszytometrie (FTTC)18. Als Regularisierung verwenden wir die einfachste vernünftige Wahl, nämlich Tikhonov (L2) Regularisierung 0. Ordnung23,24,25. Ein optimaler Regularisierungsparameter λ wird so gewählt, dass er die durch26 definierte Funktion Generalized Cross Validation (GCV) minimiert:
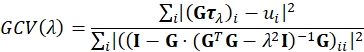
Hier ist τλ ein gestapelter Vektor, der die x- und y-Komponenten des rekonstruierten Traktionsfeldes für den gegebenen Wert von λ für alle Fourier-Abtastmoden enthält, und G ist der lineare Operator, der Traktionsfelder auf ihr entsprechendes Verschiebungsfeld abbildet, wie für FTTC definiert. Die Summe läuft über Vektorkomponenten. ui sind die x- und y-Komponenten des Verschiebungsfeldes für alle Fourier-Abtastmoden. GCV ist im Bereich der schlecht gestellten inversen Probleme weit verbreitet und ist eine gute Alternative zum L-Kurven-Kriterium, das häufig in TFM verwendet wird. Ein Lanzcos-Filter wird verwendet, um Artefakte zu reduzieren, die aufgrund des begrenzten Frequenzraums und des Verschiebungsfeld-Upsampling eingeführt werden. Die Traktionsberechnung hängt vom Elastizitätsmodul des PA (z. B. 11,3 kPa) und dem Poisson-Verhältnis (z. B. für PA im Bereich zwischen 0,2 und 0,5 abhängig von der Vernetzungskonzentration) ab.
Ergebnisse
Die PA-Hydrogele wurden auf methacrylierten Glasdeckgläsern polymerisiert, die reaktive Gruppen für die kovalente Verknüpfung des PA aufweisen. Auf diese Weise wurde beim Einbringen der Hydrogele in eine wässrige Lösung ihre Ablösung vom Substrat verhindert (Abbildung 1A-D). Um eine hohe Dichte an fiduzialen Markern in der Nähe der Hydrogeloberfläche zu erhalten, haben wir die Herstellung eines zweischichtigen PA-Hydrogels entwickelt. Die unterste Schicht, ohne fluoreszierende Kügelchen, wurde auf dem methacrylierten Deckglas polymerisiert. Anschließend wurde eine weitere Schicht, die Perlen enthielt, oben auf der unteren Schicht polymerisiert (Abbildung 1E-H), wodurch die Notwendigkeit der Sedimentation ersetzt wurde, die häufig verwendet wird, um eine Perlenverteilung in einer einzigen Fokusebene zu erreichen und die Perlendichte zu erhöhen. Um die Kontrolle über die Zellform während der TFM-Messungen zu erreichen, stellten wir mikrostrukturierte PA-Hydrogele durch direkten Transfer von Fibronektin-gemusterten Mikrostrukturen von einem Glasdeckglas auf das vorpolymerisierte PA her (Abbildung 1F-F'). Die Zugabe von 1% unkonventionellem Vernetzer (oxidiertes HEA) in der oberen Hydrogelschichtlösung liefert Aldehydgruppen, die kovalent an Amingruppen von Fibronektin binden.
Wir haben PA-Hydrogele hergestellt, die etwa 60 μm dick sind und fluoreszierende Kügelchen in der oberen Schicht in der Nähe der Hydrogeloberfläche einschließen. Diese Art von Hydrogel ist ein geeignetes Substrat für die Abbildung zellulärer Traktionen mit inversen Mikroskopen und dick genug (die Mindestdicke für die Durchführung von TFM wurde mit 20-30 μm berichtet)18 , um einen Aufprall des Glassubstrats zu verhindern. Die Lokalisation der fluoreszierenden Kügelchen wurde mittels konfokaler Mikroskopie abgebildet (Abbildung 1I). Um den Proteintransfer auf dem Hydrogel sichtbar zu machen, verwendeten wir fluoreszierend markierte ECM-Proteine und bildeten sie durch Epifluoreszenzmikroskopie ab (Abbildung 1J). Wir präparierten mikrogemusterte Kreise aus Fibronektin mit einem Durchmesser von 100 μm (linke Seite) und 50 μm (rechte Seite), um die Adhäsion von Zellgruppen oder einzelnen Zellen zu ermöglichen, wie in der Überlagerung von Hellfeldbildern von adhärenten Zellen und fluoreszenzmarkierten Fiducialperlen und Fibronektin-Mikromustern gezeigt. An einer anderen Probe wurde die Adhäsionsantwort einzelner Zellen auf mikrostrukturiertes Fibronektin durch indirekte Immunfluoreszenzmikroskopie validiert, um die Lokalisation von fokalen Adhäsionsproteinen wie Paxillin abzubilden (Abbildung 1K).
Sowohl die ECM-Proteinbeschichtung als auch die Hydrogelsteifigkeit sind entscheidende Parameter für die Zelladhäsion26. Um die mechanischen Eigenschaften unserer PA-Hydrogele zu charakterisieren, führten wir Nanoindentationsexperimente mit AFM27 in Verbindung mit einem Epifluoreszenzmikroskop durch. Hydrogelsubstrate mit drei verschiedenen Steifigkeiten wurden mit unserem Setup vorbereitet und getestet (Abbildung 2 und Tabelle 1). Kugelförmige AFM-Cantilever wurden zyklisch von ungemusterten PA-Hydrogelen und Fibrinogenen, die an Alexa488-mikrogemusterte Bereiche konjugiert wurden, angefahren und zurückgezogen, während Kraft-Weg-Kurven aufgezeichnet wurden. Anschließend ermöglichten uns die Kontaktpunktbewertung und die Anwendung des Hertz-Modells, den E-Modul (E) jeder Probe abzuschätzen. Die ECM-Mikrostrukturierung veränderte den Elastizitätsmodul nicht, der mit jedem der ungemusterten PA-Hydrogele vergleichbar blieb.
Um die Zugkräfte zu messen, die von adhärenten Zellen auf dem Substrat ausgeübt werden, entwickelten wir einen Versuchsaufbau für referenzbasiertes TFM, der an einem Weitfeld-Epifluoreszenzmikroskop mit einem Nahe-UV-Lasermodul (UV-A 6000 mJ/mm2) durchgeführt wurde, um Zelltraktionen freizusetzen (Abbildung 3A). Da die Laserstrahlbeleuchtung räumlich-zeitlich gesteuert werden kann, ist es nicht nur möglich, eine einzelne Zelle oder einen Zellhaufen selektiv mit einer hohen Laserdosis zu belichten, sondern auch und was noch wichtiger ist, der störende Zwischenschritt der Zellentnahme aus der gesamten Probe mit einem Verdauungsenzym wie Trypsin ist nicht mehr notwendig. Das Ausleuchten von Zellen mit einer so hohen Laserdosis induzierte einen erhöhten oxidativen Stress, der zum Zelltod führte (Abbildung 3B). Der Zelltod führte zur Freisetzung von Traktionen aus dem Substrat, wie durch die Perlenverschiebung angezeigt (dargestellt in Abbildung 3A). Wir kombinierten die UV-A-Beleuchtung mit einem Lichtstrukturierungsmodul, um mikrometergroße Bereiche der PA-Hydrogele selektiv zu beleuchten (Abbildung 3B-C). Auf diese Weise ist es möglich, die Traktion von mikrostrukturierten Zellclustern (Abbildung 3C,F) oder einzelnen Zellen (Abbildung 3B) freizusetzen. Wichtig ist, dass auf unseren Zeitskalen die mechanischen Eigenschaften der ECM-gemusterten Hydrogele durch die UV-Exposition nicht signifikant beeinflusst wurden (Abbildung 2C). Die Zunahme des oxidativen Stresses ist in Abbildung 3D,E dargestellt. Die Zugkräfte wurden unter Verwendung von regularisiertem FTTC mit einem durch Generalized Cross Validation ausgewählten Regularisierungsparameter rekonstruiert (Abbildung 3B,F). Die Freisetzung von Kräften für einzelne Zellen erfolgte über einen Zeitraum von 15 min, und das Ergebnis des LUVI-TFM ist vergleichbar mit dem Trypsin-basierten TFM (Abbildung 3G-H).
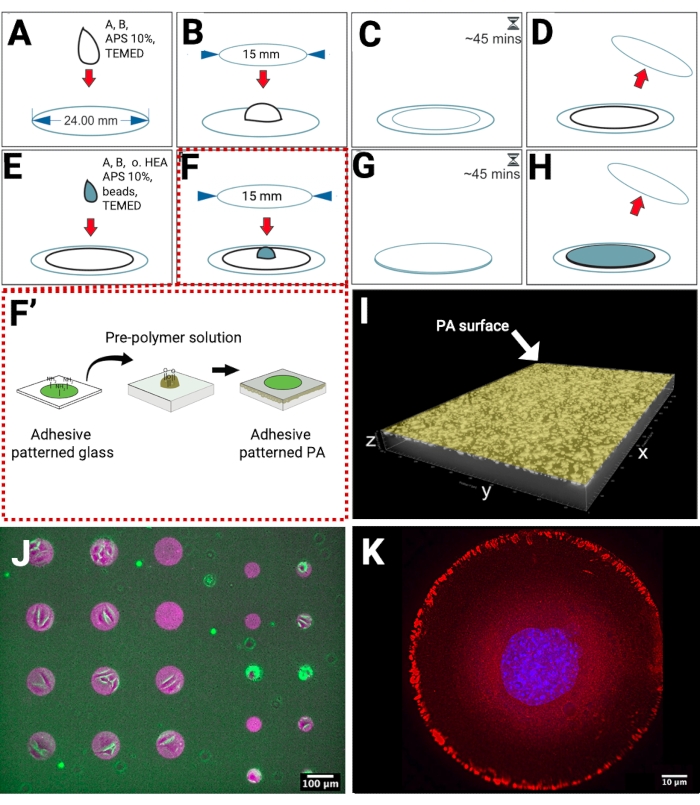
Abbildung 1: Schema der gemusterten Fibronektin-Substratvorbereitung für TFM. (A) Die Lösung für die untere Schicht wird auf einer methacrylierten Oberfläche pipettiert. (B) Ein kleinerer, sauberer Deckglas wird vorsichtig auf den Tröpfchen gelegt. (C) Die Gelierungszeit beträgt 45 min. (D) Der obere Deckglas ist abgelöst. Die unterste Schicht ist fertig. (E) Die Lösung für die oberste Schicht wird auf das Hydrogel pipettiert. (F) Der gemusterte Deckglas wird vorsichtig auf den Tröpfchen gelegt. (F') Die Mikrostrukturierung von Adhäsionsproteinen auf Glas wird durch maskenlose Nahezu-UV-Lithographie erzeugt und dann von Glas auf PA-Hydrogel übertragen. Die freien Amingruppen adhäsiver Proteine, z.B. Fibronektin, binden kovalent an Aldehydgruppen auf der PA-Oberfläche. (G) Die Gelierungszeit beträgt 45 min. (H) Der obere Deckglas ist abgelöst. Fertig ist das gemusterte PA-Hydrogel. (I) Eine 3D-Darstellung einer konfokalen xyz-Mikroaufnahme, die eine hohe Dichte von Fiducialperlen in der Nähe der Oberfläche zeigt. (J) Eine Mikroskopaufnahme von fluoreszierend markiertem Fibronektin (Magenta) auf der Oberfläche von PA mit eingebetteten fluoreszierenden Kügelchen (grün), überlagert mit einem Hellfeldbild von Zellen. (K) Indirekte Immunfluoreszenzmikroskopische Bildgebung einer einzelnen Zelle, die an einem kreisförmigen Fibronektin-Mikromuster (100 μm) haftet. Nucleus (blau), Paxillin (rot). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
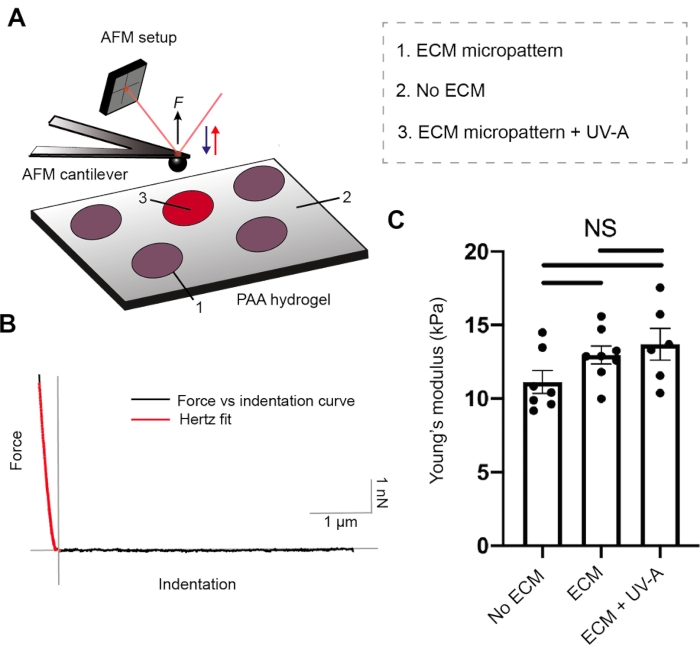
Abbildung 2: Charakterisierung der mechanischen Probeneigenschaften durch AFM. (A) AFM-Nanoindentations-Versuchsaufbau. Ein kugelförmiger Cantilever wird verwendet, um ECM-Mikromuster vor oder nach der UV-Behandlung und die nicht strukturierten Bereiche von zweischichtigen PA-Bereichen (5% Acrylamid, 0,3% Bis-Acrylamid) zu untersuchen. (B) Repräsentative Kraft-Eindring-Kurve für ECM-Mikromuster (schwarz). Hertz fit (rot) wird verwendet, um den Elastizitätsmodul (E) der Probe zu berechnen. (C) Mechanische Messungen für nicht strukturierte zweischichtige PA-Bereiche (kein ECM), ECM-Mikromuster und ECM-Mikromuster nach UV-A-Exposition. Die Balken zeigen die mittlere ± S.E.M. (Brown-Forsythe und Welch ANOVA Test). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3. Die lokale UV-A-Beleuchtung TFM (LUVI-TFM) ermöglicht lokale Zugkraftmessungen in einem großen Sichtfeld. (A) Schema der lokalen UV-A-Beleuchtung TFM. Die Zellen werden mit einer hohen Dosis UV-A-Laser behandelt, um das unverformte (Referenz-) Bild zu erhalten. (B) Das Hellfeldbild einer einzelnen Zelle vor der UV-A-Laserbeleuchtung. Mitte: Das Hellfeldbild einer einzelnen Zelle nach UV-A-Laserbeleuchtung. Rechts: Zugkraft eines einzelnen MEF, der an einem fibronektinbeschichteten PA-Hydrogel (E = 5,74 kPa) haftet, beleuchtet mit einem UV-Lichtstrahl mit 50 μm Durchmesser (rote gestrichelte Linie). (C) Links: Aufzeichnung der Zugkräfte eines Clusters embryonaler Fibroblasten (MEF) der Maus, die an mikrogemustertem Fibronektin (Kreis, 100 μm Durchmesser) anhaften. Der Cluster wurde mit einem UV-Lichtstrahl mit einem Durchmesser von 200 μm (rote gestrichelte Linie) beleuchtet. Rechts: Aufzeichnung der Zugkräfte eines Clusters von embryonalen Fibroblasten (MEF) der Maus, die an mikrogemustertem Fibronektin (Kreis, 300 μm Durchmesser) haften. Der Cluster wurde mit einem UV-Lichtstrahl mit einem Durchmesser von 300 μm (rote gestrichelte Linie) beleuchtet. Skalenbalken = 200 μm. (D,E) Ein Anstieg des oxidativen Stresses in Zellen, der durch die erhöhte Cy5-Signalintensität nach einer hohen UV-A-Laserdosis angezeigt wird, wird durch Fluoreszenzmikroskopie nachgewiesen. Der oxidative Stress führt zum Zelltod. Maßstabsbalken = 200 μm. (F) Links: Die Stress-Heatmap einer Gruppe embryonaler Fibroblasten (MEF) der Maus, die an mikrogemustertem Fibronektin (Kreis, 100 μm Durchmesser) anhaften. Rechts: Die Stress-Wärmekarte einer Gruppe embryonaler Fibroblasten (MEF) der Maus, die an mikrogemustertem Fibronektin (Kreis, 300 μm Durchmesser) haften. (G) MEF-Zellen, die an 100 μm Fibronektin-Mikromustern haften, setzen nach UV-A-Exposition langsam ihre Traktion frei. Die vollständige Freigabe erfolgt nach 15 Minuten (das Referenzbild wurde dann 15 Minuten nach der Belichtung aufgenommen). (H) Ein Vergleich mit dem herkömmlichen Trypsin-basierten TFM für MEF-Zellen mit einem Durchmesser von 300 μm gemustertem Fibronektin. Das Ergebnis der UV-A-Beleuchtung (6.000 mJ/mm2) gefolgt von 15 min Wartezeit unterscheidet sich nicht signifikant von der herkömmlichen Trypsin-Behandlung (d.h. 0,05% für 20 min). Die Balken zeigen den Mittelwert S.E.M. (zweiseitiger Student's t-Test, ****P < 0,0001, * P < 0,05, ns P ≤0,5). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
| Acrylamid (%) | Bis-Acrylamid (%) | Acrylamid aus 40 %iger Stammlösung (ml) | Bisacrylamid aus 2 %iger Stammlösung (ml) | Wasser (ml) | Elastizitätsmodul (kPa) |
| 4 | 0.1 | 1 | 0.5 | 8.5 | 5,74 ± 0,53 |
| 5 | 0.15 | 1.25 | 0.75 | 8 | 9,69 ± 0,68 |
| 5 | 0.3 | 1.25 | 1.5 | 7.25 | 11,33 ± 1,06 |
Tabelle 1: Hydrogel-Stammlösungsmischungen und daraus resultierende Elastizität
Alle Daten werden im Open Access Data Repository der Max-Planck-Gesellschaft (Edmond) hinterlegt und sind unter folgender Adresse abrufbar: https://edmond.mpdl.mpg.de/imeji/collection/JTu8PlWqpbymN9Qf
Diskussion
In diesem Protokoll beschreiben wir die Herstellung von mikrostrukturierten PA-Hydrogelen, die fluoreszierende Kügelchen enthalten, die als fiduziale Marker für TFM-Studien verwendet werden. Unser Ansatz basiert auf drei Schritten: 1) Herstellung von zweischichtigen PA-Hydrogelen; 2) Mikrostrukturierung von ECM-Proteinen und deren Übertragung auf die Hydrogeloberfläche; 3) Verwendung von gemustertem Nah-UV-Licht für TFM. Der Versuchsaufbau zur Analyse der Zelltraktionen zum Substrat erfordert die Verwendung linearer elastischer Materialien mit bekannten Steifigkeitswerten, um die Kräfte zu berechnen, die mit der Verschiebung der fluoreszierenden Kügelchen zusammenhängen26. PA-Hydrogele sind einfach zuzubereiten, die Steifigkeit kann leicht abgestimmt werden und sie werden häufig für die Steifigkeitserfassung und TFM18,28 verwendet. Um jedoch reproduzierbare Polymerisationszeiten und eine homogene Polymerisation des gesamten Hydrogels zu erhalten, sollte auf die Lagerbedingungen und die Zeit für die Reagenzien geachtet werden, z. B. sollte APS in einem Exsikkator aufbewahrt werden, um seinen Aktivitätsverlust zu vermeiden; TEMED sollte vor direktem Licht geschützt werden. Die Verwendung von oxidiertem HEA ermöglicht die kovalente Bindung von Matrixproteinen an der Hydrogeloberfläche, was vorteilhaft sein könnte, um die Bildung einer vollständigen und stabilen Proteinschicht zu erreichen. Die oxidierte HEA-Lösung sollte bei jeder Herstellung von PA-Hydrogelen frisch zubereitet werden. Das zweischichtige PA-Hydrogel bietet drei Hauptvorteile: 1) Es bietet eine alternative Möglichkeit, reproduzierbar eine homogene Verteilung von Fiducialperlen in der Nähe der Hydrogeloberfläche zu erhalten, ohne das Gel extrem dünn machen zu müssen (dh <20 μm). Die Kontrolle über die Hydrogeldicke ist entscheidend für genaue Messungen mit TFM. Wenn das elastische Substrat zu dünn ist, können stark haftende Zellen wie Fibroblasten das darunter liegende starre Glassubstrat wahrnehmen und mechanisch darauf reagieren29,30. Dicke Hydrogele machen die Bildaufnahme für die Kraftrekonstruktion anspruchsvoller. Darüber hinaus haben viele Mikroskope nicht genügend Platz, um sie unterzubringen, wenn man die zusätzliche Dicke des Glassubstrats bedenkt, das zur Befestigung des Hydrogels verwendet wird, es sei denn, es werden ultradünne Mikroskopieobjektträger verwendet. 2) Im zweischichtigen PA-Hydrogel wird die homogene Verteilung von Fiducialperlen nahe der Oberfläche des PA-Hydrogels ohne Verwendung einer Zentrifuge erreicht, sondern durch eine einfache Inkubation präziser Mengen von Hydrogellösungen und fluoreszierenden Kügelchen. Eine hohe Perlendichte ist bei der Durchführung der PIV-Analyse von erheblichem Vorteil, da sie die Auflösung der Zugkräfte und das Signal-Rausch-Verhältnis erhöht, ohne dass eine konfokale Mikroskopie erforderlich ist. 3) Die Eingrenzung von Kügelchen in einer dünnen Schicht in der Nähe der Zell-Material-Grenzfläche ermöglicht die Abbildung von Zugkräften sowohl mit Epifluoreszenzmikroskopen als auch mit konfokalen Mikroskopen. Bei der Vorbereitung des Hydrogels sollte der Benutzer sicherstellen, dass es fest am Bodenglas haftet, bevor er mit den nachfolgenden Schritten des Protokolls fortfährt. Wir empfehlen, die für die Polymerisation der Hydrogelschichten angegebene Inkubationszeit einzuhalten, da es schwierig sein kann, das Glas auf der Oberfläche zu entfernen, ohne die Hydrogeloberfläche zu beschädigen.
Die bekanntesten Techniken zur Messung elastischer Eigenschaften sind AFM, Nanoindentation, Zugversuche und Rheometrie. Die Nanoindentation induziert jedoch sehr hohe Belastungen der Materialien, die die Bestimmung der elastischen Eigenschaften beeinflussen können. Zugversuche und Rheometrie hingegen sind makroskopische Messtechniken, während Zellen auf mikroskopischer Ebene interagieren31,32. AFM ermöglicht Messungen auf der Mikroskala mit reduzierten Dehnungen unter physiologischen Bedingungen. Die Zuverlässigkeit von AFM-Messungen kann beeinträchtigt werden, wenn experimentelle Details fehlen (z. B. Eindringkraft und Geschwindigkeit) oder unzureichende Daten aufgezeichnet werden27. Huth et al. beschreiben einen Algorithmus zur Extraktion von Young-Moduli aus AFM-Daten, der wert darauf legt, die Messdetails konstant zu halten27. Dieser Algorithmus bietet eine präzise und zuverlässige Bestimmung der Young-Moduli und wurde für unsere Experimente verwendet. Zusätzlich haben wir viele Kurven an Proben gemessen, die an verschiedenen Tagen hergestellt wurden, und sehr ähnliche Ergebnisse erzielt (Variation der Mittelwerte von ca. 1-2 kPa). Dies zeigt, dass die Steifigkeit unserer Gele zuverlässig vorhergesagt werden kann.
In diesem Protokoll verwenden wir ein Photostrukturierungsmodul, um mikrostrukturierte Bereiche auf Glas zu erzeugen, die dann auf die Hydrogeloberflächen übertragen werden. Die in diesem Protokoll gezeigte Mikrostruktur basiert auf DMD-basierter maskenloser Nah-UV-Lithographie (λ = 375 nm)7. Ein DMD besteht aus einer großen Anzahl von Mikrospiegeln auf einem Chip. Ein einzelnes Pixel entspricht einem einzelnen Mikrospiegel. Die pixelige Musterbilddatei von einem Computer wird durch DMD projiziert und mit einem Objektiv auf die Oberfläche fokussiert. Zur Mikrostrukturierung von Proteinen wird das fokussierte Laserlicht verwendet, um mit Hilfe eines Photoinitiators abweisende Polymerbürsten zu spalten. Anschließend werden die exponierten Regionen mit ECM-Proteinen gefüllt. Diese maskenlose Ablationsmethode bietet große Flexibilität bei der Gestaltung neuer Muster, da sie nicht auf die Verwendung einer Fotomaske angewiesen ist. Das Entwerfen und Anwenden eines Musters ist sehr einfach, da es mit einer Freeware wie Inkscape nur wenige Minuten dauert. Die Anzahl der Muster und Proben, die in kurzer Zeit hergestellt werden, ist jedoch ein großer Nachteil, da diese Methode nur verwendet werden kann, um jedes Mal ein einzelnes Substrat zu mustern. Das Photostrukturierungsmodul verwendet eine UV-nahe Festkörperlaserquelle, die mehrere Milliwatt emittiert. Der ungeschirmte Laserstrahl ist gefährlich für Augen und Haut. Reflektiertes und gestreutes Licht und Strahlung können ebenfalls gefährlich sein. Die Handhabung muss von einer Sicherheitsanweisung der Laserbeauftragten begleitet werden. Der kritischste Schritt im Protokoll bei der Verwendung eines Photostrukturierungsmoduls besteht darin, sicherzustellen, dass der Laser während des Mikromusterns und der Ablation richtig auf die Oberfläche fokussiert wird. Eine konstante Beleuchtungsdosis (Intensität multipliziert mit der Zeit) von UV-Licht während der Strukturierung hängt davon ab, wie der Laser auf die Oberfläche fokussiert ist. Eine schwache Intensität auf der Oberfläche aufgrund einer schlechten Fokussierung kann dazu führen, dass der ECM-Transfer auf die Hydrogeloberfläche fehlschlägt, was dazu führt, dass keine Zellen an das Hydrogel gebunden werden.
In TFM-Experimenten werden Zellen nach der ersten Bildgebung von adhärenten Zellen und den fiduzialen Markern durch Trypsin-Behandlung aus dem PA-Hydrogel freigesetzt, um ihren entspannten Zustand aufzuzeichnen. Ein Nachteil bei der Durchführung dieses Schritts ist die Handhabung der Probe auf dem Mikroskopietisch. Ohne Perfusionskammer stellen das Öffnen des Deckels der Schale, das Absaugen des Mediums, das Spülen und Pipettieren der Trypsinlösung eine Herausforderung für Anfänger und erfahrene Benutzer dar. Tatsächlich sind diese Verfahren eine Hauptquelle für die Drift in xyz-Achsen , was zu einem Verlust von Position und Fokus führt. Unser lokales UV-Beleuchtungsprotokoll macht TFM zu einer zugänglicheren Technik für Anfänger. Es sollte beachtet werden, dass wir ein kommerziell erhältliches mikroskopiebasiertes maskenloses Photostrukturierungsmodul verwendet haben, aber im Prinzip könnte jedes UV-A-Beleuchtungssystem verwendet werden, schließlich in Kombination mit einer Maske, um Bereiche der Substrate zu schützen, in denen die Zellzugkräfte nicht aufgezeichnet werden sollten. Die Exposition von Zellen mit einer signifikanten Dosis von sichtbarem Licht mit niedriger Wellenlänge (z. B. das violette Licht, das die DAPI-Emission anregt) führt zu zunehmendem oxidativem Stress, der zu Phototoxizität und Zelltod führen kann. Daher kann diese Technik auch in einem Epifluoreszenzmikroskop ohne UV-Lasermodul angewendet werden. Da die Intensität jedoch viel schwächer ist, wird es in diesem Fall viel einfacher sein, TFM mit der enzymatischen Behandlung durchzuführen.
Mit LUVI-TFM ist es möglich, die gleiche Probe für mehrere Messungen zu verwenden, da einzelne Zellen oder kleine Gruppen von Zellen lokal abgelöst sind. Es sollte jedoch auf die Auswahl der zu lösenden Zellen geachtet werden, um die Aufzeichnung von Kräften benachbarter Zellen zu vermeiden. Daher sollten für Einzelzellmessungen in Abwesenheit von Mikromustern überfüllte Regionen vermieden werden; Bei Messungen an einzelnen mikrostrukturierten Zellen sollten die Muster so ausgelegt sein, dass der Abstand zwischen einzelnen Strukturen mindestens doppelt so groß ist wie der Durchmesser des gemusterten Bereichs. Wir empfehlen auch, Zellen aus benachbarten Mustern nicht nacheinander zu verwenden, sondern sie aus entfernten Regionen auf dem Substrat zu entnehmen. Unsere Messung wird gut auf einem Epifluoreszenzmikroskop durchgeführt, das mit einer Fokuskontrollfunktion und einem 40 x Luft NA = 0,9 Objektiv ausgestattet ist, wobei der Arbeitsabstand der Linse ausreichend lang ist und die schnelle Bewegung von einem Brunnen zum anderen sehr gut abstimmbar ist. Die gezielte Ablösung von Zellen für TFM-Anwendungen ist wirksam zur Messung der Zellkraft einer einzelnen Zelle oder eines ganzen kleinen Zellclusters (z.B. bis zu 300 μm Durchmesser). Mit unserem Setup beobachteten wir Zellrundungen und -ablösungen für die UV-Behandlung einzelner Zellen (Abbildung 3A), während eine Ablösung bei kleinen Zellclustern selten auftrat. Dies könnte zu einer Unterschätzung der Zellzugkräfte führen. Für größere Zellcluster wird eine enzymatische Ablösung empfohlen, da die Benutzer ein 20-faches Luftobjektiv verwenden sollten, um den gesamten Cluster abzubilden, und eine Fokuskontrollfunktion benötigt wird. Da die Tiefenschärfe des 20-fachen Luftobjektivs viel länger ist, wird die Handhabung nicht so kritisch sein wie beim Objektiv mit höherer Vergrößerung. Der Anwender sollte sicherstellen, dass der Fokus für die Ablation von Zellen richtig eingestellt ist, da die Beleuchtungsdosis vom Laserfokus auf der Oberfläche abhängig ist. Während wir uns der möglichen Einschränkungen bei der Verwendung von LUVI-TFM in Zellkollektiven aufgrund möglicher mechanischer Wechselwirkungen mit benachbarten unbehandelten Zellen bewusst sind, könnte sich dieser Aspekt tatsächlich als nützlich für Studien zur Mechanik der gezielten Zellextrusion erweisen, z.B. von epithelialen Monoschichten.
Zusammenfassend lässt sich sagen, dass wir mit unserem TFM-Ansatz in Kombination mit der lichtinduzierten Freisetzung von mikrostrukturierten Zellen ein robustes und hochdurchsatzfähiges Protokoll zur Messung der Zelladhäsionskräfte bereitstellen. Die Vielseitigkeit dieser Methode könnte durch Mikroskopie und Bildgebung weiter genutzt werden, um die Auflösung und Empfindlichkeit zu verbessern.
Offenlegungen
Die Autoren haben nichts preiszugeben.
Danksagungen
Wir danken Frau Rebecca Alvarado für die Unterstützung bei der Protokoll-Videoproduktion und Herrn Stephen Casale für die konstruktive Kritik am Manuskript. Wir danken den Kolleginnen und Kollegen aus der Abteilung Zelluläre Biophysik, Max-Planck-Institut für medizinische Forschung für die hilfreichen Gespräche. Die finanzielle Unterstützung der Max-Planck-Gesellschaft für E.A.C.-A. und die Deutsche Forschungsgemeinschaft (DFG SFB1129, Projektnummer 240245660, P15 bis E.A.C.-A. und P4 bis U.S.S.; DFG EXC 2082/1-390761711 an U.S.S.) wird auch sehr anerkannt. J.B. dankt der Carl-Zeiss-Stiftung für die finanzielle Unterstützung. E.A.C.-A., C.S. und U.S.S. würdigen die Förderung durch die Max Planck School Matter to Life mit Unterstützung des Bundesministeriums für Bildung und Forschung (BMBF). C.S. wird vom Europäischen Forschungsrat unterstützt (Consolidator Grant PHOTOMECH, Nr.101001797).
Materialien
| Name | Company | Catalog Number | Comments |
| 3-(Trimethoxysilyl)propyl methacrylate | #440159 | Sigma Aldrich | |
| Acetic acid | #33209 | Honeywell | |
| Acrylamide 40 % | #1610140 | Bio-Rad | CAUTION : toxic, work under a fume hood |
| AFM cantilever | #CP-CONT-BSG-A-G | NanoAndMore | 5 μm spherical tip |
| AFM system | #NanoWizard3 | JPK | Coupled to optical microscope equipped with 40x air objective and GFP filter |
| Ammonium persulfate | #A3678 | Sigma | |
| Bis-acrylamide 2 % | #1610142 | Bio-Rad | CAUTION : toxic, work under a fume hood |
| Camera sCMOS | #C11440-42U30 | Hamamatsu | |
| Camera sCMOS | #ANDORZYLA4.2 | Oxford Instrument | |
| CellRox | #C10422 | Thermo Fisher | |
| Custom incubator chamber | EMBLEM | ||
| Dental glue | #1300 100 | Picodent | |
| DMEM | #41965 | Thermo Fisher | |
| Epifluorescence microscope | #Eclipse Ti2E | Nikon | |
| Epifluorescence microscope | #Axiovert200 | Zeiss | |
| Ethanol | #9065.3 | Carl Roth | |
| FBS South America | #S181T | Thermo Fisher | |
| Fibrinogen | #F13191 | Invitrogen | Alexa488 conjugate |
| Fibronectin | #F1141 | Sigma | |
| Fluorescent beads 200 nm | #F8805 | Invitrogen | Carboxylated (365/415) |
| Fluorescent beads 200 nm | #F8848 | Invitrogen | Carboxylated (505/515) |
| Fluorescent beads 200 nm | #F8810 | Invitrogen | Carboxylated (580/605) |
| Fluorescent beads 200 nm | #F8807 | Invitrogen | Carboxylated (660/680) |
| Glass coverslip 15 mm round | #41001115 | Assistent | |
| Glass coverslip 24 mm round | #41001124 | Assistent | |
| Microscope Objective | #MRH08230 | Nikon | 20x air NA 0.45 |
| Mouse Embryonic Fibroblasts | #CRL-2991 | ATCC | |
| mPEG-SVA | #MPEG-SVA-5000 | Laysan Bio | |
| N-Hydroxyethyl acrylamide | #697931 | Aldrich | |
| Plasma cleaner | #100-E | TePla | |
| PLPP gel | #PLPPgel | Alveole | |
| Poly-L-lysine | #P4823 | Sigma Aldrich | |
| Poly(L-lysine)-graft-poly(ethylene glycol) | #PLL(20-g[3.5]-PEG(2) | SuSoS | |
| Sodium(meta) periodate | #S1878 | Sigma Aldrich | |
| TEMED | #17919 | Thermo Scientific | |
| UV Patterning module | #PRIMO | Alveole | |
| UVO cleaner | #342-220 | Jelight |
Referenzen
- Geiger, B., Bershadsky, A. Exploring the neighborhood: adhesion-coupled cell mechanosensors. Cell. 110 (2), 139-142 (2002).
- Beningo, K. A., Hamao, K., Dembo, M., Wang, Y. -l, Hosoya, H. Traction forces of fibroblasts are regulated by the Rho-dependent kinase but not by the myosin light chain kinase. Archives of Biochemistry and Biophysics. 456 (2), 7(2006).
- Rape, A. D., Guo, W. H., Wang, Y. L. The regulation of traction force in relation to cell shape and focal adhesions. Biomaterials. 32 (8), 2043-2051 (2011).
- Kumar, R., Saha, S., Sinha, B. Cell spread area and traction forces determine myosin-II-based cortex thickness regulation. Biochimica Biophysica Acta. Molecular Cell Research. 1866 (12), 118516(2019).
- Chen, C. S., Mrksich, M., Huang, S., Whitesides, G. M., Ingber, D. E. Geometric control of cell life and death. Science. 276 (5317), 1425-1428 (1997).
- Thery, M. Micropatterning as a tool to decipher cell morphogenesis and functions. Journal of Cell Science. 123, 4201-4213 (2010).
- Strale, P. O., et al. Multiprotein printing by light-induced molecular adsorption. Advanced Materials. 28 (10), 2024-2029 (2016).
- Azioune, A., Carpi, N., Tseng, Q., Théry, M., Piel, M. Microtubules: in vivo Methods in Cell Biology. , 133-146 (2010).
- Tseng, Q., et al. A new micropatterning method of soft substrates reveals that different tumorigenic signals can promote or reduce cell contraction levels. Lab on a Chip. 11 (13), 2231-2240 (2011).
- Vignaud, T., Ennomani, H., Thery, M. Polyacrylamide hydrogel micropatterning. Methods Cell Biology. 120, 93-116 (2014).
- Munevar, S., Wang, Y., Dembo, M. Traction force microscopy of migrating normal and H-ras transformed 3T3 fibroblasts. Biophysical Journal. 80 (4), 1744-1757 (2001).
- Style, R. W., et al. Traction force microscopy in physics and biology. Soft Matter. 10 (23), 4047-4055 (2014).
- Polacheck, W. J., Chen, C. S. Measuring cell-generated forces: a guide to the available tools. Nature Methods. 13 (5), 415-423 (2016).
- Schwarz, U. S., Soine, J. R. Traction force microscopy on soft elastic substrates: A guide to recent computational advances. Biochimica Biophysica Acta. 1853, 3095-3104 (2015).
- Roca-Cusachs, P., Conte, V., Trepat, X. Quantifying forces in cell biology. Nature Cell Biology. 19 (7), 742-751 (2017).
- Hanke, J., Probst, D., Zemel, A., Schwarz, U. S., Koster, S. Dynamics of force generation by spreading platelets. Soft Matter. 14 (31), 6571-6581 (2018).
- Butler, J. P., Tolic-Norrelykke, I. M., Fabry, B., Fredberg, J. J. Traction fields, moments, and strain energy that cells exert on their surroundings. American Journal of Physiology. Cell Physiology. 282 (3), 595-605 (2002).
- Sabass, B., Gardel, M. L., Waterman, C. M., Schwarz, U. S. High resolution traction force microscopy based on experimental and computational advances. Biophysical Journal. 94 (1), 207-220 (2008).
- Willert, C. E., Gharib, M. Digital particle image velocimetry. Experiments in Fluids. 10, 181-193 (1991).
- Lourenco, L., Krothapalli, A. On the accuracy of velocity and corticity measurements with PIV. Experiments in Fluids. 18, 421-428 (1995).
- Adrian, R. J., Westerweel, J. Particle Image Velocimetry. , Cambridge University Press. (2011).
- Westerweel, J., Scarano, F. Universal outlier detection for PIV data. Experiments in Fluids. 39 (6), 1096-1100 (2005).
- Dembo, M., Wang, Y. Stresses at the cell-to-substrate interface during locomotion of fibroblasts. Biophysical Journal. 76 (4), 2307-2316 (1999).
- Schwarz, U. S., et al. Calculation of forces at focal adhesions from elastic substrate data: the effect of localized force and the need for regularization. Biophysical Journal. 83 (3), 1380-1394 (2002).
- Huang, Y., Gompper, G., Sabass, B. A Bayesian traction force microscopy method with automated denoising in a user-friendly software package. Computer Physics Communications. 256, 107313(2020).
- Vedadghavami, A., et al. Manufacturing of hydrogel biomaterials with controlled mechanical properties for tissue engineering applications. Acta Biomaterialia. 62, 42-63 (2017).
- Huth, S., Sindt, S., Selhuber-Unkel, C. Automated analysis of soft hydrogel microindentation: Impact of various indentation parameters on the measurement of Young's modulus. PLoS One. 14 (8), 0220281(2019).
- Oria, R., et al. Force loading explains spatial sensing of ligands by cells. Nature. 552 (7684), 219-224 (2017).
- Buxboim, A., Rajagopal, K., Brown, A. E., Discher, D. E. How deeply cells feel: methods for thin gels. Journal of Physics. Condensed Matter. 22 (19), 194116(2010).
- Sen, S., Engler, A. J., Discher, D. E. Matrix strains induced by cells: Computing how far cells can feel. Cell and Molecular Bioengineering. 2 (1), 39-48 (2009).
- Arnold, M., et al. Induction of cell polarization and migration by a gradient of nanoscale variations in adhesive ligand spacing. Nano Letters. 8 (7), 2063-2069 (2008).
- Galluzzi, M., et al. Atomic force microscopy methodology and AFMech Suite software for nanomechanics on heterogeneous soft materials. Nat Communications. 9 (1), 3584(2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten