Method Article
Aislamiento rápido de nematodos silvestres por Baermann Funnel
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe un método para extraer eficientemente nematodos vivos de sustratos naturales en el campo.
Resumen
Más allá de ser organismos modelo experimentales robustos, Caenorhabditis elegans y sus parientes también son animales reales que viven en la naturaleza. Los estudios de nematodos silvestres en sus entornos naturales son valiosos para comprender muchos aspectos de la biología, incluidos los regímenes selectivos en los que evolucionan los caracteres genómicos y fenotípicos distintivos, la base genética para la variación de rasgos complejos y la diversidad genética natural fundamental para todas las poblaciones animales. Este manuscrito describe un método simple y eficiente para extraer nematodos de sus sustratos naturales, incluyendo frutas podridas, flores, hongos, hojarasca y suelo. El método del embudo de Baermann, una técnica clásica de nematología, aísla selectivamente los nematodos activos de sus sustratos. Debido a que recupera casi todos los gusanos activos de la muestra, la técnica del embudo de Baermann permite la recuperación de genotipos raros y de crecimiento lento que coexisten con genotipos abundantes y de rápido crecimiento, que podrían perderse en los métodos de extracción que involucran múltiples generaciones de reproducción. La técnica también es muy adecuada para abordar cuestiones metagenéticas, genéticas de poblaciones y ecológicas. Captura a toda la población en una muestra simultáneamente, lo que permite una visión imparcial de la distribución natural de edades, sexos y genotipos. El protocolo permite el despliegue a escala en el campo, convirtiendo rápidamente los sustratos en placas de gusano, y los autores lo han validado a través del trabajo de campo en múltiples continentes.
Introducción
Están surgiendo valiosos conocimientos biológicos a medida que los investigadores que estudian C. elegans en el laboratorio amplían su enfoque a C. elegans y nematodos rabdítidos relacionados en la naturaleza. Los estudios de nematodos silvestres sitúan los genes y genomas en su contexto natural, revelando funciones potencialmente oscurecidas por las condiciones de laboratorio1,2,3,4,5. Estos estudios generan información sobre el requisito previo para la evolución misma, la variación genética6,7,8,9,10. La variación genética natural capturada por muestras silvestres también proporciona incursiones en la base genética de muchos rasgos complejos11,12,13.
Al diseñar estudios que requieren el aislamiento de poblaciones naturales de nematodos, particularmente cuando se realiza trabajo de campo remoto, las consideraciones prácticas pasan a primer plano. Este protocolo tiene como objetivo aislar limpiamente poblaciones enteras de nematodos activos que se pueden cultivar en OP50 a partir de cebos o sustratos silvestres. El método es muy adecuado para extraer nematodos rabdíidos y diplogasteridos de vida libre, incluidos Caenorhabditis, Oscheius y Pristionchus.
Existen muchas técnicas para aislar nematodos de sus sustratos14,15. El enfoque más básico es colocar el sustrato directamente sobre una placa de nematodo medio, recogiendo animales a medida que se arrastran8,15. Este método requiere grandes cantidades de tiempo y trabajo si el objetivo es aislar todos los nematodos de una muestra. Las técnicas más sofisticadas aprovechan el peso, el tamaño, la movilidad o alguna combinación de estos de los animales14. Cada método tiene sus ventajas y desventajas en términos de configuración y rendimiento. También difieren en sus sesgos de muestreo y pueden seleccionar ciertos nematodos si los animales de la muestra varían a lo largo del eje del principio de separación del método.
El método del embudo de Baermann fue descrito por primera vez en 1917 por el médico holandés G. K. T. F. Baermann, quien inventó el dispositivo en Java mientras estudiaba los nematodos que habitan en el suelo, incluido el anquilostoma parásito16. El embudo de Baermann funciona basado en el principio de movilidad. El sustrato se coloca en un embudo forrado con un filtro de tela o papel (se utiliza un "Kimwipe" para este estudio, conocido como "toallita sin pelusa" en el protocolo actual) y se cierra sellado en la parte inferior. El embudo se llena con agua, sumergiendo la muestra mientras el filtro la separa de la salida sellada. Los nematodos activos en la muestra se liberan en el agua y nadan a través del filtro, finalmente se asientan en el fondo del embudo. Se abre la salida del embudo y se expulsa una gota de nematodos a una placa (Figura 1).

Figura 1: Resumen de la técnica del embudo de Baermann. (A) Recolección de una muestra rica en bacterias de un sitio de interés. (B) Sumergir la muestra en un embudo de Baermann y esperar a que los gusanos se retuerzan y se hundan. (C) Liberar una sola gota del embudo. (D) Mover hermafroditas individuales o hembras apareadas a placas separadas. Ilustración creada por Ramin Rahni. Haga clic aquí para ver una versión más grande de esta figura.
El embudo de Baermann no funcionará para todos los tipos de nematodos (consulte la sección Discusión para alternativas específicas) y es más adecuado para aquellos que son formas activas en el rango de tamaño de Caenorhabditis o más pequeñas14. Sin embargo, si un estudio puede usar el embudo de Baermann, hay muchas ventajas. El método es práctico en el campo, ya que requiere una configuración limitada, tiempo práctico y costo. El investigador se queda con una muestra limpia sin la obstrucción del sustrato en la placa, lo que facilita la recolección. El uso de un filtro también evita la contaminación de la placa por larvas de insectos o ácaros, que mastican placas o se alimentan de nematodos en la muestra. Lo más importante es que el embudo de Baermann extrae eficientemente casi toda la población del sustrato14, lo que puede ser necesario dependiendo del diseño del estudio. Por ejemplo, los investigadores interesados en contar la etapa o la distribución por sexo de las poblaciones silvestres, encontrar genotipos raros o de crecimiento lento, o muestrear nematodos no atraídos por OP50 podrían beneficiarse de este método. Esto es apropiado para los investigadores que estudian preguntas ecológicas17, genéticas de poblaciones18 o metagenéticas19, ya que el esquema de muestreo toma una instantánea de la población en el momento del muestreo.
El presente manuscrito describe un protocolo completo para aislar poblaciones de nematodos utilizando el embudo de Baermann y establecer líneas isofemale e isohermafroditas en el campo, utilizando equipos elegidos para facilitar el transporte. Para los investigadores que realizan trabajo de campo cerca de sus laboratorios, muchos de estos pasos pueden omitirse o simplificarse.
Protocolo
1. Preparación de placas NGM sembradas en el campo
- Antes de viajar, pesar 23.005 g de nematodo growth medium (NGM) (ver Tabla de materiales) en polvo y pre-empacar en una bolsa de plástico sellable. Haga una bolsa por cada litro de medio deseado.
NOTA: El embalaje previo antes del viaje evita la necesidad de un equilibrio funcional en el campo. - Antes de viajar, prepare 1 ml de 1M MgSO4, 1 ml de 1 M de CaCl2 y 25 ml de tampón de fosfato de potasio 1M por cada litro de medio deseado. Para hacer 1 L de tampón de fosfato de potasio, disuelva 108.3 g de KH2PO4 y 35.6 g de K2HPO4 en agua, como se describe en WormBook20.
- Antes de viajar, haga un cultivo nocturno de OP50 (ver Tabla de Materiales) cultivado en LB a 37 °C, como se describe en WormBook20. Alícuota el cultivo en tubos cónicos de 50 ml y envuelva las tapas con película de parafina para evitar fugas.
- En el campo, disuelva el contenido del paquete NGM en 973 ml de agua de doble destilación (ddH20) o el agua más pura y estéril disponible en un matraz o botella de 1 L.
- Coloque el matraz o botella de medios, con una tapa suelta o una cubierta de papel de aluminio, en un baño de agua caliente hirviendo en una placa o estufa caliente. Revuelva ocasionalmente hasta que todo el polvo se disuelva y esté claro (esto toma ~ 30 min).
NOTA: Si hay una placa magnética disponible, una barra de agitación es una excelente opción para limitar la cantidad de agitación manual. - Retire el medio del baño de agua y enfríelo a ~ 58 ° C con agitación ocasional o con una barra de agitación. Una vez que el medio se enfríe a 58 ° C, use pipetas serológicas o estándar para agregar 25 ml de tampón de fosfato de potasio 1M, 1 ml de MgSO4 de 1 M y 1 ml de CaCl2 de 1 M, mezclando bien entre cada paso.
- En el ambiente más estéril disponible, pipetee o vierta el medio en placas del tamaño deseado y deje enfriar y solidificar durante la noche. Vierta una placa de 60 mm (~10 ml) para cada muestra de sustrato. Vierta una placa de 35 mm (~3.5 mL) para cada línea isofemale; el número de placas pequeñas necesarias es difícil de predecir de antemano.
- Pipetear 50 μL de cultivo OP50 en cada placa y dejar que se seque y crezca durante la noche antes de su uso.
2. Colección de los sustratos de nematodos
- Identifique un sustrato rico en bacterias en el campo. Algunos ejemplos incluyen frutas podridas, flores, hongos y tallos de plantas herbáceas. El suelo y la hojarasca también son adecuados, aunque rara vez contienen Caenorhabditis.
- Con una mano enguantada, coloque una muestra de este sustrato (1-15 cm3) en una bolsa de plástico sellable (consulte la Tabla de materiales) etiquetada con una identificación de muestra única (Figura 1A).
- Registre la identificación de la muestra, la latitud, la longitud, la fecha, la descripción del sustrato y cualquier otra medición ambiental local relevante para el experimento, incluida la temperatura ambiente y del sustrato, el momento de la recolección, la condición del sustrato, la presencia de macroinvertebrados asociados al sustrato, etc. Hay disponible una aplicación para teléfonos inteligentes para agilizar este proceso21.
3. Preparación de una matriz de embudos de Baermann
- Para cada embudo, use tijeras para cortar un segmento de tubo de goma (consulte la Tabla de materiales) de ~ 3 cm de largo.
- Ajuste el segmento de tubería sobre el extremo de un embudo de plástico (consulte la Tabla de materiales). Esto puede requerir un poco de esfuerzo ya que el ajuste es muy ajustado.
- Deslice una abrazadera de tubo sobre el tubo de goma y colóquelo.
- Para hacer un soporte de embudo, use un bisturí para cortar agujeros circulares de 35 mm de diámetro en la parte inferior de una bandeja de cartón para frascos de mosca (consulte la Tabla de materiales) que no se haya doblado desde su orientación de envío plano. Una bandeja estándar puede acomodar 12 de estos orificios en una matriz de 3 x 4.
- Invierta el cartón, doble los lados una vez (no dos veces, como lo haría uno para hacer una bandeja de vial de mosca) y pegue los lados juntos para elevar la bandeja de cartón invertido (Figura 2).
- Coloque embudos en los orificios, primero asegurándose de que las abrazaderas de los tubos estén en la posición cerrada.

Figura 2: Bandejas de viales de mosca de cartón reutilizadas, dobladas y cortadas para soportar 12 embudos baermann cada una. Haga clic aquí para ver una versión más grande de esta figura.
4. Transferencia de muestras a los embudos
- Vierta agua (tan estéril como esté disponible) en cada embudo, llenándolo unos 3 cm por debajo del borde. Si las burbujas de aire están atrapadas en el tubo, toque el embudo para liberarlas.
- Con las manos enguantadas, coloque una toallita sin pelusa o específicamente un Kimwipe (doblado por la mitad para hacer un cuadrado) sobre el embudo, y presione hacia abajo en el centro para que se sumerja en el agua.
- Rompa manualmente grandes trozos sólidos de sustratos naturales (fruta, flor, suelo, hojarasca, etc.) en fragmentos más pequeños para minimizar la distancia que los gusanos deben viajar para caerse del sustrato.
NOTA: La hojarasca y las muestras de formas incómodas se pueden preprocesar en un procesador de alimentos o licuadora. - Coloque suavemente una muestra del sustrato natural (1-15 cm3) sobre la toallita sin tejido / pelusa en un embudo sin perforar el tejido y sin que la muestra sobresalga por encima del borde.
- Etiquete el embudo, o el cartón junto al embudo, con el ID de muestra correspondiente a las notas de recolección de campo.
- Doble las esquinas de la toallita sin pañuelos sobre la muestra (Figura 1B). Tenga cuidado de mantener la muestra contenida dentro de la toallita sin pañuelos / pelusas para que no pueda pasar tierra o escombros al fondo del embudo.
NOTA: Este paso es para evitar que las esquinas cubran el borde del embudo, donde absorberían el agua del embudo sobre los lados. - Con las manos, una espátula o la punta de una pipeta, seleccione cualquier insecto activo, milpiés u otros animales que puedan viajar de embudo a embudo, contaminando muestras cruzadas. Envuelva el pañuelo / toallita sin pelusa completamente alrededor de la muestra o coloque un segundo tejido en la parte superior de la muestra para evitar la contaminación cruzada.
- Agregue más agua a los embudos para que toda la muestra quede sumergida (Figura 3).

Figura 3: Embudos de Baermann ensamblados. Cada muestra se envuelve en una toallita sin pañuelos de papel / pelusa y se sumerge bajo el agua en el embudo, que se cierra con sujeción. Durante un período de ~ 12 h, los nematodos migrarán a través del tejido y al fondo del embudo. Haga clic aquí para ver una versión más grande de esta figura.
5. Extracción de nematodos de los embudos
- Espere ~ 12 h o durante la noche. Durante este tiempo, los gusanos activos se retorcerán fuera del sustrato, a través de la limpieza sin tejido / pelusa y hasta la parte inferior del embudo sujeto.
NOTA: Esperar mucho más de 12 h corre el riesgo de mortalidad por gusanos debido a hipoxia o infección patógena, lo que también puede ser un riesgo a duraciones más cortas para muestras que están particularmente llenas de gusanos y bacterias. - Escriba la identificación de la muestra de un embudo en la parte inferior de una placa de gusano NGM de 60 mm sembrada con una mancha de bacteria OP50 E. coli . Retire la tapa del plato.
- Retire el embudo que contiene esa muestra del soporte del embudo. Usando una mano para sostener el embudo en posición vertical sobre la placa de gusano abierta, use la otra mano para liberar presión sobre la abrazadera del tubo, permitiendo que una gota de agua caiga desde el tubo sobre la placa de gusano (Figura 1C). Tan pronto como el agua caiga del embudo, vuelva a cerrarlo rápidamente para evitar que se inunde la placa NGM.
NOTA: Para seleccionar gusanos atraídos por OP50, incluidas las especies de Caenorhabditis , libere la gota lejos del césped bacteriano. Cuando el agua se empapa en el plato o se evapora, los nematodos caenorhabditis se arrastrarán hacia el césped bacteriano. - Limpiar: Tirar el contenido de los embudos. Lavar los embudos con agua caliente para su posterior reutilización.
6. Establecimiento de las culturas
- Observe los nematodos aislados bajo el estereomicroscopio a un aumento de 5x-50x. Las placas deben incluir nematodos, y a frecuencias mucho más bajas, pequeños anélidos oligoquetos, tardígrados, rotíferos y pequeños crustáceos (Figura 4).
NOTA: Si el embudo se ha configurado correctamente, ningún ácaro, insecto o material no vivo visible habrá pasado por el embudo.
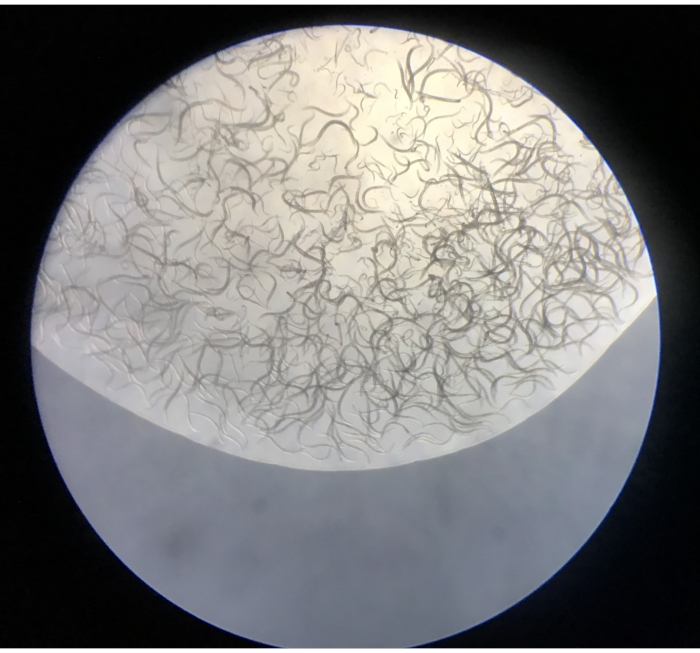
Figura 4: Contenido de la primera gota liberada de un embudo de Baermann en una placa NGM. Haga clic aquí para ver una versión más grande de esta figura.
- Para establecer líneas isohermafroditas o isofemales, use un pico de gusano para transferir cada hembra adulta hermafrodita L4 o apareada (reconocible por su mayor tamaño corporal y la falta de la cola masculina distinta22) a una placa NGM separada de 35 mm sembrada con OP50 (Figura 1D). Use un encendedor para esterilizar el pico de gusanos antes y después de transferir gusanos.
- Use una película de parafina para envolver las placas a fondo para viajar.
Resultados
Este protocolo se utilizó para aislar nematodos de frutas, flores, hongos, suelo y tallos en la isla de Barro Colorado, Panamá, en la estación de campo del Instituto Smithsonian de Investigaciones Tropicales en agosto de 2018. De los 131 sustratos procesados por un solo investigador durante cuatro días, 130 sustratos (99,2%) produjeron nematodos. Cuarenta y cuatro de los sustratos (33,6%) produjeron nematodos Caenorhabditis (Figura 5). El análisis posterior de los cultivos establecidos a partir de estos cuarenta y cuatro sustratos, mediante PCR y pruebas de apareamiento23, reveló la presencia de seis especies diferentes de Caenorhabditis : C. becei, C. tropicalis, C. briggsae, C. sp. 24, C. sp. 57 y C. panamensis.
Este protocolo se utilizó nuevamente para aislar nematodos de varios sustratos en la Zona de Exclusión de Chernobyl, Ucrania, durante cuatro días en agosto de 2019. Se recuperaron gusanos vivos de 62 de 63 muestras de suelo, 1 de cada 17 muestras de invertebrados, 31 de 75 muestras de frutas, 1 de cada 12 muestras de cebo (ver sección Discusión), y no se recuperaron gusanos de muestras de hongos, juncos de río o heces de lobo (una muestra recolectada de cada una). La secuenciación posterior del ADN ribosómico 18S15 identificó estos nematodos como Oscheius, Panagrolaimus, Acrobeloides, Mesorhabditis, Panagrellus, Pristionchus y Pelodera, pero no se identificó Caenorhabditis (Figura 5).
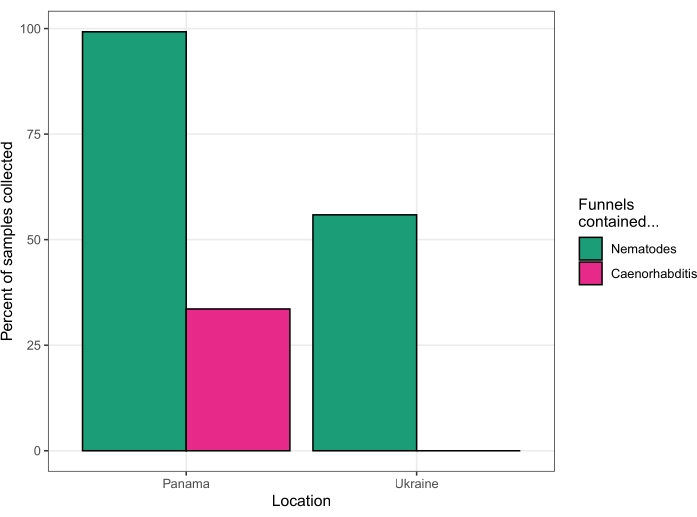
Figura 5: Tasas de éxito de dos viajes de recogida. Panamá en 2018 (izquierda) y Ucrania en 2019 (derecha). Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El principio central de este método es que los nematodos pasarán a través del tejido sumergido en agua, mientras que su sustrato y los contaminantes de invertebrados más grandes no lo harán. Los pasos críticos del protocolo son (1) recolectar un sustrato apropiado, (2) sumergir el sustrato, envuelto en un material filtrante, en agua, (3) recolectar gusanos que han pasado a través del filtro y se han hundido hasta el fondo del agua, y (4) aislar gusanos individuales para crear líneas isofemale o isohermafroditas. Todas las demás partes del método son susceptibles de modificación según sea necesario de acuerdo con los recursos disponibles, la naturaleza de los sustratos o los objetivos del trabajo de campo. Algunas modificaciones que vale la pena considerar son las siguientes.
Cebar a los gusanos plantando fruta
Si no hay un amplio suministro de material de podredumbre rico en bacterias que se encuentre en el sitio de campo, es posible que desee traer una muestra, como un trozo de manzana o tomate, para dejar que se pudra. Fije bien el cebo con unas pocas estacas para que los animales más grandes no los retiren y para que se pueda encontrar fácilmente más tarde para su recolección. Evite la luz solar directa, donde el cebo podría secarse antes de que se pudra.
Construcción de aparatos de embudo a partir de cualquier material disponible
Cualquier estructura con orificios lo suficientemente grandes como para acomodar la abrazadera del tubo y lo suficientemente estable como para soportar un embudo pesado superior funcionará. Para un solo embudo, un vaso para beber es un soporte adecuado. Se puede usar cualquier tipo de pañuelo de papel (pañuelo facial, papel higiénico o toallas de papel).
Poner menos material en los embudos, o ajustar el tiempo de espera, para prevenir la hipoxia o la infección
Si la muestra tiene una concentración muy alta de gusanos o bacterias, los nematodos pueden comenzar a morir de hipoxia o infección antes de que se complete la incubación de 12 h. Si esto es una preocupación, el investigador puede verificar los embudos antes o preparar un embudo adicional con una submuestra muy pequeña del sustrato altamente poblado.
Ajuste de la preparación de la placa NGM a las necesidades y restricciones experimentales
Las placas NGM se pueden preparar con cualquier medio y fuente de alimento que sea apropiado para el experimento. El protocolo de campo descrito anteriormente está diseñado para minimizar el peso del equipaje. Dependiendo de las limitaciones de equipaje y el tiempo de trabajo de campo, puede ser preferible traer placas NGM ya vertidas, ya sea preparadas en el laboratorio o compradas comercialmente, en lugar de verter placas en el campo.
Realización de los aislamientos de embudo en el laboratorio
El protocolo describe la realización del procedimiento completo en condiciones de campo para capturar la población de nematodos tal como ocurre en la naturaleza. Para algunos objetivos de investigación, puede ser suficiente aislar los nematodos más tarde, después de viajar de regreso al laboratorio con muestras en bolsas selladas. Incluso entonces, el método del embudo de Baermann proporciona una muestra más limpia y completa de los nematodos supervivientes que otros métodos de aislamiento. Sin embargo, las muestras en bolsas selladas pueden experimentar selección durante el viaje, ya que están expuestas a posibles extremos de temperatura e hipoxia. Esto se puede minimizar realizando aislamientos tan pronto como sea posible después de la recolección de muestras.
Un método alternativo común al embudo de Baermann consiste en colocar el sustrato directamente sobre una placa NGM y esperar a que los gusanos se arrastren, lo que es altamente laborioso o resulta en la recolección incompleta de la población. También produce placas contaminadas con ácaros y larvas de insectos. El método de embudo de Baermann es una estrategia de bajo costo, baja tecnología y baja mano de obra para separar rápidamente a toda la población de gusanos activos de su sustrato.
El método del embudo de Baermann no es universalmente aplicable para la recolección de todos los tipos de nematodos silvestres. Algunos nematodos que habitan en las plantas tardan mucho más de 12 h en emerger de su sustrato y estarán ausentes de una gota liberada demasiado pronto, mientras que algunos parásitos de insectos se arrastrarán hasta la parte superior del embudo en lugar de la parte inferior, evadiendo también la recolección14. Las alternativas al embudo de Baermann requieren equipos más especializados o más mano de obra para recuperar los gusanos. Sin embargo, aún pueden ser preferidos si las advertencias anteriores son un problema para el experimento. Las opciones alternativas, revisadas por van Bezooijen14, incluyen el método de pulverización de embudo, que proporciona una niebla constante de agua a los embudos, agregando oxígeno y permitiendo el desbordamiento de bacterias en suspensión. Esto permite un período de extracción más prolongado de nematodos de las plantas. El método de flotación centrífuga de la licuadora recupera nematodos de movimiento lento, inactivos o que se arrastran hacia arriba separándolos por su gravedad específica, elutriador Oostenbrink aplica una corriente subterránea para separar el sedimento de sedimentación de los nematodos suspendidos, y el método de Cobb utiliza una serie de tamices para aislar a los nematodos por su tamaño, forma y velocidad de sedimentación14. Sin embargo, para recolectar rabdítidos, el embudo de Baermann produce muestras limpias de manera efectiva rápidamente y con un esfuerzo mínimo.
Divulgaciones
Los autores declaran que no hay conflictos de intereses.
Agradecimientos
Este trabajo fue apoyado por las subvenciones R35GM141906 y R21ES031364 de los NIH y la beca Damon Runyon DRG-2371-19.
Materiales
| Name | Company | Catalog Number | Comments |
| 1 L glass bottle | NA | NA | Step 1 - vessel for making plate media |
| 1 mL pipette tips | any | NA | Step 1 - dispense worm media additives and seed plates |
| 1 mL pipetter | any | NA | Step 1 - dispense worm media additives and seed plates |
| 35 mm worm plates | Tritech | T3500 | Step 1 - worm plates |
| 4mm ID rubber tubing | Fisher | 14178A | Step 3 - part of the funnel |
| 60 mm worm plates | Greiner | 628161 | Step 1 - worm plates |
| 65 mm Funnel | Fisher | 22170156 | Step 3 - part of the funnel |
| Calcium chloride | Fisher | C79-500 | Step 1 - worm plate medium |
| Cooking pot | NA | NA | Step 1 - a water bath for melting the agar to pour plates |
| E. coli strain OP50 | Caenorhabditis Genetics Center | OP50 | Step 1 - worm food |
| Field microscope | OMAX | G223CS | Step 6 - for viewing worms in the field |
| Fly vial storage tray | Azer Scientific | ES-260T | Step 3 - to build a platform to hold 12 funnels |
| Hot plate or stove | NA | NA | Step 1 - to heat the water bath |
| Kimwipes | KimberlyClark | 34120 | Step 4 - filter for the funnels |
| LB media | Gibco | 10855021 | Step 1 - for growing OP50 |
| Lighter | NA | NA | Step 6 - sterilize the worm pick |
| Magnesium sulfate | Fisher | M63-500 | Step 1 - worm plate medium |
| NGM-lite agar | USBiological | N1000 | Step 1 - worm plate medium |
| Parafilm M wrapping film | Fisher | 13-374-10 | Step 6 - pack worm plates for travel |
| Potassium phosphate dibasic | Fisher | BP363-500 | Step 1 - worm plate medium |
| Potassium phosphate monobasic | Fisher | P285-3 | Step 1 - worm plate medium |
| scalpel | NA | NA | Step 3 - cut holes for the funnels |
| scissors | NA | NA | Step 3 - cut the rubber tubing |
| Tape | NA | NA | Step 3 - tape the funnel holder together |
| Tubing clamps | Fisher | 5869 | Step 3 - part of the funnel |
| Worm pick | NA | NA | Step 6 - for isolating individual worms |
| Ziplock-style storage bags | NA | NA | Step 2 - to bag a substrate sample |
Referencias
- Frezal, L., Felix, M. A. C. elegans outside the Petri dish. Elife. 4, 05849(2015).
- Greene, J. S., et al. Balancing selection shapes density-dependent foraging behaviour. Nature. 539 (7628), 254-258 (2016).
- Reddy, K. C., et al. Antagonistic paralogs control a switch between growth and pathogen resistance in C. elegans. PLOS Pathogens. 15 (1), 1007528(2019).
- Schulenburg, H., Felix, M. A. The natural biotic environment of Caenorhabditis elegans. Genetics. 206 (1), 55-86 (2017).
- Zhang, F., et al. Caenorhabditis elegans as a model for microbiome research. Frontiers in Microbiology. 8, 485(2017).
- Andersen, E. C., et al. Chromosome-scale selective sweeps shape Caenorhabditis elegans genomic diversity. Nature Genetics. 44 (3), 285-290 (2012).
- Cook, D. E., Zdraljevic, S., Roberts, J. P., Andersen, E. C. CeNDR, the Caenorhabditis elegans natural diversity resource. Nucleic Acids Research. 45, 650-657 (2017).
- Crombie, T. A., et al. Deep sampling of Hawaiian Caenorhabditis elegans reveals high genetic diversity and admixture with global populations. Elife. 8, 50465(2019).
- Lee, D., et al. Balancing selection maintains hyper-divergent haplotypes in Caenorhabditis elegans. Nature Ecology & Evolution. 5 (6), 794-807 (2021).
- Rockman, M. V., Kruglyak, L. Recombinational landscape and population genomics of Caenorhabditis elegans. PLOS Genetics. 5 (3), 1000419(2009).
- Evans, K. S., van Wijk, M. H., McGrath, P. T., Andersen, E. C., Sterken, M. G. From QTL to gene: C. elegans facilitates discoveries of the genetic mechanisms underlying natural variation. Trends in Genetics. 37, 933-947 (2021).
- Gaertner, B. E., Phillips, P. C. Caenorhabditis elegans as a platform for molecular quantitative genetics and the systems biology of natural variation. Genetics Research (Cambridge Core). 92 (5-6), 331-348 (2010).
- Noble, L. M., Rockman, M. V., Teotonio, H. Gene-level quantitative trait mapping in Caenorhabditis elegans. G3 Genes|Genomes|Genetics. 11 (2), 061(2021).
- Van Bezooijen, J. Methods and techniques for nematology. , Wageningen University. (2006).
- Barrièrre, A., Félix, M. -A. Isolation of C. elegans. and related nematodes. Wormbook. , wormbook.1.115.2 (2014).
- Baermann, G. Eine einfache Methode zur Auffindung von Anklostomum (Nematoden) Larven in Erdproben. Geneeskundig tijdschrift voor Nederlandsch-Indië. 57, 131-137 (1917).
- Gray, N. F. Ecology of nematophagous fungi Panagrellus redivivus as the target organism. Plant and Soil. 297, 293-297 (1983).
- Mallez, S., Castagnone, C., Espada, M., Viera, P., Eisenback, J., Mota, M., Guillemaud, T., Castagnone-Sereno, P. First insights into the genetic diversity of the pinewood nematode in its native area using new polymorphic microsatellite loci. PLOS ONE. 8 (3), 4-11 (2013).
- Kerfahi, D., Tripathi, M. B., Porazinska, L. D., Park, J., Go, R., Adams, M. J. Do tropical rain forest soils have greater nematode diversity than High Arctic tundra? A metagenetic comparison of Malaysia and Svalbard. Global Ecology and Biogeography. 25, 716-728 (2016).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Di Bernardo, M., Crombie, T. A., Cook, D. E., Andersen, E. C. easyFulcrum: An R package to process and analyze ecological sampling data generated using the Fulcrum mobile application. PLOS ONE. 16, 0254293(2021).
- Lints, R., Hall, D. H. Handbook of C. elegans male anatomy. WormAtlas. , (2005).
- Kiontke, K., Félix, M. -A., Ailion, M., Rockman, M. V., Braendle, C., Pénigault, J. -B., Fitch, D. H. A phylogeny and molecular barcodes for Caenorhabditis, with numerous new species from rotting fruits. BMC Evolutionary Biology. 11, 339(2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados