Method Article
Isolement rapide des nématodes sauvages par Baermann Funnel
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole décrit une méthode pour extraire efficacement les nématodes vivants des substrats naturels sur le terrain.
Résumé
En plus d’être des organismes modèles expérimentaux robustes, Caenorhabditis elegans et ses parents sont également de vrais animaux qui vivent dans la nature. Les études sur les nématodes sauvages dans leur environnement naturel sont précieuses pour comprendre de nombreux aspects de la biologie, y compris les régimes sélectifs dans lesquels évoluent les caractères génomiques et phénotypiques distinctifs, la base génétique de la variation des caractères complexes et la diversité génétique naturelle fondamentale pour toutes les populations animales. Ce manuscrit décrit une méthode simple et efficace pour extraire les nématodes de leurs substrats naturels, y compris les fruits en décomposition, les fleurs, les champignons, la litière de feuilles et le sol. La méthode de l’entonnoir de Baermann, une technique classique de nématologie, isole sélectivement les nématodes actifs de leurs substrats. Parce qu’elle récupère presque tous les vers actifs de l’échantillon, la technique de l’entonnoir de Baermann permet de récupérer des génotypes rares et à croissance lente qui coexistent avec des génotypes abondants et à croissance rapide, ce qui pourrait être manqué dans les méthodes d’extraction impliquant plusieurs générations de reproduction. La technique est également bien adaptée pour aborder les questions métagénétiques, génétiques des populations et écologiques. Il capture simultanément l’ensemble de la population dans un échantillon, ce qui permet une vue impartiale de la distribution naturelle des âges, des sexes et des génotypes. Le protocole permet un déploiement à grande échelle sur le terrain, convertissant rapidement les substrats en plaques de ver, et les auteurs l’ont validé par des travaux de terrain sur plusieurs continents.
Introduction
Des connaissances biologiques précieuses émergent à mesure que les chercheurs qui étudient C. elegans en laboratoire se concentrent sur C. elegans et les nématodes rhabditidés apparentés à l’état sauvage. Les études sur les nématodes sauvages placent les gènes et les génomes dans leur contexte naturel, révélant des fonctions potentiellement obscurcies par les conditions de laboratoire1,2,3,4,5. Ces études génèrent des informations sur la condition préalable à l’évolution elle-même, la variation génétique6,7,8,9,10. La variation génétique naturelle capturée par les échantillons sauvages fournit également des incursions dans la base génétique de nombreux traits complexes11,12,13.
Lors de la conception d’études qui nécessitent l’isolement de populations naturelles de nématodes, en particulier lors de travaux sur le terrain à distance, des considérations pratiques sont mises en avant. Ce protocole vise à isoler proprement des populations entières de nématodes actifs qui peuvent être cultivés sur OP50 à partir d’appâts ou de substrats sauvages. La méthode est bien adaptée à l’extraction de nématodes rhabditid et diplogastérides vivants libres, y compris Caenorhabditis, Oscheius et Pristionchus.
Il existe de nombreuses techniques pour isoler les nématodes de leurs substrats14,15. L’approche la plus élémentaire consiste à placer le substrat directement sur une plaque de milieu nématode, en cueillant les animaux au fur et à mesure qu’ils rampent8,15. Cette méthode nécessite beaucoup de temps et de travail si l’objectif est d’isoler tous les nématodes d’un échantillon. Des techniques plus sophistiquées tirent parti du poids, de la taille, de la mobilité ou d’une combinaison de ceux-ci14. Chaque méthode a ses avantages et ses inconvénients en termes de configuration et de débit. Ils diffèrent également par leurs biais d’échantillonnage et peuvent choisir certains nématodes si les animaux de l’échantillon varient le long de l’axe du principe de séparation de la méthode.
La méthode de l’entonnoir de Baermann a été décrite pour la première fois en 1917 par le médecin néerlandais G. K. T. F. Baermann, qui a inventé le dispositif sur Java tout en étudiant les nématodes vivant dans le sol, y compris l’ankylostome parasite16. L’entonnoir Baermann fonctionne selon le principe de mobilité. Le substrat est placé dans un entonnoir tapissé d’un filtre en tissu ou en papier (un « Kimwipe » est utilisé pour cette étude, appelé « lingette non pelucheuse » dans le protocole actuel) et scellé fermé au fond. L’entonnoir est ensuite rempli d’eau, submergeant l’échantillon tandis que le filtre le sépare de la sortie scellée. Les nématodes actifs dans l’échantillon se libèrent dans l’eau et nagent à travers le filtre, pour finalement se déposer au fond de l’entonnoir. La sortie de l’entonnoir est ouverte et une goutte de nématodes est expulsée sur une plaque (Figure 1).

Figure 1 : Résumé de la technique de l’entonnoir de Baermann. (A) Prélèvement d’un échantillon riche en bactéries sur un site d’intérêt. (B) Immersion de l’échantillon dans un entonnoir de Baermann et attente que les vers se tortillent et coulent. (C) Libérer une seule goutte de l’entonnoir. (D) Déplacement d’hermaphrodites simples ou de femelles accouplées sur des plaques séparées. Illustration réalisée par Ramin Rahni. Veuillez cliquer ici pour voir une version agrandie de cette figure.
L’entonnoir de Baermann ne fonctionnera pas pour tous les types de nématodes (voir la section Discussion pour des alternatives spécifiques) et convient mieux à ceux qui sont des formes actives dans la gamme de taille de Caenorhabditis ou plus petite14. Cependant, si une étude peut utiliser l’entonnoir de Baermann, il existe de nombreux avantages. La méthode est pratique sur le terrain, nécessitant une configuration limitée, un temps pratique et un coût limités. Le chercheur se retrouve avec un échantillon propre sans obstruction du substrat sur la plaque, ce qui facilite le prélèvement. L’utilisation d’un filtre empêche également la contamination de la plaque par des larves d’insectes ou des acariens, qui mâchent des plaques ou des proies sur des nématodes dans l’échantillon. Plus important encore, l’entonnoir de Baermann extrait efficacement presque toute la population du substrat14, ce qui peut être nécessaire en fonction de la conception de l’étude. Par exemple, les chercheurs intéressés par le comptage du stade ou de la répartition sexuelle des populations sauvages, la recherche de génotypes rares ou à croissance lente ou l’échantillonnage de nématodes non attirés par OP50 pourraient bénéficier de cette méthode. Ceci est approprié pour les chercheurs qui étudient des questions écologiques17, génétiques de population18 ou métagénétiques19, car le schéma d’échantillonnage prend un instantané de la population au moment de l’échantillonnage.
Le présent manuscrit décrit un protocole complet pour isoler les populations de nématodes à l’aide de l’entonnoir de Baermann et établir des lignes isoofémales et isohermaphrodites sur le terrain, en utilisant un équipement choisi pour faciliter le transport. Pour les chercheurs qui effectuent des travaux sur le terrain près de leurs laboratoires, bon nombre de ces étapes peuvent être omises ou simplifiées.
Protocole
1. Préparation des plaques de NGM ensemencées dans le champ
- Avant le voyage, peser 23,005 g de poudre de milieu de croissance des nématodes (NGM) (voir tableau des matériaux) et pré-emballer dans un sac en plastique scellable. Faites un sac pour chaque litre de média souhaité.
REMARQUE: Le pré-emballage avant le voyage contourne la nécessité d’un équilibre fonctionnel sur le terrain. - Avant le voyage, préparer 1 mL de 1M MgSO4, 1 mL de 1M CaCl2 et 25 mL de tampon phosphate de potassium 1M pour chaque litre de milieu souhaité. Pour faire 1 L de tampon phosphate de potassium, dissoudre 108,3 g de KH2PO4 et 35,6 g de K2HPO4 dans l’eau, comme décrit dans WormBook20.
- Avant de voyager, faites une culture nocturne de l’OP50 (voir tableau des matériaux) cultivé en LB à 37 °C, comme décrit dans WormBook20. Aliquotez la culture dans des tubes coniques de 50 mL et enveloppez le dessus avec un film de paraffine pour éviter les fuites.
- Sur le terrain, dissoudre le contenu du paquet de NGM dans 973 mL d’eau double distillée (ddH20) ou dans l’eau la plus pure et la plus stérile disponible dans une fiole ou une bouteille de 1 L.
- Placez la fiole ou la bouteille du média, avec un bouchon lâche ou un couvercle en feuille d’aluminium, dans un bain d’eau chaude bouillante sur une plaque chauffante ou une cuisinière. Remuer de temps en temps jusqu’à ce que toute la poudre soit dissoute et claire (cela prend environ 30 min).
REMARQUE: Si une plaque chauffante magnétique est disponible, une barre d’agitation est une excellente option pour limiter la quantité d’agitation manuelle. - Retirez le média du bain-marie et refroidissez à ~58 °C en secouant occasionnellement ou avec une barre de remuage. Une fois le milieu refroidi à 58 °C, utilisez des pipettes sérologiques ou standard pour ajouter 25 mL de tampon phosphate de potassium 1M, 1 mL de MgSO4 et 1 mL de CaCl2 1M, en mélangeant bien entre chaque étape.
- Dans l’environnement le plus stérile disponible, pipettez ou versez le média dans des plaques de la taille souhaitée et laissez refroidir et solidifier pendant la nuit. Versez une plaque de 60 mm (~10 mL) pour chaque échantillon de substrat. Verser une plaque de 35 mm (~3,5 mL) pour chaque ligne d’isofemale ; le nombre de petites plaques nécessaires est difficile à prévoir à l’avance.
- Pipette 50 μL de culture OP50 sur chaque plaque et laisser sécher et pousser pendant la nuit avant utilisation.
2. Collecte des substrats des nématodes
- Identifier un substrat riche en bactéries sur le terrain. Quelques exemples incluent les fruits en décomposition, les fleurs, les champignons et les tiges de plantes herbacées. La litière de sol et de feuilles convient également, bien qu’elle contienne rarement caenorhabditis.
- Avec une main gantée, placer un échantillon de ce substrat (1-15 cm3) dans un sac en plastique scellable (voir Tableau des matériaux) étiqueté avec un ID d’échantillon unique (Figure 1A).
- Enregistrez l’ID de l’échantillon, la latitude, la longitude, la date, la description du substrat et toute autre mesure environnementale locale pertinente pour l’expérience, y compris la température ambiante et du substrat, l’heure de collecte, l’état du substrat, la présence de macroinvertébrés associés au substrat, etc. Une application pour smartphone est disponible pour rationaliser ce processus21.
3. Préparation d’une gamme d’entonnoirs Baermann
- Pour chaque entonnoir, utilisez des ciseaux pour couper un segment de tube en caoutchouc (voir Tableau des matériaux) d’environ 3 cm de long.
- Placez le segment de tuyau sur l’extrémité d’un entonnoir en plastique (voir Tableau des matériaux). Cela peut prendre un certain effort car l’ajustement est très serré.
- Faites glisser une pince de tube sur le tube en caoutchouc et serrez-la.
- Pour fabriquer un porte-entonnoir, utilisez un scalpel pour couper des trous circulaires de 35 mm de diamètre dans le fond d’un plateau en carton (voir Tableau des matériaux) qui n’a pas été plié ensemble à partir de son orientation d’expédition plate. Un plateau standard peut accueillir 12 de ces trous dans un tableau 3 x 4.
- Inverser le carton, replier les côtés une fois (pas deux fois, comme on le ferait pour faire un plateau de flacon volant) et coller les côtés ensemble pour élever le plateau en carton inversé (Figure 2).
- Placez des entonnoirs dans les trous, en vous assurant d’abord que les pinces à tubes sont en position fermée.

Figure 2 : Bacs à flacons de mouches en carton réutilisés, pliés et coupés pour supporter 12 entonnoirs Baermann chacun. Veuillez cliquer ici pour voir une version agrandie de cette figure.
4. Transfert d’échantillons dans les entonnoirs
- Versez de l’eau (aussi stérile que possible) dans chaque entonnoir, en le remplissant à environ 3 cm sous le bord. Si des bulles d’air sont piégées dans le tube, appuyez sur l’entonnoir pour les libérer.
- Avec les mains gantées, placez une lingette non pelucheuse ou plus précisément un Kimwipe (plié en deux pour faire un carré) sur l’entonnoir, et appuyez sur le centre pour qu’il soit immergé dans l’eau.
- Cassez manuellement de gros morceaux solides de substrats naturels (fruits, fleurs, sol, litière de feuilles, etc.) en fragments plus petits pour minimiser la distance que les vers doivent parcourir pour tomber du substrat.
REMARQUE: La litière de feuilles et les échantillons de forme maladroite peuvent être prétraités dans un robot culinaire ou un mélangeur. - Placez doucement un échantillon du substrat naturel (1-15 cm3) sur la lingette sans tissu /peluche dans un entonnoir sans perforer le tissu et sans que l’échantillon ne dépasse au-dessus du bord.
- Étiquetez l’entonnoir, ou le carton à côté de l’entonnoir, avec l’ID d’échantillon correspondant aux notes de collecte de champs.
- Repliez les coins de la lingette non pelucheuse sur l’échantillon (Figure 1B). Veillez à conserver l’échantillon contenu dans la lingette non pelucheuse afin qu’aucun sol ou débris ne puisse passer au fond de l’entonnoir.
REMARQUE: Cette étape consiste à empêcher les coins de se draper sur le bord de l’entonnoir, où ils évacueraient l’eau de l’entonnoir sur les côtés. - Avec des mains, une spatule ou une pointe de pipette, choisissez tous les insectes actifs, les mille-pattes ou d’autres animaux qui peuvent se déplacer d’un entonnoir à l’autre, contaminant des échantillons croisés. Enroulez la lingette sans tissu ou sans peluche entièrement autour de l’échantillon ou posez un deuxième tissu sur le dessus de l’échantillon pour éviter toute contamination croisée.
- Ajoutez plus d’eau aux entonnoirs afin que tout l’échantillon soit submergé (Figure 3).

Figure 3 : Entonnoirs Baermann assemblés. Chaque échantillon est enveloppé dans une lingette non pelucheuse et immergé sous l’eau dans l’entonnoir, qui est serré fermé. Sur une période d’environ 12 h, les nématodes migreront à travers le tissu et vers le bas de l’entonnoir. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Extraction des nématodes des entonnoirs
- Attendez ~12 h ou toute la nuit. Pendant ce temps, les vers actifs se tortillent hors du substrat, à travers la lingette sans tissu / peluche et jusqu’au fond de l’entonnoir serré.
REMARQUE: Attendre beaucoup plus longtemps que 12 h risque la mortalité des vers en raison de l’hypoxie ou d’une infection pathogène, ce qui peut également être un risque à des durées plus courtes pour les échantillons particulièrement encombrés de vers et de bactéries. - Écrivez l’ID de l’échantillon d’un entonnoir au fond d’une plaque de ver NGM de 60 mm ensemencée d’une tache de bactérie OP50 E. coli . Retirez le couvercle de la plaque.
- Retirez l’entonnoir contenant cet échantillon du support de l’entonnoir. En utilisant une main pour tenir l’entonnoir droit au-dessus de la plaque de ver ouverte, utilisez l’autre main pour relâcher la pression sur la pince du tube, permettant à une goutte d’eau de tomber du tube sur la plaque de ver (Figure 1C). Dès que de l’eau tombe de l’entonnoir, serrez-le rapidement à nouveau pour éviter d’inonder la plaque NGM.
REMARQUE: Pour sélectionner les vers attirés par OP50, y compris les espèces De Caenorhabditis , relâchez la goutte loin de la pelouse bactérienne. Lorsque l’eau pénètre dans la plaque ou s’évapore, les nématodes Caenorhabditis rampent dans la pelouse bactérienne. - Nettoyage : Jetez le contenu des entonnoirs. Lavez les entonnoirs à l’eau chaude pour une réutilisation ultérieure.
6. Établir les cultures
- Observez les nématodes isolés sous le stéréomicroscope à un grossissement de 5x-50x. Les plaques doivent inclure des nématodes et, à des fréquences beaucoup plus basses, de petits annélides oligochètes, des tardigrades, des rotifères et de petits crustacés (figure 4).
REMARQUE: Si l’entonnoir a été correctement configuré, aucun acarien, insecte ou matériau non vivant visible n’aura traversé l’entonnoir.
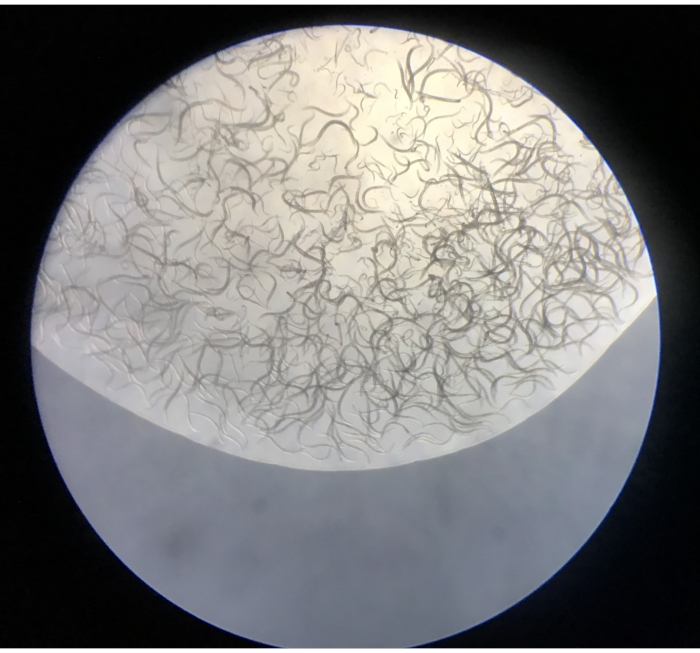
Figure 4: Contenu de la première gouttelette libérée par un entonnoir Baermann sur une plaque NGM. Veuillez cliquer ici pour voir une version plus grande de cette figure.
- Pour établir des lignées isohermaphrodites ou isofémales, utilisez un pic à vers pour transférer chaque femelle adulte hermaphrodite L4 ou accouplée (reconnaissable à sa plus grande taille corporelle et à l’absence de queue mâle distincte22) sur une plaque NGM séparée de 35 mm ensemencée d’OP50 (Figure 1D). Utilisez un briquet pour stériliser le pic à vers avant et après le transfert des vers.
- Utilisez un film de paraffine pour bien envelopper les assiettes pour le voyage.
Résultats
Ce protocole a été utilisé pour isoler les nématodes des fruits, des fleurs, des champignons, du sol et des tiges sur l’île de Barro Colorado, au Panamá, à la station de terrain du Smithsonian Tropical Research Institute en août 2018. Sur les 131 substrats traités par un seul chercheur pendant quatre jours, 130 substrats (99,2 %) ont donné des nématodes. Quarante-quatre des substrats (33,6 %) ont donné des nématodes caenorhabditis (figure 5). L’analyse ultérieure des cultures établies à partir de ces quarante-quatre substrats, par PCR et tests d’accouplement23, a révélé la présence de six espèces différentes de Caenorhabditis – C. becei, C . tropicalis, C. briggsae, C. sp. 24, C. sp. 57 et C. panamensis.
Ce protocole a de nouveau été utilisé pour isoler les nématodes de divers substrats dans la zone d’exclusion de Tchernobyl, en Ukraine, pendant quatre jours en août 2019. Des vers vivants ont été récupérés dans 62 des 63 échantillons de sol, 1 sur 17 échantillons d’invertébrés, 31 sur 75 échantillons de fruits, 1 sur 12 échantillons d’appâts (voir la section Discussion), et aucun ver n’a été récupéré dans des échantillons de champignons, de roseaux de rivière ou d’excréments de loup (un échantillon prélevé sur chacun). Le séquençage ultérieur de l’ADN ribosomique 18S15 a identifié ces nématodes comme Oscheius, Panagrolaimus, Acrobeloides, Mesorhabditis, Panagrellus, Pristionchus et Pelodera, mais aucune Caenorhabditis n’a été identifiée (Figure 5).
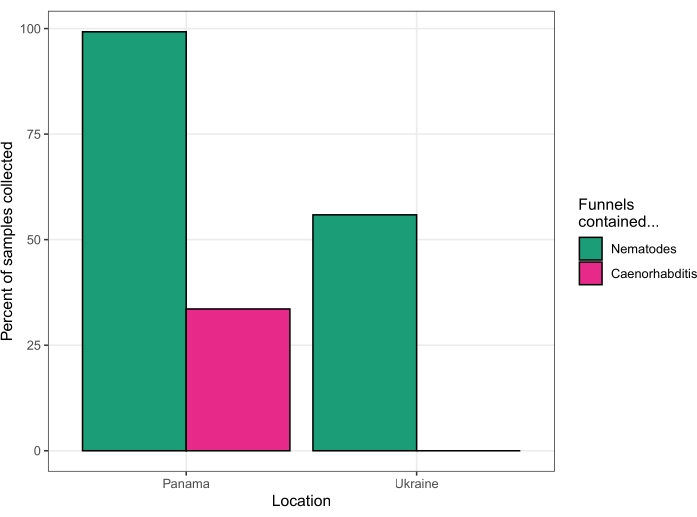
Figure 5 : Taux de réussite de deux voyages de collecte. Le Panama en 2018 (à gauche) et l’Ukraine en 2019 (à droite). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le principe central de cette méthode est que les nématodes passeront à travers le tissu immergé dans l’eau, alors que leur substrat et les plus gros contaminants invertébrés ne le feront pas. Les étapes critiques du protocole sont (1) la collecte d’un substrat approprié, (2) l’immersion du substrat, enveloppé dans un matériau filtrant, dans l’eau, (3) la collecte des vers qui ont traversé le filtre et coulé au fond de l’eau, et (4) l’isolement des vers individuels pour créer des lignes isomamale ou isohermaphrodites. Toutes les autres parties de la méthode peuvent être modifiées si nécessaire en fonction des ressources disponibles, de la nature des substrats ou des objectifs de travail sur le terrain. Certaines modifications à considérer sont les suivantes.
Appâter les vers en plantant des fruits
S’il n’y a pas suffisamment de matériel pourri riche en bactéries sur le site du champ, on peut souhaiter apporter un échantillon, comme un morceau de pomme ou de tomate, pour le laisser pourrir. Épinglez bien l’appât avec quelques piquets afin que les animaux plus gros ne les enlèvent pas et qu’il puisse facilement être trouvé plus tard pour la collecte. Évitez la lumière directe du soleil, où l’appât pourrait sécher avant de pourrir.
Construire un appareil d’entonnoir à partir de tous les matériaux disponibles
Toute structure avec des trous assez grands pour accueillir la pince à tube et suffisamment stable pour supporter un entonnoir lourd fonctionnera. Pour un seul entonnoir, un verre à boire est un support approprié. Tout type de mouchoir – mouchoir en papier, papier toilette ou serviettes en papier – peut être utilisé.
Mettre moins de matière dans les entonnoirs, ou ajuster le temps d’attente, pour prévenir l’hypoxie ou l’infection
Si l’échantillon présente une concentration très élevée de vers ou de bactéries, les nématodes peuvent commencer à mourir d’hypoxie ou d’infection avant la fin de l’incubation de 12 heures. Si cela est préoccupant, le chercheur peut vérifier les entonnoirs plus tôt ou préparer un entonnoir supplémentaire avec un très petit sous-échantillon du substrat très peuplé.
Ajustement de la préparation de la plaque NGM aux besoins et contraintes expérimentaux
Les plaques NGM peuvent être préparées avec n’importe quel support et source de nourriture approprié à l’expérience. Le protocole de terrain décrit ci-dessus est conçu pour minimiser le poids des bagages. Selon les limites de bagages et le calendrier de travail sur le terrain, il peut être préférable d’apporter des plaques NGM déjà coulées – préparées en laboratoire ou achetées dans le commerce – plutôt que de verser des plaques sur le terrain.
Effectuer les isolations de l’entonnoir en laboratoire
Le protocole décrit la réalisation de la procédure complète dans des conditions de terrain pour capturer la population de nématodes telle qu’elle se produit dans la nature. Pour certains objectifs de recherche, il peut suffire d’isoler les nématodes plus tard, après être retourné au laboratoire avec des échantillons dans des sacs scellés. Même dans ce cas, la méthode de l’entonnoir de Baermann fournit un échantillon plus propre et complet des nématodes survivants que les autres méthodes d’isolement. Cependant, les échantillons dans des sacs scellés peuvent être sélectionnés pendant le voyage, car ils sont exposés à des températures extrêmes potentielles et à l’hypoxie. Cela peut être minimisé en effectuant des isolements dès que possible après le prélèvement de l’échantillon.
Une méthode alternative courante à l’entonnoir de Baermann consiste à placer le substrat directement sur une plaque NGM et à attendre que les vers rampent, ce qui nécessite beaucoup de main-d’œuvre ou entraîne une collecte incomplète de la population. Il donne également des plaques contaminées par des acariens et des larves d’insectes. La méthode de l’entonnoir Baermann est une stratégie à faible coût, à faible technologie et à faible main-d’œuvre pour séparer rapidement toute la population de vers actifs de leur substrat.
La méthode de l’entonnoir de Baermann n’est pas universellement applicable pour la collecte de tous les types de nématodes sauvages. Certains nématodes végétaux mettent beaucoup plus de 12 h à émerger de leur substrat et seront absents d’une gouttelette libérée trop tôt, tandis que certains insectes parasites ramperont vers le haut de l’entonnoir plutôt que vers le bas, échappant également à la collecte14. Les alternatives à l’entonnoir Baermann nécessitent soit plus d’équipement spécialisé, soit plus de main-d’œuvre pour récupérer les vers. Cependant, ils peuvent toujours être préférés si les mises en garde ci-dessus sont un problème pour l’expérience. Les options alternatives, examinées par van Bezooijen14, comprennent la méthode de pulvérisation en entonnoir, qui fournit un brouillard constant d’eau aux entonnoirs, ajoutant de l’oxygène et permettant le débordement de bactéries en suspension. Cela permet une période d’extraction plus longue des nématodes des plantes. La méthode de flottation centrifuge du mélangeur récupère les nématodes lents, inactifs ou rampant vers le haut en les séparant par leur densité, l’éluat Oostenbrink applique un courant sous-jacent pour séparer les sédiments de décantation des nématodes en suspension, et la méthode de Cobb utilise une série de tamis pour isoler les nématodes par leur taille, leur forme et leur vitesse de sédimentation14. Pour collecter les rhabditids, cependant, l’entonnoir Baermann produit efficacement des échantillons propres rapidement et avec un minimum d’effort.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Ce travail a été soutenu par les subventions R35GM141906 et R21ES031364 des NIH et la bourse Damon Runyon DRG-2371-19.
matériels
| Name | Company | Catalog Number | Comments |
| 1 L glass bottle | NA | NA | Step 1 - vessel for making plate media |
| 1 mL pipette tips | any | NA | Step 1 - dispense worm media additives and seed plates |
| 1 mL pipetter | any | NA | Step 1 - dispense worm media additives and seed plates |
| 35 mm worm plates | Tritech | T3500 | Step 1 - worm plates |
| 4mm ID rubber tubing | Fisher | 14178A | Step 3 - part of the funnel |
| 60 mm worm plates | Greiner | 628161 | Step 1 - worm plates |
| 65 mm Funnel | Fisher | 22170156 | Step 3 - part of the funnel |
| Calcium chloride | Fisher | C79-500 | Step 1 - worm plate medium |
| Cooking pot | NA | NA | Step 1 - a water bath for melting the agar to pour plates |
| E. coli strain OP50 | Caenorhabditis Genetics Center | OP50 | Step 1 - worm food |
| Field microscope | OMAX | G223CS | Step 6 - for viewing worms in the field |
| Fly vial storage tray | Azer Scientific | ES-260T | Step 3 - to build a platform to hold 12 funnels |
| Hot plate or stove | NA | NA | Step 1 - to heat the water bath |
| Kimwipes | KimberlyClark | 34120 | Step 4 - filter for the funnels |
| LB media | Gibco | 10855021 | Step 1 - for growing OP50 |
| Lighter | NA | NA | Step 6 - sterilize the worm pick |
| Magnesium sulfate | Fisher | M63-500 | Step 1 - worm plate medium |
| NGM-lite agar | USBiological | N1000 | Step 1 - worm plate medium |
| Parafilm M wrapping film | Fisher | 13-374-10 | Step 6 - pack worm plates for travel |
| Potassium phosphate dibasic | Fisher | BP363-500 | Step 1 - worm plate medium |
| Potassium phosphate monobasic | Fisher | P285-3 | Step 1 - worm plate medium |
| scalpel | NA | NA | Step 3 - cut holes for the funnels |
| scissors | NA | NA | Step 3 - cut the rubber tubing |
| Tape | NA | NA | Step 3 - tape the funnel holder together |
| Tubing clamps | Fisher | 5869 | Step 3 - part of the funnel |
| Worm pick | NA | NA | Step 6 - for isolating individual worms |
| Ziplock-style storage bags | NA | NA | Step 2 - to bag a substrate sample |
Références
- Frezal, L., Felix, M. A. C. elegans outside the Petri dish. Elife. 4, 05849(2015).
- Greene, J. S., et al. Balancing selection shapes density-dependent foraging behaviour. Nature. 539 (7628), 254-258 (2016).
- Reddy, K. C., et al. Antagonistic paralogs control a switch between growth and pathogen resistance in C. elegans. PLOS Pathogens. 15 (1), 1007528(2019).
- Schulenburg, H., Felix, M. A. The natural biotic environment of Caenorhabditis elegans. Genetics. 206 (1), 55-86 (2017).
- Zhang, F., et al. Caenorhabditis elegans as a model for microbiome research. Frontiers in Microbiology. 8, 485(2017).
- Andersen, E. C., et al. Chromosome-scale selective sweeps shape Caenorhabditis elegans genomic diversity. Nature Genetics. 44 (3), 285-290 (2012).
- Cook, D. E., Zdraljevic, S., Roberts, J. P., Andersen, E. C. CeNDR, the Caenorhabditis elegans natural diversity resource. Nucleic Acids Research. 45, 650-657 (2017).
- Crombie, T. A., et al. Deep sampling of Hawaiian Caenorhabditis elegans reveals high genetic diversity and admixture with global populations. Elife. 8, 50465(2019).
- Lee, D., et al. Balancing selection maintains hyper-divergent haplotypes in Caenorhabditis elegans. Nature Ecology & Evolution. 5 (6), 794-807 (2021).
- Rockman, M. V., Kruglyak, L. Recombinational landscape and population genomics of Caenorhabditis elegans. PLOS Genetics. 5 (3), 1000419(2009).
- Evans, K. S., van Wijk, M. H., McGrath, P. T., Andersen, E. C., Sterken, M. G. From QTL to gene: C. elegans facilitates discoveries of the genetic mechanisms underlying natural variation. Trends in Genetics. 37, 933-947 (2021).
- Gaertner, B. E., Phillips, P. C. Caenorhabditis elegans as a platform for molecular quantitative genetics and the systems biology of natural variation. Genetics Research (Cambridge Core). 92 (5-6), 331-348 (2010).
- Noble, L. M., Rockman, M. V., Teotonio, H. Gene-level quantitative trait mapping in Caenorhabditis elegans. G3 Genes|Genomes|Genetics. 11 (2), 061(2021).
- Van Bezooijen, J. Methods and techniques for nematology. , Wageningen University. (2006).
- Barrièrre, A., Félix, M. -A. Isolation of C. elegans. and related nematodes. Wormbook. , wormbook.1.115.2 (2014).
- Baermann, G. Eine einfache Methode zur Auffindung von Anklostomum (Nematoden) Larven in Erdproben. Geneeskundig tijdschrift voor Nederlandsch-Indië. 57, 131-137 (1917).
- Gray, N. F. Ecology of nematophagous fungi Panagrellus redivivus as the target organism. Plant and Soil. 297, 293-297 (1983).
- Mallez, S., Castagnone, C., Espada, M., Viera, P., Eisenback, J., Mota, M., Guillemaud, T., Castagnone-Sereno, P. First insights into the genetic diversity of the pinewood nematode in its native area using new polymorphic microsatellite loci. PLOS ONE. 8 (3), 4-11 (2013).
- Kerfahi, D., Tripathi, M. B., Porazinska, L. D., Park, J., Go, R., Adams, M. J. Do tropical rain forest soils have greater nematode diversity than High Arctic tundra? A metagenetic comparison of Malaysia and Svalbard. Global Ecology and Biogeography. 25, 716-728 (2016).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Di Bernardo, M., Crombie, T. A., Cook, D. E., Andersen, E. C. easyFulcrum: An R package to process and analyze ecological sampling data generated using the Fulcrum mobile application. PLOS ONE. 16, 0254293(2021).
- Lints, R., Hall, D. H. Handbook of C. elegans male anatomy. WormAtlas. , (2005).
- Kiontke, K., Félix, M. -A., Ailion, M., Rockman, M. V., Braendle, C., Pénigault, J. -B., Fitch, D. H. A phylogeny and molecular barcodes for Caenorhabditis, with numerous new species from rotting fruits. BMC Evolutionary Biology. 11, 339(2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon