Method Article
Baermann Huni tarafından Vahşi Nematodların Hızlı İzolasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, alandaki doğal substratlardan canlı nematodları verimli bir şekilde çıkarmak için bir yöntem özetler.
Özet
Caenorhabditis elegans ve yakınları, sağlam deneysel model organizmalar olmanın ötesinde, doğada yaşayan gerçek hayvanlardır. Vahşi nematodların doğal ortamlarında yapılan çalışmalar, ayırt edici genomik ve fenotipik karakterlerin evrimleştiği seçici rejimler, karmaşık özellik varyasyonunun genetik temeli ve tüm hayvan popülasyonları için temel olan doğal genetik çeşitlilik de dahil olmak üzere biyolojinin birçok yönünü anlamak için değerlidir. Bu makale, çürüyen meyveler, çiçekler, mantarlar, yaprak çöpü ve toprak dahil olmak üzere nematodları doğal substratlarından çıkarmak için basit ve verimli bir yöntemi açıklar. Klasik bir nematoloji tekniği olan Baermann huni yöntemi, aktif nematodları seçici olarak alt tabakalarından izole eder. Örnekten neredeyse tüm aktif solucanları kurtardığı için, Baermann huni tekniği, birden fazla üreme neslini içeren ekstraksiyon yöntemlerinde kaçırılabilecek bol ve hızlı büyüyen genotiplerle birlikte ortaya çıkan nadir ve yavaş büyüyen genotiplerin geri kazanılmasına izin verir. Teknik ayrıca metagenetik, popülasyon-genetik ve ekolojik soruları ele almak için de uygundur. Tüm popülasyonu aynı anda bir örnekte yakalar ve yaşların, cinsiyetlerin ve genotiplerin doğal dağılımının tarafsız bir görünümünü sağlar. Protokol, alanda uygun ölçekte dağıtıma izin verir, substratları hızla solucan plakalarına dönüştürür ve yazarlar bunu birden fazla kıtada saha çalışmasıyla doğrular.
Giriş
Laboratuvarda C. eleganları inceleyen araştırmacılar odaklarını vahşi doğada C. eleganlara ve ilgili rabditid nematodlara genişlettikçe değerli biyolojik içgörüler ortaya çıkıyor. Yabani nematodlar çalışmaları genleri ve genomları doğal bağlamlarına yerleştirir ve laboratuvar koşulları tarafından potansiyel olarak gizlenen işlevleri ortaya çıkarır1,2,3,4,5. Bu çalışmalar, evrimin kendisi için ön koşul olan genetik varyasyon6,7,8,9,10 hakkında içgörüler üretmektedir. Vahşi örnekler tarafından yakalanan doğal genetik varyasyon, birçok karmaşık özelliğin genetik temeline de yol açmaktadır11,12,13.
Nematodların doğal popülasyonlarının izolasyonu gerektiren çalışmalar tasarlarken, özellikle uzaktan saha çalışması yaparken pratik hususlar ön plana çıkar. Bu protokol, OP50'de kültürlenebilen aktif nematod popülasyonlarının tamamını yem veya vahşi substratlardan temiz bir şekilde izole etmeyi amaçlamaktadır. Yöntem, Caenorhabditis, Oscheius ve Pristionchus dahil olmak üzere serbest yaşayan rabditid ve diplogasterid nematodları çıkarmak için çok uygundur.
Nematodları alt tabakalarından izole etmek için birçok teknik vardır14,15. En temel yaklaşım, alt tabakayı doğrudan nematod-orta plakaya yerleştirmek ve hayvanları 8,15'e kadar sürünerek seçmektir. Amaç bir numuneden tüm nematodları izole etmekse, bu yöntem büyük miktarda zaman ve emek gerektirir. Daha karmaşık teknikler, hayvanların ağırlığından, boyutundan, hareketliliğinden veya bunların bir kombinasyonundan yararlanır14. Her yöntemin kurulum ve aktarım hızı açısından avantajları ve dezavantajları vardır. Ayrıca örnekleme önyargılarında farklılık gösterirler ve numunedeki hayvanlar yöntemin ayırma prensibinin ekseni boyunca değişirse belirli nematodları seçebilirler.
Baermann huni yöntemi ilk olarak 1917'de, parazitik kanca kurdu16 da dahil olmak üzere toprakta yaşayan nematodları incelerken cihazı Java'da icat eden Hollandalı Doktor G. K. T. F. Baermann tarafından tanımlanmıştır. Baermann hunisi hareketlilik prensibine göre çalışır. Substrat, bir bez veya kağıt filtre ile kaplı bir huni içine yerleştirilir (bu çalışma için mevcut protokolde "tüy bırakmayan silme" olarak adlandırılan bir "Kimwipe" kullanılır) ve altta kapatılır. Huni daha sonra su ile doldurulur ve filtre kapalı prizden ayırırken numuneyi batırır. Numunedeki aktif nematodlar kendilerini suya bırakır ve filtreden yüzerek huni tabanına yerleşir. Huni çıkışı açılır ve bir damla nematod bir tabağa atılır (Şekil 1).

Şekil 1: Baermann huni tekniğinin özeti. (A) İlgi çekici bir siteden bakteri bakımından zengin bir örnek toplamak. (B) Numuneyi bir Baermann hunisine batırmak ve solucanların kıvrılıp batmasını beklemek. (C) Huniden tek bir damla serbest bırakma. (D) Plakaları ayırmak için tek hermafroditleri veya çiftleşme dişilerini taşımak. Ramin Rahni tarafından oluşturulan illüstrasyon. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Baermann hunisi her türlü nematod için çalışmaz (belirli alternatifler için Tartışma bölümüne bakın) ve Caenorhabditis veya daha küçük14 boyut aralığında aktif formlar olanlar için en uygun olanıdır. Bununla birlikte, bir çalışma Baermann hunisini kullanabilirse, birçok avantajı vardır. Yöntem, sınırlı kurulum, uygulamalı zaman ve maliyet gerektiren alanda pratiktir. Araştırmacı, plakadaki substratın tıkanmasının olmadan temiz bir örnekle bırakılır, bu da toplamayı kolaylaştırır. Filtre kullanmak ayrıca plakanın, numunedeki nematodları çiğneyen veya avlayan böcek larvaları veya akarları tarafından kirlenmesini önler. En önemlisi, Baermann hunisi, çalışmanın tasarımına bağlı olarak gerekli olabilecek substrat14'ten neredeyse tüm popülasyonu verimli bir şekilde çıkarır. Örneğin, vahşi popülasyonların evresini veya cinsiyet dağılımını saymak, yavaş büyüyen veya nadir genotipler bulmak veya OP50'ye çekmeyen nematodları örneklemekle ilgilenen araştırmacılar bu yöntemden yararlanabilir. Bu, örnekleme şeması örnekleme zamanında popülasyonun bir anlık görüntüsünü aldığından ekolojik17, popülasyon genetiği18 veya metagenetik19 sorularını inceleyen araştırmacılar için uygundur.
Bu makale, Baermann hunisini kullanarak nematod popülasyonlarını izole etmek ve kolay taşıma için seçilen ekipmanları kullanarak alanda izofemale ve izohermafrodit çizgileri oluşturmak için eksiksiz bir protokol tanımlamaktadır. Laboratuvarlarının yakınında saha çalışması yürüten araştırmacılar için, bu adımların çoğu atlanabilir veya basitleştirilebilir.
Protokol
1. Tohumlu NGM plakalarının tarlada hazırlanması
- Seyahate çıkmadan önce, 23.005 g Nematod Growth Medium (NGM) (bkz. Malzeme Masası) tozu ağırlığında ve sızdırmaz bir plastik torbada ön paketleyin. İstenilen her medya litresi için bir torba yapın.
NOT: Seyahat öncesi ön paketleme, alanda işlevsel bir denge ihtiyacını atlar. - Seyahat etmeden önce, istenen her bir medya litresi için 1 mL 1M MgSO4, 1 mL 1M CaCl2 ve 25 mL 1M potasyum fosfat tamponu hazırlayın. 1 L potasyum fosfat tamponu yapmak için, WormBook20'de açıklandığı gibi 108,3 g KH2PO4 ve 35,6 g K2HPO4'ü suda çözün.
- Seyahate çıkmadan önce, WormBook20'de açıklandığı gibi LB'de 37 °C'de yetişen OP50'nin bir gecelik kültürünü yapın (bkz. Malzeme Tablosu). Aliquot kültürü 50 mL konik tüpler içine ve sızıntıyı önlemek için parafin filmi ile üstleri sarın.
- Alanda, NGM paketinin içeriğini 973 mL çift damıtılmış suya (ddH20) veya 1 L şişe veya şişede bulunan en saf, en steril suya çözün.
- Media şişesini veya şişeyi, gevşek bir kapak veya alüminyum folyo kapaklı, sıcak bir tabakta veya ocakta kaynar sıcak su banyosuna yerleştirin. Tüm toz çözülene ve temizlenene kadar ara sıra karıştırın (bu ~ 30 dakika sürer).
NOT: Manyetik bir sıcak plaka varsa, karıştırma çubuğu manuel karıştırma miktarını sınırlamak için mükemmel bir seçenektir. - Ortamı su banyosundan çıkarın ve ara sıra sallanarak veya bir karıştırma çubuğuyla ~58 °C'ye kadar soğutun. Ortam 58° C'ye soğutulduktan sonra, her adım arasında iyice karıştırarak 25 mL 1M potasyum fosfat tamponu, 1 mL 1M MgSO4 ve 1 mL 1M CaCl2 eklemek için serolojik veya standart pipetler kullanın.
- Mevcut en steril ortamda pipet veya ortamı istediğiniz boyuttaki plakalara dökün ve gece boyunca soğumaya ve katılaşmaya izin verin. Her substrat numunesi için bir adet 60 mm plaka (~10 mL) dökün. Her izofemale hattı için bir adet 35 mm plaka (~3,5 mL) dökün; ihtiyaç duyulan küçük plaka sayısını önceden tahmin etmek zordur.
- Pipet 50 μL OP50 kültürü her plakaya ve kullanmadan önce bir gecede kurumasını ve büyümesini sağlar.
2. Nematod substratlarının toplanması
- Alanda bakteri bakımından zengin bir substrat tanımlayın. Bazı örnekler çürüyen meyve, çiçekler, mantarlar ve otsu bitkilerin saplarını içerir. Toprak ve yaprak çöpleri de uygundur, ancak nadiren Caenorhabditis içerirler.
- Eldivenli bir elle, bu substratın (1-15 cm3) bir örneğini, benzersiz bir numune kimliği (Şekil 1A) ile etiketlenmiş kapatılabilir bir plastik torbaya (bkz. Malzeme Tablosu) yerleştirin.
- Ortam ve substrat sıcaklığı, toplanma zamanı, substratın durumu, substrat ilişkili makro omurgaların varlığı vb. dahil olmak üzere örnek kimliği, enlem, boylam, tarih, substratın açıklaması ve deneyle ilgili diğer yerel çevresel ölçümleri kaydedin. Bu işlemi kolaylaştırmak için bir akıllı telefon uygulaması mevcuttur21.
3. Bir dizi Baermann hunisinin hazırlanması
- Her huni için, bir lastik boru parçası kesmek için makas kullanın (bkz. Malzeme Tablosu) ~3 cm uzunluğunda.
- Boru segmentini plastik bir huni ucuna takın (bkz. Malzeme Tablosu). Uyum çok sıkı olduğu için bu biraz çaba gerekebilir.
- Bir boru kelepçesini kauçuk borunun üzerine kaydırın ve kapatın.
- Huni tutucu yapmak için, düz nakliye yönünden birlikte katlanmış olmayan bir karton sinek şişesi tepsisinin altındaki 35 mm çapındaki dairesel delikleri kesmek için bir neşter kullanın (bkz. Malzeme Tablosu). Standart bir tepsi, bu deliklerden 12'sinde 3 x 4 dizisinde yer alabilir.
- Kartonun ters çevrilmesi, yanları bir kez katlayın (sinek şişesi tepsisi yapmak için iki kez değil) ve ters karton tepsiyi yükseltmek için yanları birbirine bantlayın (Şekil 2).
- Önce boru kelepçelerinin kapalı konumda olduğundan emin olarak deliklere huniler yerleştirin.

Şekil 2: Her biri 12 Baermann hunisini desteklemek için katlanmış ve kesilmiş yeniden tasarlanmış karton sinek şişesi tepsileri. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
4. Numunelerin hunilere aktarılması
- Her huniye su dökün (mevcut olduğu kadar steril) ve jantın yaklaşık 3 cm altına doldurun. Hava kabarcıkları boruya sıkışmışsa, serbest bırakmak için huniye dokunun.
- Eldivenli ellerle, huninin üzerine tüy bırakmayan bir mendil veya özellikle bir Kimwipe (kare yapmak için ikiye katlanmış) yerleştirin ve suya batırılması için ortaya bastırın.
- Solucanların substrattan düşmek için kat etmesi gereken mesafeyi en aza indirmek için büyük katı doğal yüzey parçalarını (meyve, çiçek, toprak, yaprak çöpü vb.) daha küçük parçalara manuel olarak kırın.
NOT: Yaprak çöpü ve garip şekilli numuneler bir mutfak robotunda veya karıştırıcıda ön işlenebilir. - Doğal substratın (1-15 cm3) bir örneğini, dokuyu delmeden ve numune jantın üzerinde çıkıntı yapmadan bir hunideki doku / tüy bırakmayan mendilin üzerine hafifçe yerleştirin.
- Huniyi veya huninin yanındaki kartonyu, alan koleksiyonu notlarına karşılık gelen örnek kimlikle etiketle.
- Doku/tüy bırakmayan mendilin köşelerini numunenin üzerine katlayın (Şekil 1B). Doku/tüy bırakmayan mendilin içinde bulunan numuneyi tutmaya dikkat edin, böylece huni dibine toprak veya döküntü geçemez.
NOT: Bu adım, köşelerin huni kenarından sarkmasını önlemektir, burada huniden gelen suyu yanlara fitillerler. - Eller, bir spatula veya pipet ucu ile, huniden huniye, çapraz kirletici örneklere seyahat edebilecek aktif böcekleri, kırkayakları veya diğer hayvanları seçin. Doku/tüy bırakmayan silme işlemini tamamen numunenin etrafına sarın veya çapraz kontaminasyonu önlemek için numunenin üstüne ikinci bir doku yerleştirin.
- Tüm numunenin suya batırması için hunilere daha fazla su ekleyin (Şekil 3).

Şekil 3: Birleştirilmiş Baermann hunileri. Her örnek doku/ tüy bırakmayan mendile sarılır ve kıskaçlı hunideki suyun altına batırılır. ~12 saat boyunca, nematodlar dokudan ve huni altına göç edecektir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
5. Hunilerden nematodların çıkarılması
- ~12 saat veya gece boyunca bekleyin. Bu süre zarfında, aktif solucanlar alt tabakadan, doku / tüy bırakmayan silme yoluyla ve kenetlenmiş hunilerin altına doğru kıvrılır.
NOT: 12 saatten çok daha uzun süre beklemek hipoksi veya patojenik enfeksiyon nedeniyle solucan mortalitesi riski altındadır, bu da özellikle solucan ve bakterilerle dolu örnekler için daha kısa sürelerde bir risk olabilir. - OP50 E. coli bakterisi ile tohumlanmış 60 mm NGM solucan plakasının altına bir huni örneklemini yazın. Kapağı plakadan çıkarın.
- Bu örneği içeren huniyi huni standından çıkarın. Huniyi açık solucan plakasının üzerinde dik tutmak için bir elinizin kullanılması, diğer elinizin boru kelepçesine basınç salarak bir damla suyun tüpten solucan plakasına düşmesine izin vermesi (Şekil 1C). Huniden su düşer düşmez, NGM plakasının taşmasını önlemek için hızlı bir şekilde tekrar kapatın.
NOT: Caenorhabditis türleri de dahil olmak üzere OP50'ye çekilen solucanları seçmek için, damlayı bakteri çimlerinden uzaklaştırın. Su tabağa batırıldığında veya buharlaştığında, Caenorhabditis nematodları bakteri çimlerine sürünür. - Temizleme: Hunilerin içeriğini atın. Hunileri daha sonra tekrar kullanmak için sıcak suyla yıkayın.
6. Kültürlerin oluşturulması
- Stereomikroskop altındaki izole nematodları 5x-50x büyütmede gözlemleyin. Plakalar nematodlar ve çok daha düşük frekanslarda, küçük oligochaete annelidler, tardigradlar, rotiferler ve küçük kabuklular içermelidir (Şekil 4).
NOT: Huni doğru şekilde ayarlanmışsa, hiçbir akar, böcek veya görünür canlı olmayan malzeme huniden geçememiş olacaktır.
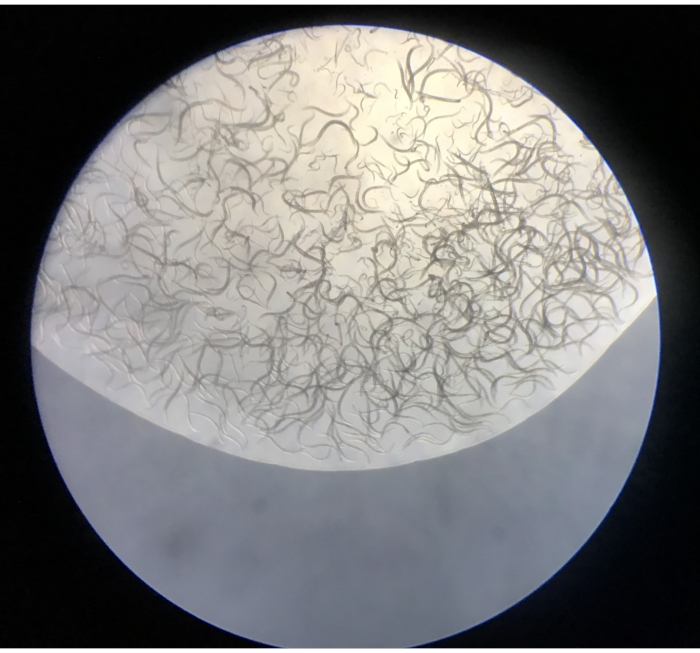
Şekil 4: Bir Baermann hunisinden bir NGM plakasına salınan ilk damlacığın içeriği. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
- İzohermafhrodite veya izofemale çizgileri oluşturmak için, her L4 hermafrodit veya çiftleştirilmiş yetişkin dişiyi (daha büyük vücut boyutları ve belirgin erkek kuyruğunun eksikliği22 ile tanınabilir) OP50 ile tohumlanmış ayrı bir 35 mm NGM plakasına aktarmak için bir solucan seçimi kullanın (Şekil 1D). Solucanları aktarmadan önce ve sonra solucan çekmesini sterilize etmek için bir çakmak kullanın.
- Seyahat için plakaları iyice sarmak için parafin filmi kullanın.
Sonuçlar
Bu protokol, Ağustos 2018'de Smithsonian Tropikal Araştırma Enstitüsü saha istasyonunda Barro Colorado Adası, Panamá'daki meyve, çiçek, mantar, toprak ve saplardan nematodları izole etmek için kullanıldı. Dört gün boyunca tek bir araştırmacı tarafından işlenen 131 substratın 130'u (%99,2) nematod verdi. Substratların kırk dördü (%33.6) Caenorhabditis nematodları verdi (Şekil 5). Bu kırk dört substrattan kurulan kültürlerin PCR ve çiftleşme testleri23 ile yapılan sonraki analizi, altı farklı Caenorhabditis türünün varlığını ortaya koydu - C. becei, C. tropicalis, C. briggsae, C. sp. 24, C. sp. 57 ve C. panamensis.
Bu protokol, Ağustos 2019'da dört gün boyunca Ukrayna'nın Çernobil Dışlama Bölgesi'ndeki çeşitli substratlardan nematodları izole etmek için tekrar kullanıldı. 63 toprak örneğinden 62'sinden, 17 omurgasız numuneden 1'inden, 75 meyve örneğinden 31'inden, 12 yem örneğinden 1'inden (bkz. Tartışma bölümünde) canlı solucanlar ele geçirildi ve mantar, nehir sazlığı veya kurt dışkısı örneklerinden (her birinden bir örnek toplandı) solucan ele geçirilmedi. Daha sonra 18S ribozomal DNA15'in dizilimi bu nematodları Oscheius, Panagrolaimus, Acrobeloides, Mesorhabditis, Panagrellus, Pristionchus ve Pelodera olarak tanımladı, ancak hiçbir Caenorhabditis tanımlanmamıştır (Şekil 5).
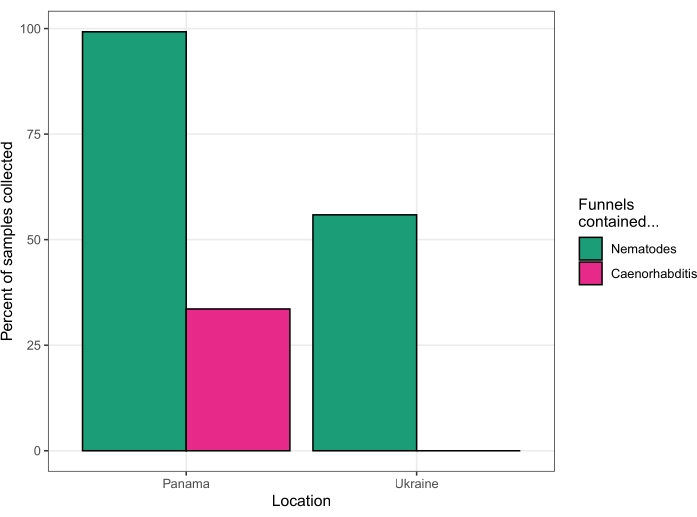
Şekil 5: İki tahsilat gezisinin başarı oranları. 2018'de Panama (solda) ve 2019'da Ukrayna (sağda). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Bu yöntemin temel prensibi, nematodların suya batırılmış dokudan geçeceği, substratlarının ve daha büyük omurgasız kirleticilerinin geçmeyeceğidir. Protokolün kritik adımları şunlardır: (1) uygun bir substratın toplanması, (2) bir filtreleme malzemesine sarılmış, suya batırılmış, (3) filtreden geçmiş ve suyun dibine batırılmış solucanları toplamak ve (4) tek tek solucanları izofemale veya izohermaphrodite çizgileri oluşturmak için izole etmektir. Yöntemin diğer tüm bölümleri, mevcut kaynaklara, substratların doğasına veya saha çalışması hedeflerine göre gerektiği şekilde değiştirilmeye hazırdır. Dikkate değer bazı değişiklikler aşağıdaki gibidir.
Meyve ekerek solucanları yemleme
Tarla alanında bulunacak çok miktarda bakteri bakımından zengin çürüyen malzeme yoksa, çürümeye bırakmak için bir elma veya domates parçası gibi bir örnek getirmek isteyebilirsiniz. Yemi birkaç kazıkla iyice sabitlayın, böylece daha büyük hayvanlar onları çıkarmaz ve böylece daha sonra toplama için kolayca bulunabilir. Yemin çürümeden önce kuruyabileceği doğrudan güneş ışığından kaçının.
Mevcut malzemelerden huni aparatı yapımı
Boru kelepçesini barındıracak kadar büyük ve üst-ağır bir huniyi destekleyecek kadar kararlı deliklere sahip herhangi bir yapı çalışacaktır. Tek bir huni için, bir içme bardağı uygun bir tutucudur. Yüz dokusu, tuvalet kağıdı veya kağıt havlu gibi her türlü doku kullanılabilir.
Hipoksi veya enfeksiyonu önlemek için hunilere daha az malzeme koymak veya bekleme süresini ayarlamak
Örnek çok yüksek bir solucan veya bakteri konsantrasyonuna sahipse, nematodlar 12 saat inkübasyon tamamlanmadan hipoksi veya enfeksiyondan ölmeye başlayabilir. Bu bir endişe ise, araştırmacı hunileri daha erken kontrol edebilir veya yüksek nüfuslu alt tabakanın çok küçük bir alt örneklemiyle ek bir huni hazırlayabilir.
NGM plaka hazırlamanın deneysel ihtiyaçlara ve kısıtlamalara göre ayarlanması
NGM tabakları deneye uygun medya ve besin kaynağı ne olursa olsun hazırlanabilir. Yukarıda açıklanan alan protokolü bagaj ağırlığını en aza indirmek için tasarlanmıştır. Bagaj sınırlamalarına ve saha çalışması zamanlamasına bağlı olarak, sahaya plaka dökmek yerine laboratuvarda hazırlanmış veya ticari olarak satın alınmış zaten dökülmüş NGM plakaları getirmek tercih edilebilir.
Huni izolasyonlarının laboratuvarda gerçekleştirilmesi
Protokol, nematod popülasyonunun doğada meydana geldiği gibi yakalanması için saha koşullarında prosedürün tamamının gerçekleştirilmesi açıklanmaktadır. Bazı araştırma hedefleri için, nematodları daha sonra, kapalı torbalardaki örneklerle laboratuvara geri döndükten sonra izole etmek yeterli olabilir. O zaman bile, Baermann huni yöntemi, hayatta kalan nematodların diğer izolasyon yöntemlerinden daha temiz ve eksiksiz bir örneğini sağlar. Bununla birlikte, sızdırmaz torbalardaki numuneler, potansiyel aşırı sıcaklık ve hipoksiye maruz kaldıkları için seyahat sırasında seçim yaşayabilir. Bu, numune toplama işleminden sonra mümkün olan en kısa sürede izolasyonlar yapılarak en aza indirilebilir.
Baermann hunisine yaygın bir alternatif yöntem, substratı doğrudan bir NGM plakasına yerleştirmeyi ve solucanların sürünerek çıkmasını beklemeyi içerir, bu da son derece emek yoğundur veya popülasyonun eksik toplanmasıyla sonuçlanır. Ayrıca akarlar ve böcek larvaları ile kontamine olmuş plakalar verir. Baermann huni yöntemi, tüm aktif solucan popülasyonlarını alt tabakalarından hızlı bir şekilde ayırmak için düşük maliyetli, düşük teknolojili, düşük işçilikli bir stratejidir.
Baermann huni yöntemi, her türlü yabani nematodu toplamak için evrensel olarak geçerli değildir. Bazı bitki yaşayan nematodların alt tabakalarından çıkması 12 saatten çok daha uzun sürer ve çok erken salınan bir damlacıkta bulunmazken, bazı böcek parazitleri alttan ziyade huni tepesine sürünerek koleksiyondan da kaçar14. Baermann hunisine alternatifler solucanları kurtarmak için daha özel ekipman veya daha fazla emek gerektirir. Ancak, yukarıdaki uyarılar deney için bir sorunsa, yine de tercih edilebilirler. Van Bezooijen14 tarafından incelenen alternatif seçenekler arasında hunilere sürekli bir su buğusu sağlayan, oksijen ekleyen ve süspansiyondaki bakterilerin taşmasına izin veren huni spreyi yöntemi yer alıyor. Bu, bitkilerden nematodların daha uzun bir ekstraksiyon süresine izin verir. Blender santrifüj yüzdürme yöntemi yavaş hareket etmeyi geri kazandırır, aktif olmayan veya yukarı doğru sürünen nematodları özgül ağırlıklarına göre ayırarak, Oostenbrink elutriator çökeltme tortularını askıya alınmış nematodlardan ayırmak için bir aksaklık uygular ve Cobb's Method, nematodları boyutlarına, şekillerine ve tortulaşma oranlarına göre izole etmek için bir dizi elek kullanır14. Yine de rabditidleri toplamak için, Baermann hunisi etkili bir şekilde hızlı ve minimum çabayla temiz numuneler üretir.
Açıklamalar
Yazarlar çıkar çatışması olmadığını beyan eder.
Teşekkürler
Bu çalışma NIH hibe R35GM141906 ve R21ES031364 ve Damon Runyon Bursu DRG-2371-19 tarafından desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 L glass bottle | NA | NA | Step 1 - vessel for making plate media |
| 1 mL pipette tips | any | NA | Step 1 - dispense worm media additives and seed plates |
| 1 mL pipetter | any | NA | Step 1 - dispense worm media additives and seed plates |
| 35 mm worm plates | Tritech | T3500 | Step 1 - worm plates |
| 4mm ID rubber tubing | Fisher | 14178A | Step 3 - part of the funnel |
| 60 mm worm plates | Greiner | 628161 | Step 1 - worm plates |
| 65 mm Funnel | Fisher | 22170156 | Step 3 - part of the funnel |
| Calcium chloride | Fisher | C79-500 | Step 1 - worm plate medium |
| Cooking pot | NA | NA | Step 1 - a water bath for melting the agar to pour plates |
| E. coli strain OP50 | Caenorhabditis Genetics Center | OP50 | Step 1 - worm food |
| Field microscope | OMAX | G223CS | Step 6 - for viewing worms in the field |
| Fly vial storage tray | Azer Scientific | ES-260T | Step 3 - to build a platform to hold 12 funnels |
| Hot plate or stove | NA | NA | Step 1 - to heat the water bath |
| Kimwipes | KimberlyClark | 34120 | Step 4 - filter for the funnels |
| LB media | Gibco | 10855021 | Step 1 - for growing OP50 |
| Lighter | NA | NA | Step 6 - sterilize the worm pick |
| Magnesium sulfate | Fisher | M63-500 | Step 1 - worm plate medium |
| NGM-lite agar | USBiological | N1000 | Step 1 - worm plate medium |
| Parafilm M wrapping film | Fisher | 13-374-10 | Step 6 - pack worm plates for travel |
| Potassium phosphate dibasic | Fisher | BP363-500 | Step 1 - worm plate medium |
| Potassium phosphate monobasic | Fisher | P285-3 | Step 1 - worm plate medium |
| scalpel | NA | NA | Step 3 - cut holes for the funnels |
| scissors | NA | NA | Step 3 - cut the rubber tubing |
| Tape | NA | NA | Step 3 - tape the funnel holder together |
| Tubing clamps | Fisher | 5869 | Step 3 - part of the funnel |
| Worm pick | NA | NA | Step 6 - for isolating individual worms |
| Ziplock-style storage bags | NA | NA | Step 2 - to bag a substrate sample |
Referanslar
- Frezal, L., Felix, M. A. C. elegans outside the Petri dish. Elife. 4, 05849(2015).
- Greene, J. S., et al. Balancing selection shapes density-dependent foraging behaviour. Nature. 539 (7628), 254-258 (2016).
- Reddy, K. C., et al. Antagonistic paralogs control a switch between growth and pathogen resistance in C. elegans. PLOS Pathogens. 15 (1), 1007528(2019).
- Schulenburg, H., Felix, M. A. The natural biotic environment of Caenorhabditis elegans. Genetics. 206 (1), 55-86 (2017).
- Zhang, F., et al. Caenorhabditis elegans as a model for microbiome research. Frontiers in Microbiology. 8, 485(2017).
- Andersen, E. C., et al. Chromosome-scale selective sweeps shape Caenorhabditis elegans genomic diversity. Nature Genetics. 44 (3), 285-290 (2012).
- Cook, D. E., Zdraljevic, S., Roberts, J. P., Andersen, E. C. CeNDR, the Caenorhabditis elegans natural diversity resource. Nucleic Acids Research. 45, 650-657 (2017).
- Crombie, T. A., et al. Deep sampling of Hawaiian Caenorhabditis elegans reveals high genetic diversity and admixture with global populations. Elife. 8, 50465(2019).
- Lee, D., et al. Balancing selection maintains hyper-divergent haplotypes in Caenorhabditis elegans. Nature Ecology & Evolution. 5 (6), 794-807 (2021).
- Rockman, M. V., Kruglyak, L. Recombinational landscape and population genomics of Caenorhabditis elegans. PLOS Genetics. 5 (3), 1000419(2009).
- Evans, K. S., van Wijk, M. H., McGrath, P. T., Andersen, E. C., Sterken, M. G. From QTL to gene: C. elegans facilitates discoveries of the genetic mechanisms underlying natural variation. Trends in Genetics. 37, 933-947 (2021).
- Gaertner, B. E., Phillips, P. C. Caenorhabditis elegans as a platform for molecular quantitative genetics and the systems biology of natural variation. Genetics Research (Cambridge Core). 92 (5-6), 331-348 (2010).
- Noble, L. M., Rockman, M. V., Teotonio, H. Gene-level quantitative trait mapping in Caenorhabditis elegans. G3 Genes|Genomes|Genetics. 11 (2), 061(2021).
- Van Bezooijen, J. Methods and techniques for nematology. , Wageningen University. (2006).
- Barrièrre, A., Félix, M. -A. Isolation of C. elegans. and related nematodes. Wormbook. , wormbook.1.115.2 (2014).
- Baermann, G. Eine einfache Methode zur Auffindung von Anklostomum (Nematoden) Larven in Erdproben. Geneeskundig tijdschrift voor Nederlandsch-Indië. 57, 131-137 (1917).
- Gray, N. F. Ecology of nematophagous fungi Panagrellus redivivus as the target organism. Plant and Soil. 297, 293-297 (1983).
- Mallez, S., Castagnone, C., Espada, M., Viera, P., Eisenback, J., Mota, M., Guillemaud, T., Castagnone-Sereno, P. First insights into the genetic diversity of the pinewood nematode in its native area using new polymorphic microsatellite loci. PLOS ONE. 8 (3), 4-11 (2013).
- Kerfahi, D., Tripathi, M. B., Porazinska, L. D., Park, J., Go, R., Adams, M. J. Do tropical rain forest soils have greater nematode diversity than High Arctic tundra? A metagenetic comparison of Malaysia and Svalbard. Global Ecology and Biogeography. 25, 716-728 (2016).
- Stiernagle, T. Maintenance of C. elegans. WormBook. , 1-11 (2006).
- Di Bernardo, M., Crombie, T. A., Cook, D. E., Andersen, E. C. easyFulcrum: An R package to process and analyze ecological sampling data generated using the Fulcrum mobile application. PLOS ONE. 16, 0254293(2021).
- Lints, R., Hall, D. H. Handbook of C. elegans male anatomy. WormAtlas. , (2005).
- Kiontke, K., Félix, M. -A., Ailion, M., Rockman, M. V., Braendle, C., Pénigault, J. -B., Fitch, D. H. A phylogeny and molecular barcodes for Caenorhabditis, with numerous new species from rotting fruits. BMC Evolutionary Biology. 11, 339(2011).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır