Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Construcción de microelectrodos de potencial de campo local para grabaciones in vivo de múltiples estructuras cerebrales simultáneamente
En este artículo
Resumen
El presente protocolo describe la construcción de matrices de microelectrodos hechas a medida para registrar potenciales de campo locales in vivo de múltiples estructuras cerebrales simultáneamente.
Resumen
Los investigadores a menudo necesitan registrar potenciales de campo locales (LFP) simultáneamente de varias estructuras cerebrales. La grabación desde múltiples regiones cerebrales deseadas requiere diferentes diseños de microelectrodos, pero las matrices de microelectrodos disponibles comercialmente a menudo no ofrecen tal flexibilidad. Aquí, el presente protocolo describe el diseño sencillo de matrices de microelectrodos hechas a medida para registrar LFP de múltiples estructuras cerebrales simultáneamente a diferentes profundidades. Este trabajo describe la construcción de los microelectrodos bilaterales corticales, estriatales, talámicos ventrolaterales y nigrales como ejemplo. El principio de diseño esbozado ofrece flexibilidad, y los microelectrodos se pueden modificar y personalizar para registrar LFP de cualquier estructura calculando coordenadas estereotáxicas y cambiando rápidamente la construcción en consecuencia para apuntar a diferentes regiones del cerebro en ratones que se mueven libremente o anestesiados. El ensamblaje de microelectrodos requiere herramientas y suministros estándar. Estas matrices de microelectrodos personalizadas permiten a los investigadores diseñar fácilmente matrices de microelectrodos en cualquier configuración para rastrear la actividad neuronal, proporcionando grabaciones LFP con resolución de milisegundos.
Introducción
Los potenciales de campo local (LFP) son los potenciales eléctricos registrados desde el espacio extracelular en el cerebro. Se generan por desequilibrios de concentración de iones fuera de las neuronas y representan la actividad de una pequeña población localizada de neuronas, lo que permite monitorear con precisión la actividad de una región específica del cerebro en comparación con los registros de EEG a macroescala1. Como estimación, los microelectrodos LFP separados por 1 mm corresponden a dos poblaciones de neuronas completamente diferentes. Mientras que la señal de EEG se filtra por el tejido cerebral, el líquido cefalorraquídeo, el cráneo, el músculo y la piel, la señal de LFP es un marcador confiable de la actividad neuronal local1.
Los investigadores a menudo necesitan registrar simultáneamente LFP de varias estructuras cerebrales, pero las matrices de microelectrodos disponibles comercialmente a menudo no ofrecen tal flexibilidad. Aquí, el presente protocolo describe microelectrodos totalmente personalizables y fáciles de construir para registrar simultáneamente LFP de cualquier región del cerebro deseada a diferentes profundidades. Aunque los LFP se han utilizado ampliamente para registrar la actividad neuronal de una región cerebral específica 2,3,4,5,6,7,8,9, el diseño actual fácilmente personalizable permite registrar LFP desde cualquier región cerebral superficial o profunda múltiple 11,12 . El protocolo también se puede modificar para construir cualquier matriz de microelectrodos deseada mediante la determinación de coordenadas estereotáxicas de las regiones cerebrales y el ensamblaje de la matriz en consecuencia. Estos microelectrodos con una frecuencia de muestreo de 10 kHz y una resistencia de 60-70 kΩ (longitud de 2 cm) nos permiten registrar LFP con precisión de milisegundos. Los datos pueden ser amplificados por un amplificador de 16 canales, filtrados (paso bajo 1 Hz, paso alto 5 kHz) y digitalizados.
Protocolo
El presente trabajo está aprobado por el Comité de Cuidado y Uso de Animales de la Universidad de Virginia. Se utilizaron ratones C57Bl/ 6 de ambos sexos (7-12 semanas) para los experimentos. Los animales se mantuvieron en un ciclo de luz de 12 h / 12 h de oscuridad y tuvieron acceso ad libitum a alimentos y agua.
1. Construcción de microelectrodos
- Para construir los microelectrodos, utilice alambre de níquel-cromo recubierto de diamel de 50 μm (diámetro) (ver Tabla de Materiales). Coloque cinta adhesiva en un extremo del cable en la parte posterior de la plataforma y envuelva el cable tres veces alrededor de la perilla más cercana en la plataforma (Figura 1A, C).
NOTA: Aquí se utilizó una plataforma acrílica con dos perillas (2 x 5 pulgadas), pero se puede usar cualquier plataforma.- Estira el cable alrededor de la segunda perilla más lejana para hacer dos bucles entre las perillas. Envuelva el cable tres veces más alrededor de la primera perilla para fijar el cable en su lugar y vuelva a pegar el extremo en la parte posterior de la plataforma.
NOTA: Después de separar los cables (pasos 1.2-1.3.1), debe haber dos cables en cada lado (cuatro cables en total, Figura 1B).
- Estira el cable alrededor de la segunda perilla más lejana para hacer dos bucles entre las perillas. Envuelva el cable tres veces más alrededor de la primera perilla para fijar el cable en su lugar y vuelva a pegar el extremo en la parte posterior de la plataforma.
- Coloque las barras de tensión debajo de los cables con la cinta envuelta alrededor de ellos (lado pegajoso hacia arriba) (Figura 1C).
NOTA: Se utilizaron piezas de acrílico triangular para las barras de tensión, con cinta envuelta alrededor de ellas (lado pegajoso en el exterior para unir los cables). El lado pegajoso de la cinta fuera de las barras de tensión mantendrá los cables en su lugar para ajustar la distancia entre ellos. Las barras de tensión deben estar a ~ 2,5 cm de distancia de las perillas, y los cables no deben estar sueltos. - Usando un microscopio y pinzas finas, haga un espacio de 3 mm o 4.5 mm entre los cables (espacio de 3 mm entre los cables para hacer microelectrodos corticales (Ctx) - núcleo talámico ventrolateral (VL); espacio de 4.5 mm para hacer microelectrodos estriatales (Str) - nigral (SNR)) (Figura 1B).
- Si se utiliza la ampliación en el microscopio, asegúrese de calcular y ajustar la diferencia de aumento y la distancia real entre los cables.
NOTA: Si los microelectrodos se construyen para estructuras distintas de las utilizadas aquí, la distancia entre los cables debe ajustarse a la distancia estereotáxica entre las estructuras. La Figura 2B proporciona un ejemplo de cómo se organizarán los cables; en consecuencia, deben ajustarse las coordenadas estereotáxicas de otras estructuras.
- Si se utiliza la ampliación en el microscopio, asegúrese de calcular y ajustar la diferencia de aumento y la distancia real entre los cables.
- Corte cuatro trozos pequeños de plástico (0,5 mm de grosor) ~ 6 mm (ancho) x 3 mm (alto) (Figura 1C).
NOTA: Cualquier pieza de plástico se puede utilizar siempre que tenga un grosor de 0,5 mm; aquí, se utilizó un tubo cuadrado en el que se vendían los pines (Pines, ver Tabla de Materiales). Si se utiliza un grosor diferente, agregue más o menos piezas de plástico para que se ajusten a las coordenadas estereotáxicas requeridas. - Aplique pegamento (ver Tabla de Materiales) sobre el plástico y colóquelos en los cables (Figura 1C). Coloque las piezas de plástico ~ 1.0 cm de distancia de la mitad del cable, que está a 1.0 cm de distancia de la barra de tensión. Retire el exceso de superpegamento con un hisopo de algodón.
- Después de que el superpegamento se seque, corte los cables con tijeras finas, en el orden indicado en la Figura 1C.
- Corte cuatro tubos de vidrio de 7 mm utilizando un kit disponible comercialmente (consulte la Tabla de materiales) e inserte los cables de los electrodos en los tubos de vidrio como se indica en la Figura 2A.
- Inserte pares de electrodos VL y SNR en los tubos de vidrio.
NOTA: Solo los cables para estructuras profundas deben insertarse en los tubos de vidrio para apoyar la implantación quirúrgica. Asegúrese de no insertar electrodos corticales en el tubo de vidrio.
- Inserte pares de electrodos VL y SNR en los tubos de vidrio.
- Coloque el pegamento en la base de los tubos de vidrio para conectarlos al plástico. Espere un tiempo hasta que el pegamento se seque.
- Cortar los tubos y alambres de vidrio con un bisturí como se indica en la Tabla 1; asegúrese de que las longitudes de los microelectrodos son correctas. Si los microelectrodos se dirigen a diferentes estructuras, ajuste la distancia de corte de acuerdo con las coordenadas estereotáxicas requeridas.
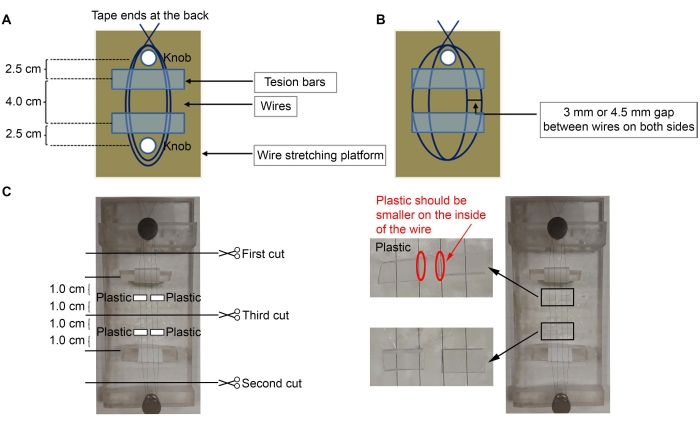
Figura 1: Esquema de la construcción del microelectrodo. (A) Instalación de cables en la plataforma con barras de tensión debajo de los cables. (B) El espacio entre los cables. (C) Cuatro piezas de plástico están pegadas a los cables. Haga clic aquí para ver una versión más grande de esta figura.
| Ctx | Str | VL | SNR | |
| AP (Anterior/Posterior) | 2.2 | 1.2 | -1.3 | -3.3 |
| ML (Medial/Lateral) | 1.8 | 1.5 | 1 | 1.5 |
| DV (Dorsal/Ventral) | 0.5 | 3.5 | 4 | 4.75 |
| Longitud del electrodo | 4 | 4.75 | 5.25 | 6 |
Tabla 1: Coordenadas de implantación estereotáxica y dimensiones de los microelectrodos.
2. Ensamblaje de matriz de microelectrodos
- Use el pegamento para colocar plásticos en el orden deseado de las regiones objetivo. Un ejemplo de electrodos corticales, talámicos, estriatales y nigrales se muestra en la Figura 2B,C.
- Coloque el par de electrodos Ctx-VL boca abajo (el lado con los cables del electrodo tiene que estar boca abajo) y conecte dos piezas vacías de plástico de 6 mm x 3 mm en la parte superior con pegamento.
- Encima de las tres piezas de plástico, coloque el segundo par de electrodos Ctx-VL con los electrodos mirando hacia arriba (use un microscopio y asegúrese de que los electrodos VL estén alineados).
NOTA: La alineación de los electrodos bilaterales (aquí, la alineación de los electrodos VL izquierdo y derecho) es esencial para apuntar adecuadamente a las estructuras bilaterales deseadas. - Use el pegamento para unir los electrodos SNR en la parte superior con los electrodos SNR a 2,0 mm de distancia de los electrodos VL y ~ 5,0 mm de distancia de los electrodos corticales (los cables de los electrodos SNR tienen que mirar hacia arriba).
- Repita el paso 2.1.3. para el otro lado (los cables de electrodos SNR tienen que enfrentarse fuera de la matriz de microelectrodos).
- Aplique resina epoxi alrededor del plástico para unir los electrodos. Evite poner resina epoxi en los electrodos.
- Tome un alambre grueso y haga un bucle en un extremo. Sumerja el lazo en la solución epoxi y colóquelo sobre el plástico, asegurándose de que el alambre grueso quede plano (Figura 2D) para que para los próximos pasos, este cable pueda usarse como mango. Espere hasta que los electrodos estén completamente secos.
- Corte los cables a 2 cm, como se muestra en la Figura 2E.
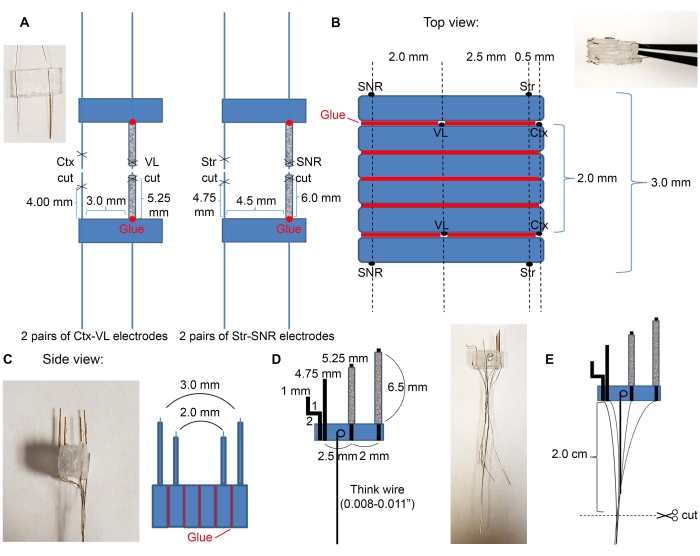
Figura 2: Construcción y dimensiones de microelectrodos. (A) Cuatro pares de electrodos formados después de que los cables fueron cortados con tijeras, como se indica en la Figura 1C (2 pares de electrodos Ctx-VL y 2 pares de electrodos Str-SNR). Inserte electrodos de estructura profunda (VL y SNR) en los tubos de vidrio y pegue sus bases al plástico (puntos rojos). (B) Vista superior: Los pares de electrodos de (A) se pegan en una pila para crear el núcleo de microelectrodo. Las líneas rojas indican líneas de pegamento. (C) Vista frontal lateral de (B). (D) El alambre grueso estaba unido a los microelectrodos. (E) Los cables se agrupan como se indica, y los extremos aislados se raspan y se cortan en 2 cm. Haga clic aquí para ver una versión más grande de esta figura.
3. Conexión de microelectrodo a los auriculares
- Agrupe los cables como se indica en la Figura 2E y raspe 1 mm de los extremos aislados con un bisturí.
- Doble los electrodos corticales como se muestra en la Figura 3A. Separe los cables como se muestra en la Figura 3B. Usando pinzas finas, haga un bucle al final de cada cable (Figura 3B).
- Sostenga un auricular de 10 pines con un hemostático (consulte la Tabla de materiales) y use el extremo de madera de un hisopo de algodón para aplicar cantidades mínimas de flujo en los pines (Figura 3C). Asegúrese de no colocar fundente fuera de los pines para evitar cortocircuitos entre los pines.
- Usando el extremo de madera de un hisopo de algodón, aplique fundente a los bucles de alambre.
- Suelde los bucles de cable a los auriculares de 10 pines como se muestra en la Figura 3C. Después de soldar, seque el auricular para evitar cortocircuitos entre los pines.
- Tome un cable delgado (0.005-0.008 pulgadas) para la referencia y conecte a tierra los cables y retire el plástico de un extremo. Haga un bucle en el otro extremo del cable.
- Suelde el lado pelado de la referencia y conecte a tierra los cables a sus respectivos pines (Figura 3A, C).
- Sosteniendo el alambre grueso (Figura 2D), aplique cemento de craneoplastia alrededor de los microelectrodos, especialmente donde los cables se conectan a los pines. Evite tocar los extremos reales del electrodo con el cemento.
- Después de que el cemento se seque, coloque resina epoxi en la base de los tubos de vidrio, los cables de microelectrodos estriatales y todo el electrodo. Evite tocar los extremos reales del electrodo con resina epoxi. Espere hasta que los electrodos estén completamente secos.
- Los electrodos están listos. Perfore agujeros en el cráneo del ratón (según las coordenadas estereotáxicas requeridas) utilizando un taladro dental e implante el auricular como se muestra en la Figura 3D bajando el auricular con microelectrodos mirando hacia el cráneo y los orificios apropiados. El auricular se puede conectar al brazo estereotáxico para su apoyo durante la implantación.
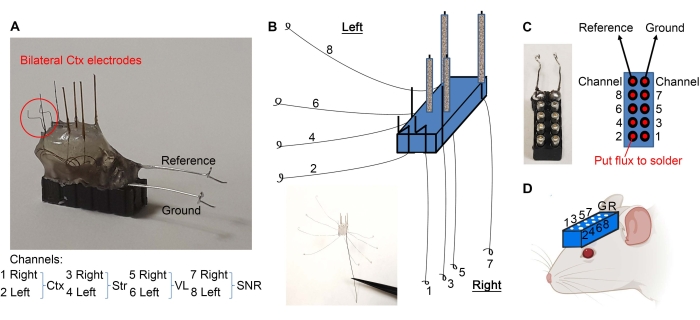
Figura 3: Implantación de microelectrodos. (A) Los electrodos corticales se doblan como se indica. (B) Los cables están separados para hacer bucles en los extremos. (C) El flujo (en los puntos rojos) y los cables en bucle se sueldan a los auriculares de 10 pines, lo que garantiza que cada cable vaya a su pin apropiado. (D) El auricular se implanta para grabar LFP. Haga clic aquí para ver una versión más grande de esta figura.
4. Marcar la ubicación del electrodo después de las grabaciones
- Al final de las grabaciones de LFP, confirme la posición correcta de los electrodos en la región objetivo aplicando una corriente en las puntas de los electrodos para hacer una lesión y esperando 30 minutos antes de perfundir el ratón.
NOTA: Ajustes de la lesión para confirmar la ubicación de las puntas de los electrodos: Ráfaga única, 40 μA, pulso de onda cuadrada monofásica de 0,75 ms, 50 Hz, 30 s. - Anestesiar a los ratones con isoflurano (hasta que el ratón se durmió) y perfundir10 transcardialmente con paraformaldehído al 4% (PFA) en un tampón de fosfato de sodio de 0,1 M. Seccionar los cerebros (40 μm de espesor) en un criostato (ver Tabla de Materiales) y manchar con DAPI (0,02% en PBS). Confirme la ubicación correcta de los electrodos por la presencia de lesiones en la punta del electrodo como se muestra en la Figura 4B, C.
NOTA: El porcentaje de isoflurano debe aplicarse siguiendo las directrices de cada institución.
5. Medición de la resistencia del electrodo
- Mida la resistencia de los electrodos y compruebe el cortocircuito entre los electrodos utilizando un ohmímetro de rango múltiple (consulte la Tabla de materiales). Establezca la escala de resistencia en R x 10,000, lo que indica que una deflexión unitaria en el puntero corresponde a una resistencia de 1 kΩ. Los electrodos de 2 cm de largo deben tener una resistencia de 60-70 kΩ.
- Personalice los auriculares tomando diez pines individuales (consulte la Tabla de materiales). Suelde cada pasador con un alambre de cobre delgado y multibrado en un cable.
- Coloque a presión los pasadores soldados con sus correspondientes colas de cable en el zócalo de acoplamiento de doble fila de 10 pines (zócalos coincidentes). Ajuste con presión los pines abiertos de la toma de acoplamiento en los auriculares LFP. De esta manera, cada electrodo LFP tiene un cable designado en el conjunto.
- Sumerja la punta de cada electrodo LFP (cuya resistencia debe medirse) en solución salina de NaCl al 0,9% (concentración de NaCl en la sangre). Conecte el extremo del cable que corresponde al electrodo LFP al terminal positivo del ohmímetro.
- Use un cable de baja resistencia (̴100 Ω) con un lado en el agua salina y el otro lado como extremo abierto. Conecte el extremo abierto del cable de baja resistencia a la toma a tierra del puntero de ohmímetro.
NOTA: Esta disposición completa el circuito y provoca una desviación del puntero de ohmímetro.
- Use un cable de baja resistencia (̴100 Ω) con un lado en el agua salina y el otro lado como extremo abierto. Conecte el extremo abierto del cable de baja resistencia a la toma a tierra del puntero de ohmímetro.
- Asegúrese de que no haya conexión eléctrica entre dos electrodos en los auriculares. Compruebe el aislamiento eléctrico de los electrodos LFP por pares (tierra: un cable corresponde a un electrodo; positivo: otro cable corresponde a otro electrodo). Deseche los electrodos si se observa alguna deflexión en este caso.
Resultados
En este trabajo, se utilizaron los microelectrodos LFP para mapear la convulsión diseminada a través de los ganglios basales11. Se realizaron registros simultáneos de LFP desde la corteza premotora derecha (donde estaba el foco de la convulsión) y la VL izquierda, el cuerpo estriado y el SNR (Figura 4). El inicio de la convulsión se identificó como la desviación de la traza de voltaje al menos dos veces la línea de base (Figura 4A...
Discusión
Históricamente, las matrices de microelectrodos se han utilizado ampliamente para registrar la actividad neuronal de una región específica del cerebro de interés 2,3,4,5,6,7,8,9,13. Sin embargo, nuestro fácil diseño ...
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Este trabajo fue apoyado por el Instituto Nacional de Salud (RO1 NS120945, R37NS119012 a JK) y el Instituto del Cerebro UVA.
Materiales
| Name | Company | Catalog Number | Comments |
| Amplifier 16-Channel | A-M Systems | Model 3600 | Amplifier |
| Cranioplasty cement | Coltene | Perm Reeline/Repair Resin Type II Class I Shade - Clear | Cement to hold microelectrodes |
| Cryostat Microtome | Precisionary | CF-6100 | To slice brain |
| Diamel-coatednickel-chromium wire | Johnson Matthey Inc. | 50 µm | Microelectrode wire |
| Dremel | Dremel | 300 Series | To drill holes in mouse skull |
| Epoxy | CEC Corp | C-POXY 5 | Fast setting adhesive |
| Hemostat | Any | To hold the headset | |
| Forceps | Any | To hold microelectrodes | |
| Light microscope | Nikon | SMZ-10 | To see alignment |
| Ohmmeter | Any | To measurre resistance | |
| Pins (Headers and matching Sockets) | Mill-Max | Interconnects, 833 series, 2 mm grid gull wing surface mount headers and sockets | To attach microelectrodes to |
| Polymicro Tubing Kit | Neuralynx | ID 100 ± 04 µm, OD 164 ± 06 µm, coating thickness 12 µm | Glass tubes |
| Pulse Stimulator | A-M Systems | Model 2100 | To mark the microelectrode location at the end of the recordings |
| Scissors | Any | To cut microelectrodes | |
| Superglue | Gorilla | Adhesive | |
| Thick wire 0.008 in. – 0.011 in. | A-M Systems | 791900 | Tick wire to hold the microelectrode array |
| Thin wire 0.005 in. - 0.008 in. | A-M Systems | 791400 | Thin wire for reference and ground |
Referencias
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents-EEG, ECoG, LFP and spikes. Nature Reviews Neuroscience. 13, 407-420 (2012).
- Hubel, D. H., Wiesel, T. N. Receptive fields of single neurones in the cat's striate cortex. The Journal of Physiology. 148 (3), 574-591 (1959).
- O'Keefe, J. Place units in the hippocampus of the freely moving rat. Experimental Neurology. 51 (1), 78-109 (1976).
- Fyhn, M., Molden, S., Witter, M. P., Moser, E. I., Moser, M. B. Spatial representation in the entorhinal cortex. Science. 305 (5688), 1258-1264 (2004).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7, 446-451 (2004).
- Buckmaster, P. S., Edward Dudek, F. In vivo intracellular analysis of granule cell axon reorganization in epileptic rats. Journal of Neurophysiology. 81 (2), 712-721 (1999).
- Driscoll, N., et al. Multimodal in vivo recording using transparent graphene microelectrodes illuminates spatiotemporal seizure dynamics at the microscale. Communications Biology. 4, 1-14 (2021).
- Roy, D. S., et al. Memory retrieval by activating engram cells in mouse models of early Alzheimer's disease. Nature. 531, 508-512 (2016).
- Igarashi, K. M., Lu, L., Colgin, L. L., Moser, M. B., Moser, E. I. Coordination of entorhinal-hippocampal ensemble activity during associative learning. Nature. 510, 143-147 (2014).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Brodovskaya, A., Shiono, S., Kapur, J. Activation of the basal ganglia and indirect pathway neurons during frontal lobe seizures. Brain. 144 (7), 2074-2091 (2021).
- Ren, X., Brodovskaya, A., Hudson, J. L., Kapur, J. Connectivity and neuronal synchrony during seizures. The Journal of Neuroscience. 41 (36), 7623-7635 (2021).
- Chang, E. H., Frattini, S. A., Robbiati, S., Huerta, P. T. Construction of microdrive arrays for chronic neural recordings in awake behaving mice. Journal of Visualized Experiments. (77), e50470 (2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados