このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
複数の脳構造から同時に 生体内 記録のための局所電界電位微小電極の構築
要約
本プロトコールは、複数の脳構造から 同時に生体内の 局所電界電位を記録するためのカスタムメイドの微小電極アレイの構築を記載する。
要約
研究者はしばしば、複数の脳構造から同時に局所場電位(LFP)を記録する必要があります。複数の所望の脳領域からの記録には異なる微小電極設計が必要であるが、市販の微小電極アレイはしばしばそのような柔軟性を提供しない。ここで、本プロトコルは、異なる深さで同時に複数の脳構造からのLFPを記録するためのカスタムメイドの微小電極アレイの簡単な設計を概説する。本研究は、両側皮質、線条体、腹側視床、および黒質微小電極の構築を例に説明する。概説された設計原理は柔軟性を提供し、微小電極は、定位座標を計算し、それに応じて構造を迅速に変更して、自由に動くマウスまたは麻酔をかけられたマウスの異なる脳領域を標的とすることによって、任意の構造からLFPを記録するように変更およびカスタマイズすることができる。微小電極アセンブリには、標準的な工具と消耗品が必要です。これらのカスタムマイクロ電極アレイにより、研究者はニューロン活動を追跡するためにあらゆる構成のマイクロ電極アレイを簡単に設計でき、ミリ秒単位の分解能でLFP記録を提供することができます。
概要
局所電界電位(LFP)は、脳内の細胞外空間から記録された電位である。これらは、ニューロンの外側のイオン濃度の不均衡によって生成され、ニューロンの小さな、局所的な集団の活動を表し、マクロスケールの脳波記録と比較して特定の脳領域の活動を正確に監視することを可能にする1。推定値として、1mmで分離されたLFP微小電極は、ニューロンの2つの全く異なる集団に対応する。脳波信号は脳組織、脳脊髄液、頭蓋骨、筋肉、および皮膚によってフィルタリングされるが、LFP信号は局所ニューロン活動の信頼できるマーカーである1。
研究者はしばしば複数の脳構造からのLFPを同時に記録する必要があるが、市販の微小電極アレイはしばしばそのような柔軟性を提供しない。ここで、本プロトコルは、所望の脳領域からのLFPを異なる深さで同時に記録するために、完全にカスタマイズ可能で容易に構築された微小電極を記載する。LFPは、特定の脳領域2,3,4,5,6,7,8,9のニューロン活動を記録するために広く使用されてきたが、現在の容易にカスタマイズ可能な設計により、任意の複数の表在性または深部脳領域からのLFPを記録することができる11,12.プロトコルは、脳領域の定位座標を決定し、それに応じてアレイを組み立てることによって、任意の所望の微小電極アレイを構築するように変更することもできる。サンプリングレートが10kHz、抵抗が60~70kΩ(長さ2cm)の微小電極により、LFPをミリ秒単位で記録することができます。その後、データは16チャンネルアンプで増幅され、フィルタリングされ(ローパス1Hz、ハイパス5kHz)、デジタル化されます。
プロトコル
現在の研究は、バージニア大学動物管理および使用委員会によって承認されています。両性のC57Bl/6マウス(7〜12週目)を実験に使用した。動物は12時間の明暗/12時間の暗サイクルで維持され、食物と水への 自由 アクセスを有していた。
1. 微小電極構造
- 微小電極を構成するには、50μm(直径)のダイアメル被覆ニッケルクロム線を使用します( 材料表を参照)。プラットフォームの背面にあるワイヤの一方の端をテープで固定し、プラットフォーム上の最も近いノブにワイヤを3回巻き付けます(図1A、C)。
メモ:ここでは、2つのノブ(2 x 5インチ)を備えたアクリルプラットフォームが使用されていましたが、任意のプラットフォームを使用できます。- 最も遠い 2 番目のノブの周りにワイヤーを伸ばして、ノブ間に 2 つのループを作ります。最初のノブにワイヤーをさらに 3 回巻き付けてワイヤーを所定の位置に固定し、最後にもう一度プラットフォームの背面にテープを貼ります。
メモ: ワイヤを分離した後(手順 1.2 ~ 1.3.1)、両側に 2 本のワイヤ(合計 4 本のワイヤ、 図 1B)が必要です。
- 最も遠い 2 番目のノブの周りにワイヤーを伸ばして、ノブ間に 2 つのループを作ります。最初のノブにワイヤーをさらに 3 回巻き付けてワイヤーを所定の位置に固定し、最後にもう一度プラットフォームの背面にテープを貼ります。
- テンションバーをワイヤの下に置き、テープを巻いて(粘着面を上にして)配線します(図1C)。
注:テンションバーには三角形のアクリル片が使用され、テープが巻き付けられました(ワイヤーを取り付けるために外側に粘着性があります)。テンションバーの外側のテープの粘着性のある側は、ワイヤー間の距離を調整するためにワイヤーを所定の位置に保ちます。テンションバーはノブから約2.5cm離れていなければならず、ワイヤーは緩んではいけません。 - 顕微鏡と微細な鉗子を使用して、ワイヤー間に3 mmまたは4.5 mmの隙間を作ります(皮質(Ctx)-腹側視床核(VL)微小電極を作るためのワイヤー間の3 mmの隙間;線条体(Str)-nigral(SNR)微小電極を作るための4.5 mmの隙間)を作ります(図1B)。
- 顕微鏡で倍率を使用する場合は、倍率の差とワイヤ間の実際の距離を計算して調整してください。
注:ここで使用している構造以外の構造に対して微小電極を構成する場合は、配線間の距離を構造間の定位距離に調整する必要があります。 図 2B は、ワイヤがどのように編成されるかの例を示しています。したがって、他の構造の定位座標を調整する必要があります。
- 顕微鏡で倍率を使用する場合は、倍率の差とワイヤ間の実際の距離を計算して調整してください。
- プラスチック(厚さ0.5 mm)~6 mm(幅)×高さ3 mmのプラスチックを4枚切ります(図1C)。
注:厚さ0.5mmであれば、プラスチック片を使用できます。ここでは、ピンが販売された正方形のチューブが使用されました(ピン、 材料表を参照)。異なる厚さを使用する場合は、必要な定位座標に合うようにプラスチック片を多かれ少なかれ追加してください。 - プラスチックに接着剤( 材料表を参照)を塗布し、ワイヤの上に置きます(図1C)。ワイヤーの中央から約 1.0 cm 離れたところに、テンションバーから 1.0 cm 離れたところにプラスチック片を置きます。余分なスーパーグルーを綿棒で取り除きます。
- スーパーグルーが乾いたら、 図1Cに示す順序で細いはさみを使ってワイヤーを切断します。
- 市販のキット( 材料表参照)を使用して4本の7mmガラス管を切断し、 図2Aに示すように電極線をガラス管に挿入する。
- VL 電極と SNR 電極のペアをガラス管に挿入します。
注:外科的移植をサポートするためにガラス管に挿入する必要があるのは、深部構造用のワイヤのみです。皮質電極をガラス管に挿入しないようにしてください。
- VL 電極と SNR 電極のペアをガラス管に挿入します。
- ガラス管の根元に接着剤を入れて、プラスチックに接続します。接着剤が乾くまでしばらくお待ちください。
- 表1に示すようにメスを用いてガラス管およびワイヤーを切断する。微小電極の長さが正しいことを確認します。微小電極が異なる構造をターゲットとする場合は、必要な定位座標に従って切断距離を調整します。
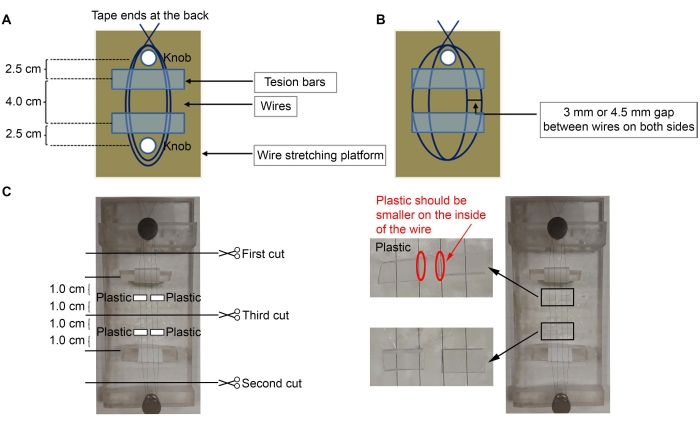
図1:微小電極構造の概略。 (A)ワイヤの下にテンションバーを備えたワイヤをプラットフォーム上にセットアップします。(B) ワイヤ間の隙間。(C)4枚のプラスチックをワイヤーに接着する。 この図の拡大版を表示するには、ここをクリックしてください。
| ティッカー | トル | ティッカー | ティッカー | |
| AP (前部/後部) | 2.2 | 1.2 | -1.3 | -3.3 |
| ML (縦隔/横方向) | 1.8 | 1.5 | 1 | 1.5 |
| DV (背側/腹側) | 0.5 | 3.5 | 4 | 4.75 |
| 電極長 | 4 | 4.75 | 5.25 | 6 |
表1:微小電極の定位移植座標および寸法。
2. 微小電極アレイアセンブリ
- 接着剤を使用して、ターゲット領域の所望の順序でプラスチックを取り付けます。皮質電極、視床電極、線条電極、および黒質電極の例を 図2B、Cに示す。
- Ctx-VL電極ペアを下に向け(電極線のある側は下を向かなければなりません)、2つの6 mm x 3 mmの空のプラスチック片を接着剤で上に接続します。
- 3枚のプラスチックの上に、電極が上を向くように2番目のCtx-VL電極ペアを置きます(顕微鏡を使用して、VL電極が揃っていることを確認します)。
注:両側電極の位置合わせ(ここでは、左右のVL電極の位置合わせ)は、所望の両側構造を適切にターゲットにするために不可欠です。 - 接着剤を使用して、VL電極から2.0 mm、皮質電極から約5.0 mm離れたSNR電極(SNR電極ワイヤは上を向く必要があります)でSNR電極を上部に取り付けます。
- 手順 2.1.3 を繰り返します。反対側(SNR電極ワイヤはマイクロ電極アレイの外側を向いていなければなりません)。
- プラスチックの周りにエポキシ樹脂を塗布して、電極を結合します。電極にエポキシ樹脂を貼らないでください。
- 太いワイヤーを取り、一方の端にループを作ります。ループをエポキシ溶液に浸してプラスチックの上に置き、太いワイヤが平らに横たわっていることを確認します(図2D)ので、次のステップでこのワイヤをハンドルとして使用できます。電極が完全に乾くまで待ちます。
- 図 2E に示すように、ワイヤーを 2 cm に切断します。
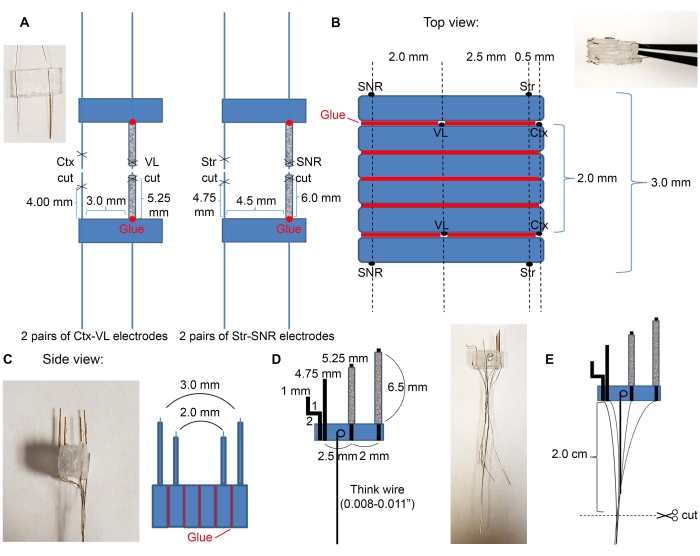
図2:微小電極の構造と寸法。(A)図1Cに示すように、ワイヤをハサミで切断した後に形成された4対の電極(2対のCtx-VL電極と2対のStr-SNR電極)。ガラス管に深層構造電極(VLおよびSNR)を挿入し、その基部をプラスチック(赤い点)に接着します。(B)上面図:(A)の電極対をスタック状に接着して微小電極コアを作成する。赤い線は接着剤の線を示します。(C)(B)の正面側面図。(d)微小電極に太い線を取り付けた。(E) ワイヤは示されているようにグループ化され、孤立した端部は削り取られて 2 cm に切断されます。この図の拡大版を表示するには、ここをクリックしてください。
3. ヘッドセットへの微小電極接続
- 図 2E に示すようにワイヤをグループ化し、分離された端部の 1 mm をメスでこすり落とします。
- 図3Aに示すように皮質電極を曲げる。図 3B に示すようにワイヤを分離します。細かい鉗子を使用して、各ワイヤの端にループを作成します(図3B)。
- 10ピンヘッドセットを止銅で持ち( 材料表を参照)、綿棒の木製の端を使用してピンに最小限の量のフラックスを適用します(図3C)。ピン間の短絡を防ぐために、フラックスをピンの外側に置かないでください。
- 綿棒の木の端を使用して、ワイヤーループにフラックスを塗布します。
- 図3Cに示すように、ワイヤループを10ピンヘッドセットにはんだ付けします。はんだ付け後、ピン間の短絡を防ぐためにヘッドセットを乾かします。
- 基準線とアース線に細い線(0.005~0.008インチ)を取り、プラスチックを一端から剥がします。ワイヤのもう一方の端にループを作成します。
- 基準線とアース線の剥がれた側をそれぞれのピンにはんだ付けします(図3A、C)。
- 太いワイヤー(図2D)をつかんで、マイクロ電極の周囲、特にワイヤーがピンに接続する場所に頭蓋形成性セメントを塗布します。実際の電極端部をセメントで触れないでください。
- セメントが乾いたら、ガラス管の基部にエポキシ樹脂、線条体微小電極線、電極全体を入れます。実際の電極端部をエポキシ樹脂で触れないでください。電極が完全に乾くまで待ちます。
- 電極の準備が整いました。歯科用ドリルを使用してマウスの頭蓋骨に(必要な定位座標に従って)穴を開け、頭蓋骨と適切な穴に面した微小電極でヘッドセットを下げて 、図3D に示すようにヘッドセットを埋め込みます。ヘッドセットは、移植中にサポートするために定位アームに取り付けることができます。
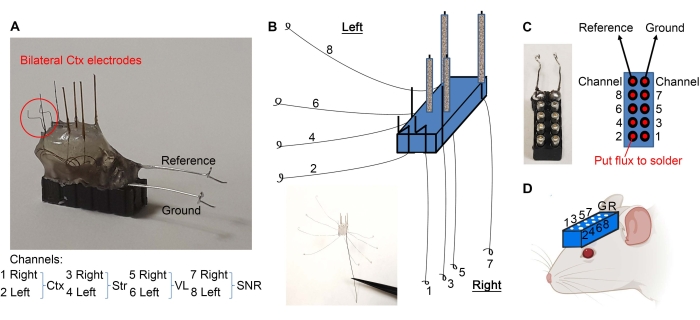
図3:微小電極移植(A)皮質電極は、示されているように曲がっている。(B)ワイヤは、端部にループを作るために分離される。(C) フラックス(赤い点)とループ配線は10ピンヘッドセットにはんだ付けされ、各ワイヤが適切なピンに確実に届きます。(D) LFP を記録するためにヘッドセットが埋め込まれています。この図の拡大版を表示するには、ここをクリックしてください。
4. 記録後の電極位置のマーキング
- LFP記録の最後に、電極先端に電流を流して病変を作り、マウスを灌流する前に30分間待ってから、ターゲット領域内の電極の正しい位置を確認します。
メモ:電極先端の位置を確認するための病変設定:シングルバースト、40μA、0.75ms単相矩形波パルス、50Hz、30秒。 - マウスをイソフルランで麻酔し(マウスが眠りにつくまで)、0.1Mリン酸ナトリウム緩衝液中の4%パラホルムアルデヒド(PFA)で10の経心線を灌流する。クライオスタット(材料表を参照)で脳(厚さ40μm)を切断し、DAPI(PBSで0.02%)で染色します。図4B,Cに示すように、電極先端病変の存在により電極の正しい位置を確認する。
注:イソフルランの割合は、個々の機関のガイドラインに従って適用する必要があります。
5. 電極抵抗の測定
- 電極の抵抗を測定し、マルチレンジオームメータを使用して電極間の短絡を確認します( 材料表を参照)。抵抗スケールをRx 10,000に設定し、ポインタの単位たわみが1kΩの抵抗に対応することを示します。長さ2cmの電極には60~70kΩの抵抗が必要です。
- ヘッドセットをカスタマイズするには、10 本のピンを個別に使用します ( 材料表を参照)。各ピンを細い多撚り銅線でケーブルにはんだ付けします。
- はんだ付けされたピンと、対応するケーブルテールを10ピンの2列嵌合ソケット(一致するソケット)に押し込みます。嵌合ソケットのオープンエンドピンをLFPヘッドセットに押し込みます。このようにして、各LFP電極は、アセンブリ内に指定されたケーブルワイヤを有する。
- 各LFP電極の先端(その抵抗を測定する)を0.9%NaCl生理食塩水(血液中のNaCl濃度)に浸します。LFP電極に対応するケーブル線端をオームメータの正極端子に接続します。
- 片側を生理食塩水に、もう片側を開放端とする低抵抗(〜100 Ω)ワイヤを使用してください。低抵抗ワイヤの開口端をオームメータポインタのグランドに接続します。
メモ: この配置により回路が完了し、オームメータポインタのたわみが促されます。
- 片側を生理食塩水に、もう片側を開放端とする低抵抗(〜100 Ω)ワイヤを使用してください。低抵抗ワイヤの開口端をオームメータポインタのグランドに接続します。
- ヘッドセットの 2 つの電極間に電気的接続がないことを確認します。ペアワイズLFP電極の電気的絶縁を確認します(グランド:1本のケーブルが1本の電極に対応し、正:別のケーブルが別の電極に対応します)。この場合、たわみが観察された場合は電極を廃棄してください。
結果
この作業では、LFP微小電極を用いて、大脳基底核11に広がる発作をマッピングした。LFP記録は、右前運動野(発作焦点があった場所)と左VL、線条体、およびSNRから同時に行われた(図4)。発作開始は、ベースラインの少なくとも2倍の電圧トレースのたわみとして同定された(図4A、赤矢印)。パワースペクトルプロット11
ディスカッション
歴史的に、微小電極アレイは、関心のある特定の脳領域2、3、4、5、6、7、8、9、13からのニューロン活動を記録するために広く使用されてきた。しかし、当社の簡単?...
開示事項
著者らは開示するものは何もありません。
謝辞
この研究は、国立衛生研究所(RO1 NS120945、R37NS119012からJK)とUVA脳研究所の支援を受けた。
資料
| Name | Company | Catalog Number | Comments |
| Amplifier 16-Channel | A-M Systems | Model 3600 | Amplifier |
| Cranioplasty cement | Coltene | Perm Reeline/Repair Resin Type II Class I Shade - Clear | Cement to hold microelectrodes |
| Cryostat Microtome | Precisionary | CF-6100 | To slice brain |
| Diamel-coatednickel-chromium wire | Johnson Matthey Inc. | 50 µm | Microelectrode wire |
| Dremel | Dremel | 300 Series | To drill holes in mouse skull |
| Epoxy | CEC Corp | C-POXY 5 | Fast setting adhesive |
| Hemostat | Any | To hold the headset | |
| Forceps | Any | To hold microelectrodes | |
| Light microscope | Nikon | SMZ-10 | To see alignment |
| Ohmmeter | Any | To measurre resistance | |
| Pins (Headers and matching Sockets) | Mill-Max | Interconnects, 833 series, 2 mm grid gull wing surface mount headers and sockets | To attach microelectrodes to |
| Polymicro Tubing Kit | Neuralynx | ID 100 ± 04 µm, OD 164 ± 06 µm, coating thickness 12 µm | Glass tubes |
| Pulse Stimulator | A-M Systems | Model 2100 | To mark the microelectrode location at the end of the recordings |
| Scissors | Any | To cut microelectrodes | |
| Superglue | Gorilla | Adhesive | |
| Thick wire 0.008 in. – 0.011 in. | A-M Systems | 791900 | Tick wire to hold the microelectrode array |
| Thin wire 0.005 in. - 0.008 in. | A-M Systems | 791400 | Thin wire for reference and ground |
参考文献
- Buzsáki, G., Anastassiou, C. A., Koch, C. The origin of extracellular fields and currents-EEG, ECoG, LFP and spikes. Nature Reviews Neuroscience. 13, 407-420 (2012).
- Hubel, D. H., Wiesel, T. N. Receptive fields of single neurones in the cat's striate cortex. The Journal of Physiology. 148 (3), 574-591 (1959).
- O'Keefe, J. Place units in the hippocampus of the freely moving rat. Experimental Neurology. 51 (1), 78-109 (1976).
- Fyhn, M., Molden, S., Witter, M. P., Moser, E. I., Moser, M. B. Spatial representation in the entorhinal cortex. Science. 305 (5688), 1258-1264 (2004).
- Buzsáki, G. Large-scale recording of neuronal ensembles. Nature Neuroscience. 7, 446-451 (2004).
- Buckmaster, P. S., Edward Dudek, F. In vivo intracellular analysis of granule cell axon reorganization in epileptic rats. Journal of Neurophysiology. 81 (2), 712-721 (1999).
- Driscoll, N., et al. Multimodal in vivo recording using transparent graphene microelectrodes illuminates spatiotemporal seizure dynamics at the microscale. Communications Biology. 4, 1-14 (2021).
- Roy, D. S., et al. Memory retrieval by activating engram cells in mouse models of early Alzheimer's disease. Nature. 531, 508-512 (2016).
- Igarashi, K. M., Lu, L., Colgin, L. L., Moser, M. B., Moser, E. I. Coordination of entorhinal-hippocampal ensemble activity during associative learning. Nature. 510, 143-147 (2014).
- Gage, G. J., Kipke, D. R., Shain, W. Whole animal perfusion fixation for rodents. Journal of Visualized Experiments. (65), e3564 (2012).
- Brodovskaya, A., Shiono, S., Kapur, J. Activation of the basal ganglia and indirect pathway neurons during frontal lobe seizures. Brain. 144 (7), 2074-2091 (2021).
- Ren, X., Brodovskaya, A., Hudson, J. L., Kapur, J. Connectivity and neuronal synchrony during seizures. The Journal of Neuroscience. 41 (36), 7623-7635 (2021).
- Chang, E. H., Frattini, S. A., Robbiati, S., Huerta, P. T. Construction of microdrive arrays for chronic neural recordings in awake behaving mice. Journal of Visualized Experiments. (77), e50470 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved